锈赤扁谷盗响应低温胁迫的转录组分析
吴天意1,伍 祎1,方智毅2,张晓培3,王富领3,薛丁榕1✉
(1. 国家粮食和物资储备局科学研究院,粮食储运国家工程研究中心,北京 100037;2. 福建省储备粮管理有限公司漳浦直属库,福建 漳州 363200;3. 广西壮族自治区柳州粮食储备库有限公司,广西 柳州 545007)
摘 要:锈赤扁谷盗是世界范围内重要的储粮害虫之一,通过转录组测序分析,初步研究锈赤扁谷盗响应低温胁迫的分子机制。采用三代测序结合二代测序技术对锈赤扁谷盗进行转录组测序,共获得锈赤扁谷盗全长转录本10 508 个,并对其中9 523 个转录本进行注释。相较于对照组,低温胁迫后有477个基因显著性差异表达,其中177 个基因上调表达,300 个基因下调表达。进一步KEGG 分析发现上述差异表达基因主要富集在代谢途径、脂肪酸生物合成和次生代谢产物的生物合成等通路。基于荧光定量PCR(RT-qPCR)技术对热激蛋白、脂肪酸合成酶、几丁质酶、海藻糖转运蛋白、细胞色素P450和卵黄蛋白原编码基因6 个差异表达基因进行表达量分析,结果表明RT-qPCR 和转录组测序分析结果趋势一致。初步探究的储粮害虫锈赤扁谷盗适应低温胁迫的分子机制,为低温储粮技术在害虫综合治理策略中的应用奠定基础。
关键词:锈赤扁谷盗;转录组分析;低温胁迫;差异表达基因;荧光定量PCR
中图分类号:S379.5
文献标识码:A
文章编号:1007-7561(2025)01-0238-08
网络首发时间:2024-12-27 15:40:20
网络首发地址:https://link.cnki.net/urlid/11.3863.TS.20241225.1813.021
DOI: 10.16210/j.cnki.1007-7561.2025.01.026
吴天意, 伍祎, 方智毅, 等. 锈赤扁谷盗响应低温胁迫的转录组分析[J]. 粮油食品科技, 2025, 33(1): 238-245.
WU T Y, WU Y, FANG Z Y, et al. Transcriptome analysis of Cryptolestes ferrugineus under low-temperature stress[J]. Science and Technology of Cereals, Oils and Foods, 2025, 33(1): 238-245.
收稿日期:2024-05-15;修回日期:2024-06-06;录用日期:2024-06-07
基金项目:国家粮食和物资储备局科学研究院自主选题“4 种主要储粮害虫对粮食数量损失影响研究”(JY2401)、“捕食螨工程化应用技术研究”(JY2308)
Supported by: Optional Research Project of Academy of National Food and Strategic Reserves Administration “Research on the Impact of Four Major Stored-grain Pests on Grain Quantity Loss” (No. JY2401), “Research on the Engineering Application Technology of Predator Mites” (No. JY2308)
第一作者:吴天意,女,1999 年出生,硕士,研究方向为食品工程,E-mail: tianyi2020@163.com
通信作者:薛丁榕,女,1990 年出生,博士,副研究员,研究方向为粮食储藏,E-mail: xdr@ags.ac.cn
Transcriptome Analysis of Cryptolestes ferrugineus under Low-temperature Stress
WU Tian-yi1, WU Yi1, FANG Zhi-yi2, ZHANG Xiao-pei3, WANG Fu-ling3, XUE Ding-rong1✉
(1. National Engineering Research Centre of Grain Storage and Logistics, Academy of National Food and Strategic Reserves Administration, Beijing 100037, China; 2. Fujian Grain Reserves Co., Ltd. Zhangpu Depot, Zhangzhou, Fujian 363200, China; 3. Guangxi Zhuang Autonomous Region Liuzhou Grain Reserves Co., Ltd., Liuzhou, Guangxi 545007, China)
Abstract: Cryptolestes ferrugineus, a cosmopolitan stored-grain pest, was studied using transcriptome sequencing to investigate its molecular response to low-temperature stress.. Combining PacBio Iso Sequencing and Illumina RNA Sequencing, 10,508 full-length transcripts were obtained, with 9,523 successfully annotated. Compared to the control group, 477 genes exhibited significant differential expressed under low-temperature stress, including 177 upregulated and 300 downregulated genes. KEGG analysis revealed that differentially expressed genes were primarily enriched in metabolic pathways, fatty acid biosynthesis, and secondary metabolite biosynthesis. RT-qPCR was used to analyze the expression levels of six differentially expressed genes: heat shock protein, fatty acid synthase, chitinase, trehalose transporter,cytochrome P450, and vitellogenin.. The results demonstrated consistency between RT-qPCR and transcriptome sequencing analysis. This study offers preliminary insights into the molecular mechanisms of C. ferrugineus adaptation to low-temperature stress, forming a foundation for applying low-temperature grain storage technology in integrated pest management strategies.
Key words: Cryptolestes ferrugineus; transcriptome analysis; low temperature stress; differentially expressed genes; RT-qPCR
锈赤扁谷盗是一种常见的世界性储粮害虫[1],以幼虫和成虫危害粮食,环境适应能力强、易存活、繁殖能力强、在粮库中发生频率高,易对粮食及其加工产品造成危害和严重经济损失[2-3]。低温储粮技术是保持粮堆常年平均温度不超过15 ℃,局部最高温度不超过20 ℃的储粮技术,能有效降低粮食代谢,延缓品质劣变,也具有防虫抑菌的作用,是一项重要的绿色储粮技术。温度是影响储粮害虫生命活动最主要的环境因素之一,低温直接影响昆虫的生存和繁殖能力,限制种群的动态发生和迁移扩散[4]。通过低温对于锈赤扁谷盗的生长、发育和产卵繁殖等方面研究,表明锈赤扁谷盗具有较强的耐寒性[1,5]。
随着高通量测序技术的发展与成熟,害虫逆境胁迫进入组学研究阶段,可以解析基因转录调控规律及分子机制[6]。目前针对储粮害虫转录组水平的研究多集中在探究磷化氢抗性相关的基因上[7],从分子生物学水平上分析低温对锈赤扁谷盗作用的相关研究还较为缺乏。本文利用转录组测序技术分析低温条件下差异表达基因,以期发掘锈赤扁谷盗体内与低温响应相关的基因和代谢通路,为从分子水平开展锈赤扁谷盗耐寒机制的研究奠定基础。
1 材料与方法
1.1 供试昆虫
本研究用储粮害虫锈赤扁谷盗、赤拟谷盗、谷蠹、米象、锯谷盗和玉米象均由国家粮食和物资储备局科学研究院提供,锈赤扁谷盗在最适温度(35±1)℃,其他5 种试虫在(28±1)℃培养,相对湿度均为(70±5)%,锈赤扁谷盗、赤拟谷盗和锯谷盗采用四合一饲料饲养(全麦粉、燕麦片、酵母、小麦质量比为10∶8∶1∶2),谷蠹、米象、玉米象采用小麦饲养。
1.2 仪器与设备
HPP 750 恒温恒湿培养箱:德国美墨尔特有限公司;Schneider Scientz-48 高通量组织研磨器:宁波新芝生物科技股份有限公司;5424R 小型高速冷冻离心机:德国艾本德有限公司;H2O3-100C金属浴:卡尤迪生物科技宜兴有限公司;OSEMP25 微孔板离心机、DNase/RNase-Free 去离子水:天根生化科技北京有限公司;9902PCR 仪:Applied Biosystems;CFX96 Touch 高通量核酸检测分析仪:伯乐生命医学产品有限公司;RNeasy Plus Mini Kit(50)试剂盒:QIAGEN,德国;HiScript Ⅲ逆转录试剂盒、SYBR GreenⅠ qPCR 试剂盒:诺唯赞生物科技股份有限公司。
1.3 低温对不同储粮害虫死亡率的室内生测试验
分别取20 头羽化后1~2 周的锈赤扁谷盗、赤拟谷盗、谷蠹、米象、锯谷盗和玉米象成虫放入饲虫板中,每种害虫分别置于20、15、10 和5 ℃培养箱中处理,每个温度设三组平行,观察害虫死亡情况。
1.4 测序样品准备
为进行全长转录本 PacBio Iso-Seq 三代测序,挑选25 头锈赤扁谷盗成虫和30 头幼虫,混合为一个样品,液氮速冻,–80 ℃保存,待提取RNA。
为进行二代转录组测序分析低温胁迫对锈赤扁谷盗的影响,挑取羽化后1~2 周的同日龄锈赤扁谷盗成虫,分别取10 只放置于15 ℃和35 ℃恒温恒湿培养箱中处理24 h。其中,35 ℃处理试虫为对照组,15 ℃处理试虫为低温处理组,每组重复4 次。以上试虫处理完成后迅速装入2 mL离心管中,采用液氮速冻,保存至–80 ℃超低温冰箱待提取RNA。
1.5 RNA 提取和转录组测序
根据RNeasy Plus Mini Kit 试剂盒说明书提取样品总RNA。采用NanoDrop 2000 分光光度法,检测RNA 的浓度和纯度,利用Agilent 2100 系统检测RNA 完整度。三代测序技术利用Pacbio 公司的SequelII 三代测序平台,二代测序技术采用Illumina NovaSeq6000 测序平台,测序工作由北京贝瑞和康生物技术有限公司完成。
1.6 全长转录本数据处理与注释
对于测序下机的原始数据进行过滤、聚和去冗余处理后到非冗余的高质量锈赤扁谷盗全长转录本[8],作为二代测序的参考序列。为了解锈赤扁谷盗全长转录本的功能信息,将其序列分别与公共数据库进行比对,得到功能注释信息。
1.7 低温胁迫差异表达基因分析
利用二代转录组测序技术测定不同温度下锈赤扁谷盗各样品的转录组序列,与对照组(35 ℃)相比,分析低温处理组(15 ℃)基因表达水平的差异。利用软件edgeR 来分析锈赤扁谷盗成虫转录组在各温度下差异表达的具体情况,计算得到差异表达的P-value 值,P-value 经过校正后得到错误发现率(False discovery rate,FDR),FDR的值越小也就表示差异越显著,Fold Change(FC)是指两基因表达值的变化倍数。满足FDR<0.05且log2|FC|>1 时,即为显著差异表达。利用超几何检验法,对差异表达基因进行GO 和KEGG 富集分析,预测锈赤扁谷盗体内与温度胁迫相关的差异表达基因的生物学功能和代谢途径等。
1.8 RT-qPCR 验证转录组测序结果
本试验选择ef1α 作为内参基因[9],根据转录组的测序结果,选择出其中6 个差异表达基因作为目的基因并进行RT-qPCR 验证试验。这6 个基因编码包括热休克蛋白 83(cfhsp1:Cfs 1-10k transcript/9445);酶类,如脂肪酸合成酶(cffas1:Cfs 1-10k transcript/8866)和几丁质酶(cfchit1:Cfs 1-10k transcript/15488);其他参与生命活动的重要组分海藻糖转运体(cftpst1:Cfs 1-10k transcript/14140)、细胞色素P450(cfP450:Cfs 1-10k transcript/12344)和卵黄蛋白原(cfvg1:Cfs 1-10k transcript/7247)。利用Primer Premier 5.0 对筛选出的6 个目的基因以及内参基因进行引物设计,引物具体信息见表1。
表1 内参基因和目标基因引物序列
Table 1 Primer sequences of reference genes and target genes

引物名称 基因名 引物序列(5′-3′) 退火温度 扩增长度EF1α-F CCAGGCATGGTAGTGACCTT[9] 57.5 EF1α-R ef1α TTGGAGGGTTGTTTTTGGAG[9] 53.4 184 HSP83-F GCTAAATCCGGTACGAAA 51.1 HSP83-R cfhsp1 GGCTGAGTAGAAACCCACA 52.8 93 FAS-F TCAATGACAGCGGTGGAG 54.9 FAS-R cffas1 GTTATCACCCGAGCGTCT 52.6 129 CHIT-F TCTTGCCAGAAGACATCG 51.5 CHIT-R cfchit1 AAACCGTCTAACTGAACATC 49.0 121 TPST-F TTGTCCTGGGATTGCTCT 52.7 TPST-R cftpst1 TGGTACTGCCAGACATAGAA 51.0 83 P450-F TACCGATTGCGGACCAGG 59.7 P450-R cfP450 CTCGATATGCTTGCGTAGA 52.1 87 Vg-F GGTCTTGACTTGGCTGATT 51.8 Vg-R cfvg1 GCGTTCTTCGCTTCTGTG 54.5 132
试虫处理及RNA 提取方法同二代测序样品处理方法。将提取的试虫RNA 参照HiScript ⅢRT SuperMix for qPCR 试剂盒说明书合成cDNA第一链,合成后再按照ChamQ Universal SYBR qPCR Master Mix 试剂盒说明书配置qPCR 反应体系,每 20 μL 体系由 10 μL 的 2×ChamQ Universal SYBR qPCR Master Mix,1∶20 稀释后5.0 μL 的cDNA,各0.4 μL 的正反向引物和4.2 μL的ddH2O 构成。每组实验3 个重复并在荧光定量PCR 仪上进行检测,具体反应条件如下:第一阶段:95 ℃预变性30 s;第二阶段循环反应:95 ℃变性10 s,60 ℃退火30 s,共40 个循环;第三阶段:熔解曲线。以ef1α 作为内参基因,采用2–ΔΔCT 方法分析基因的相对表达水平。通过Excel计算平均值和标准差,并利用SPSS 27.0 进行统计学分析。
2 结果与分析
2.1 不同储粮害虫耐低温试验结果
通过低温对不同储粮害虫成虫的致死情况,分析各储粮害虫抵御低温的能力,结果如图1 所示。从图中可以看出,5 ℃处理30 d,锈赤扁谷盗死亡率为29%、玉米象为40%、谷蠹为65%,米象、赤拟谷盗和锯谷盗的死亡率依次达到100%,锈赤扁谷盗的死亡率显著低于其他5 种害虫;10 ℃下,玉米象、锈赤扁谷盗和米象的死亡率均低于5%,显著低于其他3 种害虫,而谷蠹死亡率最高;15 ℃下,赤拟谷盗和锈赤扁谷盗的死亡率均低于5%,显著低于其他4 种害虫,而米象死亡率最高,达到87.5%;20 ℃下,赤拟谷盗、锯谷盗和锈赤扁谷盗的死亡率均低于10%,显著低于另外3 种害虫,其中米象死亡率最高,达到100%。因此,锈赤扁谷盗具有较强的耐寒性。
2.2 全长转录本测序和功能注释
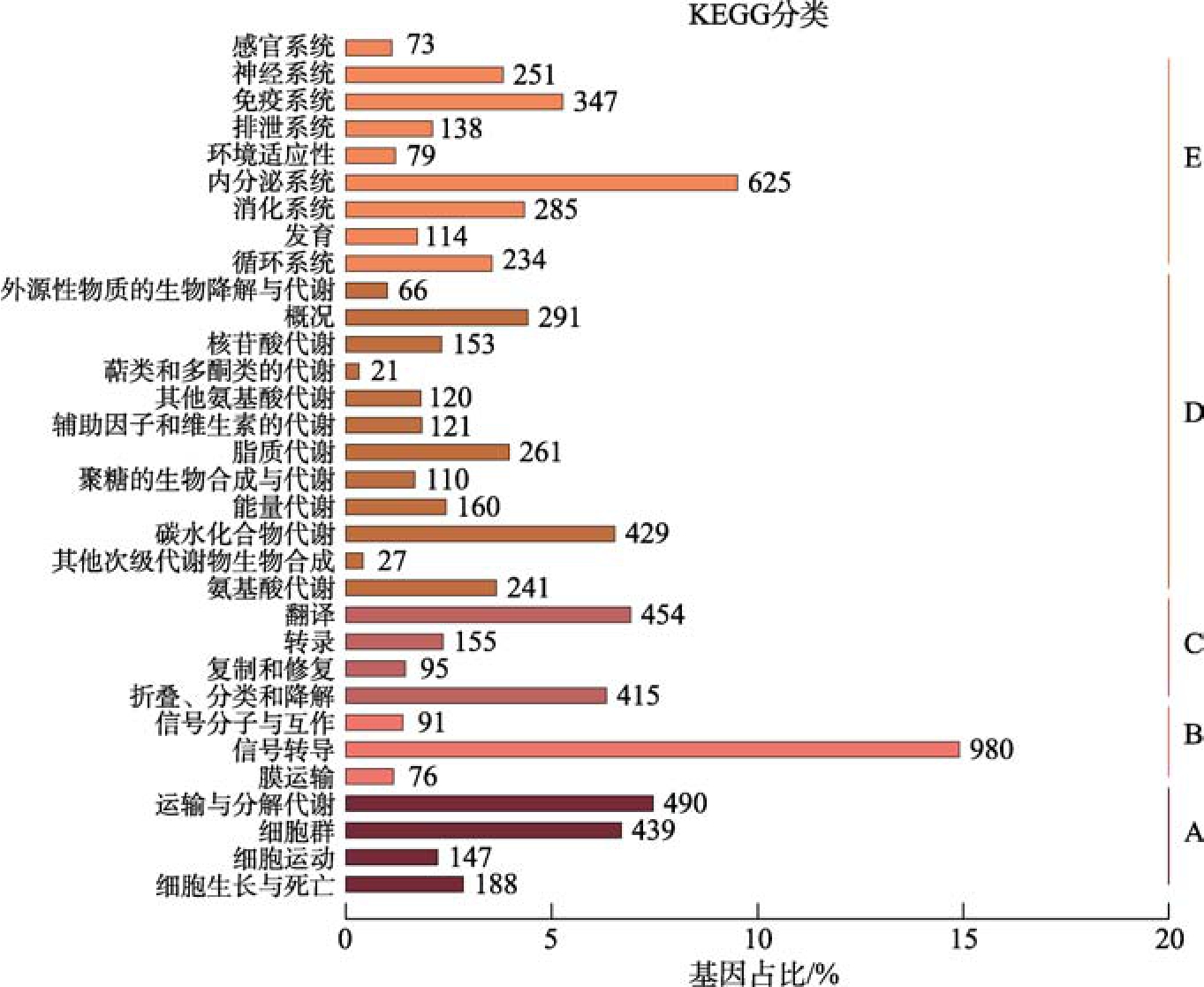
锈赤扁谷盗全长转录组三代测序结果产出10 315 165 条原始序列,平均长度达2 950 bp,N50 长度为3 132 bp,经过过滤、聚类、矫正和去冗余后共获得全长转录本10 508 个。将锈赤扁谷盗全长转录本与GO、KEGG、KOG、NR、NT和Swiss-Prot 6 个数据库进行比对,得到了相关功能信息,具体比对结果如表2 所示。其中3 519个转录本在6 个数据库中均有注释,7 531 个转录本在3 个及以上数据库中均有注释,9 523 个转录本至少在一个数据库有注释,锈赤扁谷盗全长转录本在各数据库总注释比例为90.6%。为了解基因产物及化合物在细胞内的代谢路径以及基因产物的功能,对转录本基因进行了KEGG 注释,共注释到6 574 个转录本,其中富集到基因最多的路径是信号传导,其次分别为分泌系统、运输和分解代谢等(图2)。
表2 各数据库注释结果统计表
Table 2 Statistical table of annotated results for each database
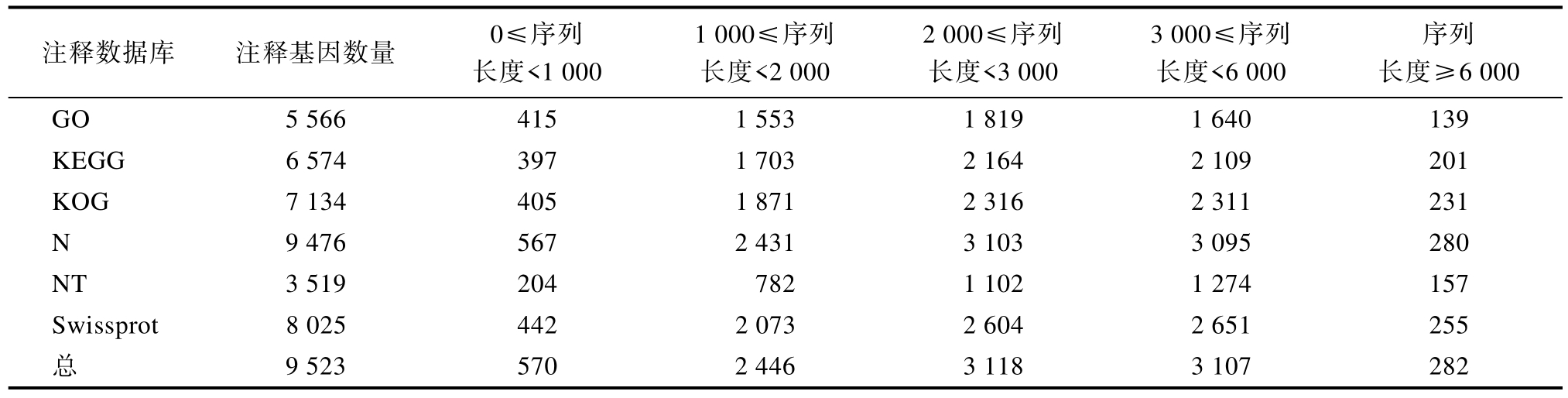
注释数据库 注释基因数量 0≤序列长度<1 000 1 000≤序列长度<2 000 2 000≤序列长度<3 000 3 000≤序列长度<6 000序列长度≥6 000 GO 5 566 415 1 553 1 819 1 640 139 KEGG 6 574 397 1 703 2 164 2 109 201 KOG 7 134 405 1 871 2 316 2 311 231 N 9 476 567 2 431 3 103 3 095 280 NT 3 519 204 782 1 102 1 274 157 Swissprot 8 025 442 2 073 2 604 2 651 255总 9 523 570 2 446 3 118 3 107 282
2.3 低温胁迫下差异表达基因
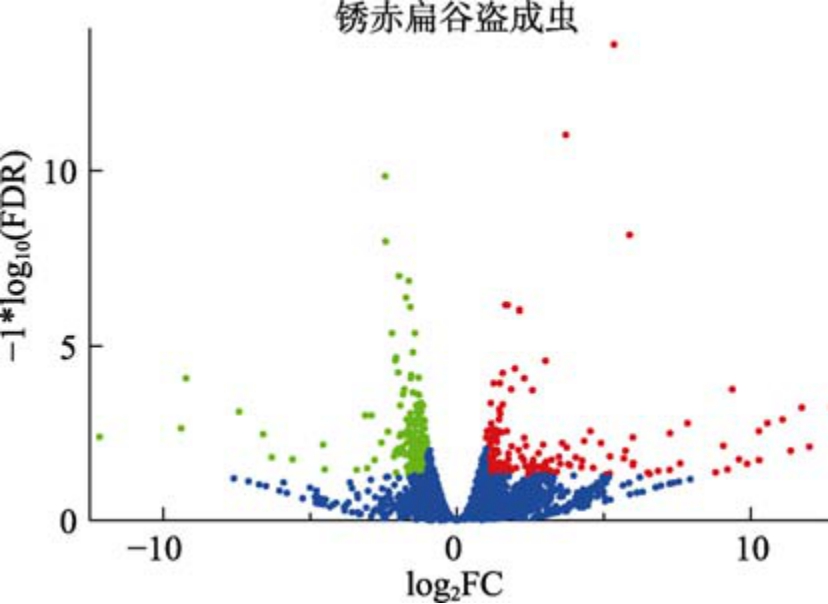
为了研究锈赤扁谷盗成虫响应低温胁迫的差异表达基因,分别测定了低温条件(15 ℃)和常温条件(35 ℃)下害虫的二代转录组数据。以三代全长转录本为参考序列,将二代转录组测序中每个样品的有效数据与之对比,各样品的有效数据比对到锈赤扁谷盗三代参考基因组的效率在73.00%~75.21%之间。与常温对照组相比,锈赤扁谷盗成虫经历15 ℃低温胁迫24 h 后有477 个基因发生了差异表达,其中177 个上调的基因,300 个下调的基因(图3)。
2.4 差异表达基因功能注释分析
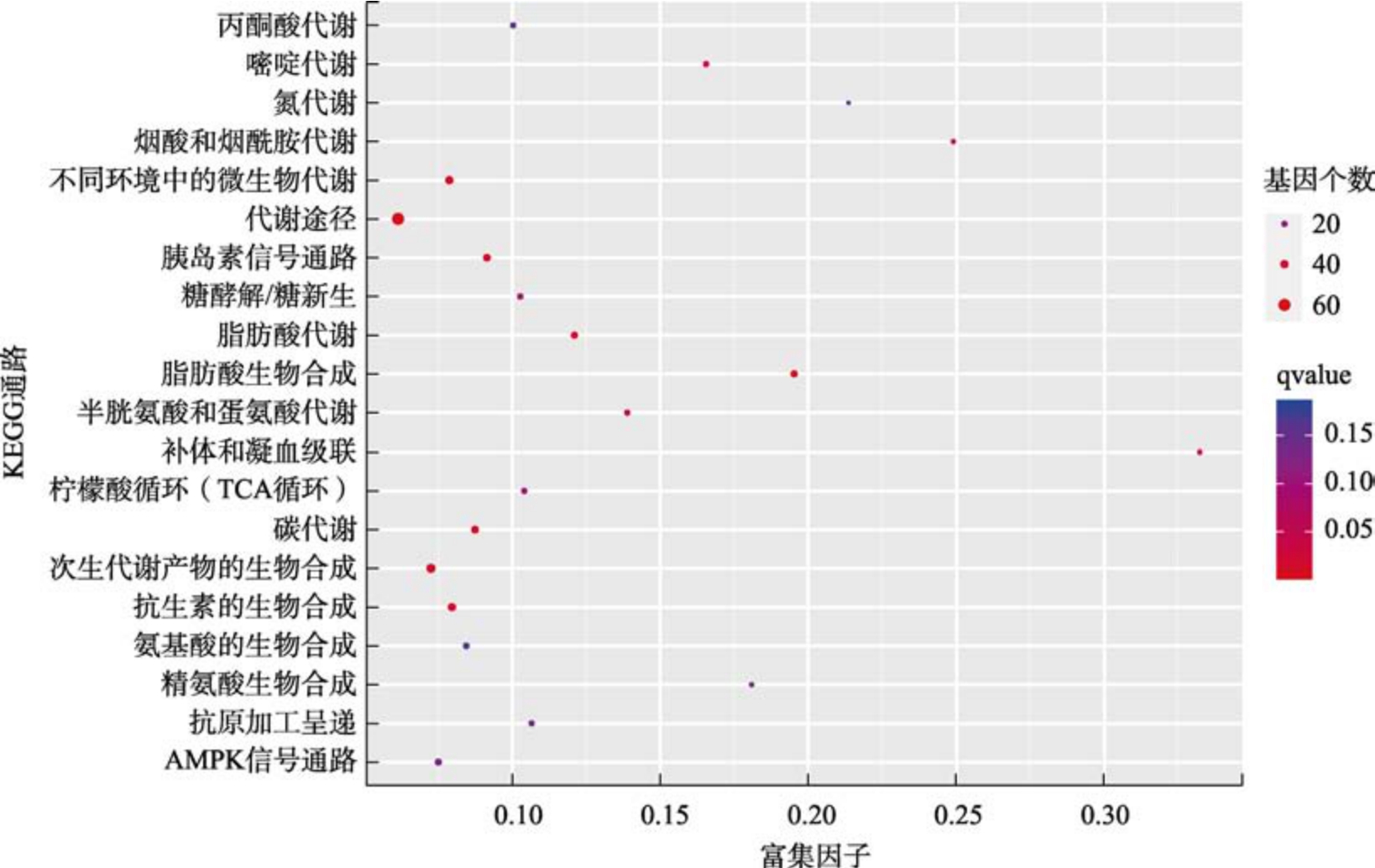
为进一步分析低温对锈赤扁谷盗的影响情况,利用KEGG 数据库对锈赤扁谷盗成虫差异表达基因参与的信号通路和生物学功能进行分析。低温差异表达的基因共富集到229 条信号通路,其中显著富集(校正P 值:qvalue<0.05)的有10条。富集程度最高的前5 条信号通路为代谢途径、脂肪酸生物合成、次生代谢产物的生物合成、脂肪酸代谢和不同环境中的微生物代谢(图4),结果表明低温胁迫条件下锈赤扁谷盗通过调控基因表达参与多条信号通路。
2.5 RT-qPCR 验证试验结果
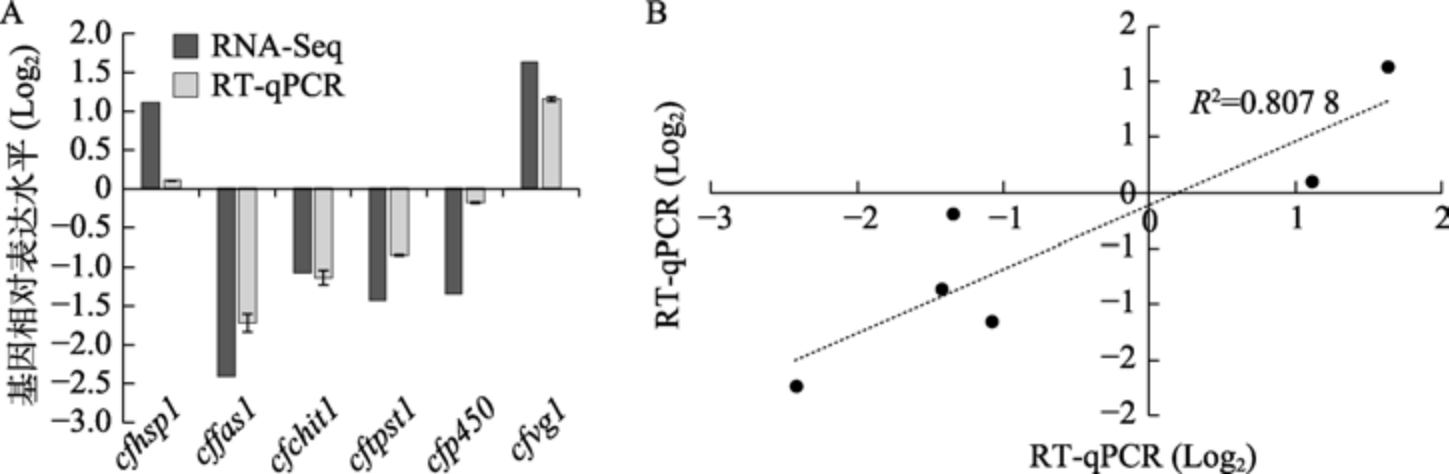
转录组测序结果表明锈赤扁谷盗成虫和幼虫的热激蛋白、脂肪酸合成酶、几丁质酶、海藻糖转运蛋白 P450 和卵黄蛋白原编码基因(cfhsp1、cffas1、cfchit1、cftpst1、cfP450 和cfvg)在低温胁迫条件下差异表达。因此,以ef1α 为内参基因,采用RT-qPCR 进一步验证转录组结果,与对照组35 ℃相比,低温条件下cffas1、cftpst 1 和cfP450 显著性下调表达, 而cfvg1 显著性上调表达(图5A),锈赤扁谷盗通过促进或抑制不同的表达响应低温胁迫,说明害虫应对低温具有多种适应性调节机制。进一步进行相关性分析,RT-qPCR 结果与转录组分析(RNASeq)的相关系数R2 为0.807 8(图5B),结果表明 RT-qPCR 和转录组测序分析结果的趋势一致。
3 讨论
基于转录组测序技术研究低温胁迫与储粮害虫的相互作用机制,可为低温防控储粮害虫提供理论支撑,同时为低温储粮技术中储粮害虫综合治理策略提供理论依据。本研究通过比较6 种常见的储粮害虫在4 种低温条件下的死亡率,表明锈赤扁谷盗具有较强的耐寒性,这与已有报道结果一致[1,5],为更好地了解其耐寒机制及低温对其影响,本文基于高通量转录组测序技术开展锈赤扁谷盗低温适应性形成的分子机制。
低温调控害虫基因表达,影响营养物质合成、能量产生、代谢途径等,进而影响其活动、取食和生长发育等行为。差异表达基因KEGG 分析中富集程度较高的是代谢途径和脂肪酸生物合成。这与谷蠹[10]、阿尔泰蝠蛾[11]和二化螟[12]等昆虫在低温胁迫下的脂肪酸生物合成代谢通路富集的分析结果类似,低温条件下脂肪酸合成酶活性均下降,可能是低温条件下昆虫通过脂质为机体提供能量,以保证昆虫在低温条件下能更好地存活。
差异表达基因分析显示低温胁迫下锈赤扁谷盗脂肪酸合成酶的表达量降低,脂肪酸合成酶参与昆虫脂肪代谢,在低温胁迫下表达量下降可能是能量供应不足所致,因此,调整表达量以适应低温环境。昆虫体内的海藻糖含量与昆虫抵抗环境胁迫具有相关性[13],昆虫体内的海藻糖需要由海藻糖转运体运输到循环的血淋巴中,从而为其他组织提供能量[15],本研究中海藻糖转运蛋白编码基因在低温胁迫下基因的表达量降低,表明海藻糖代谢途径参与抵御低温胁迫。多项转录组学分析研究表明温度胁迫影响细胞色素P450 编码基因的表达水平[14],由于细胞色素P450 广泛存在于昆虫体内,参与外援有毒物质的代谢,推测低温对于害虫的抗药性具有一定影响。此外,低温条件下促进卵黄蛋白原的表达,这与在蜜蜂中的研究结果一致[16],这表明卵黄蛋白原可能在低温条件下对受损细胞起到保护或识别的作用。因此,害虫通过调节多种基因的表达量响应低温胁迫。
4 结论
通过转录组学分析了低温对锈赤扁谷盗基因表达水平的影响,代谢途径、脂肪酸生物合成和次生代谢产物的生物合成等多条信号通路参与响应温度胁迫,脂肪酸合成酶、海藻糖运转蛋白和卵黄蛋白原等相关编码基因显著性表达,通过调节锈赤扁谷盗的代谢途径和生长发育抑制害虫爆发。此外,有关差异表达基因功能的研究仍有待进一步探索,以期更好地分析储粮害虫的耐寒机制。本文对锈赤扁谷盗转录组水平的研究为耐寒性靶标基因寻找提供了基础数据,为低温储粮下害虫的综合防治策略奠定了基础。
参考文献:
[1] BHARATHI V S K, JIAN F, JAYAS D S. Biology, ecology, and behavior of rusty grain beetle (Cryptolestes ferrugineus(Stephens))[J]. Insects, 2023, 14(7): 590.
[2] 赵欣欣, 王殿轩, 白春启, 等. 锈赤扁谷盗等3 种菌食性储粮害虫的发生分布调查[J]. 粮油食品科技, 2019, 27(3): 83-89.ZHAO X X, WANG D X, BAI C Q, et al. Investigation on occurrence and distribution of three fungivore pests in stored grain[J]. Science and Technology of Cereals, Oils and Foods,2019, 27(3): 83-89.
[3] 齐艳梅, 伍祎, 汪中明, 等. 稻谷粮堆表层害虫活动和发展规律初探[J]. 粮油食品科技, 2015, 23(6): 105-110.QI Y M, WU Y, WANG Z M, et al. A primary study about the activity and development regularity of pests on the surface of grain bulk[J]. Science and Technology of Cereals, Oils and Foods, 2015, 23(6): 105-110.
[4] BALE J, HAYWARD S. Insect overwintering in a changing climate[J]. Journal of Experimental Biology, 2010, 213(6):980-994.
[5] 吴天意, 赵国民, 夏丽媛, 等. 低温对锈赤扁谷盗不同虫态及其种群的抑制作用[J]. 中国粮油学报, 2023, 38(4): 1-6.WU T Y, ZHAO G M, XIA L Y, et al. Inhibition effects of low temperature on different growth stages and the populations of Cryptolestes Ferrugineus[J]. Journal of the Chinese Cereals and Oils Association, 2023, 38(4): 1-6.
[6] WANG Z, GERSTEIN M, SNYDER M. RNA-Seq: A revolutionary tool for transcriptomics[J]. Nature Reviews Genetics, 2009,10(1): 57-63.
[7] CHEN E H, DUAN J Y, SONG W, et al. RNA-seq analysis reveals mitochondrial and cuticular protein genes are associated with phosphine resistance in the rusty grain beetle (Coleoptera:Laemophloeidae) [J]. Journal of Economic Entomology, 2020,114(1): 440-453.
[8] FU L, NIU Z, ZHU Z, et al. CD-HIT: accelerated for clustering the next-generation sequencing data[J]. Bioinformatics, 2012,28(23): 3150-3152.
[9] 吴海晶. 锈赤扁谷盗对磷化氢产生抗性的机理研究[D]. 南京:南京财经大学, 2016.WU H J. The study of phosphine resistance mechanisms in the Cryptolestes Ferrugineus[D]. Nan jing: Nanjing University of Finance and Economics, 2016.
[10] XUE D R, YANG Y, FANG L W, et al. Trehalose 6-phosphate synthase gene rdtps1 contributes to thermal acclimation in Rhyzopertha dominica[J]. BMC Genomics, 2024, 25(1): 172.
[11] 孙涛, 张示渊, 张婷婷, 等. 阿尔泰蝠蛾(鳞翅目: 蝙蝠蛾科)幼虫低温胁迫转录组分析[J]. 应用昆虫学报, 2021, 58(5):1113-1125.SUN T, ZHANG S Y, ZHANG T T, et al. Gene transcription in Hepialus altaicola (Lepidoptera: Hepialidae) larvae subject to cold stress[J]. Chinese Journal of Applied Entomology, 2021,58(5): 1113-1125.
[12] SONODA S, FUKUMOTO K, IZUMI Y, et al. Cloning of heat shock protein genes (hsp90 and hsc70) and their expression during larval diapause and cold tolerance acquisition in the rice stem borer, Chilo suppressalis Walker[J]. Archives of insect biochemistry and physiology, 2006, 63(1): 36-47.
[13] SHUKLAE, THORAT L J, NATH B B, et al. Insect trehalase:physiological significance and potential applications[J]. Glycobiology,2015, 25(4): 357-367.
[14] MWANDO N L, KHAMIS F M, NDLELA S, et al. Comparative transcriptome analysis of false codling moth, Thaumatotibia leucotreta in response to high and low-temperature treatments[J].Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 2024, 50: 101199.
[15] LEYRIA J, EL-MAWED H, ORCHARD I, et al. Regulation of a trehalose-specific facilitated transporter (TRET) by insulin and adipokinetic hormone in Rhodnius prolixus, a vector of chagas disease[J]. Frontiers in Physiology, 2021, 12: 624165.
[16] RAMIREZ L, NEGRI P, STURLA L, et al. Abscisic acid enhances cold tolerance in honeybee larvae[J]. Proceedings of the Royal Society B-Biological Sciences, 2017, 284(1852):20162140.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。