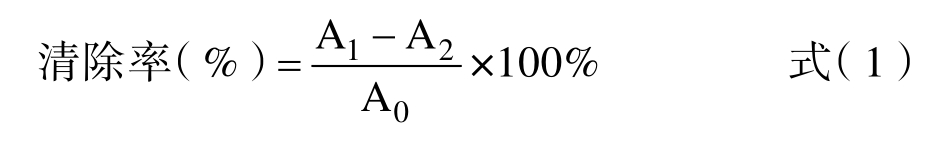
Effects of Different Modification Methods on the Functional Properties and Structure of Chlorella Protein
小球藻,属绿藻门,是一类微小的绿色藻类[1],因存在的形式为球状细胞而得名。临床试验表明,补充小球藻有助于改善人体的高血脂和高血糖,并能预防氧化应激、癌症和慢性阻塞性肺病[2]。小球藻富含蛋白质、多糖[3],还含有人和动物所必需的多种氨基酸、维生素等营养成分[4],是一种极具开发潜质的新型蛋白质资源[5]。但是,小球藻蛋白中近六成属于不溶性蛋白,其在水性体系中分散能力弱,导致其通常作为惰性填料使用,难以作为乳化剂、发泡剂等功能成分参与食品加工体系,因此极大限制了小球藻蛋白在食品领域的应用[6]。找出有效的蛋白改性方法,改善小球藻蛋白的功能特性,从而解决局限性,将其应用在食品功能成分中是小球藻加工领域研究的热点[7]。
目前,食用蛋白改性的方法涉及多个领域,主要目的是改善其功能性、稳定性、可溶性以及其他特定性质。有生物酶法,WAGHMARE[8]使用多种酶来对小球藻蛋白的溶解性进行改良;物理法,LEE[9]使用超声破碎法使小球藻蛋白表面特性得到改变,但面临高能量输入导致蛋白质结构破坏的风险;化学法,WANG[10]对稻米谷蛋白使用三聚磷酸钠进行磷酸化改性,稻米谷蛋白的溶解性、乳化性和热稳定性显著改善。
因此,本研究以小球藻粉为原料,采用超声辅助热碱法提取小球藻蛋白,比较三聚磷酸钠法(Sodium tripolyphosphate method, STPPM)、中性蛋白酶法(Neutral protease method, NPM)、超声波法(Ultrasonic method, UM)3 种改性方法对小球藻蛋白的粒径、电位、理化性质、微观结构、二级结构及热稳定性的影响差异,寻求一种最佳的小球藻蛋白改性方法,为小球藻蛋白在食品加工方面的应用提供借鉴。
小球藻(Chlorella sp. FACHB-5)藻泥:中国科学院淡水藻种库;考马斯亮蓝G-250、中性蛋白酶(8×105 U/g)、溴酚蓝:国药集团化学试剂有限公司;氢氧化钠、盐酸、三聚磷酸钠、过硫酸钾(分析纯):天津市科密欧化学试剂有限公司。
Scientz-IID 超声波细胞破碎仪:宁波新芝生物科技股份有限公司;VERTEX70 傅立叶变换中远红外光谱仪:德国BRUKER 公司;激光粒度仪及ZETA 电位分析系统:丹东百特仪器有限公司;DSC3 差示扫描量热仪:瑞士梅特勒托利多国际有限公司;荧光分光光度计:美国安捷伦有限公司;台式扫描电镜:日本日立高新技术公司;Chirascan多功能圆二色光谱仪:英国应用光物理公司。
1.2.1 小球藻蛋白溶液的制备
将小球藻藻泥按照料液比1∶50 加入100 mL质量分数为5%的NaOH 溶液,50 ℃加热1 h 后使用超声细胞破碎仪(300 W,10 min)破碎细胞壁,得到小球藻蛋白溶液。
1.2.2 小球藻蛋白的纤维素柱层析纯化
将破壁后的小球藻蛋白溶液通过等电点碱提酸沉法获得粗蛋白溶液,参考曹猛[11]的方法在4 ℃下,取500 mL 粗蛋白溶液上样并进行梯度洗脱,洗脱液为含0、0.2、0.4、0.6、0.8 mol/L NaCl的 Tris-HCl 缓冲液(pH 8.0),洗脱速度为 2 mL/min,每支收集管收集洗脱液10 mL,每个梯度收集50 管。随后将收集管内的洗脱液合并,透析浓缩后进行干燥处理得到纯化小球藻蛋白。
1.2.3 小球藻蛋白的改性
1.2.3.1 三聚磷酸钠法 在小球藻蛋白溶液中按0.5%的质量分数加入三聚磷酸钠,在60 ℃水浴中加热30 min,随后通过等电点法加入盐酸调节pH 为4.0 使蛋白质沉淀,放入转速8 000 r/min 的离心机中离心10 min 后得到沉淀蛋白,放入–80℃超低温冰箱预冻6 h 后进行冷冻干燥。
1.2.3.2 中性蛋白酶法 调节小球藻蛋白溶液pH 为6.8,按1.5%的质量分数加入中性蛋白酶(8×105 U/g),在55 ℃水浴中搅拌30 min 进行水解预处理,处理结束调节溶液pH 为10.0 并保持10 min 使酶灭活,后续步骤同1.2.3.1。
1.2.3.3 超声波法 将小球藻蛋白溶液放入超声细胞破碎仪中,以500 W 持续超声10 min,后续步骤同1.2.3.1。
1.2.4 小球藻蛋白抗氧化活性测定
1.2.4.1 DPPH 自由基清除率的测定 将样品分别制成浓度为1 mg/mL 的溶液,吸取2.5 mL 0.025 mg/mL 的DPPH(1,1-二苯基-2-三硝基苯肼)溶液,加入2.5 mL 样品溶液,混匀,黑暗中放置30 min,随后吸取100 μL 于517 nm 处测吸光度,记为A1;吸取2.5 mL 乙醇溶液,加入2.5 mL 样品溶液,混匀,黑暗中放置30 min,随后吸取100 μL 于517 nm 处测吸光度,记为A2;吸取2.5 mL 0.025 mg/mL 的DPPH 溶液,加入2.5 mL乙醇溶液,混匀,黑暗中放置30 min,随后吸取100 μL 于517 nm 处测吸光度,记为A0。DPPH自由基清除率计算公式如下:
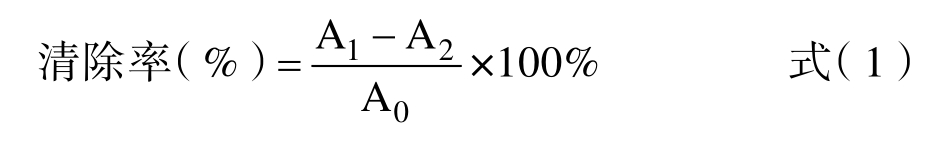
1.2.4.2 ABTS 自由基清除能力的测定 取等体积的2.45 mmol/L K2S2O4 溶液和7 mmol/L ABTS溶液振荡混匀,黑暗中过夜配置成ABTS·+溶液。取1 mg/mL 样品20 μL 和ABTS·+溶液180 μL 在25 ℃反应10 min,于734 nm 处测吸光值,记为A0;取蒸馏水20 μL 和ABTS·+溶液180 μL 在25 ℃反应10 min,于734 nm 处测吸光值,记为A1。ABTS 自由基清除率计算公式如下:
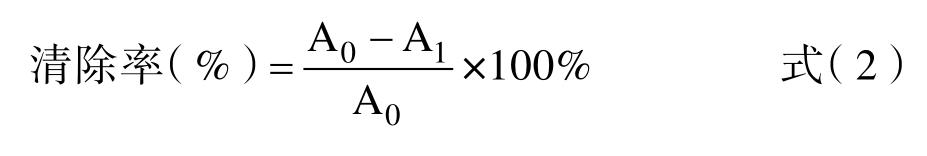
1.2.5 小球藻蛋白功能性质测定
1.2.5.1 溶解度的测定 参照Cepeda 等的方法进行适当修改[12],配置1 mg/mL 样品溶液20 mL,分别用1 mol/L 盐酸溶液和1 mol/L NaOH 溶液调节pH 为7.0,涡旋仪震荡5 min,以转速4 000 r/min离心10 min 后使用考马斯亮蓝法测上清蛋白含量(595 nm)溶解度计算方法如下:
1.2.5.2 持水性及持油性的测定 持水性:参照宋林的方法进行适当修改[13],取100 mg 样品溶解于10 mL 蒸馏水并放置在离心管中,以转速5 000 r/min 离心10 min 后倒掉上清液并称量残渣质量。持水性计算公式如下:
式中:m 为样品质量,g;m1 为去除上清液后离心管质量,g;m 2 为离心管和样品的总质量,g。
持油性:取100 mg 样品溶解于10 mL 大豆油并放置在离心管中,以转速 4 000 r/min 离心10 min 后倒掉上清液并称量残渣质量。持油性计算公式如下:
其中各符号含义同持水性计算公式。
1.2.5.3 表面疏水性测定 将50 mg 样品溶于1.5 mL(0.1 mol/L,pH=7.0)的磷酸盐缓冲溶液中,同时加入40 μL 的溴酚蓝,室温放置10 min后以4 000 r/min 转速离心10 min,将上清液稀释10 倍,在595 nm 测吸光值,以不加蛋白样品为空白对照。
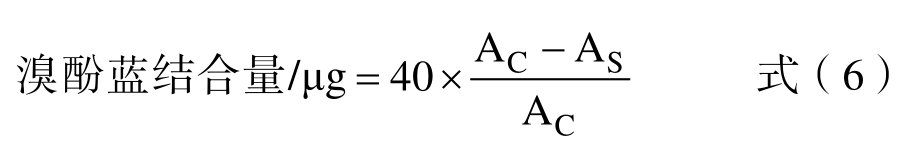
式中:AS 为样品在595 nm 处测的吸光值;AC 为空白在595 nm 处测的吸光值。
1.2.5.4 乳化性及乳化稳定性的测定 将1 mg/mL 样品取9 mL 与3 mL 大豆油混合,涡旋5 min 后从离心管底部取100 μL 乳浊液用0.1%十二烷基硫酸钠溶液稀释至5 mL,混匀后于500 nm波长处测定吸光值,记为AS;10 min 后再从离心管底部取100 μL 乳浊液用浓度为0.1%的十二烷基硫酸钠溶液稀释至5 mL,混匀后于500 nm 波长处测定其吸光值,记为AW。根据以下公式计算样品溶液的乳化性和乳化稳定性:
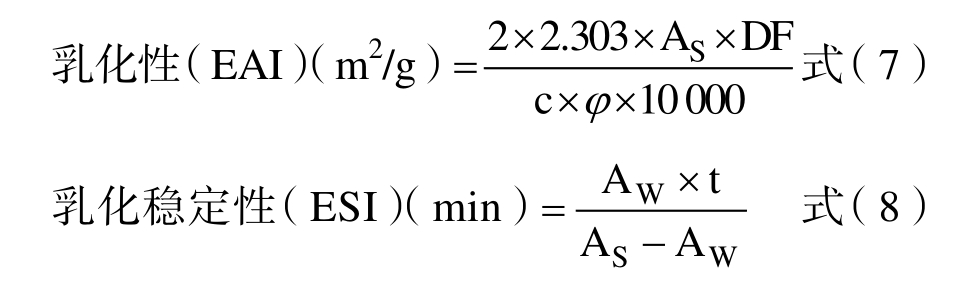
式中:DF 为稀释倍数(50);c 为样品初始浓度(g/mL);φ 为乳状液中油体积分数(0.25);t 为10 min。
1.2.6 小球藻蛋白的结构表征
1.2.6.1 小球藻蛋白粒径及电位分析 将各样品溶于磷酸盐缓冲溶液配置成1 mg/mL 蛋白溶液使用激光粒度仪及ZETA 电位分析系统测定。
1.2.6.2 小球藻蛋白的红外光谱测定 将各样品和溴化钾粉末以1∶100 的质量比混合研磨,确保将粉末压薄后放进红外光谱仪内在4 000~400 cm–1波段之间扫描,分辨率为4 cm–1,连续扫描30 次。
1.2.6.3 小球藻蛋白的圆二色谱测定 参照孔潇等的方法进行适当修改[14],圆二色谱条件为:光谱测量范围260~180 nm,响应时间1 s,扫描速度100 nm/min,每个样品采集3 次,扫描带宽2 nm,扫描温度(25±1) ℃。
1.2.6.4 小球藻蛋白的荧光光谱测定 将各样品稀释成0.2 mg/mL,设置激发波长为270 nm,选择发射波长的测定范围320~400 nm,狭缝宽度在5 nm,扫描速度为1 200 nm/min,扫描电压为450 mV。
1.2.6.5 小球藻蛋白的热稳定性测定 参照张慧娟的方法进行测定[15]。
1.2.6.6 小球藻蛋白的微观结构测定 参照Gómez 等的方法进行测定[16]。
实验数据采用SPSS 19.0 进行显著性分析,运用Excel 2016 进行统计分析,利用Origin 2021 软件作图,用Omnic 9.2 和Perkfit 4.1.2 对蛋白二级结构进行图谱分析,每组样品均做3 次平行实验。
DPPH 自由基和ABTS 自由基两者均是常用的抗氧化活性指标,在化学方法中用于评价样品对自由基的清除能力,从而评估其抗氧化活性。由图1 可知,经UM 改性后的小球藻蛋白的DPPH自由基清除率提升较为明显,高达24.98%,NPM的小球藻蛋白改性后其ABTS 自由基清除率由改性前的22.95%提升至35.72%。这是由于超声波通过高频振动会改变小球藻蛋白的结构,可能使得原本被隐藏的活性位点暴露出来使其能够与DPPH 自由基发生反应,从而增强了其DPPH 自由基清除能力。
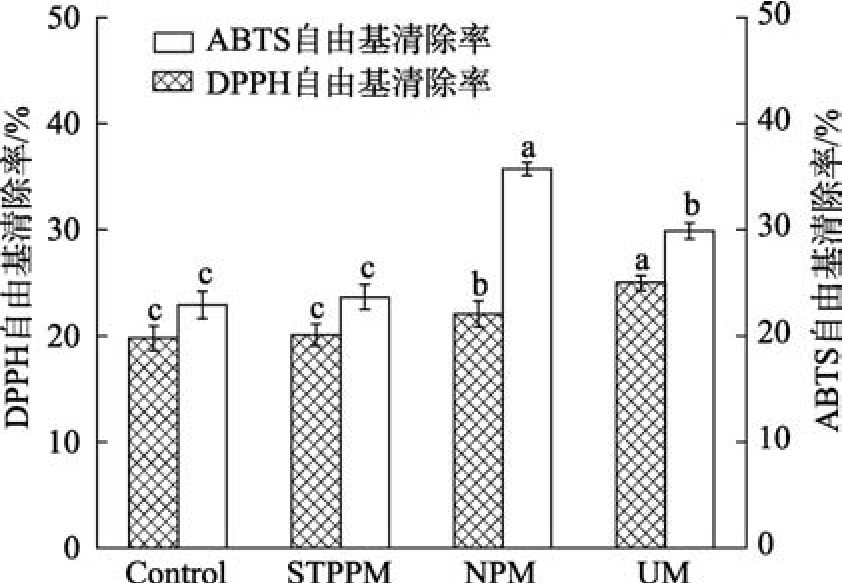
图1 不同改性方法对小球藻蛋白抗氧化活性的影响
Fig.1 Effect of different modification methods on the antioxidant activity of Chlorella proteins
注:图中不同的小写字母代表样品间存在显著性差异(P<0.05),显著性大小依次为“a, b, c”,下同。
Note: Differernt lowercase letters in the figure indicate significant differences among samples (P<0.05), significance in order of “a, b, c”, the same as below.
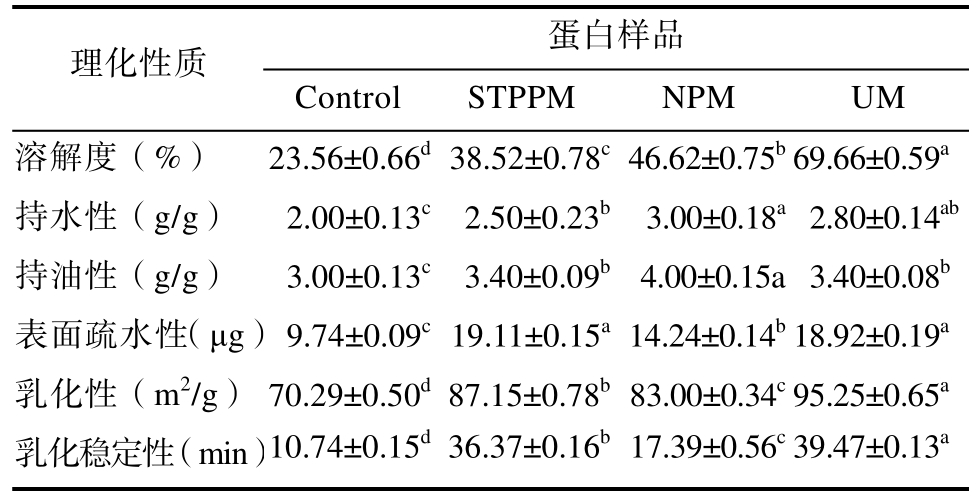
蛋白质的改性直接影响蛋白的功能特性。用三种改性方法对小球藻蛋白进行改性,其特性变化见表1,蛋白在改性后,在功能性质方面均有改善,特别是NPM 和UM 的改性效果明显。
表1 不同改性方法对小球藻蛋白功能性质变化的对比分析
Table 1 Comparative analysis of changes in functional properties of Chlorella proteins by different modification methods
注:表中不同的小写字母代表样品间存在显著性差异(P<0.05),显著性大小依次为“a, b, c”,下同。
Note: Differernt lowercase letters in the table indicate significant differences among samples (P<0.05), significance in order of “a, b, c”, the same as below.
蛋白样品理化性质Control STPPM NPM UM溶解度(%) 23.56±0.66d 38.52±0.78c 46.62±0.75b 69.66±0.59a持水性(g/g) 2.00±0.13c 2.50±0.23b 3.00±0.18a 2.80±0.14ab持油性(g/g) 3.00±0.13c 3.40±0.09b 4.00±0.15a 3.40±0.08b表面疏水性(μg)9.74±0.09c 19.11±0.15a 14.24±0.14b 18.92±0.19a乳化性(m2/g) 70.29±0.50d 87.15±0.78b 83.00±0.34c 95.25±0.65a乳化稳定性(min)10.74±0.15d 36.37±0.16b 17.39±0.56c 39.47±0.13a
根据表1 和图2 可知,UM 改性的小球藻蛋白得到的溶解度、乳化性及乳化稳定性都有明显的提高,特别是溶解度比对照提升了46.10%,乳化稳定性相较对照提升了28.73%,这是由于超声波通过产生高频振动波,引起蛋白质分子之间的机械剪切效应,有助于打破蛋白质的分子结构,使其更容易在水中或其他溶剂中溶解,同时由于超声波的作用导致溶液中形成微小的气泡或颗粒,从而在乳化过程中提高了蛋白质与油相的接触面积,增加了乳化稳定性。NPM 改性的小球藻蛋白在持水性、持油性以及表面疏水性方面有很大改善,这是由于热力学的作用使得埋藏在蛋白分子里的极性侧链得到解离和断链并转向蛋白表面,提高了蛋白分子之间的相互作用,从而使持水性提高。
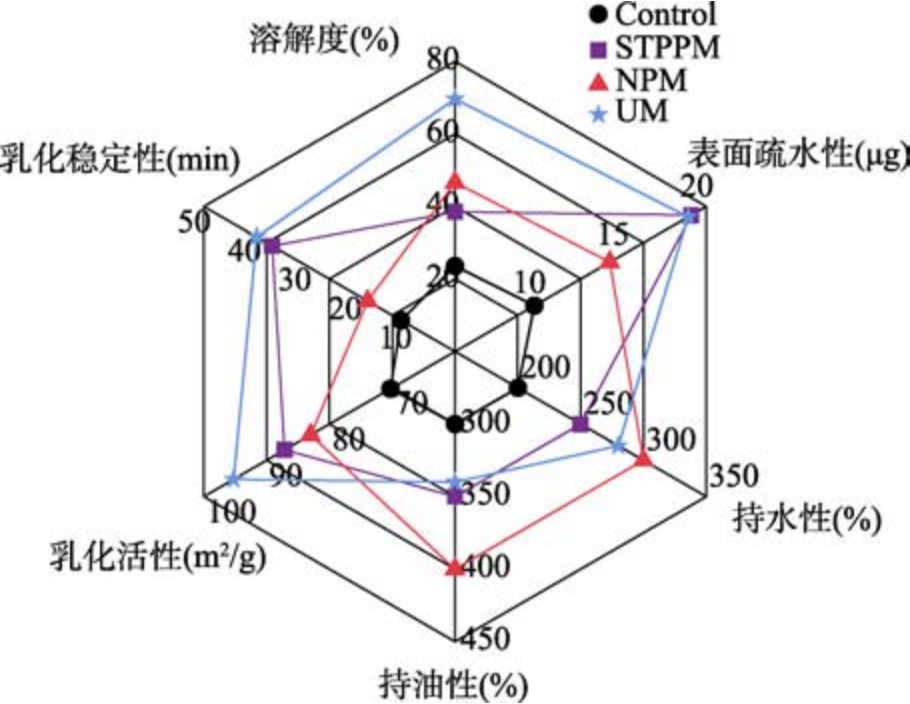
图2 不同改性方法对小球藻蛋白功能性质的影响
Fig.2 Effects of different modification methods on the functional properties of Chlorella proteins
通常粒径越小说明蛋白质溶液越均一,Zeta电位的绝对值越大,蛋白质分子间的静电相互作用越强,其在溶液中的分散稳定性越好,溶液越稳定[17]。对改性后的小球藻蛋白粒径和电位进行测定,结果见图3,与未改性蛋白相比,STPPM、NPM、UM 的小球藻蛋白粒径大小显著降低。尤其是UM 改性后,小球藻蛋白粒径从674.12 nm降至324.42 nm,Zeta 电位的绝对值增大,改性前的Zeta 电位值为–19.46 mV,改性后变为–31.27 mV。这是因为超声波产生的机械剪切力对小球藻蛋白结构造成一定的破坏,使蛋白质结构更为舒展,静电斥力增强,抑制了蛋白质的聚集,使蛋白质的粒径减小,这也为上述小球藻蛋白的溶解度变化提供了有力印证。
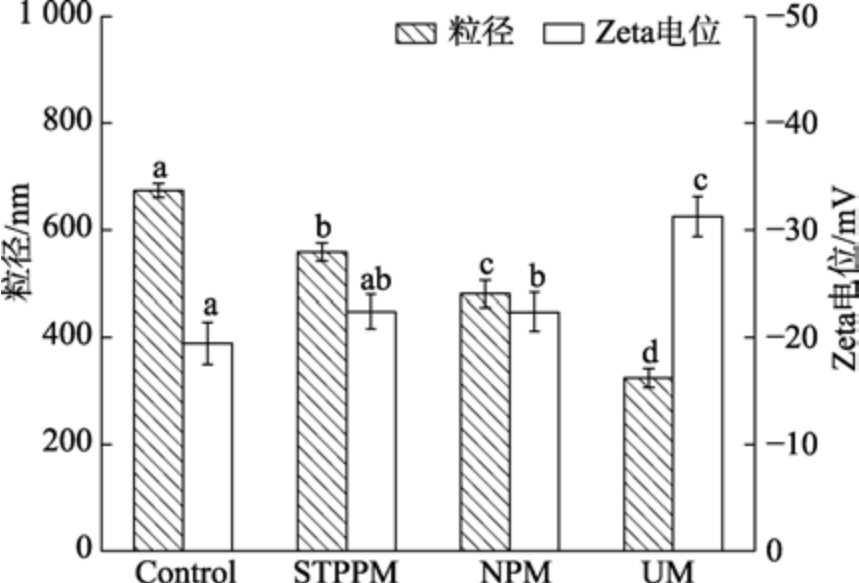
图3 不同改性方法对小球藻蛋白粒径和电位的影响
Fig.3 Effect of different modification methods on particle size and potential of chlorella protein
红外光谱主要通过对峰的位置及形状改变判定小球藻蛋白的二级结构变化,结果见图4。通过PeakFit 4.1.2 酰胺I 带的波长分析二级结构,1 636~1 618 cm–1 波 段 代 表β-折 叠、1 647~1 636 cm–1 波段代表无规则卷曲、1 666~1 647 cm–1波段代表α-螺旋、1 698~1 666 cm–1 波段代表β-转角,1 651 cm–1 附近的峰为酰胺Ⅰ带的C==O 伸缩振动引起,而1 522 cm–1 附近出现的各峰则由多种振动共同引起,包括酰胺Ⅱ带的C—N 伸缩振动、N—H 变形振动、CH2 弯曲、COO—对称伸缩振动[18]。改性前后二级结构的差异可能是提取蛋白过程中改性方法的原因,降低了氨基酸部分序列之间或蛋白质分子各部位之间的相互作用力[19]。
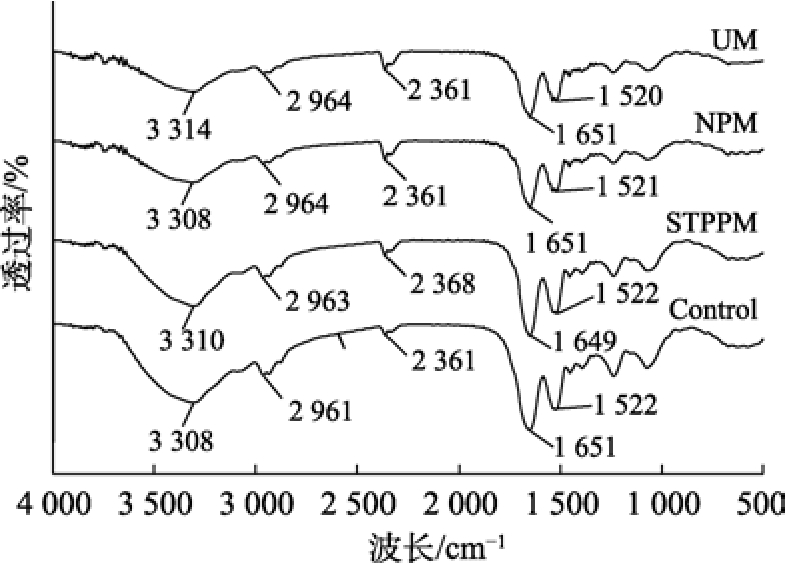
图4 红外光谱分析各改性蛋白的二级结构
Fig.4 Secondary structure of each modified protein analyzed by infrared spectroscopy
圆二色光谱对于研究稀溶液中的蛋白质构象具有快速、简单、较准确的特点,是应用最为广泛的测定蛋白质二级结构的方法。圆二色光谱分为远紫外和近紫外两个区域,远紫外区是肽键所在的吸收范围,其能够较为直观的反映肽链的结构。通过圆二色光谱对改性蛋白分析,由图5 知,205 nm 处的负峰显示具有α-螺旋结构,由于其过于稳定,会阻止改变蛋白质构象,蛋白质趋于稳定则不利于蛋白功能特性的改变。相比α-螺旋结构,β-折叠与无规则卷曲结构使得蛋白稳定性较差,从而促使蛋白的柔韧度以及功能特性有良好的改变[20]。
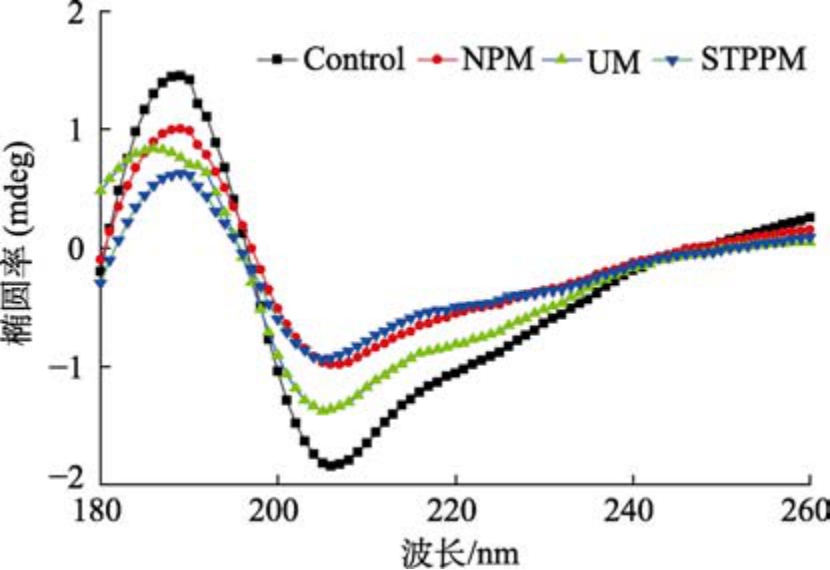
图5 不同改性方法对小球藻蛋白二级结构的影响
Fig.5 Effect of different modification methods on the secondary structure of Chlorella protein
通过红外光谱及圆二色谱并结合表2 可以看出,改性前后蛋白质二级结构改变了构象,在对照蛋白中包含了10.5%的α-螺旋、29.0%的β-折叠、15.5%的β-转角和44.9%的无规则卷曲。改性后的蛋白α-螺旋含量均出现不同程度降低,其中STPPM 的α-螺旋含量下降最低;同时β-折叠含量均出现不同程度增多,以NPM 最为明显,而α-螺旋含量下降,β-折叠含量增多可以表示蛋白质结构的展开,这与Sun 等的研究结果一致[21],也侧面证明了NPM 相较于其他改性方法对改善蛋白柔韧度以及功能特性方面有更好的效果。蛋白质的二级结构不仅取决于氨基酸的局部序列,还取决于分子之间的相互作用,STPPM 中二级结构变化可能是由于三聚磷酸钠和小球藻蛋白反应后溶解性的增加,从而增大蛋白质之间的空间距离,分子链的伸展使得小球藻蛋白尾部的α-螺旋链部分解开,小球藻蛋白的疏水性增加,同时增强了蛋白二级结构的稳定性,使小球藻蛋白的α-螺旋向其他结构转化;NPM 这种结构变化可能与中性蛋白酶底物位点为疏水性芳香族氨基酸有关,而疏水性芳香族氨基酸多包埋于蛋白质内部的α-螺旋结构中,因此酶解处理后小球藻蛋白的α 螺旋受到破坏则转变为无规则卷曲结构;UM 就是由于超声波在分子之间引起机械剪切效应从而引起了二级结构的变化。
表2 不同改性方法对小球藻蛋白二级结构变化的对比分析
Table 2 Comparative analysis of changes in the secondary structure of Chlorella protein by different modification methods %
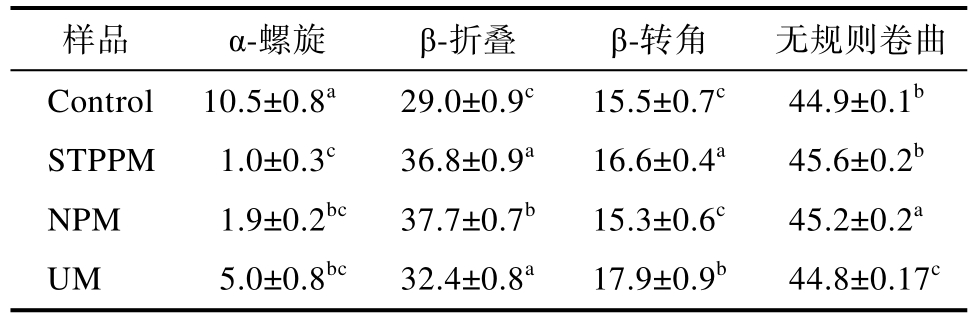
样品 α-螺旋 β-折叠 β-转角 无规则卷曲Control 10.5±0.8a 29.0±0.9c 15.5±0.7c 44.9±0.1b STPPM 1.0±0.3c 36.8±0.9a 16.6±0.4a 45.6±0.2b NPM 1.9±0.2bc 37.7±0.7b 15.3±0.6c 45.2±0.2a UM 5.0±0.8bc 32.4±0.8a 17.9±0.9b 44.8±0.17c
荧光光谱可以用来反映芳香族氨基酸荧光强度的变化,将色氨酸、酪氨酸以及苯丙氨酸残基暴露在极性环境里,使其作为蛋白质构象变化的指示剂,从而可以间接反映蛋白质三级结构的变化,从图6 可以看出,NPM 的小球藻蛋白荧光强度升高,说明其中的酪氨酸残基存在于更疏水的环境中。STPP 的小球藻蛋白荧光强度达到最高,这可能是小球藻蛋白经过三聚磷酸钠改性后构象发生变化,导致荧光基团更多地暴露在溶液中,这种暴露可能增加了荧光基团的受激发几率,从而提高了荧光强度;超声波的机械作用打开了蛋白的疏水内部,在分子水平上暴露疏水氨基酸残基,因而造成UM 的小球藻蛋白的荧光强度较对照蛋白有所降低。
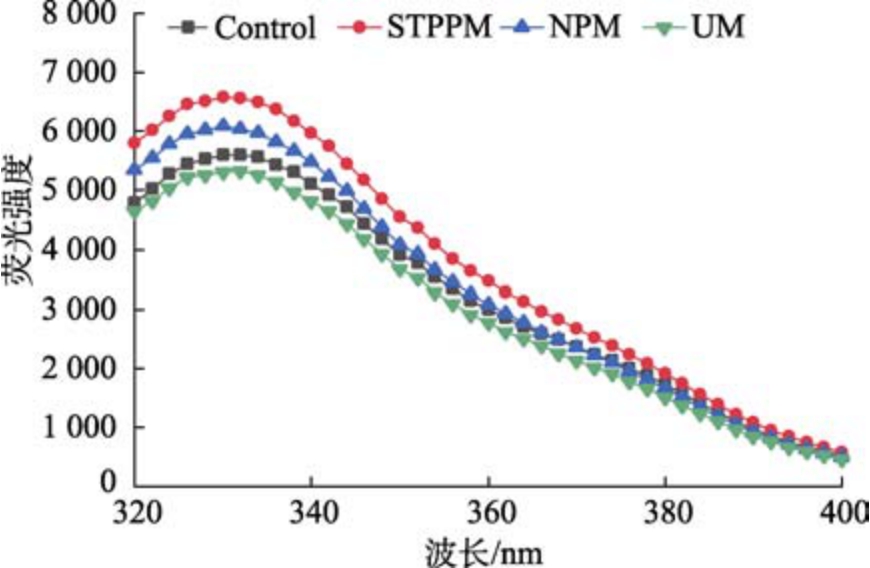
图6 不同改性方法对小球藻蛋白三级结构的影响
Fig.6 Effect of different modification methods on the tertiary structure of Chlorella proteins
热稳定性是指物质在加热过程中所表现出的稳定性,即物质抵抗热分解或热变性的能力,本文通过差示扫描量热法分析改性后的小球藻蛋白热稳定性差异。由图7 可知,对照及各改性蛋白的曲线均有一个明显的吸热峰,NPM 和UM 改性蛋白变性温度提升明显,分别为 82.35 ℃和78.86 ℃,60~80 ℃出现吸热峰大多与蛋白样品中的水分有关,在升温过程中,水分的蒸发造成吸热现象。上文各改性蛋白持水性的变化则印证此论述,热稳定性是蛋白应用于食品工业中的重要性质之一,由热力学分析可知改性后的小球藻蛋白均具有较好的热稳定性。
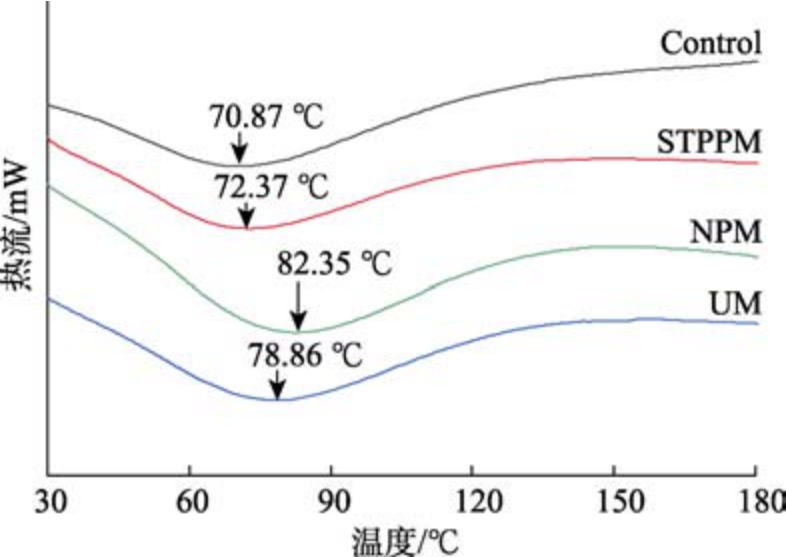
图7 不同改性方法对小球藻蛋白热稳定性的影响
Fig.7 Effect of different modification methods on the thermal stability of chlorella protein
在放大500 倍条件下观察对照蛋白样品以及各改性蛋白样品表面结构见图8,由图8a 可知改前小球藻蛋白为呈相对紧密的较大体积片层状,多为光滑表面,无较为明显小颗粒物质;图8b 是STPPM 改性后的小球藻蛋白,颗粒感明显增多;图8c 是小球藻蛋白经 NPM 改性后的结果,性可见其表面颗粒较少,但片层状结构仍占多数;图8d 是经UM 改性后的小球藻蛋白,颗粒感物质相较于图8b 更为细小且数量更多,这也更直观地显示了经过超声波改性后小球藻蛋白溶解度明显升高同时粒径显著变小的原因。这是由于超声波产生的高频振动波导致小球藻蛋白分子链的断裂或分解,从而形成更多的颗粒感物质。

图8 改性前后小球藻蛋白的扫描电镜图
Fig.8 Scanning electron microscopy of chlorella proteins before and after modification
注:a:对照蛋白;b:STPPM;c:NPM;d:UM。
Note: a: - control protein; b: - STPPM; c: - NPM; d: - UM.
小球藻蛋白因其丰富的营养成分和多种生物活性,在多个领域具有重要的应用价值。通过使用三聚磷酸钠法、中性蛋白酶法和超声波法3 种不同方法对小球藻蛋白进行改性,并对其改性后的结构和理化性质进行分析。小球藻蛋白的结构特性及理化性质与改性前均存在较大变化,其溶解度、乳化性、乳化稳定性及热稳定性均显著高于改性前的小球藻蛋白(P<0.01)。其中超声波法对小球藻蛋白的溶解度、乳化性、乳化稳定性、粒径以及电位指数改善最为显著,溶解度从23.56%提升到69.66%,乳化性从70.29 m2/g 提升到95.25 m2/g,乳化稳定性从10.74 min 提升到39.47 min,粒径从674.12 nm 下降到324.42 nm,Zeta 电位值为从改性前的–19.46 mV 变为–31.27 mV,同时发现经过超声波处理的小球藻蛋白在抗氧化活性方面有显著提升,DPPH 以及ABTS 自由基清除能力有所增强,但持油性的改善效果并不明显。综上所述,超声波法对小球藻改性效果最为有效,是小球藻蛋白改性可行的方法,具有潜在的创新和改进价值,为小球藻蛋白在食品工业中的应用提供了有效途径。随着研究的深入和技术的进步,小球藻蛋白的应用潜力将会进一步拓展。
[1] 韦进钟. 小球藻的营养价值及其开发利用简述[J]. 畜牧兽医科技信息, 2004, (8): 12-13.WEI J Z. Nutritional value of Chlorella and its exploitation and utilization[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2004(8): 12-13.
[2] PANAHI Y, DARVISHI B, JOWZI N, et al. Chlorella vulgaris: a multifunctional dietary supplement with diverse medicinal properties[J]. Current Pharmaceutical Design, 2016, 22(2): 164-173.
[3] 黄燕娟, 王小芬, 陈向凡. 小球藻的营养及药用价值[J]. 现代生物医学进展, 2013, 13(32): 6396-6398.HUANG Y J, WANG X F, CHEN X F. Analysis of the nutritional value and pharmacological action of Chlorella[J]. Progress in Modern Biomedicine, 2013, 13(32): 6396-6398.
[4] 陈颖, 李文彬, 孙勇如. 小球藻生物技术研究应用现状及展望[J]. 生物工程进展, 1998, 18(6): 12-16.CHEN Y, LI W B, SUN Y R. Current status and prospects of Chlorella biotechnology research and application[J]. Progress in Biotechnology, 1998, 18(6): 12-16.
[5] 马石霞, 马咸莹, 丁功涛, 等. 小球藻叶绿素脱除工艺优化及蛋白提取[J]. 西北民族大学学报(自然科学版), 2020, 41(4):74-79.MA S X, MA X Y, DING G T, et al. Optimization of chlorophyll removal process and protein extraction from Chlorella [J].Journal of Northwest Minzu University (Natural Science Edition),2020, 41(4): 74-79.
[6] DAI L, HINRICHS J, WEISS J. Emulsifying properties of acid-hydrolyzed insoluble protein fraction from Chlorella protothecoides: Formation and storage stability of emulsions[J].Food Hydrocolloids, 2020, 108: 105954.
[7] NN A, ASD A, RM B. Modification approaches of plantbased proteins to improve their techno-functionality and use in food products[J]. Food Hydrocolloids, 2021, 118: 106789.
[8] WAGHMARE A G, SALVE M K, LEBLANC J G, et al.Concentration and characterization of microalgae proteins from Chlorella pyrenoidosa[J]. Bioresources and Bioprocessing, 2016,3(1): 1-11.
[9] LEE S Y, SHOW P L, LING T C, et al. Single-step disruption and protein recovery from Chlorella vulgaris using ultrasonication and ionic liquid buffer aqueous solutions as extractive solvents[J].Biochemical Engineering Journal, 2017, 124: 26-35.
[10] WANG Y R, ZHANG B, FAN J L, et al. Effects of sodium tripolyphosphate modification on the structural, functional, and rheological properties of rice glutelin[J]. Food Chemistry, 2019,281: 18-27.
[11] 曹猛. 小球藻(Chlorella sorokiniana C74)多糖及蛋白质等活性物质研究[D]. 海口: 海南大学, 2020.CAO M. Study on the active substance polysaccharides and proteins of Chlorella sorokiniana C74[D]. Haikou: Hainan University, 2020.
[12] CEPEDA E, VILLARAN M C, ARANGUIZ N. Functional properties of faba bean (Vicia faba) protein flour dried by spray drying and freeze drying[J]. Journal of Food Engineering, 1998,36(3): 303-310.
[13] 宋林. 裸藻蛋白的提取及其功能特性改善研究[D]. 西宁: 青海师范大学, 2023.SONG L. Extraction of Euglena protein and improvement of its functional characteristics[D]. Xining: Qinghai Normal University,2023.
[14] 孔潇. 小球藻抗氧化肽的胃肠消化特性及分离纯化研究[D].烟台: 烟台大学, 2023.KONG X. Properties of peptides from Chlorella vulgaris protein hydrolysates during gastrointestinal digestion and purification of antioxidant peptides[D]. Yantai: Yantai University, 2023.
[15] 张慧娟, 靳程茗, 吕世豪, 等. 麦麸酚酸对面团及面筋蛋白理化性质的影响[J]. 中国食品学报, 2023, 23(11): 94-104.ZHANG H J, JIN C M, LV S H, et al. Effects of wheat bran phenolic acids on physicochemical properties of dough and gluten protein[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(11): 94-104.
[16] GÓMEZ A V, FERRER E G, AÑÓN M C, et al. Changes in secondary structure of gluten proteins due to emulsifiers[J].Journal of Molecular Structure, 2013, 1033: 51-58.
[17] VARGAS S A, DELGADO-MACUIL R J, RUIZ-ESPINOSA H,et al. High-intensity ultrasound pretreatment influence on whey protein isolate and its use on complex coacervation with kappa carrageenan: Evaluation of selected functional properties[J].Ultrasonics Sonochemistry, 2021, 70: 105340.
[18] BHARADWAZ M, MANNA P, DAS D, et al. Isolation,purification, and characterization of staphylocoagulase, a blood coagulating protein from Staphylococcus sp. MBBJP S43[J].International Journal of Biological Macromolecules, 2017, 102:1312-1321.
[19] JIN J, MA H, WANG K, et al. Effects of multi-frequency power ultrasound on the enzymolysis and structural characteristics of corn gluten meal[J]. Ultrasonics Sonochemistry, 2015, 24: 55-64.
[20] VALUEVA T A, REVINA T A, MOSOLOV V V, et al. Primary structure of potato kunitz-type serine proteinase inhibitor[J].2000:1215-1221.
[21] SUN X, ZHANG W, ZHANG L, et al. Molecular and emulsifying properties of arachin and conarachin of peanut protein isolate from ultrasound-assisted extraction[J]. LWT, 2020, 132: 109790.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。