
Effect of Ultrasound-assisted pH Shift on Tartary Buckwheat Protein Structure and Functional Properties
苦荞为一年生草本双子叶蓼科荞麦属作物,学名鞑靼荞麦,又名花荞、乌麦等,是一种重要的药食两用植物,富含蛋白质、淀粉、黄酮等生物活性物质,具有较高的营养和药用价值。苦荞蛋白是苦荞重要的营养成分,占种子总量的12%~24%[1]。它含有丰富均衡的氨基酸,具有较高的营养价值,表现出多种生物活性,例如降血压、降血糖、抗氧化等[2]。苦荞蛋白的等电点在 pH 4.0~5.0,当靠近等电点时,其溶解性会逐渐降低;另外,苦荞蛋白中疏水性氨基酸的含量高[3],这也是其溶解性差的另一原因,因此苦荞蛋白在食品中应用有一定局限性。pH 值对苦荞蛋白乳化性有较大的影响,有研究表明[4],当pH 在 4.0~10.0范围内,随pH 的升高,其乳化性逐渐增大。目前研究发现,通过对蛋白质改性处理,可以提高其功能特性。超声处理和pH 值改变是常见的绿色改性方法[5]。超声波处理蛋白质时,会同时产生热效应和机械效应(如空化、辐射和剪切等),这些效应有助于破坏蛋白质的化学键,进而改变其结构和特性[6];在pH 值的偏移过程中,蛋白质被置于远离其等电点的极端pH 环境,这导致蛋白质分子间的静电排斥力增强,进而引起蛋白质部分解构;随后将pH 值恢复至中性,蛋白质将重新折叠,这种展开与再折叠作用显著改善了蛋白的功能特性[7]。Wu 等[8]研究发现pH 呈碱性可以有效提高苦荞分离蛋白的得率,pH>12 时,苦荞分离蛋白的乳化稳定性显著提高。一些研究指出,使用超声波辅助的pH 值偏移技术在改善蛋白质性能方面,比单一处理方法更为有效,Das等[9]研究发现经超声和pH 偏移处理后豆粕分离蛋白功能特性得到了改善,蛋白质结构更加聚集。Zhang 等[10]的研究揭示了超声波处理与pH 偏移技术在提升豌豆分离蛋白的溶解性和乳化性方面存在相互促进的效果。然而超声辅助pH 偏移处理对苦荞蛋白的结构和功能性质的影响及其作用机制尚不清楚。
因此,本研究选用了pH 2 和pH 12 作为处理条件,结合不同超声时间和超声功率,以研究其对苦荞蛋白结构和功能的影响。同时测定了改性后苦荞蛋白的粒径、Zeta 电位、乳化特性、溶解度、表面疏水性、巯基含量、内源荧光光谱等指标及变化情况,为苦荞蛋白的进一步应用奠定基础。
苦荞粉:山西雁门清高食业有限责任公司;大豆油:益海嘉里食品工业有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳试剂盒、BCA(Bicinchoninic acid)蛋白浓度测定试剂盒、磷酸盐缓冲液干粉:北京索莱宝科技有限公司;盐酸、考马斯亮蓝(R-250)、石油醚、氢氧化钠:上海麦克林生化科技有限公司;8-苯胺基-1-萘磺酸铵、5,5′-二硫代(2-硝基苯甲酸):上海源叶生物科技有限公司;乙二胺四乙酸:成都市科隆化学品有限公司;甘氨酸、三羟甲基氨基甲烷、十二烷基硫酸钠:德国Biofroxx 公司;以上试剂纯度级别均为分析纯及以上。
PH-100A 型pH 计:上海力辰仪器科技有限公司;A25 高剪切分散乳化均质机:上海欧河机械设备有限公司; UV-2802 型紫外可见分光光度计:上海尤尼柯仪器有限公司;H4-20KR 台式高速冷冻离心机:湖南可成仪器设备有限公司;PowerPacTM Basic 小型垂直电泳仪:美国Bio-Rad 公司;RF-6000 荧光分光光度计:美国安捷伦科技有限公司;ZSU3200 纳米粒度仪:英国马尔文仪器有限公司;SpectraMaxP 多功能酶标仪:美国美谷分子公司。
1.3.1 苦荞蛋白的提取
根据茹倩雯[11]描述的碱溶酸沉法提取苦荞蛋白。经GB5009.5—2016(分光光度法)测定其含量为80.32%,过100 目筛,装袋4 ℃保存。
1.3.2 超声辅助pH 偏移苦荞蛋白的制备
用超纯水配制30 mg/mL 苦荞蛋白溶液,搅拌30 min 使其完全溶解。
在室温下,分别使用 0.5 mol/L HCl 和0.5 mol/L NaOH 将苦荞蛋白溶液的pH 值分别调节至2 和12,并搅拌30 min。然后用超声波细胞破碎仪对苦荞蛋白溶液进行处理。处理温度设为20 ℃,工作时间和间歇时间均设置为2 s,频率为20 kHz,功率为(100、200、300、400、500 W),时间为(10、15、20、25、30 min)。根据上述参数,将pH 偏移和超声处理相结合,对苦荞蛋白溶液进行处理。超声结束后,苦荞蛋白溶液继续搅拌30 min,加入0.5 mol/L HCl 或0.5 mol/L NaOH 将样品调至pH 7。分别将以上样品冷冻干燥。以不加任何处理苦荞蛋白为空白对照。
1.3.3 粒径和zeta 电位的测定
用去离子水将1.3.2 中配置的蛋白溶液稀释100 倍,使用马尔文纳米粒度仪在25 ℃下测定样品的平均粒径分布和Zeta 电位。
1.3.4 乳化活性及乳化稳定性的测定
参照王帅等[5]的方法测定乳化活性及乳化稳定性。
1.3.5 溶解度的测定
参照Ina 等[12]的方法并适当修改。将样品溶于蒸馏水,使其浓度为10 mg/mL。搅拌1 h 后以10 000 r/min 的速度离心15 min,取上清液,使用BCA 试剂盒测定上清液中的蛋白质数量。蛋白质溶解度按公式(1)计算。

式中:NS——上清液中蛋白质数量;N 总——样品中蛋白质数量。
1.3.6 表面疏水性的测定
参照Han 等[13]的方法测定表面疏水性。
1.3.7 总巯基、游离巯基和二硫键的测定
参考Wang 等[14]的方法测定总巯基、游离巯基和二硫键。
1.3.8 内源荧光光谱
参考Choi 等[15]的方法测定内源荧光光谱。
实验数据使用Origin 2023 软件作图,数据间的显著性差异采用SPSS Statistics 25.0 软件分析,所有实验均重复3 次,数据间显著性水平设置为P<0.05。
平均粒径的大小是影响蛋白质功能特性的一个重要因素。研究结果表明,当蛋白质的平均粒径减小时,其溶解度、乳化性等性能会得到提升[16]。如图1(B)、图1(D)所示,超声辅助pH 值碱性偏移处理后苦荞蛋白的粒径与空白对照组粒径显著减小(P<0.05)。如图1(A)、图1(B)所示,当超声时间为20 min 时,平均粒径减小。但pH=12 时,苦荞蛋白粒径减小程度最大,这可能是因为极端碱性条件下蛋白质被诱导成熔融的球状结构,同时超声处理减少了部分蛋白质去折叠导致侧链之间的相互作用(疏水相互作用,二硫键和氢键)[10]。如图1(C)、图1(D)所示,当超声功率在100~500 W 的范围内时,经pH 偏移处理后发现苦荞蛋白在300 W 时的粒径最小。当超声功率为300 W 时,pH 碱偏移处理的样品粒径减小,这是因为在极端pH 条件下(pH12),苦荞蛋白远离其等电点,产生了强烈的静电斥力。这一结果与Li 等[17]报道的通过超声波处理结合碱性pH偏移技术减小菜籽蛋白粒径的研究结果相吻合。
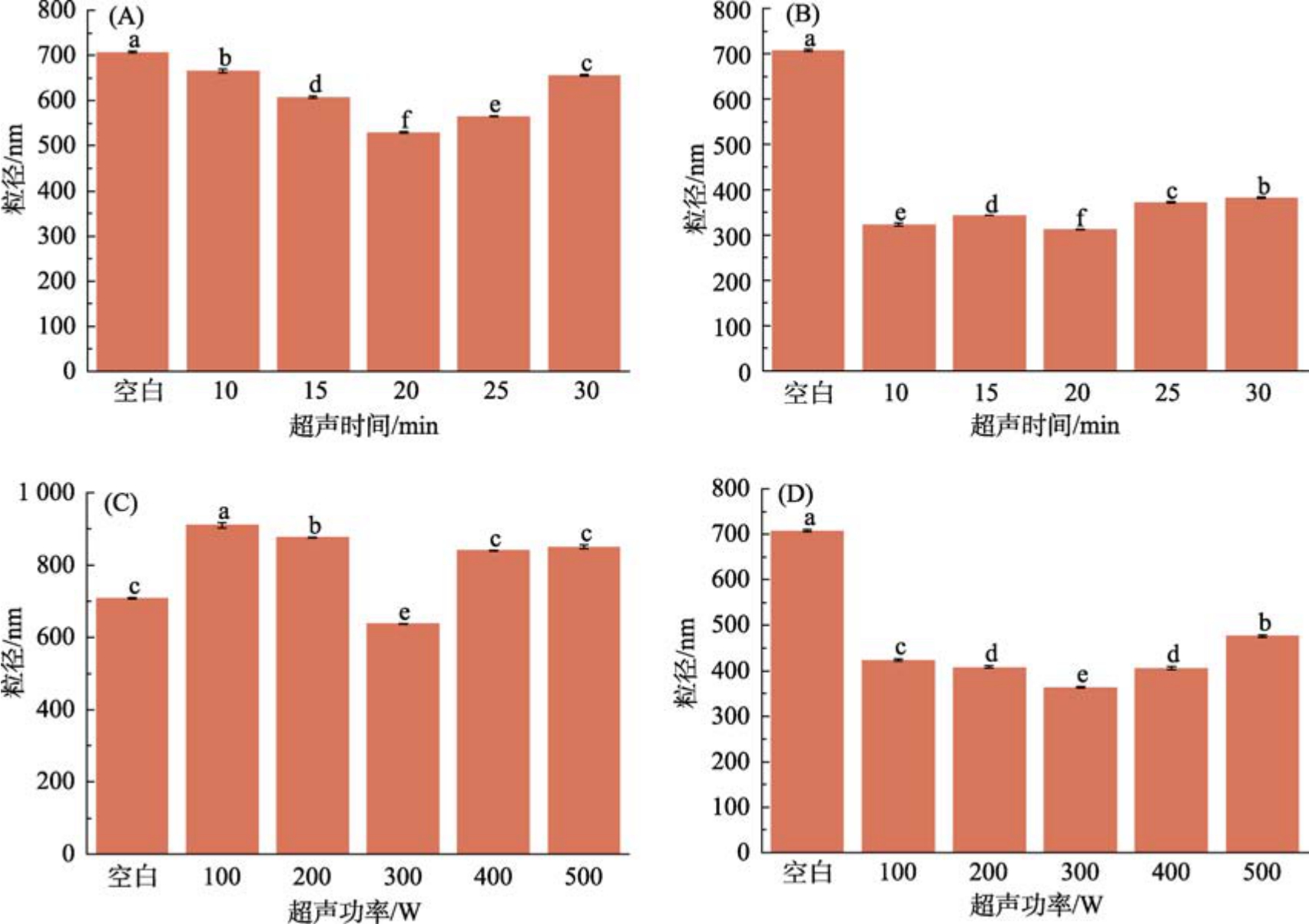
图1 超声时间和超声功率对苦荞蛋白粒径的影响
Fig.1 Effectsof ultrasonic time and ultrasonic power on the particle size of tartary buckwheat protein
注:A 为pH 2,功率300 W;B 为pH 12,功率300 W;C 为pH 2,时间20 min;D 为pH 12,时间20 min。图中不同的小写字母代表样品之间存在显著性差异(P<0.05),a 代表最大值,下同。
Note: A, pH 2, power 300 W; B, pH 12, power 300 W; C, pH 2, time 20 min; D, pH 12, time 20 min. Different lowercase letters in the figure indicate significant differences among samples (P<0.05), with “a” indicating the maximun value, and the same as below.
Zeta 电位是衡量溶液中粒子表面电荷特性的一个指标。当Zeta 电位的绝对值较大时,表明粒子之间存在较强的静电排斥力,这有助于防止粒子聚集,从而使得溶液体系被认为是处于一种“相对稳定”的状态[18]。如图2 所示,经过不同超声辅助pH 偏移处理后,苦荞蛋白的Zeta 电位绝对值相较于空白对照组显著增加(P<0.05)。因此,随着表面极性基团的电离,分子表面聚集了更多的电荷,从而使其具有更高的净负电荷[10]。

图2 超声时间和超声功率对苦荞蛋白电位的影响
Fig.2 Effects of ultrasonic time and ultrasonic power on the zeta potential of tartary buckwheat protein
注:A 为pH 2,功率300 W;B 为pH 12,功率300 W;C 为pH 2,时间20 min;D 为pH 12,时间20 min。
Note: A, pH 2, power 300 W; B, pH 12, power 300 W; C, pH 2, time 20 min; D, pH 12, time 20 min.
乳化活性(Emulsifying activity,EAI)是描述蛋白质在油水界面形成能力的指标,而乳化稳定性(Emulsion stability,ESI)则表示蛋白质在形成乳滴时的抗张力能力[19]。如图3 所示,超声辅助pH 偏移处理提高了苦荞蛋白的EAI,在超声时间为20 min、超声功率为300 W 时观察到最高的增加。这种改善可能是由于在超声处理期间苦荞蛋白质结构折叠后,疏水性氨基酸侧链基团增加,从而增强了其表面活性和柔韧性,改善了其稳定油水界面的能力[20]。这一发现与Jiang 等[21]报道的结果一致,表明pH 偏移处理后蛋白质的结构膨胀,变得更加灵活,从而增加了其乳化特性。随着超声时间和超声功率的增加,苦荞蛋白在极端碱性和酸性条件下的ESI 降低。这可能是由于pH 导致的过度加工引起了蛋白的大量聚集[22]。这与之前报道的经pH 偏移的分离乳清蛋白比未处理的具有更低的EAI 是一致的[23]。

图3 超声时间和超声功率对苦荞蛋白乳化活性和乳化稳定性的影响
Fig.3 Effects of ultrasonic time and ultrasonic power on emulsifying activity and stability of tartary buckwheat protein
注:A 为pH 2,功率300 W;B 为pH 12,功率300 W;C 为pH 2,时间20 min;D 为pH 12,时间20 min。
Note: A, pH 2, power 300 W; B, pH 12, power 300 W; C, pH 2, time 20 min; D, pH 12, time 20 min.
溶解度可以用来表征溶液中颗粒尺寸的变化和聚集体的形成,其与蛋白质的界面功能有一定的关系[24]。由图4 可知,所有蛋白样品在超声辅助pH 偏移处理后溶解性均得以改善。特别是超声辅助pH 值碱性偏移处理组的样品,蛋白质的溶解度显著增加(P<0.05),这可能是因为在碱性条件下,蛋白质的疏水性相互作用遭到破坏,进而促进了其溶解性[25];超声辅助下,在酸性偏移处理组中,苦荞蛋白溶解度有所提高但差异不显著,可能的原因是蛋白质在酸性条件下发生了结构性折叠,导致蛋白质颗粒在等电点附近相互碰撞并形成较大的沉淀颗粒,当pH 值调回中性时,由于电荷作用减弱,这些沉淀的蛋白质不易溶解,因此苦荞蛋白的溶解度变化不明显[9]。
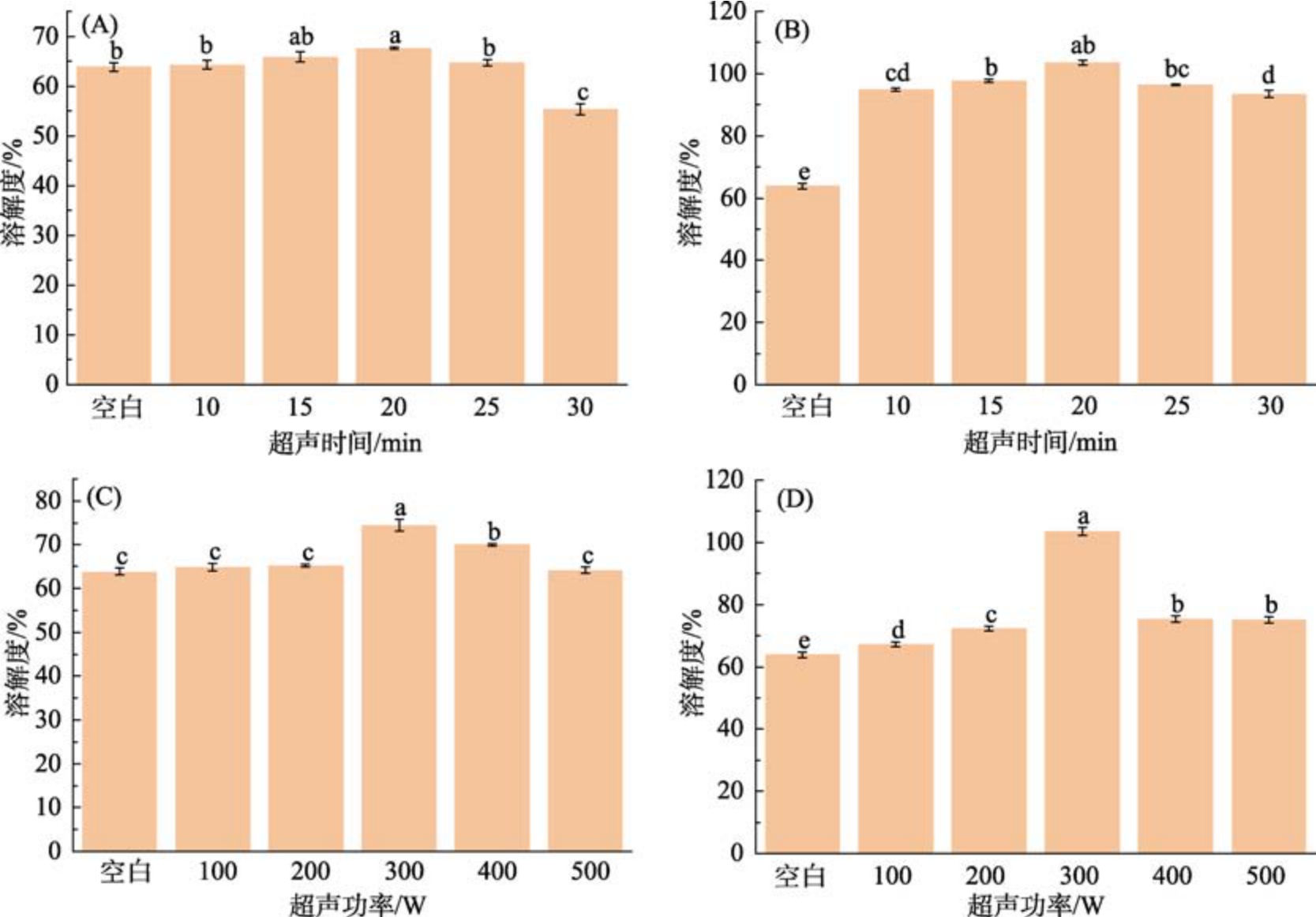
图4 超声时间和超声功率对苦荞蛋白溶解度的影响
Fig.4 Effects of ultrasonic time and ultrasonic power on solubility of tartary buckwheat protein
注:A 为pH 2,功率300 W;B 为pH 12,功率300 W;C 为pH 2,时间20 min;D 为pH 12,时间20 min。
Note: A, pH 2, power 300 W; B, pH 12, power 300 W; C, pH 2, time 20 min; D, pH 12, time 20 min.
表面疏水性反映了蛋白质的构象变化,为蛋白质功能特性变化的原因分析提供了依据[26]。总体而言,当超声时间为20 min,超声功率为300 W时改性后所有样品的表面疏水性均显著提高(P<0.05),说明该技术对苦荞蛋白的三级结构产生了一定的影响。
如图5(A)、5(B)所示,随着超声功率的增加,苦荞蛋白的表面疏水性在300 W 时达到最高,这可能是由于超声产生的空化和剪切应力导致蛋白质去折叠,暴露了更多的蛋白质疏水基团,从而增加了其表面疏水性。当超声时间为20 min 时,碱性pH 偏移处理组的表面疏水性较酸性pH 偏移处理组显著增加(P<0.05),这与唐永欣等[27]的研究结果一致。类似地,Yan 等[28]报道了随着超声时间和功率的增加,蛋白质通过疏水结合等作用发生部分变性和重新聚合,导致蛋白质表面疏水性降低。
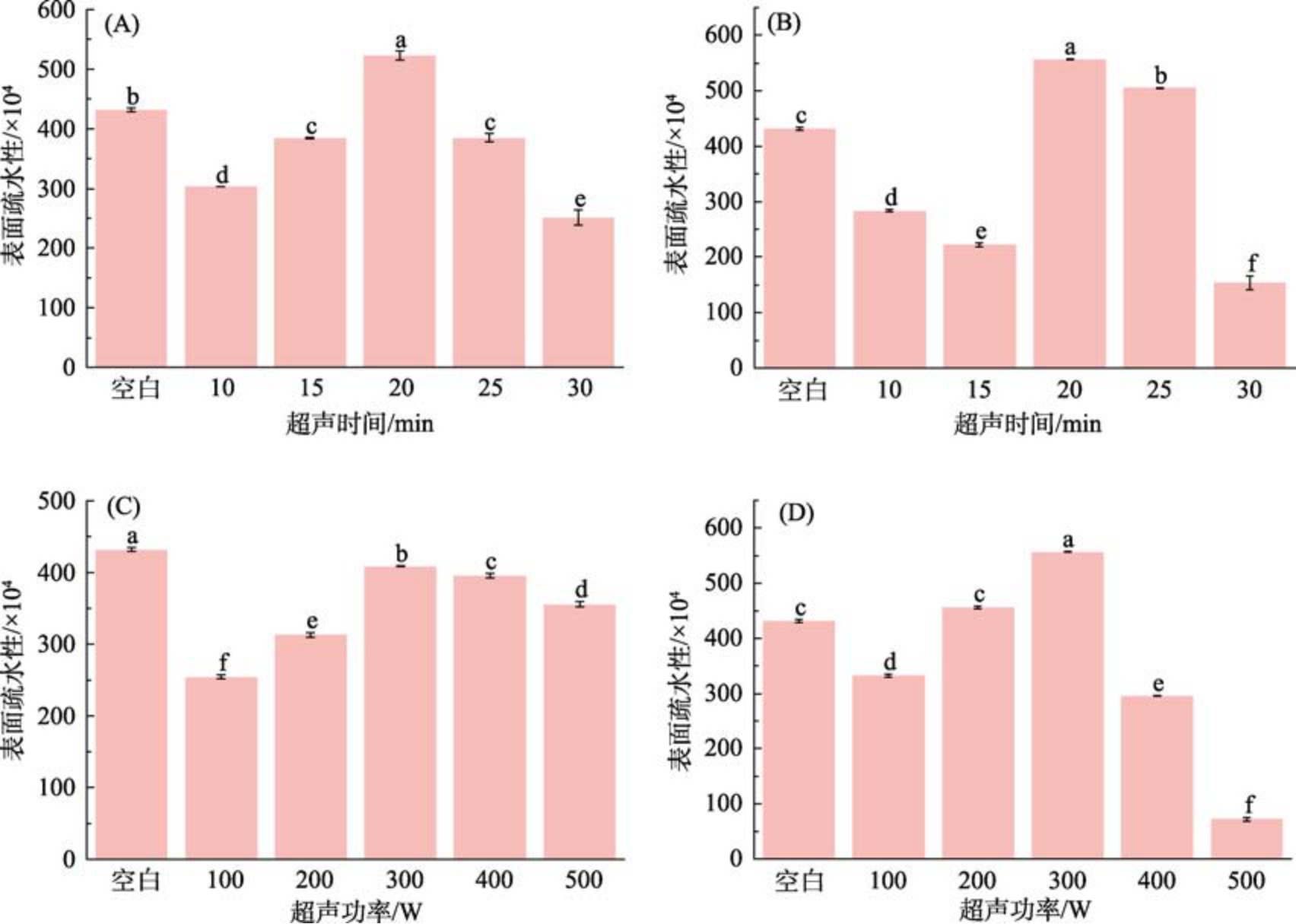
图5 超声时间和超声功率对苦荞蛋白表面疏水性的影响
Fig.5 Effects of ultrasonic time and ultrasonic power on surface hydrophobicity of tartary buckwheat protein
注: A 为pH 2,功率300 W;B 为pH 12,功率300 W;C 为pH 2,时间20 min;D 为pH 12,时间20 min。
Note: A, pH 2, power 300 W; B, pH 12, power 300 W; C, pH 2, time 20 min; D, pH 12, time 20 min.
游离巯基(Free sulfhydryl,FSH)是蛋白质中重要的功能基团,可以用来指示蛋白质中二硫键的形成或断裂,二硫键有助于蛋白质结构的形成[29]。根据表1~2 数据显示,经过超声辅助和pH值偏移处理后,苦荞蛋白的游离巯基含量显著增加(P<0.05)。这表明,蛋白质在去折叠过程中可能暴露了内部的巯基,或者是天然蛋白质中的二硫键断裂导致了新的巯基形成。FSH 含量的增加可能是由于超声处理暴露了蛋白质分子内部的巯基,并且由于空化的物理和化学作用,破坏了二硫键。
表1 超声时间对苦荞蛋白总巯基、游离巯基和二硫键的影响
Table 1 Effects of ultrasonic time on total thiols, free thiols, and disulfide bonds in buckwheat proteins.
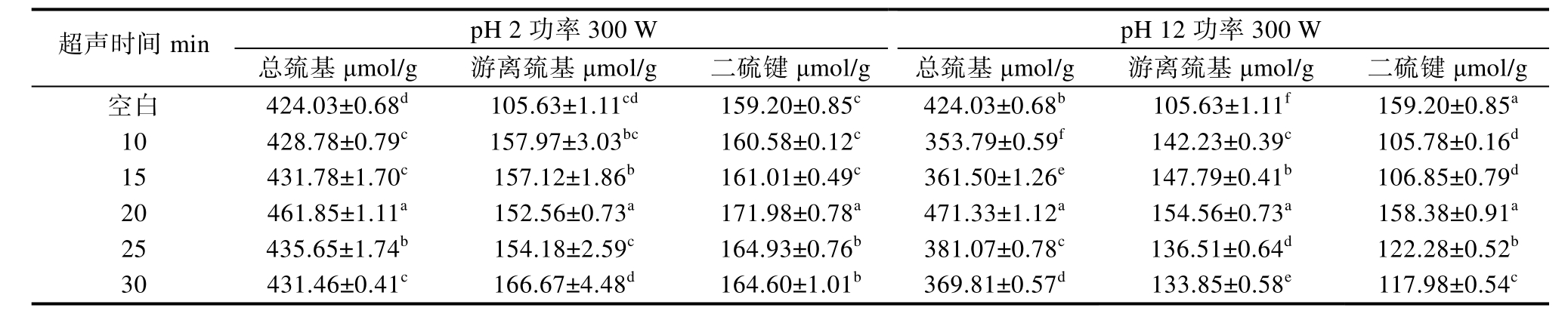
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),a 代表最大值,下同。
Note: Values in the table are mean ± standard deviation, different letters in the same column represent significant differences (P<0.05),with “a” representing the maximum value, the same as below.
pH 2 功率300 W pH 12 功率300 W 超声时间min 总巯基μmol/g 游离巯基μmol/g 二硫键μmol/g 总巯基μmol/g 游离巯基μmol/g 二硫键μmol/g空白 424.03±0.68d 105.63±1.11cd 159.20±0.85c 424.03±0.68b 105.63±1.11f 159.20±0.85a 10 428.78±0.79c 157.97±3.03bc 160.58±0.12c 353.79±0.59f 142.23±0.39c 105.78±0.16d 15 431.78±1.70c 157.12±1.86b 161.01±0.49c 361.50±1.26e 147.79±0.41b 106.85±0.79d 20 461.85±1.11a 152.56±0.73a 171.98±0.78a 471.33±1.12a 154.56±0.73a 158.38±0.91a 25 435.65±1.74b 154.18±2.59c 164.93±0.76b 381.07±0.78c 136.51±0.64d 122.28±0.52b 30 431.46±0.41c 166.67±4.48d 164.60±1.01b 369.81±0.57d 133.85±0.58e 117.98±0.54c
二硫键是稳定蛋白质结构的重要作用力之一。如表1、表2 所示,超声辅助pH 碱偏移处理降低了苦荞蛋白的二硫键含量,说明苦荞蛋白的二硫键发生了不同程度的断裂,导致新的游离巯基的形成。当超声功率为300 W,pH=2 时,苦荞蛋白的二硫键含量显著增加(P<0.05),说明在超声处理过程中,暴露出的游离巯基可能被进一步氧化形成了二硫键。
表2 超声功率对苦荞蛋白总巯基、游离巯基和二硫键的影响
Table 2 Effects of ultrasonic power on total thiols, free thiols, and disulfide bonds in buckwheat proteins.

pH 2 时间20 min pH 12 时间20 min 超声功率W 总巯基μmol/g 游离巯基μmol/g 二硫键μmol/g 总巯基μmol/g 游离巯基μmol/g 二硫键μmol/g空白 424.03±0.68b 105.63±1.11bc 159.20±0.85b 424.03±0.68c 105.63±1.11e 159.20±0.85a 100 371.29±0.24e 108.84±0.51ab 131.22±0.16e 384.33±1.65d 155.97±0.76c 114.18±1.07d 200 369.71±1.45e 108.76±2.49ab 130.47±0.74e 477.70±2.24a 154.90±0.42c 161.40±1.27a 300 461.85±1.11a 110.68±2.58a 175.58±1.83a 456.52±1.00b 164.45±0.30a 146.03±0.59b 400 383.80±0.68d 105.86±0.45bc 138.96±0.30d 435.67±5.01c 150.84±0.12d 142.42±5.00b 500 396.47±3.22c 103.45±0.62c 146.50±1.88c 424.03±3.53c 160.67±0.76b 131.68±3.34c
荧光光谱图可以通过观察色氨酸和酪氨酸的荧光特性来判断蛋白质构象的变化。如图6(A)、图6(B)和图6(D)所示,经超声辅助pH 偏移过的苦荞蛋白的荧光强度都低于空白对照组,可能是由于超声引起的空化作用加速了蛋白质分子的大聚集体形成。这种聚集体形成可能促使游离巯基被氧化形成二硫键所替代,导致色氨酸和酪氨酸的暴露量减少,从而减弱了荧光强度。而图6(C)经超声辅助pH 酸偏移过的苦荞蛋白荧光强度高于空白对照组的荧光强度,表明超声功率结合酸处理所产生的能量可以强化蛋白质的熔融状态,使蛋白质分子发生了展开,构像更为松散,进而暴露出更多的发色团[12]。与图6(C)相比,图6(D)超声辅助pH 碱偏移过的苦荞蛋白荧光强度则低于空白对照组的荧光强度,造成不同结果的原因是在极酸条件下,苦荞蛋白发生聚集,使暴露的发色团猝灭,从而荧光强度降低[18]。

图6 超声时间和超声功率对苦荞蛋白内源荧光光谱的影响
Fig.6 Effects of ultrasonic time and ultrasonic power on endogenous fluorescence spectra of tartary buckwheat protein
注: A 为pH 2,功率300 W;B 为pH 12,功率300 W;C 为pH 2,时间20 min;D 为pH 12,时间20 min。
Note: A, pH 2, power 300 W; B, pH 12, power 300 W; C, pH 2, time 20 min; D, pH 12, time 20 min.
本研究考察了超声辅助pH 偏移处理对苦荞蛋白结构和功能特性的影响。结果显示,处理后的苦荞蛋白游离巯基含量显著增加,荧光强度有不同程度的降低,这说明超声辅助pH 偏移处理使苦荞蛋白的三级结构发生了明显的变化。同时pH 的酸性、碱性偏移对苦荞蛋白的影响明显不同,碱性pH 偏移处理能显著提高苦荞蛋白的溶解度、乳化活性和乳化稳定性。当进行酸性pH值偏移处理时,乳液的粒径会变大,同时乳液的电位绝对值会降低。相反,碱性pH 值偏移处理则会导致乳液粒径减小,电位绝对值升高。当超声时间为20 min,超声功率为300 W 时,苦荞蛋白表面疏水性显著增加,且碱偏移处理下表面疏水性要高于酸偏移处理。
综上所述,超声辅助pH 偏移处理是一种优良的蛋白质改性方法,具有良好的应用前景。本研究对改善苦荞蛋白功能特性、挖掘其在食品工业的应用范围具有积极意义。
[1] 王立博, 陈静, 任艳娟, 等. 荞麦麸皮蛋白的制备及功能特性研究[J]. 中国调味品, 2023, 48(12): 16-24.WANG L B, CHEN J, REN Y J, et al. Preparation and functional properties of buckwheat bran protein[J]. Chinese Seasoning,2023, 48 (12): 16-24.
[2] TAO T, PAN D, ZHENG Y Y, et al. Optimization of hydrolyzed crude extract from Tartary buckwheat protein and analysis of its hypoglycemic activity in vitro[J]. IOP Conference Series: Earth and Environmental Science, 2019, 295(3): 032065.
[3] 杨婷. 苦荞蛋白-黄原胶复合物的构建及其在Pickering乳液中的应用研究[D]. 成都: 成都大学, 2024.YANG T. Construction of tartary buckwheat protein xanthan gum complex and its application in Pickering lotion[D].Chengdu: Chengdu University, 2024.
[4] RAIKOS V, NEACSU M, RUSSELL W, et al. Comparative study of the functional properties of lupin, green pea, fava bean,hemp, and buckwheat flours as affected by pH[J]. Food Science& Nutrition, 2015, 2(6): 802-810.
[5] 王帅, 钟明明, 王震霄, 等. 超声辅助pH 偏移处理对大豆亲脂蛋白结构-功能性相关性分析[J/OL]. 食品科学, 2023.WANG S, ZHONG M M, WANG Z X, et al. Ultrasound assisted pH shift treatment for structural functional correlation analysis of soybean lipophilic proteins[J/OL]. Food Science, 2023.
[6] 陈云洁, 徐艳阳, 周千了, 等. 超声辅助均质制备负载人参皂苷功能型Pickering 乳液的工艺优化[J]. 食品安全质量检测学报, 2023, 14(23): 196-205.CHEN Y J, XU Y Y, ZHOU Q L, et al. Optimization of ultrasonic assisted homogenization process for preparing functional Pickering lotion loaded with ginsenosides[J]. Journal of Food Safety and Quality Testing, 2023, 14 (23): 196-205.
[7] WANG Y, LIU X, LUO S, et al. The impact of pH shifting combined high-pressure homogenization on structural and functional properties of rice dreg protein[J]. Innovative Food Science & Emerging Technologies, 2024, 91: 103520.
[8] WU L L, LI J H, WU W J, et al. Effect of extraction pH on functional properties, structural properties, and in vitro gastrointestinal digestion of tartary buckwheat protein isolates[J].Journal of Cereal Science, 2021, 101: 103314.
[9] DAS D, PANESAR P S, SAINI C S. pH shifting treatment of ultrasonically extracted soybean meal protein isolate: Effect on functional, structural, morphological and thermal properties[J].Process Biochemistry, 2022, 120: 227-238.
[10] FIGUEROA-GONZALEZ J J, LOBATO-CALLEROS C, VERNONCARTERr E J, et al. Modifying the structure, physicochemical properties, and foaming ability of amaranth protein by dual pH-shifting and ultrasound treatments[J]. LWT, 2022, 153:112561.
[11] 茹倩雯. 苦荞麸皮蛋白的制备、修饰及其在纳米乳液中的应用[D]. 重庆: 重庆大学, 2022.RU Q W. Preparation and modification of tartary buckwheat bran protein and its application in nano lotion[D]. Chongqing:Chongqing University, 2022.
[12] INA S, HAMADA A, KANEKO T, et al. Physicochemical and surface properties of rice albumin for its application as a functional food material[J]. Food Science and Technology Research, 2019, 25(4): 555-562.
[13] HAN T, WANG M, WANG Y, et al. Effects of high-pressure homogenization and ultrasonic treatment on the structure and characteristics of casein[J]. LWT, 2020, 130: 109560.
[14] WANG S, XU X, WANG S, et al. Effects of microwave treatment on structure, functional properties and antioxidant activities of germinated tartary buckwheat protein[J]. Foods,2022, 11, 1373.
[15] CHOI S M, CHOI S M, MA C Y, et al. Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy[J].Food Chemistry, 2007, 102(1): 150-160.
[16] WANG Y, WANG S, LI R, et al. Effects of combined treatment with ultrasound and pH shifting on foaming properties of chickpea protein isolate[J]. Food Hydrocolloids, 2022, 124:107351.
[17] ALAVI F, CHEN L, EMAM-DJOMEH Z. Effect of ultrasoundassisted alkaline treatment on functional property modifications of faba bean protein[J]. Food Chemistry, 2021, 354: 129494.
[18] LI Y, CHENG Y, ZHANG Z, et al. Modification of rapeseed protein by ultrasound-assisted pH shift treatment: Ultrasonic mode and frequency screening, changes in protein solubility and structural characteristics[J]. Ultrasonics Sonochemistry, 2020,69: 105240.
[19] PAN X, FANG Y, WANG L, et al. Covalent interaction between rice protein hydrolysates and chlorogenic acid: Improving the stability of oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2019, 67(14): 4023-4030.
[20] ZHU Y, FU S, WU C, et al. The investigation of protein flexibility of various soybean cultivars in relation to physicochemical and conformational properties[J]. Food Hydrocolloids, 2020,103: 105709.
[21] JIANG J, CEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J]. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7576-7583.
[22] PEZESHK S, REZAEI M, HOSSEINI H, et al. Impact of pH-shift processing combined with ultrasonication on structural and functional properties of proteins isolated from rainbow trout by-products[J]. Food Hydrocolloids, 2021, 118: 106768.
[23] JIANG Z, GAO Y, LI J, et al. Consecutive pH-shift and ultrasound treatment modify the physicochemical properties of whey protein isolate[J]. International Dairy Journal, 2022, 127:105211.
[24] YAN S, XU J, ZHANG X, et al. Effect of pH-shifting treatment on the structural and functional properties of soybean protein isolate and its interactions with (–)-epigallocatechin-3-gallate[J].Process Biochemistry, 2021, 101: 190-198.
[25] 陆今明, 彭松林, 杨凯麟, 等. 超声波辅助pH 偏移处理对猪肝蛋白结构及乳化特性的影响[J]. 食品研究与开发, 2023,44(5): 89-96.LU J M, PENG S L, YANG K L, et al. The effect of ultrasound assisted pH shift treatment on the structure and emulsifying properties of pig liver protein[J]. Food Research and Development,2023, 44 (5): 89-96.
[26] BU F, NAYAK G, BRUGGEMAN P, et al. Impact of plasma reactive species on the structure and functionality of pea protein isolate[J]. Food Chemistry, 2022, 371: 131135.
[27] 唐永欣, 彭松林, 郭晨晨, 等. 温和热辅助pH 值碱性偏移处理对猪肝蛋白结构和功能特性的影响[J]. 食品科学, 2023,44(24): 88-96.TANG Y X, PENG S L, GUO C C, et al. The effect of mild heat assisted pH alkaline shift treatment on the structure and functional properties of pig liver protein[J]. Food Science, 2023,44 (24): 88-96.
[28] YAN S, XU J, ZANG S, et al. Effects of flexibility and surface hydrophobicity on emulsifying properties: Ultrasound-treated soybean protein isolate[J]. LWT- Food Science and Technology,2021, 142: 110881.
[29] WANG P, JIN Z Y, XU Y M, et al. Physicochemical alterations of wheat gluten proteins upon dough formation and frozen storage review from gluten, glutenin and gliadin perspectives[J].Trends in Food Science & Technology, 2015, 46(2): 189-198.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。