
图1 胆汁酸合成与循环
Fig. 1 Overview of bile acid synthesis and circulation
Research Advances in the Role of Cereal Dietary Fiber in Modulating Glucose and lipid Metabolism via the Gut Microbiota-Bile Acid
随着膳食结构的改变,长期高糖高脂饮食会诱发肥胖、糖尿病、心脑血管疾病等慢性代谢疾病,是影响人类健康的重要因素。多项研究显示,谷物膳食纤维摄入可以降低糖尿病患者的空腹血糖水平和高脂血症人群的血浆总胆固醇、甘油三酯和低密度脂蛋白胆固醇水平。目前,关于谷物膳食纤维对糖脂代谢的调节研究主要集中在其理化性质、肠道菌群和代谢产物短链脂肪酸调控等方面。研究发现,膳食纤维的摄入可通过调节胆汁酸的代谢平衡调控糖脂代谢稳态,这一过程与肠道菌群密切相关。然而,谷物膳食纤维如何通过肠道菌群-胆汁酸途径调控糖脂代谢平衡尚未被完全阐明。因此本文就谷物膳食纤维调节肠道微生物及其胆汁酸调控糖脂代谢的进展进行综述,以期为深入了解谷物膳食纤维如何改善糖脂代谢、维护人体健康提供新的参考见解。
根据国际食品法典委员会的定义,膳食纤维(Dietary fiber,DF)是一类在小肠中无法被消化吸收的碳水化合物聚合物,其聚合度≥3。天然DF 种类繁多,谷物中的DF 主要来源于麸皮或米糠,包括阿拉伯木聚糖、β-葡聚糖、抗性淀粉、半纤维素、木质素等。在主要谷物中,小麦DF含量约为12%,糙米中约为3.4%,大麦中约为17%,玉米中约为7%,而燕麦和黑麦的DF 含量在10%~20%。适量摄入DF 具有改善血糖和血脂异常、提高免疫力、调节肠道健康、预防肥胖和慢性疾病等生理功能。
肠道菌群失调与人类多种疾病的发生、发展密切相关。DF 可直接为肠道菌群提供能量和营养素,增加宿主体内肠道菌群多样性和有益菌丰度,提高肠道免疫代谢并调控糖脂代谢平衡。Gan 等[1]发现,小鼠在摄入大麦DF 后,肠道内有益菌如阿克曼氏菌科(Akkermansiaceae)、毛螺菌科(Lachnospiraceae)和Muribaculaceae 数量增加,同时改善了宿主脂质积累和肥胖,并缓解了葡萄糖耐受量和胰岛素抵抗。此外,DF 经肠道微生物发酵产生的短链脂肪酸(Short chain fatty acid,SCFAs)可降低肠道内pH 值,促进益生菌增殖并阻止致病菌生长,增强肠道环境的免疫性和稳定性。Li 等[2]发现,小麦麸皮中DF 能显著增加肠道菌群的多样性,提高有益菌的丰富度,促进SCFAs 的合成,这可能通过影响胃肠激素和胰岛素对血糖的调节,缓解糖尿病小鼠的代谢水平。因此,谷物DF 的摄入与肠道屏障、代谢调控和免疫功能密切相关,有助于改善糖脂代谢紊乱,在预防糖尿病、肥胖和高血脂等慢性代谢疾病中发挥重要作用。
3.1.1 胆汁酸分类
胆汁酸(Bile acid,BA)是胆汁的重要成分,按结构可分为游离和结合两种类型。游离型BA 包括胆酸(Cholic acid,CA)、脱氧胆酸(Deoxycholic acid,DCA)、鹅脱氧胆酸(Chenodeoxycholic acid,CDCA)和石胆酸(Lithocholic acid,LCA)。结合型BA 是由游离BA 与甘氨酸或牛磺酸共轭产物,主要包括甘氨胆酸、甘氨鹅脱氧胆酸、牛磺胆酸和牛磺鹅脱氧胆酸等。BA 按其来源可分为初级BA和次级BA 两种类型。在肝细胞以胆固醇为原料直接合成的BA 称为初级BA,包括CA、CDCA及其与甘氨酸或牛磺酸的结合产物。初级BA 在肠道中受细菌作用生成次级BA,主要包括DCA 和LCA 及其与甘氨酸或牛磺酸结合生成的结合产物。
3.1.2 胆汁酸合成与肠肝循环
初级BA 在肝细胞中通过细胞色素P450 酶在胆固醇中合成,其中包括至少17 种不同的酶参与。BA 的合成分为两种,即经典途径(产生12α-羟基化初级BA)和替代途径(产生非12α-羟基化初级BA)。在经典途径中,胆固醇由7α-羟化酶(Cholesterol 7a-hydroxylase,CYP7A1)启动,经 过 甾 醇 12α- 羟 化 酶( Sterol 12 alphahydroxylase,CYP8B1)和甾醇27α-羟化酶(Sterol 27-hydroxylase,CYP27A1)的催化,形成CA 和CDCA;在替代途径中,胆固醇由CYP27A1 启动,后 经 过 氧 甾 醇 12α- 羟 化 酶( Oxysterol 7 alpha-hydroxylase,CYP7B1)催化,最终生成CDCA。在啮齿类动物中,大多数CDCA 转化为鼠胆酸(Muricholic acids,MCAs)和熊去氧胆酸(Ursodeoxycholic acid,UDCA),而在人体中,UDCA 是一种次级胆汁酸,并且通常检测不到MCAs。在这两种途径中,CYP7A1 是限速酶,决定BA 池的大小,CYP7B1 是参与BA 替代合成途径的关键酶,决定非 12α-羟基化 BA 水平,CYP8B1 是CA 合成关键酶,控制CA/CDCA 的比。BA 在肝细胞合成后与牛磺酸和甘氨酸结合形成结合型BA 并分泌到胆汁中,餐后随胆汁分泌进入肠道。在肠道中,结合型BA 被含有胆盐水解酶(Bile salt hydrolase,BSH)的肠道细菌经去结合以及7α-羟化酶和7α-羟类固醇脱氢酶的进一步修饰后转化成次级BA。大约95%的BA 以结合形式在回肠末端进行重吸收,进入门静脉循环,最终将BA 转运到肝细胞,这个过程称为胆汁酸肠肝循环,如图1 所示。成人每天进行6~8 次肠肝循环,约3 g 的BA 参与肠肝循环,每天只需要0.2~0.6 g 新合成的BA 来维持BA 池的稳定。而其余未被重吸收的BA 在肠道微生物作用下转化为次级BA,通过被动吸收或随粪便排出体外。

图1 胆汁酸合成与循环
Fig. 1 Overview of bile acid synthesis and circulation
3.1.3 肠道菌群与胆汁酸代谢
大约5%的BA 进入结肠,在微生物作用下产生次级BA,主要包括去结合、7-脱羟基、氧化、差向异构化、脱硫、酯化等(表1 和图1)。BA的去结合是由具有BSH 活性的细菌进行,可促使结合型BA 水解牛磺酸和甘氨酸的C-24N-酰基键,转变为游离BA。在参与形成BSH 的菌群中,革兰氏阳性菌主要包括梭菌(Clostridium)、肠球菌(Enterococcus)、双歧杆菌(Bifidobacterium)和乳杆菌属(Lactobacillus)等,而革兰氏阴性菌主要在拟杆菌属(Bacteroides)中[3]。在Clostridium和真杆菌(Eubacterium)作用下,游离BA 在诱导胆汁酸(bai)操纵子基因作用下发生7 α/β-脱羟基化反应,促使初级胆汁酸CA/CDCA 转变为次级胆汁酸DCA/LCA。细菌立体异构特异性羟基类固醇脱氢酶(Hydroxysteroid dehydrogenases,HSDHs)对胆汁酸的3-、7-和12-羟基进行可逆氧化,并根据α/β-HSDH 结构性质发生差向异构化,降低BA 毒性,增强亲水性[4]。多种细菌,如消化链球菌(Peptostreptococcus)、 埃希氏菌( Escherichia )、 Bacteroides 、 Clostridium 、Eubacterium、Bifidobacterium 和Lactobacillus 已被证实具有 HSDH 活性。BAs 的酯化发生在Bacteroides、Eubacterium 和Lactobacillus 中,并通过Clostridium、胃球菌(Gastrococcus)和假单胞菌(Pseudomonas)进行脱硫。然而,这一反应的机理和酶都尚不清楚。此外发现,毛螺菌科(Trichospiridae)、普氏菌科(Prevotellaceae)、阿克曼菌属( Akkermansia)、 脱硫弧菌属(Desulfovibrio)和Alloprevotella 属,可能参与调节生成次级胆汁酸,原理尚不清楚。
表1 肠道菌群对胆汁酸调节[5]
Table 1 Regulating effects of Gut microbiota on bile acid metabolism

酶/基因 BA 转化 参与的微生物BSH 结合型BA→游离型BA Bacteroides、Bifidobacterium、Lactobacillaceae、Clostridium、Enterococcus bai 基因 CDCA→LCA CA→DCA Clostridium scindens、Clostridum hylemonae、Clostridium hiranonis Clostridium leptum 3α-HSDH DCA→3-oxo DCA Eggerthella lenta、Ruminococcus gnavus、Clostridium perfringens 3β-HSDH 3-oxo DCA→ iso DCA Eggerthella lenta、Ruminococcus gnavus、Peptostreptococcus productus 7α-HSDH CDCA→7-oxoLCA Eggerthella lenta、Clostridium scindens、Escherichia coli 7β-HSDH 7-oxoLCA→urso-DCA Ruminococcus gnavus 12α-HSDH DCA→12-oxoLCA Clostridium scindens、Clostridium hylemonae、Clostridium hiranonis、Clostridium leptum、Eggerthella lenta 12β-HSDH 12-oxoLCA→epiDCA Clostridium paraputrificum
3.2.1 非受体介导作用
BA 在消化和吸收脂类物质起到重要作用。BA 含有亲水性和亲油性基团,可乳化脂肪并增加脂肪酶接触表面积,促进脂质和脂类维生素消化吸收。在肠道内,BA 还可通过调节胰脂肪酶和脂蛋白酯酶活性改善脂质代谢紊乱,并通过激素敏感脂肪酶减少脂质分解作用。此外,BA 可作为胰脂肪酶的辅基水解脂类物质,其分解产物与胆汁形成复合物,并通过BA 经过上皮细胞进入血液,BA 被肠上皮细胞识别后,脂肪酸/胆汁酸复合物进入小肠绒毛膜内,促进脂肪吸收[5]。
3.2.2 受体介导作用
BA 可作为信号分子,作用于细胞核或细胞膜上的受体,参与BA、胆固醇、甘油三酯及葡萄糖等在内的多条代谢通路。常见的受体包括:尼醇X 受体(Farnesoid X receptor,FXR)、G 蛋白偶联BAs 受体(Takeda G protein -coupled receptor 5,TGR5)、孕烷X 受体和肝X 受体等。其中FXR 和TGR5 是调节葡萄糖和脂质代谢的两个关键受体。
3.2.2.1 FXR 调控胆汁酸合成 FXR 是核受体超家族的成员之一,BA 是其内源性配体,CDCA是其最有效激活剂,依次为TCA、DCA 和CA,而UDCA、α/β-MCA 对其产生拮抗作用。BA 能与FXR 相互结合,作用于FXR 的空间结构,以此激活/抑制靶基因转录。FXR 可负反馈调节BA合成酶表达,调控BA 谱。在肝脏中,BA 刺激FXR,诱导小异二聚体伴侣(Small heterodimer partner, SHP)的表达上调,SHP 并与肝受体同源蛋白-1 和肝细胞核因子 4α 结合,从而抑制CYP7A1 和CYP8B1 转录基因的表达,抑制BA合成。CYP7A1 是BA 合成中关键的限速酶,研究发现,过表达CYP7A1 的小鼠会减轻高脂饮食诱导的肥胖、脂肪肝以及胰岛素抵抗,形成一种保护作用。在CYP7A1 过表达小鼠中12α-羟基化BA 水平降低,CYP8B1 表达显著抑制[6]。CYP8B1的消耗或下调导致12α-羟基化BA 减少,对宿主代谢状态产生有益的影响。在回肠中,FXR 可被特定BA 激活,诱导成纤维细胞生长因子15/19(Fibroblast growth factor 15/19,FGF15/19)表达,进而促进肝脏中FGF 受体4(FGF receptor 4,FGFR4)与β-klotho(KLβ)异二聚体复合物结合,通过磷酸化作用抑制CYP7A1 和CYP7B1 的表达,负反馈调节BA 自身合成[7]。CYP7B1 是另一个参与BA 合成途径的关键酶,CYP7B1-/-小鼠显著下调棕色脂肪组织中解偶联蛋白-1(Uncoupling protein-1,UCP-1)的表达水平,导致脂代谢异常。由此可见,调控BA 合成途径,从经典途径到替代途径的转换可能是改善糖脂代谢异常的一种有效方法。
3.2.2.2 FXR 在糖脂代谢中的调控作用 肝脏FXR-SHP 信号通路在调控糖脂代谢稳态方面具有重要作用。BA 经FXR-SHP 通路以SHP 依赖性方式抑制糖异生过程中关键酶的表达,从而抑制糖异生,减少肝脏葡萄糖生成。此外,SHP 抑制转录因子固醇调节因子结合蛋白-1C(Sterol regulatory element-binding protein-1c,SREBP-1C)及其下游肝脏脂质合成基因表达,减少肝脏脂质合成。肝脏FXR 激活还可增加过氧化物酶体增殖体激活受体、丙酮酸脱氢酶激酶-4 和羧酸酯酶1 的表达,增加脂肪酸氧化和肝脏甘油三酯代谢分解[8]。此外,FXR 的激活可通过调控肝脏脂肪代谢保护骨骼肌免于出现脂毒性的症状,并通过调控胰高血糖素样肽-1(Glucagon-like peptide-1, GLP-1)和胰岛素的分泌,调节糖脂代谢稳态。
肠道FXR-FGF15/19 信号通路在调控糖脂代谢稳态中同样发挥重要作用,BA 经FXR-FGF15/19 通路介导肝脏FGFR4/KLβ 增加糖原合成、促进葡萄糖摄取和降低糖异生水平。同时FGF15/19可上调棕色脂肪组织UCP-1 表达,使棕色脂肪组织含量升高,并抑制SREBP-1C 等脂肪生成因子表达[9]。肠道 FXR-FGF15/19 信号通路激活可加速肝脏SHP 磷酸化,破坏肝脏脂质生成的基因空间结构,抑制脂质合成基因转录表达以减缓肝脏脂肪变性。
多项研究证实FXR 受体激活或抑制对糖脂代谢均有正向调节作用,这可能与实验环境相关,例如,在饲喂普通饲料的FXR 基因敲除小鼠中观察到肝脏脂质、甘油三酯和胆固醇的积累,而在高脂饮食诱导的糖脂代谢紊乱小鼠中,FXR 的敲除可维持小鼠体内糖稳态并减少体重增加程度,这可能是由肠道微生物结构的不同导致BA 代谢受阻所致,具体原因尚不清楚,该调节还可能与机体病理有关[10]。此外,FXR 对代谢的调控作用也可能因组织不同而存在差异,如肝脏FXR 转录激活可抑制糖异生和脂质合成;相反肠道FXR 转录抑制或敲除时,对糖异生和脂质合成产生抑制作用。另有研究表明特异性激动或拮抗肠道FXR均可通过不同的代谢通路调控糖代谢。例如,在肠道中,抑制FXR 可促进GLP-1 和胰岛素分泌,改善胰岛素抵抗[11]。然而活化肠道FXR,可激活肠道 TGR5,通过环磷腺苷(Cyclic adenosine monophosphate,cAMP)信号通路刺激肠L 细胞分泌和释放GLP-1,改善糖代谢紊乱[12]。抑制或激活肠道FXR 所引起的相同结果很可能是在特定的环境因素下2 条不同代谢通路竞争的结果。由此可见,激活/抑制FXR 均可调节机体糖脂代谢稳态,而其背后的调节机制仍值得进一步深入研究。
3.2.2.3 TGR5在糖脂代谢中的调控作用 TGR5 是研究最为深入的膜结合G 蛋白偶联受体,BA 是目前已知的TGR5 唯一内源性配体。不同BA 激活 TGR5 效果依次为:LCA>DCA>CDCA>CA[13]。BA 通过激活TGR5 信号转导,增加线粒体氧化磷酸化和ATP/ADP 比值,打开钾离子通道,促使钙离子内流,最终刺激肠道内L 细胞释放GLP-1,平衡糖代谢[14]。在骨骼肌和棕色脂肪组织中,TGR5-cAMP 激活可诱导DIO2 蛋白分泌,促进非活性甲状腺素转化成活性甲状腺激素来增加能量消耗[13]。
微生物-胆汁酸途径对糖脂代谢的作用受到饮食的调控。在高脂饮食条件下,肠道菌群不仅直接影响宿主的生理代谢,还可以通过改变BA谱调控糖脂代谢。Iwamoto 等[15]发现,高脂高糖饮食通过抑制肠道BA 去结合和7α-去羟基化细菌丰度,增加CA/CDCA 比例,上调BA 合成酶CYP8B1表达水平,引起小鼠脂代谢紊乱和免疫失调,这可能是肝脏FXR 路径对BA 代谢的反馈调节。DF的摄入可通过调节肠道菌群和BA 代谢缓解不利饮食带来的负面影响,改善糖脂代谢紊乱。以下将从不同种类谷物DF 进行论述,阐释其通过肠道菌群-胆汁酸途径对糖脂的代谢的调控机制。
水稻是我国的第一大粮食作物,米糠中DF含量在20%~51%,其中90%为不可溶性DF。Xinwen 等研究发现,10%糙米DF 可通过增加胆汁酸代谢菌如肠球菌科(Enterobacteriaceae)、unclassified_f__Enterobacteriaceae 丰度,缓解2型糖尿病小鼠胰岛素抵抗,改善糖代谢紊乱[16]。课题组前期发现,在高脂饮食小鼠中添加5%糙米DF,可显著降低BSH 产生菌如Lactobacillus、Enterococcus 和链球菌(Streptococcus)并增加Clostridium 的相对丰度,进而增加结合型BA 和非12α-羟基化BA 水平,降低小鼠体重、体脂率,血液中甘油三酯水平以及肝脏脂滴积累和脂质变性,从而改善小鼠脂代谢紊乱(数据未发表)。由此,糙米DF 可通过调节BSH 细菌丰度改变BA谱组成,改善糖脂代谢紊乱。
小麦是最为重要的谷物之一,小麦麸皮中含有丰富的DF、主要由阿拉伯木聚糖、半纤维素、木质素等组成,在调控代谢中发挥重要。Hong 等[17]发现,在高脂饮食中添加8%小麦阿拉伯聚糖可增加小鼠肠道中Ruminiclostridium_5、Bifidobacterium和Eubacterium 等菌属丰度,并激活肝脏FXR 促进脂肪酸氧化,同时,肝脏FXR 活化抑制了胆汁酸合成酶(CYP7A1 和CYP27A1)的表达,减少了循环中BA 水平并改善了小鼠脂代谢紊乱表型。Gunness 等[18]在猪模型中同样发现,小麦阿拉伯木聚糖可增加肠道BA 排泄,降低循环中的BA水平,从而减缓甘油三酯和游离脂肪酸的吸收和消化,降低血液中甘油三酯水平,调控脂代谢平衡。付南燕等[19]发现,在高胆固醇饮食小鼠中加入5 g/kg 小麦DF,饲养8 周后发现,小鼠血清和肝脏中胆固醇和甘油三酯水平降低,粪便胆固醇含量增加,肝脏CYP7A1 表达水平降低,同时次级BA 产生菌Clostridium Ⅺ和Clostridium Ⅺ αⅪ相对丰度提高。上述表明,小麦DF 可通过富集BA 代谢菌丰度,减少循环中BA 水平,并通过肝脏FXR 信号通路调控BA 合成酶表达,缓解高脂高胆固醇饮食引起的脂代谢紊乱。
燕麦麸皮总DF 中至少1/3 为水溶性DF,并具有丰富的β-葡聚糖。Zuzanna 等[20]发现,在高脂饮食中加入5%燕麦DF,降低了BA 去结合作用,增加了 TβMCA 含量,并通过抑制肠道FXR-FGF15 途径促进CYP7A1 表达,降低了血液中胆固醇和甘油三酯水平,BA 谱的这种变化可能与特异性解偶联的独特细菌组成有关,具体的细菌组成还需要进一步通过深度测序来揭示这些依赖性。然而,Connolly 对高胆固醇血症或葡萄糖不耐症人群进行6 周的45 g/d 的燕麦DF 干预后发现,燕麦DF 增加受试者粪便中BSH 阳性菌种(Bifidobacterium、Bacteroidetes、Lactobacillus)种类,降低了血液中甘油三酯和低密度脂蛋白胆固醇水平,BSH 活性菌干预可以降低血清低密度脂蛋白胆固醇水平,这是因为游离BA 更有可能在粪便中被消除,从而推动BA 从头合成的需求,并相应减少全身胆固醇水平[21]。以上两种对肠道菌群相反的调控结果可能是燕麦DF 结构差异和不同添加量引起的。
Fang 等[22]利用16s rDNA 微生物测序和非靶向代谢组学研究发现,5%燕麦β-葡聚糖可通过降低高脂饮食小鼠肠道中Clostridium 丰度和12α-羟基化BA 水平,缓解肝脏胆固醇积累和糖代谢紊乱。Gunness 研究发现,燕麦β-葡聚糖可使血液中总BA 降低24%,总胆固醇降低34%,低密度脂蛋白胆固醇降低57%,回肠末端BA 降低20%,盲肠总中性固醇升高80%,BA 在回肠中的主动转运减少50%,粪便中BA 排泄并没有变化,表明燕麦β-葡聚糖通过改变BA 谱的分布,阻碍了BA 的主动重吸收和胆固醇的摄取,降低了循环中BA 和胆固醇水平,而这并不是通过增加BA粪便排出引起的[23]。这说明燕麦β-葡聚糖可通过调节Clostridium 丰度和改变BA 谱分布调节机体脂代谢稳态。
小米糠是小米生产加工过程中的主要副产物,其中含量较多的是DF。朱玉等[24]研究发现,在高胆固醇饲粮小鼠中添加小米糠DF 5 周后,小鼠血清中胆固醇水平显著降低,肝脏 FXR 的mRNA 表达下调,而CYP7A1 的mRNA 水平上调,表明小米糠DF 可通过抑制肝脏FXR 信号通路促进BA 合成,增加胆固醇向BA 转化,调控机体胆固醇代谢平衡。黑麦麸皮含有较高的DF,其含量在15%~20%,既往研究表明,摄入高纤黑麦食品可调节机体代谢水平。Zuzanna 等[20]发现5%黑麦DF 可降低小鼠血液脂质水平,这是由于黑麦DF 增加了粪便中结合型BA 排泄,降低肠道BA重吸收,导致肠道中FXR 受体活性下降,肝脏中CYP7A1 表达增加,促使肝脏中胆固醇向BA 转化,调控脂代谢稳态。抗性淀粉是一种特殊类型的DF,最新研究发现,玉米抗性淀粉通过增加宿主青春双歧杆菌属(Bifdobacterium adolescentis)丰度,促使肠道中次级BA 含量增加,进而降低了肥胖人群的体重并改善胰岛素抵抗[25]。大麦富含可溶性DF,如β-葡聚糖和阿拉伯木聚糖,这些成分有助于预防体内血糖水平升高和脂质积累。Kento 等[26]发现,在高脂饮食小鼠中加入大麦β-葡聚糖喂养12 周后,降低了小鼠血清中胆固醇和甘油三酯含量,促进了BA 肠肝循环并降低其浓度,增加次级胆汁酸水平;在肝脏中,FXR 的表达激活抑制BA 和脂质合成相关基因的表达水平,同时在肠道中,次级BA 的增加激活了TGR5,导致肝脏中脂质合成的基因表达下调,从而改善小鼠脂质代谢紊乱。
以上研究发现,谷物DF 可通过肠道菌群和胆汁酸代谢途径调控宿主糖脂代谢平衡,调控机制如图2 所示。然而不同谷物DF 在不同模型中的调控机制是不同的,这可能由于谷物DF 结构组成、理化性质和添加量的差异对肠道菌群和胆汁酸代谢产生不同的调控作用;同时谷物DF 与胆汁酸受体TGR5 结合参与宿主生理代谢的机制仍是缺乏,还需要更多的研究去阐明。
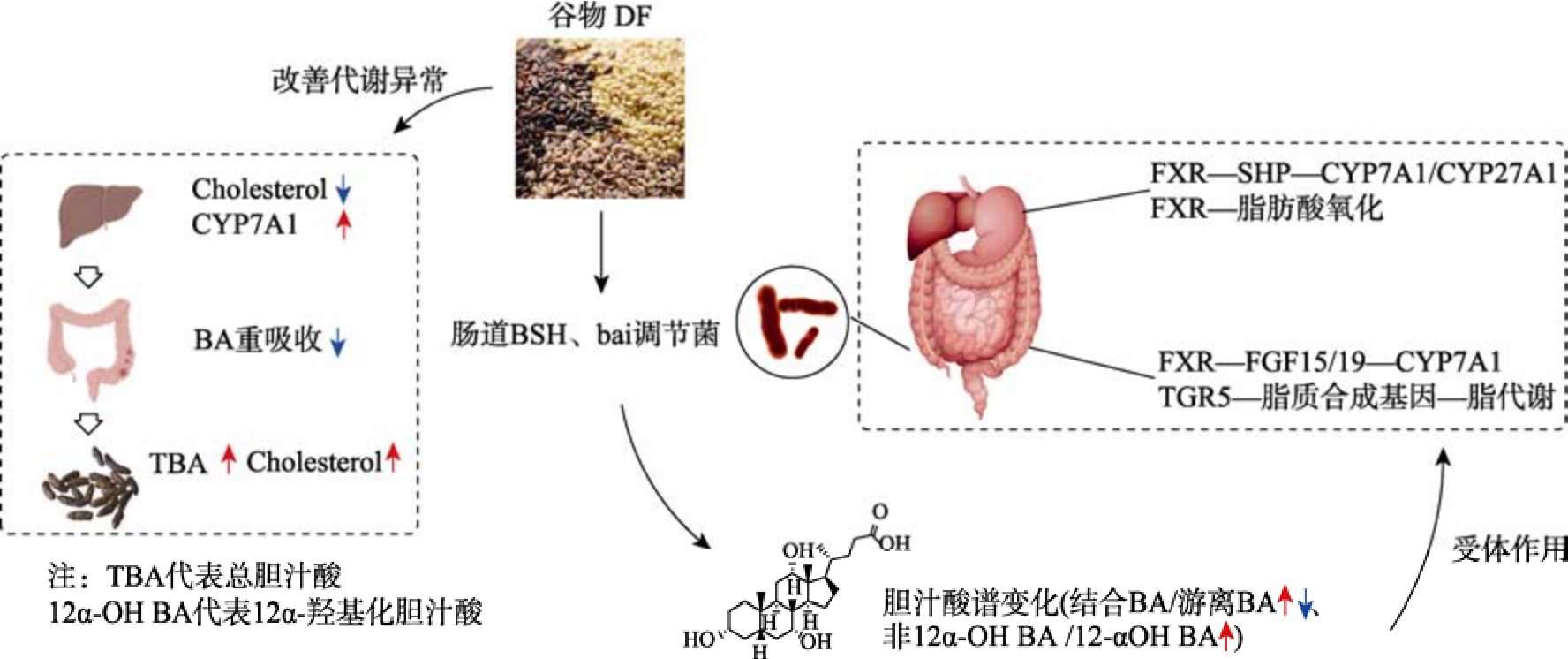
图2 谷物膳食纤维调控通过肠道菌群-胆汁酸途径调控糖脂代谢机制
Fig. 2 Mechanism by which grain dietary fiber regulates glucose and lipid metabolism via the gut microbiota - bile acid pathway
谷物DF 可通过肠道菌群-胆汁酸途径,对糖脂代谢起到正向调节作用。一方面谷物DF 与BA结合,增加粪便中BA 排泄,减少BA 重吸收和循环中BA 水平,促进胆固醇向BA 转化,改善机体代谢紊乱;另一方面,在肠道菌群作用下,DF 可促使/降低BA 解偶联和脱羟基反应,改变BA 谱,变化的BA 作为信号分子与相应受体FXR和TGR5 结合,调控机体糖脂代谢稳态(图2)。然而,不同类别的谷物DF 对肠道菌群和BA 的调节作用不尽相同,因此对糖脂代谢的调控机制也存在差异,具体为:
富含β-葡聚糖的燕麦DF 和大麦DF,通过调控BSH 生成菌丰度,增加结合型BA 或次级BA水平,并激活肝脏FXR 和抑制肠道FXR-FGF15信号通路,促进BA 合成酶表达并抑制脂质合成相关基因的表达,进而调控脂代谢;而糙米DF和小麦DF 则通过调控BA 代谢菌和BA 代谢谱,减少血液中BA 水平,促进BA 外排,激活肝脏FXR 转录表达,通过降低BA 经典合成途径、改善胰岛素抵抗并促进脂肪酸氧化缓解糖脂代谢紊乱;与之相反,小米糠DF 通过降低肝脏FXR-SHP通路,促进BA 胆汁酸合成酶表达,增加胆固醇转化和BA 外排,降低机体脂质水平。综上可明确不同谷物DF 如何通过肠道菌群-胆汁酸途径调控糖脂代谢,以期为不同谷物DF 改善肥胖、高血脂、糖尿病等慢性代谢疾病提供理论支持。
就目前的研究进展而言,以下问题仍需要进一步研究:(1)谷物DF 可通过激活/抑制肝肠FXR信号通路调控糖脂代谢平衡,然而谷物DF 调控具体微生物菌株、BA 种类和FXR 相互作用关系的直接证据对机体代谢的影响机制仍是缺乏,需要更多的实验探究其具体调控机理;(2)谷物DF与TGR5 结合调控代谢的机制仍是缺乏,还需要更多的研究去阐明;(3)谷物DF 通过肠道菌群-胆汁酸途径对机体糖代谢的研究不足;(4)靶向FXR 或TGR5 来预防或治疗代谢性疾病是目前研究热点,在未来研究中,如何利用特定谷物DF干预,通过FXR/TGR5 信号途径实现疾病防治将会是研究的重要领域之一,这也为谷物副产物高值化利用提供理论依据。
[1] GAN L, HAN J, LI C, et al. Tibetan highland barley fiber improves obesity and regulates gut microbiota in high-fat diet-fed mice[J]. Food Bioscience, 2023, 53: 102620.
[2] LI X X, ZHANG X X, ZHANG R, et al. Gut modulation based anti-diabetic effects of carboxymethylated wheat bran dietary fiber in high-fat diet/streptozotocin-induced diabetic mice and their potential mechanisms[J]. Food and Chemical Toxicology,2021, 152: 112235.
[3] CAI J, SUN L L, GONZALEZ F J. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis[J]. Cell Host & Microbe, 2022, 30(3): 289-300.
[4] DODEN H L, RIDLON J M. Microbial hydroxysteroid dehydrogenases: from alpha to omega[J]. Microorganisms,2021, 9(3).
[5] 徐运杰, 汪前红. 胆汁酸的作用与分子调控机制[J]. 饲料工业, 2015, 36(S2): 20-24.XU Y J, WANG Q H. The role and molecular regulatory mechanism of bile acids[J] Feed Industry, 2015, 36(S2): 20-24
[6] SAYIN S I, WAHLSTR M A, FELIN J, et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist [J]. Cell Metabolism, 2013, 17(2): 225-235.
[7] JIA W, XIE G, JIA W. Bile acid–microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nature Reviews Gastroenterology & Hepatology, 2018, 15(2): 111-128.
[8] MENCARELLI A, CIPRIANI S, RENGA B, et al. FXR activation improves myocardial fatty acid metabolism in a rodent model of obesity-driven cardiotoxicity[J]. Nutrition,Metabolism and Cardiovascular Diseases, 2013, 23(2): 94-101.
[9] JAHN D, RAU M, HERMANNS H M, et al. Mechanisms of enterohepatic fibroblast growth factor 15/19 signaling in health and disease[J]. Cytokine & Growth Factor Reviews, 2015,26(6): 625-635.
[10] PRAWITT J, ABDELKARIM M, STROEVE J H, et al.Farnesoid X receptor deficiency improves glucose homeostasis in mouse models of obesity[J]. Diabetes, 2011, 60(7): 1861-1871.
[11] TRABELSI M-S, DAOUDI M, PRAWITT J, et al. Farnesoid X receptor inhibits glucagon-like peptide-1 production by enteroendocrine L cells[J]. Nature Communications, 2015, 6(1):7629.
[12] PATHAK P, XIE C, NICHOLS R G, et al. Intestine farnesoid X receptor agonist and the gut microbiota activate G-protein bile acid receptor-1 signaling to improve metabolism[J].Hepatology, 2018, 68(4): 1574-1588.
[13] WAHLSTRÖM A, SAYIN S I, MARSCHALL H-U, et al.Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism[J]. Cell Metabolism, 2016, 24(1):41-50.
[14] THOMAS C, GIOIELLO A, NORIEGA L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J].Cell Metabolism, 2009, 10(3): 167-177.
[15] IWAMOTO J, HONDA A, MIYAZAKI T, et al. Western diet changes gut microbiota and ameliorates liver injury in a mouse model with human-like bile acid composition[J]. Hepatology Communications, 2021, 5(12): 2052-2067.
[16] ZHANG X, DONG L, JIA X, et al. Bound phenolics ensure the antihyperglycemic effect of rice bran dietary fiber in db/db mice via activating the insulin signaling pathway in skeletal muscle and altering gut microbiota[J]. Journal of Agricultural and Food Chemistry, 2020, 68(15): 4387-4398.
[17] CHEN H, CHENG J, ZHOU S, et al. Arabinoxylan combined with different glucans improve lipid metabolism disorder by regulating bile acid and gut microbiota in mice fed with high-fat diet[J]. International Journal of Biological Macromolecules, 2021, 168: 279-288.
[18] GUNNESS P, WILLIAMS B A, GERRITS W J, et al.Circulating triglycerides and bile acids are reduced by a soluble wheat arabinoxylan via modulation of bile concentration and lipid digestion rates in a pig model[J]. Molecular Nutrition &Food Research, 2016, 60(3): 642-651.
[19] 付南燕, 吴正平, 周林华, 等. 谷物膳食纤维对高胆固醇饮食小鼠脂质代谢及肠道菌群的影响[J]. 动物营养学报, 2021,33(2): 1137-1144.FU N Y, WU Z P, ZHOU L H, et al. The effects of dietary fiber from grains on lipid metabolism and gut microbiota in high cholesterol diet mice[J] Journal of Animal Nutrition, 2021, 33(2): 1137-1144
[20] KUNDI Z M, LEE J C Y, PIHLAJAMÄKI J, et al. Dietary fiber from oat and rye brans ameliorate Western diet–induced body weight gain and hepatic inflammation by the modulation of short-chain fatty acids, bile acids, and tryptophan metabolism[J]. Molecular Nutrition & Food Research, 2021,65(1): 1900580.
[21] CONNOLLY M L, TZOUNIS X, TUOHY K M, et al.Hypocholesterolemic and prebiotic effects of a whole-grain oat-based granola breakfast cereal in a cardio-metabolic “at risk” population[J]. Frontiers in Microbiology, 2016, 7: 1675.
[22] FANG W, PENG W, QI W, et al. Ferulic acid combined with different dietary fibers improve glucose metabolism and intestinal barrier function by regulating gut microbiota in high-fat diet-fed mice[J]. Journal of Functional Foods, 2024,112: 105919.
[23] GUNNESS P, MICHIELS J, VANHAECKE L, et al. Reduction in circulating bile acid and restricted diffusion across the intestinal epithelium are associated with a decrease in blood cholesterol in the presence of oat β-glucan[J]. The FASEB Journal, 2016, 30(12): 4227-4238.
[24] 朱玉. 小米糠膳食纤维降胆固醇活性的研究[D]. 南京: 南京农业大学, 2015.ZHU Y. A study on the cholesterol lowering activity of dietary fiber from millet bran[D]. Nanjing: Nanjing Agricultural University,2015.
[25] LI H, ZHANG L, LI J, et al. Resistant starch intake facilitates weight loss in humans by reshaping the gut microbiota[J].Nature Metabolism, 2024: 1-20.
[26] MIO K, IIDA TANAKA N, TOGO-OHNO M, et al. Barley consumption under a high-fat diet suppresses lipogenic genes through altered intestinal bile acid composition[J]. The Journal of Nutritional Biochemistry, 2024, 125: 109547.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。