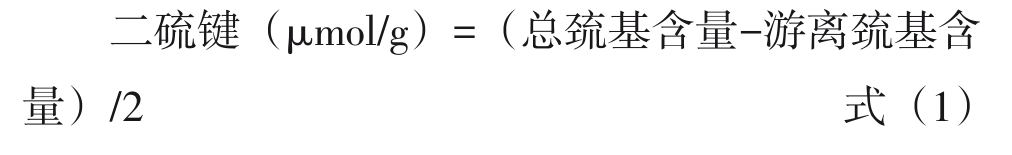
Study for the Effect on Structure and Properties of Highland Barley Proteins During Stirfrying
青稞(Hordeum vulgare Linn Var.Nudum Hook.f.)是我国四省藏区主要栽培的粮食作物之一,其富含多种营养成分,具有高蛋白、高纤维、高维生素、低脂肪和低糖等特点。蛋白质是青稞中仅次于淀粉的第二大成分[1],具有机体调节功能。侯殿志等[2]研究我国29种青稞的营养及功能组分发现,其中蛋白质的平均含量为10.55%,供试青稞中均含有17 种氨基酸,包括人体必需的8 种氨基酸。目前,青稞主要用于青稞酒、青稞饼干、糌粑、青稞面条等[3]产品研究。
炒制是一种传统的热处理方式,会使食品获得独特的香味、风味。张垚等[4]研究炒制时间及炒制方式对青稞的影响发现,青稞在炒制过程中,风味化合物的前体物质较原籽粒都发生明显的变化。炒制也是蛋白质改性的常用技术,王婧[5]研究热处理对燕麦蛋白质理化与功能特性影响发现,热处理后蛋白质亚基被分解,β-折叠结构含量下降,α-螺旋结构含量增加,蛋白质有序性降低,从而影响蛋白质稳定性。雷洋[6]发现,在炒制过程中,游离巯基会转换为二硫键,促进二硫键的形成,进而稳定了蛋白质结构。青稞经高温炒制,籽粒膨化爆花后发生形变,会导致蛋白质结构及性质发生变化。青稞蛋白质作为优质植物蛋白质资源,相对研究较少,进一步限制青稞精深加工和利用。近年来炒制以及热处理对探究蛋白质功能主要涉及荞麦、燕麦、苦荞等谷物,尚未有文献报道对炒制后青稞中蛋白质结构及性质的研究。
本研究以青稞为研究对象,提取炒制前后青稞中的蛋白质,通过十二烷基硫酸钠-聚丙烯酰胺凝胶(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳、傅里叶红外光谱、紫外光谱、内源荧光光谱、X-射线衍射、化学键、微观结构及流变学特性等测定方法,探讨炒制前后青稞中蛋白质结构及性质的变化及影响,以期为青稞精深加工以及青稞蛋白质在食品加工中的应用提供理论依据,拓展青稞蛋白质的应用及经济价值。
白青稞 冬青18号:西藏农牧学院植物科学学院;黑青稞 苟芒紫:西藏自治区农牧科学院;石油醚,色谱级;氢氧化钠、盐酸,分析纯:国药集团化学试剂有限公司;5×变性蛋白上样缓冲液、Tris-HCl缓冲液、考马斯亮蓝染液套装:北京索莱宝科技有限公司;Tris-Glycine 蛋白预制胶、Tris-Glycine 甘氨酸蛋白缓冲液、Western Blotting 预染蛋白Marker:百达康生物科技有限公司;总巯基检测试剂盒、游离巯基检测试剂盒5,5'-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis (2-nitrobenzoic acid),DTNB)法:艾迪生生物科技有限公司。
J-03 型炒制机:合肥亿久机电科技有限公司;FA2104S 电子天平:广州玉治仪器有限公司;GL21M离心机:湖南湘仪实验仪器开发有限公司;HH-4 数显恒温水浴锅:上海力辰邦西仪器科技有限公司;BJ-800A多功能粉碎机:浙江志高机械股份有限公司;LGJ-25JY 冷冻干燥机:北京八方中大科技发展有限公司;Nicolet iS 50衰减全反射-傅里叶变换红外光谱仪:赛默飞世尔(上海)仪器有限公司;MX-S 可调式混匀仪:大龙兴创实验仪器股份公司;T6 新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;PHS-3E pH计:上海仪电科学仪器股份有限公司;LS 45 荧光分光光度计:铂金埃尔默股份有限公司;D8 ADVANCE X射线衍射仪:德国布鲁克公司;MCR 92 型Anton paar 流变仪:奥地利安东帕有限公司;SU8010 扫描电子显微镜:HITACHI 日立公司;BAI-DAK 电泳仪:百达康生物科技有限公司。
1.3.1 青稞炒制
1.3.1.1 工艺流程 青稞→除杂→润麦(5 min)→沥干→炒制(260 ℃,15 s)→磨粉
1.3.1.2 操作要点 青稞除杂、浸泡润麦:选择颗粒饱满、不含杂质、不发霉的青稞。将筛选后的青稞用蒸馏水清洗2~3次,去除表面灰尘,浸泡5 min,沥干水分备用。炒制:沙子在260 ℃下充分预热15 min,将沥干的青稞放入高温炒锅中炒制15 s 左右,使其膨化爆花后得到爆米花青稞。磨粉:将得到的爆米花青稞用多功能粉碎机粉碎,过筛后得到炒制后青稞粉。
1.3.2 蛋白质提取
以炒制前后青稞粉为原料,按1:5(w/v)在沉淀中加入石油醚,于800 r/min 常温搅拌1 h 脱脂,去除上清液,收集沉淀,以上重复5次,风干备用。参考杜艳[7]的方法对脱脂的样品进行蛋白质提取。将经处理的样品与蒸馏水按1:15(w/v)混合均匀,加入NaOH 溶液调至pH11,于40 ℃下水浴搅拌60 min,经4 500 r/min离心20 min,收集上清液加入 HCl溶液至pH4.5,静置10 min,4 000 r/min 离心15 min 后富集沉淀,经蒸馏水冲洗2~3次,复溶后,用NaOH溶液调至pH7,真空冷冻干燥后研磨(过200 目筛),即得不同来源样品蛋白质粉末。其中,炒制前黑、白青稞的蛋白质提取率分别为85.48%、87.08%,炒制后提取率为45.26%、39.61%;纯度分别为82.31%、83.48%、79.62%、80.84%。
1.3.3 蛋白质SDS-PAGE电泳
参考刘永慧[8]的方法并做修改。称量50 mg蛋白质粉末加入2 mL 1 mol/L pH 8.8 Tris-HCl 充分涡旋混匀后,离心取其上清液与5×变性蛋白上样缓冲液按4:1 比例混匀后沸水浴中加热10 min,静置冷却至室温后,吸取10 μL上样;运行电压为100 V。凝胶分别用考马斯亮蓝快速染色液和脱色液进行染色和脱色。
1.3.4 蛋白质衰减全反射-傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)测定
将蛋白质粉末置于于ATR 附件上,在400~4 000 cm-1波长、4 cm-1分辨率下,所有样品连续扫描32次。
1.3.5 蛋白质紫外光谱测定
将蛋白质粉末用磷酸盐缓冲溶液(pH=7)配置为1.0 mg/mL 的溶液,扫描磷酸盐缓冲溶液调零后,采用紫外分光光度计在波长范围为200~400 nm处进行样品全波长扫描。
1.3.6 蛋白质内源性荧光发射光谱测定
将1.2.6配置的溶液稀释10倍后在295 nm处激发,扫描300~400 nm 范围内的荧光发射光谱,激发和发射狭缝宽均为10 nm,所有样品均平行扫描3次。
1.3.7 蛋白质X-射线衍射测定
将适量蛋白质粉末在管压40 kV、电流40 mA条件下,以扫描速度3 °/min、步长0.02°在5~40°范围内扫描。
1.3.8 蛋白质化学键测定
总巯基、游离巯基测定采用试剂盒的方法测定,按照说明书中公式求出相应含量,并根据公式(1)计算二硫键的含量。
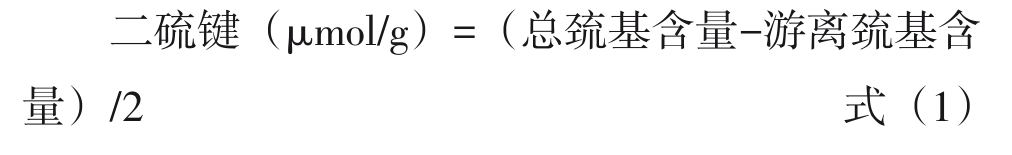
1.3.9 蛋白质微观结构
将蛋白质粉末置于附有导电硅胶带的样品台上,于扫描电镜3 kV下观察样品形态。
1.3.10 蛋白质流变学特性测定
将蛋白质粉末用蒸馏水配置成10%的溶液,糊化后立即置于流变仪上,采用PP25 平板,测量间距为1 mm,温度为25 ℃,动态流变测试的条件如下:以频率0.1~100 rad/s、应变1%进行测定,记录G'、G''、tan δ 和复数黏度的变化;静态黏弹性测试条件如下:以剪切速率为0.1~100 s-1进行测定,记录样品黏度和剪切应力的变化。
利用OMNIC 8.2 和PeakFit v4.12 进行蛋白质二级结构的分析,使用Origin 2022 对实验结果进行绘图,采用SPSS 25.0 对数据进行显著性分析,每组样品均进行3次平行实验。
由图1可知,炒制前,青稞中蛋白质分子量主要集中分布在中低区域(15~55 kDa)[9],炒制后,青稞中蛋白质分子量在40~55 kDa附近的条带明显变弱,而在20 kDa 附近的条带略有加强,可能由于炒制使青稞中蛋白质亚基发生降解为低分子量多肽或寡肽,使条带下移,分布在低分子量区域。
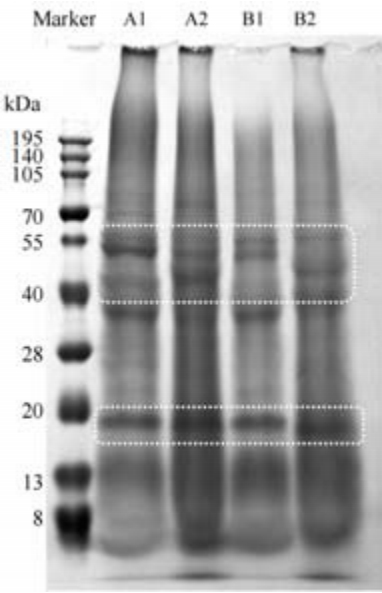
图1 不同来源样品蛋白质SDS-PAGE图
Fig.1 SDS-PAGE analysis of protein samples from different sources
注:A1、B1 为炒制前黑青稞、白青稞中蛋白质样品;A2、B2为炒制后黑青稞、白青稞中蛋白质样品,下同。
Notes:A1 and B1 are protein samples from black highland barley and white highland barley before frying; A2 and B2 are protein samples from black barley and white barley after stirfrying, same as below.
FTIR 光谱通常用来表征蛋白质分子结构中化学键和基团的变化情况。酰胺Ⅰ带(1 600~1 700 cm-1)对分析蛋白质的二级结构变化至关重要。其中β-折叠结构位于波段(1 613~1 637 cm-1)和(1 682~1 696 cm-1),α-螺旋结构位于波段(1 645~1 662 cm-1),β-转角结构位于波段(1 662~1 682 cm-1),无规则卷曲位于波段(1 637~1 645 cm-1)[10]。
由表1可得,炒制前,青稞蛋白质中β-折叠和β-转角结构两者之和占比高达55%以上,这表明青稞中蛋白质多为相对舒展的有序结构。炒制后,青稞蛋白质中β-折叠结构含量降低,α-螺旋、β-转角结构含量增加,无规则卷曲含量变化较小[11],可能是由于在炒制过程中,氢键断裂导致β-折叠结构含量下降,黑、白青稞分别下降了1.74%、3.55%,其结构逐渐转变为其他二级结构。α-螺旋结构含量增加,分别增加了2.41%、2.26%,可能由于炒制使R 基基团形成的聚合物发生分解[12],存在非α-螺旋结构的部分链段形成α-螺旋结构的可能性,从而导致α-螺旋结构比例升高,进而影响蛋白质二级结构的稳定性。青稞中蛋白质二级结构发生变化,可能会影响炒制后青稞的质构和口感以及营养成分的释放,并增强其营养价值。
表1 不同来源样品蛋白质二级结构含量
Table 1 Protein secondary structure content of samples from different sources%
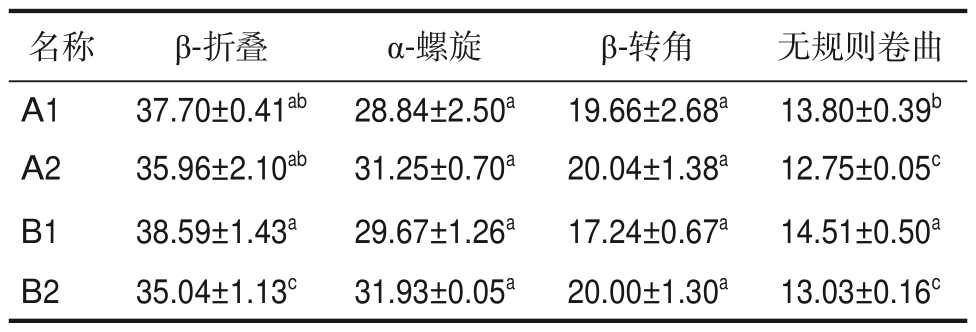
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),下同。
Notes:The values in the table are mean ± standard deviation.Different letters in the same column indicate significant differences(P < 0.05), same as below.
无规则卷曲13.80±0.39b 12.75±0.05c 14.51±0.50a 13.03±0.16c名称A1 A2 B1 B2 β-折叠37.70±0.41ab 35.96±2.10ab 38.59±1.43a 35.04±1.13c α-螺旋28.84±2.50a 31.25±0.70a 29.67±1.26a 31.93±0.05a β-转角19.66±2.68a 20.04±1.38a 17.24±0.67a 20.00±1.30a
蛋白质紫外光谱的变化通常被用来表征其三级结构构象的变化。一般认为,蛋白质在紫外区有两个特征吸收峰,分别位于220 nm 和280 nm 附近处,是由肽键(—CO—NH—) 和色氨酸(Trp)、酪氨酸(Tyr)吸收引起的[13]。
图2 可知,炒制前,青稞在220 nm、280 nm附近分别有一个吸收峰。炒制后,青稞在220 nm处紫外吸收增强,这表明炒制过程中蛋白质发生分解,破坏其肽链结构,使得内部肽键的暴露,导致蛋白质的比表面积增大。此外,炒制后的青稞在280 nm 附近的紫外吸光度增大,由于蛋白质在炒制作用下发生分解,使结构变得较为疏松,导致暴露出更多的Trp 和Tyr,增强了对紫外光的吸收[14]。
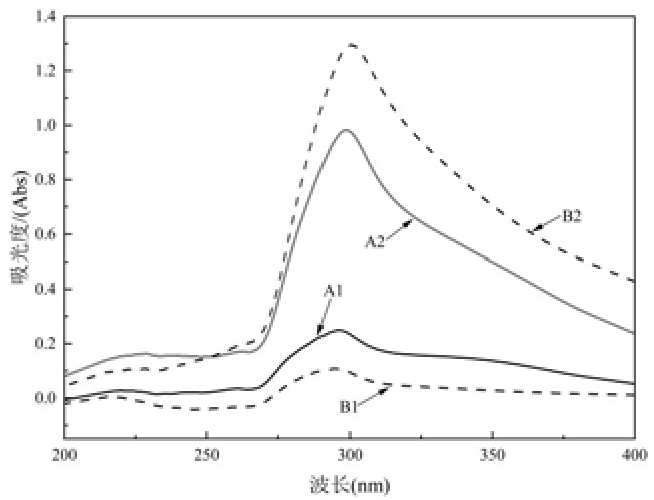
图2 不同来源样品蛋白质紫外光谱图
Fig.2 UV spectra of protein samples from different sources
内源荧光光谱的变化可用来直接反映蛋白质溶液微环境和结构的变化。图3显示,炒制后,青稞中的蛋白质最大发射波长发生偏移,即发生红移,可能是由于炒制使结构变得较为疏松,导致内部色氨酸与酪氨酸残基暴露在水溶液中,并且荧光强度明显降低,可能是由于炒制使蛋白质发生分解,导致荧光基团结构改变,从而使荧光强度降低[15]。
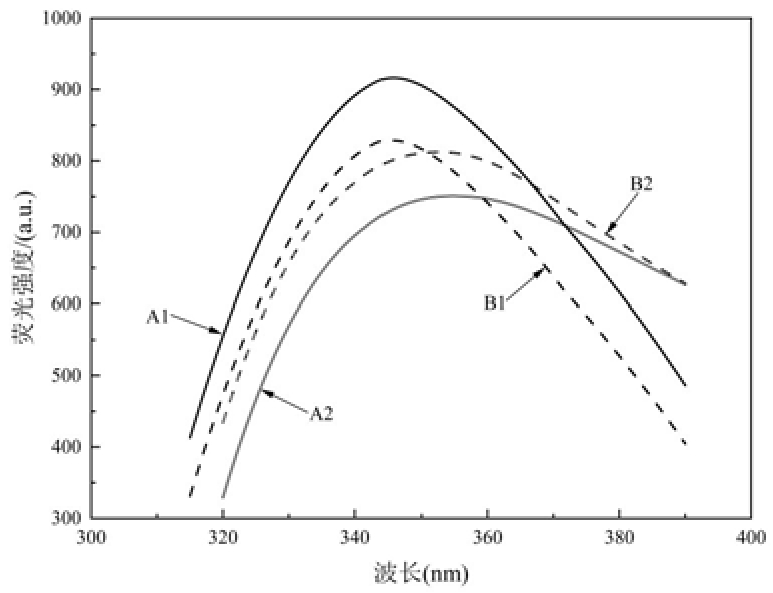
图3 不同来源样品蛋白质内源性荧光光谱图
Fig.3 Endogenous fluorescence spectra of proteins from different sources
XRD 光谱通过峰形、峰宽和结晶峰的位置等特征,对晶体的三维网络结构变化予以表征,并对物质进行鉴别。图4可知,炒制前,青稞可以观察到两个衍射峰,分别在10°和20°左右,2θ=10°为水分子经过排列组合与蛋白质一起形成的水合晶体[16],2θ=20°为典型的蛋白质半结晶峰[17]。炒制后,在2θ=10°处的结晶峰强度减小,趋于平缓,可能是炒制使青稞中的蛋白质表面吸附水分子数降低,这与蛋白质表面的疏水基团有关;青稞在2θ=20°处保持基本相似的结晶峰,说明炒制使青稞籽粒膨化没有破坏蛋白质的基本结晶结构。
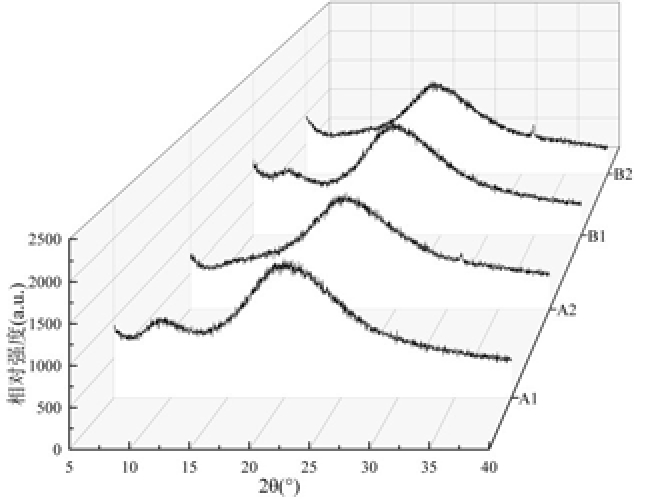
图4 不同来源样品蛋白质X-射线衍射图谱
Fig.4 Protein X-ray diffraction patterns of samples from different sources
通过蛋白质中游离巯基与总巯基的比值大小,判断蛋白质解折叠的程度[18]。如表2 可知,炒制前,青稞中蛋白质游离巯基与总巯基比值分别为0.60、0.58,游离巯基分别为0.37 μmol/g、0.33 μmol/g。炒制后,青稞中蛋白质游离巯基与总巯基的比值分别为0.38、0.47显著小于炒制前青稞(P<0.05),可能是由于在炒制过程中蛋白质与非淀粉多糖作用,使其热稳定性增加,导致解折叠程度减小;而游离巯基分别增加了0.04 μmol/g、0.43 μmol/g,显著大于炒制前青稞(P<0.05),可能是由于在炒制过程中蛋白质的聚合体解聚成较小的亚基,使部分包裹在内部的巯基基团暴露出来,导致游离巯基含量增加[19];此外,炒制前青稞中蛋白质二硫键含量分别为0.13 μmol/g、0.12 μmol/g,炒制后青稞中蛋白质二硫键的含量分别增加了0.23 μmol/g、0.31 μmol/g,可能是由于高温条件下,分子间相互增强,使游离巯基不断向二硫键转化[20]。
表2 不同来源样品蛋白质巯基与二硫键含量
Table 2 Protein sulfhydryl and disulfide bond content of samples from different sources μmol/g
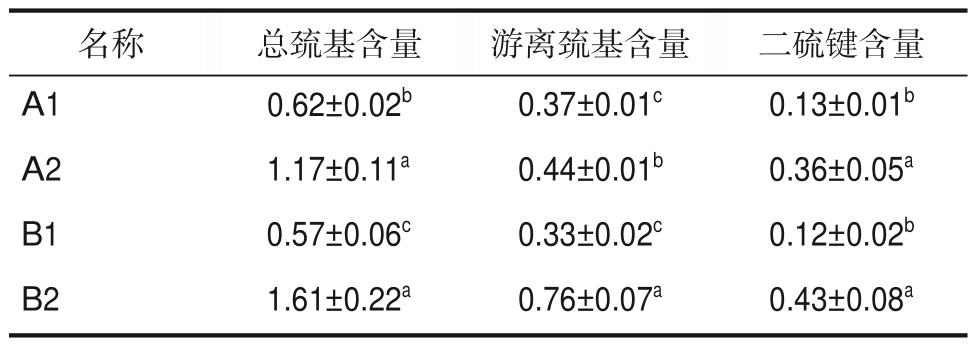
名称A1 A2 B1 B2总巯基含量0.62±0.02b 1.17±0.11a 0.57±0.06c 1.61±0.22a游离巯基含量0.37±0.01c 0.44±0.01b 0.33±0.02c 0.76±0.07a二硫键含量0.13±0.01b 0.36±0.05a 0.12±0.02b 0.43±0.08a
由图5 可知,炒制后,青稞中蛋白质表面粗糙,被降解为许多小颗粒,分子连接紧密,可观察到明显凹凸,可能是由于炒制破坏了蛋白质分子的天然状态结构,蛋白质受热伸展,暴露出更多的疏水基团,同时蛋白质间氢键被破坏,降低成相对小分子质量的颗粒,使蛋白质微观结构发生变化。

图5 不同来源样品蛋白质微观结构
Fig.5 Protein microstructure of samples from different sources
物质的流变特性与其分子量、结构密切相关。储能模量G'和损耗模量G''分别代表样品的弹性和黏性特征,tan δ 值反应材料在受到外部应力或应变时黏弹性的相对比例,由图6A~B 发现,炒制前,青稞中蛋白质溶液的G'与G''值随着角频率增大升高,G'值在角频率为10 rad/s 左右时终止,而tan δ值始终在1以上,说明青稞中蛋白质黏性应力比弹性应力更强,具有较高的黏性特性,导致流变弹性值截止。炒制后,青稞中蛋白质溶液的G'与G''值趋势和炒制前相似,始终为炒制后>炒制前,可能炒制使蛋白质分子间的相互作用力增强,因此展现出更高的黏弹性[21];随着角频率增大,tan δ值大于1,高角频率下蛋白质溶液内部微观结构发生变化,可能产生相态转变且具有良好的黏性[22]。此时,蛋白质分子结构变得松散,更易于被消化酶作用,从而可以提高蛋白质的消化率。
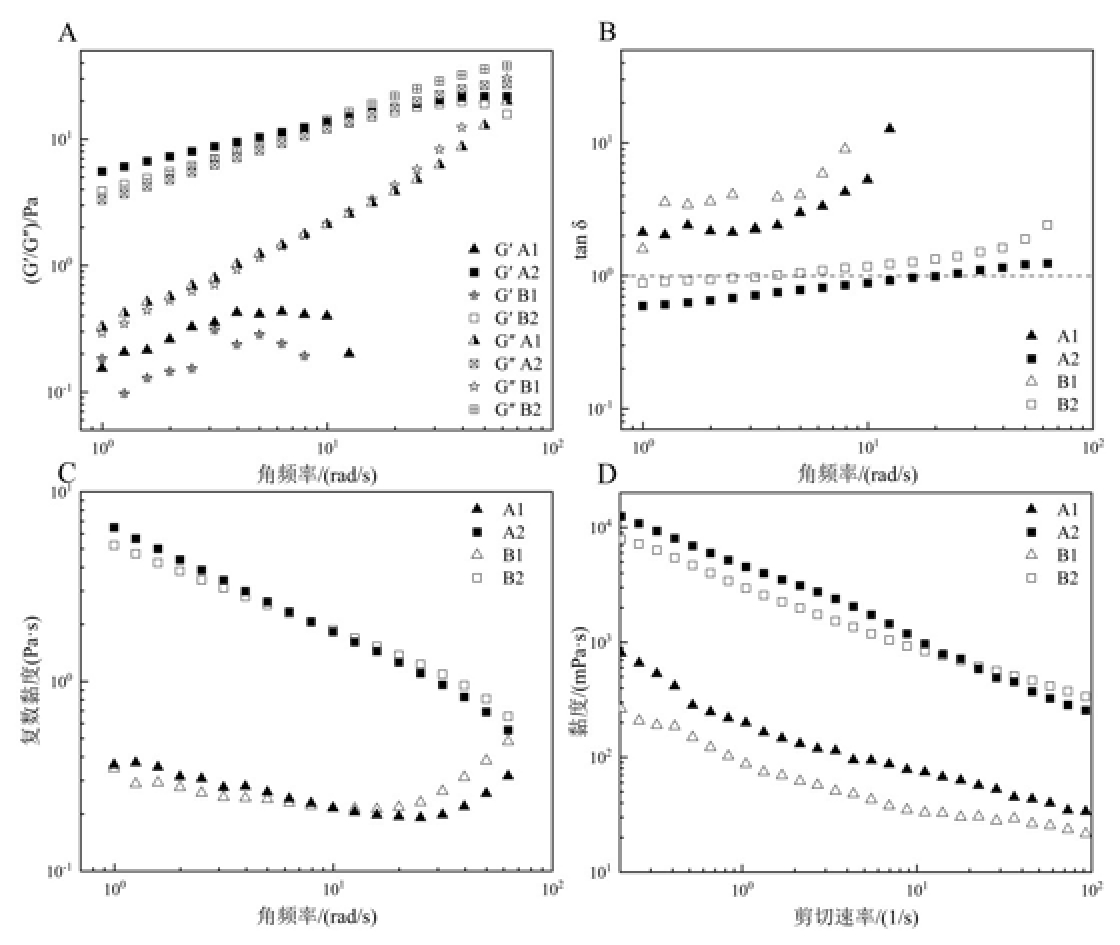
图6 不同来源样品蛋白质流变特性曲线图
Fig.6 Rheological properties curves of protein samples from different sources
由图6C 可知,炒制前,青稞中蛋白质溶液的复数黏度随着角频率的增加先下降后增加,可能是在较低角频率下,蛋白质分子有足够的时间进行取向和重排,从而减小了流动阻力,导致复数黏度下降;随着角频率增大,蛋白质分子间相互作用力增强,导致内摩擦增大,从而使复数黏度增大。炒制后,青稞中的蛋白质溶液的复数黏度随着角频率呈下降趋势,蛋白质聚集体发生解聚和解离,从而减小流动阻力,导致复数黏度下降[23],这与炒制后青稞中蛋白质的二级结构结果相吻合。
由图6D 可知,两种蛋白质溶液随剪切速率增大,黏度呈下降趋势,呈现出非牛顿流体特性。在相同剪切速率下,炒制后青稞中蛋白质的黏度>炒制前,可能是由于炒制过程中蛋白质二硫键含量增多,使蛋白质交联程度增强,导致蛋白质黏度增大;黏度随剪切速率的增加而降低,可能是因为随剪切速率增大,蛋白质分子在剪切作用下使分子沿流动方向取向,蛋白质分子呈轴向排列,导致黏度减小[24]。
研究了炒制对青稞中蛋白质结构与性质的影响,扫描电镜、FTIR、荧光光谱结果表明,炒制使得蛋白质分子表面形态被破坏,分子结构发生了显著变化,β-折叠结构逐渐转变为α-螺旋结构及β-转角结构,导致R 基基团形成的聚合物发生分解;存在非α-螺旋结构的部分链段形成α-螺旋结构可能性,使炒制后青稞中蛋白质游离巯基含量和表面疏水性提高;炒制后蛋白质溶液体系发生相变,且具有良好的黏性。
[1] GUO T L, HORVATH C, CHEN L, et al. Understanding the nutrient composition and nutritional functions of highland barley(Qingke): A review[J]. Trends in Food Science & Technology,2020, 103: 109-117.
[2] 侯殿志, 沈群. 我国29种青稞的营养及功能组分分析[J]. 中国食品学报, 2020, 20(02): 289-298.HOU D Z, SHEN Q. Analysis of nutrition and functional components of 29 kinds of highland barley in China [J].Journal of Chinese Institute of Food Science and Technology, 2020, 20 (02):289-298.
[3] 周智伟, 刘战民, 周选围. 青稞加工制品研究进展[J]. 粮油食品科技, 2018,26(05): 11-16.ZHOU Z W, LIU Z M , ZHOU X W. Research progress of highland barley processed products[J]. Science and Technology of Cereals, Oils and Foods, 2018, 26(05): 11-16.
[4] 张垚, 张文刚, 党斌, 等. 炒制时间及炒制方式对青稞挥发性风味化合物的影响[J]. 食品科学, 2020,41(14): 271-277.ZHANG Y, ZHANG W G, DANG B, et al. Effects of stir-frying time and method on volatile flavor compounds in highland barley[J]. Food Science, 2020, 41 (14): 271-277.
[5] 王婧. 热处理对燕麦蛋白质理化与功能特性影响的研究[D].西安: 陕西师范大学, 2019.WANG J. Effect of heat treatment on physicochemical and functional properties of oat protein[D]. Xi'an: Shaanxi Normal University, 2019.
[6] 雷洋. 炒制对燕麦主要功能成分理化特性及挥发性风味物质的影响研究[D]. 西安: 陕西师范大学, 2022.LEI Y. Effects of stir-frying on physicochemical properties of main functional components and volatile flavor substances of oat[D]. Xi'an: Shaanxi Normal University, 2022.
[7] 杜艳. 青稞蛋白-多酚相互作用机制及复合物应用研究[D]. 无锡: 江南大学, 2023.DU Y. The interaction mechanism of highland barley proteinspolyphenols and the application of its complexes[D]. Wuxi:Jiangnan University, 2023.
[8] 刘永慧, 田亚凝, 张永琥, 等. 低温等离子体技术对青稞蛋白结构及功能特性的影响[J]. 食品工业科技, 1-12[2024-09-17].https://doi.org/10.13386/j.issn1002-0306.2023120290.LIU Y H, TIAN Y N, ZHANG Y H, et al. Effects of cold plasma technology on the structural and functional properties of highland barley protein[J]. Science and Technology of Food Industry, 1-12[2024-09-17]. https://doi. org/10.13386/j. issn1002-0306.2023120290.
[9] XING J J, LI Z M, ZHANG W H, et al. The composition,structure, and functionalities of prolamins from highland barley[J].Molecules, 2023, 28(14): 5334.
[10] DONG X, WANG J, RAGHAVAN V. Impact of microwave processing on the secondary structure, in-vitro protein digestibility and allergenicity of shrimp (Litopenaeus vannamei)proteins[J]. Food Chemistry, 2021, 337: 127811.
[11] 申慧珊, 张捷, 张艳艳, 等. γ射线辐照对小麦粉面筋蛋白结构及功能特性的影响研究[J]. 粮油食品科技, 2024, 32(04): 76-83.SHEN H S, ZHANG J, ZHANG Y Y, et al. Effect of γ-irradiation on functional properties and structure of wheat gluten protein[J].Science and Technology of Cereals, Oils and Foods, 2024, 32(04):76-83.
[12] HE R, HE H Y, CHAO D F, et al. Effects of high pressure and heat treatments on physicochemical and gelation properties of rapeseed protein isolate[J]. Food And Bioprocess Technology,2014, 7(5): 1344-1353.
[13] BOBONE S, VAN DE WEERT M, STELLA L. A reassessment of synchronous fluorescence in the separation of Trp and Tyr contributions in protein emission and in the determination of conformational changes[J]. Journal of Molecular Structure, 2014,1077: 68-76.
[14] HUANG K, SHI J R, LI M Y, et al. Intervention of microwave irradiation on structure and quality characteristics of quinoa protein aggregates[J]. Food Hydrocolloids, 2022, 130: 106677.
[15] LI J, ZHANG X, ZHOU W J, et al. Impacts of proanthocyanidin binding on conformational and functional properties of decolorized highland barley protein[J]. Foods, 2023, 12(3): 481.
[16] 于娇娇. 高温花生蛋白的低温等离子体结构修饰及物性研究[D]. 天津: 天津科技大学, 2022.YU J J. Study on structural modification and physicochemical properties of high-temperaturepeanut protein by cold plasma[D].Tianjin: Tianjin University of Science & Technology, 2022.
[17] ZHANG Z S, FANG C Q, LIU D H, et al. Preparation and characterization of the protein edible film extracted from the migratory locust (Locusta migratoria) [J]. Food Packaging And Shelf Life, 2022, 33: 100899.
[18] 王中江, 江连洲, 魏冬旭, 等. pH 值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.WANG Z J, JIANG L Z, WEI D X, et al. Effect of pH on conformation and surface hydrophobicity of soybean protein isolate[J]. Food Science, 2012, 33(11): 47-51.
[19] ZHAO Q L, HONG X, FAN L P, et al. Solubility and emulsifying properties of perilla protein isolate: Improvement by phosphorylation in the presence of sodium tripolyphosphate and sodium trimetaphosphate[J]. Food Chemistry, 2022, 382: 132252.
[20] LI C Y, TIAN Y C, LIU C H, et al. Effects of heat treatment on the structural and functional properties of Phaseolus vulgaris L.protein[J]. Foods, 2023, 12(15): 2869.
[21] 张丽静, 华欲飞, 张彩猛, 等. 蛋白质含量对搅拌型大豆酸奶质构、流变特性和微观结构的影响[J]. 食品工业科技, 1-12[2024-09-17]. https://doi. org/10.13386/j. issn1002-0306.2024030054.ZHANG L J, HUA Y F, ZHANG C M, et al. The Effect of protein content on the texture, rheological properties and microstructure of stirred soy yogurt[J]. Science and Technology of Food Industry,1-12[2024-09-17]. https://doi. org/10.13386/j. issn1002-0306.2024030054.
[22] 白艺朋. 热处理诱导青稞和鹰嘴豆籽粒结构和组分变化及其应用研究[D]. 无锡: 江南大学, 2022.BAI Y P. Study on the thermally processing induced structural and component's changes of highland barley and chickpea kernels and their application[D]. Wuxi: Jiangnan University, 2022.
[23] ZHANG Y Z, XIONG W F, LEI L L, et al. Influence of heat treatment on structure, interfacial rheology and emulsifying properties of peanut protein isolate[J]. Czech Journal of Food Sciences, 2019, 37(3): 212-220.
[24] RAN X L, LOU X W, ZHENG H Q, et al. Improving the texture and rheological qualities of a plant-based fishball analogue by using konjac glucomannan to enhance crosslinks with soy protein[J]. Innovative Food Science & Emerging Technologies, 2022, 75:102910.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。