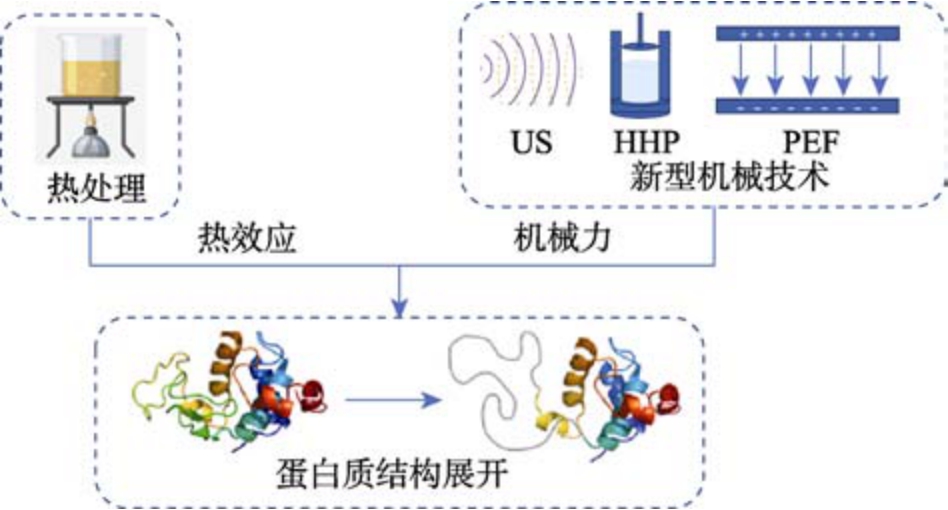
图1 SPs 的物理改性技术
Fig.1 Physical modification techniques for SPs
Research Progress on Soy Protein Modification Techniques and Its Combined Application
膳食蛋白质是满足人体营养需求的必不可少的成分,根据其来源可以分为动物蛋白和植物蛋白两大类。动物蛋白的生产不仅占用着大量土地和水资源,还会造成温室气体排放,对环境产生不良影响,不符合当代的可持续发展理念[1]。同时,过量摄入动物蛋白可能增加肥胖和糖尿病等慢性疾病的患病风险[2]。随着人们对健康和环境的关注度不断提高,越来越多的人选择转向安全健康和环境友好型的饮食模式,这一趋势推动了植物蛋白产品消费的增长。大豆蛋白(Soy proteins,SPs)是最常见的植物蛋白,其氨基酸组成与人体所需的必需氨基酸模式非常接近,具有较高营养价值和生物利用率[3]。然而,由于天然结构的限制,SPs 在功能特性上难以满足市场多样化的需求[4]。因此,对SPs 结构进行修饰和调整以增强其功能特性成为了当前研究的热点之一[5]。本文综述了物理、化学、生物3 种改性技术影响SPs结构和功能特性的分子机制,建立SPs 的“结构-功能特性”桥梁,同时讨论了多种改性技术联合应用的效果和前景,旨在推动植物蛋白产品的创新和多样化,以满足不断变化的市场需求。
SPs 的物理改性技术是指通过热效应和机械效应改变蛋白质分子的聚集状态,促进亚基解离和蛋白质结构展开,暴露出活性基团,进而改善蛋白质的功能特性。其中,热处理作为传统的蛋白改性手段已得到了广泛的应用,但随着行业需求的提升,传统热处理难以满足人们需求。因此,新型机械加工技术成为了目前常用的物理改性方法,包括超声(Ultrasound,US)、高静水压力(High hydrostatic pressure,HHP)、脉冲电场(Pulsed electric field,PEF)等,如图1 所示。

图1 SPs 的物理改性技术
Fig.1 Physical modification techniques for SPs
US 处理通过声空化效应产生气泡,这些气泡的振荡和破裂会产生高速液体射流,促进蛋白质展开,从而增强蛋白质与水的相互作用,增加蛋白质的溶解性等功能特性。Kong 等[6]研究表明,US 处理引起大豆分离蛋白(Soy protein isolates,SPI)分子的结构展开和构象改变,导致α-螺旋相对含量降低,β-转角、β-折叠、无规则卷曲相对含量增加,荧光强度和表面疏水性增强,进而改善了SPI 的溶解度、乳化活性、发泡能力和发泡稳定性等功能特性。此外,Wang 等[7]还发现US的空化作用能够将较大的蛋白质颗粒破碎成较小的分子,增加蛋白的溶解度。较小的蛋白质聚集体和较高的溶解度使得蛋白质分子之间的相互作用增强,为形成良好的凝胶网络结构提供了基础,同时US 处理后蛋白的游离巯基含量增加,其在加热过程中可以转化为二硫键,能够进一步改善蛋白的凝胶特性。综上所述,US 处理不仅能够通过改变蛋白结构来提升其功能特性,还能促进蛋白在后续的热处理过程中形成均匀致密的凝胶网络,在实际应用中具有积极意义。
HHP 主要破坏蛋白质的非共价键,如疏水键、氢键、离子键和盐桥,导致蛋白质的解聚或构象改变。Xi 等[8]发现高压不仅破坏了蛋白质分子间的范德华力和氢键,使蛋白质分子去折叠化,暴露疏水区域,还能使蛋白质解离成亚基,形成更多的疏水区域,显著增加蛋白的表面疏水性。HHP诱导SPs 结构变化的同时也会影响其功能特性,Dehnad 等[9]指出不同的压力条件对SPs 产生的影响各有不同,在300~400 MPa 的压力水平下,蛋白质由不溶性大分子向可溶性低分子聚集体转化的速度最快,SPs 的表面电荷电位和表面疏水性增加,更容易被空气-水和油-水界面吸附,此时SPs的溶解度和疏水性显著提升。然而,当压力高于400 MPa 时,疏水相互作用会导致蛋白质聚集。总之,HHP 能显著改变蛋白质的结构和功能特性,应用不同的处理条件可以达到不同的改性效果,但也导致了参数设置困难,应用门槛较高的问题。
PEF 能使蛋白质的极性基团产生自由基,破坏蛋白质分子之间相互作用,引起蛋白质结构和功能特性的改变。Wang 等[10]研究发现PEF 处理改变了蛋白质的二级和三级结构,在电场强度较低时,α-螺旋和β-转角含量增加,β-折叠含量降低,表面疏水性升高,总巯基含量降低,此时蛋白质的变性程度低,粒径小且分布均匀,表现出良好的界面吸附特性。然而,当电场强度过高时,电场的定向运动加速了蛋白质分子碰撞,促进分子间和分子内二硫键的形成,产生了大的聚集体结构,其产生的空间位阻效应不利于蛋白在界面上的吸附,降低了发泡稳定性。此外,张子信[11]研究表明PEF 的能量能促使肽键断裂,使部分蛋白质分解为小分子多肽和游离氨基酸,与大分子蛋白质相比更易被人体吸收,且具有更良好的理化性质和生物活性。这种改性方式的作用效率高,但具有较强的随机性,还需要进行更深入的研究以开发其潜在的应用价值。
化学改性技术是指利用外源的化学物质修饰特定官能团,进而影响蛋白质的结构和功能特性。然而,化学改性技术由于引入了化学物质并可能产生有毒副产物,在食品工业中的应用受限。本节只讨论糖基化和多酚这两种天然化学物质的改性方式。
糖基化反应只需加热即可自发发生,无需额外的化学试剂,因此在SPs 工业中应用广泛。左颖昕等[12]探究了葡萄糖偶联对SPI 结构和功能特性的影响,发现糖链的引入使SPI 的肽链展开,二级结构趋于无序性。Li 等[13]指出与未经处理的SPs 相比,SPs-葡萄糖缀合物即使在高温和较大的pH 值范围内也具有良好的溶解度、热稳定性和乳化性能。Peng 等[14]指出大豆可溶性多糖与11S 蛋白的糖基化反应引入了亲水基团,也保留了足够的疏水基团,使产物具有良好的两亲性,有利于在油水界面的吸附,提高了11S 的乳化活性(如图2 所示)。同时,由于糖链独特的结构和力学性能,能够在四级结构水平上增强蛋白质的柔韧性,提高界面模量,提供更好的乳化稳定性。此外,有研究表明,糖基化程度受到诱导方式、反应时间和糖链长度的影响,糖基化程度越小对蛋白功能特性的改善效果越弱[15],但过度糖基化由于空间位阻效应会产生负面影响。因此,利用糖基化反应能够实现SPs 的可控化改性,使其更符合人们的需求。
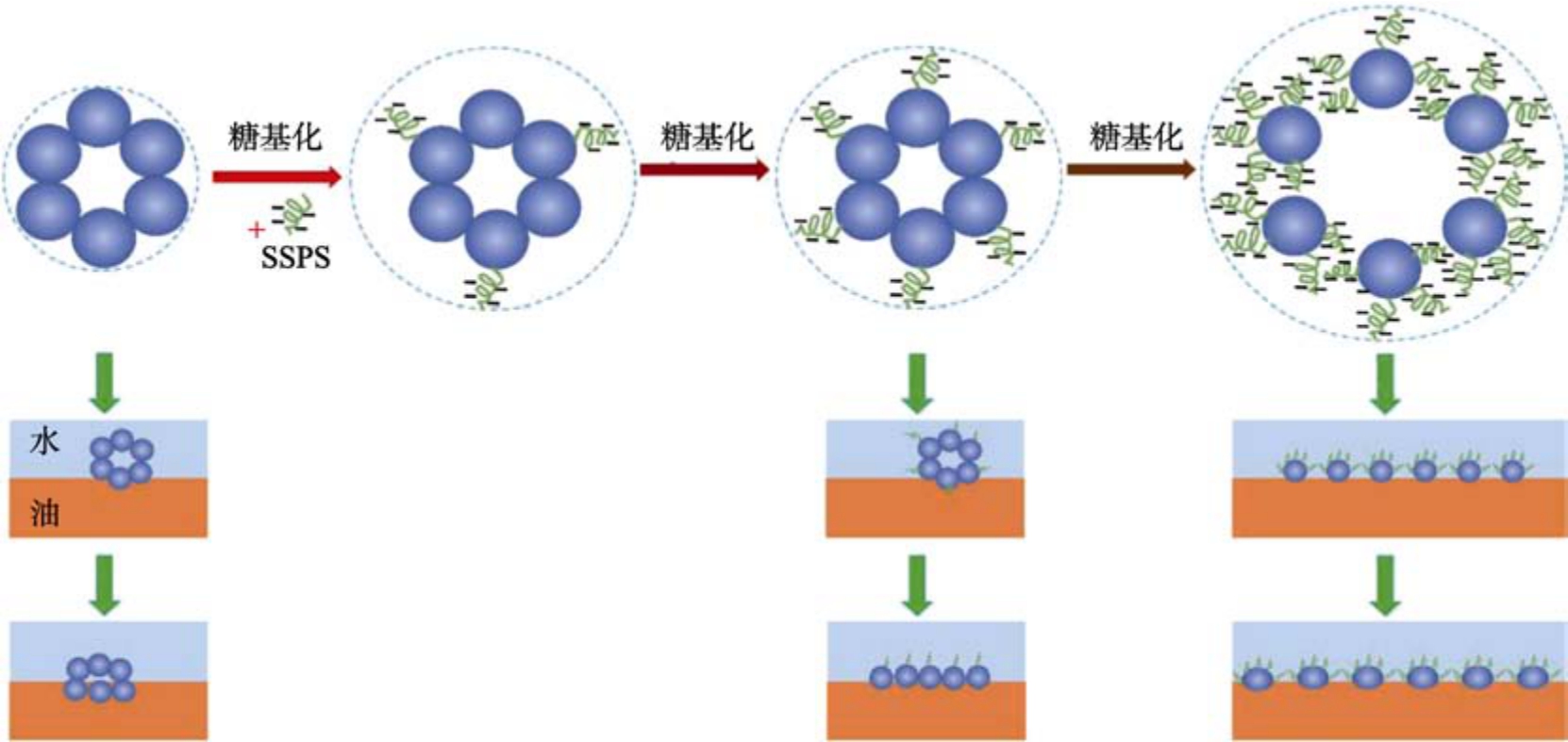
图2 11S 蛋白的糖基化改性[14]
Fig.2 Glycosylation modification of 11S proteins[14]
多酚类化合物是植物体内重要的次生代谢产物,由于其具有芳香环结构和丰富的羟基,对蛋白质具有很强的亲和力。研究发现,多酚与蛋白质的相互作用包括非共价相互作用和共价相互作用两种。其中,非共价相互作用是可逆的,通常涉及氢键、疏水相互作用、静电相互作用和范德华力,共价结合指多酚-蛋白质和蛋白质-蛋白质分子间形成共价键的过程,这一过程是不可逆且相对稳定的[16]。近年来,研究者们利用多酚改善SPs 的结构和功能特性,取得了良好的效果。表1展示了多酚改性在SPs 中的应用现状。
表1 多酚改性在SPs 中的应用现状
Table 1 Current status of polyphenol modification in SPs

多酚种类 作用蛋白 改性效果 参考文献花青素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside,C3G) 7S、11S单宁酸(Tannic acid,TA) SPI原花青素(Proanthocyanidins,PC) SPI、7S、11S羟基酪醇(Hydroxytyrosol,HT) SPI表没食子儿茶素没食子酸酯((-)-Epigallocatechin gallate,EGCG) SPI通过非共价结合引起7S 和11S 的二级和三级结构变化,使蛋白质展开,结构更加松散,此过程中静电力起主导作用,且与7S 相比,C3G 对11S 的结合亲和力更强。SPI-TA 的非共价相互作用主要是氢键和范德华力,TA 的加入改变了SPI 的二级结构,降低了其表面疏水性。在功能性能方面,TA 提高了SPI 的乳化能力,降低了SPI 的界面张力。PC 的共价改性诱导了SPI 结构的展开,增加了分子柔韧性,且碱加热处理能够加速这一过程。PC 的加入还提高了体系的抗氧化性和乳液活性,保持了乳液的稳定性。在HT 浓度为50 μmol/g 时,复合物的持水性、溶解度和乳化性均达到最佳,此外,HT 的加入显著提高了复合物的抗氧化性,其抗氧化性能与HT 含量呈正相关。EGCG 主要通过氢键与SPI 结合形成稳定的复合物,多酚浓度的增加促进了与蛋白质的共轭作用,导致SPI-EGCG 复合物具有较大的粒径和较低的表面疏水性。[17][18][19][20][21]
生物改性技术通常指酶法改性,利用酶的催化作用对蛋白质特定位点进行断裂或连接。根据其催化的反应类型可以分为酶水解和酶交联,其作用机制如图3 所示。
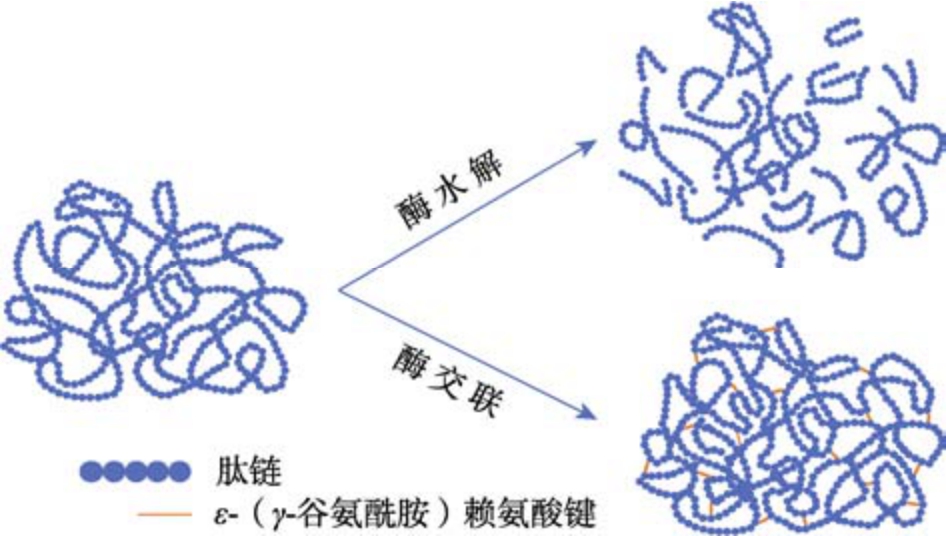
图3 SPs 的酶法改性机制
Fig.3 Enzymatic modification mechanism of SPs
酶水解通常是由蛋白质水解酶作用于蛋白质的一级结构,断开氨基酸序列中的肽键,使蛋白质分裂成短链肽和分子量较低的氨基酸。一方面,通过非共价相互作用改变蛋白质的聚集和凝胶行为,影响其结构特性[22],另一方面,在某些生物活性肽的作用下,蛋白质水解物(Soy protein hydrolysates,SPHs)能够表现出降糖、抗氧化等生理活性[23]。水解程度与SPHs 的功能特性和生物活性密切相关。郑环宇等[24]选取了5 种不同的酶,分别在其最适温度和pH 对SPI 进行酶解处理(酶∶底物=1∶50,4 h),其中菠萝蛋白酶具有最高的水解程度(14.08%),其水解产物的结构展开程度高,疏水基团大量暴露,显著提高了SPI的乳化性。然而,过度酶解会促进水解产物的聚集行为,暴露的疏水性基团随着聚集被重新掩埋进聚集的蛋白质中,从而减少可用的疏水性基团的数量[25]。此外,Xu 等[26]通过计算机虚拟筛选结合体外试验验证发现碱性蛋白酶作用于SPI 产生的水解产物具有更突出的抗氧化活性,这是因为SPI 肽链中具有较多碱性蛋白酶的裂解位点,使其水解产物的分子量低,结构分散性强,能够更好地与自由基接触,同时由于其活性氨基酸含量高,能通过电子转移提供强大的自由基清除活性。总而言之,不同酶水解程度对蛋白质结构产生不同的影响,改变其功能特性与生物活性,未来通过优化酶解条件和筛选高效酶制剂,将进一步推动酶水解技术在蛋白质改性领域的广泛应用。
谷氨酰胺转氨酶(Transglutaminase,TGase)能够催化ε-(γ-谷氨酰胺)赖氨酸键的生成,使蛋白质分子内及分子间产生共价交联[27]。王稳等[28]研究发现,与未经处理的SPI 相比,TGase 处理的SPI 乳化活性和乳化稳定性显著升高。时玉强等[29]发现添加0.3%TGase 可使SPI 凝胶的硬度较未处理组提高28.4%,弹性提高 13.8%,咀嚼性提高52.8%,说明TGase 催化的共价交联诱导了蛋白质分子间聚集,引起了结构变化。Sun 等[30]通过扫描电镜也证明了这一点。臧学丽等[31]研究发现在TGase 添加量为34.67 U/g、时间为2.21 h的反应条件下,SPI 溶液的表面疏水性提高35.9%,表面巯基含量降低24.8%,二硫键含量增加10.3%,自由氨基的含量降低73.8%,其中自由氨基含量下降在一定程度上反映了TGase 催化的交联程度增加。然而,Luo 等[32]发现高浓度的TGase 形成了粗糙的网络结构,使凝胶硬度和断裂性能严重下降,这是因为TGase 过度交联导致了较大聚合物的形成,减少了非共价键的数量而无法形成致密的凝胶网络。因此,在工业化场景中利用酶交联法进行蛋白改性时,需要精细调控酶活和反应条件,控制蛋白的交联程度,避免过度交联引起的负面效应。
尽管针对SPs 的改性技术研究已取得了一定的进展,但单一的改性技术具有各自的局限性(如表2 所示),难以满足日益增长的应用需求。
表2 单一改性技术的优势和局限性
Table 2 Advantages and limitations of single modification techniques

改性技术 优势 局限性物理改性技术化学改性技术传统热处理 操作简单,改性效率高;能够去除抗营养因子,提高SPs 的营养价值。改性效果单一且不可逆,会导致蛋白质严重的疏水聚集,降低溶解度。新型机械加工 不引入外源物质,安全性高,在食品行业应用潜力高;能够避免传统热处理带来的负面效应。作用方式简单,对结构复杂的蛋白作用效果有限;非定向改性,无法精确调控蛋白质结构。糖基化反应 原料来源广泛、安全无毒;蛋白和多糖通过共价键结合,其结合强度较非共价键更高。反应程度难以控制,且过度反应可能产生有害物质。多酚改性 多酚来源广泛,具有较强的生物活性,可与蛋白通过共价和非共价方式结合。反应条件复杂,不利条件可能对蛋白结构和功能特性产生负面影响。生物改性技术 酶水解、酶交联 酶的作用条件温和,不会引起蛋白过度变性;酶作用的专一性强,能够实现结构的定向调控。受SPs 天然结构限制,酶对底物可及性较差,改性过程相对缓慢;过度的水解或交联对蛋白结构和功能特性不利。
为了克服这些局限性并进一步提升SPs 的功能特性,研究者们开始将目光转向多种改性技术的创造性联合应用,旨在充分发挥不同技术的优势,弥补各自的不足,从而获得结构和功能特性更符合产业期待的改性SPs。研究表明,以新型机械加工手段辅助生物化学改性技术可以提高改性效率,降低成本,实现SPs 的定向可控化改性。
近年来,US 辅助糖基化改性的研究也取得了一定进展,但HHP 和PEF 辅助糖基化对SPs 改性暂无报道。夏爽[33]在US 处理的基础上对SPI与低聚木糖进行糖基化改性,发现超声处理后SPI的二级结构发生改变,α-螺旋和无规则卷曲结构明显增加,在随后的糖基化过程中,无规则卷曲含量上升3.54%,结构更加无序。Chen 等[34]研究了不同US 参数(功率和时间)对豌豆分离蛋白-阿拉伯糖缀合物结构和功能特性的影响,其结果表明US 的空化效应促进了蛋白质的结构展开,使分子表面的疏水性基团和游离巯基含量增加,有利于蛋白质与糖的糖基化反应,当US 处理功率为150 W、处理时间为30 min 时,蛋白质的糖基化程度达到最大。总之,US 处理不仅能有效地提高糖基化的反应速率,还可以通过调节参数控制糖基化反应的程度,实现对蛋白结构和功能的精确控制,具备在工业中推广的潜力。
结构展开的蛋白比天然的球状蛋白具有更高的多酚结合能力,因此利用新型机械加工技术辅助多酚改性具有理论基础。代世成等[35]研究了US处理对 SPI-儿茶素复合物结构及功能特性的影响,发现US 处理使SPI 结构变得更加松散和舒展,蛋白肽链内部的疏水基团和极性基团暴露于表面,增大了儿茶素与SPI 产生不可逆共价相互作用的程度,形成了粒度较大的网状复合物,同时引入了大量的亲水基团(羟基和羧基),增大了复合物的溶解度和泡沫稳定性,分子对接的结果显示复合体系中形成氢键和疏水作用的能力更强,因此复合物具有较强的亲水能力,进而增强了溶解性、持水性等功能特性。Chen 等[36]研究了PEF 协同EGCG 修饰下豌豆分离蛋白(Pea protein isolates,PPI)的构象变化及其分子机制,结果表明,经PEF 处理后(10 kV/c),PPI 分子的柔韧性显著增强,分子对接证明了经PEF 处理的PPI 与EGCG 的结合位点从4 个增加到10 个,参与疏水相互作用的氨基酸残基数从5 个增加到13 个。以上研究结果表明,新型机械加工技术能够增强蛋白质与多酚的互作行为,显著提升改性效率并优化生产经济性。
SPs 的刚性结构会阻碍酶扩散到底物反应位点,从而影响酶对底物的可及性,导致酶反应速率降低。因此,利用新型加工技术辅助酶改性被认为是一种有效的SPs 改性方式。Wu 等[37]研究水解酶和US 联合处理对SPI 结构和凝胶特性的影响,发现经双重处理的SPI 溶液粒径显著低于单处理样品,且粒径分布更加均匀,溶解度和浊度改善效果更好。此外,二者的联合处理还赋予SPI 凝胶均匀致密的凝胶网络,使其具有更高的持水能力和凝胶强度。李杨等[38]研究发现US 处理不仅产生了机械力和空化效应,使蛋白质结构展开,暴露出更多的疏水基团和游离巯基,提升了SPI 表面疏水性和游离巯基含量,还促进了TGase的扩散,使其能够与更多的赖氨酸残基接触,有利于TGase 催化交联反应的进行,进而形成均匀致密的凝胶结构。此外,Guan 等[39]探索了SPI水解过程中HHP 和Corolase PP 酶(一种蛋白水解酶)的协同作用效果,发现当压力从0.1 MPa提高到200 MPa 时,SPI 的水解度显著提高,水解产物的表面疏水性降低,当压力达到300 MPa时,水解度不再提高但水解速率降低,可能是由于过高的压力导致了蛋白质的聚集或酶的部分变性。综上所述,新型机械加工技术辅助酶法改性有助于减少加工时间和能耗,降低生产成本,但也可能造成酶的变性失活,在实际生产中需要合理应用以实现高效稳定改性的目的。
基于环保、健康等方面的考量,SPs 的发展和工业化应用成为必然趋势,通过技术手段对SPs进行修饰以改善其功能特性已经成为热点研究问题。目前国内外已有大量研究表明物理、化学、生物技术能够通过不同的机制改善SPs 的结构和功能特性,也逐渐关注多种技术的联合应用,以期得到更加全面有效的新型改性技术。然而这些改性技术仍存在着不可忽视的问题亟待解决。首先,对于多种改性技术联合应用效果探究的深度和广度还有不足,未来还需要深入解析复合改性过程中蛋白质分子间复杂的互作行为以及不同技术间的协同增效机制。其次,改性程度与SPs 功能特性之间具有密切关联,程度较小时效果不明显,程度过大则会对蛋白的功能特性产生负面影响,甚至产生有毒物质对人体健康造成危害。因此,如何控制SPs 改性程度也是未来研究中的一个重点。此外,对于SPs 在不同应用场景中的改性技术选择还没有一个明确的标准,需要评估不同改性技术的优劣,通过跨学科合作建立改性技术选择的指导原则,为SPs 的应用提供可靠的技术支持。
[1] MCCLEMENTS D J, GROSSMANN L. The science of plant-based foods: Constructing next-generation meat, fish, milk,and egg analogs[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4): 4049-4100.
[2] SHA L, XIONG Y L. Plant protein-based alternatives of reconstructed meat: Science, technology, and challenges[J]. Trends in Food Science & Technology, 2020, 102: 51-61.
[3] RIZZO G, BARONI L. Soy, soy foods and their role in vegetarian diets [J/OL] 2018, 10(1): 10.3390/nu10010043.
[4] 孙燕婷, 黄国清, 孙萍, 等. 大豆分离蛋白溶解性和乳化性影响因素研究[J]. 粮油食品科技, 2011, 19(1): 32-35.SUN Y T, HUANG G Q, SUN P, et al. Factors affecting the solubility and emulsifying property of soy protein isolate[J].Science and Technology of Cereals, Oils and Foods, 2011, 19(1):32-35.
[5] 张涛, 魏安池, 刘若瑜. 大豆蛋白改性技术研究进展[J]. 粮油食品科技, 2011, 19(5): 26-29.ZHANG T, WEI A C, LIU R Y. Research progress on modification of soy protein[J]. Science and Technology of Cereals, Oils and Foods, 2011, 19(5): 26-29.
[6] KONG Y, SUN L, WU Z, et al. Effects of ultrasonic treatment on the structural, functional properties and beany flavor of soy protein isolate: comparison with traditional thermal treatment[J].Ultrasonics Sonochemistry, 2023, 101: 106675.
[7] WANG Y, WANG Y, LI K, et al. Effect of high intensity ultrasound on physicochemical, interfacial and gel properties of chickpea protein isolate[J]. LWT-Food Science and Technology, 2020, 129:109563.
[8] XI J, HE M X. High hydrostatic pressure (HHP) effects on antigenicity and structural properties of soybean β-conglycinin[J]. Journal of Food Science and Technology. 2018, 55, 630-637.
[9] DEHNAD D, EMADZADEH B, GHORANI B, et al. The influence of high hydrostatic pressure on different properties of legume proteins with an emphasis on soy proteins: a comprehensive review[J]. Food Hydrocolloids, 2024, 146: 109188.
[10] WANG W, WANG X, ZHANG H, et al. Effects of electric field intensity regulation on protein aggregation behaviour and foaming property of soybean 7S globulin[J]. International Journal of Biological Macromolecules, 2023, 248: 125784.
[11] 张子信. 脉冲电场处理对液体食品大分子蛋白质分解作用的研究[D]. 南宁: 广西大学, 2023: 42-44.ZHANG Z X. Study on the effect of pulse electric field treatment on the decomposition of large molecular proteins in liquid food[D], Nanning: Guangxi University, 2023: 42-44.
[12] 左颖昕, 布冠好. 葡萄糖接枝对大豆分离蛋白功能特性和结构的影响[J]. 河南工业大学学报(自然科学版), 2018, 39(2):58-64+71.ZUO Y X, BU G H. Functional and structural properties of soybean protein isolate–glucose conjugates[J]. Journal of Henan University of Technology (Natural Science Edition), 2018, 39(2):58-64+71.
[13] LI R, WANG X, LIU J, et al. Relationship between molecular flexibility and emulsifying properties of soy protein isolateglucose conjugates[J]. Journal of Agricultural and Food Chemistry,2019, 67(14): 4089-4097.
[14] PENG X Q, XU Y T, LIU T X, et al. Molecular mechanism for improving emulsification efficiency of soy glycinin by glycation with soy soluble polysaccharide[J]. Journal of Agricultural and Food Chemistry, 2018, 66(46): 12316-12326.
[15] ZHANG L, CHANDRA ROY M, ZHOU P. Effect of reducing sugars on the in-vitro glycation of goat milk whey protein by mass spectrometry[J]. LWT-Food Science and Technology, 2021,147: 111608.
[16] CHEN D, STONE S, ILAVSKY J, et al. Effect of polyphenols on the rheology, microstructure and in vitro digestion of pea protein gels at various pH[J]. Food Hydrocolloids, 2024, 151: 109827.
[17] REN C, XIONG W, LI B. Binding interaction between β-conglycinin/glycinin and cyanidin-3-O-glucoside in acidic media assessed by multi-spectroscopic and thermodynamic techniques[J]. International Journal of Biological Macromolecules, 2019,137: 366-373.
[18] LI X, HU S, RAO W, et al. Study on the interaction mechanism,physicochemical properties and application in oil-in-water emulsion of soy protein isolate and tannic acid[J]. Journal of Food Engineering, 2023, 357: 111626.
[19] PI X, SUN Y, LIU J, et al. Multi-spectral and proteomic insights into the impact of proanthocyanidins on IgE binding capacity and functionality in soy 11S protein during alkali-heating treatment[J]. International Journal of Biological Macromolecules, 2023,226: 597-607.
[20] GU M, SHI J, ZHANG B, et al. Interaction of soy protein isolate with hydroxytyrosol based on an alkaline method: Implications for structural and functional properties[J]. Food Chemistry, 2024,446: 138813.
[21] DAI S, XU T, YUAN Y, et al. Combination and precipitation mechanism of soy protein and tea polyphenols[J]. Food Hydrocolloids, 2024, 146: 109197.
[22] 赵沙沙, 孔祥珍, 苏芮, 等. 大豆蛋白酶解过程中聚集行为的研究[J]. 中国粮油学报, 2014, 29(4): 16-21.ZHAO S S, KONG X Z, SU R, et al. The properties of the aggregation of soy proteins during enzymic hydrolysis[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(4): 16-21.
[23] DU X, JING H, WANG L, et al. Characterization of structure,physicochemical properties, and hypoglycemic activity of goat milk whey protein hydrolysate processed with different proteases[J]. LWT-Food Science and Technology, 2022, 159: 113257.
[24] 郑环宇, 赵晓明, 张梦, 等. 不同酶切方式引发大豆蛋白构象变化及功能特性评价[J]. 中国粮油学报, 2022, 37(6): 103-111.ZHENG H Y, ZHAO X M, ZHANG M, et al. Evaluation on changes and functional properties of soy protein conformationdue to different enzymolysis methods[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(6): 103-111.
[25] AVRAMENKO N A, LOW N H, NICKERSON M T. The effects of limited enzymatic hydrolysis on the physicochemical and emulsifying properties of a lentil protein isolate[J]. Food Research International, 2013, 51(1): 162-169.
[26] XU Y, YANG Y, MA C-M, et al. Characterization of the structure,antioxidant activity and hypoglycemic activity of soy (Glycine max L.) protein hydrolysates[J]. Food Research International,2023, 173: 113473.
[27] AKBARI M, RAZAVI S H, KIELISZEK M. Recent advances in microbial transglutaminase biosynthesis and its application in the food industry[J]. Trends in Food Science & Technology, 2021,110: 458-469.
[28] 王稳, 黄国清, 肖军霞, 等. 谷氨酰胺转氨酶对大豆分离蛋白溶解性和乳化性的影响[J]. 粮油食品科技, 2014, 22(2): 38-42.WANG W, HUANG G Q, XIAO J X, et al. Effects of transglutaminase on the solubility and emulsifying property ofsoybean protein isolate[J]. Science and Technology of Cereals,Oils and Foods, 2014, 22(2): 38-42.
[29] 时玉强, 何东平, 刘军, 等. 谷氨酰胺转氨酶对大豆分离蛋白生产的影响[J]. 中国油脂, 2018, 43(4): 25-27+32.SHI Y Q, HE D P, LIU J, et al. Effect of glutamine transaminase on production of soybean protein isolate[J]. China Oils and Fats,2018, 43(4): 25-27+32.
[30] SUN P, ZHANG Q, ZHAO Y, et al. Improving gel properties of soy protein isolate through alkaline pH-shifting, mild heat treatment, and TGase cross-linking[J]. Food Hydrocolloids,2023, 144: 108924.
[31] 臧学丽, 陈光. 转谷氨酰胺酶交联大豆分离蛋白的结构变化与凝胶强度的相关性[J]. 吉林农业大学学报, 2021, 43(6):685-689.ZANG X L, CHEN G. Correlation between structural changes and gel strength oftransglutaminase cross-linked soybean protein lsolate[J]. Journal of Jilin Agricultural University, 2021, 43(6):685-689.
[32] LUO K, LIU S, MIAO S, et al. Effects of transglutaminase pre-crosslinking on salt-induced gelation of soy protein isolate emulsion[J]. Journal of Food Engineering, 2019, 263: 280-287.
[33] 夏爽. 超声-糖基化改性对大豆分离蛋白的影响及应用[D].天津: 天津科技大学, 2019: 45-47.XIA S. Effect of ultrasonie pretreatment-glycosylation modification on soy protein isolate and application[D]. Tianjin: Tianjin University of Science and Technology, 2019: 45-47.
[34] CHEN X, DAI Y, HUANG Z, et al. Effect of ultrasound on the glycosylation reaction of pea protein isolate-arabinose: Structure and emulsifying properties[J]. Ultrasonics Sonochemistry, 2022,89: 106157.
[35] 代世成, 连子腾, 马林智, 等. 超声预处理对大豆分离蛋白-儿茶素非共价/共价复合物结构及功能的影响[J]. 食品科学,2022, 43(1): 102-110.DAI S C, LIAN Z T, MA L Z, et al. Effect of ultrasonic pretreatment on the structure and function of soybeanprotein lsolate-catechin non-covalent/covalent complexes[J]. Food Science,2022, 43(1): 102-110.
[36] CHEN Z L, LI Y, WANG J H, et al. Pulsed electric field improves the EGCG binding ability of pea protein isolate unraveled by multi-spectroscopy and computer simulation[J]. International Journal of Biological Macromolecules, 2023, 244: 125082.
[37] WU X, GAO T, XU Z, et al. Effect of combined enzyme and ultrasound treatment on the structure and gel properties of soy protein isolate: a comparative study of alkaline protease and pepsin[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2024, 687: 133533.
[38] 李杨, 马召蕾, 郑丽, 等. 超声联合酶处理下TG 酶交联大豆分离蛋白凝胶特性研究[J]. 农业机械学报, 2022, 53(4):394-402.LI Y, MA Z L, ZHENG L, et al. Effect of ultrasonic combined with enzyme treatment on glutaminetransaminase cross-linked soybean protein lsolate gels[J]. Transactions of the Chinese Society for Agricultural Machinery, 2022, 53(4): 394-402.
[39] GUAN H, DIAO X, JIANG F, et al. The enzymatic hydrolysis of soy protein isolate by Corolase PP under high hydrostatic pressure and its effect on bioactivity and characteristics of hydrolysates[J]. Food Chemistry, 2018, 245: 89-96.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。