藜麦原产于南美洲的安第斯山区,由于其独特的营养价值和耐旱、耐寒、耐盐碱等生理特性,目前已广泛种植在欧洲、非洲和亚洲等大陆[1]。藜麦籽粒通常含有皂苷,是其中苦味的主要来源。藜麦皂苷含量因品种、气候和栽培环境不同而呈现出差异,由于皂苷具有抗病和免受鸟、昆虫取食的作用,因此国内外栽培的藜麦均以“苦藜麦”品种为主,皂苷含量通常在2%~5%之间[2]。
藜麦皂苷是由一个三萜苷元和1~3 个不同糖链组成的五环三萜化合物,其中种类最多的是双糖链皂苷,其次为单糖链皂苷,而三糖链皂苷则比较少见[3]。藜麦皂苷元母核含有5 个六元环、30个碳原子,苷元母核上C23、C27 和C30 可以连接不同的取代基,进而引起苷元结构的多样化;糖基侧链主要与三萜苷元在C3 和C28 位置上相连形成单糖链或双糖链皂苷化合物,其中在C3 位置以糖苷键相连,而在C28 位置则以酯键相连。若形成三糖链皂苷化合物,则糖基侧链与C23 以糖苷键相连。构成藜麦皂苷元的化合物主要有齐墩果酸、常春藤苷元、美商陆酸、塞战藤酸等7 种[4] (图1 和表1),其中R1、R2、R3 基团决定皂苷元的结构,而R4 和R5 基团则决定糖基侧链的结构。虽然藜麦皂苷元的结构目前主要报道了7 种类型,但不同糖基侧链与皂苷元之间的组合决定了藜麦皂苷结构具有多样性。迄今为止,已经报道的藜麦皂苷有90 多种[4]。
表1 藜麦皂苷元类型[4]
Table 1 Types of quinoa saponins[4]
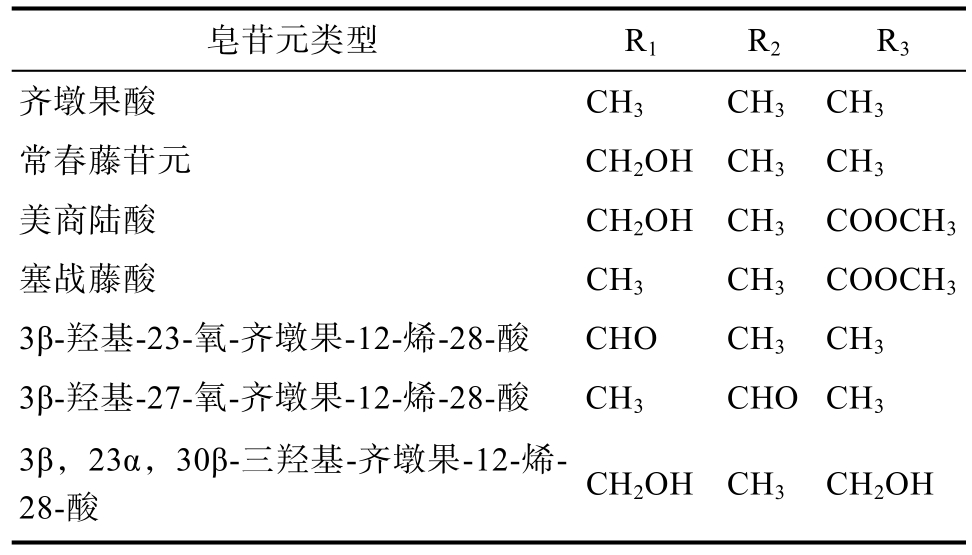
皂苷元类型 R1 R2 R3齐墩果酸 CH3 CH3 CH3常春藤苷元 CH2OH CH3 CH3美商陆酸 CH2OH CH3 COOCH3塞战藤酸 CH3 CH3 COOCH3 3β-羟基-23-氧-齐墩果-12-烯-28-酸 CHO CH3 CH3 3β-羟基-27-氧-齐墩果-12-烯-28-酸 CH3 CHO CH3 3β,23α,30β-三羟基-齐墩果-12-烯-28-酸 CH2OH CH3 CH2OH
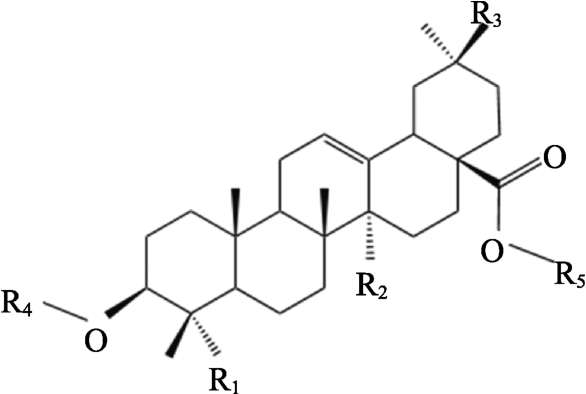
图1 藜麦皂苷的化学结构[4]
Fig.1 Chemical structure of quinoa saponins[4]
藜麦皂苷在食品、制药和化妆品等行业有广泛的商业用途[5-6]。对于以藜麦总皂苷为化学成分的产品而言,只需要除去皂苷以外的非皂苷成分即可完成纯化;而对于皂苷构效关系的研究,则需要明晰单体皂苷结构与生物活性之间的关系,这就涉及不同单体皂苷的分离问题。虽然藜麦皂苷的分离纯化可以借鉴其他植物中三萜皂苷的分离纯化方法,但与其他常见三萜皂苷相比,藜麦皂苷具有种类繁多、分离纯化难度高等特点。加之藜麦是我国2011 年才正式引种的作物新品种,在藜麦皂苷分离纯化方面的技术积累较少。为了推动相关研究,本文全面综述了国内外关于藜麦皂苷纯化、单体分离方面的研究进展,并结合作者的实验经验,提出了改进建议。
2 藜麦皂苷的纯化方法
藜麦皂苷是由不同皂苷元与相同或不同糖链构成的一系列性质较为接近的五环三萜化合物,所提取的全部皂苷称之为总皂苷。在以总皂苷为产品的加工过程中,为了降低成本和提高效率往往不涉及皂苷单体之间的分离,只需要除去皂苷以外的非皂苷成分即可达到纯化目的。由于藜麦皂苷是极性较强的齐墩果烷类五环三萜化合物,在采用醇-水溶液提取过程中不仅会受到酚酸类、黄酮类等极性较强化合物的干扰,也会受到脂类、香豆素、游离生物碱等极性较弱化合物的影响。因此,藜麦总皂苷在提取完成后,需要去除上述非皂苷成分。常用的纯化方法主要有正丁醇-水溶液萃取、大孔树脂纯化、C18 色谱柱纯化、HPLC 系统纯化、皂苷泡沫收集纯化和超滤纯化等。
2.1 正丁醇-水溶液萃取纯化法
依据藜麦原料是否需要脱脂以及脱脂、提取、萃取顺序的不同,此类操作方法可以分为以下4 种。
2.1.1 藜麦原料脱脂-醇提-正丁醇萃取纯化法
藜麦原料脱脂后再进行醇提取属于常规操作流程,在脱脂过程中乙醚是常用溶剂。全籽藜麦经乙醚脱脂6 h 后滤去脱脂液,再用80%(v/v)甲醇水溶液提取皂苷4 h,过滤、蒸发、干燥得到皂苷固体粉末。将皂苷粉末溶于正丁醇-乙醇-水溶剂中(1∶1∶1,v/v/v),用氧化铝柱吸附色素,减压浓缩、真空冷冻干燥后得到藜麦皂苷粉末,纯度78.8%[7]。
氯仿和石油醚也可用作藜麦原料的脱脂溶剂[5,8]。研磨的藜麦粉与沙子混合后加入氯仿脱脂16 h,使脂类物质溶入氯仿。然后加甲醇继续提取30 h,减压蒸干得到皂苷粉末。芦晓芳等[5]将藜麦粉置于石油醚中浸泡过夜,反复2~3 次至石油醚溶液呈无色为止。藜麦粉用70%(v/v)乙醇水溶液在40 ℃条件下超声提取20 min,蒸发乙醇得到皂苷粗提物。粗皂苷经甲醇溶解、正丁醇水饱和溶液萃取,旋蒸冷却后得到藜麦皂苷的析出物。
虽然乙醚、氯仿和石油醚均可用于藜麦原料脱脂,但在实际应用中应从脱脂效率、回收成本以及安全性三个方面加以选择。由于乙醚沸点(34.5 ℃)较低且安全性差,目前应用较少。
2.1.2 藜麦原料醇提-脱脂-正丁醇萃取纯化法
Herrera 等[9]将藜麦种子粉放入1∶10(w/v)甲醇溶液中,在超声波辅助下提取15 min。离心分离上清液,真空浓缩后加入等体积的己烷脱脂,正丁醇连续萃取3 次,真空浓缩得到藜麦皂苷。Dong 等[10]将藜麦粉用75%(v/v)乙醇水溶液在超声波辅助下连续提取两次。将两批提取液合并,60 ℃旋转蒸发除去乙醇。浓缩液依次用石油醚、乙酸乙酯和正丁醇提取3 次。合并正丁醇萃取层,在蒸发皿中蒸发得到干燥的粗皂苷粉。乙酸乙酯萃取可以脱除中等极性的有机酸、黄酮、香豆素、游离生物碱等物质,有利于提高皂苷纯度[11]。与藜麦原料脱脂相比,醇提后再进行脱脂属于液液萃取操作,避免了液固萃取的相转移过程,故脱脂效率提高。
2.1.3 正丁醇萃取后再脱脂的纯化方法
Dini 等[12]将脱脂操作放在了正丁醇萃取之后。这种操作与原料脱脂相比有两个好处:(1)藜麦原料中的皂苷经过提取、萃取浓缩后,其体积与原材料相比有了很大的缩减,故脱脂操作更容易进行,且节省溶剂;(2)可以验证脱脂操作的必要性。如果最后一步脱脂操作只得到很少的脂肪,则表明脱脂操作可以省略,预先进行脱脂操作没有必要。
2.1.4 省略脱脂步骤的正丁醇萃取纯化方法
Xue 等[13]则省略了藜麦糠原料的脱脂步骤,直接采用 30 ℃的水在超声辅助下提取皂苷。Madl 等[14]则直接用50%(v/v)乙醇水溶液提取藜麦种皮皂苷,正丁醇萃取后离心、冻干,得到淡黄色的藜麦皂苷,提取产率9.2%。实践证明,当提取溶剂极性较高时,例如采用水提取或浓度较低的醇溶液提取时,脂肪溶出度并不高,故脱脂步骤通常可以省略。
2.2 D101 型大孔树脂纯化藜麦皂苷
大孔树脂是分离纯化皂苷类化合物的所常用的层析材料。根据其吸附性质,可以分为强极性、极性、中极性、弱极性和非极性5 种类型。典型的大孔树脂纯化皂苷的特性列于表2。
表2 代表性大孔树脂纯化皂苷的性能
Table 2 Physical and chemical properties of representative macroporous resins
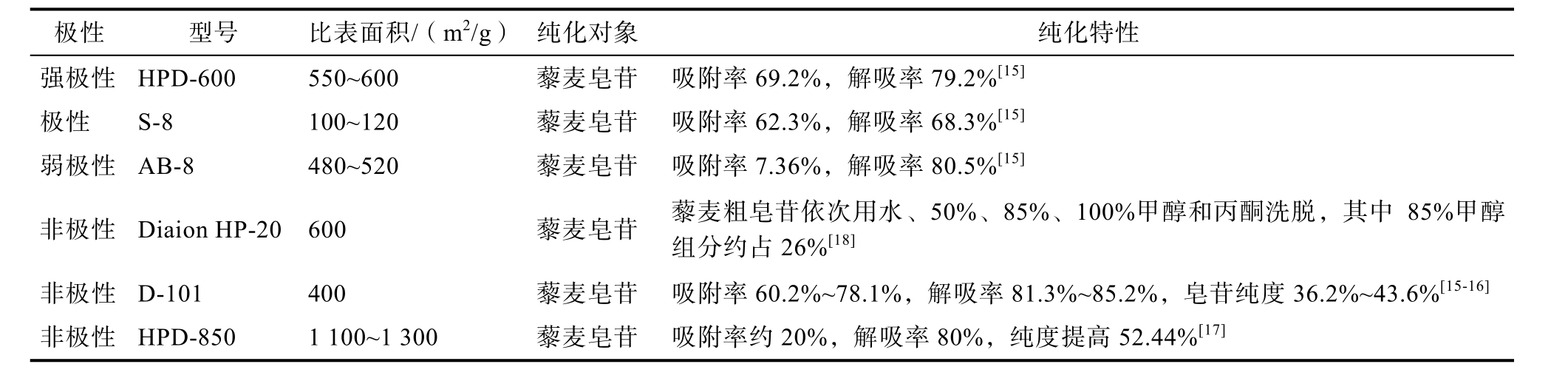
极性 型号 比表面积/(m2/g) 纯化对象纯化特性强极性 HPD-600 550~600 藜麦皂苷 吸附率69.2%,解吸率79.2%[15]极性 S-8 100~120 藜麦皂苷 吸附率62.3%,解吸率68.3%[15]弱极性 AB-8 480~520 藜麦皂苷 吸附率7.36%,解吸率80.5%[15]非极性 Diaion HP-20 600 藜麦皂苷 藜麦粗皂苷依次用水、50%、85%、100%甲醇和丙酮洗脱,其中85%甲醇组分约占26%[18]非极性 D-101 400 藜麦皂苷 吸附率60.2%~78.1%,解吸率81.3%~85.2%,皂苷纯度36.2%~43.6%[15-16]非极性 HPD-850 1 100~1 300 藜麦皂苷 吸附率约20%,解吸率80%,纯度提高52.44%[17]
赵文婷[15]研究发现,D101 型大孔树脂对藜麦皂苷的静态吸附率和解吸率明显高于HPD-600、S-8、AB-8 型大孔树脂。因此,可以选择D101型大孔树脂纯化藜麦皂苷。根据国内研究的结果,经D101 型大孔树脂纯化后,皂苷含量在36.2%~43.6%之间[15-16],纯化效果并不理想。雷蕾[17]通过静态吸附实验发现,藜麦皂苷是一种弱极性的化合物,在极性较弱的HPD-850 型树脂上吸附、解吸性能良好。因此,HPD-850 型树脂适合用于皂苷纯化。与纯化前相比,藜麦皂苷纯度提高了52.44%。
2.3 C18 色谱柱纯化皂苷
藜麦粉经甲醇提取、减压蒸发干燥后得到粗藜麦皂苷粉。粗皂苷粉溶于水中,加己烷振摇脱脂。脱脂后的皂苷用C18 色谱柱(BakerElut)纯化,依次经水和甲醇洗脱,得到纯度较高的皂苷[19]。最近的研究表明,Sepax GP-C18 色谱柱对藜麦皂苷的纯化效果更佳。藜麦皂苷粗品经大孔树脂D101 纯化、Sepax GP-C18 色谱柱分离后,藜麦皂苷的纯度达到90%[20]。
2.4 HPLC 系统纯化皂苷
HPLC 系统配备 Eclipse XDB-C18 色谱柱(4.6 mm×150 mm,5 μm)可以对藜麦粗皂苷进行纯化。采用0.1%(v/v)甲酸水溶液(A)和乙腈(B)两种流动相进行梯度洗脱,在前12 min内流动相的流速为0.7 mL/min,两种流动相的比例(A∶B)由75∶25(v/v)逐步调整为65∶35(v/v)。接下来流动相的流速继续保持0.7 mL/min,A 与B 的比例调整为55∶45(v/v)。运行25 min 后流速调整为1.0 mL/min,等度洗脱30 min。分离得到的皂苷纯度78% (w/w) [21]。
2.5 泡沫收集法纯化藜麦总皂苷
根据藜麦皂苷容易起泡沫的特性,通过收集藜麦皂苷溶液的泡沫能够达到纯化皂苷的目的[22]。该方法首先将藜麦种皮粉与水配成1∶10(w/v)的悬浮液,在超声波辅助下提取1 h,静置、过滤、稀释后将皂苷提取液送入泡沫分离塔。塔的底部通入压缩空气,藜麦皂苷溶液在空气气泡的扰动下产生泡沫并逐渐向上移动,至塔的顶端通过弯管引出。实验结果表明,在适宜条件下藜麦皂苷富集比为2.0~2.6,回收率为42%~52%。该方法虽然操作简单,但对起泡物质均能收集,故存在选择性不强的问题。此外,当皂苷浓度降低时起泡性能下降,导致溶液中剩余皂苷回收不完全。
2.6 超滤法纯化皂苷
超滤是一种基于分子尺寸而设计的过滤排除技术,它可以在没有相变或无需添加化学试剂的情况下,通过孔隙排阻原理去除蛋白质、多糖、内毒素和聚集体等大分子物质,然后采用较小孔径的超滤膜将皂苷分子截留而使水分排除,从而实现皂苷的浓缩纯化。Li 等[23]研究表明,人参皂苷的分子量约为1 000 Da,采用100 kDa 的超滤膜可以截留溶液中的蛋白质、聚集体等大分子物质,而人参皂苷分子则可以顺利通过膜孔进入超滤液。此后超滤液改用膜孔为3 kDa 的聚醚砜中空纤维膜或膜孔为5 kDa 的再生醋酸纤维素膜对皂苷分子进行截留,脱除80%水分后,两种超滤膜处理后的人参皂苷 Rb1 含量由浓缩前的20.8 mg/g 分别提高到25.3 mg/g 和37.2 mg/g[24],起到了一定的浓缩纯化作用。此外,与水溶液中相比,乙醇可以提高皂苷在超滤膜中的透过滤,这个问题需要引起重视。
目前采用超滤法纯化藜麦皂苷尚未见文献报道,但由于藜麦皂苷分子量与人参皂苷接近(表3),故相关经验可以借鉴。
表3 正丁醇萃取水相中分离出的6 种藜麦皂苷化合物
Table 3 Six quinoa saponin compounds separated from water phase after n-butanol partition

皂苷产物序号皂苷元名称 分子式 分子量化合物1 Phytolaccagenic acid C48H74O21985化合物2 Spergulagenic acid C54H86O241 117化合物3 Hederagenin C48H70O20927化合物4 Phytolaccagenic acid C55H88O261 163化合物5 Hederagenin C54H88O241 119化合物6 Spergulagenic acid C48H74O20969
3 藜麦皂苷单体的分离方法
藜麦总皂苷是由一系列理化性质相近的五环三萜化合物组成的混合物,因此皂苷单体分离比较困难。截至目前,藜麦皂苷单体的分离方法主要为色谱柱分离法,而以生物活性为导向的分离方法非常值得尝试。
3.1 色谱柱分离藜麦皂苷单体的方法
采用色谱柱分离藜麦皂苷单体应关注两个方面的技术问题,一是色谱柱种类的选择,二是洗脱条件的优化。目前使用最多的色谱柱有LiChrospher硅胶柱、Sephadex LH-20 色谱柱、DIAION HP-20色谱柱以及与其它柱相组合的联合分离。
3.1.1 LiChrospher 硅胶柱色谱柱分离藜麦皂苷
Ruales 等[25]采用高效液相色谱仪对藜麦皂苷进行了分离。色谱柱(4 mm×250 mm)内填充硅胶LiChrospher100 CH-8/2(5 μm),配备紫外检测器和积分器,检测波长为 200 nm。进样量20 μL,洗脱剂为25%~40%的乙腈水溶液,流速2.0 mL/min,梯度洗脱15 min 得到皂苷A 和B 两个主要组份,其化学结构见图2。由于皂苷A 和B 的保留时间分别为7.04 min 和12.53 min,故分离效果较好。
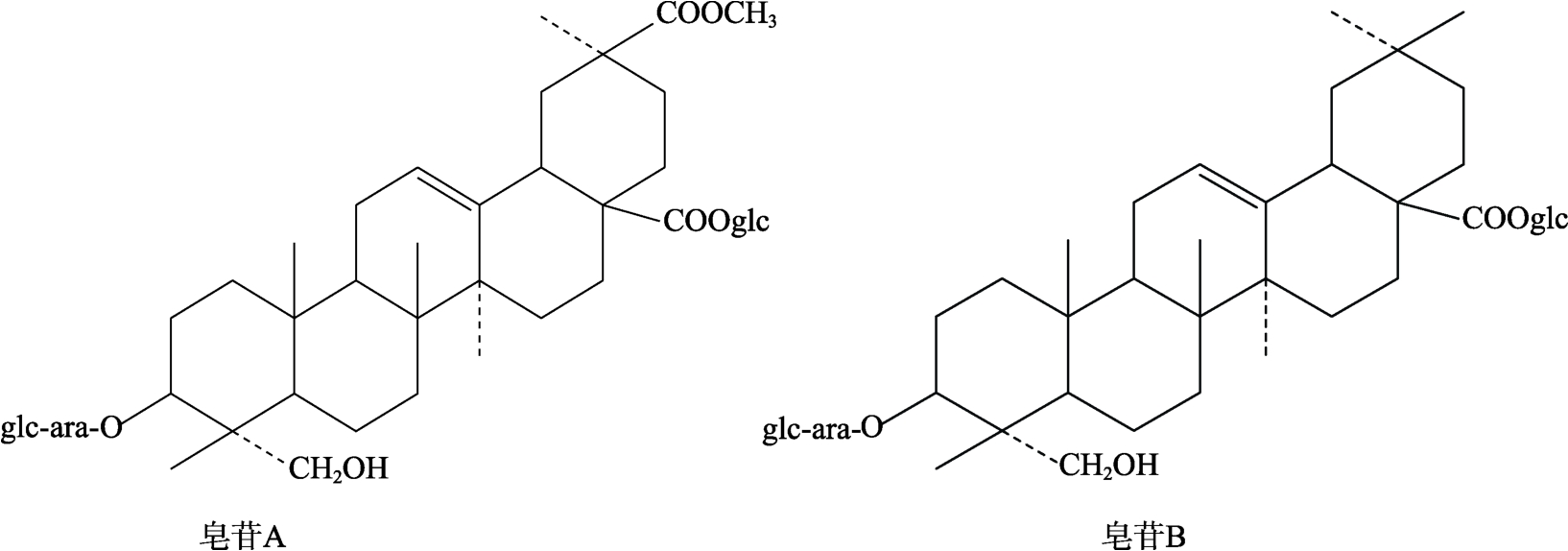
图2 藜麦皂苷A 和B 的化学结构
Fig.2 Chemical structure of quinoa saponins A and B
3.1.2 Sephadex LH-20 色谱柱分离藜麦皂苷单体
Sephadex LH-20 色谱柱填充的吸附剂为羟丙基化的葡聚糖凝胶,既有亲水性又有亲脂性,且同时具备分子排阻色谱和分配色谱的优点。Dini等[12]采用甲醇提取藜麦皂苷后,提取物经正丁醇-水体系分配萃取、氯仿脱脂后,采用SephadexLH-20 色谱柱(100 cm×5 cm)对皂苷进行分离,甲醇为洗脱液。洗脱流出物中的皂苷用薄层色谱检验,展开剂为正丁醇-醋酸-水(60∶15∶25),含粗皂苷的混合物进一步以液滴逆流色谱柱(Droplet counter-current chromatography,DCCC)纯化。DCCC 流出组份用反相高效液相色谱分离,得到7 个纯皂苷化合物。
Dini 等[26]发现,皂苷提取物经过正丁醇-水分配萃取后,水相中也存在一些极性强的新皂苷,将水相真空浓缩,然后用Sephadex LH-20 色谱柱分离。合并皂苷流出液进一步以反相高效液相色谱分离,得到6 种纯皂苷化合物,保留时间分别为4.4、5.0、6.8、14.2、28.8、50.8 min(表3)。
3.1.3 DIAION HP-20 组合色谱柱分离法
Diaion HP-20 属于大孔吸附树脂,具有吸附性能强、容易再生等优点。Verza 等[27]采用超临界溶剂提取藜麦皂苷后,经过Diaion HP 20 柱进行分离纯化,得到FQ70 和FQ90 两个组分,产率分别为15.6%和5.0%。这两种组分由10 种皂苷元组成,且均为双糖链皂苷。Zhu 等[28]采用正丁醇萃取藜麦皂苷后,用Diaion HP-20 凝胶色谱柱分离,依次用纯水、水:乙醇(3∶7,v/v)、水:乙醇(1∶9,v/v)和丙酮洗脱得到4 个组分,其中水:乙醇(3∶7,v/v)洗脱的组分用Sephadex LH-20 色谱柱进一步分离,以90%乙醇洗脱又得到7 个组份(A1~A7);组分A1 采用RP-18 柱(反相C18 色谱柱)分离,甲醇:水(2∶1,v/v)溶液洗脱得到化合物3。经过核磁共振和质谱分析,这些皂苷组份的化学结构得以确定。
近年来,采用Diaion HP 20 柱分离藜麦皂苷的报道较少。但作为一种有效的分离手段,国外学者已成功利用Diaion HP 20 柱对藜麦糠和种子皂苷进行了分离纯化[18,27-28],因此,国内学者应予以重视。
3.1.4 液质联用分离鉴定技术
如果皂苷单体分离的目的只是用于鉴定结构而不是为了获得一定数量的单体物质,则采用液质联用分离鉴定技术最为方便。Gómez-Caravaca等[29]采用含有0.1%(w/v)乙酸的甲醇水溶液(4∶1,v/v)提取藜麦粉中皂苷等极性物质,减压蒸干后溶解于少量甲醇溶液(1∶1,v/v),用0.22 μm滤膜过滤。样品首先进行高效液相色谱分离,色谱柱为熔芯柱Kinetex C18 (100 mm×4.6 mm,填料粒径2.6 μm)。分离的皂苷单体经过电喷雾电离、飞行时间质谱仪检测,得到12 种皂苷化合物。通过这样的研究手段,可以让研究人员快速了解藜麦原料中的皂苷类型。
3.2 以生物活性为导向的皂苷单体分离方法
全面分离藜麦总皂苷中的各个单体不仅工作量很大,而且由于部分皂苷单体可能缺乏特定的生物活性,其结果反而不利于构效关系研究。如果以某种生物活性作为皂苷单体分离的指导原则,就可以确定分离过程中皂苷活性成分所在的部位或流分,从而定向地获得具有特定生物活性的藜麦皂苷单体[30]。这样的分离操作成本低、效率高,具体分离操作步骤可以参考以下流程:(1)藜麦粉用不同极性的溶剂提取,冷冻干燥后得到粗皂苷粉;(2)将粗皂苷粉溶于水,用正丁醇萃取;(3)收集正丁醇萃取后的有机相和水相,旋转蒸发后冷冻干燥,得到相应的藜麦皂苷粗品;(4)对上述藜麦皂苷粗品进行生物活性测试;(5)选择活性高的组分进行色谱柱纯化,液-质联用技术鉴定藜麦皂苷结构。
目前,以生物活性为导向的藜麦皂苷分离尚未见文献报道,但可以借鉴甾体皂苷[30]、三萜皂苷[31]的等定向分离经验制定出合理的分离方案。该方法能实现化学分离与活性分离的同步进行,通过追踪目标化合物的方法提高分离效率。
4 结论
藜麦皂苷具有重要的生理和药理活性,其分离纯化具有重要的理论意义和应用价值。藜麦皂苷纯化方法主要有正丁醇-水溶液萃取、大孔树脂纯化、C18 色谱柱纯化、HPLC 系统纯化、泡沫收集纯化和超滤浓缩纯化等,其中正丁醇-水溶液萃取法得到了广泛应用,从实际效果来看,脱脂可以放在正丁醇萃取之后进行,或者直接省略脱脂步骤。在大孔树脂纯化过程中,树脂的极性与纯化效果有关,但二者的关系尚有待于进一步验证。皂苷泡沫收集纯化选择性不高,故纯化作用有限,而超滤浓缩法理论依据充分,值得在藜麦皂苷纯化中加以尝试。LiChrospher 硅胶柱、Sephadex LH-20 色谱柱和DIAION HP-20 组合色谱柱在藜麦皂苷分离中有重要作用。液-质联用分离鉴定技术在皂苷结构解析方面具有优势,适用于快速了解藜麦皂苷的结构类型。由于藜麦皂苷的生物活性与其化学结构密切相关,因此,以生物活性为导向的藜麦皂苷单体分离方法能极大地提高研究效率,下一步,可加大力度开展此类研究。
[1] CHAUDHARY N, WALIA S, KUMAR R. Functional composition,physiological effect and agronomy of future food quinoa(Chenopodium quinoa Willd.): A review[J]. Journal of Food Composition and Analysis, 2023, 118: 105192.
[2] MEDINA-MEZA I G, ALUWI N A, SAUNDERS S R, et al.GC-MS profiling of triterpenoid saponins from 28 quinoa varieties (Chenopodium quinoa Willd.) grown in Washington State[J]. Journal of Agricultural and Food Chemistry, 2016,64(45): 8583-8591.
[3] COLSON E, SAVARINO P, CLAEREBOUDT E J S, et al.Enhancing the membranolytic activity of Chenopodium quinoa saponins by fast microwave hydrolysis[J]. Molecules, 2020,25(1731): 2-20.
[4] SCHMÖCKEL S M. The quinoa genome[M]. Switzerland:Springer Nature Switzerland AG, 2021.
[5] 芦晓芳, 唐雨薇, 高春艳, 等. 超声负压法提取藜麦皂苷及其活性研究[J]. 天然产物研究与开发, 2022, 34(3): 465-472.LU X F, TANG Y W, GAO C Y, et al. Study on extraction of quinoa saponins by ultrasonic negative pressure method and its activity[J]. Natural Product Research and Development, 2022,34(3): 465-472.
[6] JUREK I, GÓRAL I, GĘSIŃSKIC K, et al. Effect of saponins from quinoa on a skin-mimetic lipid monolayer containing cholesterol[J]. Steroids, 2019, 147: 52-57.
[7] ESCRIBANO J, CABANES J, JIMÉNEZ-ATIÉNZAR M, et al.Characterization of betalains, saponins and antioxidant power in differently[J]. Food Chemistry, 2017, 234: 285-294.
[8] SANTIS G D, MADDALUNO C, D’AMBROSIO T, et al.Characterisation of quinoa (Chenopodium quinoa Willd.)accessions for the saponin content in Mediterranean environment[J].Italian Journal of Agronomy, 2016, 11(4): 277-281.
[9] HERRERA T, HIERRO J N D, FORNARI T, et al. Acid hydrolysis of saponin-rich extracts of quinoa, lentil, fenugreek and soybean to yield sapogenin-rich extracts and other bioactive compounds[J]. Journal of the Science of Food and Agriculture,2019, 99: 3157-3167.
[10] DONG S, YANG X, ZHAO L, et al. Antibacterial activity and mechanism of action saponins from Chenopodium quinoa Willd.husks against foodborne pathogenic bacteria[J]. Industrial Crops and Products, 2020, 149: 112350.
[11] 杜静婷. 藜麦种皮皂苷的提取、纯化、抗氧化、抑菌及皂苷元成分鉴定[D]. 太原: 山西大学, 2017.DU J T, Extraction, purification, antioxidant and antimicrobial of saponin in (Chenopodium quinoa Willd.) seed coat and component identification of aglycone[D]. Taiyuan: Shanxi University, 2017.
[12] DINI I, TENORE G C, DINI A. Oleanane saponins in“Kancolla”, a sweet variety of Chenopodium quinoa[J]. Journal of Natural Products, 2002, 65(7): 1023-1026.
[13] XUE P, ZHAO L, WANG Y, et al. Reducing the damage of quinoa saponins on human gastric mucosal cells by a heating process[J]. Food Science & Nutrition, 2020, 8: 500-510.
[14] MADL T, STERK H, MITTELBACH M, et al. Tandem mass spectrometric analysis of a complex triterpene saponin mixture of Chenopodium quinoa[J]. Journal of the American Society Mass Spectrometry, 2006, 17(6): 795-806.
[15] 赵文婷. 藜麦麸皮总皂苷的提取纯化及其抗氧化和免疫增强作用[D]. 晋中:山西农业大学, 2015.ZHAO W T. The Extraction, purification, antioxidant and immunoenhancement in (Chenopodium Quinoa Willd.) bran total saponins[D]. Jinzhong: Shanxi Agricultural University, 2015.
[16] 徐晓敏. 藜麦皂苷的提取、分离纯化及生物活性研究[D]. 呼和浩特: 内蒙古农业大学, 2017.XU X M. Studies on extraction, separation, purification and biological activity of Chenopodium Quinoa saponins[D].Hohhot: Inner Mongolia Agricultural University, 2017.
[17] 雷蕾. 藜麦皂苷的分离纯化及皂苷元的制备研究[D]. 西宁:青海师范大学, 2019.LEI L. Separation and purification of saponins and preparation of sapogenins from (Chenopodium quinoa Willd.)[D]. Xining:Qinghai Normal University. 2019.
[18] MIZUI F, KASAI R, OHTANI K, et al. Saponins from bran of quinoa, Chenopodium quinoa Willd. II.[J]. Chemical and Pharmaceutical Bulletin, 1990, 38(2): 375-377.
[19] NG K G, PRICE K R, FENWICK G R. A TLC method for the analysis of quinoa (Chenopodium quinoa) saponins[J]. Food Chemistry, 1994, 49: 311-315.
[20] 商海军. 藜麦皂苷的提取分离及其抗结肠癌作用研究[D]. 合肥: 合肥工业大学, 2022.SHANG H J. Study on extraction and isolation of saponins from Chenopodium quinoa and its anti-colon cancer effect[D]. Hefei:Hefei University of Technology, 2022.
[21] QUISPE-FUENTES I, VEGA-GÁLVEZ A, MIRANDA M, et al.A kinetic approach to saponin extraction during washing of quinoa (Chenopodium quinoa Willd.) seeds[J]. Journal of Food Process Engineering, 2013, 36(2): 202-210.
[22] 熊成文, 逯雯洁, 孙春艳. 一种藜麦皂苷的分离方法和泡沫分离装置[P]. 中国: 201910537739.9, 2019-06-20.XIONG C W, LU W J, SUN C Y. A kind of separation method of quinoa saponins and foam separation device[P]. China:201910537739.9, 2019-06-20.
[23] LI D, LI Z, PENG F, et al. Ultrafiltration process yield study on aqueous solution of total ginsenosides[J]. Natural Product Communications, 2022, 17(5): 1-7.
[24] SEOL S Y, KIM B R, HONG S C, et al. The effective preparation of protopanaxadiol saponin enriched fraction from ginseng using the ultrafiltration[J]. Natural Product Sciences,2014, 20(1): 58-64.
[25] RUALES J, NAIR B M. Saponins, phytic acid, tannins and protease inhibitors in quinoa (Chenopodium quinoa Willd)seeds[J]. Food Chemistry, 1993, 48(2): 137-143.
[26] DINI I, TENORE G C, SCHETTINO O, et al. New oleanane saponins in Chenopodium quinoa[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 3976-3981.
[27] VERZA S G, SILVEIRA F, CIBULSKI S, et al. Immunoadjuvant activity, toxicity assays, and determination by UPLC/Q-TOF-MS of triterpenic saponins from Chenopodium quinoa seeds[J].Journal of Agricultural and Food Chemistry, 2012, 60(12):3113-3118.
[28] ZHU N Q, SHENG S Q, SANG S M, et al. Triterpene saponins from debittered quinoa (Chenopodium quinoa) seeds[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 865-867.
[29] GÓMEZ-CARAVACA A M, SEGURA-CARRETERO A,FERNÁNDEZ- GUTIÉRREZ A, et al. Simultaneous determination of phenolic compounds and saponins in quinoa (Chenopodium quinoa Willd) by a liquid chromatography diode array detection-electrospray ionization-time-of-flight mass spectrometry methodology[J]. Journal of Agricultural and Food Chemistry,2011, 59(20): 10815-10825.
[30] WANG M Y, PENG Y, PENG C S, et al. The bioassay-guided isolation of antifungal saponins from Hosta plantaginea leaves[J].Journal of Asian Natural Products Research, 2017, 20(6):501-509.
[31] KARAKAS F P, ŞÖHRETOĞLU D, LIPTA T, et al. Isolation of an oleanane-type saponin active from Bellis perennis through antitumor bioassay-guided procedures[J]. Pharmaceutical Biology, 2014, 52(8): 951-955.