在自然界中,多糖广泛存在,不仅作为重要的能量储存形式,还是构成细胞骨架的关键组成部分,具有多样的功能特性。除了植物和藻类,微生物(如霉菌、酵母菌、细菌)也能合成多糖,且其具有环境适应性强、成本低廉和生物活性高的特点,相较于植物来源的多糖,有更广泛的应用前景[1]。
微生物多糖的存在形式主要包括胞外多糖(Exopoly saccharides,EPS)、胞内多糖(Intercellular polysaccharide,IPS)和胞壁多糖(Cellwall polysaccharide)。微生物产胞外多糖在安全、环保、健康、成本等方面都具有显著优势,良好的理化性质及诸多潜在的功能特性使其在诸多领域具有广阔发展前景[2]。但截至目前,人们对于微生物产胞外多糖的认识还较浅显,由于其结构的复杂性、合成成本高、功能特性不确定等因素的影响。因此,深入探索微生物产生胞外多糖的来源、生物合成机制及其功能活性的发挥非常必要。本文通过国内外微生物EPS 研究现状,着重探讨了其生物合成、结构修饰、功能特性及应用方面的相关内容,期望为微生物产生EPS 在食品、医疗、保健、生物等多个领域的研究开发提供更多的参考和指导。
1 微生物产EPS
EPS 作为微生物次生代谢的产物,在工业和科研中备受关注[3]。其因易提取的特性和良好的生物活性被广泛应用于制药、石油、化工和食品等领域,不仅提升产品质量,还为人类疾病的治疗提供新思路。
微生物产生EPS 包括乳杆菌、链球菌、明串珠菌、芽孢杆菌、酵母菌等(常见微生物产胞外多糖见表1),它们的结构、表型和生物学活性已被深入研究。
表1 常见微生物产胞外多糖
Table 1 Exopoly saccharides produced by common microorganisms

菌属 发酵菌株 多糖产物 作用效果/功能特性 应用前景乳杆菌属副干酪乳杆菌(Lacyobacillus paracasei) LPP-1、LPP-2 降血糖 为糖尿病治疗的药物研发提供了新的方向植物乳杆菌(Lacyobacillus plantarum) c-EPS、r-EPS 抗氧化作用、抗肿瘤 显著抗肿瘤医疗作用,在抗癌药物研发上提供新方向链球菌属 嗜热链球菌(Streptococcus thermophilus) EPS-1a、EPS-3a改善原料感官性状;抗氧化、抗肿瘤、具有免疫刺激活性能够赋予原料更好地气味,同时为医疗药物研发提供新导向肠膜明串珠菌(Leuconostoc mesenteroides) HDE1EPS 抗氧化性 作为天然食品添加剂改善食品的感官性状,并依托其抗氧化性可用于药物研发明串珠菌属可在食品中用作稳定剂、增稠剂、乳化剂;也可在医疗、化妆品行业发挥作用解淀粉芽孢杆菌(Leuconostoc citreum) B-2 EPS 乳化特性、抗氧化、促进益生菌生长柠檬明串珠菌(Bacillus amyloliquefaciens) SQ-2 EPS 具有良好的水溶性、粘性;抗氧化性能改善食品质地和流变学特性;并由于其较好的抗氧化性可用于医疗制药芽孢杆菌属 苏云金芽孢杆菌(Bacillus thuringiensi) RSK CAS4 EPS 具有良好的乳化活性;免疫调节功能可作为食品添加剂,并为新型药物研发提供材料胶红酵母酵母菌属(Rhodotorula mucilaginosa) RmEPS-11 抗氧化活性 可用于肝脏疾病治疗及镇痛的药物研究(Candida albicans) EPS2-1 抗氧化活性 基于其天然的抗氧化活性可用作新药研发白假丝酵母
然而,不同微生物种类导致EPS 的生物合成机制存在明显差异。受到相关酶种类和中间体转运的影响,EPS 的合成机制复杂多样,终产物结构存在较大差异。因此,深入了解EPS 的种类对EPS 的生物合成机制对于优化其生产工艺和应用至关重要。进一步,通过掌握EPS 的合成途径和调控机制,可以有针对性地提高其产量和品质,更好地满足工业和医药领域的需求。
2 胞外多糖分类
根据EPS 主链结构组成和生物合成机制及合成部位将其分为同多糖(Homopoly saccharide,HoPS)和杂多糖(Heteropoly saccharides,HePS)。
2.1 杂多糖(HePS)
HePS 合成机制复杂,主要由糖核苷酸、酰基供体、脂中间体、酶系统和糖基受体构成[4],分子量104~106 Da。其结构由2~8 种单糖构成,如D-葡萄糖、D-半乳糖和D-鼠李糖等,并可能含有其他单糖、磷酸、乙酰基等修饰[5]。深入研究HePS 有助于揭示微生物生长和代谢机制、探索生物技术应用、优化工业生产工艺。在食品工业中,HePS 可作为益生元,调节肠道菌群、增强免疫力,提升食品的营养价值和功能性。然而,高成本和合成过程的限制是当前应用中的挑战,需要进一步研究和技术创新解决。通过优化工艺、降低成本、改良菌株等手段,可以推动HePS在食品行业的更广泛应用。
2.2 同多糖(HoPS)
HoPS 作为乳酸菌(Lactic acid bacteria,LAB)产生的多糖,在食品行业具有广泛应用前景。其合成过程中,利用特定酶催化蔗糖水解生成单糖残基,然后连接到聚糖主链上。根据残基的不同来源,可分为含左旋糖和菊粉的果聚糖以及含α-葡聚糖及β-葡聚糖的葡聚糖[6]。这些多糖不仅调控细胞耐受性,还能提高益生菌在发酵剂培养物中的存活率。然而,在食品行业应用中,HoPS 仍存在生产成本高、合成过程限制以及稳定性等问题。解决这些问题的关键在于优化生产工艺、改良菌株以提高产量和稳定性,并深入研究其在食品中的相互作用,以推动其更广泛的应用。通过技术创新和研究进展,HoPS 有望为食品行业带来新的发展机遇。
EPS 的多样结构赋予其丰富的生物学功能。为获取具有特定功能的EPS,需要深入探究其生物合成机制。由于不同菌株合成相关基因簇的种类各异,EPS 的合成机制呈现出多样化特征。因此,深入了解EPS 的生物合成机制对于拓展其应用具有重要意义。
3 胞外多糖的生物合成
EPS 的生物合成受到相关基因簇的调控,其核苷酸序列和基因模块的变异性影响多酶系统的参与方式和EPS 的结构多样性。同一物种不同菌株可能具有不同的相关基因簇和EPS 特性。特别地,Wzx/Wzy 基因的功能分区使得产杂多糖的菌株的EPS 基因簇比产同多糖的菌株更为复杂,赋予了杂多糖合成更高的合成多样性[7-8]。这不仅揭示了EPS 合成的复杂性,还为进一步优化EPS 生产提供了重要基础。
3.1 杂多糖(HePS)的生物合成
参与反应的单糖在相应基因的调控下进入细胞质被活化,进一步完成内部连接和跨膜转运。随后,它们与糖核苷酸合成前体结合,形成核苷糖。通过特异性糖基转移酶的催化,依赖C53-P载体形成重复单元[9]。这些重复单元可能进一步聚合、延伸和输出,形成最终的HePS。尽管其基质尚未明确,但有研究表明该过程与Wzx/Wzy途径相关。具体的杂多糖生物合成机制见图1。

图1 杂多糖(HePS)生物合成机制[6]
Fig.1 Mechanism of heteropolysaccharide biosynthesis[6]
目前,对于HePS 的应用多用于乳制品,其可用作改善乳制品质地的发酵剂培养物,然而,由于它们的产量很低,很少有研究调查HePS 在谷物和烘焙行业中的应用。
3.2 同多糖(HoPS)的生物合成
HoPS 的合成发生于胞外,依托于具有胞外活性的相关酶及糖基供体,实现HoPS 的聚合并依托糖苷键供能实现转移[6]。同多糖生物合成机制见图2。
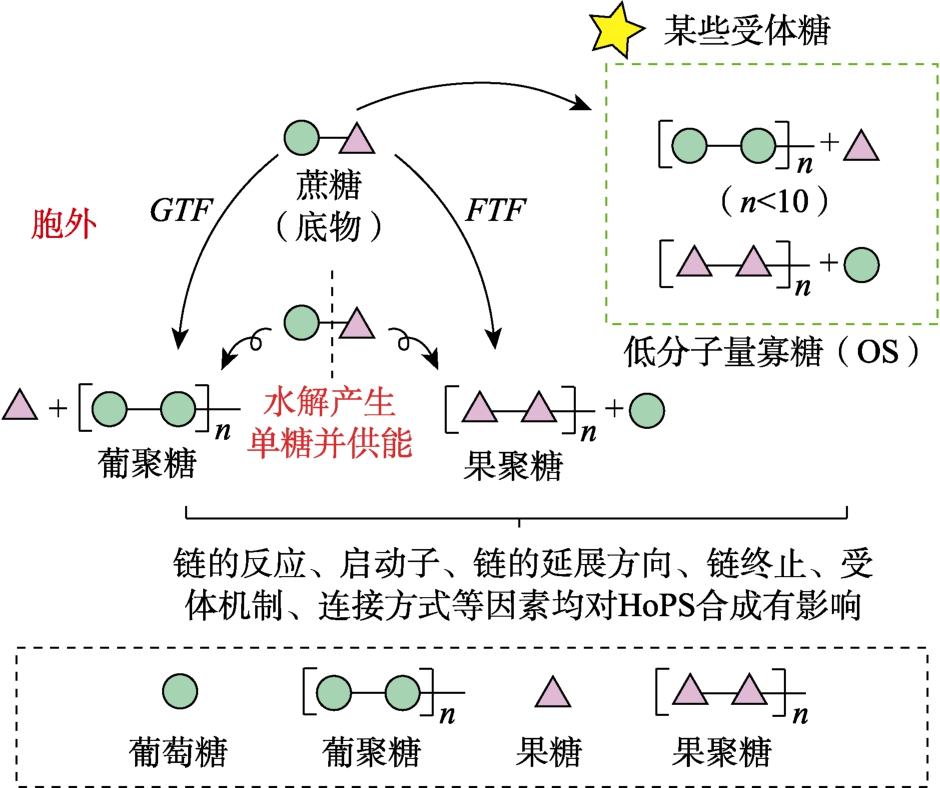
图2 同多糖(HoPS)生物合成机制[6]
Fig.2 Mechanism of isopolysaccharide biosynthesis[6]
而糖基供体中如蔗糖还可以在某些受体糖作用下形成低分子量寡糖(Oligosaccharide,OS)[9]。OS 的存在可减低EPS 产量。因而聚糖合成过程中链的反应、启动子、链的延展方向、链终止、受体机制、连接方式等因素都需要研究人员结合具体的研究需求进行把控,这也为EPS 在烘焙行业发酵的应用打下基础。
基于不同种类EPS 的合成机理,为获取更高产量及更丰富生物学活性EPS,除具有功能性的天然EPS 产物的提取外,人们进一步研究通过物理、化学、生物手段实现对EPS 的结构修饰,以添加或提高EPS 的性能。
微生物产生的胞外多糖结构复杂,合成机制因微生物种类而异,且与酶类和中间体转运等因素相关。因此,通过深入研究微生物合成胞外多糖的基因簇,可以更好地了解不同微生物的合成机制,从而优化生产工艺和提高产量。此外,还应探索EPS 合成途径与调控机制。通过探索微生物胞外多糖的合成途径和调控机制,有针对性地提高胞外多糖的产量和改良其功能性,促进其工业化应用。
同时,微生物胞外多糖的复杂结构和合成过程带来了生产成本的增加,也可通过优化微生物胞外多糖的生产工艺,包括菌株筛选、培养条件优化等,来降低生产成本,提高产量和纯度。
深入研究微生物胞外多糖的结构与功能的关联,可以揭示其生物学活性的机制,并在此基础上基于不同种类EPS 的合成机理,人们可通过物理、化学、生物手段实现对EPS 的结构修饰,以添加或提高EPS 的性能,获取更高产量及更丰富生物学活性EPS,为其工业化生产提供重要支持。
4 提高EPS 性能的方法
研究表明,并非所有EPS 都具有生物活性。一些微生物产生的EPS 生物学活性不高,可能与其单糖组成、糖苷键类型和官能团等结构因素有关[10]。通过结构修饰,可以赋予一些EPS 新的生物活性或增强其现有生物活性,这对医疗保健和食品行业的发展至关重要。
4.1 对EPS 进行物理修饰
超声波处理可实现EPS 的分解和降解,产生低分子量的代谢产物,这些产物往往具有更好的生物活性和生物利用度,从而为其在医药和保健品领域的应用提供了全新的机遇[11]。其次,超声波处理有助于改善多糖的分子结构和物理性质,如提高溶解度和降低粘度,这对于其在食品工业中的稳定性和加工性能至关重要[12]。此外,超声波还能促进EPS 与其他生物活性物质的结合,如蛋白质和抗氧化剂,进一步拓展了其应用领域。
4.2 对EPS 进行化学修饰
化学修饰为EPS 带来了更广泛的应用。通过引入不同的官能基或基团,可以调控EPS 的性质和功能[13]。乙酰化、磷酸化和磺化等修饰方式可以增强EPS 的活性,提高其水溶性和生物相容性。有研究发现,经过磷酸化、硫酸化和硒化修饰后的木蹄层孔菌胞外多糖的抗氧化活性明显增强此外,羧甲基化改善了EPS 的水溶性和抗氧化活性,并加强了免疫调节功能[14]。化学修饰为功能性食品、药物和生物材料的开发提供了技术支持,也拓展了EPS 在各个领域的应用范围,提升了其在生物体内的利用率。
4.3 对EPS 进行生物修饰
4.3.1 酶修饰
酶在EPS 修饰中发挥着重要作用,其高效性和专一性使得可以在不破坏多糖主体结构的情况下实现多糖的降解,并获得所需的分子片段。微生物多糖降解酶主要是糖苷酶,能够作用于EPS主链和侧链,从而改变EPS 的理化性质,影响其功能特性。有研究通过非洲大蜗牛消化道中分离出的混合酶实现催化紫球藻EPS 降解,并进一步证实其酶解产物综合抗氧化性增强[15]。但有些EPS 能够抵抗酶的降解,需要较温和的化学处理。
4.3.2 基因工程修饰
基因工程技术可将EPS 基因簇转入不产EPS的菌株使其获得生产EPS 的能力。如不产胞外多糖的Lc.lactis MG1360 可通过S.thermophilus Sfi6胞外多糖基因簇的转入获得了产胞外多糖的能力[16]。并可通过诱变处理,丰富单株菌株的EPS单元组成[17]。导入外源基因或通过调控现有相关基因也可实现对EPS 合成的控制。此外,研究者还可通过控制相应的菌株培养条件实现对部分EPS 的结构调控。
这些修饰技术有望解决食品行业面临的诸多问题,包括食品保质期的延长、口感的改善、营养价值的提升以及产品功能的增强。通过物理、化学和生物修饰,可以有效改善食品的稳定性,减少食品腐败和变质,延长产品的货架期限。同时,修饰后的胞外多糖还可以增强食品的口感和质地,提高产品的风味和口感体验。此外,通过调整多糖的结构和功能,可以增加食品的营养成分,提高其营养价值,满足消费者对健康食品的需求。总之,胞外多糖的修饰技术在未来有望为食品行业带来更多的创新和发展机遇。
5 EPS 的功能特性及应用
近年来,人们对微生物产EPS 的深入研究发现,EPS 具有益生元效应、抗氧化、抗肿瘤、降血脂、降压、免疫原调节等多种生物学功能,能够为人体健康带来可观的益处。同时,益生元的存在还将会反向影响提高EPS 产量[18]。
5.1 EPS 改善食品品质
EPS 多被用作非添加剂型商业食品胶投入食品生产,改善食品的质地和感官品质。在乳品行业中,LAB 产EPS 可作为稳定剂、增稠剂,通过蛋白质和胶束相互作用稳定乳制品成分结构,同时不同程度上提高终产品的黏稠度、质地甚至生物性能[19]。而在烘焙领域,部分EPS 可利用其多孔网状结构及其高分子量和较硬的链结构提高面团黏度和保水能力。同时,葡聚糖的存在可增大酵母面包体积,提高面包屑柔软度。部分EPS形成菌株还存在精氨酸代谢,能使面包具有更良好的风味。此外,低聚果糖的存在改善面团的流变学特性,提高面包质量,满足消费者对天然、健康产品的需求。
5.2 EPS 具有益生元效应及抑菌特性
EPS 的复杂结构赋予其益生元潜力。双歧杆菌和乳酸杆菌等菌株产生EPS 形成保护层,可提高益生菌在肠道中的定植和保护,并通过与肠道上皮细胞或树突细胞的交流调节肠道菌群,促进消化[20]。此外,EPS 还具有抗菌作用,影响生物膜合成或降解病原菌细胞壁,预防感染[21]。细胞外因子的产生可提高对胃肠道环境的抵抗力,增强免疫调节特性[22]。EPS 在调节肠道菌群、预防感染等方面具有重要应用价值,为维护肠道健康和提高免疫力提供了新途径。
5.3 EPS 免疫原活性及抗炎作用
微生物EPS 可通过增强细胞介导发挥免疫调节作用,提高炎症因子的基因表达水平而促进免疫细胞吞噬能力,增强免疫原活性,并在体外实验中得到证实[23-24]。EPS 免疫原活性及抗炎作用可能有助于解决免疫调节不足和炎症性疾病治疗等方面的实际问题。如:免疫功能失调、自身免疫性疾病、慢性炎症、过敏反应等。通过利用EPS的免疫调节和抗炎特性,可以开发新型的免疫调节剂和抗炎药物,为治疗这些疾病提供新的治疗途径。
5.4 抗氧化特性
自由基是人体老化和疾病的关键因素,导致细胞氧化损伤。某些LAB 产生的HePS 具有抗氧化能力,刺激体内抗氧化酶活性,减少自由基产生。研究表明,LPC-1 能抑制丙二醛(Malondialde hyde,MDA)合成,提高相关酶活性,增强机体抗氧化能力[25]。此外,EPS 可参与自由基清除和金属螯合,调节氧化应激反应,维持氧化还原平衡。在癌症领域,EPS 通过影响炎症因子表达和抑制肿瘤细胞增殖,展现抗癌潜力。研究显示,处理结肠癌细胞HT-29 的EPS 浓度与抑制肿瘤生长呈正相关[26]。这些发现为开发低副作用的天然抗肿瘤药物提供了新思路。
5.5 降低胆固醇的能力
人们目前对于EPS 降低胆固醇的确切机制尚不完全清楚,但经研究推测可能与其促进与胆固醇结合和代谢有关。通过刺激相关酶活性并促进微生物数目的增加,增加向胆汁的转化,实现降低胆汁水平[27]。
EPS 的多种生物学功能为其在食品和生物医药领域的应用提供了广阔的前景。在食品行业,EPS 作为益生元可促进肠道健康,改善消化系统功能,解决肠道菌群失调引起的问题。其抗氧化和抗炎作用有助于提高食品的品质和保质期,减少食品腐败和变质。此外,EPS 的抗肿瘤和降血脂、降压功能为开发功能性食品和药品提供了可能,有望应用于生物医药领域,用于预防和治疗相关疾病,如癌症、心血管疾病等。可见,EPS的多种生物学功能使其在食品和生物医药领域具有广阔的应用前景,有望为解决相关问题提供新的解决方案。
6 展望
微生物产胞外多糖在食品、医疗和生物领域展现出巨大潜力,但仍需克服挑战和深入探索。因此,我们应加强国内外合作与交流,与国际前沿研究机构合作,共享资源和数据,加速微生物胞外多糖的研究进程,提高研究水平,同时开展多学科合作研究。结合生物学、化学、工程等多个学科的研究方法,深入探索微生物胞外多糖的合成机制和功能活性,为其工业化应用提供更多的理论基础。
未来研究应聚焦于四个方面:首先,深入理解EPS 生物合成机制,包括不同菌株和EPS 类型的合成机制差异,以实现EPS 产量和品质的提高。其次,创新EPS 结构修饰技术,进一步探索新的修饰方法和技术,以精准调控EPS 结构,并在食品、医药和生物工程领域中发挥更广泛作用。第三,拓展EPS 在食品和医药领域的应用,重点关注EPS 在预防和治疗相关疾病方面的应用,以及与其他功能性成分的复合应用,提高其应用效果。最后,创新EPS 产业化生产技术,随着科学界对于菌种基因组或部分基因序列的不断破解,已知序列的获得为后续研究者提供了较多研究基础,可为进一步通过基因工程手段解决影响合成相关酶、改善育种等方面的难题,实现产量提升。进一步通过优化菌株、改良工艺来降低成本,实现EPS 的大规模生产和应用,推动EPS 产业的发展。
综上所述,EPS 作为重要生物活性物质,在食品、医药和生物工程领域有广阔发展前景。未来研究应致力于深入理解EPS 生物合成机制、创新EPS 结构修饰技术、拓展EPS 应用以及完善产业化生产技术,为人类健康和生活质量做出更大贡献。
[1] CHEN X X, YANG J, SHEN M Y, et al. Structure, function and advance application of microwave-treated polysaccharide: A review[J]. Trends in Food Science Technology, 2022, 123198-123209.
[2] JI X, HOU C, SHI M, et al. An insight into the research concerning panax ginseng c. a. meyer polysaccharides: a review[J].Food Reviews International, 2020, 38(6): 1-17.
[3] 王蓓蓓, 张伟, 周晓伦. 微生物胞外多糖的提取与应用研究进展[J]. 安徽农学通报, 2021, 27(18): 21-23.WANG B B, ZHANG W, ZHOU X L. Research progress in extraction and application of microbial exopolysaccharides[J].Anhui Agricultural Science Bulletin, 2021, 27(18): 21-23.
[4] 杨洁彬, 郭兴华. 乳酸菌——生物学基础及应用[M]. 北京:中国轻工业出版社, 1996: 1-3.YANG J B, GUO X H. Lactic acid bacteria: biological basis and application [M]. Beijing: China Light Industry Press, 1996: 1-3.
[5] RYAN P M, ROSS R P, FITZGERALD G F, et al. Sugarcoated:Exopolysaccharide producing lactic acid bacteria for food and human health applications[J]. Food & Fuction, 2015, 6(3):679-693.
[6] 熊永刚. 过表达引导糖基转移酶对Lactobacillus plantarum YM-4-3 胞外多糖合成的影响[D]. 昆明: 昆明理工大学, 2021:4-8.XIONG Y G. The effect of overexpression guided glycosyltransferase on the synthesis of Lactobacillus plantarum YM-4-3 exopolysaccharide[D]. Kunming: Kunming University of Science and Technology, 2021: 4-8.
[7] 赵波. 2 种糖基转移酶在植物乳杆菌YM 4-3 菌株胞外多糖生物合成中的分子调控机理研究[D]. 昆明: 昆明理工大学,2019: 4-8.ZHAO B. Molecular regulation mechanism of two glycosyltransferases in extracellular polysaccharide biosynthesis of Lactobacillus plantarum YM 4-3 strain[D]. Kunming: Kunming University of Science and Technology, 2019: 4-8.
[8] 司天昭. 引导糖基转移酶在植物乳杆菌YM-4-3 菌株胞外多糖生物合成中的分子调控机理研究[D]. 昆明: 昆明理工大学,2018: 6-9.SI T Z. Study on molecular regulation mechanism of guiding glycosyltransferase in extracellular polysaccharide biosynthesis of Lactobacillus plantarum YM-4-3 strain[D]. Kunming: Kunming University of Science and Technology, 2018: 6-9.
[9] KORAKLI M, VOGEL R F. Structure/function relationship of homopolysaccharide producing glycansucrases and therapeutic potential of their synthesised glycans[J]. Applied Microbiology& Biotechnology, 2006, 71(6): 790-803.
[10] 李清春, 张景强, 贺稚非. 乳酸菌胞外多糖的研究[J]. 电子科技大学学报, 2003, (6): 764-769.LI Q C, ZHANG J Q, HE Z F. Study on extracellular polysaccharide of lactic acid bacteria[J]. Journal of UESTC,2003, (6): 764-769.
[11] KLAUS-PETER S, NICOLE M, HERMANN S, et al. Structural properties of native and sonicated cinerean, a β-(1→3)(1→6)-dglucan produced by Botrytis cinerea[J]. Carbohydrate Research,1995, 266(1): 115-128.
[12] 刘梅, 陈必链, 陈伟平. 超声波降解紫球藻胞外多糖研究[J].亚热带植物科学, 2008, (1): 48-50.LIU M, CHEN B L, CHEN W P. Ultrasonic degradation of extracellular polysaccharide from Porphyridium cruentum[J].Subtropical Plant Science, 2008, (1): 48-50.
[13] LIU J, LUO J, YE H, et al. Preparation, antioxidant and antitumor activities in vitro of different derivatives of levan from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Food &Chemical Toxicology, 2012, 50(3-4): 767-772.
[14] 张嫱. 木蹄层孔菌胞外多糖的结构表征、化学修饰及生物活性研究[D]. 合肥: 合肥工业大学, 2022.ZHANG Q. Structural characterization, chemical modification and biological activity research on the exopolysaccharide of Streptococcus xylella[D]. Hefei: Hefei University of Technology,2022.
[15] 董乐, 何静艳, 郑婷婷, 等. 抗氧化紫球藻胞外多糖酶解物制备工艺优化[J]. 食品与机械, 2018, 34(5): 177-182.DONG L, HE J Y, ZHENG T T, et al. Optimization of the preparation process of antioxidant Porphyrococcus exopolysaccharide enzymatic hydrolyzate[J]. Food and Machinery, 2018, 34(5):177-182.
[16] STINGELE F, VINCENT S, FABER E J, et al. Introduction of the exopolysaccharide gene cluster from Streptococcus thermophilus Sfi6 into Lactococcus lactis MG1363: production and characterization of an altered polysaccharide[J]. Molecular Microbiology, 2010, 32(6): 1287-1295.
[17] 童良琴, 曲亚军, 陈敏. 乳酸菌胞外多糖的研究进展[J]. 中国生物工程杂志, 2015, 35(11): 85-91.TONG L Q, QU Y J, CHEN M. Research progress on lactic acid bacteria extracellular polysaccharides[J]. Chinese Journal of Bioengineering, 2015, 35(11): 85-91.
[18] 杨铭, 郭婷, 杜鸿宇, 等. 益生元对藏灵菇发酵乳细菌多样性和胞外多糖产量的影响[J]. 中国乳品工业, 2020, 48(1): 4-7+13.YANG M, GUO T, DU H Y, et al. Effects of prebiotics on bacterial diversity and extracellular polysaccharide yield in fermented milk of Tibetan mushroom[J]. China Dairy Industry,2020, 48(1): 4-7+13.
[19] DABA G M, ELNAHAS M O, ELKHATEEB W A.Contributions of exopolysaccharides from lactic acid bacteria as biotechnological tools in food, pharmaceutical, and medical applications[J]. International Journal of Biological Macromolecules,2021, 173(2): 1-11.
[20] CAGGIANIELLO G, KLEEREBEZEM M, SPANO G.Exopolysaccharides produced by lactic acid bacteria: from health-promoting benefits to stress tolerance mechanisms[J].Applied Microbiology & Biotechnology, 2016, 100(9): 3877-3886.
[21] 王烁, 姜静, 杜仁鹏, 等. 乳酸菌胞外多糖的生物合成、特性和应用[J]. 生物技术, 2022, 32(3): 394-401.WANG S, JIANG J, DU R P, et al. Biosynthesis, characterization and application of extracellular polysaccharide from Lactic acid bacteria[J]. Biotechnology, 2022, 32(3): 394-401.
[22] 于亚静. 可溶性胞外多糖PS202 的发酵动力学、分离纯化及其结构修饰的研究[D]. 南宁: 广西大学, 2007: 4-8.YU Y J. Study on fermentation kinetics, purification and structural modification of soluble extracellular polysaccharide PS202[D]. Nanning: Guangxi University, 2007: 4-8.
[23] HIDALGO-CANTABRANA C, PATRICIA L, GUEIMONDE M, et al. Immune modulation capability of exopolysaccharides synthesised by lactic acid bacteria and bifidobacteria[J].Probiotics & Antimicrobial Proteins, 2012, 4(4): 227-237.
[24] 郝敏, 李殿龙, 徐俊亭, 等. 黑木耳胞外多糖对小鼠肠道微生态及免疫调节的影响[J]. 中国食品学报, 2021, 21(3): 63-70.HAO M, LI D L, XU J T, et al. Effects of Auricularia auriculata extracellular polysaccharide on intestinal microecology and immune regulation in mice[J]. Chinese Food Sci, 2021, 21(3):63-70.
[25] KIERAN L, EMANUELE Z, AIDAN C, et al. Lactic acid bacteria exopolysaccharides in foods and beverages: isolation,properties, characterization, and health benefits[J]. Annual Review of Food Science and Technology, 2018, 9(1): 155-176.
[26] 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究[D]. 长春: 吉林大学, 2015: 77-89.WANG J. Isolation, screening, molecular characterization and application of extracellular polysaccharide producing Lactobacillus plantarum[D]. Changchun: Jilin University, 2015: 77-89.
[27] 刘孝芳, 雷文平, 迟珺曦, 等. 乳酸菌降胆固醇作用及降解机制研究进展[J]. 中国酿造, 2020, 39(6): 22-25.LIU X F, LEI W P, CHI J X, et al. Research progress on cholesterol-lowering effect and degradation mechanism of lactic acid bacteria[J]. China Brewing, 2020, 39(6): 22-25.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。