呕吐毒素又名脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),分子式C15H20O6,相对分子质量296.3,主要包括禾谷镰刀菌产生的B型单端孢霉和环氧-倍半萜类化合物。近年来我国饲料中DON 污染日趋严重,动物摄入DON 污染的饲料后主要表现为腹泻、呕吐、采食量降低、体重减轻、免疫系统紊乱等症状,并最终通过动物产品对人体健康产生严重危害[1]。DON 性质稳定,有很强的耐高温和耐酸碱性,因此在一般的饲料加工生产过程中不易将其灭活[2]。常见的DON 脱毒方法有物理、化学和生物法等,其中,生物脱毒技术由于具有反应条件温和、特异性强及脱毒效率高等特性,已经成为解决毒素污染的重要手段[3]。
生物脱毒法按作用机制主要分为生物吸附和生物降解[4-5]。其中,生物吸附脱毒是利用生物材料的吸附作用将DON 去除,主要以酵母为主[6-7]。部分乳酸菌对DON 也起一定吸附作用,如副干酪乳杆菌LHZ-1 的细胞壁可与DON 形成复合物,在24 h 内使反应液中DON 的含量降低40.7%[6]。一些丝状真菌的菌丝体也可以吸附DON,如曲霉在反应96 和240 h 后对DON 的吸附率最高可分别达到74%和90%[8]。生物降解主要是利用微生物或其产生的酶对DON 的主要毒性基团C-12,13环氧基和C3-OH 基团进行结构的改变或破坏,并将DON 转化为无毒或低毒的物质。例如Gao 等[9]在鸡肠中发现了一株可以将DON 去氧化成DOM-1的革兰氏阳性非芽孢杆Slackia sp. D-G6,在培养基中可将25 mg/L DON 在48 h 内完全转化为DOM-1;He 等[10]在麦田土壤中筛选得到了可将DON 降解为DOM-1 的混合菌群PGC-3,经过16S rDNA 测序发现该菌群由10 个属构成,起主要作用的是脱亚硫酸杆菌属细菌。
我国农业农村部规定,凡生产、经营和使用的营养性饲料添加剂及一般饲料添加剂均应符合《饲料添加剂品种目录》中规定的品种,其中规定允许添加的与脱毒直接相关的微生物及酶的种类极为有限,而常用粘土类吸附剂又存在着吸附营养物质、易解吸附等缺点。因此,本研究在常见的饲用益生菌中筛选出高效脱除谷物中呕吐毒素的脱毒菌,在液态基质中对其脱毒机理进行初步研究,并在固态发酵体系中验证其对真菌毒素污染小麦和玉米中DON 的脱毒效果,从而为益生菌固态发酵脱除饲料中DON 提供一定参考依据。
1 材料与方法
1.1 材料与仪器
DON 污染小麦(DON 2 500 μg/kg)、DON 和玉米赤酶烯酮(Zearalenone, ZEN)联合污染玉米(DON 3 500 μg/kg,ZEN 1 500 μg/kg):牧原食品股份有限公司。
戊糖片球菌(Pediococcus pentosaceus)、嗜热链球菌(Streptococcus thermophilus)、植物乳杆菌(Lactobacillus plantarum)、酿酒酵母(Saccharomyces cerevisiae)、枯草芽孢杆菌(Bacillus subtilis):国家和粮食物资储备局科学研究院粮食品质营养研究所保存。
德曼-罗戈萨-夏普(MRS)培养基;Luria-Bertani(LB)培养基;酵母培养基:葡萄糖1%、蛋白胨1%、酵母提取物0.5%。以上培养基均在使用前于121 ℃高压灭菌15 min。
色谱纯乙腈、甲醇:Dikma 公司,DON、ZEN标准品:青岛普瑞邦有限公司。呕吐毒素和玉米赤霉烯酮免疫亲和柱:北京华安麦科生物技术有限公司。
1.2 液态基质中单菌脱毒率的测定
将实验室保存的菌株活化后制备种子液,并在培养至稳定期后分别按2%接种量接入5 mL 新鲜培养基中(植物乳杆菌和戊糖片球菌:MRS 培养基、37 ℃;酿酒酵母:酵母培养基、28 ℃;嗜热链球菌、枯草芽孢杆菌:LB 培养基、32 ℃),同时加入DON 使其终浓度为1 μg/mL,对照组用等体积的培养基代替菌液,280 r/min 摇振培养4、8、12、16、20、24 和48 h 后,加入等体积乙腈浸提,8 000 r/min 离心3 min,取1 mL 上清待测DON 含量。
将DON 标准品溶解于乙腈溶液,配制成0.1、0.5、1.0、5.0 和10.0 μg/mL 的标准工作液,绘制毒素标准曲线。色谱柱:C18 柱,柱长150 mm,内径4.6 mm,填料直径5 μm;柱温:室温;流动相:超纯水和99.9%色谱级乙腈(超纯水∶乙腈=9∶1);流速:0.8 mL/min;检测波长:218 nm;进样量:20 μL。待测样品过0.22 μm 滤膜后取1 mL 上机待测。
DON 标准曲线:y=0.064 40x+101.070 59,R2=0.999 97,x 为峰面积(mv·S),y 为DON 浓度(ng/mL),标准曲线在(500~2 000)ng/mL 浓度范围内线性关系良好。
脱毒率=(对照组DON 含量-处理组DON含量)/对照组DON 含量×100%。
1.3 呕吐毒素脱毒菌的脱毒机制研究
1.3.1 吸附作用
将培养至稳定期的100 mL 菌液分为2 份,1份于121 ℃灭活15 min,另1 份4 ℃暂存。2 份样品离心后取细胞沉淀,用0.9%氯化钠溶液洗涤3 次后重悬,加入DON 使其终浓度为1 μg/mL,并分别于相应温度下280 r/min 摇振培养,反应0、24、48 h 时取样,生理盐水清洗2~3 次后离心得细胞沉淀,加入乙腈充分浸提残余细胞中DON,HPLC 上机测定DON 含量。每个样品3 个重复。
1.3.2 降解作用
取培养至稳定期的菌液50 mL,9 000 r/min离心10 min,上清液4 ℃保存备用,下层菌体用Tris-HCL(pH=7.4)洗涤3 次后重悬,菌体经细胞破碎仪破碎5~6 次,于12 000 r/min 离心10 min 除去细胞碎片,得到细胞内容物。将上清液与细胞内容物分别进行如下处理:(1)4 ℃暂存;(2)沸水浴处理2 h。处理后的样品在无菌条件下过0.22 μm水系滤膜,加入DON 使其终浓度为1 μg/mL,分别于相应温度下280 r/min 摇振培养,反应0、24、48和72 h 时取样,HPLC 上机测定DON 含量。同时将Tris-HCL 缓冲液加入等量的DON 作为空白对照。
1.4 呕吐毒素脱毒菌的吸附和解吸附特性
1.4.1 吸附效果
用胃蛋白酶和磷酸钾缓冲液配置模拟胃液(量取浓盐酸3.84 mL 加入800 mL 的超纯水中,准确称取20 g 的固体胃蛋白酶一起摇匀后移入1 000 mL 容量瓶中,加水稀释至刻度),加入DON使其终浓度为1 μg/mL,37 ℃、280 r/min 进行吸附实验,并分别于30、60、90、120 和180 min时离心取上清,HPLC 上机测定DON 含量,根据DON 的标准曲线计算吸附率。
1.4.2 解吸附效果
向上述反应结束离心后的沉淀中加入人工肠液(称取固体KH2PO4 6.8 g 溶解于500 mL 超纯水中,使用0.1 mol/L NaOH 溶液调节pH 至6,准确称取10 g 胰酶使用适量水溶解,将两种溶液均匀移入1 000 mL 容量瓶中用水定容至刻度),加入DON 使其终浓度为1 μg/mL,37 ℃、280 r/min进行解吸实验,并分别于60、120、180、240 和300 min 时离心取上清,HPLC 上机测定DON 含量。
1.5 小麦和玉米固态发酵脱毒效果评价
1.5.1 正交实验设计
将筛选出的益生菌菌株分别活化,280 r/min震荡培养24 h 制备发酵菌液。以戊糖片球菌、酿酒酵母和植物乳杆菌为单因素,在之前研究的基础上,确定接种量即各单菌接种量分别为1×106、1×107、1×108 CFU/mL 为接种水平,以DON 脱除率为指标,设计L9(34)正交实验(表1~2)。
表1 因素水平表
Table 1 Table of factor levels

水平 戊糖片球菌 酿酒酵母 植物乳杆菌1 1×106 1×106 1×106 2 1×107 1×107 1×107 3 1×108 1×108 1×108
表2 正交实验设计表
Table 2 Table of orthogonal experimental designs
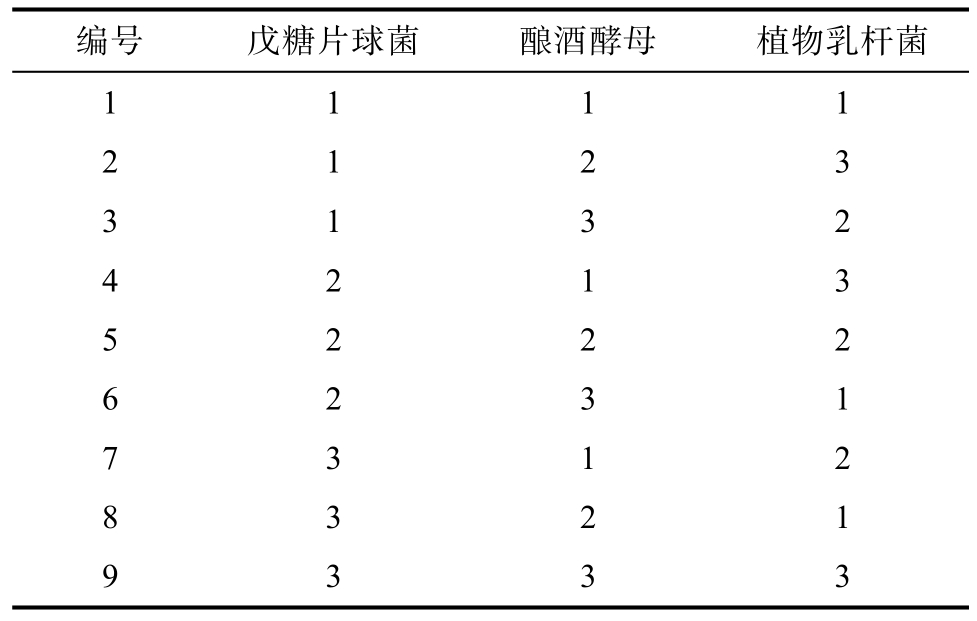
编号 戊糖片球菌 酿酒酵母 植物乳杆菌1 1 1 1 2 1 2 3 3 1 3 2 4 2 1 3 5 2 2 2 6 2 3 1 7 3 1 2 8 3 2 1 9 3 3 3
1.5.2 态发酵脱毒率测定
分别取粉碎后的毒素污染小麦或玉米100 g于烧杯中,设置发酵时间48 h、发酵温度32 ℃、料水比1∶0.6、总菌接种量1×107 CFU/g,发酵后的样品60 ℃烘干、粉碎后,参照GB/T 30956—2014《饲料中脱氧雪腐镰刀菌烯醇的测定 免疫亲和柱净化-高效液相色谱法》和GB/T 28716—2012《饲料中玉米赤霉烯酮的测定 免疫亲和柱净化-高效液相色谱法》测定DON 和ZEN 含量。
1.5.3 粗蛋白质和粗纤维的测定
参照GB/T 6432—2018《饲料中粗蛋白的测定凯氏定氮法》测定粗蛋白质(Crude protein,CP)含量;参照GB/T 6434—2022《饲料中粗纤维的含量测定》测定粗纤维(Crude fiber,CF)含量。
1.6 数据处理
实验结果用SPSS 22.6 进行统计分析,结果用平均值±标准差表示,用Turkey 法对数据进行差异性分析,P<0.05 代表差异显著。
2 结果与讨论
2.1 呕吐毒素脱毒菌的筛选及脱毒率的测定
将实验室保存的戊糖片球菌、嗜热链球菌、植物乳杆菌、酿酒酵母、枯草芽孢杆菌按1.2.1 的方法在含有DON 的液态培养基中反应24 h,由图1 可知,植物乳杆菌脱毒率最高为82.75%,戊糖片球菌脱毒率为79.62%,酿酒酵母脱毒率为62.22%,高于其他菌株的DON 脱毒率。植物乳杆菌主要通过菌体细胞壁的疏水性及电子供体-受体和酸碱的相互作用脱除DON。文献报道,多株乳酸菌和酵母菌也被证实具有脱除真菌毒素的作用[11-13]。Nathanail 等[14]实验结果表明,巴斯德酵母在发酵过程中通过与DON 的C3 位羟基经糖基化后可生成D3G(DON-3-O-glucoside, D3G),DON 和D3G 均可被酵母细胞壁吸附。Niderkorn等[15]将包括乳酸杆菌、乳酸球菌、明串珠菌、丙酸杆菌、链球菌和肠球菌在内的202 株菌株,进行对DON 生物转化和吸附能力测试,实验结果表明:以上这些菌株均不能生物代谢转化DON,但是大部分菌株能吸附DON,最高可吸附33%的DON。
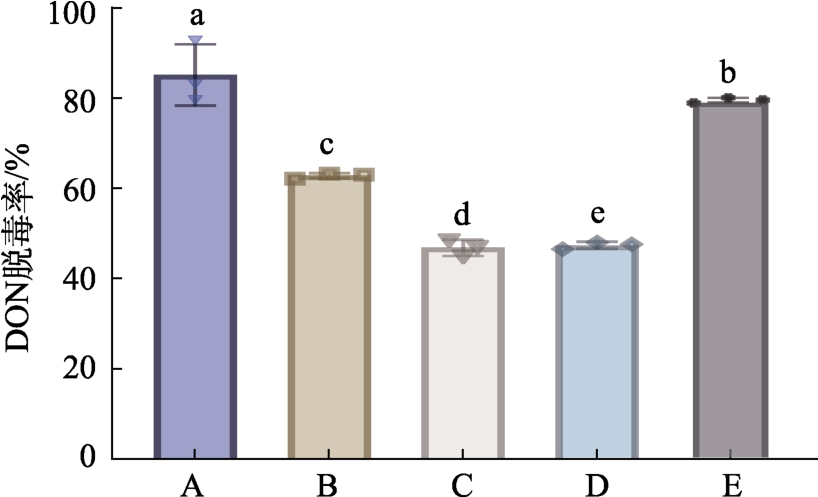
图1 单菌液态发酵DON 脱毒率
Fig.1 Single-bacteria liquid fermentation DON removal rate
注:A:植物乳杆菌B:酿酒酵母C:嗜热链球菌D:枯草芽孢杆菌E:戊糖片球菌,不同小写字母表示差异显著(P<0.05),下同。
Note: A: Lactobacillus plantarum B: Saccharomyces cerevisiae C: Streptococcus thermophilus D: Bacillus subtilis E: Pentosaccharomyces cerevisiae, different lowercase letters indicate significant differences(P<0.05), same as below.
由图2 可知,在相同的条件下,酿酒酵母的初始脱毒率较低,4 h 时脱毒率仅为9.47%,12 h后增幅变大,脱毒率增高;植物乳杆菌和戊糖片球菌分别在反应24 h 时脱毒率可达82.75%和79.62%,之后脱毒率则趋于稳定,即本研究所筛选出的3 株脱毒菌株在液态基质中对DON 的脱除率在24 h 内,随反应时间增加而不断提高,可能是因为菌体细胞对毒素的脱除作用随反应时间的增加而逐渐增强,在24 h 达到最高,随后保持稳定状态[2,16]。
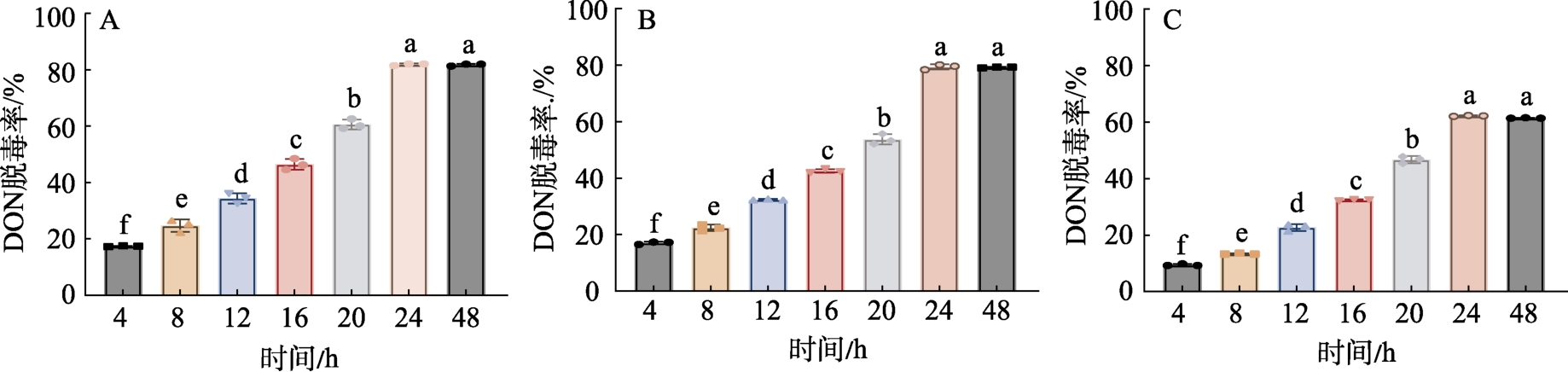
图2 不同反应时间菌株脱毒率
Fig.2 Detoxification rate of the three strains over time
注:A:植物乳杆菌B:戊糖片球菌C:酿酒酵母。
Note: A: Lactobacillus plantarum B: Pentosaccharomyces cerevisiae C: Saccharomyces cerevisiae.
2.2 呕吐毒素脱毒菌的脱毒机制研究
通过对不同处理条件下菌株细胞壁对DON的吸附率,图3 可以看出,在共培养一段时间后3 株菌的活细胞和失活细胞中都含有DON,不同处理条件下对DON 都能迅速吸附,共培养24~48 h 时吸附率可达到最大,灭活细胞的吸附量略高于未灭活的细胞但并不显著(P>0.05)。其中,酿酒酵母和植物乳杆菌灭活细胞的吸附率约为90%,戊糖片球菌灭活细胞的吸附率约为65%。这可能是由于植物乳杆菌和戊糖片球菌均为革兰阳性菌,肽聚糖层较厚,其—OH、—NH 等基团空隙较大,有利于DON 的进入和结合;酿酒酵母是一种单细胞微生物,属于兼性厌氧菌,其水解后,细胞壁中的甘露低聚糖、葡聚糖等成分充分暴露,能够与DON 结合[16]。此外,热处理使得菌体细胞壁肽聚糖和多聚糖的肽键或者糖苷键断裂,使肽聚糖结构边薄而孔径增大,菌体对毒素的吸附能力增加[17]。
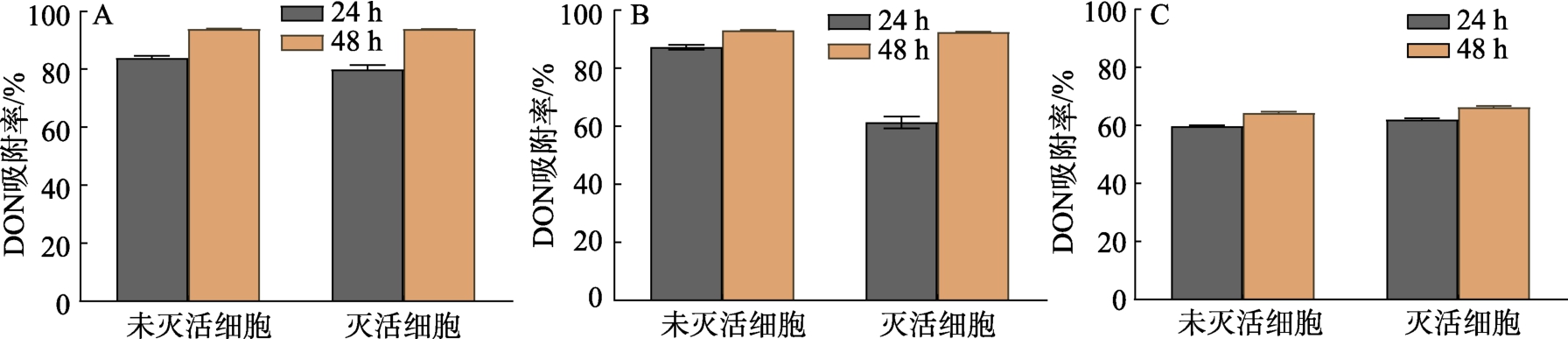
图3 脱毒菌株对DON 的吸附率
Fig.3 Adsorption rate of DON by detoxified strains of bacteria
注:A:酿酒酵母B:植物乳杆菌C:戊糖片球菌。
Note: A: Saccharomyces cerevisiae B: Lactobacillus plantarum C: Pentosaccharomyces schizococcus.
3 株菌DON 脱毒活性物质定位研究结果见图4。可以看出,在含DON 的液态基质中培养72 h 后,3 株菌的上清液和细胞内容物中DON含量略有下降,但DON 降解率不足10%。据此推测,3 株菌对DON 的降解作用较弱,结合吸附研究结果,说明3 株菌对DON 的脱除主要以吸附作用为主,与尹鹏等[18]、刘畅等[19]的研究结果一致。
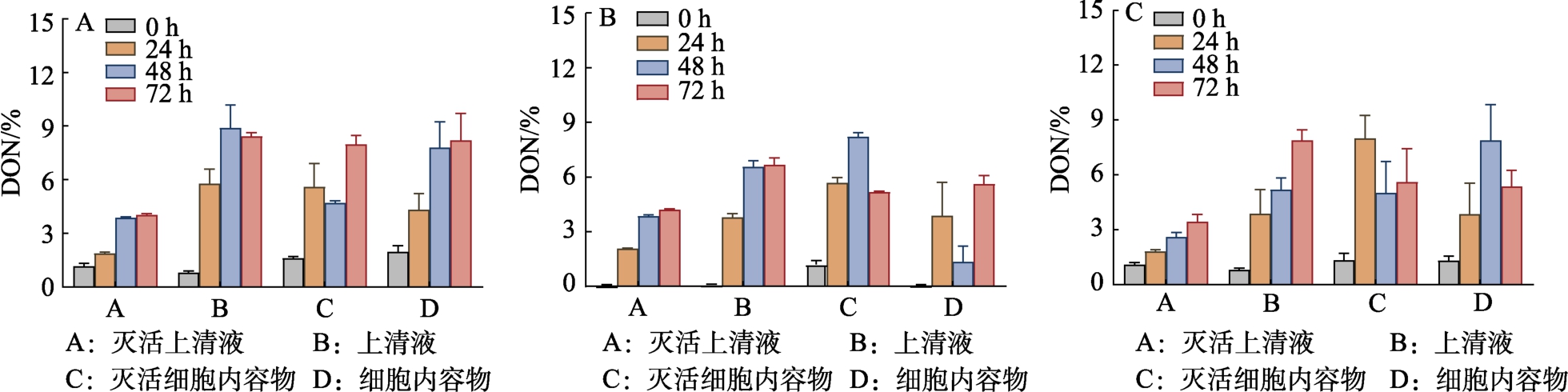
图4 脱毒菌株对DON 的降解率
Fig.4 Degradation rate of DON by detoxified strains of bacteria
注:A:戊糖片球菌B:植物乳杆菌C:酿酒酵母。
Note: A: Pentosaccharomyces cerevisiae B: Lactobacillus plantarum C: Saccharomyces cerevisiae.
2.3 呕吐毒素脱毒菌吸附和解吸附作用
微生物对真菌毒素的吸附率与其细菌种类和浓度有关,且部分微生物的细胞壁结构对毒素的吸附作用具有可逆性[20]。因此,本研究测定了在模拟胃肠液中所筛选的3 株菌对DON 的吸附及解吸附率,结果见图5。可以看出,共培养一段时间后,3 株菌在模拟胃液中对DON 的吸附率逐渐增高,在3 h 时达到最高,戊糖片球菌和植物乳杆菌对DON 脱除率可达到80%左右,酿酒酵母对DON 脱除率可达到65%;而在模拟肠液中反应300 min,3 株菌对DON 的解吸附率不足15%,表明3 株菌在模拟胃肠液中可高效脱除DON,同时对DON 的解吸附率较低。

图5 脱毒菌对DON 的吸附情况
Fig.5 Adsorption of DON by detoxifying bacteria
注:A 为戊糖片球菌,B 为植物乳杆菌,C 为酿酒酵母。
Note: A: Pentosaccharomyces cerevisiae B: Lactobacillus plantarum C: Saccharomyces cerevisiae.
2.4 小麦和玉米固态发酵脱毒效果评价
将筛选出的3 株菌株进行混菌发酵接种量及单菌比例实验,由表3 可知,影响小麦DON 含量的因素依次为酿酒酵母>戊糖片球菌>植物乳杆菌,综合极差分析结果,确定戊糖片球菌、酿酒酵母和植物乳杆菌单菌接种量分别为1×107、1×108、1×106 CFU/g 时,对毒素小麦中的DON 脱毒率最高,可达到79.49%。梁含等[21]用植物乳酸菌和枯草芽孢杆菌混合发酵可降解麸皮中71%的DON,田祖光等[22]用筛选到的一株枯草芽孢杆菌发酵对麸皮中DON 的降解率为73.25%,在本研究中3 株益生菌复合发酵对小麦中DON 脱毒率最高达79.49%,说明所筛选的3 株益生菌在谷物固态发酵脱除DON 上取得了较好的效果。
表3 小麦DON 脱毒正交实验结果统计表
Table 3 Statistical table of results of wheat DON detoxification orthogonal test

注:表中“K”、“k”、“R”为正交实验直观分析参数,“K”为正交表中竖列中不同水平所对应的测定值的和;“k”为“K”值的平均值;“R”为因素列中最大值与最小值的差。实验结果为干物质基础。脱毒率1、2、3 为3 个平行实验结果。下表同。
Note: In the table, “K”, “k” and “R” are the intuitive analysis parameters of the orthogonal test, and “K” is the sum of the measured values corresponding to different levels in the vertical columns of the table; “k” is the mean value of “K”; “R” is the difference between the maximum and minimum values in the factor columns. “K” is the sum of the measured values corresponding to different levels in the vertical columns of the table; “k” is the mean value of “K”; “R” is the difference between the maximum and minimum values in the factor columns.The results of the experiment are on a dry matter basis. The orthogonal text 1, 2, 3 were the result of 3 parallel experiments. Same as below.
戊糖片球菌酿酒酵母植物乳杆菌 脱毒率1 脱毒率2 脱毒率3 1 1 1 1 37.03 40.82 43.10 2 1 2 3 47.94 47.72 49.79 3 1 3 2 50.81 50.92 50.55 4 2 1 3 52.67 49.92 52.26 5 2 2 2 55.71 57.70 57.34 6 2 3 1 79.22 79.75 79.50 7 3 1 2 55.65 57.35 59.64 8 3 2 1 50.62 56.76 55.87 9 3 3 3 61.75 62.99 61.28 K1 418.68 448.44 522.67 K2 564.07 479.45 495.67 K3 521.91 576.77 486.32 k1 46.52 49.83 58.07 k2 62.67 53.27 55.07 k3 57.99 64.09 54.04 R 16.15 14.26 4.04最佳组合 戊糖片球菌2酿酒酵母3植物乳杆菌1
饲料原料普遍存在多种真菌毒素共存污染的现象,本研究利用筛选出的3 株菌对DON 和ZEN联合污染的玉米进行固态发酵,由表4~5 可知,戊糖片球菌、酿酒酵母和植物乳杆菌单菌接种时对 DON 的脱毒率分别为 33.45%、28.03%和25.73%;单菌接种量分别为1×108、1×107、1×106 CFU/g 时,对玉米中的DON 脱毒率最高可达61.54%;3 株菌单菌接种量均在1×108 CFU/g 时,对毒素玉米中ZEN 脱毒率最高可达78.15%。郭瑞等[23]筛选到一株蜡样芽孢杆菌BL-17,对黄曲霉毒素、ZEN 和DON 三种毒素降解率分别可达74.38%、98.31%和39.66%。曹坤等[24]筛选到一株解淀粉芽孢杆菌,对DON 的降解率可达92.440%,但这些菌种均不在《饲料添加剂品种目录》中,而本研究筛选出的3 株菌均为常见益生菌,可广泛应用于饲料真菌毒素的脱除。3 株菌对玉米中DON 的脱除率低于小麦中DON 的脱除率,可能是玉米被DON 和ZEN 联合污染,而多种毒素污染的原料比单一毒素污染的原料脱毒更难所致[25-26]。
表4 玉米DON 脱毒正交实验结果统计表
Table 4 Statistical table of the results of the orthogonal test of corn DON detoxification
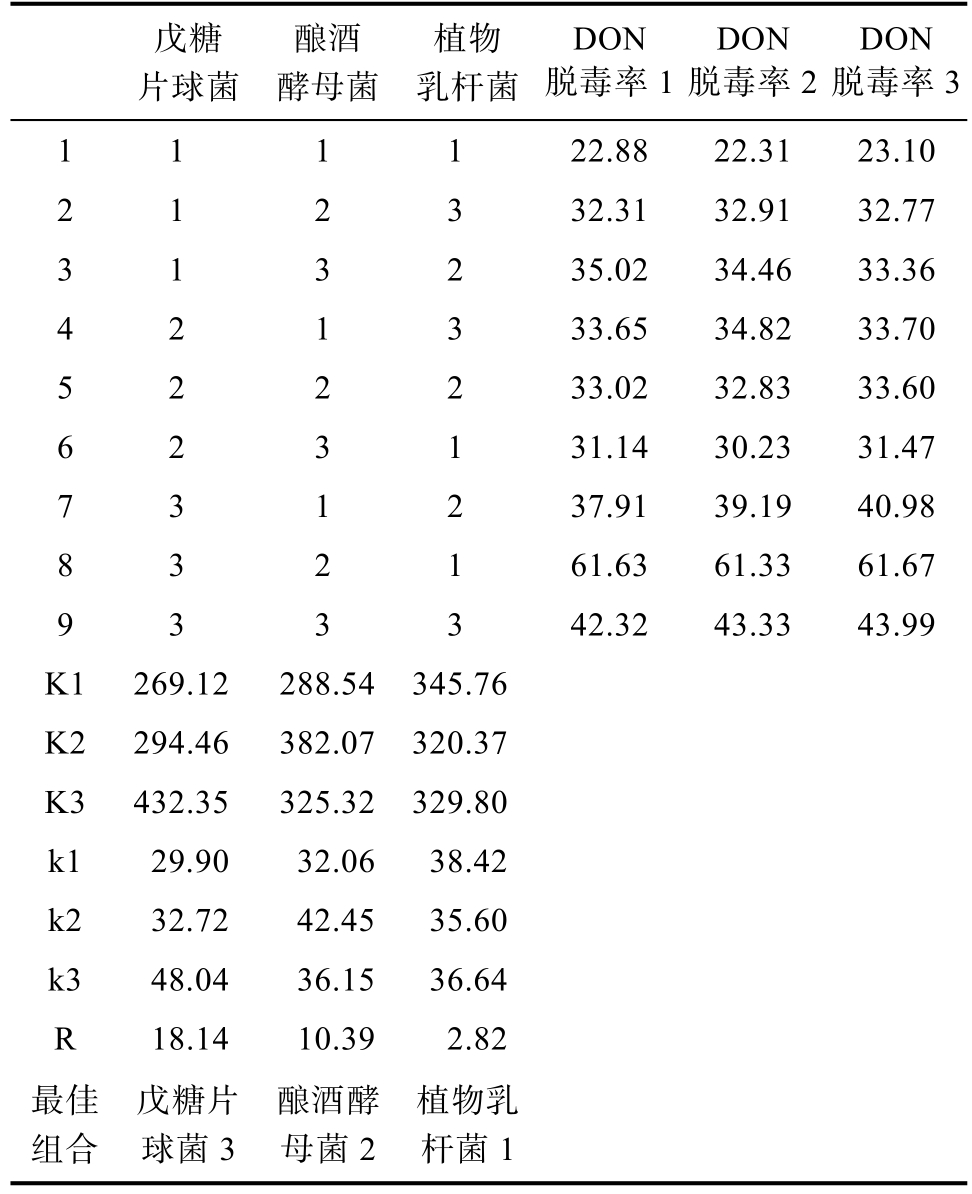
戊糖片球菌酿酒酵母菌植物乳杆菌DON脱毒率1 DON脱毒率2 DON脱毒率3 1 1 1 1 22.88 22.31 23.10 2 1 2 3 32.31 32.91 32.77 3 1 3 2 35.02 34.46 33.36 4 2 1 3 33.65 34.82 33.70 5 2 2 2 33.02 32.83 33.60 6 2 3 1 31.14 30.23 31.47 7 3 1 2 37.91 39.19 40.98 8 3 2 1 61.63 61.33 61.67 9 3 3 3 42.32 43.33 43.99 K1 269.12 288.54 345.76 K2 294.46 382.07 320.37 K3 432.35 325.32 329.80 k1 29.90 32.06 38.42 k2 32.72 42.45 35.60 k3 48.04 36.15 36.64 R 18.14 10.39 2.82最佳组合戊糖片球菌3酿酒酵母菌2植物乳杆菌1
表5 玉米ZEN 脱毒正交实验结果统计表
Table 5 Statistical table of the results of the orthogonal test of corn ZEN detoxification
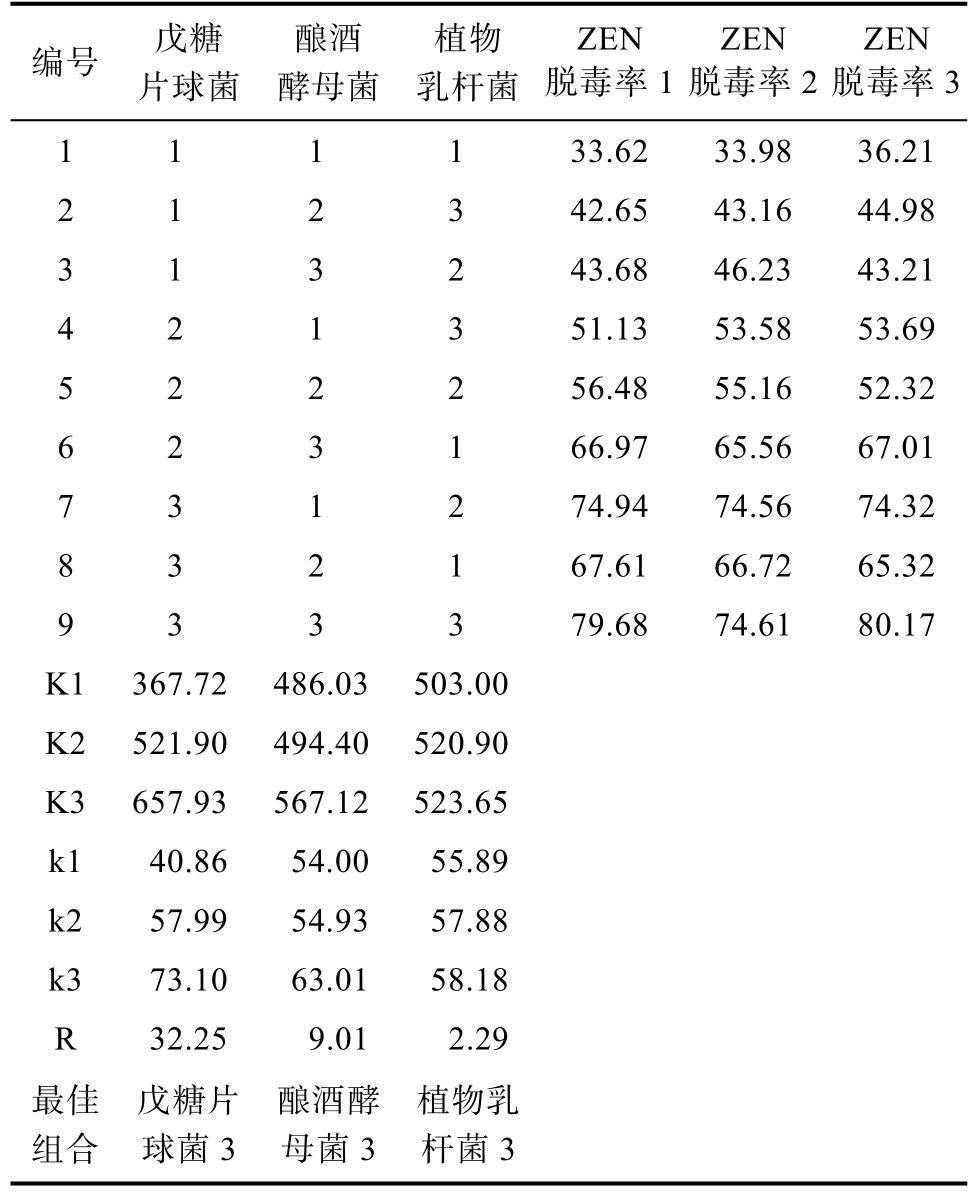
编号 戊糖片球菌酿酒酵母菌植物乳杆菌ZEN脱毒率1 ZEN脱毒率2 ZEN脱毒率3 1 1 1 1 33.62 33.98 36.21 2 1 2 3 42.65 43.16 44.98 3 1 3 2 43.68 46.23 43.21 4 2 1 3 51.13 53.58 53.69 5 2 2 2 56.48 55.16 52.32 6 2 3 1 66.97 65.56 67.01 7 3 1 2 74.94 74.56 74.32 8 3 2 1 67.61 66.72 65.32 9 3 3 3 79.68 74.61 80.17 K1 367.72 486.03 503.00 K2 521.90 494.40 520.90 K3 657.93 567.12 523.65 k1 40.86 54.00 55.89 k2 57.99 54.93 57.88 k3 73.10 63.01 58.18 R 32.25 9.01 2.29最佳组合戊糖片球菌3酿酒酵母菌3植物乳杆菌3
对发酵后小麦CP 和CF 含量进行测定,结果如图6 所示,即毒素小麦经3 株益生菌联合固态发酵后,其中CP 含量略有提高,CF 含量降低,说明所选3 菌株联合发酵在有效脱除小麦中毒素的同时,对其常规营养成分并无太大影响[27-28]。刘永清等[29]选用地衣芽孢杆菌、产朊假丝酵母和植物乳杆菌3 株益生菌,通过优化接种量、料液比、原料添加量等因素,对残次枣粉固态发酵工艺进行优化,发现发酵后枣粉的营养品质和抗氧化性能得到有效提升,且黄曲霉毒素B1 的含量显著降低。此外,张春吉[30]研究了不同发酵时间对饲料真菌毒素含量(包括黄曲霉毒素B1(Aflatoxin B1,AFB1)、ZEN 和DON)和营养价值的影响,结果证明全价饲料用呼吸膜袋发酵3 d 为宜,且发酵时间越长毒素含量越高。郭瑞等[23]将蜡样芽孢杆菌和两株乳酸菌混合对饲料原料进行发酵,结果表明可显著降低饲料中的毒素含量,对AFB1、ZEN 和DON 的降解率分别达86.72%、100%和43.19%。因此,在适宜的菌种筛选和工艺优化下,固态发酵可在脱除饲料原料真菌毒素含量的同时进一步提升其营养价值。
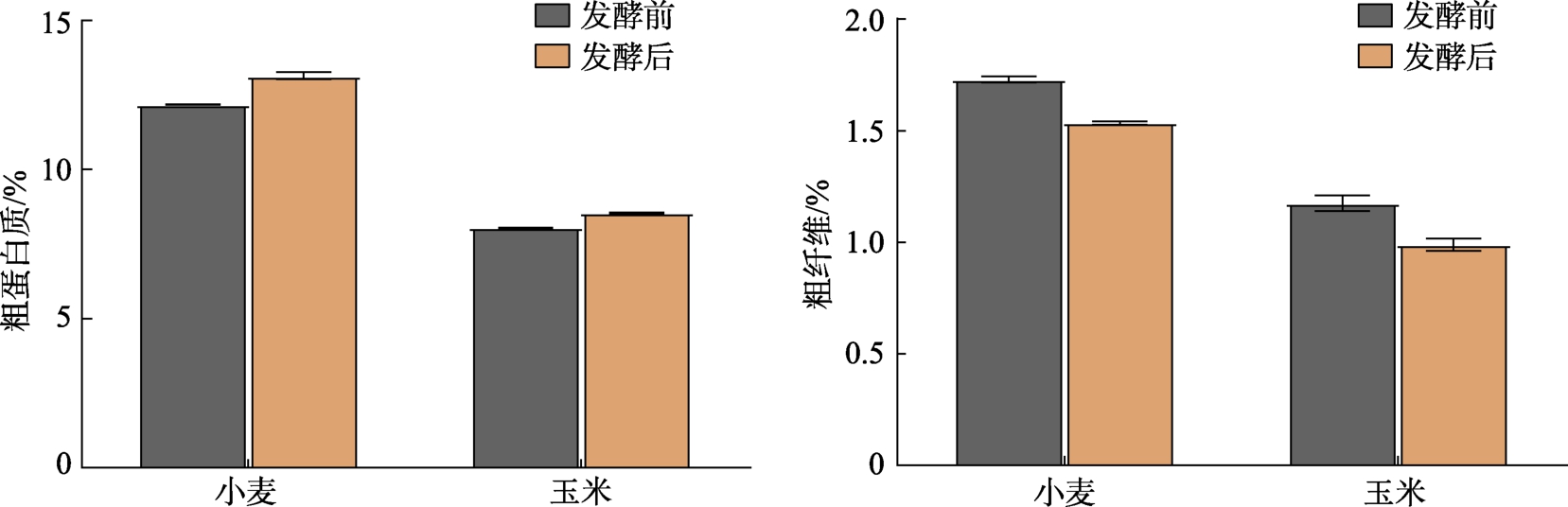
图6 小麦和玉米发酵前后CP 和CF 含量变化
Fig.6 Changes in CP and CF content of wheat and corn before and after fermentation
3 结论
本研究筛选出了3 株可高效脱除小麦和玉米中DON 的益生菌,即戊糖片球菌、酿酒酵母和植物乳杆菌,24 h 单菌脱毒率分别为79.62%、62.22%和82.75%。且3 株菌对DON 的脱除以吸附作用为主,解吸附率均低于15%。在优化后的固态发酵工艺下,3 株菌对小麦DON 的脱毒率最高达79.49%,对玉米DON 和ZEN 的脱毒率最高分别达61.54%和78.15%。此外,3 株菌联合固态发酵可提高毒素污染谷物的粗蛋白质,降低其粗纤维含量。
[1] WÉBER A, MERY L, NAGY P, et al. Evaluation of data quality at the Hungarian National Cancer Registry, 2000—2019[J]. Cancer Epidemiology, 2023, 82:102306.
[2] MISHRA S, SRIVASTAVA S, DEWANGAN J, et al. Global occurrence of deoxynivalenol in food commodities and exposure risk assessment in humans in the last decade: a survey[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(8): 1346-1374.
[3] HAO G, MCCORMICK S, TILEY H, et al. Detoxification and excretion of trichothecenes in transgenic Arabidopsisthaliana expressing Fusarium graminearum trichothecene 3-O-acetyltransferase[J]. Toxins (Basel), 2021, 13(5): 320.
[4] HOLANDA D M, KIM S W. Investigation of the efficacy of mycotoxin-detoxifying additive on health and growth of newlyweaned pigs under deoxynivalenol challenges[J]. Anim Biosci,2021, 34(3): 405-416.
[5] LI Y, GAO H, WANG R, et al. Deoxynivalenol in food and feed:Recent advances in decontamination strategies[J]. Front Microbiol,2023, 14: 1141378.
[6] ZHAI Y, HU S, ZHONG L, et al. Characterization of deoxynivalenol detoxification by Lactobacillus paracasei LHZ-1 isolated from yogurt[J]. J Food Prot, 2019, 82(8): 1292-1299.
[7] XU R, YIANNIKOURIS A, SHANDILYA U K, et al. Comparative assessment of different yeast cell wall-based mycotoxin adsorbents using a model- and bioassay-based in vitro approach[J]. Toxins(Basel), 2023, 15(2): 104.
[8] PIERRON A, MIMOUN S, MURATE L S, et al. Microbial biotransformation of DON: molecular basis for reduced toxicity[J]. Scientific Reports, 2016, 6(1): 29105.
[9] GAO X J, MAO P Q, ZHANG X H, et al. Dual function of a novel bacterium, Slackia sp. d-g6: detoxifying deoxynivalenol and producing the natural estrogen analogue, equol[J]. Toxins,2020, 12(2): 85.
[10] HE W J, YUAN Q S, ZHANG Y B, et al. Aerobic de-epoxydation of trichothecene mycotoxins by a soil bacterial consortium isolated using in situ soil enrichment[J]. Toxins (Basel), 2016, 8(10): 277.
[11] 尹清强, 刘洋, 高天增, 等. 一种降解呕吐毒素的酵母菌及其应用: CN201810556975.0[P]. 河南省, 2021-11-26.YIN Q Q, LIU Y, GAO T Z, et al. A yeast degrading vomitoxin and its application: CN201810556975.0[P]. Henan Province,2021-11-26.
[12] LAHTINEN S J, HASKARD C A, OUWEHAND A C, et al.Binding of aflatoxin B1 to cell wall components of Lactobacillus rhamnosus strain GG[J]. Food Addit Contam, 2004, 21(2): 158-164.
[13] 谭剑, 杨硕, 苏会波, 等. 一株降解呕吐毒素枯草芽孢杆菌的鉴定与降解效果研究[J]. 当代化工, 2018, 47(3): 548-551.TAN J, YANG S, SU H B, et al. Identification of a Bacillus subtilis strain with deoxynivalenol degradation ability[J]. Contemporary Chemical Industry, 2018, 47(3): 548-551.
[14] NATHANAIL A V, GIBSON B, HAN L, et al. The lager yeast Saccharomyces pastorianus removes and transforms Fusarium trichothecene mycotoxins during fermentation of brewer's wort[J]. Food Chem, 2016, 203: 448-455.
[15] NIDERKORN V, MORGAVI D P, PUJOS E, et al. Screening of fermentative bacteria for their ability to bind and biotransform deoxynivalenol, zearalenone and fumonisins in an in vitro simulated corn silage model[J]. Food Addit Contam, 2007, 24(4):406-415.
[16] 向雨珂, 熊犍, 张晓琳, 等. T-2 毒素脱毒菌株的筛选及脱毒机制初探[J]. 食品科技, 2017, 42(11): 27-33.XIANG Y K, XIONG J, ZHANG X L, et al. Screening of T-2 toxin detoxification strains and the mechanism of detoxification[J]. Food Science and Technology, 2017, 42(11): 27-33.
[17] 曹凤明, 杨小红, 马鸣超, 等. 枯草芽孢杆菌近缘种群鉴定方法研究进展[J]. 微生物学通报, 2014, 41(5): 968-974.CAO F M, YANG X H, MA M C, et al. Advances in the identification of Bacillus subtilis and closely related species[J].Microbiology China, 2014, 41(5): 968-974.
[18] 尹鹏, 杨芸芸, 赵一凡, 等. 基于BP 人工神经网络的酿酒酵母发酵培养基优化及其水解物对真菌毒素吸附研究[J]. 中国粮油学报, 2023, 38(8): 206-212.YIN P, YANG Y Y, ZHAO Y F, et al. Optimization of Saccharomyces cerevisiae culture medium based on BP artificial neural networkand mycotoxin adsorption studies by lts hydrolysate[J]. Journal of the Chinese Cereals and Oils Association, 2023,38(8): 206-212.
[19] 刘畅, 刘阳, 邢福国, 等. 黄曲霉毒素B_1 吸附菌株的筛选及吸附机理研究[J]. 核农学报, 2010, 24(4): 766-771.LIU C, LIU Y, XING F G, et al. Screening of aflatoxin B_1 binding strains and binding mechanism of yeast strain Y1[J].Journal of Nuclear Agricultural Sciences, 2010, 24(4): 766-771.
[20] LEE Y K, EL-NEZAMI H, HASKARD C A, et al. Kinetics of adsorption and desorption of aflatoxin B1 by viable and nonviable bacteria[J]. J Food Prot, 2003, 66(3): 426-430.
[21] 梁含, 马召稳, 于思颖, 等. 呕吐毒素降解菌的筛选、鉴定及应用[J]. 中国畜牧杂志, 2019, 55(12): 115-119.LIANG H, MA Z W, YU S Y, et al. Screening, identification and application of vomitoxin-degrading bacteria[J]. Chinese Journal of Animal Husbandry, 2019, 55(12): 115-119.
[22] 田祖光, 高恺玥, 周蕾, 等. 降解呕吐毒素益生菌的筛选及在发酵麸皮中的应用[J]. 饲料研究, 2021, 44(6): 84-87.TIAN Z G, GAO K Y, ZHOU L, et al. Screening of vomitoxindegrading probiotics and their application in fermenting bran[J].Feed Research, 2021, 44(6): 84-87.
[23] 郭瑞, 张香香, 董维璇, 等. 降解多种真菌毒素的芽孢杆菌的筛选鉴定及其发酵饲料应用[J]. 饲料工业, 2024, 45(2): 125-131.GUO R, ZHANG X X, DONG W X, et al. Screening and identification of Bacillus sphaericus for degradation of various mycotoxins and its fermented feed application[J]. Feed Industry,2024, 45(2): 125-131.
[24] 曹坤, 管明, 陈康, 等. 一株拮抗禾谷镰刀菌和降解呕吐毒素解淀粉芽孢杆菌的筛选及在饲料贮存中的应用[J]. 江苏农业科学, 2019, 47(8): 179-183.CAO K, GUAN M, CHEN K, et al. Screening of a strain of antagonistic Fusarium graminearum and vomitoxin-degrading Bacillus amyloliquefaciens and its application in feed storage[J].Jiangsu Agricultural Science, 2019, 47(8): 179-183
[25] 彭馨, 姜夏雨, 杨烨, 等. 霉菌毒素对家禽的致毒机制及互作效应研究进展[J]. 动物营养学报, 2024, 36(2): 700-707.PENG X, JIANG X Y, YANG Y, et al. Progress in the study of mycotoxin toxicity and interaction effects on poultry[J]. Journal of Animal Nutrition, 2024, 36(2): 700-707.
[26] VALERIA P, ALEJANDRA M, ANALÍA F, et al. A Saccharomyces cerevisiae RC016-based feed additive reduces liver toxicity,residual aflatoxin B1 levels and positively influences intestinal morphology in broiler chickens fed chronic aflatoxin B1-contaminated diets[J]. Animal Nutrition, 2020, 6(1): 31-38.
[27] 张娅妮, 解修超, 王昌钊, 等. 大球盖菇固态发酵对小麦营养成分影响的研究[J]. 食品科技, 2023, 48(8): 121-126.ZHANG Y N, XIE X C, WANG C Z, et al. Effects of solid-state fermentation of Agaricus blazei on the nutrient composition of wheat[J]. Food Science and Technology, 2023, 48(8): 121-126.
[28] 张守梅, 翟胜男, 郭玉秋, 等. 芽孢杆菌固态发酵对麦麸改性和呕吐毒素的影响[J]. 食品科技, 2022, 47(9): 1-7.ZHANG S M, ZHAI S N, GUO Y Q, et al. Effect of solid-state fermentation of Bacillus sphaericus on the modification of wheat bran and vomitoxin[J]. Food Science and Technology, 2022,47(9): 1-7.
[29] 刘永青, 李锦连, 张凯. 复合益生菌发酵对残次枣粉营养成分、毒素含量和抗氧化性的影响[J]. 中国畜牧杂志, 2023,59(9): 276-282.LIU Y Q, LI J L, ZHANG K. Effects of probiotic complex fermentation on the nutrient composition, toxin content and antioxidant property of residual date powder[J]. Chinese Journal of Animal Husbandry, 2023, 59(9): 276-282.
[30] 张春吉. 不同发酵时间对全价饲料营养成分、霉菌毒素含量和能量体外消化率的影响[J]. 中国饲料, 2023(2): 33-36.ZHANG C J. Effects of different fermentation times on the nutrient composition, mycotoxin content and in vitro digestibility of energy of complete feeds[J]. China Feed, 2023(2): 33-36.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。