2 型糖尿病(Type 2 diabetes mellitus,T2DM)的致病机制是由于胰腺无法产生足够的胰岛素来控制食物在体内产生的血糖,致使血糖水平持续上升,并导致碳水化合物、蛋白质、脂肪、以及水和电解质代谢的紊乱[1]。T2DM 及其并发症已成为影响人类健康的主要疾病之一。饮食干预,特别是富含膳食纤维(Dietary fiber,DF)的饮食,可有效预防或延缓T2DM。一项涉及17 项饮食前瞻性队列研究的荟萃分析结果发现,每天增加2 g谷物DF 摄入,T2DM 风险降低6%。相比之下,水果或蔬菜DF 摄入量与T2DM 风险之间没有类似的剂量-反应关系[2]。这一研究结果说明,谷物DF 在调节糖代谢方面具有潜在功效。
肠道微生物在调节机体代谢中发挥重要作用,肠道菌群平衡的破坏会导致宿主高血糖、高脂等慢性代谢疾病的发展;反之肠道菌群平衡的维持和改善则对糖脂代谢具有正向的调控作用[3]。肠道微生物群在很大程度上受饮食调节,DF干预可以改变T2DM 患者的肠道微生物群组成和丰度,从而缓解T2DM 症状[4-5]。不同DF 由于组成、结构和理化性质不同,其对机体代谢和肠道菌群的调控作用也存在差异[6-7],然而不同谷物DF 对糖代谢和肠道菌群影响的差异化研究还未见报道。因此,本文主要探究4 种谷物DF 对db/db小鼠糖代谢和肠道菌落丰富度与结构的影响,研究结果对不同谷物DF 在调节血糖和肠道菌群开发产品中提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
4 种谷物DF:陕西森弗天然制品有限公司;AIN93G 饲料:北京科澳协力饲料有限公司;One Touch 血糖仪:强生(中国)医疗器材有限公司;高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)试剂盒:南京建成生物工程研究所;白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-8(Interleukin-8,IL-8)、白细胞介素-10(Interleukin-10,IL-10)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)和白细胞介素-1β(Interleukin-1β,IL-1β)酶联免疫吸附测定(ELISA)试剂盒:武汉纯度生物技术有限公司;E.Z.N.A.® soil DNA 提取试剂盒:Omega Bio-tek, 美国;NanoDrop2000:美国Thermo Scientific 公司;Quantus™荧光计:美国Promega 公司。
1.2 动物饲养
4 周龄无特定病原体级db/db(C57BLKS/JLepRdb/LepRdb)和db/m(C57BLKS/J-LepRdb/+)小鼠(固安赛业生物科技有限公司,生产许可证号为 SCXK(翼)2021-003)经过1 周适应期后分为6 个组,每组6 只,其中db/m 小鼠作为对照组(CON,饲喂AIN93G 基础饲料),db/db 小鼠按照空腹血糖随机分为:模型组(MC,AIN93G基础饲料)、小麦膳食纤维组(WDF,AIN93G 饲料添加5%小麦DF)、糙米膳食纤维组(BDF,AIN93G 饲料添加5%糙米DF)、燕麦膳食纤维组(ODF,AIN93G 饲料添加5%燕麦DF)和荞麦膳食纤维组(BWDF,AIN93G 饲料添加5%荞麦DF),实验周期为14 周。
小鼠自由进食和饮水,温度在22~25 ℃,相对湿度维持在55%~60%,保持12 h 光照/黑暗循环。小鼠饲养于国家粮食和物资储备局科学研究院无特定病原体级动物房,本试验获得国家粮食和物资储备局科学研究院动物伦理委员会批准,批准号2022-10-2-FW。
1.3 动物样本采集和处理
每周对小鼠体重和摄食量进行监测,每两周进行空腹血糖测定,14 周时,收集各组小鼠粪便,无菌放置–80 ℃冰箱冻存,进行肠道菌群测定。采样前一天,小鼠禁食不禁水12 h,摘除眼球取血,室温静置30 min 后,4 ℃条件下,3 500 rpm离心15 min,取上清液,于–80 ℃冰箱保存,用于血清生化及免疫因子等指标检测。
1.4 口服糖耐量测试
第8 周和第14 周时,进行口服葡萄糖耐量试验(Oral qlucose tolerance test,OGTT)。小鼠禁食过夜后,按照 1 g/kg 剂量进行葡萄糖溶液灌胃,灌胃后的第30、60、90、120 min 时,取尾部静脉血,用血糖仪测定小鼠血糖水平,并绘制120 分钟内血糖变化曲线,计算血糖曲线下面积(Area under the curve,AUC)。
1.5 血液生化和免疫指标测定
采用比色法,按试剂盒说明测定血清中HDL-C和LDL-C 的含量。采用ELISA 试剂盒测定血液中免疫因子(TNF-α、IL-6、IL-8、IL-10、IL-1β)水平。
1.6 肠道菌群测定
根据试剂盒说明提取微生物群落总 DNA,使NanoDrop2000 定量粪便样品中DNA 的浓度和纯度,并通过1%琼脂糖凝胶电泳评估提取DNA 的质量。以上述提取的 DNA 为模板,使用携带Barcode 序列的上游引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′ ) 和 下 游 引 物 806R(5′-GGACTACHVGGGTWTCTAAT-3′)对 16S rRNA 基因V3-V4 区进行PCR 扩增。扩增产物经2%琼脂糖凝胶进行电泳检测,并用Quantus™ 荧光计对回收产物进行检测定量。纯化后的PCR 产物在Illumina 公司的Miseq PE300/NovaSeq PE250平台上进行测序。使用美吉生物云平台(https://cloud.majorbio.com)对微生物群进行生物信息学分析。主成分分析采用Bray- curtis 来确定样品中微生物群落的相似性,鉴定各组间细菌类群显著丰富,并在不同物种分类水平下统计每个样本的群落组成。采用线性判别分析效应量(Linear discriminant analysis effect size,LEfSe)分析不同组间从门到属水平丰度显著差异的的细菌类群。并通过Spearman 相关系数分析代谢指标与差异菌群之间的相关性。
1.7 数据处理
使用Graphpad Prism 8.0 软件进行数据处理和分析,所有结果表示为平均值±标准差(Mean ±SD)。各组之间采用单因素方差分析和LSD 分析进行评估。P < 0.05 被认为差异具有统计学意义。
2 结果与分析
2.1 谷物膳食纤维对db/db 小鼠体质量和摄食量的影响
各组小鼠体重和摄食量结果如图1 所示,与db/m 小鼠比较,db/db 小鼠体质量增加量和摄食量显著升高(P<0.05),而MC 组与各DF 组之间的差异无统计学意义(P>0.05)。表明谷物DF 对db/db 小鼠的体质量增加量和摄食量均无明显影响。
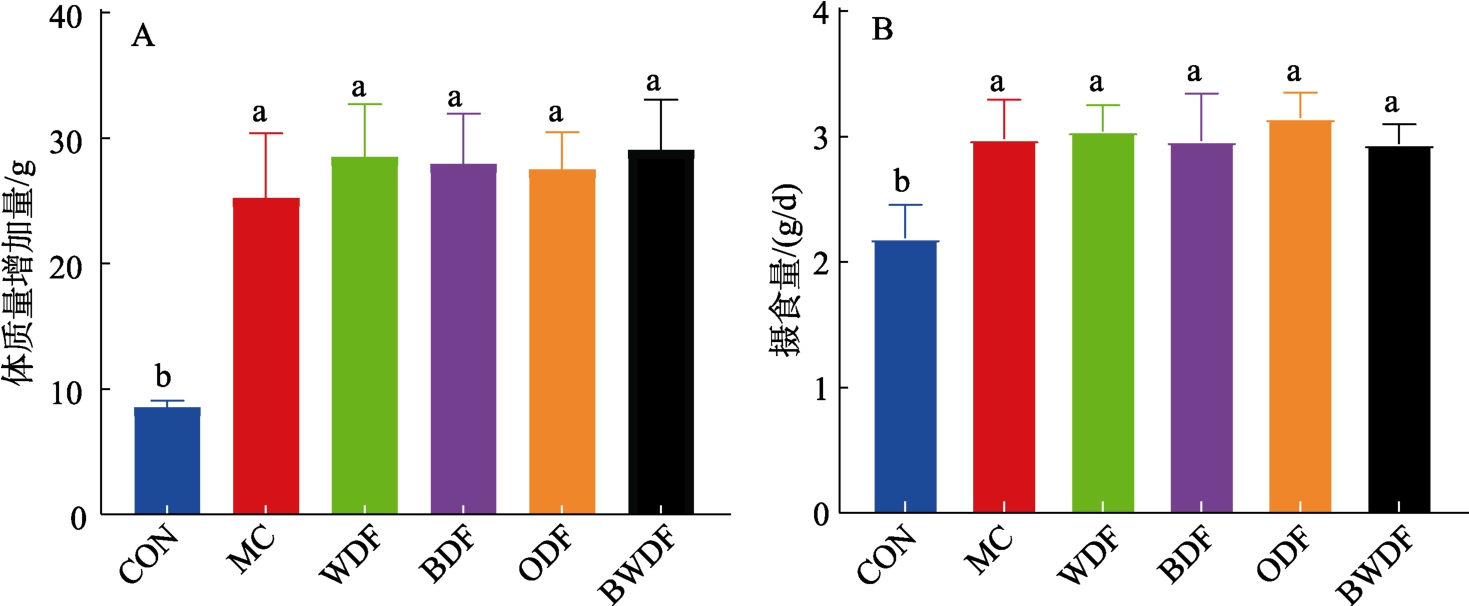
图1 谷物膳食纤维对db/db 小鼠体质量增加量和摄食量影响
Fig.1 Effects of cereal dietary fiber on body weight gain and food intake of db/db mice
注:(A)体质量增加量;(B)摄食量变化。不同字母代表组间存在差异(P<0.05),下同。
Note: (A) Body weight gain; (B) Change in food intake. Different letters indicate differences between groups (P<0.05), the same as below.
2.2 谷物膳食纤维对db/db 小鼠空腹血糖和糖耐受量的影响
空腹血糖结果如表1 所示,CON 组空腹血糖水平为最低(P<0.01),谷物DF 干预2 周后,WDF、ODF 和BWDF 组空腹血糖显著低于MC 组(P<0.05),干预4 周后,WDF 组db/db 小鼠空腹血糖显著低于MC 和BDF 组,12 周时,WDF、BDF和BWDF 组db/db 小鼠空腹血糖显著低于MC 组,这表明4 种谷物DF 对db/db 小鼠均有一定降低空腹血糖效果。饲喂8 周OGTT 结果如图2 所示,口服葡萄糖后,各组小鼠血糖水平在30 min 时达到最大值,然后缓慢下降,在MC 组中,小鼠血糖在30 min 达到峰值,并在接下来的90 min 内持续保持高水平,而各谷物DF 组均可逆转上述高血糖现象(P<0.05,图2A)。且与MC 组相比(图2B),4 种谷物DF 组OGTT 曲线下面积(AUC)均显著降低(P<0.05)。14 周时(图2C-D),与MC 组比较,WDF、BDF 和ODF 3 组显著降低了小鼠空腹血糖和灌胃后30 min 血糖(P<0.05),而各db/db小鼠之间AUC 值未出现明显差异(P>0.05)。
表1 谷物膳食纤维对db/db 小鼠空腹血糖水平变化的影响
Table 1 Effect of cereal dietary fiber on changes in fasting blood glucose levels in db/db mice
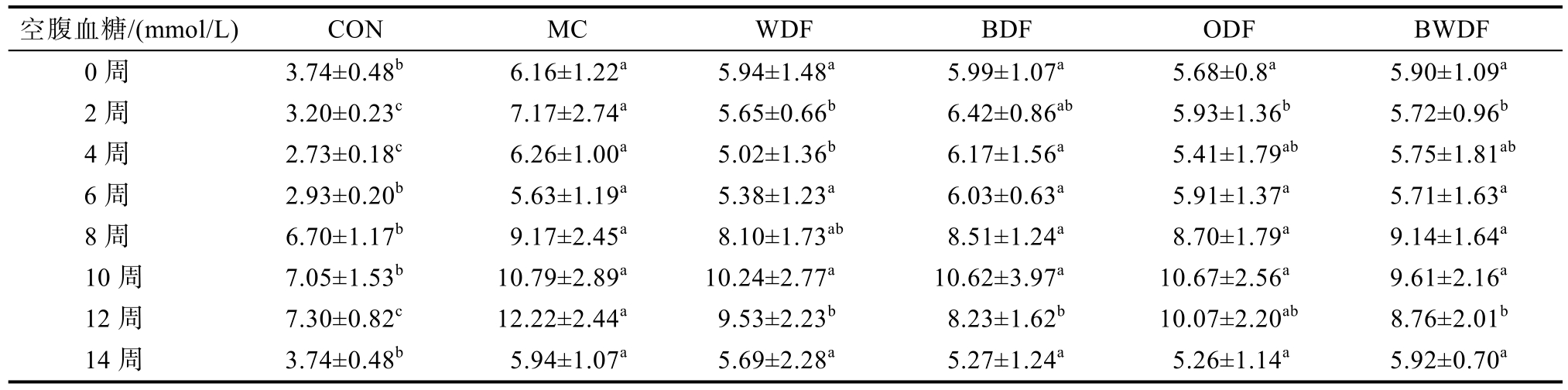
注:不同字母代表组间存在差异(P<0.05),下同。
Note: Different letters indicate differences between groups (P<0.05), the same as below.
空腹血糖/(mmol/L) CON MC WDF BDF ODF BWDF 0 周 3.74±0.48b 6.16±1.22a 5.94±1.48a 5.99±1.07a 5.68±0.8a 5.90±1.09a 2 周 3.20±0.23c 7.17±2.74a 5.65±0.66b 6.42±0.86ab 5.93±1.36b 5.72±0.96b 4 周 2.73±0.18c 6.26±1.00a 5.02±1.36b 6.17±1.56a 5.41±1.79ab 5.75±1.81ab 6 周 2.93±0.20b 5.63±1.19a 5.38±1.23a 6.03±0.63a 5.91±1.37a 5.71±1.63a 8 周 6.70±1.17b 9.17±2.45a 8.10±1.73ab 8.51±1.24a 8.70±1.79a 9.14±1.64a 10 周 7.05±1.53b 10.79±2.89a 10.24±2.77a 10.62±3.97a 10.67±2.56a 9.61±2.16a 12 周 7.30±0.82c 12.22±2.44a 9.53±2.23b 8.23±1.62b 10.07±2.20ab 8.76±2.01b 14 周 3.74±0.48b 5.94±1.07a 5.69±2.28a 5.27±1.24a 5.26±1.14a 5.92±0.70a
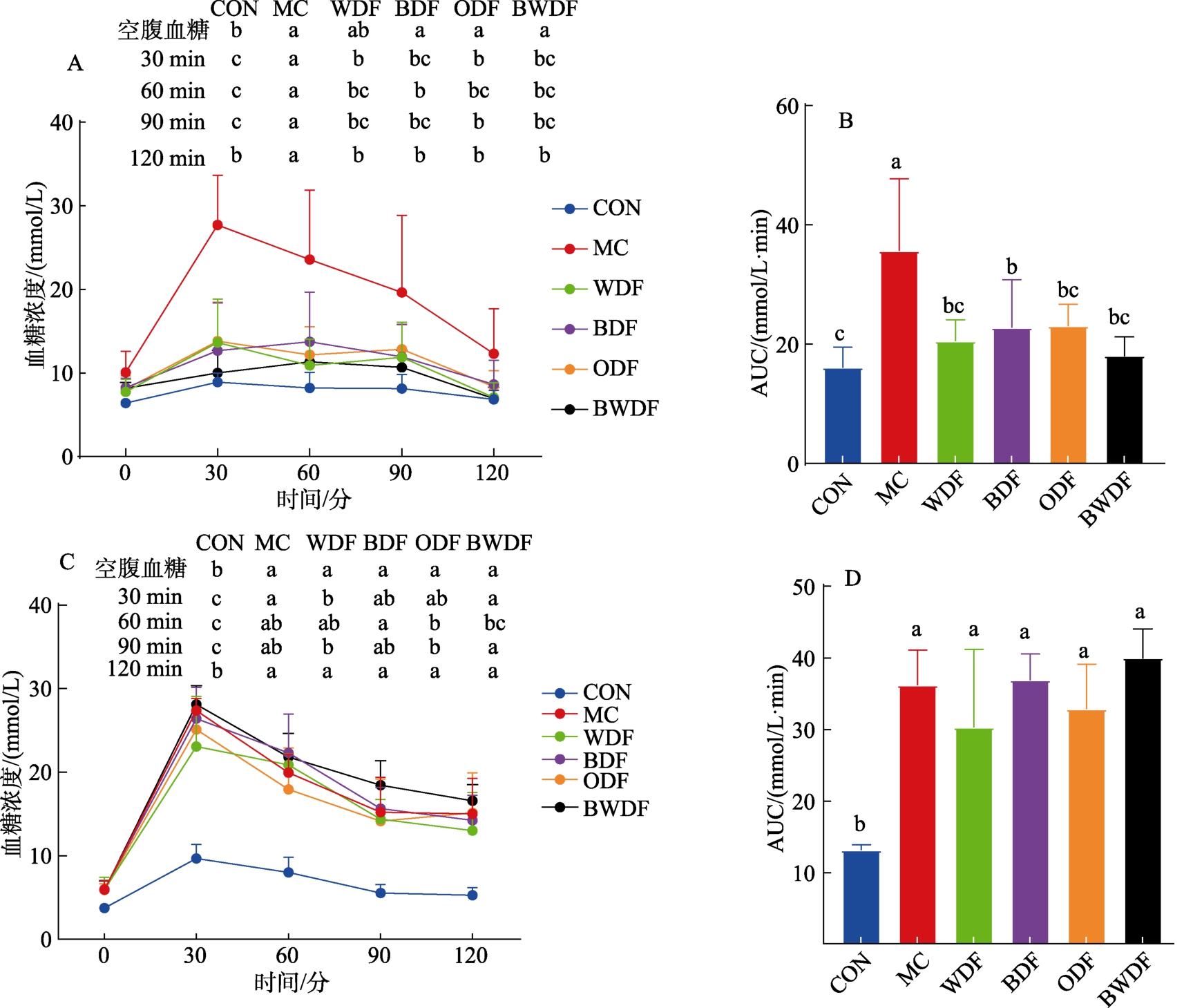
图2 谷物膳食纤维对db/db 小鼠糖耐量和AUC 的影响
Fig.2 Effect of cereal dietary fiber on glucose tolerance and area under the blood glucose-time curve (AUC) of db/db mice
注:(A)8 周葡萄糖耐量试验(OGTT);(B)8 周OGTT 曲线下面积(AUC);(C)14 周OGTT;(D)14 周曲线下面积(AUC)。
Note: (A) 8-week glucose tolerance test (OGTT); (B) 8-week OGTT area under the curve (AUC); (C) 14-week OGTT; (D) 14-week area under the curve (AUC).
2.3 谷物膳食纤维对db/db 小鼠血液生化指标的影响
小鼠血液生化指标如图3 所示,与CON 组比较,MC 组LDL-C 水平显著上升,而HDL-C 水平明显下降(P<0.01),与MC 组比较,WDF 组和BDF 组LDL-C 水平下降,而ODF 组和BWDF组HDL-C 浓度升高(P<0.05,图3A~B)。与CON组相比,MC 组血清IL-6、IL-8 水平显著升高,IL-10 水平显著降低(P<0.05),与MC 组比较,谷物DF 干预组IL-6 水平均显著降低(图3C),IL-8 水平在BDF、ODF 和BWDF 组中显著下降,并且趋于CON 组水平(P<0.05,图3D);BWDF组显著降低了小鼠血液IL-1β 水平(图3E),TNF-α水平在BDF 组降低(图3F),IL-10 水平在WDF、BDF 和BWDF 3 组中显著升高(P<0.05,图3G)。

图3 谷物膳食纤维对db/db 小鼠血液生化指标的影响
Fig.3 Effects of cereal dietary fiber on blood biochemical indexes of db/db mice
注:(A~B)14 周血液脂质水平变化;(C~G)血液炎症因子浓度变化。
Note: (A~B) 14-week changes in blood lipid levels; (C~G) changes in blood inflammatory factor concentrations.
2.4 谷物膳食纤维对db/db 小鼠肠道菌群的影响
2.4.1 肠道菌群多样性指数的变化
α 多样性结果如图4 所示,与CON 和MC 组比较,谷物DF 组肠道ACE 指数、Chao 指数Shannon 指数均显著升高,Simpson 指数显著降低(P<0.05,图4-D),表明,4 种谷物DF 均可提高菌群多样性和丰富度。图4E Venn 图展示了不同组之间共有和独有的OUT 数目,其中CON 组OTU 总数为217 个,MC 组OTU 数目为228 个,高于CON 组;谷物DF 干预组进一步增加db/db小鼠的OTU 数目,其中ODF 组OTU 数目最多,为302 个,WDF 组、ODF 组和BWDF 组OTU 数目分别为264 个、279 个和277 个;6 组之间共有的OTU 数目为166 个。表明谷物DF 干预后可增加小鼠肠道微生物的种类。

图4 谷物膳食纤维对db/db 小鼠肠道菌群多样性的影响
Fig.4 Effects of cereal dietary fiber on gut microbial diversity in db/db mice
注:(A) ACE 指数;(B) Chao 指数;(C) Shannon 指数;(D) Simpson 指数:(E)Venn 图;(F)PCoA 图。
Note: (A) ACE index; (B) Chao index; (C) Shannon index; (D) Simpson index: (E) Venn diagram; (F) PCoA diagram.
基于Bray-Curtis 距离的主成分分析法进行可视化肠道微生物群落结构和多样性差异分析,其结果如图4F 所示,各组之间微生物群落结构存在显著差异(P = 0.001,R = 0.494),并且呈现明显的分离和空间聚类。变异主轴(PC1)占总方差的30.25%,CON 组、MC 组和谷物DF 饮食干预组之间存在差异。MC 组与WDF 组和ODF 组之间的Bray-Curtis 距离大于MC 组与BDF 和BWDF组之间的距离。此外,沿PC2 轴,BDF 和BWDF干预组显著地将微生物谱从MC 组转向CON 组,而BWDF 组与CON 组处于相似的相对位置。结果表明,谷物DF 干预,尤其是WDF、ODF 和BWD 影响了db/db 糖尿病小鼠的肠道微生物群。
2.4.2 门水平菌群丰度及差异
如图5 所示,在门水平上,小鼠菌群主要由主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、疣 微 菌 门( Verrucomicrobiota )、 变 形 菌 门(Proteobacteria)、脱硫菌门(Desulfobacterota)和放线菌门(Actinobacteriota)组成(图5A)。比较各组间特定微生物相对丰度,结果发现:与MC 组相比,WDF 和BDF 组厚壁菌门相对丰度显著上升(图5B,P<0.05),BDF 组拟杆菌门丰度显著降低(图5C,P<0.05)。此外,与MC 组比较(图5D),厚壁菌门/拟杆菌门(Firmicutes/Bacteroide,F/B)在BDF 组显著升高(P<0.05);同时,MC 组放线菌门的相对丰度显著低于CON组,而BDF 干预组逆转了上述现象(图5E,P<0.05)。

图5 谷物膳食纤维对db/db 小鼠肠道菌群门水平组成的影响
Fig.5 Effects of cereal dietary fiber on abundance of gut microbiota at family level in db/db mice
注:(A) 门水平组成;(B) Firmicutes;(C) Bacteroidota;(D) Firmicutes/Bacteroidota;(E) Actinobacteriota。
Notes: (A) Horizontal composition of phylum; (B) Firmicutes; (C) Bacteroidota; (D) Firmicutes/Bacteroidota; (E) Actinobacteriota.
2.4.3 属水平丰度及差异
如图6 所示,在属水平上,小鼠肠道优势菌群主要为嗜黏蛋白阿克曼菌属(Akkermansia)、norank_f__Muribaculaceae、拟杆菌属(Bacteroides)、粪杆菌属(Faecalibaculum)、埃希-志贺菌属(Escherichia-Shigella)、罗姆布茨菌(Romboutsia)、乳杆菌属(Lactobacillus)等(图6A)。与MC 组比较,norank_f__Muribaculaceae 和另枝菌属(Alistipes)相对丰度在WDF 组、ODF 组和BWDF组升高(P<0.05,图6B~C);粪杆菌属和罗姆布茨菌丰度在分别在BWDF 组和WDF 组增加(P <0.05,图6D~E);Lachnospiraceae_NK4A136_group相对丰度在WDF 组、BDF 组和BWDF 组中显著增加(P<0.05,图6F);而拟杆菌属在BWDF 组显著降低(P<0.05,图6G)。

图6 谷物膳食纤维对db/db 小鼠肠道菌群属水平组成的影响
Fig.6 Effects of cereal dietary fiber on abundance of gut microbiota at genus level in db/db mice
注:(A) 属水平组成;(B) norank_f__Muribaculaceae;(C)Alistipes;(D) Faecalibaculum;(E) Romboutsia;(F) Lachnospiraceae_NK4A136_group;(G) Bacteroides。
Notes: (A) Horizontal composition of genera; (B) norank_f__Muribaculaceae; (C) Alistipes; (D) Faecalibaculum; (E) Romboutsia; (F)Lachnospiraceae_NK4A136_group; (G) Bacteroides.
2.4.4 LEfSe 多级物种差异分析
采用非参数统计中的Kruskal-Wallis 秩和检验和LDA 估计各物种丰度的效应大小,利用LEfSe确定5 组db/db 小鼠之间的显著差异物种。LEfSe 分析结果如图7 所示,db/db 组具有显著不同的群落特征分别属于疣微菌门和阿克曼菌属。WDF 干预后标志物种属于消化链球菌科(Peptostreptococcaceae)和罗姆布茨菌等;B D F 组对丹毒丝菌科、肠杆菌科和乳酸菌科等具有显著的选择性增强,ODF 组中对群落结构影响较大的物种有颤螺菌科(Oscillospiraceae)和另枝菌属;而BWDF 组显着富集的物种是norank_f__Muribaculaceae。

图7 谷物膳食纤维对db/db 小鼠肠道菌群LEfSe 多级物种差异分析
Fig.7 LEfSe identified the significantly different species among different db/db mice groups after cereal dietary fiber administration
注:(A)进化分支图;(B)分布柱状图。
Note: (A) Evolutionary branching diagram; (B) distribution histogram.
2.5 肠道差异菌群与代谢指标相关性分析
采用Pearson 相关分析进一步研究了肠道菌群与代谢指标之间存在的关系,结果如图8 所示:放线菌门和厚壁菌门/拟杆菌门(F/B)与空腹血糖(2 周、4 周和12 周)和IL-8 呈现显著负相关,与IL-10 呈现正相关,放线菌门单独与8 周AUC和 LDL-C 水平呈负相关;益生菌 norank_f__Muribaculaceae 与促炎因子IL-6、IL-1β 和TNF-α呈负相关,而与HDL-C 呈正相关;另枝菌属和norank_f__ Muribaculaceae 与IL-1β 呈现显著负相关;粪杆菌属和罗姆布茨菌分别与IL-8 和TNF-α呈现负相关;拟杆菌属与空腹血糖和炎症因子(IL-8 和TNF-α)呈现显著正相关,而与HDL-C呈现负相关。结果表明谷物DF 调控肠道菌群可能是其改善糖脂代谢紊乱和降低炎症水平的关键作用途径。
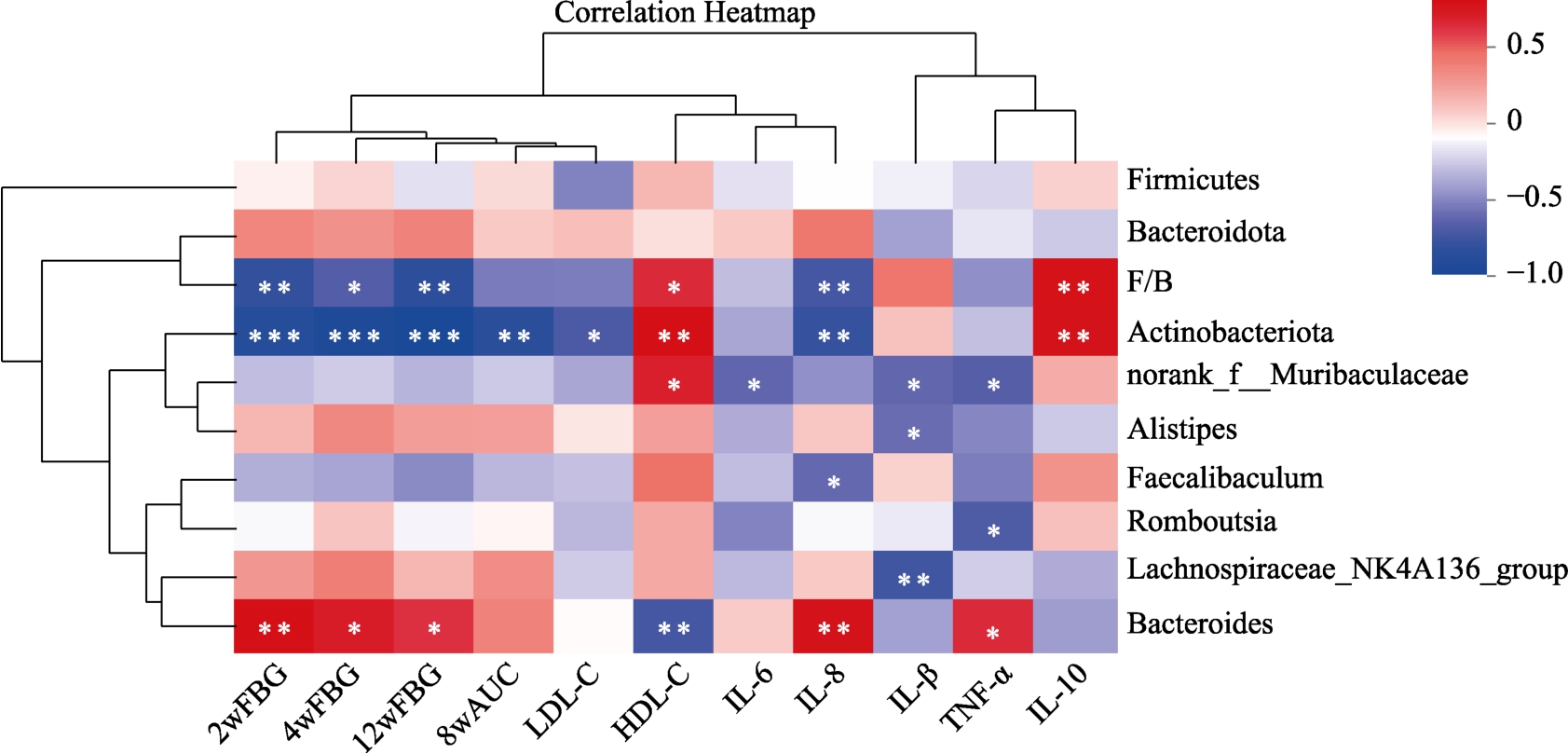
图8 肠道菌群与代谢指标相关性分析
Fig.8 Correlation analysis between gut microbiota and metabolic indicators
注:红色代表正相关,蓝色代表负相关;*显著相关(P<0.05);**极显著相关(P<0.01);***高度显著相关(P<0.001);2wFBG表示2 周时空腹血糖,以下同上;8wAUC 表示8 周时血糖曲线下面积。
Note: Red represents positive correlation and blue represents negative correlation; * significant correlation (P<0.05); ** highly significant correlation (P < 0.01); *** highly significant correlation (P < 0.001); 2wFBG denotes fasting blood glucose at 2 weeks, the same as below; 8wAUC denotes the area under the curve of blood glucose at 8 weeks.
3 讨论
db/db 小鼠是公认的缺乏功能性瘦素受体的T2DM 模型[8]。本试验选取4 种谷物DF 为研究对象,探讨其对db/db 小鼠糖代谢和肠道菌群的影响及差异化。
空腹血糖和OGTT 是诊断糖尿病最重要的指标。在干预初期(2 周),WDF、ODF 和BWDF降低了db/db 小鼠的空腹血糖水平,干预12 周时,WDF、BDF 和BWDF 组db/db 小鼠空腹血糖水平下降。同时,4 种谷物DF 均可降低小鼠8 周时OGTT-AUC 水平,表明谷物DF 对db/db 小鼠血糖异常具有改善效果。T2DM 会引起血脂异常和慢性低度炎症[9]。本试验发现,经谷物DF 干预后,WDF和BDF 组小鼠LDL-C 水平降低,ODF 和BWDF组HDL-C 水平升高;4 种谷物DF 均可降低db/db小鼠血液中炎症因子水平。以上结果表明,谷物DF 对db/db 小鼠糖耐量和血脂异常以及慢性炎症反应,具有明显的缓解作用。
越来越多的证据表明,肠道微生物群与T2DM 之间的关系是交织在一起的。增加肠道菌群多样性有助于改善T2DM 体内葡萄糖代谢平衡[10]。本研究发现,4 种谷物DF 在调节db/db 小鼠微生物多样性方面均具有显著效果,具体表现为增加肠道菌群OUT 水平和多样性水平。T2DM 微生物群中F/B 减少是肠道菌群失调的重要标志之一[11],其中拟杆菌门显示出致糖尿病的特性,可能由于拟杆菌损害了上皮细胞的屏障功能,促进慢性炎症的发生,引起糖代谢紊乱[12]。在本研究中与db/m 小鼠相比,db/db 小鼠肠道微生物失调的特征是放线菌门丰度大量下降。Mokhtari 等发现,与健康儿童相比,糖尿病儿童中放线菌门的细菌数量明显减少[13]。由此可见,放线菌门下降可能反应了db/db 小鼠生态失调或不稳定的肠道菌群结构。我们通过对比肠道菌群门水平发现,与MC组比较,BDF 组F/B 显著增加,同时放线菌门丰度显著升高,相关性分析结果同样显示,放线菌门丰度和F/B 与空腹血糖和促炎因子呈显著负相关,与抗炎因子呈正相关,说明BDF 可通过增加厚壁菌门水平及F/B、降低拟杆菌门相对丰度和回增放线菌门丰度改善db/db 小鼠糖代谢异常。
糖尿病人群肠道菌群的另一个代表性特征是产生短链脂肪酸(SCFAs)的细菌数量减少,有害细菌数量增加,破坏宿主内部代谢微环境平衡[5]。肠道菌群代谢产生的SCFAs 能够促进有益菌繁殖、抑制促炎因子产生、调控机体免疫反应、影响脂类代谢,参与血糖稳态调节,起到降血糖效果。norank_f__Muribaculaceae[14]广泛存在于肠道微生物组中,其丰度与空腹血糖和炎症水平呈负相关,对血糖调节有积极影响。粪杆菌属、令枝菌属和Lachnospiracae_NK4A136_group 是SCFAs中丁酸产生菌,是具有降血糖潜力的益生菌,可通过刺激AMPK 信号通路缓解葡萄糖、脂质代谢紊乱和炎症水平[15]。罗姆布茨菌是SCFAs 中乙酸产生菌,其丰度与肥胖和T2DM 呈负相关[16]。Goffau MC 等研究说明,拟杆菌属[17]在糖尿病发展中起到关键作用,其原因可能由于拟杆菌属可获得抗生素耐药基因,引起免疫受损,导致代谢失调[18]。本研究通过比较肠道菌群属水平结果发现,4 种谷物DF 在调节肠道菌群平衡方面均有明显效果,但是不同谷物DF 之间调控菌群种类是有差异的,具体表现为:WDF 可增加norank_f__Muribaculaceae、令枝菌属、罗姆布茨菌和 Lachnospiraceae_NK4A136_group 丰 度 ; BDF 增 加 了Lachnospiraceae_NK4A136_group 水平;ODF 促进norank_f__Muribaculaceae 和另枝菌属的增殖;而BWDF 则增加了norank_f__Muribaculaceae、另枝菌属、粪杆菌属和Lachnospiraceae_NK4A136_group 丰度,降低了拟杆菌属水平。相关性分析结果表明,谷物 DF 上调的菌属 norank_f__Muribaculaceae、令枝菌属、粪杆菌属和罗姆布茨菌均与促炎因子呈负相关,而下调的拟杆菌属与空腹血糖和炎症因子呈现显著正相关。这进一步证明谷物 DF 可通过调节相关菌属丰度改善T2DM db/db 小鼠的糖脂代谢紊乱和炎症反应。
4 结论
4 种谷物DF 可通过增加肠道菌群多样性和对菌群的不同调节作用,逆转T2DM db/db 小鼠空腹血糖和OGTT-AUC 升高现象,降低血脂和促进因子浓度并提高抗炎因子水平。这为开发含有谷物膳食纤维的功能食品提供了有力支持,也为推进粮食营养和功能性成分的高值化利用提供了新思路。
[1] CHEN Y, WANG M. New insights of anti-hyperglycemic agents and traditional Chinese medicine on gut microbiota in type 2 diabetes[J]. Drug Design, Development and Therapy, 2021, 15:4849-4863.
[2] YAO B, FANG H, XU W, et al. Dietary fiber intake and risk of type 2 diabetes: a dose-response analysis of prospective studies[J].European Journal of Epidemiology, 2014, 29: 79-88.
[3] GAGNON E, MITCHELL P L, MANIKPURAGE H D, et al.Impact of the gut microbiota and associated metabolites on cardiometabolic traits, chronic diseases and human longevity: a Mendelian randomization study[J]. Journal of Translational Medicine, 2023, 21(1): 60.
[4] CHEN L, LIU B, REN L, et al. High-fiber diet ameliorates gut microbiota, serum metabolism and emotional mood in type 2 diabetes patients[J]. Frontiers in Cellular and Infection Microbiology,2023, 13: 66.
[5] ZHAO L, ZHANG F, DING X, et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J]. Science,2018, 359(6380): 1151-1156.
[6] NIE Q, SUN Y, LI M, et al. Targeted modification of gut microbiota and related metabolites via dietary fiber[J].Carbohydrate Polymers, 2023, 316: 120986.
[7] LANCASTER S M, LEE-MCMULLEN B, ABBOTT C W, et al.Global, distinctive, and personal changes in molecular and microbial profiles by specific fibers in humans[J]. Cell Host &Microbe, 2022, 30(6): 848-862.
[8] ISLAM M S. Animal models of diabetic neuropathy: progress since 1960s[J]. Journal of Diabetes Research, 2013, 2013: 1-9.
[9] HANEFELD M, FLEISCHMANN H, SIEGMUND T, et al.Rationale for timely insulin therapy in type 2 diabetes within the framework of individualised treatment: 2020 update[J]. Diabetes Therapy, 2020, 11(8): 1645-1666.
[10] CHEN L, GUO L, FENG S, et al. Fecal microbiota transplantation ameliorates type 2 diabetes via metabolic remodeling of the gut microbiota in db/db mice[J]. BMJ Open Diabetes Research &Care, 2023, 11(3): e003282.
[11] SEKIROV I, RUSSELL L, ANTUNES M, et al. Gut microbiota in health and disease[J]. Physiological Reviews, 2010, 90(3):859-904.
[12] TLASKALOVÁ-HOGENOVÁ H, ŠTĚPÁNKOVÁ R, KOZÁKOVÁ H, et al. The role of gut microbiota (commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer: contribution of germ-free and gnotobiotic animal models of human diseases[J]. Cellular &Molecular Immunology, 2011, 8(2): 110-120.
[13] MOKHTARI P, METOS J, ANANDH P V. Impact of type 1 diabetes on the composition and functional potential of gut microbiome in children and adolescents: possible mechanisms,current knowledge, and challenges[J]. Gut Microbes, 2021,13(1): 1926841.
[14] OU Y, GUO Y, CHEN M, et al. Gut microbiome-serum metabolic profiles: insight into the hypoglycemic effect of Porphyra haitanensis glycoprotein on hyperglycemic mice[J]. Food &Function, 2023, 14(17): 7977-7991.
[15] ZHANG L, CHU J, HAO W, et al. Gut microbiota and type 2 diabetes mellitus: association, mechanism, and translational applications[J]. Mediators of Inflammation, 2021, 2021: 1-12.
[16] GERRITSEN J, HORNUNG B, RENCKENS B, et al. Genomic and functional analysis of Romboutsia ilealis CRIBT reveals adaptation to the small intestine[J]. PeerJ, 2017, 5:e3698.
[17] SALLES M, CIOFFI D, FERREIRA G. Probiotics supplementation and insulin resistance: a systematic review[J]. Diabetology &Metabolic Syndrome, 2020, 12(1): 98.
[18] GOFFAU M C, FUENTES S, BOGERT B, et al. Aberrant gut microbiota composition at the onset of type 1 diabetes in young children[J]. Diabetologia, 2014, 57(8): 1569-1577.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。