糖尿病是一种常见疾病,影响患者的生活质量。淀粉在胃肠道的消化吸收过程是最主要的血糖来源途径[1]。在可能导致糖尿病恶化的因素中,淀粉摄入过量是其中之一,因为过量的淀粉摄入通常伴随着过度消化。由于许多糖尿病患者难以控制淀粉摄入量,在进食淀粉类食物后易出现高血糖[2]。因此,人们一直在努力寻找含有能够降低淀粉消化速率的天然化合物制剂。根据淀粉消化速率的不同,可将淀粉分为快消化淀粉(Rapidly digestible starch, RDS)、慢消化淀粉(Slowly digestible starch, SDS)和抗性淀粉(Resistant starch, RS)[3]。SDS 在小肠中缓慢消化以维持餐后葡萄糖稳态,RS 的作用类似于膳食纤维,在进入大肠时保持完整,促进肠道健康。SDS 和RS有利于降低餐后血糖,减轻食欲,减少食物摄入,从而缓解高血糖症状[4]。事实上,已经有大量天然化合物被报道能够影响淀粉的消化速率,其中包括大量的多酚化合物,如类黄酮、酚酸、花青素和单宁酸[5]。Gesser 等发现富含单宁的两种栗子提取物有效抑制了小鼠模型的淀粉消化,葡萄糖水平分别降低了46%和59.3%[6]。Yu 等发现肉桂酸类酚酸显著抑制普通玉米淀粉消化率,其抑制作用随添加量的增加而增加[7]。张等观察到有色藜麦多酚降低了玉米淀粉消化率[8]。茶多酚表儿茶素没食子酸酯容易与淀粉的疏水区结合,通过氢键和疏水相互作用形成多酚-淀粉复合物,显著降低RDS 的含量并增加RS 的含量,延缓淀粉的消化,表明多酚可以通过与淀粉相互作用并改变淀粉的消化特性来延迟淀粉的消化[9-10]。
杨梅素是从杨梅的果实中提取的一种黄酮类化合物,具有清除自由基、抗氧化、抗肿瘤、降低神经毒性等多种功效[11]。已有研究报道杨梅素能与淀粉发生相互作用并具有降血糖功能,例如,钟晓瑜等将5%二氢杨梅素添加到大米淀粉中,大米淀粉的回生焓值、回生率以及相对结晶度分别下降了68.75%、71.86%、59.07%,表明杨梅素可以抑制大米淀粉的回生[12]。赵一灵考察了不同黄酮类化合物对α-淀粉酶的抑制作用机制及构效关系,发现杨梅素对猪胰腺α-淀粉酶的半数抑制浓度为(6.1±0.39)mg/mL[13]。逯凤肖等发现二氢杨梅素能极显著降低四氧嘧啶致病小鼠的血糖[14]。
本文旨在借助现代仪器手段,通过体外消化模拟实验,考察杨梅素对玉米淀粉消化率的影响,探究杨梅素与玉米淀粉之间的相互作用。研究结果将有助于进一步了解杨梅素与玉米淀粉之间的相互作用机制,以更大限度地利用玉米作物,为杨梅素作为降血糖功能因子提供理论实验依据。
1 材料与方法
1.1 仪器与试剂
杨梅素(纯度>99%):上海阿拉丁生化科技股份有限公司;α-淀粉酶(EC3.2.1.1,77.0 U/mg)和α-葡萄糖苷酶(EC3.2.1.20,19.3 U/mg):美国Sigma 公司;玉米淀粉,葡萄糖,无水乙醇均为国产分析纯试剂;实验过程中用水均为超纯水。
UV-2450 型紫外可见分光光度计:日本岛津;TM 1000 型台式环境扫描电子显微镜:日本日立;RS6000 型流变仪、DSC-250 型差示扫描量热仪:美国TA 仪器公司;LGJ-10 型冷冻真空干燥机:宁波新艺;D8 ADVANCE 型X-射线衍射仪:德国Bruker 公司;Nicolet iS50 型傅里叶红外光谱:美国赛默飞。
1.2 实验方法
1.2.1 杨梅素-淀粉样品的制备
参照黄艳梅[15]的方法,并作适当修改:将1 g玉米淀粉分别与不同浓度的杨梅素(终浓度为1.7、5.1、10.2、15.3 mg/mL)溶解于去离子水中(总体系为10 mL),在90 ℃水浴加热20 min,然后冷却至室温,制得杨梅素-淀粉样品。
1.2.2 体外淀粉消化性的测定
参照王梦婷[16]的方法,并作适当修改。将1 g玉米淀粉分别与不同浓度的杨梅素(最终浓度为0、1.7、5.1、10.2、15.3 mg/mL)溶解于pH 5.2的醋酸缓冲体系中(总体系10 mL),90 ℃水浴加热20 min,冷却至37 ℃。加入3 mL 消化酶液(α-淀粉酶和α-葡萄糖苷酶混合液)进行消化,分别在20、40、60、90、120、180、240 min 时停止反应,灭酶,5 000 rpm 离心10 min,取上清液,用二硝基水杨酸(Dinitrosalicylic acid,DNS)法测定其中的葡萄糖含量(利用紫外可见分光光度计测定540 nm 处的吸光度值),淀粉的消化率(Hydrolysis rate of starch, SH)计算如下:
G 为淀粉消化产生的葡萄糖量(g);TS 为反应前样品中淀粉的含量(g)。根据淀粉消化20 min和120 min 时的葡萄糖量,利用公式(2)~(4)计算得到RDS、SDS 和RS 的含量:
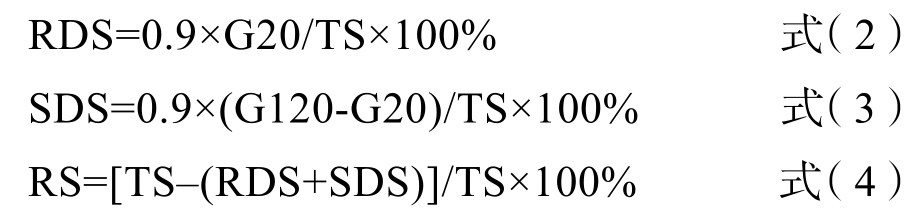
G20 为淀粉消化20 min 时产生的葡萄糖量(g);G120 为淀粉消化120 min 时产生的葡萄糖量(g)。葡萄糖含量的标准曲线:y=0.867 3x– 0.014 5(R2 = 0.994 8),x 为葡萄糖浓度(mg/mL),y为540 nm 处的吸光值。
1.2.3 淀粉与碘结合能力的评价
参照先前报道的方法[16]。将杨梅素-玉米淀粉样品与碘混合,随后加水稀释至3 mL,利用紫外吸收光谱扫描500~750 nm 下的光谱,扣除杨梅素-碘试剂的影响,得到紫外吸收差谱ΔA。
1.2.4 静态流变学性质的测定
参照黄艳梅[15]的方法,并作适当修改。将杨梅素-淀粉样品均匀加至流变仪的平板上,设置剪切速率为0.1~100 s-1,记录相应的剪切应力变化,得到流变曲线。用公式δ=K·γn 对得到的流变曲线进行拟合。δ 为剪切力;K 为稠度系数;γ 为剪切速率;n 为流体行为指数。
1.2.5 热力学特性的测定参照陆林[17]的方法,并作适当修改。利用冷冻真空干燥机将杨梅素-淀粉样品进行冻干,称取2 mg 于坩埚中,加入蒸馏水,平衡12 h,然后利用差示扫描量热仪进行测定,升温速率10 ℃/min,升温范围25~100 ℃。
1.2.6 X-射线衍射仪
参照林丽[18]的方法,并作适当修改。利用冷冻真空干燥机将杨梅素-淀粉样品进行冻干,采用X-射线衍射仪对冻干样品进行扫描,衍射角(2θ)为 4~40°,步长 0.02°。相对结晶度(Relative crystallinity)=Ac/(Ac+Aa)×100%,其中Ac(结晶区域面积);Aa(非结晶区域面积)。
1.2.7 傅里叶红外光谱
参照刘佳松[19]的方法,并作适当修改。利用冷冻真空干燥机将杨梅素-淀粉样品进行冻干,然后将样品与溴化钾(KBr)混合研磨,用傅里叶红外光谱对样品进行测试,波数范围为4 000~400 cm-1,分辨率4 cm-1。
1.2.8 扫描电子显微镜
参照周慧超[20]的方法,并作适当修改。利用冷冻真空干燥机将杨梅素-淀粉样品进行冻干,喷金,用台式环境扫描电子显微镜观察样品,放大倍数为500×。
1.3 数据处理
本实验中的数据表示为平均值±标准差,所有数据均独立测定3 次以上。数据在Origin 2018 软件上进行了单因素方差分析(One-way ANOVA)。
2 结果与讨论
2.1 杨梅素对淀粉体外消化性的影响
如图1A 所示,杨梅素能够抑制玉米淀粉的消化。未加入杨梅素之前,玉米淀粉的消化率达到86.53%,加入杨梅素之后,玉米淀粉的消化速率降低,并且随着杨梅素浓度的增大,玉米淀粉的消化率下降的越多,呈现剂量依赖性。随着杨梅素含量的增大,RDS 含量显著减少(P<0.05),RS 含量则显著增加(P<0.05)。浓度范围在1.7~15.3 mg/mL 内的杨梅素将RDS 含量从22.72%降低至 19.35%,则将 RS 含量从 18.11%提高至39.25%(图1B)。说明杨梅素对玉米淀粉消化具有较强的抑制作用,能够缓解玉米淀粉的消化,从而降低体内血糖含量。
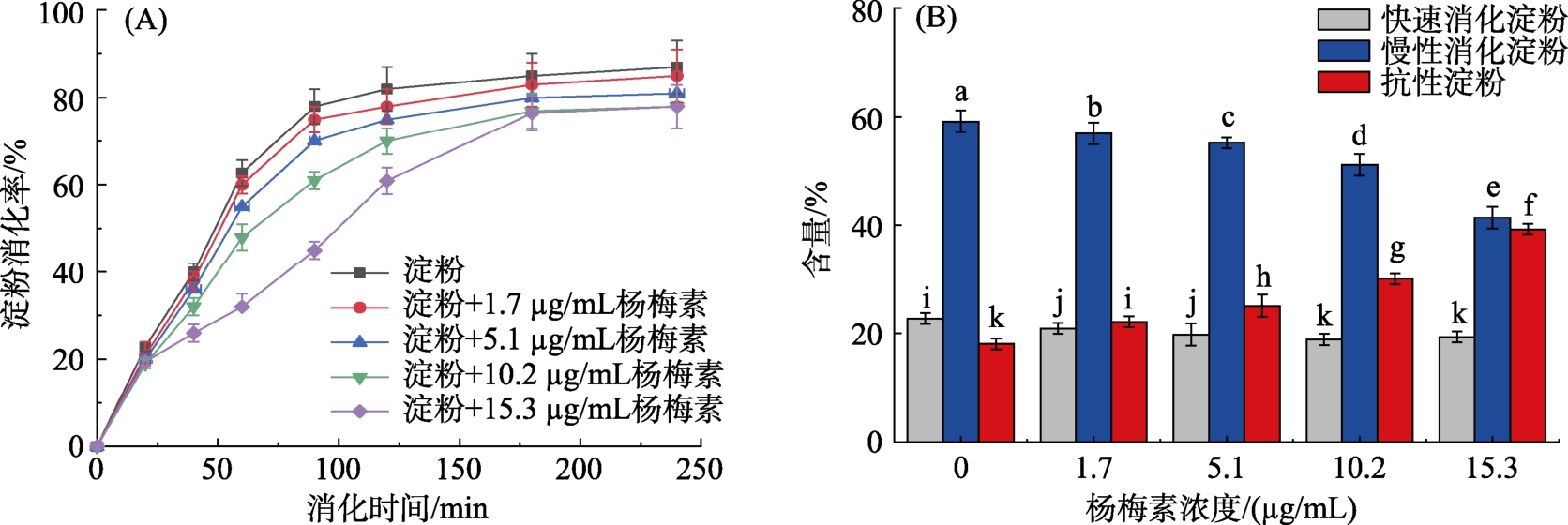
图1 杨梅素对玉米淀粉消化性的影响
Fig.1 Effect of myricetin on the digestibility of corn starch
注:(A):杨梅素对玉米淀粉体外消化的影响;(B):杨梅素-玉米淀粉样品中快消化淀粉,慢消化淀粉和抗性淀粉的含量。不同字母表示差异性显著(P<0.05)。
Note: (A) Effect of myricetin on digestion of corn starch in vitro; (B) Content of fast-digesting starch, slow-digesting starch and resistant starch in myricetin-corn starch samples. Different letters indicated significait differces (P<0.05).
2.2 杨梅素对淀粉-碘结合能力的影响
如图2 所示,在571 nm 处,玉米淀粉-碘出现了最高吸收峰,说明玉米淀粉与碘发生了络合反应,显蓝色。加入杨梅素后,玉米淀粉-碘的吸收峰强度(ΔA 值)减弱,并且杨梅素浓度越大,峰值降低的越多,呈剂量依赖性。当杨梅素浓度增加到15.3 mg/mL 时,淀粉-碘的吸收峰强度降低了13.76%,并且峰值从571 nm 移动到602 nm。说明杨梅素能抑制淀粉与碘形成复合物,推测是因为杨梅素能和碘发生竞争,占据碘在玉米淀粉上的结合位点,与玉米淀粉发生相互作用。
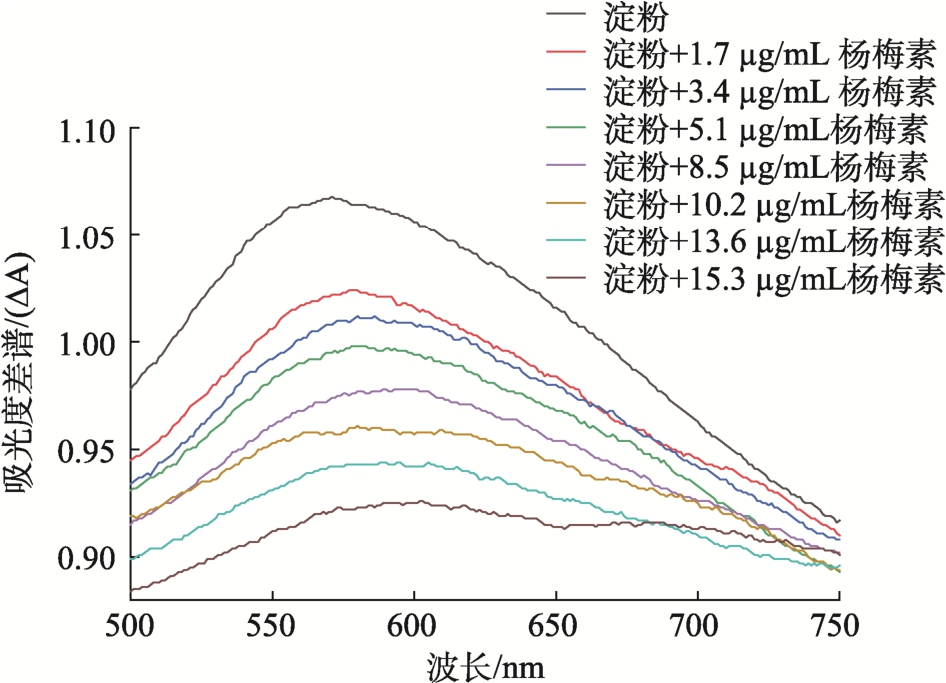
图2 杨梅素对玉米淀粉-碘紫外吸收差谱(ΔA)的影响
Fig.2 Effect of myricetin on ultraviolet absorption difference spectra (ΔA) of corn starch-iodine
2.3 杨梅素对淀粉静态流变学性质的影响
如图3 所示,在剪切速率不变的情况下,加入杨梅素后,淀粉糊的剪切应力变大,并且杨梅素浓度越大,剪切应力越大,呈现剂量依赖性,说明杨梅素改变了淀粉糊的静态流变学性质。随后,对不同浓度的杨梅素-玉米淀粉样品的静态流变曲线进行拟合,如表1 所示,加入杨梅素后,淀粉糊的稠度系数K 值增大,流动行为指数n 值减小,说明杨梅素与玉米淀粉发生了相互作用,增大了玉米淀粉糊的表观粘度,致使其流动性变差,影响了玉米淀粉糊的流变性。
表1 杨梅素对玉米淀粉静态流变拟合的参数
Table 1 Parameters of static rheology of myricetin-corn starch
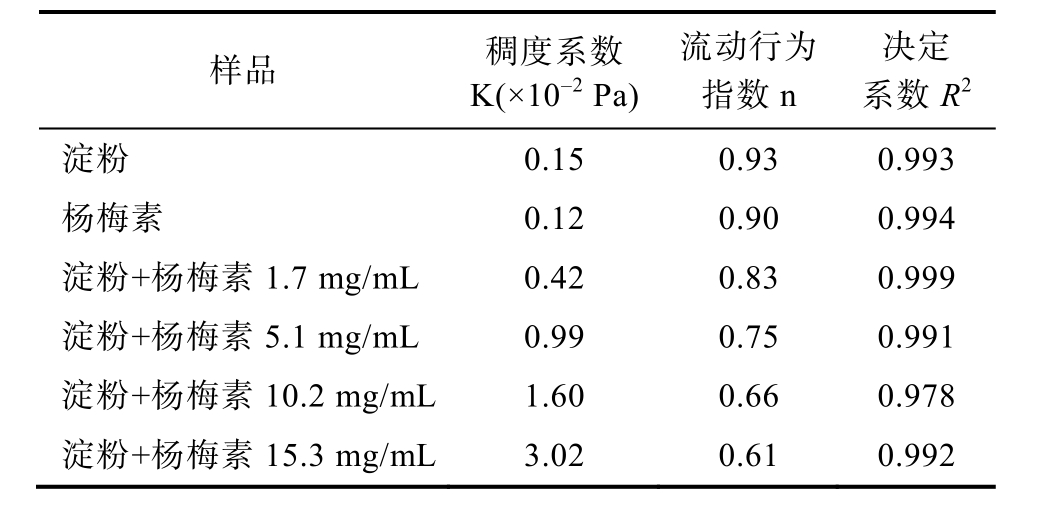
样品 稠度系数K(×10–2 Pa)流动行为指数n决定系数R2淀粉 0.15 0.93 0.993杨梅素 0.12 0.90 0.994淀粉+杨梅素1.7 mg/mL 0.42 0.83 0.999淀粉+杨梅素5.1 mg/mL 0.99 0.75 0.991淀粉+杨梅素10.2 mg/mL 1.60 0.66 0.978淀粉+杨梅素15.3 mg/mL 3.02 0.61 0.992
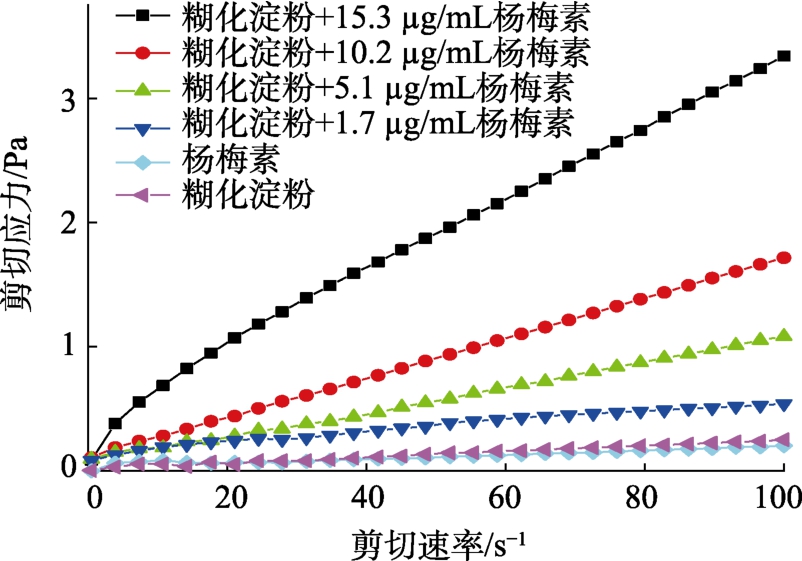
图3 杨梅素对玉米淀粉静态流变学性质的影响
Fig.3 Effect of myricetin on the static rheological properties of corn starch
2.4 杨梅素对淀粉热力学特性的影响
杨梅素-淀粉样品的相关热力学参数如表2 所示。糊化焓表示淀粉在糊化过程中破坏双螺旋结构所需的能量,与分子内结晶密度有关。加入杨梅素后,淀粉样品的糊化峰值先减小后增大,表明杨梅素使淀粉的热稳定性降低。同时,杨梅素-淀粉样品的糊化焓值降低,推断杨梅素的加入,使得淀粉分子间的连接键断裂,淀粉的结晶结构被破坏。
表2 杨梅素对淀粉热力学特性参数的影响
Table 2 Effect of myricetin on the parameters of thermodynamic properties of corn starch

注:同列中不同字母表示差异性显著(P<0.05)。
Note: Different letters in the same column indicated significant differences (P<0.05).
样品 糊化起始温度T0/℃ 糊化峰值温度TP/℃ 糊化终止温度Tc/℃ 糊化焓ΔH/(J/g)淀粉 55.10±0.10b 62.87±0.03b 67.32±0.10b 37.88±0.00a淀粉+杨梅素3.4 μg/mL 53.89±0.03c 57.03±0.12d 62.21±0.14d 11.93±0.13b淀粉+杨梅素10.2 μg/mL 55.25±0.15b 59.54±0.21c 64.59±0.02c 10.98±0.20c淀粉+杨梅素15.3 μg/mL 62.03±0.13a 66.27±0.11a 69.11±0.12a 9.23±0.12d
2.5 杨梅素对玉米淀粉结晶结构的影响
XRD 用于分析淀粉的结晶结构和相对结晶度,主要反映其与双螺旋堆积相关的长程有序结构。如图4 所示,天然玉米淀粉(Native starch)在2θ=15°、17°、22°附近出现明显特征衍射峰。玉米淀粉糊化后,没有新的衍射峰,且衍射峰强度降低,相对结晶度从18.33%降至15.11%。加入15.3 μg/mL 的杨梅素后,也未发现新峰,说明杨梅素-淀粉相互作用主要是由非共价键主导的。但加入杨梅素后,糊化玉米淀粉的衍射峰强度减弱,相对结晶度从15.11%降至13.21%,有削弱B 型峰的趋势,说明杨梅素会使糊化玉米淀粉的结晶结构受到破坏,双螺旋被分解,从而影响淀粉的长程有序结构,无定形区的比例增加,这与之前的研究结果一致[16,21]。
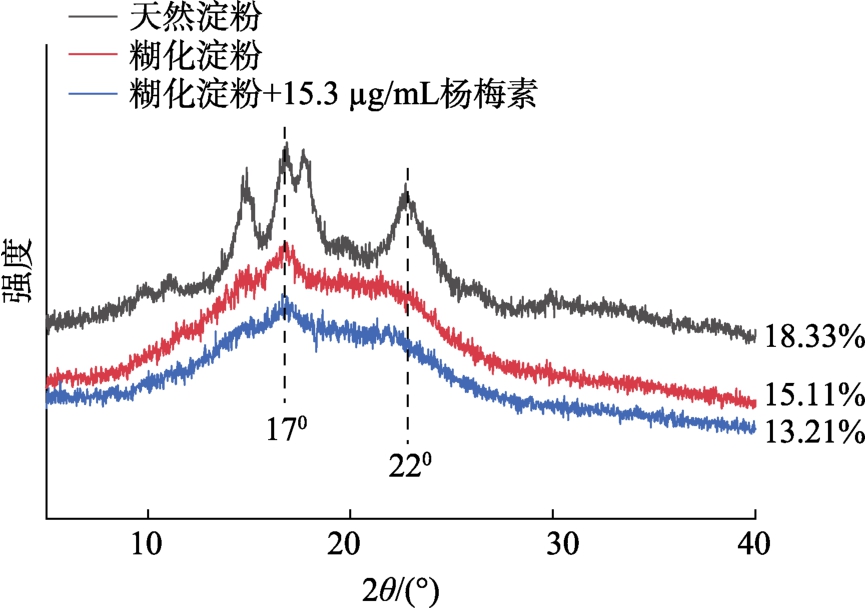
图4 杨梅素-玉米淀粉的X 射线衍射图谱(XRD)
Fig.4 X-ray diffraction pattern (XRD) of myricetin-corn starch
2.6 杨梅素对淀粉官能团结构的影响
红外光谱图中3 287 cm-1 处的峰与官能团O—H 的振动有关,572~1 016 cm-1 的峰与官能团C==O 的伸缩振动有关。如图5 所示,玉米淀粉经糊化后,没有出现新的峰。加入杨梅素后,也无新峰出现,说明杨梅素与玉米淀粉的相互作用是由非共价键主导的。但是加入杨梅素后,玉米淀粉在3 287 cm-1 处的吸收峰向3 314 cm-1 偏移,说明杨梅素的加入一定程度上破坏了玉米淀粉链之间的氢键,并且杨梅素使得玉米淀粉在1 200~900 cm-1 之间的峰型和吸收强度也略有改变,说明杨梅素的加入影响了玉米淀粉的短程有序性。
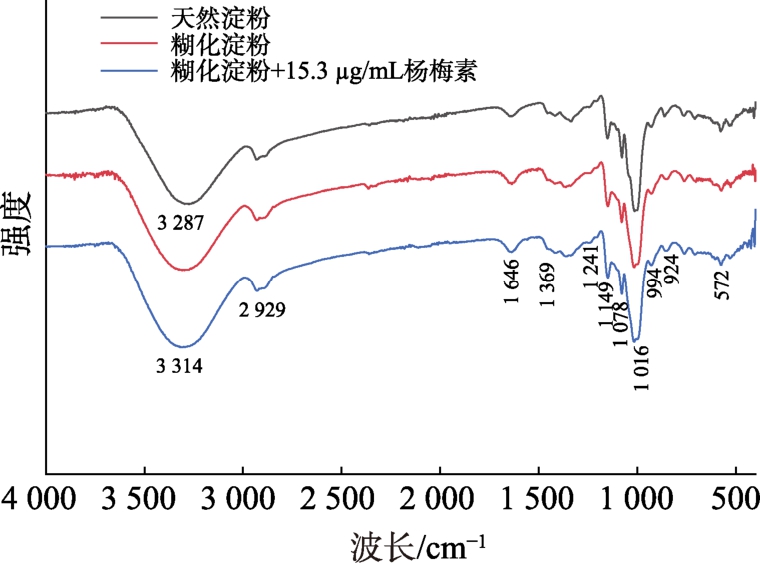
图5 杨梅素-玉米淀粉的傅里叶变换红外光谱(FT-IR)
Fig.5 Fourier transform infrared (FT-IR) spectrum of myricetin-corn starch
2.7 杨梅素对淀粉微观结构的影响
如图6A 所示,天然玉米淀粉呈现光滑的颗粒状。经糊化后,玉米淀粉表面变得粗糙,聚集成块状(图6B)。加入杨梅素后,杨梅素促使糊化的玉米淀粉聚集并黏附成薄片状(图6C~D),并且形成更大的聚集体,这样的形态使得玉米淀粉更加不易被消化酶水解,不易转化成被人体吸收的葡萄糖。

图6 杨梅素-玉米淀粉样品的扫描电镜
Fig.6 Scanning electron microscopy of myricetin-corn starch samples
注:(A):天然淀粉;(B):糊化淀粉;(C):5.1mg/mL杨梅素-淀粉样品;(D):10.2 mg/mL 杨梅素-淀粉样品。
Note: Scanning electron micrographs of (A) natural corn starch, (B) gelatinized corn starch, (C) 5.1 mg/mL myricetin-corn starch sample, and (D) 10.2 mg/mL myricetin-corn starch sample.
3 结论
杨梅素可以显著抑制玉米淀粉的消化,1.7~15.3 mg/mL 的杨梅素可以将玉米淀粉的快速消化淀粉(RDS)含量从22.72%降至19.35%,抗性淀粉(RS)含量从18.11%升至39.25%。杨梅素是通过非共价作用与玉米淀粉结合,同时降低玉米淀粉的热稳定性,使得淀粉分子间的连接键断裂,破坏玉米淀粉原本的结晶结构,降低淀粉的结晶度,影响淀粉的有序性,使得淀粉的无定形区比例增加,并且与玉米淀粉形成更大的聚集体,使其更加不易被消化酶消化水解,进而不易转化为被人体吸收的葡萄糖。
[1] 李华, 吴庆峰, 薛晴晴, 等. 低血糖指数食品的研究进展[J].河南工业大学学报(自然科学版), 2023, 44(2): 119-126.LI H, WU Q F, XUE Q Q et al. Research progress of low glycemic index foods[J]. Journal of Henan University of Technology(Natural Science Edition), 2023, 44(2): 119-126.
[2] FARADIANNA E L, HAZREEN S B, SHAFIZA A I, et al.Postprandial glucose-lowering effects by sago (Metroxylon sagu Rottb.) resistant starch in spontaneously type 2 diabetes,Goto-Kakizaki rat[J]. Nutrition and Health, 2023.
[3] ZHIQIAN W, MINGCONG F, KANZA H, et al. Impact of red kidney bean protein on starch digestion and exploring its underlying mechanism[J]. International Journal of Biological Macromolecules, 2023, 253: 6.
[4] 高品涵, 薛薇, 李婷, 等. 内源性物质对不同品种大米淀粉消化性的影响[J/OL]. 中国粮油学报: 1-12[2023-10-23].GAO P H, XUE W, LI T, et al. Effects of endogenous substances on starch digestibility of different varieties of rice[J/OL]. Chinese Journal of Cereals and Oils: 1-12[2023-10-23].
[5] 任顺成, 陈佳乐, 陶华. 多酚对淀粉慢消化作用及其生物利用率研究进展[J]. 河南工业大学学报(自然科学版), 2022,43(3): 133-140.REN S C, CHEN J L, TAO H. Progress of polyphenols on the slow digestion of starch and its bioavailability[J]. Journal of Henan University of Technology (Natural Science Edition),2022, 43(3): 133-140.
[6] GESSER V C, ANDRADE A J G, RITA A S, et al. Exploring the α-amylase-inhibitory properties of tannin-rich extracts of Cytinus hypocistis on starch digestion[J]. Food Research International,2023, 173: 1.
[7] YU M H, ZHU S, TAO X, et al. Inhibition of starch digestion by phenolic acids with a cinnamic acid backbone: Structural requirements for the inhibition of α-amylase and α-glucosidase[J]. Food Chemistry, 2024, 435.
[8] ZHANG Q Z, FAN S Y, XIE H J, et al. Polyphenols from pigmented quinoa as potential modulators of maize starch digestion:Role of the starch-polyphenol inclusion and non-inclusion complexes[J]. Food Hydrocolloids, 2023, 144.
[9] SHAN W, CHAO J, HUIJUAN J, et al. Synthesis of ECG((-)-epicatechin gallate) acylated derivatives as new inhibitors of α-amylase and their mechanism on delaying starch digestion[J].Food Bioscience, 2023, 52.
[10] DENG N, DENG Z, TANG C, et al. Formation, structure and properties of the starch-polyphenol inclusion complex: A review[J]. Trends in Food Science & Technology, 112 (2021): 667-675.
[11] XUE H K, CUI P S, TAN J Q, et al. Separation of principal component dihydromyricetin from Ampelopsis grossedentata by high-speed counter-current chromatography and its interaction with corn starch[J]. Journal of Food Science, 2022, 87(6): 2350-2363.
[12] 钟晓瑜, 杨志伟. 二氢杨梅素对大米淀粉回生的抑制作用[J].现代食品科技, 2022, 38(9): 153-158.ZHONG X Y, YANG Z W. Inhibitory effect of dihydromyricetin on rice starch regrowth[J]. Modern Food Science and Technology,2022, 38(9): 153-158.
[13] 赵一灵. 不同黄酮类化合物对α-淀粉酶的抑制作用机制及蒲公英果冻的开发[D]. 南昌: 南昌大学, 2023.ZHAO Y L. Mechanism of inhibition of α-amylase by different flavonoids and development of dandelion jelly[D]. Nanchang:Nanchang University, 2023.
[14] 逯凤肖, 王恩花, 秦湉, 等. 二氢杨梅素对糖尿病小鼠降糖作用研究[J]. 中药药理与临床, 2016, 32(3): 45-48.LU F X, WANG E H, QIN T, et al. Study on the hypoglycemic effect of dihydromyricetin on diabetic mice[J]. Pharmacology and Clinics of Traditional Chinese Medicine, 2016, 32(3): 45-48.
[15] 黄艳梅. 蒲公英黄酮对马铃薯淀粉和面条体外消化特性的影响及其机制[D]. 苏州: 苏州大学, 2021.HUANG Y M. Effects of dandelion flavonoids on in vitro digestive properties of potato starch and noodles and its mechanism[D].Suzhou: Suzhou University, 2021.
[16] 王梦婷. 杨梅叶原花色素基于调控淀粉消化吸收和肝糖代谢的降血糖作用机制[D]. 杭州: 浙江大学, 2021.WANG M T. Hypoglycemic mechanism of Yangmei leaf proanthocyanidins based on the regulation of starch digestion and absorption and hepatic glucose metabolism[D]. Hangzhou:Zhejiang University, 2021.
[17] 陆林. 鹰嘴豆粉强化对饼干淀粉消化性与质构的影响及其机制[D]. 无锡: 江南大学, 2023.LU L. Effect of chickpea flour fortification on starch digestibility and texture of cookies and its mechanism[D]. Wuxi: Jiangnan University, 2023.
[18] 林丽. 大米蛋白水解物对小麦淀粉理化性质及体外消化性影响的研究[D]. 合肥: 安徽农业大学, 2023.LIN L. Study on the effect of rice protein hydrolysate on the physicochemical properties and in vitro digestibility of wheat starch[D]. Hefei: Anhui Agricultural University, 2023.
[19] 刘佳松. 乳清蛋白及其酶解产物对淀粉消化性影响机制探究[D]. 无锡: 江南大学, 2022.LIU J S. Investigation on the mechanism of the effect of whey protein and its enzymatic products on starch digestibility[D].Wuxi: Jiangnan University, 2022.
[20] 周慧超. 小麦颗粒粉添加对挂面品质及其淀粉消化性的影响[D]. 郑州: 河南工业大学, 2023.ZHOU H C. Effect of wheat grain flour addition on the quality of hanging noodles and its starch digestibility[D]. Zhengzhou:Henan University of Technology, 2023.
[21] 赵宁涛, 刘百成, 董新红, 等. 莓茶黄酮提取物对粉葛淀粉结构和体外消化的影响[J]. 粮食与油脂, 2024, 37(4): 124-128.ZHAO N T, LIU B C, DONG X H, et al. Effects of berry tea flavonoid extract on the structure and in vitro digestion of kudzu starch[J]. Grain and Oil, 2024, 37(4): 124-128.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。