雨生红球藻(Haematococcus pluvialis)是一种单细胞绿藻,已被我国批准为新资源食品[1],可以作为原料直接加入普通食品和保健食品中,是继螺旋藻、小球藻之后又一重要的经济型藻类,也是迄今为止发现的最丰富的天然虾青素来源。目前,关于除去虾青素后雨生红球藻的研究极少,对于其中所含蛋白质的研究更少。大多数研究主要集中在雨生红球藻中虾青素的提取和功能活性评价等方面,忽略了虾青素提取后的雨生红球藻副产物中蛋白质的存在,这些副产物一般作为动物饲料或被直接丢弃,造成环境污染和资源浪费。雨生红球藻中蛋白质的含量为16%~23%,氨基酸含量较高、组成合理,必需氨基酸模式与世界卫生组织(WHO)和联合国粮农组织(FAO)推荐的食品中必需氨基酸参考模式相接近,是一种良好的蛋白质来源,具有抗氧化、改善急性酒精性肝损伤的作用[2]。但目前对于雨生红球藻蛋白的结构与功能性质鲜见报道。为了充分挖掘雨生红球藻残渣潜在的营养及利用价值,本研究以已完成虾青素提取的雨生红球藻粉为原料,通过碱提酸沉法制备雨生红球藻蛋白,研究分析雨生红球藻蛋白的结构及离子强度、pH 对其功能特性的影响,以期获得一种具有适当功能特性的藻蛋白,来解决提取完虾青素后剩余的雨生红球藻残渣的处理问题并为其开发利用奠定了基础。
1 材料与方法
1.1 材料与试剂
实验原料:雨生红球藻:云南时光印记生物科技有限公司;虾青素的提取由本实验室完成;其他试剂均为分析纯。
虾青素的提取方法:50 g 藻粉→研钵中研磨6 h 至藻粉结块→加入适量乙酸乙酯(溶剂量没过藻粉即可)研磨3 h→加入乙酸乙酯(料液比1∶15)→40 ℃水浴提取60 min→静置20 min→4 800 r/min 离心10 min→过滤→虾青素粗提液,残渣进行二次萃取→合并两次提取液→浓缩→虾青素油树脂。
1.2 仪器与设备
TGL-16M 台式高速冷冻离心机:上海卢湘仪实验室仪器有限公司;S-3CpH 计:上海仪电科学科学仪器股份有限公司;V5000 分光光度仪计:上海元析股份有限公司;Pekin-Elmer Model GX傅里叶交换红外光谱仪:美国赛默飞世尔科技有限公司;Scientz-12ND 真空冷冻干燥机:宁波新芝生物科技有限公司;FSH-2 型可调高速匀浆机:常州澳华仪器有限公司;SH-3 双显恒温加热磁力搅拌器:北京金紫光科技发展有限公司;S-4800型扫描电镜:日本日立公司。
1.3 实验方法
1.3.1 雨生红球藻蛋白的制备
采用碱提酸沉法制备雨生红球藻蛋白。制备流程:称取1 g 除去虾青素后的雨生红球藻粉(过100 目筛)→加入44 mL 磷酸缓冲液→匀浆30 min→调节pH 值至12→56 ℃水浴震荡150 min→4 000 r/min 离心10 min 后取上清液→调节pH 值至4.2→4 000 r/min 离心10 min 后取沉淀→透析→真空冷冻干燥→雨生红球藻蛋白粉。
1.3.2 基本成分的测定
蛋白质测定:GB/T6432—2018《饲料中粗蛋白的测定凯氏定氮法》;水分测定:GB/T5009.3—2016《食品安全国家标准 食品中水分的测定》;灰分测定:GB/T5009.4—2016《食品安全国家标准食品中灰分的测定》;粗脂肪测定:GB/T5009.6—2016《食品安全国家标准 食品中脂肪的测定》。
1.3.3 等电点的检测
将碱提的雨生红球藻蛋白上清液用1 mol/L的HCl 调节pH 值分别为3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0、5.2,4 ℃静置2 h 后离心。采用二喹啉甲酸(BCA)法分别测定沉淀前后上清液中蛋白的含量,确定雨生红球藻蛋白的等电点[3]。
1.3.4 雨生红球藻蛋白结构研究
1.3.4.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) SDS-PAGE 预制胶(分离胶12.5%,浓缩胶3%),电压80 V/120 V。常温固定胶板,用染色液考马斯亮蓝R-250 振荡染色30 min,然后过夜脱色。
1.3.4.2 氨基酸组成 参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》方法,利用氨基酸分析仪测定雨生红球藻蛋白的氨基酸组成。
1.3.4.3 蛋白的二级结构 以KBr为背景,在4 000~400 cm–1 波数下对雨生红球藻蛋白进行红外光谱分析,温度为20 ℃,扫描次数为32 次。
1.3.4.4 扫描电镜 利用扫描电镜在20 kV 加速电压下扫描雨生红球藻蛋白形貌特征。
1.3.5 雨生红球藻蛋白功能特性研究
蛋白质含量测定:BCA 法;雨生红球藻蛋白溶解性测定见参考文献[4],吸水性测定见参考文献[5],起泡性及泡沫稳定性测定见参考文献[6],乳化性及乳化稳定性测定见参考文献[7]。
1.4 数据处理
每份样品重复测定3 次,取平均值。采用Excel和Origin 7.5 软件进行数据处理和分析。
2 结果与讨论
2.1 基本成分分析结果
由表1 得出,雨生红球藻蛋白与雨生红球藻残渣相比,雨生红球藻蛋白中蛋白质含量增长最为明显,由16.50%提升到58.18%,粗脂肪和水分含量变化次之,分别从原来的2.56%、5.58%下降到0.08%和3.86%,灰分含量的变化最小,仅下降了0.37%。
表1 雨生红球藻残渣和雨生红球藻蛋白基本成分
Table 1 Basic components of residues of Haematococcus pluvialis and Haematococcus pluvialis protein %

成分 粗蛋白 水分雨生红球藻残渣 16.50±2.32 5.58±0.06雨生红球藻蛋白 58.18±1.95 3.86±0.08灰分 粗脂肪2.80±0.84 2.56±0.62 2.43±0.01 0.08±0.54
2.2 等电点分析
雨生红球藻蛋白等电点见图1。由图1 可知,当pH 值为4.2 时,蛋白质沉淀率最高,在此pH值下,蛋白沉淀率高达98.88%,这是由于在酸性条件下蛋白质分子间相互作用变强并形成聚集体,导致蛋白质沉淀,所以确定pH=4.2 为雨生红球藻蛋白的等电点。
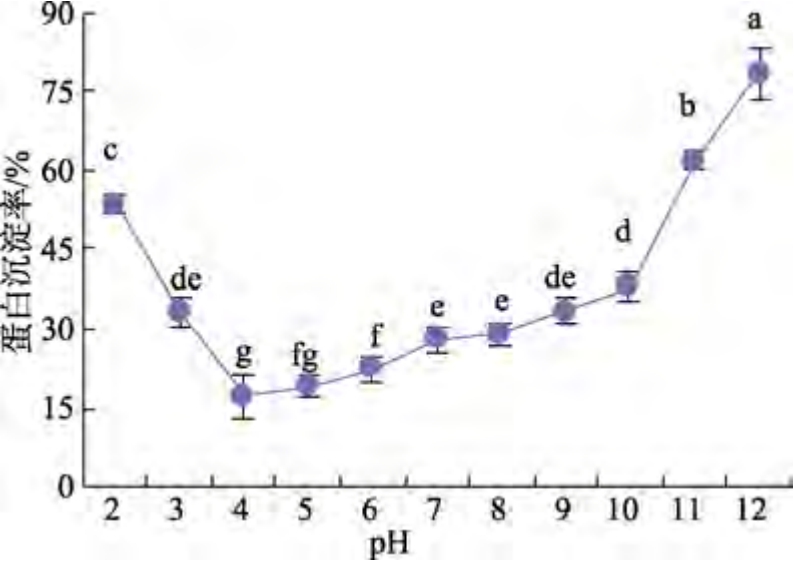
图1 雨生红球藻蛋白等电点
Fig.1 The protein isoelectric point of Haematococcus pluvialis
注:同一折线图中的小写字母上标表示P<0.05 时有显著性差异。
Note: The lowercase letters in the same line chart were marked differently when P<0.05.
2.3 雨生红球藻蛋白结构特性
2.3.1 SDS-PAGE
雨生红球藻蛋白电泳图谱如图2 如所示,藻红蛋白一般具有α、β 和γ 三种亚基,α 亚基(12~20 kDa)通常小于β 亚基(15~22 kDa),γ 亚基分子量比α,β 亚基大,约为32 kD[8]。从图2 可以看出,雨生红球藻蛋白在14.4、18.4、38 kDa处出现条带,这与Zhao 等[9]研究的江蓠中R-藻红蛋白的α、β、γ 亚基分子量分别为17、18、30 kDa相接近。目前对于雨生红球藻蛋白亚基的研究很少,根据本研究中SDS 电泳结果推测雨生红球藻蛋白属于藻红蛋白。
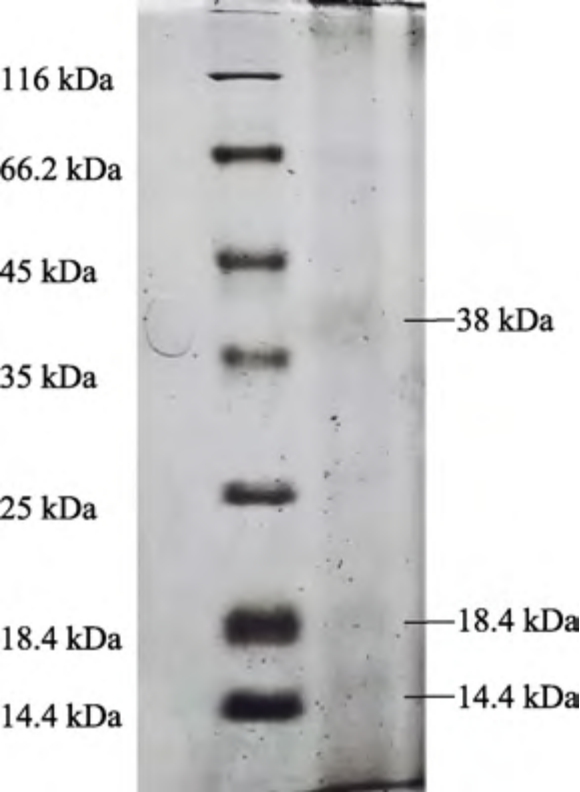
图2 雨生红球藻蛋白的SDS 电泳图谱
Fig.2 SDS electrophoresis pattern of Haematococcus pluvialis protein
注:左泳道是蛋白质分子量标准品的电泳图谱,右泳道是雨生红球藻蛋白样品的电泳图谱。
Note: The left lane is the electrophoretic pattern of protein molecular weight marker, while the right lane is the electrophoretic pattern of protein samples from Haematococcus pluvialis.
2.3.2 氨基酸分析
雨生红球藻蛋白氨基酸组成成分见表2。由表2 可知,雨生红球藻蛋白中含有17 种氨基酸,其中7 种是人体所需的必需氨基酸,分别为亮氨酸、苏氨酸、缬氨酸、苯丙氨酸、异亮氨酸、赖氨酸和蛋氨酸,必需氨基酸占总氨基酸的比值(EAA/TAA)为 36.38%,与联合国粮农组织(FAO)和世界卫生组织(WHO)提出的理想蛋白质模式相接近。雨生红球藻蛋白中含量最高的是谷氨酸,占总氨基酸组分的13.24%,其次是丙氨酸、亮氨酸及天冬氨酸。蛋氨酸和半胱氨酸(含硫氨酸)是雨生红球藻蛋白中的第一限制氨基酸和第二限制氨基酸,氨基酸评分为41.57,亮氨酸、缬氨酸、苏氨酸、异亮氨酸、苯丙氨酸和酪氨酸的氨基酸评分均高于FAO/WHO 提出的推荐值。支链氨基酸具有独特的生理功能,曾被认为是人体的第三燃料[10],可改善肝功能和抗疲劳功能及多种病人蛋白质营养失常状态。雨生红球藻蛋白中支链氨基酸占总氨基酸组分的19.72%,可通过雨生红球藻蛋白补充因剧烈运动而丢失的蛋白质。结果表明,雨生红球藻蛋白可作为一种有益的营养和功能成分添加到食品中。
表2 雨生红球藻蛋白氨基酸组成
Table 2 Amino acid compositions of Haematococcus pluvialis protein
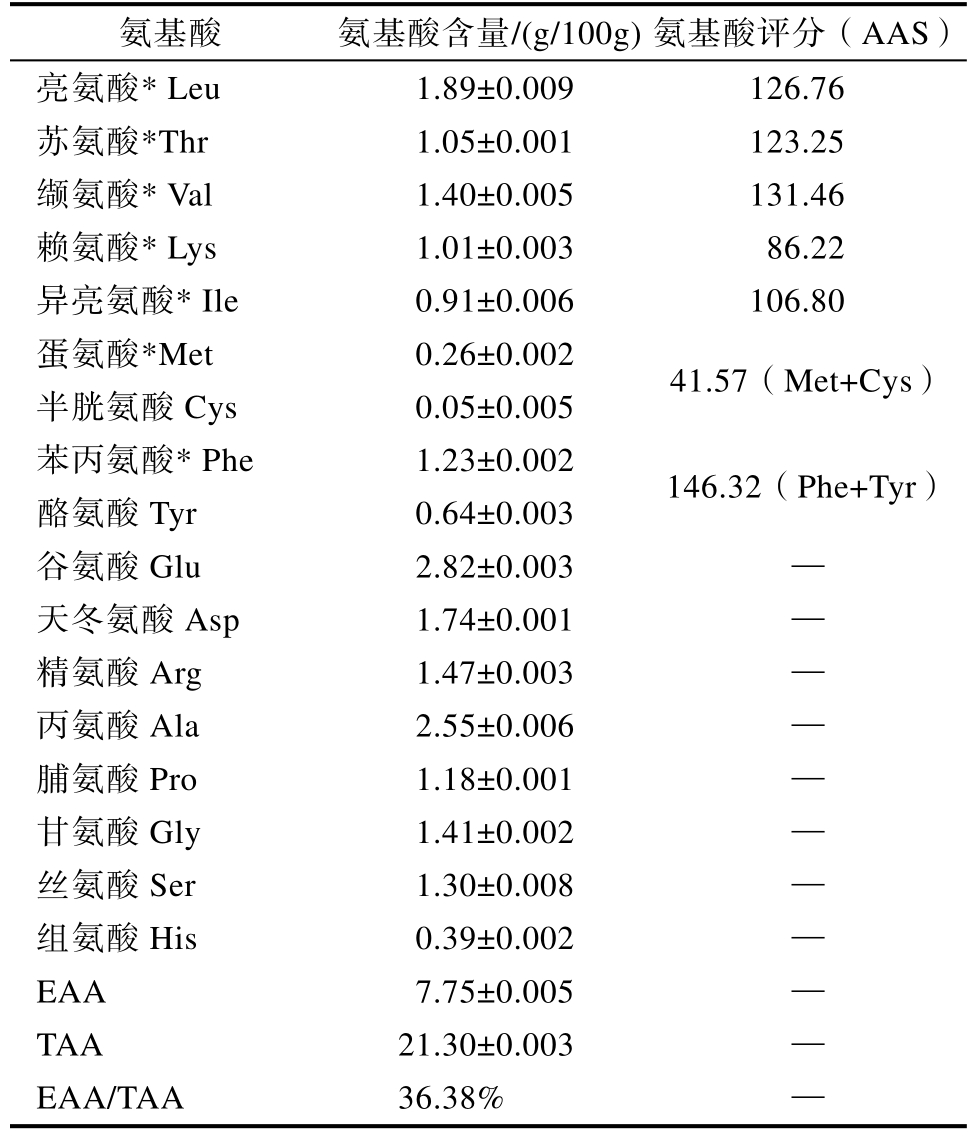
注:*必需氨基酸;EAA 必需氨基酸含量;TAA 总氨基酸含量。
Note: * Essential amino acids; EAA essential amino acid content; Total amino acid content of TAA.
氨基酸 氨基酸含量/(g/100g) 氨基酸评分(AAS)亮氨酸* Leu 1.89±0.009 126.76苏氨酸*Thr 1.05±0.001 123.25缬氨酸* Val 1.40±0.005 131.46赖氨酸* Lys 1.01±0.003 86.22异亮氨酸* Ile 0.91±0.006 106.80蛋氨酸*Met 0.26±0.002半胱氨酸Cys 0.05±0.005 41.57(Met+Cys)苯丙氨酸* Phe 1.23±0.002酪氨酸Tyr 0.64±0.003 146.32(Phe+Tyr)谷氨酸Glu 2.82±0.003 —天冬氨酸Asp 1.74±0.001 —精氨酸Arg 1.47±0.003 —丙氨酸Ala 2.55±0.006 —脯氨酸Pro 1.18±0.001 —甘氨酸Gly 1.41±0.002 —丝氨酸Ser 1.30±0.008 —组氨酸His 0.39±0.002 —EAA 7.75±0.005 —TAA 21.30±0.003 —EAA/TAA 36.38% —
2.3.3 二级结构分析
对1 600~1 700 cm-1 光谱进行曲线拟合、反卷积和二阶导数,得到酰胺I 区原始光谱和反卷积光谱如图3 所示。由图3 可知,通过分峰拟合得到了11 个单峰,并计算各子峰的面积,得出相对应结构所占比例,二级结构含量如表3 所示。

图3 雨生红球藻蛋白红外光谱图
Fig.3 Infrared spectroscopy of Haematococcus pluvialis protein
表3 雨生红球藻蛋白二级结构含量
Table 3 Secondary structure contents of protein Haematococcus pluvialis
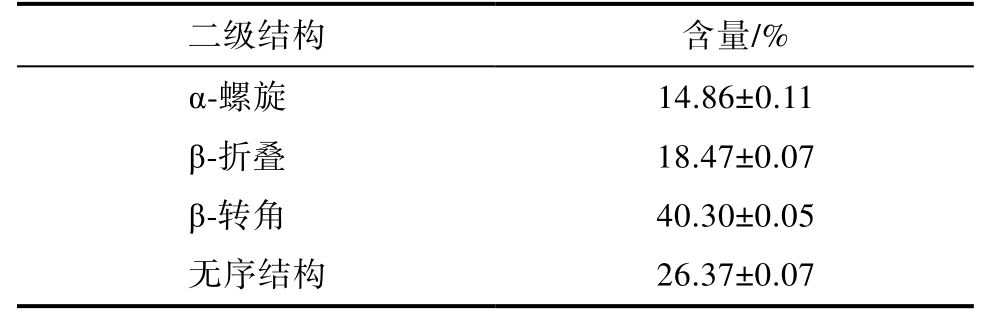
二级结构α-螺旋β-折叠β-转角无序结构含量/%14.86±0.11 18.47±0.07 40.30±0.05 26.37±0.07
由表3 可知,雨生红球藻蛋白二级结构以β-转角和无序结构为主,含量分别为40.3%和26.37%。蛋白质的二级结构与表面疏水性存在一定的联系,表面疏水性与α-螺旋、β-折叠结构的含量呈负相关,与β-转角和无规则卷曲结构呈正相关。β-转角和无规则卷曲越多,说明蛋白的自由度越大,变性的程度越大,β-转角也可促使蛋白质形成球状结构[11],α-螺旋含量较低,也进一步表明该蛋白具有相对疏松的分子结构。这为雨生红球藻蛋白提供了相对宽松的空间结构,使其能够在油水界面处充分膨胀,从而吸附和稳定乳状液[12]。
2.3.4 扫描电镜分析
扫描电镜可以观察出雨生红球藻蛋白表面的微观结构。由图4a 和图4b 可知,在pH12 条件下提取的雨生红球藻蛋白具有较大的不规则片状与杆状结构,蛋白体较完整,几乎无细小碎片,表面粗糙,有数量较多的微小孔洞。从图4c 和图4d 中可以观察到在pH13 条件下提取的雨生红球藻蛋白多呈不同程度碎片状与弯曲杆状结构,与pH12 时提取的雨生红球藻蛋白微观结构对比,pH13 条件下提取的雨生红球藻蛋白杆状结构减少,且蛋白表面有破损,可能是强碱条件下蛋白质的结构被破坏。

图4 雨生红球藻蛋白的扫描电镜图
Fig.4 SEM images of protein of Haematococcus pluvialis
注:a. pH 12 条件下提取的雨生红球藻蛋白微观结构;b. a 图的局部放大图;c. pH 13 条件下提取的雨生红球藻蛋白微观结构;d. c 图的局部放大图。
Note: a. The microstructure of Haematococcus pluvialis protein extracted under pH 12 conditions; b. A locally enlarged image of Figure a; c. The microstructure of Haematococcus pluvialis protein extracted under pH 13 conditions; d. Enlarged partial image of Figure c.
2.4 雨生红球藻蛋白功能特性研究
2.4.1 雨生红球藻蛋白的溶解度
不同pH 和NaCl 浓度对雨生红球藻蛋白溶解度的影响见图5。蛋白质溶解度体现的是蛋白质在溶剂中分散的程度,与蛋白质其他性质密切相关,同时,它还是评价蛋白聚集状态和变性程度的重要指标。由图5 a 可知,当pH 从2~4 时,雨生红球藻蛋白溶解度不断减小,因为蛋白质分子在等电点时,蛋白自身不带电,与水分子作用力最弱,相邻蛋白质分子间的作用力增强,易发生团聚沉降。当pH 大于4 时,溶解度不断上升,pH值为10 时,蛋白质溶解度达到最大值(62.63%)。这是因为pH 值大于等电点时,氨基的脱质子和羧基的电离导致蛋白质带负电荷,与溶剂水合作用的增强使得蛋白溶解性增强。通常,蛋白分子间的相互作用是通过疏水相互作用促进并导致沉淀,而蛋白质与溶剂间的相互作用提高了蛋白质的水合作用和溶解度。已有研究发现,较低的表面疏水性和较高的表面电荷是蛋白质高溶解度的主要原因。但随着pH 值继续增加,蛋白质发生变性,从而导致溶解度下降[13]。结果表明,在中性和微碱环境中,雨生红球藻蛋白的应用效果较好。从图5b 可以看出,NaCl 浓度为0.1 mol/L 时较未加NaCl 时蛋白的溶解性降低。原因可能是低离子强度时,盐离子中和蛋白质分子表面的电荷,从而产生电荷屏蔽效应,若蛋白质有高比例的非极性区域,屏蔽效应会引起蛋白质抵御外来盐离子的影响而形成蛋白质分子聚集体,导致蛋白溶解度下降。许雪儿等[14]在研究反溶剂法制备玉米醇溶蛋白基纳米颗粒时发现,低盐浓度下,玉米醇溶蛋白-阿拉伯胶体系产生电荷屏蔽作用以抵御盐离子的影响。当NaCl 浓度从0.1~1 mol/L 时,雨生红球藻蛋白溶解度逐渐上升,NaCl 浓度为1 mol/L 时最高(55.36%)。当NaCl 浓度高于1.0 mol/L,雨生红球藻蛋白溶解度下降,是因为Na+中和部分蛋白表面的电荷,并破坏蛋白质的水化层,导致溶解度降低。
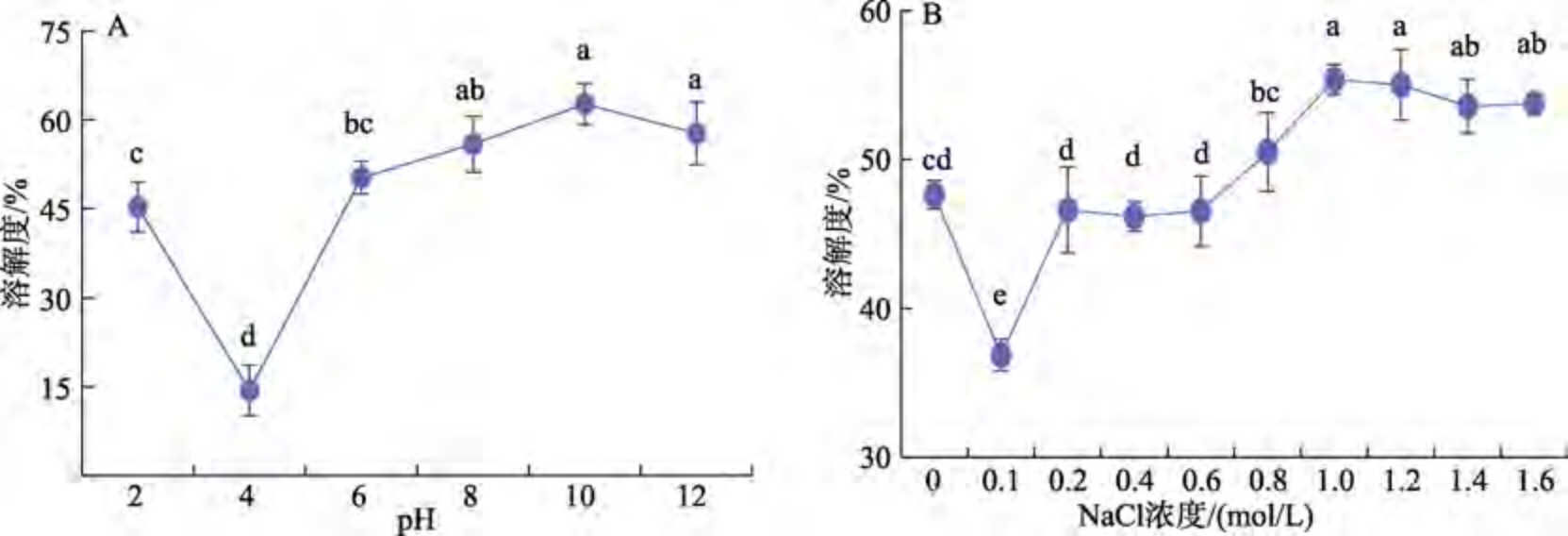
图5 不同pH 和NaCl 浓度对雨生红球藻蛋白溶解度的影响
Fig.5 Effect of different pH and NaCl concentration on the protein solubility of Haematococcus pluvialis
注:A:pH 的影响;B:NaCl 浓度的影响。同一折线图中的小写字母上标在P<0.05 时显著不同。
Note: A: Effect of pH; B: Effect of NaCl concentration. The lowercase letters in the same line chart were marked differently when P<0.05.
2.4.2 雨生红球藻蛋白的吸水性
不同pH 对雨生红球藻蛋白吸水性的影响见图6。由图6 可以看出,雨生红球藻蛋白的吸水性随着pH 值的升高呈先降低后增加的趋势,在pH 值为4 时,蛋白吸水性最低为2.21 g/g。这是因为pH 值为蛋白质等电点时,水结合位点埋藏在蛋白质内部,蛋白质-水分子间结合的能力最弱,导致吸水性下降。随着pH 值的升高,蛋白质被电离,构象发生改变,暴露出更多的水结合位点,蛋白质的极性和电荷增多,分子间相互作用减小,结合水的能力增强,从而提高了吸水性。总体来看,雨生红球藻蛋白在不同pH 条件下吸水性相差不大,说明其对酸、碱环境的适应性较强,在食品加工方面具有一定的优势。研究显示,吸水性为1.49~4.72 g/g 的蛋白质可用于粘弹性食品中[15]。
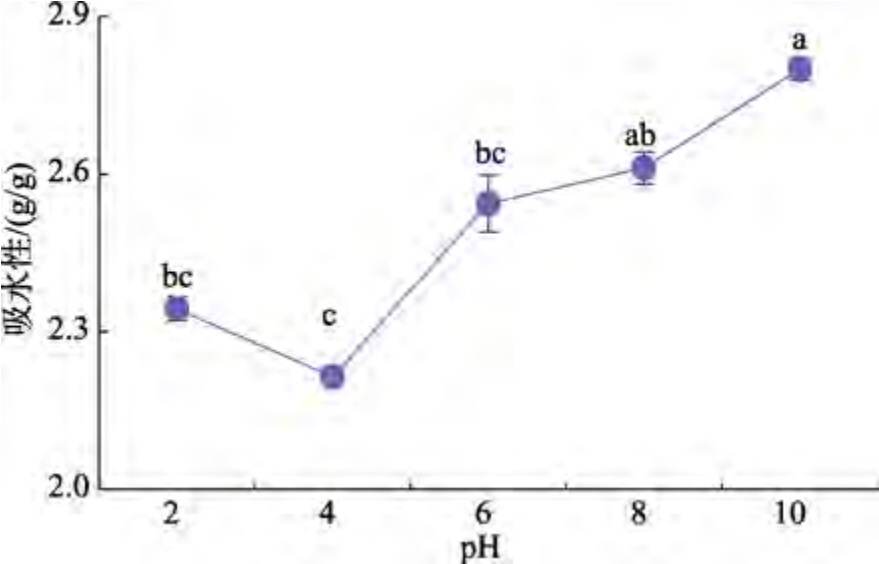
图6 不同pH 对雨生红球藻蛋白吸水性的影响
Fig.6 Effect of different pH on the water absorption of Haematococcus pluvialis protein
注:同一折线图中的小写字母上标在P<0.05 时显著不同。
Note: The lowercase letters in the same line chart were marked differently when P<0.05.
2.4.3 雨生红球藻蛋白的起泡性及泡沫稳定性
不同pH 和NaCl 浓度对雨生红球藻蛋白起泡性及泡沫稳定性的影响见图7。由图7a 可知,pH值在2~4 时,雨生红球藻蛋白的起泡性和泡沫稳定性均呈下降趋势,在pH 值为4 时起泡性和泡沫稳定性最差(16.20%和40.08%),随着pH 值的进一步升高,起泡性和泡沫稳定性增加。这可能是因为表面张力的影响,pH 值在等电点时,雨生红球藻蛋白溶解性最小,可溶性蛋白含量少,表面张力增加,形成的泡沫较少。随着溶液pH 值增加,雨生红球藻蛋白的溶解性增强,蛋白质在溶液界面和空气的吸附力变强,降低表面张力,促进泡沫的形成和稳定[16];在碱性条件下,蛋白质分子的折叠结构被打开,暴露出大量的疏水基团,增加了蛋白结构的灵活性以及在空气-水界面的吸附速率。由图7b 可以看出,随着NaCl 浓度的增加,雨生红球藻蛋白的起泡性和泡沫稳定性均呈现先升高后降低的趋势,在NaCl 浓度为1 mol/L 时,达到最大值(70.20%和90.04%)。离子强度对蛋白质起泡性的影响主要与蛋白质在盐溶液中的溶解特性有关。NaCl 浓度的适量增加对蛋白质产生盐溶作用,但浓度过高会对蛋白质产生静电屏蔽作用,导致蛋白质在盐溶液中的溶解度下降,不利于泡沫的形成[17]。在高NaCl 浓度下雨生红球藻蛋白的泡沫稳定性下降缓慢是因为此时虽然可溶部分蛋白质的含量较低,形成泡沫的数量较少,但是部分不溶解蛋白质的吸附在一定程度上增强了蛋白质膜的粘合力,一定时间内可维持泡沫的稳定。
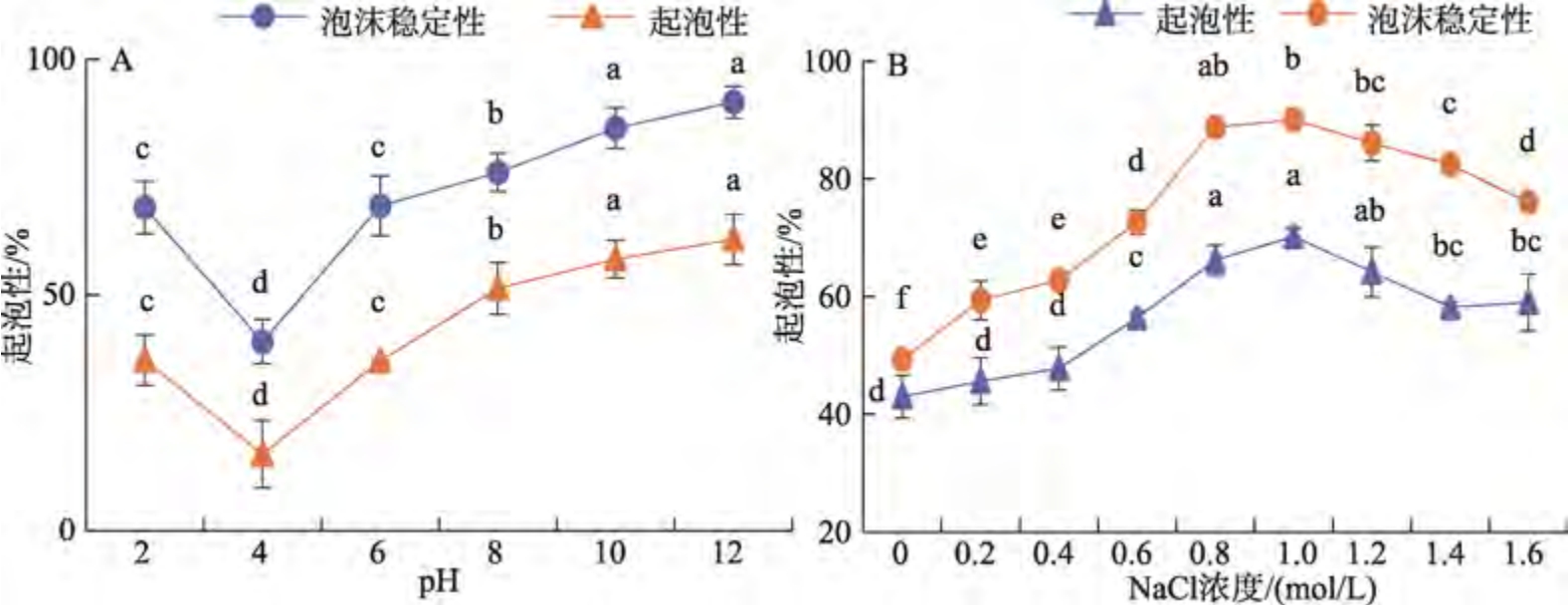
图7 不同pH 和NaCl 浓度对雨生红球藻蛋白起泡性及泡沫稳定性的影响
Fig.7 Effect of different pH and NaCl concentration on the foaming capability and stability of Haematococcus pluvialis protein
注:A:pH 的影响;B:NaCl 浓度的影响。同一折线图中的小写字母表示各组内差异显著(P<0.05)。
Note: A: Effect of pH; B: Effect of NaCl concentration. The lowercase letters in the same line chart indicate significant differences within each group (P<0.05).
2.4.4 雨生红球藻蛋白的乳化性及乳化稳定性
不同pH 和NaCl 浓度对雨生红球藻蛋白乳化性及乳化稳定性的影响见图8。从图8 a 可知,雨生红球藻蛋白的乳化性随着pH 值的升高呈先降低后升高的趋势,在pH 值为4 时,乳化性达到最低(34.74%),因为此时乳液分子间的斥力变弱,蛋白分子易于团聚沉淀,影响了蛋白质的伸展或在界面上的吸附能力,从而阻碍了乳状液的形成,导致乳化性能下降。随着pH 增加,蛋白在碱性环境中与电解质的阴离子结合,所带负电荷增多,分子间静电斥力增加,蛋白液膜增厚,更有利于形成“水包油”的状态,从而乳化性提高[18];pH的增加使分子间的作用力增强,从而展开蛋白质的结构,暴露出大量的疏水基团,形成界面膜来分散油滴,从而形成更高的乳化活性。乳化性变化趋势与溶解性变化趋势一致,这说明可溶性蛋白对其乳化性的发挥有着极大作用。与乳化性的变化规律不同,乳化稳定性随着pH 值的增大呈先上升后下降的趋势,在pH 值为4 时达到最高值(96.99%)。其原因可能是不溶性蛋白在乳液的制备过程中吸附到水油界面上,形成了相对稳定的水包油乳液,同时由于不溶性蛋白被吸附,可以形成较为致密的蛋白界面膜,从而减缓油滴的上浮。
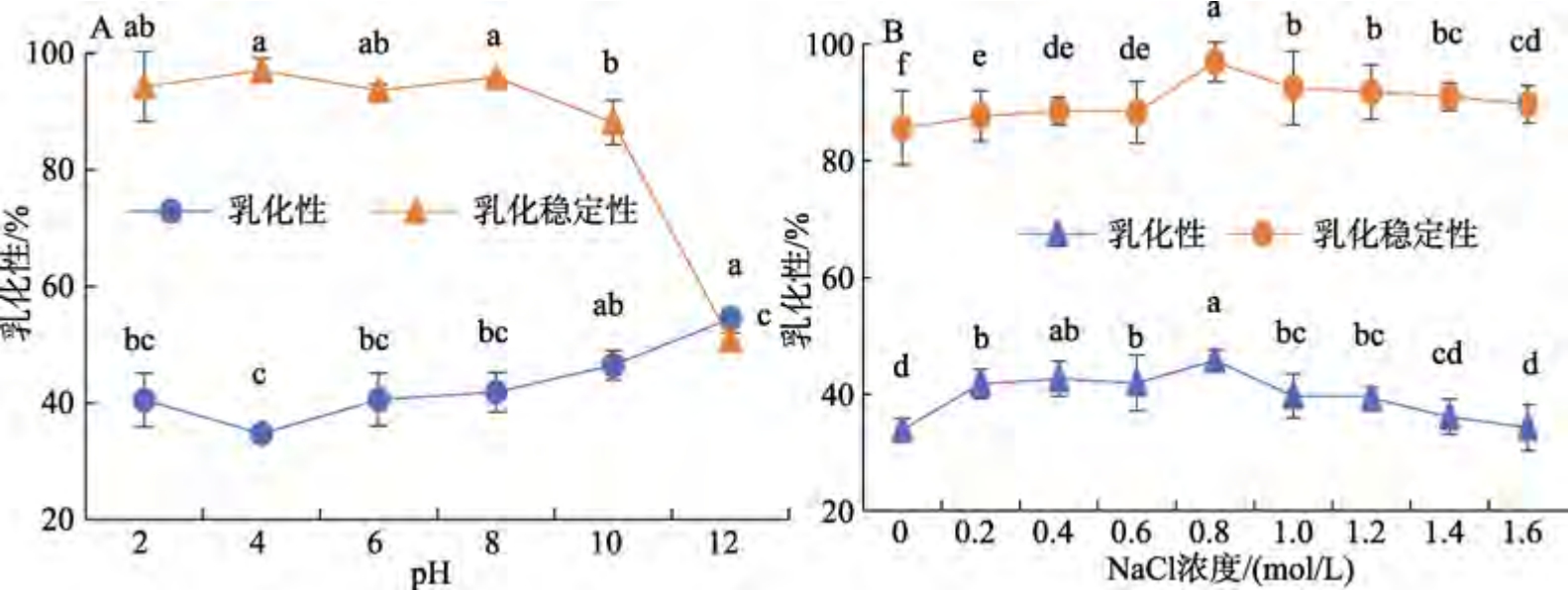
图8 不同pH 和NaCl 浓度对雨生红球藻蛋白乳化性及乳化稳定性的影响
Fig.8 Effect of different pH and NaCl concentration on the emulsification and stability of Haematococcus pluvialis protein
注:A:pH 的影响;B:NaCl 浓度的影响。同一折线图中的小写字母表示各组内差异显著(P<0.05)。
Note: A: Effect of pH; B: Effect of NaCl concentration. The lowercase letters in the same line chart indicate significant differences within each group (P<0.05).
如图8b 所示,随着NaCl 浓度的增大,雨生红球藻蛋白的乳化性和乳化稳定性均呈先增大后减少的趋势,当NaCl 浓度为0.8 mol/L 时,乳化效果最佳(45.78%和96.94%)。这是因为在低浓度盐溶液中,离子强度的增加促进了蛋白的溶解,油-水界面蛋白质吸附量的增多使乳化性提高。蛋白与油滴形成的脂肪球周围形成静电层,产生的相互斥力延缓了液滴结合的能力,同时,乳化胶体周围形成水化层,水-油界面的薄膜稳定性变强,乳液稳定性也随之增强[19]。随着盐浓度的增加,乳化胶体的水化层变薄,乳化稳定性降低。
3 结论
本文研究了雨生红球藻蛋白的结构和功能特性,发现雨生红球藻蛋白的等电点为4.2,其亚基分子量主要分布在中低分子范围内,含有人体所必需的氨基酸7 种,易于被人体吸收利用。红外光谱分析表明二级结构中雨生红球藻蛋白的β-转角相对占比最高,其次是无序结构,β-折叠和α-螺旋相当。另外,pH 远离等电点时,雨生红球藻蛋白的溶解性、吸水性、起泡性、乳化性逐渐增强,溶解性是影响起泡性和乳化性的重要因素;NaCl 浓度在1.0 mol/L 时,雨生红球藻蛋白溶解性、起泡性最强,表明NaCl 浓度和pH 对雨生红球藻蛋白的功能特性均有不同程度的影响。本研究为雨生红球藻蛋白的产品研究和开发提供理论依据。
[1] FAN Q S, CHEN Z, WU Y T, et al. Study on the enhancement of immune function of astaxanthin from Haematococcus pluvialis[J].Foods, 2021, 10(8): 1847.
[2] 刘辰玥, 梁铎, 刘芯怡, 等. 雨生红球藻蛋白稳定的Pickering乳液对酒精性肝损伤的保护作用[J]. 食品研究与开发, 2023,44(23): 8-15.LIU C Y, LIANG D, LIU X Y, et al. Pickering emulsion stabilized by haematococcus pluvialis protein protects mice from acute alcoholic liver injury[J]. Food Research and Development,2023, 44(23): 8-15.
[3] BA F, URSU V A, LAROCHE C, et al. Haematococcus pluvialis soluble proteins: Extraction, characterization, concentration/fractionation and emulsifying properties[J]. Bioresource Technology,2016, 200: 147-152.
[4] 何帼英. 燕麦麸皮中蛋白的提取及功能特性与流变学特性的研究[D]. 黑龙江八一农垦大学, 2016.HE G Y. Extraction, characterization and rheological properties of the oat bran protein[D]. Heilongjiang Bayi Agricultural University, 2016.
[5] 赵晓瑜. 不同处理方法对翅果油粕蛋白结构性质、功能性质和抗氧化能力的影响[D]. 山西大学, 2021.ZHAO X Y. Effect of different treatments on the structural,functional and antioxidant properties of Elaeagnus mollis oil meal protein[D]. Shanxi University, 2021.
[6] ZHU Y P, ZHAO X Y, ZHANG X W, et al. Extraction, structural and functional properties of Haematococcus pluvialis protein after pigment removal[J]. International Journal of Biological Macromolecules, 2019, 140: 1073-1083.
[7] 杨威, 董志文, 何东平, 等. 铁核桃蛋白和多肽功能特性的研究[J]. 粮食与油脂, 2018, 31(5): 86-91.YANG W, DONG Z W, HE D P, et al. Study on the functional properties of iron walnut protein and peptide[J]. Cereals & Oils,2018, 31(5): 86-91.
[8] 伍华菊, 张建平, 夏安东, 等. 条斑紫菜中R-藻红蛋白的生化特性[J]. 生物化学与生物物理学报, 1994, 26(5): 491-497.WU H J, ZHANG J P, XIA A D, et al. Biochemical characteristics of r-phycoerythrin in Porphyra yezoensis[J]. Acta Biochimica et Biophysica Sinica, 1994, 26(5): 491-497.
[9] ZHAO P, WANG X, NIU J, et al. Agar extraction and purification of R-phycoerythrin from Gracilaria tenuistipitata, and subsequent wastewater treatment by Ulva prolifera[J]. Algal Research, 2020,47: 101862.
[10] 蓝晓萍. 支链氨基酸饮料对体操运动员运动能力的影响研究[J]. 食品研究与开发, 2023, 44(19): 233-234.LAN X P. Study on the influence of branched-chain amino acid beverage on gymnast's exercise ability[J]. Food Research and Development, 2023, 44(19): 233-234.
[11] 商海军, 蒋丽君, 江本利, 等. 藜麦秸秆蛋白的结构和功能性质[J]. 食品研究与开发, 2022, 43(17): 49-56.SHANG H J, JIANG L J, JIANG B L, et al. Structural and functional characteristics of proteins in quinoa straw[J]. Food Research and Development, 2022, 43(17): 49-56.
[12] YIN Z, WANG M, ZENG M. Novel pickering emulsion stabilized by natural fiber polysaccharide-protein extracted from Haematococcus pluvialis residues[J]. Food hydrocolloids, 2023.
[13] MIR N A, RIAR C S, SINGH S. Effect of pH and holding time on the characteristics of protein isolates from Chenopodium seeds and study of their amino acid profile and scoring[J]. Food Chemistry, 2019, 272: 165-173.
[14] 许雪儿, 李娟, 陈正行. 负载生育酚的玉米醇溶蛋白纳米颗粒的构建及性质表征[J]. 中国食品学报, 2020, 20(12): 24-30.XU X E, LI J, CHEN Z X. Construction and characterization of zein nanoparticles loaded with tocopherol[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(12): 24-30.
[15] ALETOR O, OSHODI A A, IPINMOROTI K. Chemical composition of common leafy vegetables and functional properties of their leaf protein concentrates[J]. Food Chemistry,2002, 78(1): 63-68.
[16] 张婷, 陈美如, 于一丁, 等. 生物酶解影响蛋白起泡特性的因素及机理研究进展[J]. 食品科学, 2022, 43(7): 298-304.ZHANG T, CHEN M R, YU Y D, et al. Factors affecting the foaming properties of protein by enzymatic hydrolysis research progress of nutrients and their mechanisms[J]. Food Science,2022, 43(7): 298-304.
[17] AMUNDON C M. Factors affecting emulsion capacity as a measure of protein functionality for nonmeat proteins[J]. Journal of Food Science, 1990, 55(1): 267-268.
[18] 罗鑫, 高盼, 王澍, 等. 棉籽多肽的制备工艺优化及功能特性[J]. 中国油脂, 2023, 48(5): 30-36.LUO X, GAO P, WANG S, et al. Preparation process optimization and functional characteristics of cottonseed polypeptide[J].China Oils and Fats, 2023, 48(5): 30-36.
[19] ALUKO R E, YADA R Y. Structure-function relationships of cowpea (Vigna unguiculata) globulin isolate: influence of pH and NaCl on physicochemical and functional properties[J]. Food chemistry, 1995, 53(3): 259-265.