枸杞(Lycium barbarum L.)是一种茄科枸杞属的药食同源植物,主要分布于中国西北部,作为食品和药品食用已有上千年的历史[1]。枸杞果实中含有多糖、有机酸、甜菜碱、类胡萝卜素及黄酮类化合物等多种生物活性成分,这些活性成分使得枸杞能够发挥相应的功能特性,使得枸杞具有抗氧化、抗衰老、增强免疫力等多种生物学功能[2-3]。枸杞多糖是枸杞主要的生物活性成分,具有抗疲劳、降血糖等作用[4]。果实细胞壁由纤维素、半纤维素、果胶等非纤维素壁多糖聚合物和少量蛋白质组成,而细胞壁多糖是枸杞多糖的主要成分,在水溶性枸杞多糖组分中,其主要物质为果胶成分,不溶性枸杞多糖组分中主要物质为具有分支结构的果胶类物质以及部分半纤维素,枸杞果实细胞壁是枸杞多糖的主要来源之一[5-6]。
冯美[7]等以不同贮藏期的枸杞果实为研究对象,测定分析细胞壁组分及果胶代谢酶类活性的变化,结果发现细胞壁结构的破坏主要是由细胞壁物质大量分解造成的,其中包括果胶物质、纤维素、半纤维素的降解同时还伴随细胞其它成分的分解,而细胞壁中的这些成分降解依赖于一系列相关酶的活性变化。Liu[8]等为了更好地了解枸杞果实软化的潜在分子机制,通过同位素标记相对和绝对定量(iTRAQ)方法研究了枸杞果实呼吸跃变前后蛋白组的变化,在果实成熟过程中,果实软化是由细胞壁降解引起的,其中能量代谢导致大分子细胞壁物质被分解成底物进行呼吸代谢。Hu[9]等研究考察了枸杞果实成熟过程中细胞壁的变化,并利用iTRAQ 技术进一步分析了细胞壁多糖的重塑,结果表明葡萄糖、果糖、半乳糖、半乳糖醛酸和阿拉伯糖代谢途径中涉及的54 种蛋白质的差异表达导致纤维素和半纤维素含量在预熟期呈增加趋势,在果实成熟后期呈下降趋势,果胶含量在果实成熟前呈上升趋势,为枸杞果实细胞壁中多糖的重组提供了一个生物学框架。
目前,对枸杞果实细胞壁多糖的研究主要集中在其生物活性上,通过透射电镜与显微共聚焦拉曼光谱对枸杞果实生长发育过程中细胞壁变化的研究鲜有报道。本实验以花后7、14、21、28、35 d 的“宁杞1 号”枸杞果实为研究对象,对其细胞壁微观结构变化、细胞壁多糖组分及相关降解酶活性进行研究,为进一步揭示枸杞果实生长发育过程中枸杞多糖代谢规律提供了理论依据。
1 材料与方法
1.1 材料与试剂
“宁杞1 号”枸杞果实采摘于宁夏银川贺兰山军马场种植园枸杞树,花后7、14、21、28、35 d进行采摘。随机收集无病虫害和机械损伤的果实,采摘的枸杞果实一部分冰盒中冷藏,用于拉曼光谱测定和透射电镜观测;一部分放入液氮中冷冻保存,运送回实验室转移至–80 ℃冰箱备用。
蒽酮(分析纯):国药集团化学试剂公司;咔唑(纯度≥98%):常州中集化工有限公司;二甲砷酸钠(纯度≥98%):上海迈瑞尔化学技术有限公司;聚乙烯吡咯烷酮(PVPP):美国Sigma 公司;硼氢化钠(纯度≥98%):徐州天鸿化工有限公司;聚半乳糖醛酸(纯度≥85%):上海阿拉丁生化科技股份有限公司;1, 2-环己二胺四乙酸(CDTA)、4-硝基苯基-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(纯度≥98%)、对硝基苯基-β-D-吡喃半乳糖苷(纯度≥99%):上海凛恩科技发展有限公司。
1.2 仪器与设备
AL204 电子天平、Five Easy Plus PH 酸度计:梅特勒-托利多仪器(上海)有限公司;BGZ-146电热鼓风干燥箱:上海博迅实业有限公司;DXR激光共聚焦显微拉曼光谱:美国赛默飞公司;H-7650 透射电子显微镜:日本日立公司;EM UC7显微超薄切片机:德国徕卡显微系统(上海)贸易有限公司;GL-10C 冷冻离心机:上海安亭科学仪器厂;T6 新世纪紫外风光光度计:北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 透射电镜观测
参考刘军[10]的方法进行样品前处理,然后染色切片。将样品切成70 nm 厚度的超薄切片,固定在铜网上,用碱性柠檬酸铅染色30 min,再用乙酸铀酰复染10 min。最后在80 kv 的电压下,观察枸杞果实细胞壁的微观结构。
1.3.2 细胞壁物质提取及含量的测定
采用热乙醇不溶法[11]提取枸杞果实细胞壁物质(cell wall material,CWM)。研钵中放入10 g枸杞果实,用冰乙醇研磨,然后放入热酒精(乙醇70%,温度约82~85 ℃)中,磁力搅拌温和回流20 min,在4 ℃下12 000 rpm 离心20 min,将沉淀依次在70%、96%乙醇和无水乙醇中洗涤,然后在丙酮中洗涤、晾干,最后在40 ℃条件下干燥。干燥后称重,计算不同生长期枸杞果实CWM 含量。
1.3.3 细胞壁多糖提取及含量的测定
参考Monika Chylinska[12]的方法提取CWM中的水溶性果胶(water-soluble pectin,WSP)、碳酸钠可溶性果胶(sodium carbonate-soluble pectin,SSP)和半纤维素,并稍作修改。
在9 mL 去离子水中加入CWM0.1 g 搅拌过夜,然后过滤收集含有WSP 的上清液。将溶解在水中的残余物放入0.1 M 的CDTA(5 mL,pH 6.5)中搅拌6 h,过滤并再次在0.1 M 的CDTA(5 mL,pH 6.5)中搅拌2 h。然后,将CDTA 残余物放入0.05 M 的Na2CO3 中搅拌,加入20 mM 的NaBH4(5 mL)过夜,过滤后再次放入0.05 M 的Na2CO3中搅拌,加入20 mM 的NaBH4(5 mL)2 h。收集两个步骤中含有SSP 的上清液。分别用0.5 M、1 M 和4 M 的KOH 加10 mM 硼氢化钠萃取残余物。提取条件为2 ℃下进行2 h,室温下进行2 h。收集含有半纤维素的上清液。通过半纤维素在不同浓度碱溶液中的溶解度,将其分为KOH-0.5、KOH-1 和KOH-4 三部分,KOH-0.5、KOH-1、KOH-4 分别代表0.5 mol/L KOH、1 mol/L KOH和4 mol/L KOH 可溶性半纤维素。参考范新光[13]的方法用咔唑硫酸比色法测定WSP 和SSP 含量,用蒽酮比色法测定半纤维素含量。
1.3.4 显微共聚焦拉曼光谱测定
显微共聚焦拉曼光谱测定参考 Monika Chylinska[12]的方法,略作修改。将枸杞果实去籽,纵向切成条状,横切取果实赤道部。将果实切片移至干净载玻片上,并固定在载物台上,调整载物台至50 倍物镜视野并将激光束聚焦到样本表面。调整视野清晰度后,使用拉曼光谱点扫描随机选取的细胞壁10 个区域。激光波长为532 nm,每点采集的激光曝光时间为20 s,激光功率为2.5 mW,采集一次,光栅为900 lines/mm,拉曼位移范围为3 000~100 cm–1。实验在恒温(25±2 ℃)条件下进行。
1.3.5 细胞壁降解酶活性的测定
取枸杞果实15 g,液氮速冻,冰浴研磨,在含有0.5%聚乙烯吡咯烷酮的40 mL 50 mmol/L 乙酸钠缓冲液(pH 6.6)中,4 ℃下保持过夜,期间颠倒混合 2~3 次。将 β-氨基己糖苷酶(β-hexosaminidase,β-Hex)提取液在12 000 rpm的条件下离心15 min,上清液用于活性测定。果胶甲酯酶(pectin methylesterase,PME)、多聚半乳糖醛酸酶(polygalacturonase,PG)、纤维素酶(cellulase,Cx)和β-半乳糖苷酶(β-galactosidase,β-Gal)参考董黎梨等[14]的方法提取。
PME 活性的测定参考董黎梨等[14]的测定方法,其中以含有1M NaCl 为对照,在620 nm 波长每隔30 s 测定一次吸光度,共测定10 min。以每分钟每克鲜重OD620 值降低0.1 为1 个酶单位。PG 活性测定参考徐晓波等[15]的测定方法,略有修改。其中以每分钟每克鲜重OD540 值降低0.1为1 个酶单位。Cx 活性测定参考艾静[16]的方法进行。β-Gal 活性测定参考董黎梨等[14]的测定方法,略作修改。其中以每分钟每克鲜重OD400 值降低0.1 为1 个酶单位。β-Hex 活性测定参考Cao 等[17]的方法。
1.4 数据处理
采用SPSS.22 软件处理数据并进行相关性分析,结果以平均值±SD 表示,使用方差分析(analysis of variance, ANOVA)法分析显著性,显著性差异水平为P<0.05,利用Origin 2021 软件进行作图,所有实验重复3 次及以上。
2 结果与分析
2.1 枸杞果实细胞壁微观结构的变化
如图1 所示,花后7 d 的枸杞果实细胞排列紧密,薄壁细胞体积由中间向两侧逐渐缩小,形状多为不规则圆形,其细胞壁清晰可见。花后14 d的枸杞果实细胞相较于花后7 d 可以看到部分果肉细胞纵向伸长,体积增大,但依然存在体积小呈不规则圆形的细胞紧密贴合在一起,皮下细胞也出现拉长现象,厚壁化现象也随之出现。花后21 d 的枸杞果实皮下细胞厚壁化明显,且整齐排列为一层,形状多为长椭圆形,排列有序。花后28 d 的枸杞果实除皮下细胞呈不规则圆形整齐排列为一排外,此时细胞的体积明显增大且排列混乱。花后35 d 的枸杞果实细胞体积明显增大的同时,细胞形状极不规则,分布混乱,部分细胞的细胞壁已不能明显分界。
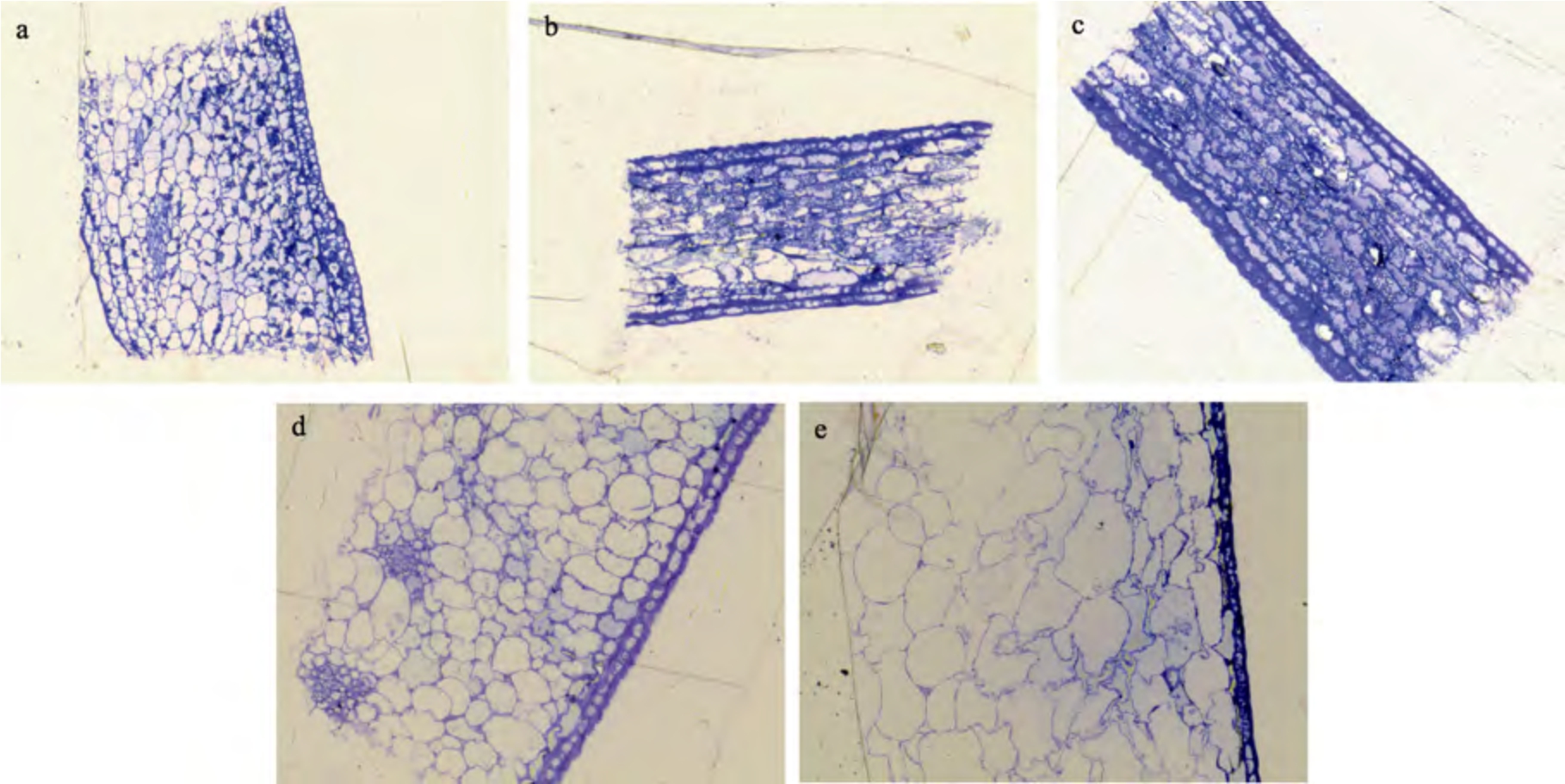
图1 不同生长时期20 倍条件下枸杞果实细胞壁半薄切片细胞形态
Fig.1 Cell morphology of Lycium barbarum fruit cell wall semi-thin section under 20 times conditions at different growth stages
注:a-花后7 d;b-花后14 d;c-花后21 d;d-花后28 d;e-花后35 d。
Note: a-7 days after flowering; b-14 days after flowering; c-21 days after flowering; d-28 days after flowering; e-35 days after flowering.
枸杞果实细胞壁超微结构如图2 所示,花后7 d,细胞体积普遍较小,细胞壁宽厚,分布均匀,细胞紧密粘合在一起。花后14 d 相较于花后7 d,细胞体积明显增大,细胞壁更加致密且厚,且中胶层更清晰,有轻微的质壁分离现象。花后21 d,细胞的体积更大且更加狭长,细胞壁开始出现分布不均匀、细胞间隙小和中胶层不明显的现象。花后28 d,细胞体积增大,细胞壁明显变薄,中胶层很难分辨,细胞间隙在可见视野内已不存在。花后35 d 相较于前四个时期,枸杞果实细胞壁极细,且分布不均匀,有些细胞壁缠联在一起无法区分细胞区域,细胞壁内中胶层完全消失,细胞壁接近崩毁。

图2 不同生长时期5 000 倍–5 000 nm 条件下枸杞果实细胞壁微观结构
Fig.2 Cell wall microstructure of Lycium barbarum fruit under 5 000-5 000 nm conditions at different growth stages
注:a-花后7 d;b-花后14 d;c-花后21 d;d-花后28 d;e-花后35 d。
Note: a-7 days after flowering; b-14 days after flowering; c-21 days after flowering; d-28 days after flowering; e-35 days after flowering.
综上所述,在枸杞果实成熟过程中,细胞体积不断增大,花后7~28 d 细胞形状以狭长椭圆状为主,花后28 d 后,主要以不规则圆形为主,其细胞壁超微结构变化明显,细胞壁变薄,分布不均,中胶层消失,细胞与细胞之间直接撕裂不再粘连。果实成熟后,细胞内陷严重呈极不规则形状混乱分布,表皮细胞则没有明显变化。
2.2 枸杞果实细胞壁多糖含量的变化
如表1 所示,随着枸杞果实的发育和成熟,CWM 含量呈现先增加后降低的趋势,在花后21 d时含量达到最高为171.6 mg/g。WSP 在果实发育前期含量较低,花后21 d 含量最低为13.9 mg/g,后期急剧升高,花后35 d 含量最高为44.2 mg/g。而SSP 含量则在花后14 d 时最高达到25.0 mg/g,随后缓慢降低。KOH-0.5 和KOH-1 含量变化趋势相近,均在花后14 d 时达到最高,随后呈现降低趋势到花后35 d 时含量最低。KOH-4 也是在花后14 d 时含量最高为31.1 mg/g,但花后28 d 相较于21 d 其含量显著增高(P<0.05),在花后21 d 时含量最低为10.2 mg/g,这与前人的研究结果一致[18]。整体而言,在枸杞果实成熟过程中,WSP、SSP 和半纤维素含量都发生了一定的变化,包括原果胶向WSP 转变,中胶层降解,细胞壁结构被破坏,半纤维素骨架结构逐渐疏松,导致细胞间的粘附力下降,细胞间隙增大[7],这与超微结构观察结果一致。
表1 枸杞果实细胞壁多糖含量
Table 1 Polysaccharide content in cell wall of Lycium barbarum fruit mg/g

注:数值为三次测定的平均值±标准差。同一指标不同字母表示差异显著(P<0.05)。
Note: Values are the mean ± standard deviation of the three measurements. Different letters of the same index indicated significant difference (P<0.05).
含量生长期/d CWM WSP SSP KOH-0.5 KOH-1 KOH-4 7 108.7±10.5e 20.0±2.6c 8.9±1.2e 15.1±1.2b 9.8±1.1d 27.5±2.1b 14 160.5±15.0b 30.9±2.8b 25.0±1.7a 20.7±2.2a 15.9±2.2a 31.1±2.5a 21 171.6±15.5a 13.9±1.5d 20.8±1.5b 12.0±1.5c 13.4±1.5b 10.2±1.3d 28 119.3±11.0d 43.5±3.6a 18.8±2.3c 7.5±1.1d 10.6±1.2c 25.4±1.8c 35 132.6±12.0c 44.2±1.5a 15.7±2.6d 4.5±0.9e 6.5±0.8e 13.0±1.1e
2.3 枸杞果实细胞壁多糖成分的变化
由图3 可知,在五个时期的拉曼光谱图中,800~2 000 cm–1 之间存在有明显的特征峰。果胶特征峰出现在870 cm–1 处对应于果胶的α-异头物和α-糖苷的(C—O—C)骨架模式带[19],不同生长时期的枸杞果实均具有果胶特征峰,并随着果实成熟,果胶峰强逐渐增大,花后7~28 d 特征峰不明显,在花后35 d 时明显出现,这从一定程度上反应了果胶含量在果实发育过程中逐渐增多的现象。半纤维素特征峰出现在960 cm–1 和1 447 cm–1处,可能是由来自于半纤维素的C—C、C—O 伸缩振动以及αβ (CH2)中的C—H 键摇摆振动与H—C—C、H—C—O、H—C—H 及C—O—H 的弯曲振动引起的[19-21]。随着枸杞果实的发育和成熟,半纤维素峰强在花后21 d 和35 d 时较大。

图3 花后7、14、21、28、35 d 的枸杞果实细胞壁拉曼光谱图
Fig.3 Raman spectra of cell wall of Lycium barbarum fruit at 7, 14, 21, 28 and 35 days after anthesis
2.4 枸杞果实细胞壁降解酶活性的变化
如图4 所示,在枸杞果实生长发育过程中PME 活性整体呈先降低后升高的趋势,花后7 d时活性最高为3.50 U/g,花后21 d 时活性最低为2.00 U/g。PG 活性整体呈现增加趋势,自花后14 d开始活性增加,到花后28 d 为最高达到0.83 U/g,花后35 d 时下降到0.66 U/g。果实成熟过程中PME 可以催化果胶去酯化,PG 可以催化降解多聚半乳糖醛酸,二者共同作用能将细胞壁中的不溶性果胶降解为可溶性果胶和果胶酸[22],使得WSP 含量增加。Cx 可以将半纤维素水解成葡萄糖分子来破坏细胞壁结构[23]。Cx 活性整体呈现增加趋势,在花后21~28 d 阶段,Cx 活性急剧增加,在花后28 d 时达到顶峰0.56 U/g。β-Gal 可以去除细胞壁多糖侧链中的半乳糖残基,从而加速果胶溶解,促进细胞壁结构的解体[23]。β-Gal 在果实发育过程中酶活性较高,呈现增加趋势,并在花后35 d 时达到最大值2.56 U/g。β-Hex 在花后21 d时活性最高为5.47 U/g,而在发育后期则有所降低。β-Hex 可能在与细胞壁降解相关的果实软化中发挥重要作用[17]。细胞壁多糖组分的降解是多种酶共同作用的结果,并且与细胞壁降解酶的活性有关[24]。
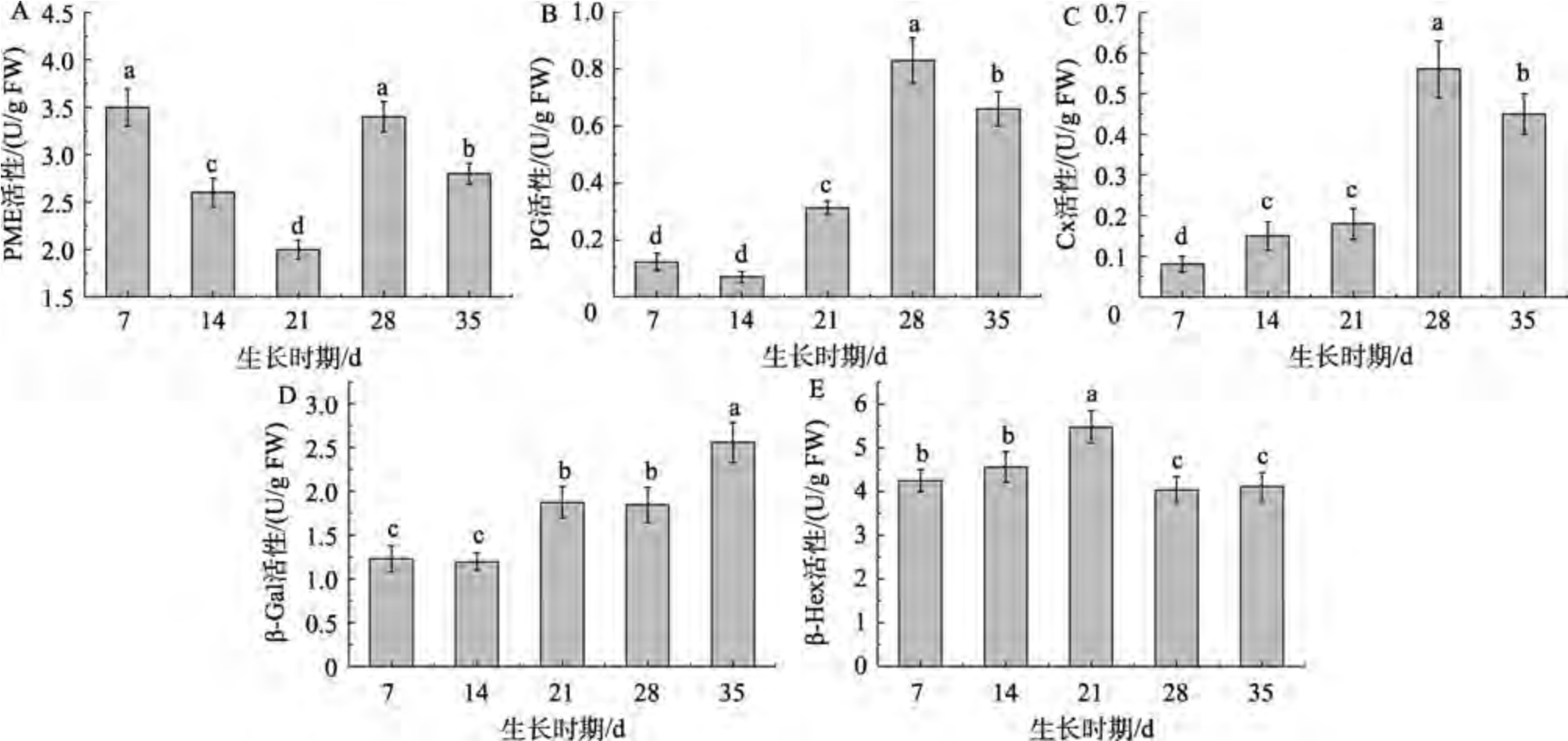
图4 花后7、14、21、28、35 d 的枸杞果实5 种细胞壁降解酶活性变化
Fig.4 Changes in 5 cell wall degrading enzyme activities of Lycium barbarum fruit at 7, 14, 21, 28 and 35 days after anthesis
注:A:PME;B:PG;C:Cx;D:β-Gal;E:β-Hex。不同字母表示差异显著(P<0.05)。
Note: A:PME;B:PG;C:Cx;D:β-Gal;E:β-Hex. Different letters of the same index indicated significant difference (P<0.05).
2.5 细胞壁多糖含量及其降解酶活性相关性分析
在果实不同生长发育阶段细胞壁结构、化学成分的变化与酶降解密切相关,果实软化主要是由于细胞壁结构和成分逐渐分解,这些分子和结构通过细胞壁降解酶的作用而解聚,与细胞壁降解酶的活性密切相关[25]。由细胞壁微观结构可知细胞壁在花后28 d 和35 d 发生降解,而果胶和半纤维素的含量在果实成熟后期整体呈现下降趋势,结果表明细胞壁的降解导致细胞壁多糖含量降低。由图5 可知,通过对细胞壁多糖含量及相关酶活性的 Pearson 相关分析发现,CWM 和KOH-0.5 含量与细胞壁降解酶PG、Cx、β-Gal 的活性有显著相关性。CWM 含量与WSP 含量以及PG、Cx 活性呈现显著负相关关系,KOH-0.5 含量与PG、β-Gal 活性呈现显著负相关关系,PG 活性与Cx 活性呈现显著正相关关系。在降解酶的协同作用下,细胞壁果胶层不断降解,原果胶转化为果胶多糖,半纤维素降解含量降低,WSP 含量不断上升,破坏了细胞壁结构[26]。结果表明,在枸杞果实生长发育过程中,降解酶活性的变化及其协同作用会使细胞壁多糖组分降解,继而细胞壁结构崩解。
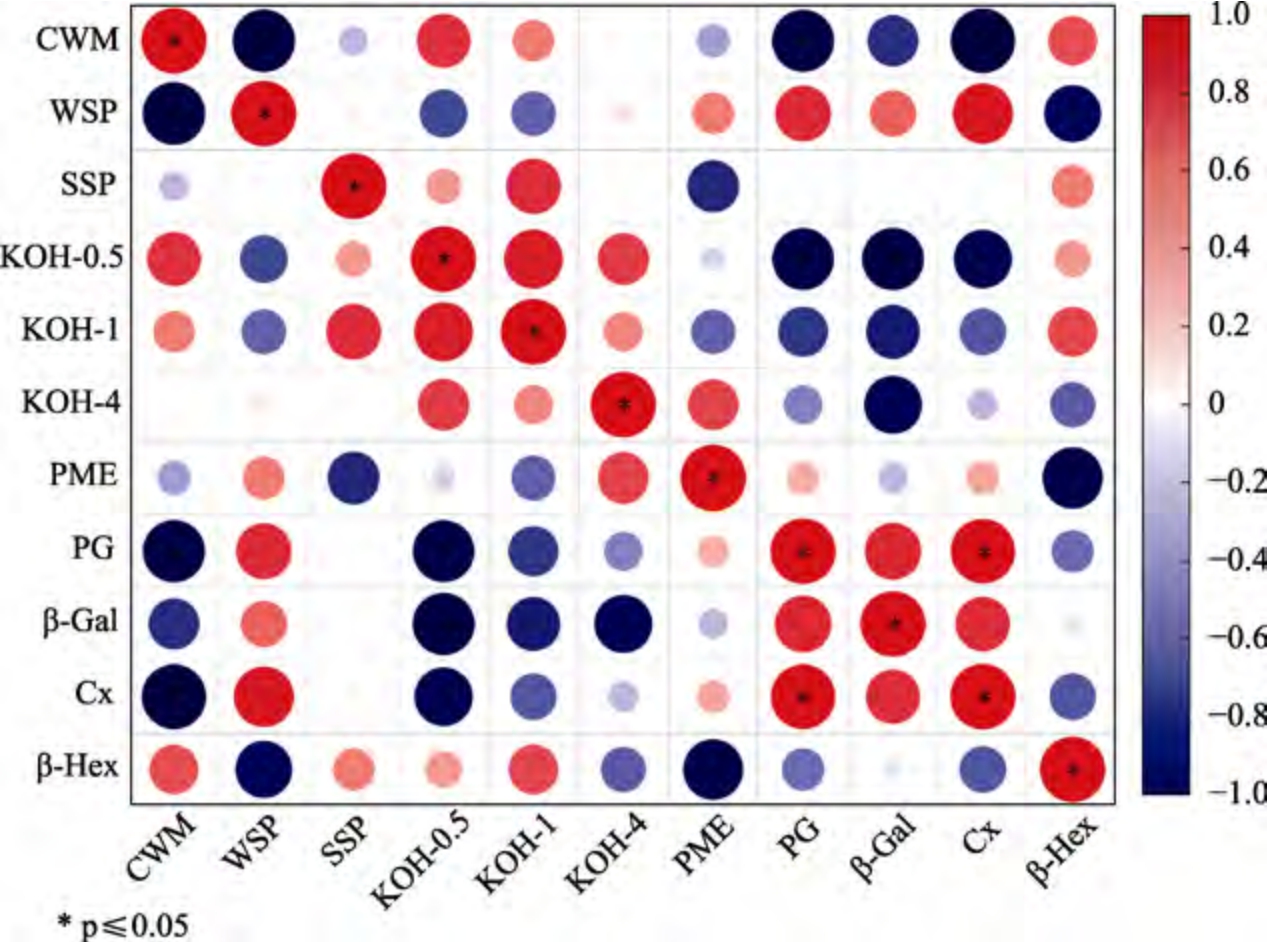
图5 枸杞果实细胞壁多糖与细胞壁降解酶活性的相关性热图
Fig.5 Correlation heat map between cell wall polysaccharide and cell wall degrading enzyme activity in Lycium barbarum fruit
3 结论
本研究通过观察生长发育过程中枸杞果实的细胞壁微观结构,测定细胞壁多糖含量及细胞壁降解酶活性,探究枸杞多糖的变化规律。结果表明,在花后28~35 d 时,枸杞果实细胞壁明显变薄,果胶降解,细胞壁结构逐渐崩毁。在CWM中,WSP 含量显著增加(P<0.05),SSP 和半纤维素含量先增加后降低。PG、β-Gal 和Cx 活性升高,PME、β-Hex 活性先降低后升高。相关性分析结果表明,在枸杞果实生长发育过程中细胞壁多糖含量与细胞壁降解酶活性显著相关(P<0.05)。随着枸杞果实的成熟,在PME、PG、Cx、β-Gal 和β-Hex 五种细胞壁降解酶协同作用下,不同类型的果胶及半纤维素发生降解,细胞壁结构在果实成熟后期逐渐崩毁。研究结果有助于揭示枸杞果实生长发育过程中枸杞多糖的代谢规律,为枸杞鲜果采后贮藏保鲜提供了理论依据。
[1] 刘敦华, 刘军, 李佩佩, 等. 枸杞深加工产品开发现状及研究进展 [J]. 食品科学技术学报, 2020, 38(4): 10-20.LIU D H, LIU J, LI P P, et al. Development status and research progress of deep processing products of Lycium barbarum[J].Journal of Food Science and Technology, 2020, 38(4): 10-20.
[2] WANG Y J, LIANG X J, GUO S J, et al. Evaluation of nutrients and related environmental factors for wolfberry (Lycium barbarum) fruits grown in the different areas of China[J].Biochemical Systematics and Ecology, 2019, 86.
[3] THIHARA R F, AMANDA C R K, PAMELA G D S, et al.Effects of electron beam irradiation on the bioactive components of goji -berry[J]. Radiation Physics and Chemistry, 2021, 179:109144.
[4] GONG G P, DANG T T, DENG Y N, et al. Physicochemical properties and biological activities of polysaccharides from Lycium barbarum prepared by fractional precipitation[J].International Journal of Biological Macromolecules, 2018, 109.
[5] REDGWELL R J, CURTI D, WANG J K, et al. Cell wall polysaccharides of Chinese Wolfberry (Lycium barbarum): Part 1. Characterisation of soluble and insoluble polymer fractions[J].Carbohydrate Polymers, 2011, 84(4): 1344-1349.
[6] BASHLINE L, LEI L, LI S D, et al. Cell wall, cytoskeleton, and cell expansion in higher plants[J]. Molecular Plant, 2014, 7(4):586-600.
[7] 冯美, 张宁, 张宏宝, 等. 枸杞采后细胞壁组分及其降解酶活性的变化[J]. 干旱地区农业研究, 2011, 29(5): 111-114.FENG M, ZHANG N, ZHANG H B, et al. Changes in cell wall component and hydrolases in the fruit of Lycium barbarum during the postharvest period[J]. Agricultural Research in the Arid Areas, 2011, 29(5): 111-114.
[8] LIU J, MA Q, LIU D H, et al. Identification of the cell wall proteins associated with the softening of Lycium barbarum L.fruit by using iTRAQ technology[J]. Food Chemistry: Molecular Sciences, 2022, 4: 1001110-1001110.
[9] HU Z Y, LIU J, XU H, et al. Exploring the mechanism of Lycium barbarum fruit cell wall polysaccharide remodeling reveals potential pectin accumulation contributors[J]. International journal of biological macromolecules, 2023, 258(P2): 128958-128958.
[10] 刘军. 枸杞发育过程中果实软化的生理差异及其作用机制研究[D]. 宁夏: 宁夏大学, 2020.LUN J. Physiological differences and mechanism of fruit softening during the development of Lycium barbarum L ripening[D]. Ningxia: Ningxia University, 2020.
[11] CATHERINE M G C RENARD. Variability in cell wall preparations: quantification and comparison of common methods[J]. Carbohydrate Polymers, 2005, 60(4).
[12] CHYLIŃSKA M, SZYMAŃSKA-CHARGOT M, DERYLO K,et al. Changing of biochemical parameters and cell wall polysaccharides distribution during physiological development of tomato fruit[J]. Plant Physiology and Biochemistry, 2017,119.
[13] 范新光. 杏果实采后品质特性及近冰温冷藏技术研究[D]. 北京: 中国农业大学, 2018.FAN X G. Analysis of apricot postharvest quality and study of near freezing temperature storage on apricot[D]. Beijing: China Agricultural University, 2018.
[14] 董黎梨. 菠萝蜜果实成熟软化过程中细胞壁修饰酶及糖代谢相关酶的研究[D]. 广东: 广东海洋大学, 2013.DONG L L. Research on activities of enzymes involved in cell wall modification and sugar metabolism during fruit ripening and softening of jackfruit[D]. Guangdong: Guangdong Ocean University, 2013.
[15] 徐晓波. 李果实成熟过程中细胞壁多糖的降解和相关酶的研究[D]. 江苏: 扬州大学, 2008.XU X B. Research on the degradation of cell wall polysaccharides and relevant enzymes during plum fruit softening[D]. Jiangsu: Yangzhou University, 2008.
[16] 艾静. ‘山农脆’梨果实硬度及其相关酶活性的初步研究[D].山东: 山东农业大学, 2014.AI J. Preliminary study on the firmness and related enzyme activity of ‘Shannongcui’ pear[D]. Shandong: Shandong Agricultural University, 2014.
[17] CAO L J, ZHAO C P, SU S X, et al. The role of β-hexosaminidase in peach (Prunus persica) fruit softening[J].Scientia Horticulturae, 2014, 169: 226-233.
[18] 沈颖, 李芳东, 王玉霞, 等. 甜樱桃果实发育过程中细胞壁组分及其降解酶活性的变化[J]. 果树学报, 2020, 37(5): 677-686.SHEN Y, LI F D, WANG Y X, et al. A study on the variation of cell wall components and activities of their degradation enzymes in sweet cherry during fruit development[J]. Journal of Fruit Science, 2020, 37(5): 677-686.
[19] PAN T T, PU H B, SUN D W. Insights into the changes in chemical compositions of the cell wall of pear fruit infected by,Alternaria alternata, with confocal Raman microspectroscopy[J].Postharvest Biology and Technology, 2017, 132: 119-129.
[20] SCHWANNINGER G M. Chemical imaging of poplar wood cell walls by confocal raman microscopy[J]. Plant Physiology, 2006,140(4): 1246-1254.
[21] 马静, 马建锋, 张逊, 等. 拉曼光谱在植物细胞壁研究中的进展[J]. 光谱学与光谱分析, 2013, 33(5): 1239-1243.MA J, MA J F, ZHANG X, et al. Application of the raman spectroscopy to the study of plant cell walls[J]. Spectroscopy and Spectral Analysis, 2013, 33(5): 1239-1243.
[22] 张元薇, 辛颖, 陈复生. 果实软化过程中果胶降解酶及相关基因研究进展[J]. 保鲜与加工, 2019, 19(2): 147-153.ZHANG Y W, XIN Y, CHEN F S. Research progress of pectin degrading enzymes and related genes in fruit softening[J].Storage and Process, 2019, 19(2): 147-153.
[23] 李瑞娟, 杨淑霞, 王丹, 等. 高能电子束辐照对猕猴桃细胞壁降解相关酶活性和基因表达的影响[J]. 食品工业科技, 2022,43(1): 326-334.LI R J, YANG S X,WANG D, et al. Effect of high energy electron beam irradiation on cell wall degradation related enzyme activities and gene expressions of kiwifruit[J]. Science and Technology of Food Industry, 2022, 43(1): 326-334.
[24] 李娇娇, 郜海燕, 陈杭君, 等. 温度对桑葚采后贮藏品质及细胞壁代谢酶的影响[J]. 中国食品学报, 2016, 16(2): 166-172.LI J J, GAO H Y, CHEN H J, et al. The effect of storage temperature on fruit quality and cell wall degrading enzymes in postharvest mulberries[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(2): 166-172.
[25] LIU J, ZHAO Y H, XU H, et al. Fruit softening correlates with enzymatic activities and compositional changes in fruit cell wall during growing in Lycium barbarum L[J]. International Journal of Food Science & Technology, 2021, 56(6): 3044-3054.
[26] 郝慧慧, 邱雪, 张海红, 等. 灵武长枣贮藏过程中细胞壁降解及多糖结构的变化[J]. 中国食品学报, 2022, 22(9): 199-207.HAO H H, QIU X, ZHANG H H, et al. Degradation of cell wall and changes of polysaccharide structure of lingwu long jujube during the storage[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(9): 199-207.