3D 打印产品具有柔软、湿润的质地,能负载生物活性成分,提高食品的营养和功能特性,被视为改善特殊需求消费者(如吞咽困难患者)的安全和营养需求的有效方法之一[1]。3D 打印油墨通常要具备较好的剪切稀化能力(高剪切速率下黏度较低)、较高的机械强度(无外力作用下黏度较高,支撑力强)和较强的剪切恢复性。水凝胶具有安全无毒、自修复性等优点,近几年在3D打印领域受到了较多的关注。但有些水凝胶的凝胶强度较低、3D 打印自支撑能力差;有些水凝胶刚性强、脆性大、高剪切下易断裂、易堵塞打印机的喷嘴等,这限制了其在3D 打印中的应用[2]。改变聚合物浓度、3D 打印温度、凝胶化时间等,能改善水凝胶的机械性能和剪切恢复性,进而改善其3D 可打印性能[3-4]。
Ca2+是多糖、蛋白质等凝胶制备中常用的离子交联剂,EDTA-Ca、CaCO3 等微溶或不溶的钙盐能随环境pH 的降低缓慢释放Ca2+,调控凝胶的形成过程和凝胶网络结构的致密程度,影响凝胶强度、黏度等,进而影响凝胶的3D 可打印性[5]。改变Ca2+浓度或控制凝胶化时间能调节复合凝胶的强度[6-8]。但是,通过控制凝胶化时间调控凝胶的3D 打印性能、可吞咽性能、对活性物质保护及缓释效果的研究尚未见报道。
豌豆是世界主要的豆类作物之一,我国豌豆的年产量约为1 200 万 t。豌豆中蛋白质含量约为20%~25%,豌豆分离蛋白(Pea protein isolate,PPI)具有丰富氨基酸谱、低过敏性、非转基因等优点,可以作为大豆分离蛋白的替代品[9]。但是PPI 的半胱氨酸含量低,二硫键的形成受到限制,导致PPI 凝胶形成所需的最低临界浓度高、胶凝性差、形成凝胶的强度低,进而影响PPI 的3D打印性能。海藻酸钠(SA)是一种来源于褐藻的线性阴离子多糖,具有良好的胶凝性,但SA 凝胶刚性强、加工过程中易碎,限制了其在3D 打印中的应用[2]。在酸性条件下,PPI 与SA 之间可产生氢键和静电相互作用,形成SA-PPI 复合物;二者还能与Ca2+通过氢键、离子和静电相互作用形成凝胶网络结构[10]。基于此,作者推测通过Ca2+的缓慢释放能够调节SA-PPI 复合物的凝胶化时间,进而调控其凝胶网络结构的形成。
因此,本文以SA 和PPI 为原料,采用GDL与CaCO3 调控Ca2+的释放,探究预凝胶化时间对SA-PPI 复合凝胶的流变特性、3D 可打印性和可吞咽性能的影响,并以姜黄素(Curcumin,Cur)为活性物质模型,探究SA-PPI 复合凝胶对姜黄素包封效率、体外释放能力等的影响。研究结果将为SA-PPI 复合凝胶在3D 打印吞咽困难食品的研究开发提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
豌豆分离蛋白(PPI,蛋白质含量≥85%):中国山东双塔食品有限公司;海藻酸钠(SA):青岛明月海藻集团有限公司;葡萄糖酸内酯(GDL)、碳酸钙:天津市博迪化工有限公司;姜黄素(Cur):上海麦克林生化科技股份有限公司;其他所有试剂均为分析纯。
1.2 仪器与设备
动态流变仪(Anton Paar MCR102):奥地利安东帕公司;紫外-可见光分光光度计(UV-2000):上海 UNIC 仪器有限公司;3D 打印机(EFLBP6601):杭州时印科技有限公司。
1.3 实验方法
1.3.1 SA-PPI 复合凝胶的制备
1.3.1.1 CaCO3 悬浊液的制备 称取3.0 g 的CaCO3 粉末分散至100 mL 蒸馏水,置于室温贮藏、备用。使用前,搅拌均匀。
1.3.1.2 不同预凝胶化时间的SA-PPI 复合凝胶的制备 称取2.0 g PPI 分散至100 mL 蒸馏水,搅拌均匀,用2 mol/L 的NaOH 调节pH 为12,搅拌30 min 后,置于85 ℃水浴加热处理30 min,取出后立即用冰水浴冷却至室温,用2 mol/L 的HCl 调节pH 为7,制备PPI 储备液,浓度分别为2.0%(w/v)。
称取2.0 g 的SA 分散至100 mL 蒸馏水中,充分搅拌使之完全水化,制备出SA 储备液,浓度为2.0%(w/v)。
2.0%的PPI 储备液(w/v)和2.0%的SA 储备液(w/v)以1∶1(v/v)的比例混合均匀,4 ℃过夜。取30 mL 的SA-PPI 复合物溶液,加入0.3 g的GDL 混合均匀,再加入0.6 mL 的CaCO3 悬浊液混合均匀,常温下分别预凝胶化0、12、22、32、42 min 后进行高速剪切。样品分为两组,一组用于3D 打印,一组用于流变学性质的测定,将样品记为SA-PPIX(X 代表预凝胶化时间)。
1.3.2 流变学特性
参照Cui 等[3]的方法稍作修改,平行板直径50 mm,间隙1 mm。测量前,样品平衡1 min。
1.3.2.1 黏度测定 所有样品在25 ℃、剪切速率为0.1~300 s–1 的条件下进行稳态剪切黏度测试,记录黏度随剪切速率变化的曲线。
1.3.2.2 动态振荡流变分析 所有样品在0.1%~1 000%范围内容进行应变扫描。测试温度25 ℃,振荡频率1 Hz。记录G′和G″,确定样品线性黏弹区(LVR)范围。
1.3.2.3 交替应变扫描 用低应变(0.1%)和高应变(50%)交替进行扫描,应变间隔为500 s,共进行3 个周期,记录G′。
1.3.3 3D 打印特性
使用3D 打印软件分别设计三维形状A 型和长方体(15×15×10 mm3),对样品进行3D 打印。打印参数如下:填充密度100%,喷嘴直径1.2 mm,层高1.5 mm,打印速度30 mm/s,收缩速度50 mm/s,平台温度25 ℃,打印温度25 ℃。A 型打印样品直接用于外观表征。长方体打印样品置于4 ℃过夜进行后凝胶化处理,用于国际吞咽障碍食物标准(IDDSI)测试,测定前置于室温平衡1 h。
1.3.4 IDDSI 测试
根据Liu 等[10]进行叉子压力、叉子滴落和勺子倾斜测试。
1.3.5 负载姜黄素(Cur)的不同预凝胶化时间SA-PPI 复合凝胶的制备
1.3.5.1 姜黄素(Cur)溶液的制备 将Cur 溶于60%乙醇中,制备Cur 储备液(30 mg/mL),使用铝箔覆盖,避光保存,备用。
1.3.5.2 负载姜黄素(Cur)海藻酸钠-豌豆蛋白复合凝胶的制备 移取29 mL 的SA-PPI 复合物溶液,加入1 mL 的Cur 溶液(30 mg/mL)和0.3 g的GDL 搅拌均匀,再加入0.6 mL 的CaCO3 悬浊液混合均匀,常温下分别预凝胶化0、12、22、32、42 min。预凝胶化样品经高速剪切后进行3D打印,再置于4 ℃冰箱中过夜进行后凝胶化处理,样品分别记为SA-PPIX-C(X 代表预凝胶化时间)。
1.3.6 姜黄素(Cur)包封效率
参照Chen 等[11]的方法测定并稍作修改。首先绘制 Cur 标准曲线(y=161.76x+0.004,R2=0.996),然后根据标准曲线计算Cur 包封效率。
1.3.7 体外模拟消化
模拟消化实验及姜黄素(Cur)累计释放率的测定参照Li 等[12]的方法测定并稍作修改。根据Cur 的标准曲线,计算样品中Cur 的释放量,并绘制Cur 的累计释放量随消化时间变化的曲线。
1.4 数据处理
所有实验至少重复3 次,结果以平均值±标准差表示。采用SPSS 25.0 软件中Duncan’s 多重比较法对数据进行差异显著性分析(P<0.05 为显著差异),使用Origin 2021 软件绘图。
2 结果与分析
2.1 流变学特性
如图1A 所示,随着剪切速率增加,所有样品的黏度均降低,表现出剪切稀化行为,这将有利于样品从3D 打印机的狭窄喷嘴中被平稳地挤出。剪切速率相同时,随着预凝胶化时间的延长,样品的黏度显著上升,适当的高黏度有利于提高3D 打印挤出过程中油墨的可控性。Xiong 等[13]发现随着凝胶化时间的延长(0~20 min),羟丙基瓜尔豆胶凝胶的黏度呈上升的趋势,显著减少了凝胶的流动性,提高了凝胶的支撑能力。如图1B所示,SA-PPI0 具有最大的线性黏弹区(LVR)为0.1%~46%,随着预凝胶化时间延长,样品的LVR 范围变窄。在LVR 范围内,SA-PPI0 的G′小于G″,表明SA-PPI0 呈类液体状态,易于被挤出打印喷嘴。但预凝胶化时间≥12 min 时,样品的G′均大于G″,表现出典型的类固体特征。随预凝胶化时间的延长,样品的G′与G″之间差值增加,意味着样品的凝胶网络结构增强,在3D 打印中具有更高的自支撑能力[14]。Hou 等[14]等也发现了类似的现象。这可能是预凝胶化时间较短时,GDL 水解程度低,体系释放的Ca2+较少,SA、PPI 与Ca2+之间的交联程度低,形成网络结构较为疏松,抗变形能力较弱,同时重力作用影响较大,3D 打印时样品挤出更流畅,但不易控制[15]。预凝胶化时间较长时,体系释放的Ca2+增加,SA、PPI 和Ca2+三者之间能形成更加致密的凝胶网络结构,抗变形能力增强,样品通过3D 打印机喷嘴需要更强的外力,挤出过程容易被控制[16]。

图1 不同预凝胶化时间SA-PPI 的流变学特性
Fig.1 Rheological property of SA-PPI at different pre-gelation times
注:A:黏度曲线;B:应变扫描曲线。
Note: A: Viscosity curve; B: strain sweep curve.
如图2 所示,交替应变扫描过程中,SA-PPI0的G′呈升高趋势,可能是扫描过程中Ca2+的持续释放促进了网络结构的形成。除SA-PPI0 外,当由低应变转变为高应变时,样品的G′迅速降低,当由高应变恢复至低应变时,G′又迅速升高,意味着3D 打印过程中样品具有一定结构恢复能力。这可能是交替应变扫描过程中,Ca2+的持续释放,能促进SA 与Ca2+(离子交联)、SA 与PPI(氢键和静电)、PPI 与Ca2+(氢键)的相互作用,有利于促进高应变破坏的凝胶结构的部分重排和恢复,提高了样品的结构稳定性[17]。随着预凝胶化时间的延长,样品的恢复率显著降低。这可能是预凝胶化时间过短(0~12 min)时,实验前Ca2+释放数量较少,Ca2+、SA、PPI 之间的相互作用较弱,形成的网络结构较少;但实验过程中,随着 Ca2+的释放,体系会发生后凝胶化现象,形成较为致密的凝胶网络,导致恢复率较高;随着预凝胶化时间的延长,试验前已经释放了较多的Ca2+,并与SA、PPI 形成较致密的网络结构,高应变易导致部分网络结构发生不可逆的破坏,被破坏的网络结构恢复程度较低,导致恢复率降低[18]。
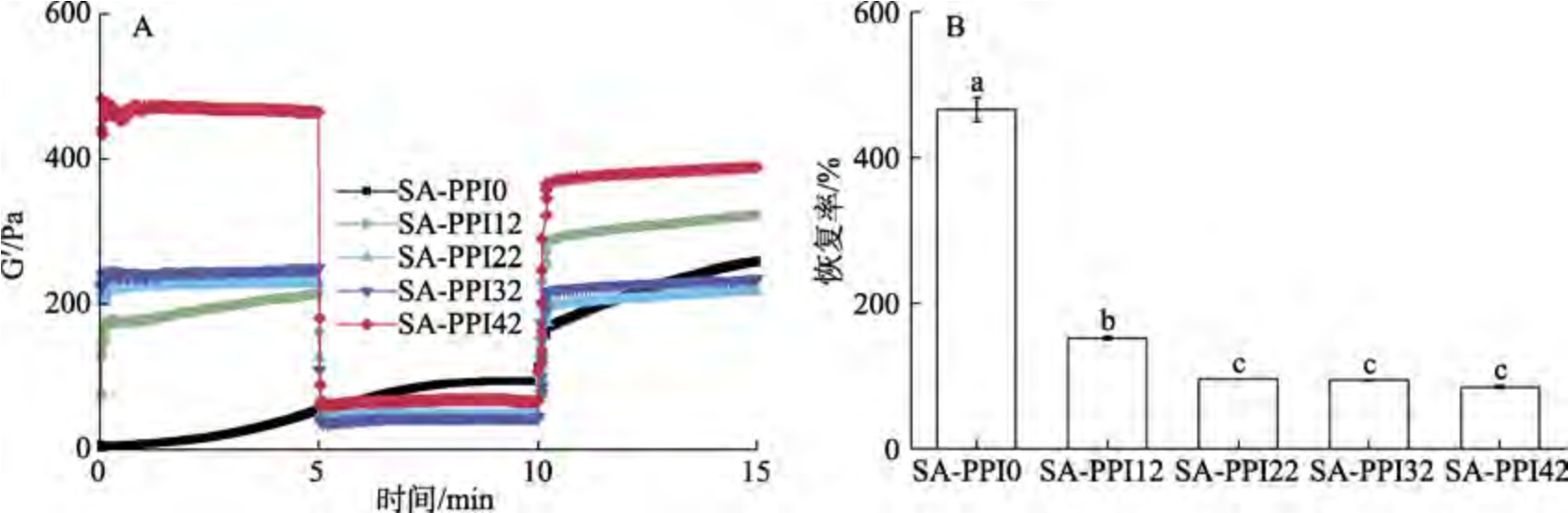
图2 不同预凝胶化时间SA-PPI 的应变恢复性
Fig.2 Strain recovery of SA-PPI at different pre-gelation times
注:A:交替应变扫描曲线;B:恢复率。小写字母不同表示不同凝胶化时间的样品差异显著,下同。
Note: A: Alternate strain sweep curve; B: recovery rate. Different lowercase letters indicate significant differences between samples with different gelation times, the same below.
2.2 3D 打印外观
如图3 所示,SA-PPI0 打印的A 型图形整体结构发生严重坍塌,边界层次不清晰,并出现不良扩散现象,图形高度远低于预设高度。SA-PPI12打印的A 型表面光滑,但打印图形发生部分坍塌,侧面呈明显的“梯形”。SA-PPI22 打印的A 型图形表面光滑,边界层清晰,图形高度与预设高度较为一致,表明SA-PPI22 具有良好的自支撑能力。预凝胶化时间延长至32 min 以上时,SA-PPI32和SA-PPI42 打印的A 型表面粗糙度增加,尽管图形未发生坍塌,但存在明显凸起、打印线条断续等现象。这与Zhu 等[4]研究结果一致。这可能是预凝胶化时间较短时,样品中凝胶结构还未形成,样品的自支撑能力差,打印后图形容易塌陷。预凝胶化时间适宜有助于样品形成较致密的凝胶网络,增强其机械性能,提高打印图形的完整性和边界的清晰性。预凝胶化时间过长,样品的凝胶结构形成充分,流动性较差,较难被挤出喷嘴,3D 打印过程中凝胶网络容易被破坏,形成凝胶小颗粒,降低打印样品的光滑度和均匀性[5]。
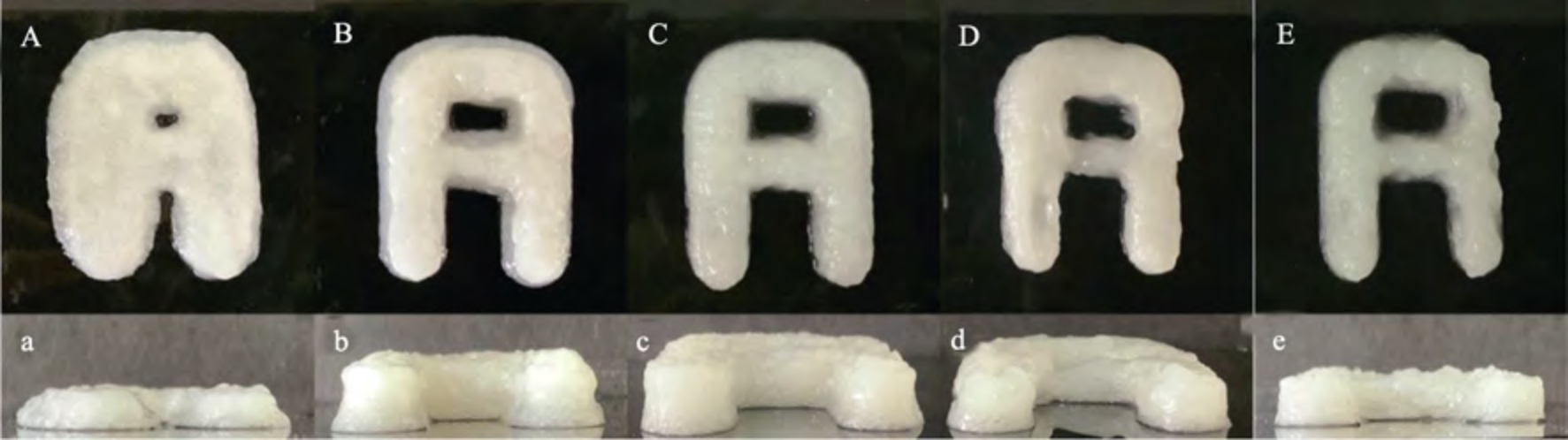
图3 不同预凝胶化时间SA-PPI 的3D 打印图形
Fig.3 3D printed graphics of SA-PPI at different pre-gelation times
注:A 和a:SA-PPI0;B 和b:SA-PPI12;C 和c:SA-PPI22;D 和d:SA-PPI32;E 和e:SA-PPI42。大写字母代表 3D 打印样品的俯视图,小写字母代表 3D 打印样品的正视图。
Note: A and a: SA-PPI0; B and b: SA-PPI12; C and c: SA-PPI22; D and d: SA-PPI32; E and e: SA-PPI42. Upper case letters represent top views of 3D printed samples, lower case letters represent front views of 3D printed samples.
2.3 吞咽试验
IDDSI 是用以评估吞咽困难患者设计食品的测试方法[10]。如表1 所示,所有3D 打印样品均可轻易被叉子压碎。SA-PPI0 叉子压碎时所用压力使指甲部分变白,撤去叉子后部分凝胶能缓慢回弹。除SA-PPI0 外,其余3D 打印样品压碎时所用压力不会使指甲变白,移除叉子后样品不能恢复至原有状态,并留下叉子相对应的清晰图案,其中SA-PPI32 和SA-PPI42 在测试时易被压碎,且压痕边缘粗糙。叉子滴落实验可以表征3D 打印样品的流动性能。SA-PPI0、SA-PPI12 和SA-PPI22 均堆积在叉子上方,未从叉子缝隙滴落;SA-PPI32 和SA-PPI42 在叉子下方形成短尾。勺子倾斜实验可直观地评估食物的内聚力。当勺子倾斜后,预凝胶化时间≤22 min 的样品可轻易滑落,勺子内几乎未有残留;预凝胶化时间超过22 min 的样品较黏,样品无法完全从勺子上滑落,留下部分颗粒。对照IDDSI,SA-PPI12 和SA-PPI22 与5 级细馅型食物描述一致,能减少食物黏在喉咙或舌头上的可能性,更容易吞咽,适用于吞咽困难患者[10]。
表1 不同预凝胶化时间的3D 打印图形的IDDSI 测试
Table 1 IDDSI tests of 3D printed figures at different pre-gelation times

样品名称 叉子压力 叉子滴落 勺子倾斜SA-PPI0images/BZ_143_517_1175_989_1459.pngimages/BZ_143_1113_1175_1585_1459.pngimages/BZ_143_1709_1175_2181_1459.pngSA-PPI12images/BZ_143_517_1478_989_1763.pngimages/BZ_143_1113_1478_1585_1763.pngimages/BZ_143_1709_1478_2181_1763.pngSA-PPI22images/BZ_143_517_1781_989_2066.pngimages/BZ_143_1113_1781_1585_2066.pngimages/BZ_143_1709_1781_2181_2066.pngSA-PPI32images/BZ_143_517_2084_989_2369.pngimages/BZ_143_1113_2084_1585_2369.pngimages/BZ_143_1709_2084_2181_2369.pngSA-PPI42images/BZ_143_517_2388_989_2672.pngimages/BZ_143_1113_2388_1585_2672.pngimages/BZ_143_1709_2388_2181_2672.png
2.4 姜黄素包封效率
如图4 所示,随预凝胶化时间延长,Cur 包封效率呈先上升后下降的趋势。SA-PPI22-C 具有最高的Cur 包封效率,为84%。但进一步延长预凝胶化时间,Cur 包封效率明显降低。Liu 等[19]也发现相似的结果。这可能与3D 打印前样品网络结构的形成程度有关。预凝胶化时间过短时,样品的网络结构疏松,仅部分Cur 被固定在网络中,而3D 打印能破坏凝胶结构,使部分Cur 游离至凝胶表面,即使经过后凝胶化处理也只能固定部分游离的Cur,导致Cur 包封效率较低。预凝胶化时间适宜时,样品能形成较致密的凝胶网络,固定更多的Cur,且3D 打印对凝胶结构的破坏程度较低,再经过后凝胶化处理,能显著提升凝胶网络的致密性,有效减少了暴露在凝胶网络外的Cur 含量,显著提高了Cur 包封效率[19]。但是,预凝胶化时间过长能使大部分的Ca2+在3D打印前被释放,导致3D 打印后Ca2+浓度低,被破坏的凝胶结构重排程度差,网络较松散,使部分Cur 暴露在凝胶网络外,Cur 的包封效率降低。
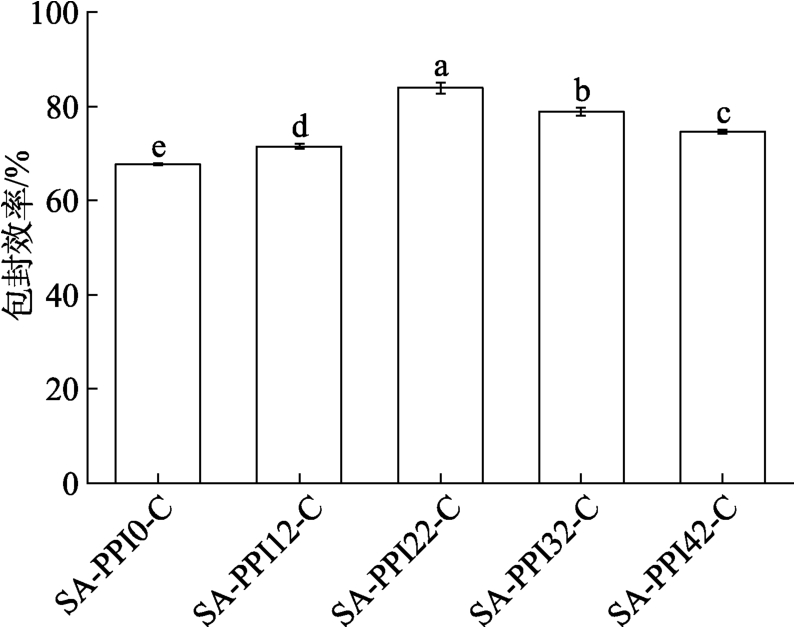
图4 不同预凝胶化时间SA-PPI-C 的Cur 包封效率
Fig.4 Cur encapsulation efficiency of SA-PPI-C at different pre-gelation times
2.5 体外模拟释放
如图5 所示,随着消化时间的延长,样品中Cur 的累计释放率逐渐增加。模拟口腔消化过程(0~10 min)中,样品的Cur 释放率较低;模拟胃部(10~130 min)和模拟肠部消化(130~250 min)过程中,Cur 的释放率均呈先升高后减缓的趋势。肠部为Cur 主要释放阶段,与胃部阶段Cur 累计释放率(9.8%)相比,肠部阶段Cur 累计释放率较高,最高可达到56%。这与Liu 等[20]的研究结果一致。这可能是在胃部消化初期,样品表面游离的Cur 释放至消化液中,使Cur 释放率上升。但在胃部消化后期,受强酸性条件影响,样品中SA 未交联的羧基发生质子化,SA 与PPI 之间的氢键相互作用增强,凝胶结构变致密,阻碍了胃蛋白酶对凝胶内部PPI 的酶解作用,维持了样品网络结构的完整性,抑制了Cur 的释放。肠部环境的pH 接近中性,SA 羧基发生去质子化,增加了SA 之间的静电斥力,样品网络结构变松散,胰蛋白酶和胆盐容易渗透至复合凝胶内部促进PPI 酶解,凝胶结构进一步被破坏,同时PPI 的酶解降低了PPI 与Cur 的疏水相互作用,使凝胶包封的Cur 被释放至消化液中,导致Cur 累计释放率迅速上升;而肠部消化后期,凝胶内部Cur数量减少,Cur 累计释放率上升速率减缓[21]。
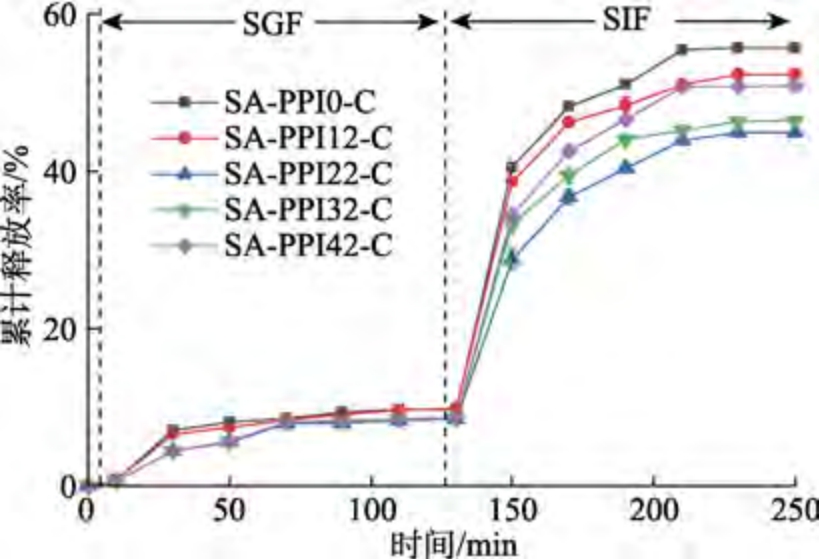
图5 SA-PPI 的3D 图形体外模拟释放
Fig.5 3D graphics in vitro simulated release of SA-PPI at different pre-gelation times
随着预凝胶化时间的延长,样品的Cur 累计释放率呈先降低后增加的趋势,肠道消化后SA-PPI22-C 的Cur 累计释放率最低,为45%。这可能是预凝胶化时间较短时,Cur 主要存在于样品凝胶表面及网络外层,易受到外界影响而释放;预凝胶化时间适宜时,样品能固定更多Cur,阻碍消化液渗透到凝胶内部,Cur 释放减缓;而预凝胶化时间过长,导致3D 打印后凝胶网络疏松,消化液易渗透至凝胶内部,促进PPI 酶解和Cur释放[21]。
3 结论
本文探究了预凝胶化时间对SA-PPI 复合凝胶流变特性、3D 可打印性能、可吞咽性能及对Cur 缓释和保护效果的影响。结果表明,随着预凝胶化时间的延长和Ca2+缓慢释放,Ca2+、SA、PPI 三者之间的氢键、静电和离子相互作用逐渐增强,网状结构更致密,增强了SA-PPI 复合凝胶的黏度和3D 打印自支撑力。预凝胶化时间为22 min 的SA-PPI 复合凝胶最适宜作为3D 打印油墨。SA-PPI22 的3D 打印产品具有优秀的可吞咽性能、Cur 包封效率和体外缓释效果。本研究为SAPPI 复合凝胶在3D 打印应用中提供参考依据。
[1] ZHANG C, WANG C S, GIRARD M, et al. 3D printed protein/polysaccharide food simulant for dysphagia diet: Impact of cellulose nanocrystals[J]. Food Hydrocolloids, 2024, 148:109455.
[2] ARIF Z U, KHALID M Y, TARIQ A, et al. 3D printing of stimuli-responsive hydrogel materials: Literature review and emerging applications[J]. Giant, 2024, 17: 100209.
[3] CUI X R, WANG Y S, CHEN Y, et al. Effects of wheat protein on hot-extrusion 3D-printing performance and the release behaviours of caffeic acid-loaded wheat starch[J]. International Journal of Biological Macromolecules, 2024, 258: 129097.
[4] ZHU Y, DI W, SONG M, et al. Correlating 3D printing performance with sol-gel transition based on thermo-responsive k-carrageenan affected by fructose[J]. Journal of Food Engineering,2023, 340: 111316.
[5] ZHANG X, YANG L, WANG W, et al. Sodium alginate/sodium lignosulfonate hydrogel based on inert Ca2+ activation for water conservation and growth promotion[J]. Environmental Research,2024, 246: 118144.
[6] SU C Y, LI D, WANG L J, et al. Green double crosslinked starch-alginate hydrogel regulated by sustained calcium iongluconolactone release for human motion monitoring[J].Chemical Engineering Journal, 2023, 455: 140653.
[7] PEñA-CHáIDEZ J E, ROSAS-FLORES W, SALAZARMONTOYA J A, et al. Rheological and thermal characterization of pinto saltillo bean (Phaseolus vulgaris L.) protein isolates/sodium alginate gels[J]. LWT, 2021, 146: 111419.
[8] STRACCIA M C, D’AYALA G G, ROMANO I, et al. Novel zinc alginate hydrogels prepared by internal setting method with intrinsic antibacterial activity[J]. Carbohydrate Polymers, 2015,125: 103-112.
[9] 仪登霞, 庞永珍. 世界豌豆蛋白生产现状与发展对策[J]. 中国种业, 2022, 11: 14-16.YI D X, PANG Y Z. Production status and development countermeasures of pea protein in the world[J]. China Seed Industry, 2022, 11: 14-16.
[10] LIU Z, CHEN X, DAI Q, et al. Pea protein-xanthan gum interaction driving the development of 3D printed dysphagia diet[J]. Food Hydrocolloids, 2023, 139: 108497.
[11] CHEN Y, WANG Y S, LI Y H, et al. Extrusion-based 3D printing of pickering high internal phase emulsions stabilized by flaxseed protein-sodium alginate complexes for encapsulating curcumin[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2023, 673: 131863.
[12] LI Y H, WANG Y S, ZHAO J S, et al. A pH-sensitive curcumin loaded microemulsion-filled alginate and porous starch composite gels: Characterization, in vitro release kinetics and biological activity[J]. International Journal of Biological Macromolecules,2021, 182: 1863-1873.
[13] XIONG Z, FU F, ZOU Z, et al. Development and application of guar gum crosslinked gel with adjustable gelation time for total loss treatment[J]. Petroleum, 2023, 9(4): 621-628.
[14] HOU Y, SUN Y, ZHANG P, et al. Development and characterization of emulsion gels prepared via gliadin-based colloidal particles and gellan gum with tunable rheological properties for 3D printed dysphagia diet[J]. International Journal of Biological Macromolecules, 2023, 253: 126839.
[15] WANG Y, LIU Q, YANG Y, et al. Impact of pH on pea protein–hydroxypropyl starch hydrogel based on interpenetrating network and its application in 3D-printing[J]. Food Research International, 2023, 170: 112966.
[16] CARVAJAL-MENA N, TABILO-MUNIZAGA G, PéREZ-WON M, et al. Evaluation of physicochemical properties of starchprotein gels: Printability and postprocessing[J]. LWT, 2023, 182:114797.
[17] SRIDHARAN S, MEINDERS M B J, SAGIS L M, et al.Jammed emulsions with adhesive pea protein particles for elastoplastic edible 3D printed materials[J]. Advanced Functional Materials, 2021, 31(45): 2101749.
[18] SHU J, MCCLEMENTS D J, LUO S, et al. Effect of internal and external gelation on the physical properties, water distribution,and lycopene encapsulation properties of alginate-based emulsion gels[J]. Food Hydrocolloids, 2023, 139: 108499.
[19] LIU K, HUANG R L, ZHA X Q, et al. Encapsulation and sustained release of curcumin by a composite hydrogel of lotus root amylopectin and chitosan[J]. Carbohydrate Polymers, 2020,232: 115810.
[20] LIU J, CHAI J, YUAN Y, et al. Designation and characterization of cold-set egg white protein/dextran sulfate hydrogel for curcumin entrapment[J]. Food Chemistry, 2023, 419: 136038.
[21] YAN J N, DU Y N, JIANG X Y, et al. Curcumin-loaded composite hydrogel based on scallop (Patinopecten yessoensis)male gonad hydrolysates and κ-carrageenan: Characterization and in vitro digestibility[J]. Food Hydrocolloids, 2022, 125:107398.