绿豆是东南亚地区主要的豆科作物之一,其淀粉含量为54.7%~58.0%,是人类饮食中抗性淀粉的主要来源。绿豆淀粉(Mung bean starch,MBS)具有良好的颗粒稳定性、高抗剪切性和抗膨胀性。MBS 凝胶透明度较高且凝胶形成能力较强,被认为是生产粉丝的优良原料。MBS 中直链淀粉含量为40.4%~ 41.8%,明显高于其他谷物[1]。直链淀粉易在氢键作用下发生自重排形成有序结晶结构,导致淀粉发生老化。这使高直链淀粉含量的绿豆淀粉老化速度较快,缩短了绿豆淀粉产品的货架期,限制其在食品中的应用。目前对MBS研究主要集中于提高其溶解度、结构特性[2]和消化性质[3]等,而关于抑制MBS 老化的研究相对较少,因此,迫切需要一种有效的方法来延缓MBS老化。抑制淀粉老化方法主要包括酶处理、化学改性、物理改性(如多糖、脂肪酸、多羟基化合物)等。酶处理反应时间难以控制;化学改性易残留化学试剂,存在安全隐患。添加多糖是抑制淀粉老化的简单安全的方法,如黄原胶、海藻酸钠、鼠尾草胶、刺槐豆胶(Locust bean gum,LBG)等。淀粉和多糖的相互作用以及多糖强亲水性,能抑制淀粉聚集和重结晶[4],从而抑制淀粉老化。然而以上研究主要集中于单一多糖抑制大米淀粉、小麦淀粉或玉米淀粉老化。相较于单一多糖,两种多糖可能存在协同作用(如乙酰化己二酸双淀粉酯与田菁胶),能更有效延缓淀粉老化[4]。
LBG 是一种植物种子半乳甘聚糖,由β-(1,4)-糖苷键连接的D-吡喃甘露糖的线性骨架和α-(1,6)-糖苷键连接的D-吡喃半乳糖的侧链组成[5]。由于LBG 在相对较低浓度下具有较高黏度,在食品领域被广泛用作稳定剂和脂肪替代品[5]。Upadhyay等[6]发现LBG 水合作用较强,能显著降低淀粉与水分子之间的相互作用,延缓淀粉老化速度。LBG具有较长的半乳糖侧链和高生物相容性,能与多糖发生协同作用(如卡拉胶、黄原胶、瓜尔胶和海藻酸钠),且LBG 与多糖协同作用的强弱与多糖浓度有关,协同作用随多糖浓度升高而增强,达到“峰值”后,随多糖浓度升高而逐渐减弱。Arda 等[7]发现卡拉胶的持水能力和凝胶强度随LBG浓度增加呈先升高后降低趋势,LBG 与卡拉胶比例为1∶8,表现出最强的协同作用。Higiro 等[8]发现黄原胶与LBG 比例为6∶4 时,黄原胶-LBG混合物黏度和弹性最强,存在最强的协同作用。目前对LBG 与多糖协同作用的研究主要集中于黄原胶、卡拉胶、瓜尔胶,对海藻酸钠(Sodium alginate,SA)的研究较少。SA 常作为增稠剂、抗老化剂和乳化剂应用于食品工业中。Upadhyay等[6]在交联剂作用下,研究了LBG 与SA 比例对凝胶珠粒径及药物荷载能力的影响,而无交联剂作用下LBG 与SA 二者之间的“协同峰”比例还尚未研究。此外,关于LBG 与多糖协同作用研究主要为协同作用对淀粉乳液流变性能、冻融稳定性及淀粉凝胶吸水性能等方面的影响。而LBG 与SA 的协同作用对MBS 老化影响尚未研究。因此,本研究主要探究不同复配比例的SA与LBG对MBS短期和长期老化的影响,并分析其抑制机理,为LBG-SA混合物作为潜在抗老化剂提供了理论依据。
1 材料与方法
1.1 材料与试剂
绿豆淀粉(MBS):无锡市九鼎食品有限公司;海藻酸钠(SA):青岛明月海藻基团有限公司;刺槐豆胶(LBG):北京索莱宝科技有限公司。
1.2 仪器与设备
AR224CN 电子天平:上海奥豪斯仪器有限公司;1 型差示扫描量热仪(DSC):瑞士梅特勒-托利多公司;MCR102 型动态流变仪:奥地利安东帕公司;TA-XT Plus 型物性测定仪:英国Stable Micro Systems 公司;NMI20-040 V-I 低场核磁共振:苏州纽迈分析仪器股份有限公司;D8 ADVANCE X-射线衍射仪:德国布鲁克AXS 有限公司。
1.3 实验方法
1.3.1 样品制备
制备总固体浓度为10%的MBS 淀粉悬浊液,悬浊液含有2% SA(w/w,占淀粉干基)、2% LBG(w/w,占淀粉干基)或SA-LBG 混合物(如表1所示)。随后,悬浊液在95 ℃水浴加热15 min,加热过程中不断搅拌进行淀粉糊化。将糊化样品冰水浴快速冷却至4 ℃,并在4 ℃储存1、3、7 d,得到老化MBS 和MBS-多糖凝胶。其中,10%纯MBS 凝胶作为对照。
表1 样品组成和样品名称缩写
Table 1 List of abbreviations in the samples used in tables and figures %
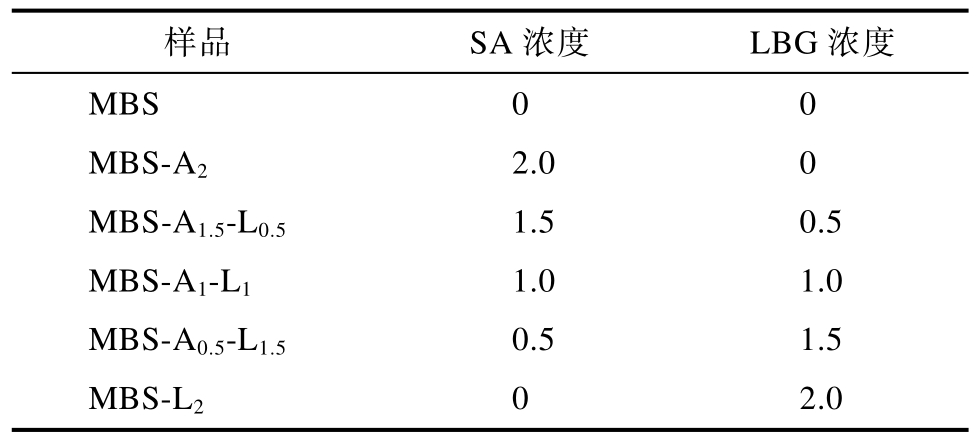
样品 SA 浓度 LBG 浓度MBS 0 0 MBS-A2 2.0 0 MBS-A1.5-L0.5 1.5 0.5 MBS-A1-L1 1.0 1.0 MBS-A0.5-L1.5 0.5 1.5 MBS-L2 0 2.0
1.3.2 流变特性测定
按照1.3.1 的方法制备5%(w/w,占MBS 干基)的MBS-多糖糊化样品,参照Chen 等[9]方法测定糊化样品的流变特性。
1.3.3 凝胶硬度测定
凝胶硬度测定参照Chen 等[9]方法并适当修改。以1 mm/s 测试速度和5 g 触发力将凝胶压缩至10 mm。
1.3.4 老化特性测定
将1.3.1 制备的老化样品冷干后磨粉、过100目筛。凝胶的糊化和老化特性参照Chen 等[9]方法并适当修改。称取样品粉末3 mg,加入蒸馏水9 mg,升温范围30~115 ℃。
1.3.5 结晶特性测定
参照Chen 等[9]等方法测定1.3.4 中样品粉末的结晶特性,并计算样品的相对结晶度(Relative crystallinity,RC)。
1.3.6 低场核磁共振(LF-NMR)
采用1.3.1 制备的糊化样品测定其水分分布,参照 Chen 等[9]等方法并适当修改。进样时间3 000 ms,回波时间0.600 ms,回波数量为6 000,半回波时间τ=7 μs。
1.4 数据处理
所有实验至少重复3 次,结果以平均值±标准差表示。采用SPSS 25.0 软件中Duncan’s 多重比较法对数据进行差异显著性分析(P<0.05 为显著差异),使用Origin 2021 软件绘图。
2 结果与讨论
2.1 流变特性分析
损耗因子(tanδ)能监测绿豆淀粉中支链淀粉聚集的变化。如图1 所示,所有样品tanδ 值均小于1,且随着扫描时间延长而降低,表明所有样品呈具有弹性特征的类固体状态。这与Luo 等[10]的研究结果一致。这可能是渗出的直链淀粉之间通过氢键形成具有双螺旋结构的聚合物和凝胶网络[10]。
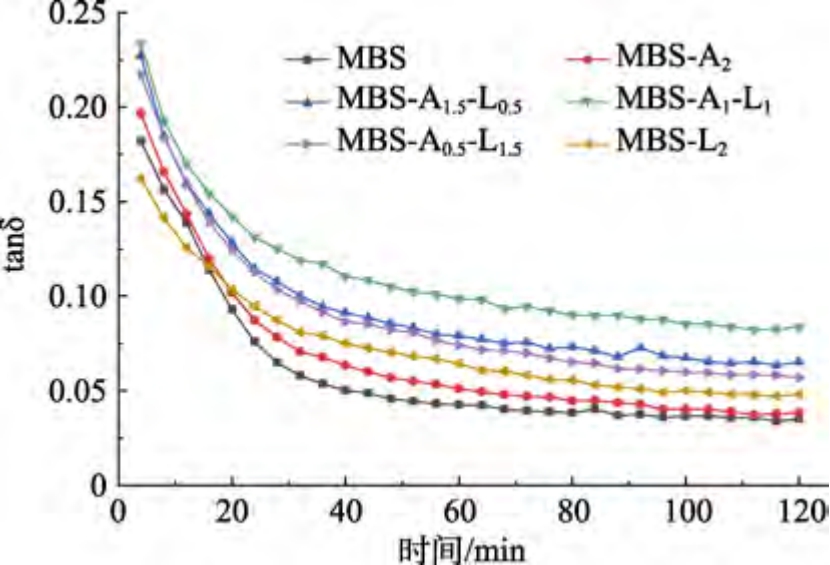
图1 不同SA 和LBG 复配比的MBS 的时间扫描曲线
Fig.1 Time sweep rheograms of MBS with different ratios between SA and LBG
相同扫描时间时,MBS-多糖的tanδ 值高于MBS,表明多糖增强了MBS 黏性性质,延缓了MBS 的短期老化。这可能是多糖与直链淀粉的相互作用阻碍了凝胶网络的形成[11]。此外,多糖的添加限制了直链淀粉的渗出,抑制弹性凝胶的形成[12]。
含有SA-LBG 混合物MBS 的tanδ 值高于添加单一多糖的MBS,表明SA 与LBG 存在协同作用。随着SA-LBG 混合物中LBG 含量升高,MBS的tanδ 值不断增大,MBS-A1-L1 的tanδ 值最高,扫描120 min 后MBS-A1-L1 的tanδ 值比MBS-A2高约58%,表明MBS-A1-L1 具有更强的黏性特征,当SA 与LBG 复配比例为1∶1 时,能更好的延缓MBS 短期老化。Zhang 等[4]也发现含有乙酰化己二酸二淀粉-田菁胶混合物的小麦淀粉的tanδ值高于含有单一多糖的小麦淀粉的tanδ 值。Higiro等[8]也发现黄原胶-LBG 比例为1∶1 时,混合物的黏度最大。这可能是SA 与LBG 持水能力较强,能与直链淀粉有效争夺水分[9]。此外,SA 中羧基与 LBG 中羟基可能发生弱静电相互作用[9],SA-LBG 形成的静电复合物与直链淀粉结合,阻碍了直链淀粉自聚集,抑制MBS 短期老化[11]。随着SA-LBG 混合物中LBG 含量进一步提高,MBS的tanδ 值迅速下降,这与He 等[13]研究结果一致,LBG-卡拉胶凝胶中LBG 含量过多会降低凝胶黏度。这可能是由于过量LBG 干扰LBG 与SA 相互作用,降低凝胶网络强度[7]。因此,当SA 与LBG 复配比例为1∶1 时有最佳协同作用,能提高MBS 凝胶的弹性,抑制MBS 的短期老化。
2.2 凝胶硬度分析
如图2 所示,所有样品凝胶硬度随储存时间的延长呈升高趋势。Hu 等[14]也发现大米淀粉凝胶硬度有类似的变化趋势,这可能是直链淀粉和支链淀粉重结晶形成有序结构所致[15]。相同储存时间下,添加SA、LBG 或SA-LBG 能降低MBS 凝胶硬度,表明添加多糖能使MBS 凝胶强度变弱,并抑制MBS 老化。在4 ℃储存3 d 后,MBS-A2、MBS-L2 和MBS-A1L1 凝胶硬度比MBS 分别低了20%、9%和35%,这一结果与之前研究发现的黄原胶降低老化大米淀粉凝胶硬度的结果是一致的[16]。这可能是多糖较强的亲水性能抑制淀粉分子的溶胀,阻碍淀粉凝胶网络的形成[17]。MBS-A2凝胶硬度显著低于MBS-L2,说明与LBG 相比,SA 抑制MBS 凝胶老化作用更强。这可能是SA的羧基影响淀粉的无定型区和结晶区,导致淀粉链的解离[9]。这与Chen 等[9]的研究结果是一致。添加SA-LBG 混合物的MBS 凝胶硬度均低于添加单一多糖的MBS,说明SA 与LBG 的协同作用能降低老化MBS 凝胶的硬度。相同储存时间,MBS-A1-L1 凝胶具有最低的硬度,储存7 d 后,MBS-A1-L1 硬度比MBS 低362 g,这表明SA 与LBG 的复配比例为1∶1 时,存在最强的协同作用,能阻碍MBS 凝胶的长期老化。这可能是LBG的非分支或光滑区域能与SA 的双螺旋结构结合,而LBG 的分支区域在分子间起交联作用[18]。Zhang等[4]发现添加复配比例为1∶4 的乙酰化己二酸二淀粉和田菁胶混合物时,小麦淀粉具有最低的凝胶硬度。因此,当LBG 与SA 以1∶1 比例复合可以增加二者的交联位点,此时SA 与LBG 的氢键作用最强,SA-LBG 混合物的吸水能力最强,能有效与淀粉分子竞争可利用水,阻止淀粉分子之间的重结晶[19]。
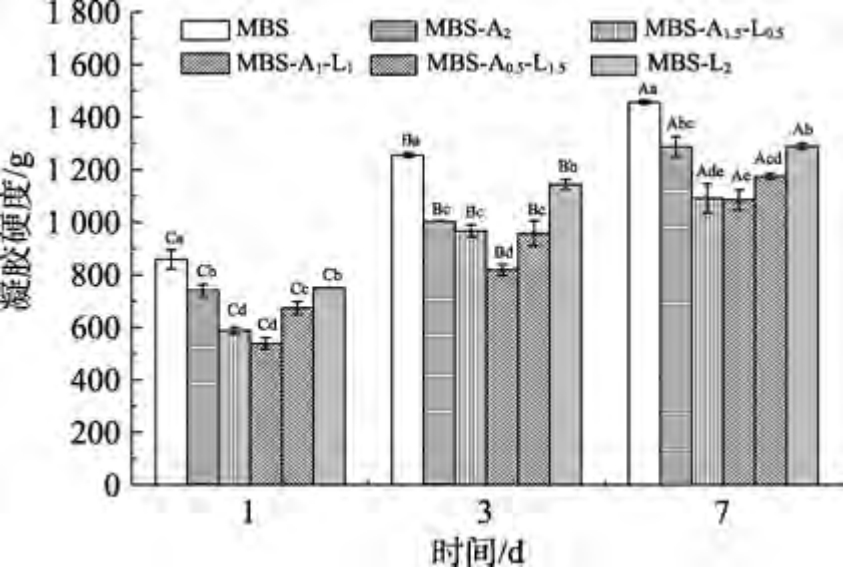
图2 不同储存时间的MBS 及MBS-多糖的凝胶硬度
Fig.2 Firmness of MBS or MBS-polysaccharide at different storSAe time
注:小写字母不同表示相同储存时间内不同样品差异显著;大写字母不同表示相同样品不同贮存时间差异显著。
Note: Different lowercase letters indicate significant differences between different samples during the same storSAe time; Different capital letters indicate significant difference in storSAe time of the same sample.
2.3 热特性分析
ΔHg 是指糊化过程中淀粉结晶熔融和/或展开淀粉侧链通过氢键形成的双螺旋展所需的能量。如图3A 和表2 所示,所有样品在约70 ℃处都观察到一个大的糊化吸热峰。添加多糖能显著降低MBS 的ΔHg,且添加两种多糖MBS 的ΔHg 低于添加单一多糖MBS,说明LBG 与SA 的协同作用能抑制MBS 糊化。其中,MBS-A1-L1 具有最低的ΔHg,表明当LBG 与SA 的比例为1∶1 时具有最佳的协同作用,更有效抑制MBS 的糊化。这可能是LBG 与SA 之间较强的协同作用减少了淀粉糊化过程中可用水的含量[20]。多糖与淀粉的相互作用改变了晶体和非晶体质地之间的耦合力[21]。
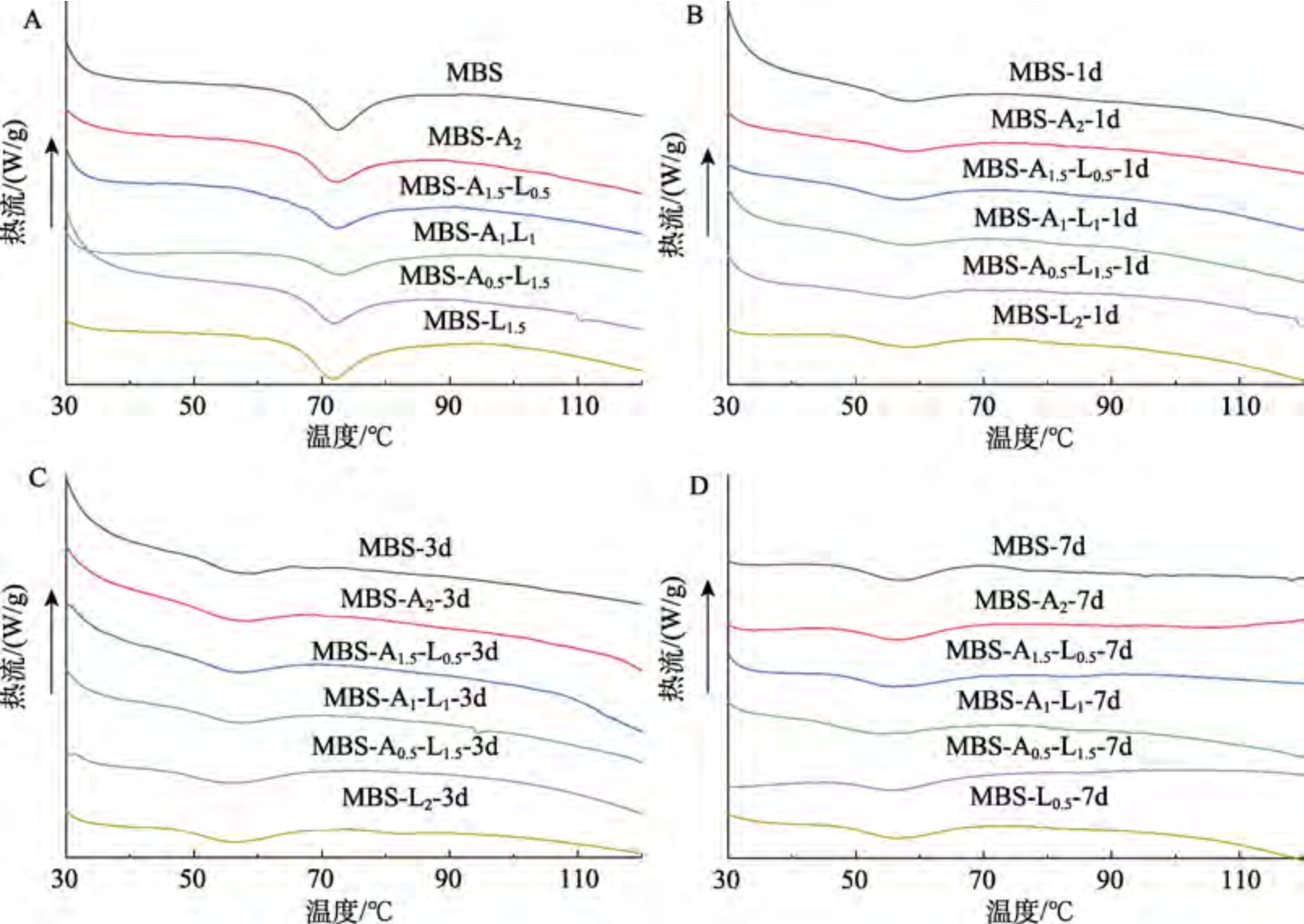
图3 MBS 及MBS-多糖混合物的热力学曲线
Fig.3 Thermodynamic curves of MBS and MBS-polysaccharide mixtures
注:A:糊化;B:4 ℃储存1 d;C:4 ℃储存3 d;D:4 ℃储存7 d。
Note: A: gelatinized; B: stored at 4 ℃ for 1 d; C: stored at 4 ℃ for 3 d; D: stored at 4 ℃ for 7 d.
表2 MBS 及MBS-多糖混合物糊化焓值、老化焓值和Avrami 参数
Table 2 Gelatinization enthalpy, retrogradation enthalpy and Avrami parameters for MBS and MBS-polysaccharide gels
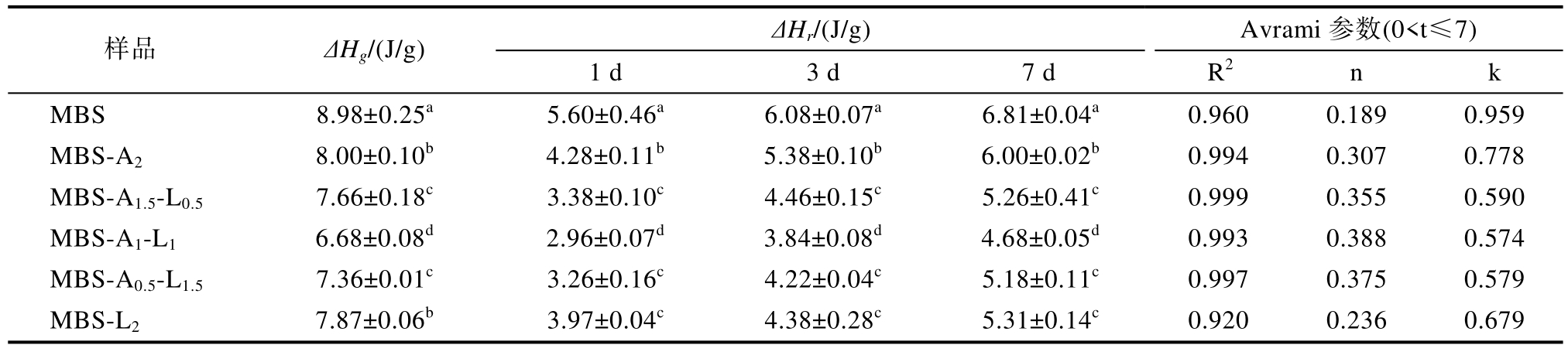
注:同一列的不同字母表示样品间的显著性差异(P<0.05)。
Note: Different letters in the same column indicate significant differences between samples (P<0.05).
ΔHr/(J/g) Avrami 参数(0
老化焓值(ΔHr)是指储存过程中熔融支链淀粉形成的结晶或双螺旋所需要的能量。如图3B、C 和D 所示。在4 ℃储存不同时间的所有样品在60 ℃以下都有一个老化吸热峰,老化峰值温度要显著低于糊化温度,这表明在老化淀粉样品中形成了不完美结晶体[22]。如表2 所示,所有样品的ΔHr 随储存时间延长而增大,表明在储存过程中淀粉凝胶老化程度加深。这与Chen 等[9]研究结果一致。这可能是直链淀粉侧链通过氢键形成双螺旋结构所致。相同储存时间下,添加SA 或LBG均能降低MBS 的ΔHr,表明添加多糖能抑制MBS重结晶。此外,添加SA-LBG 混合物的MBS 的ΔHr低于仅添加SA 或LBG 的MBS,其中MBS-A1-L1有最低的ΔHr。例如,储存7 d 后,MBS-A1-L1 的ΔHr比MBS 和MBS-A2分别低2.13 J/g 和1.32 J/g。因此,当SA 与LBG 复配比例为1∶1 时,强协同作用能最有效抑制MBS 长期老化。
2.4 老化动力学
如表2 所示,老化样品的R2范围是0.92~0.99,表明样品ΔHr 良好拟合了Avrami 方程。n 值取决于晶体成核方式和晶体尺寸,n<1 和1
2.5 X 射线衍射图谱
如图4 所示,天然MBS 表现为典型的C 型结晶结构(图4A),储存后所有样品在2θ 为17°和23°处均有较强的衍射峰,呈现出B 型结晶结构,这表明MBS 老化使其结晶结构由C 型转变为B 型。这可能是淀粉链与水分子之间的相互作用,使直链淀粉和支链淀粉变得更有序[24]。但多糖的添加对MBS 结晶结构没有显著影响,这表明多糖不影响淀粉的结晶类型。这与Li 等[25]的研究结果一致。

图4 MBS 及MBS-多糖凝胶的X 射线衍射图谱和RC 值
Fig.4 X-ray diffraction profiles and RC values of MBS and MBS-polysaccharides gels
注:A:MBS;B:4 ℃储存1 d;C:4 ℃储存7 d。
Note: A: MBS; B: stored at 4 ℃ for 1 d; C: stored at 4 ℃ for 7 d.
RC 值常被用于评估支链淀粉的重结晶程度[4]。随着储存时间延长,所有样品RC 值均升高,表明储存过程中淀粉样品的老化程度增加。这与Zheng 等[26]的研究结果一致。这可能是储存过程中支链淀粉的重结晶形成了有序结构[10]。在相同储存时间下,添加多糖能降低MBS 的RC 值。储存7 d 后,与MBS 相比,添加SA 或LBG 的MBS 凝胶RC 值降低了3.5%~4.9%。表明多糖能有效抑制淀粉重结晶和老化。Luo 等[24]也发现黄原胶能降低大米淀粉RC 值。此外,相比添加单一多糖的MBS 凝胶,添加SA-LBG 混合物的MBS 凝胶的RC 值较低,且MBS-A1-L1 具有最低的RC 值,说明SA-LBG 混合物在复配比例为1:1 时,LBG 和SA 的协同效应最强,显著延缓MBS 老化。这可能是多糖和淀粉分子之间形成的氢键能抑制直链淀粉和支链淀粉的重结晶,进而抑制MBS的老化[24]。
2.6 弛豫时间
淀粉体系中水的流动性对淀粉老化有重要影响,可通过低场核磁共振的自旋-自旋弛豫时间(T2)来监测。在淀粉体系中,T2 表示水分子与淀粉分子的结合程度,T2 越低,表示水分子与淀粉分子的结合越紧密,水分子流动性低[22]。如表3 所示,随储存时间的延长,所有样品的T2 均逐渐降低,表明储存过程中淀粉发生了老化,淀粉凝胶中水的流动性降低。这可能是淀粉凝胶中有更多的水分子留在结晶结构中,淀粉分子和水分子的紧密结合促进有序结构形成[22]。这与Zhang等[22]的研究结果一致。在相同储存时间下,添加SA 或LBG 能显著提高MBS 的T2,储存7 d 后,MBS-L2 的T2 比MBS 高12 ms。这表明添加多糖提高了淀粉凝胶中水分子的流动性。这可能是SA与LBG 具有较强的水结合能力,抑制了淀粉与水分子的紧密结合,促进了水分子的迁移,减少了淀粉结晶结构中保留的水分子,延缓了MBS 的长期老化[9]。在相同储存时间下,添加SA-LBG 混合物的MBS 凝胶的T2 高于添加单一SA 或LBG的MBS 凝胶,储存7 d 后,MBS-A1-L1 的T2 比MBS-A2 高33 ms。这表明SA-LBG 混合物显著提高MBS 凝胶中水的流动性。Luo 等[24]也发现添加黄原胶-植物蛋白水解物混合物的大米淀粉凝胶的T2 显著高于添加单一黄原胶或单一植物蛋白水解物的大米淀粉凝胶。这可能是渗出的直链淀粉与多糖之间的氢键作用、SA 与LBG 之间的协同作用、以及多糖较强的水结合能力,抑制了直链淀粉和支链淀粉的聚集及淀粉分子与水分子的紧密结合,使淀粉重结晶受到抑制,从而延缓MBS 的长期老化[4]。
表3 MBS 及MBS-多糖凝胶在4 ℃储存1~7 d 的弛豫时间
Table 3 The spin-spin relaxation time of MBS and MBS-polysaccharide gels stored at 4 ℃ for 1~7 d

注:同一列的不同字母表示相同储存时间的样品间的显著性差异(P<0.05),N.D.表示没有数据。
Note: Different letters in the same column indicate significant differences between samples of the same storSAe time (P<0.05), N.D.indicates no data.
样品 T2/ms T21/ms T22/ms T23/ms A21/% A22/% A23/%1d MBS 84.840 ± 2.164d 0.433 ± 0.083d 114.976 ± 4.931cN.D. 0.107 ±0.013f 99.893 ±0.512a N.D.MBS-A2 108.430 ± 1.395c 0.498 ± 0.041d 86.975 ± 3.724dN.D. 0.458 ± 0.085e 99.542 ± 0.493a N.D.MBS-A1.5-L0.5 118.330 ± 1.607c 0.658 ±0.027c 132.194 ± 4.050bN.D. 1.442 ± 0.021b 98.558 ± 0.319b N.D.MBS-A1-L1 168.310 ± 1.932a 1.150 ± 0.037a 174.753 ±5.172aN.D. 1.624 ± 0.013a 98.376 ± 0.261b N.D.MBS-A0.5-L1.5 132.470 ± 3.016b 0.870 ± 0.046b 132.194 ± 3.721bN.D. 0.921 ± 0.092c 99.079 ± 0.609a N.D.MBS-L2 103.760 ± 2.637c 0.433 ± 0.062d 114.976 ± 4.073cN.D. 0.652 ± 0.035d 99.348 ± 0.593a N.D.3d MBS 53.420 ± 1.392f 0.123 ± 0.005e 57.224 ± 2.018e 3 102.267 ± 9.731e 0.000 ± 0.000e 94.319 ± 0.379c 5.681 ± 0.087a MBS-A2 60.670 ± 1.871e 0.201 ± 0.017c 77.474 ± 1.925c 3 764.936 ± 6.183d 0.002 ± 0.000d 94.602 ± 0.297c 5.396 ± 0.039a MBS-A1.5-L0.5 74.250 ± 1.507c 0.215 ± 0.021c 86.975 ± 2.734b 4 977.024 ± 7.391b 0.026 ± 0.002c 96.526 ± 0.306b 3.448± 0.013b MBS-A1-L1 100.030 ± 1.062a 0.281 ± 0.019b 100.000 ± 1.073a 5 722.368 ± 9.319a 0.054 ± 0.005a 98.077 ± 0.391a 1.868 ± 0.008c MBS-A0.5-L1.5 87.480 ± 1.391b 0.321 ± 0.026a 75.646 ± 3.067c 4 977.024 ± 8.259b 0.037 ± 0.003b 96.565 ± 0.258b 3.398 ± 0.026b MBS-L2 65.450 ± 1.906d 0.163 ± 0.037d 65.793 ± 2.360d 4 328.761 ± 4.370c 0.004 ± 0.001d 94.791 ± 0.179c 5.204 ± 0.041a 7d MBS 43.220 ± 0.981f N.D. 43.288 ±2.491e 1 232.847 ± 10.271eN.D. 90.140 ±0.571b 9.860 ± 0.017a MBS-A2 50.370 ±1.375e N.D. 43.288 ±1.834e 1 417.474 ±8.654dN.D. 91.421 ±0.395b 9.364 ± 0.053b MBS-A1.5-L0.5 61.710 ±1.530c N.D. 65.793 ±2.043b 1 629.751±5.307b N.D. 91.421 ±0.207b 8.579 ± 0.074c MBS-A1-L1 83.560 ±1.094a N.D. 75.646 ±1.931a 1 773.817±7.218a N.D. 93.376 ±0.613a 6.624 ± 0.062e MBS-A0.5-L1.5 75.180 ±1.273b N.D. 57.224 ±2.607c 1 532.847±5.091c N.D. 92.687 ±0.216b 7.313 ± 0.037d MBS-L2 55.200 ± 1.734d N.D. 49.770 ±1.037d 1 232.847 ±7.350eN.D. 90.945 ±0.375b 9.055 ± 0.091b
根据弛豫时间的差异,淀粉凝胶中水的存在状态可分别为结合水(0.01~10 ms,T21)、不易流动水(40~200 ms,T22)和自由水(1 000~10 000 ms,T23),它们常被用来评价淀粉-水体系中不同组分水的流动性[24],相应的,峰面积比例分别标记为A21、A22、A23,表示水中不同组分(T21、T22 和T23)的含量。如表3 所示,随着储藏时间的延长,所有淀粉凝胶中的T21 和T22 逐渐降低,但储存7 d后,所有样品的T21 消失。Zheng 等[27]也发现贮藏3 d 后,莲子淀粉凝胶中的T21 无法检测到。Zhao等[28]发现随着储存时间的延长,小麦淀粉凝胶中的T22 逐渐降低。说明结合水向不易流动水与凝胶网络的结合更紧密。这可能是储存时间延长,淀粉分子之间交联形成有序结构,能将水分子固定有序结构中,减弱了淀粉凝胶中水的流动性[24]。
T23 在储存1 d 时无法检测,但储存3 d 后可以检测到,表明MBS-多糖体系中的自由水迁移主要发生在储存后期,此时淀粉开始回生。这可能是回生过程中,淀粉分子通过氢键聚集形成不溶性聚集体并发生结构重排,形成了致密的网络结构,降低了水的流动性,但同时导致部分不易流动水从网络结构中挤出,转变为自由水[29]。Chen 等[29]也发现大米淀粉-普鲁兰凝胶储存0~7 d无法检测到T23,延长储存时间能检测到T23。Luo等[10]也发现随着储藏时间的延长,仙草多糖-玉米淀粉凝胶的T23 逐渐降低。添加SA 或LBG 后,MBS 的T21、T22 和T23 升高,说明多糖的添加可以增强与淀粉链紧密连接的水的流动性。这可能是多糖与淀粉链之间的氢键相互作用以及SA 或LBG 的高亲水性,能减弱淀粉-淀粉之间的相互作用,抑制淀粉凝胶有序结构的形成,减弱淀粉与水分子的紧密结合,延缓淀粉的老化[4]。与添加单一多糖相比,添加SA-LBG 混合物的MBS 的T21、T22 和T23 值较高,且MBS-A1-L1 具有最高的T21、T22 和T23,说明与添加单一多糖相比,SA与LBG 之间存在协同作用,能显著提高MBS 中水的流动性,这与Zhang 等[4]研究结果一致。这可能是SA 与LBG 之间的协同作用能更有效的减弱淀粉分子之间的重排和聚集,延缓MBS 凝胶的老化[4]。
随着储存时间的延长,所有样品的A21 和A22显著降低,A23 显著升高。储存7 d 后,MBS 的A22 比储存1 d 的MBS 显著降低约10%,而储存7 d 的MBS 的A23 比储存3 d 的MBS 显著提高约42%。这说明延长储存时间能增加自由水比例,部分结合水在储存过程中转变为自由水,表明淀粉老化程度随着储存时间延长而加深。这与之前研究发现大米淀粉的A21 和A22 随储存时间延长而下降是一致的[16]。这可能是淀粉在老化过程中形成了不溶性的聚集体,降低了淀粉凝胶的持水能力,导致淀粉凝胶中水的渗出[22]。添加多糖后,MBS 的A21 和A22 逐渐增加,而A23 则呈现降低的趋势。这说明多糖的添加降低了MBS 中自由水的占比,提高结合水的占比。这与Zheng 等[26]的研究结果相似。这可能是SA 或LBG 提供的空间位阻以及淀粉与多糖的氢键相互作用,削弱了淀粉链的交联,阻止了淀粉结晶结构的形成,限制自由水的渗出,减少自由水的占比[29]。此外,在相同储存时间下,MBS-A1-L1 具有最高的A21 和A22 和最低A23,表明SA 和LBG 之间的协同作用能减少自由水的比例,延缓淀粉的老化。这可能是淀粉与SA 分子之间的静电相互作用以及淀粉分子与LBG-SA 混合物之间的氢键相互作用,限制结合水进入MBS 结晶区,抑制了MBS 老化[24]。
3 结论
本文探究了SA 与LBG 之间的协同作用对MBS 老化的影响。结果表明SA 与LBG 具有协同抑制MBS 老化的作用。二者复配比为1∶1 时协同作用最强,抑制MBS 老化的效果最佳。MBSA1-L1 显示出最高的tanδ 值以及最低的凝胶硬度、老化动力学常数、相对结晶度和自由水比例。核磁共振结果表明SA-LBG 混合物可以抑制淀粉与水分子之间的紧密连接,使较少的水分子留在结晶区,从而阻止了非晶态向结晶态转变。这可能是SA 和LBG 的持水能力较强,且SA 与LBG 之间的弱静电相互作用及其与淀粉分子之间的氢键相互作用,能抑制MBS 的重结晶和老化。结果表明SA-LBG 混合物能有效延长MBS 基食品的货架期。
[1] DHULL S B, TANWAR M, KHATKAR S K, et al. Exploring the effects of thermal and non-thermal modification methods on morphological, functional, and pasting properties of mung bean starch[J]. Innovative Food Science & Emerging Technologies,2024, 92: 103581.
[2] WANG N, DONG Y, DAI Y, et al. Influences of high hydrostatic pressure on structures and properties of mung bean starch and quality of cationic starch[J]. Food Research International, 2023,165: 112532.
[3] DUYEN T T M, HUONG N T M, PHI N T L, et al.Physicochemical properties and in vitro digestibility of mungbean starches varying amylose contents under citric acid and hydrothermal treatments[J]. International Journal of Biological Macromolecules, 2020, 164: 651-658.
[4] ZHANG D, LIN Z, LEI W, et al. Synergistic effects of acetylated distarch adipate and sesbania gum on gelatinization and retrogradation of wheat starch[J]. International Journal of Biological Macromolecules, 2020, 156: 171-179.
[5] KHOOBBAKHT F, KHORSHIDI S, BAHMANYAR F, et al.Modification of mechanical, rheological and structural properties of agar hydrogel using xanthan and locust bean gum[J]. Food Hydrocolloids, 2024, 147: 109411.
[6] UPADHYAY M, ADENA S K R, VARDHAN H, et al. Locust bean gum and sodium alginate based interpenetrating polymeric network microbeads encapsulating Capecitabine: Improved pharmacokinetics, cytotoxicity &in vivo antitumor activity[J].Materials Science and Engineering: C, 2019, 104: 109958.
[7] ARDA E, KARA S, PEKCAN Ö. Synergistic effect of the locust bean gum on the thermal phase transitions of κ-carrageenan gels[J]. Food Hydrocolloids, 2009, 23(2): 451-459.
[8] HIGIRO J, HERALD T J, ALAVI S. Rheological study of xanthan and locust bean gum interaction in dilute solution[J].Food Research International, 2006, 39(2): 165-175.
[9] CHEN Y, WANG Y S, ZHANG X, et al. Retardant effect of different charge-carrying amino acids on the long-term retrogradation of normal corn starch gel[J]. International Journal of Biological Macromolecules, 2021, 189: 1020-1028.
[10] LUO Y, XIAO Y, SHEN M, et al. Effect of Mesona chinensis polysaccharide on the retrogradation properties of maize and waxy maize starches during storage[J]. Food Hydrocolloids,2020, 101: 105538.
[11] ZHANG K, LI X, LI J, et al. Tunable controlling the retrogradation rate of wheat starch using different fractions of Artemisia sphaerocephala Krasch polysaccharide[J]. Bioactive Carbohydrates and Dietary Fibre, 2021, 26: 100272.
[12] 房子蔚, 王雨生, 于真, 等. 油酸和麦芽糖醇混合物对玉米淀粉老化特性的影响[J]. 食品科学, 2022, 43(20): 109-116.FANG Z W, WANG Y S, YU Z, et al. Effects of oleic acid and maltitol mixtures on the retrogradation properties of corn starch[J]. Food Science, 2022, 43(20): 109-116.
[13] HE H, YE J, ZHANG X, et al. κ-Carrageenan/locust bean gum as hard capsule gelling agents[J]. Carbohydrate Polymers, 2017,175: 417-424.
[14] HU Y, HE C, ZHANG M, et al. Inhibition from whey protein hydrolysate on the retrogradation of gelatinized rice starch[J].Food Hydrocolloids, 2020, 108: 105840.
[15] 王心, 闫璟圆, 张倩, 等. 甜菜果胶对小麦淀粉老化的影响[J]. 中国食品学报, 2023, 23(7): 169-76.WANG X, YAN J Y, ZHANG Q, et al. Effect of sugar beet pectin on the retrogradation of wheat starch[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(7): 169-76.
[16] LUO Y, NIU L, ZHANG S, et al. Effect of grass carp skin protein hydrolysates on the retrogradation tendency of gelatinized rice starch in the presence of non-ionic and ionic hydrocolloids during cold storage[J]. Starch-Stärke, 2019, 71: 1800260.
[17] LIU J, XU B. A comparative study on texture, gelatinisation,retrogradation and potential food application of binary gels made from selected starches and edible gums[J]. Food Chemistry,2019, 296: 100-108.
[18] GARCíA-GARCíA E, TOTOSAUS A. Low-fat sodium-reduced sausages: Effect of the interaction between locust bean gum,potato starch and κ-carrageenan by a mixture design approach[J].Meat Science, 2008, 78(4): 406-413.
[19] QIU S, PUNZALAN M E, ABBASPOURRAD A, et al. High water content, maltose and sodium dodecyl sulfate were effective in preventing the long-term retrogradation of glutinous rice grains - A comparative study[J]. Food Hydrocolloids, 2020, 98:105247.
[20] FUNAMI T, KATAOKA Y, OMOTO T, et al. Food hydrocolloids control the gelatinization and retrogradation behavior of starch.2a. Functions of guar gums with different molecular weights on the gelatinization behavior of corn starch[J]. Food Hydrocolloids,2005, 19(1): 15-24.
[21] TANG M, HONG Y, GU Z, et al. The effect of xanthan on short and long-term retrogradation of rice starch[J]. Starch - Stärke,2013, 65: 702-708.
[22] ZHANG M, SUN C, WANG X, et al. Effect of rice protein hydrolysates on the short-term and long-term retrogradation of wheat starch[J]. International Journal of Biological Macromolecules,2020, 155: 1169-1175.
[23] XU H, FAN Q, HUANG M, et al. Combination of carrageenan with sodium alginate, gum arabic, and locust bean gum: Effects on rheological properties and quiescent stabilities of partially crystalline emulsions[J]. International Journal of Biological Macromolecules, 2023, 253: 127561.
[24] LUO Y, NIU L, LI D, et al. Synergistic effects of plant protein hydrolysates and xanthan gum on the short-and long-term retrogradation of rice starch[J]. International Journal of Biological Macromolecules, 2020, 144: 967-977.
[25] LI S, ZHANG M, REN X, et al. Effects of oat β-glucan on the retrogradation behavior of rice starch and its potential mechanism[J]. International Journal of Biological Macromolecules, 2024,260: 129509.
[26] ZHENG M, LIN Y, WU H, et al. Water migration depicts the effect of hydrocolloids on the structural and textural properties of lotus seed starch[J]. Food Chemistry, 2020, 315: 126240.
[27] ZHENG M, SU H, YOU Q, et al. An insight into the retrogradation behaviors and molecular structures of lotus seed starchhydrocolloid blends[J]. Food Chemistry, 2019, 295: 548-555.
[28] ZHAO Q, TIAN H, CHEN L, et al. Interactions between soluble soybean polysaccharide and starch during the gelatinization and retrogradation: Effects of selected starch varieties[J]. Food Hydrocolloids, 2021, 118: 106765.
[29] CHEN L, TIAN Y, TONG Q, et al. Effect of pullulan on the water distribution, microstructure and textural properties of rice starch gels during cold storage[J]. Food Chemistry, 2017, 214:702-709.