重组稀奶油通常指以黄油、无水黄油、植物油等油相物质为主要原料,添加生牛乳或乳蛋白浓缩物提供蛋白质,并加入水相、适当的乳化剂及稳定剂,通过剪切乳化、高压均质、超声处理或其他方式使得油相分散在水相中并在一定的保质期内保持稳定而不发生两相分离的乳制品。与生鲜稀奶油相比,重组稀奶油具有原料受季节影响小、储藏稳定期长、成本价低等特点,在近年来发展极速的现饮咖啡、新中式茶饮等行业应用广泛。
通过机械搅打使体系快速失稳,充入气体后再次稳定并形成具有一定硬度的“泡沫”是重组稀奶油的重要特点之一。利用这一特点可以制备茶饮奶盖、进行咖啡拉花或蛋糕裱花等。但因产品又需要在一定保质期内保持水包油(Oil in water,O/W)体系的稳定,稳定-失稳-再次稳定之间的转变给重组稀奶油产品的研发与生产带来了不小的挑战。保障重组稀奶油产品在6~12 个月保质期内的稳定性,同时提升重组稀奶油搅打后泡沫的稳定性,成为乳制品工业行业的热点话题。
已有许多研究证明,脂肪晶体刺破脂肪球膜而发生部分聚结是重组稀奶油搅打起泡的先决条件[1-2]。本文以重组稀奶油的储藏期失稳机理为出发点,探究部分聚结现象的发生机制与影响因素,以期为重组稀奶油的研发与工业生产提供一定的帮助。
1 重组稀奶油的静态稳定机理及其影响因素
重组稀奶油的重组过程本质上是使互不相溶的水油两相通过添加乳化剂以及加工工艺实现一定时期内“相溶”的过程。均质后脂肪球粒径降低、总表面积增加,原有的膜材料不足,两亲性的乳化剂分子能作为表面活性剂定向吸附于水-油表面,维持储藏期内的相对稳定性。在储藏期间,重组稀奶油体系趋向于两相完全分离使界面面积最小而减少体系吉布斯自由能,处于热力学的不稳定状态,因此会发生不稳定现象,如乳化、奥斯特瓦尔德成熟、相反转和部分或完全聚结[3]。高强度热处理后蛋白质变性聚集,相邻脂肪球间因缺乏足够的蛋白质覆盖而共享界面蛋白,进而发生桥接絮凝[4],加剧体系不稳定的发生。
重组稀奶油的这种失稳过程可以大致分为三个阶段:初始稳态阶段、析水阶段和脂肪球聚结上浮阶段。
1.1 初始稳态阶段
在重组稀奶油制备完成的初期,油相通过高速剪切、高压均质等工艺形成粒径较小的脂肪球均匀的分散在水相之中,小分子乳化剂(例如磷脂、单硬脂酸甘油酯等)因其竞争性吸附作用能够快速的吸附到脂肪球表面,减少油相液滴形成的能量密度,起到降低油水界面界面自由能的作用[5]。同时离子型乳化剂还能够形成带电膜层,通过静电斥力作用防止脂肪球间相互聚集。在此阶段,足量的乳化剂与合理的乳化剂配比对重组稀奶油的静态稳定性以及抵抗温度变化、抵抗运输过程机械剪切的能力至关重要。亲水-亲油平衡值(Hydrophilic lipophilic balance,HLB 值)较低的复配乳化剂能够促进形成小而均匀的脂肪球,使得重组稀奶油的粒径显示窄而尖挺的单峰状,液滴间相互碰撞聚集成团的几率降低,使乳液的稳定性增高[6]。酪蛋白通过其两亲的特殊性质包围在脂肪球表面,形成具有粘弹性的界面蛋白层,提供空间和互斥的静电力,使脂肪球间不容易相互聚集[7]。同时,长链状稳定剂(例如微晶纤维素、羧甲基纤维素钠、黄原胶等)构成的网状结构形成空间位阻,使重组稀奶油表观粘度提升,脂肪球难以在连续相中分散,还有一些研究发现黄原胶与微晶纤维素(Microcrystalline cellulose,MCC)复配使用时,阴离子多糖的存在还能削弱填充MCC 网络的脂肪球之间的相互作用力,阻止脂肪球的相互聚集[8]。这一时期脂肪球间碰撞机会减少,相互间很少或几乎没有聚集,体系处于初始的稳态阶段(图1a)。

图1 重组稀奶油储藏期间的静态失稳过程
Fig.1 Static instability process during storage of recombined dairy cream
注:(a)初始稳态阶段;(b)析水阶段;(c)脂肪球聚结上浮阶段。
Note: (a)Initial homeostatic stage; (b)Bleeding stage; (c)Fat globule coalescence and floating stage.
1.2 析水阶段
在重组稀奶油保质期大约1~2 个月时,由于液滴间的相互碰撞使得脂肪球逐渐聚集,平均尺寸增大,重组稀奶油中发生乳析作用(creaming)。乳析的发生会导致界面层的破坏,最终导致脂肪球的聚结(coalescence)并促进水油两相不可逆的分离[9]。受高强度热杀菌后,变性的乳清蛋白会与酪蛋白、胶束酪蛋白形成聚集体,未吸附而散落在分散相中的乳清蛋白聚集体与钙离子相互作用将促进脂肪球的絮凝(flocculation),引发界面膜排水变薄,使得脂肪球易发生部分聚结并在重组稀奶油底部形成以水相和乳清蛋白聚集体为主的析水层[10](图1b)。S. A. K. Jeelani 等以斯托克斯定律为基础建立了一套评价O/W 乳液发生乳析作用速率的理论模型,通过实验验证得出,脂肪球的初始平均直径(d0)的值越大、初始粒径尺寸分布的范围越大,油相从分散相中聚结并“逃离”所需的时间就越短[11],乳析作用发生的时间就会越快。重组稀奶油的d0 值主要取决于加工过程中的均质压力与乳化剂的HLB 值,均质压力越大、HLB 值越低初始粒径就越小。但需要注意的是,d0 值变小会引起重组稀奶油粘度的上升,过高的粘度将会对加工过程中的泵送与换热装置造成极大压力。
1.3 脂肪球聚结上浮阶段
随着时间的推移,脂肪球的絮凝和蛋白质作用下的桥接絮凝逐渐发生,大液滴形成,并导致大块分散相的分离,重组稀奶油进入脂肪球聚结上浮阶段(图1c)。Hzlett, R. N.等研究发现液滴的聚集和分离涉及以下三个主要过程:接近和碰撞,排水和粘附,以及液滴释放[12]。一旦脂肪球间接近和碰撞发生,就会以通过最小化比表面积来降低界面能作为驱动能而推动完全聚结的发生,这个过程是不可逆的。脂肪球的完全聚结会影响的重组稀奶油的搅打起泡特性,使得搅打后泡沫硬度降低、表面粗糙、应用性能降低。如果重组稀奶油在静态储存期出现严重的失稳情况,其搅打时的去稳起泡性能和泡沫的再稳定性能均会受到极大的负面影响。在重组稀奶油的生产过程中需要通过对均质压力、降温速率、乳化剂及稳定剂的添加量和比例的控制来降低d0 值,提升粘度;在运输过程中要尽量限制温度波动与物理震荡程度,以达到延后聚结上浮阶段的目的,提升产品品质。
2 重组稀奶油搅打期间的再稳定机理及其影响因素
2.1 搅打
O/W 乳液的部分聚结发生在液滴形成的固体部分(通常为乳脂晶体)从液滴中突出并刺穿临近液滴的界面吸附层时。此时突出的桥接晶体被流出的油相湿润,在两液滴间形成油颈,油颈起到“桥梁”作用,促进两液滴向颈状部分相互聚集;但因液滴内部形成的晶体网络产生了可以平衡拉普拉斯压力(Laplace pressure)的机械强度,液滴内部的弹性能与界面能互平衡,抵抗系统最小化表面张力的趋势,发生聚结阻滞;两液滴达到最低能态时部分聚集现象发生,形成不规则的非球状液滴[13],如图2。

图2 光学镊子法观察无水奶油液滴聚结形态
Fig.2 Aggregation and coalescence of partially crystalline emulsion drops investigated usingoptical tweezers
注:(a)施加温度循环前的液滴;(b)温度循环后晶体生长;(c)两个带有晶体的液滴被捕获在两个光学陷阱中;(d)单个光阱中两个液滴相互作用;(e)从捕集器释放的液滴部分聚结[13],液滴表面涂覆Tween 20。平均尺寸约2 mm。
Note: (a) Droplet before applying temperature cycles; (b)crystals grow after temperature cycles; (c) two droplets with crystals trapped in two optical traps; (d) the two droplets in a single optical trap interacting; (e) droplets released from the trap partially coalesce[13]. Droplets coated with Tween 20. Average size around 2 mm.
目前普遍认为O/W 乳液搅打起泡的过程分为三个主要阶段,即迅速充气段、大气泡破裂段与泡沫稳定段[14]。搅打时机械力带入气体,蛋白质迅速吸附到气-液界面,随着机械搅打的继续,大气泡破裂,乳化剂竞争性的吸附到蛋白质表面,脂肪球间发生部分聚结促使脂肪颗粒逐渐吸附到界面上,随着部分聚结的进一步发生,脂肪球间形成具有一定强度的网络结构将充入的气泡俘获起来。部分聚结的脂肪球、乳化剂、蛋白质共同形成新的界面膜抵抗不同大小气泡间的卡普拉斯压力,在一定时间内保持泡沫硬度与可塑型性[15]。因此,搅打时脂肪球部分聚结发生的程度与速度决定了重组稀奶油搅打形成泡沫的再稳定的能力。
2.2 脂肪球部分聚结的影响因素
2.2.1 固体脂肪含量
乳脂肪球的固体脂肪含量(Solid fat content,SFC)较低时,其弹性模量也较低,此时界面能将主导弹性能,导致相邻两乳脂肪球接近后更倾向于形成新的球状,使原有形态消失,即发生完全聚结。随着固体脂肪比例的增加,弹性能将占拉普拉斯压力的主导地位,使得聚结阻滞,最终发生部分聚结。因此,重组稀奶油能否发生部分聚结取决于固体脂肪的初始分数。在对乳脂肪球进行冷冻透射电镜(CRYO-TEM)显微观察时也显示出相同倾向,在低SFC 下脂肪球表面相对光滑,随着SFC 的增加,表面越来越粗糙并含有突起[16],有利于薄膜破裂,更容易发生部分聚结。相同温度下固体脂肪含量升高时,Avrami 指数(n)、Avrami 常数(K)增大,结晶所需的诱导时间越短,结晶速率就越快[17]。但并不是一味增大SFC 值就能使O/W 乳液的部分聚结能力无限提升。当乳脂肪结晶发生后脂肪球的密度会有所增大,液态油脂比例降低,当液态油脂量低至无法覆盖刺破的桥接晶体时无法形成油颈,部分聚结就无法发生。目前的研究认为O/W 乳液发生部分聚结的最佳SFC 值在15%~25%左右[18-19]。
固体脂肪含量主要取决于饱和脂肪酸与不饱和脂肪酸的组成、体系冷却速率等,提高的冷却速度能够在结晶时使更多的液油吸附在晶体表面,因此使SFC 值得到提升。据报道,乳牛品种、进食饲料、产奶季节等均会影响乳脂的脂肪酸组成[20],因此,为保证重组稀奶油的产品品质的均一性,其配方也需要随产奶季节不断进行调整。SFC 值随饱和脂肪酸含量的增加而增加,因此加入高饱和脂肪酸油脂形成多元油脂共混物体系也可以改变重组稀奶油的固体脂肪含量。按不同比例加入棕榈仁油、大豆油、棕榈硬脂后的所有多元混合脂在低温下的SFC 均显著高于纯乳脂,使用多元混合脂制备重组稀奶油的部分聚结率也相应有所上升[21]。使用富含多不饱和脂肪酸的液体油部分取代乳脂则会导致液滴间的连通性降低,使部分聚结作用减少[15]。王筠钠等在使用不同来源的无水奶油作为油相制备重组稀奶油时还发现,当原料碘值越低时饱和程度越高,体系中的SFC 值就越高,能够快速形成晶核并诱导周围脂肪不断结晶而聚集形成小而密的结晶网络[22],使得打发后泡沫的保型性得到提升。
2.2.2 结晶特征
当脂质被冷却至低于甘油三酯(TAGs)熔点的温度时TAGs 变得过饱和,并由液态相变转化为有序的固态,称为结晶。结晶过程可以视作由温度变化驱动的分子重排列的过程,主要包括成核、晶体生长、晶型转换三个阶段。脂肪结晶时会首先形成横向分层排列的薄片结构,随后向外延伸堆叠形成板状,然后形成团簇,最终絮凝聚集形成晶体,晶体再进一步生长与聚集成为多晶体,组成三维网状结构[23](如图3)。根据冷却速度、过冷度、脂肪粒径大小的不同,乳脂肪在结晶时存在不同比例的α、β′、β 晶型三种晶体亚型。其中,β 型结晶体积最大、熔点最高、稳定性最强[24],其亚细胞呈三斜状分布;α 型结晶体的亚细胞呈六角形分布;β′型结晶体呈细针状,其亚细胞呈正交分布。三种晶型可以从不稳定状态向稳定状态(即α→β′→β)转化,这种转化通常是不可逆的[25]。
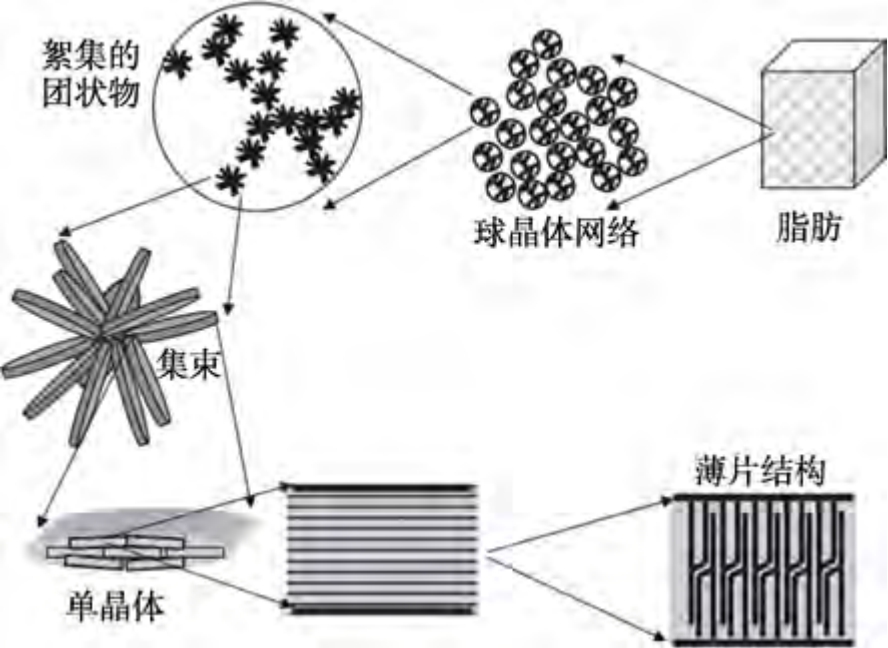
图3 脂肪晶体网络中的结构层次[23]
Fig.3 Structural hierarchy in colloidal fat crystal networks[23]
乳脂肪球的部分聚结程度与效率和脂肪的结晶特征——晶体尺寸、晶体形态、晶型等密切相关。脂肪球表面形成的晶体尺寸越大、形态越粗糙、突出长度越长,相邻两脂肪球靠近时界面膜被刺破的可能性就越高,可以加速部分聚结的发生。当脂肪晶体呈现片状或球状时,脂肪球主要呈单个分布状态,此时部分聚结不易发生粒径图呈现尖窄的单峰形状;当脂肪球呈现针状时,部分聚结发生的可能性较大,粒径图显示为分布较宽的单峰形状或双峰形状[26]。脂肪晶体的晶型主要取决于冷却速率、储存时间与剪切转速,降低结晶温度、提升冷却速率会使晶体的成核速率提升,能够形成更细小的结晶。脂肪酸组成也是影响脂肪结晶特征的主要因素之一。当在乳脂中加入椰子油、油棕籽油等月桂酸含量较高的油脂形成多元脂质时,O/W 乳液可以形成排列致密、尺寸较大的结晶体[27],使得重组稀奶油在搅打时更易起泡,泡沫的再稳定性能也有所提升。对重组稀奶油体系而言,形态小、大小均匀、密度大的β′晶型是最为理想的。有研究表明,提升降温速率与搅拌速度能够获得更多的β′晶体[28],因此,生产加工过程中的换热冷却速度是重组稀奶油稳定性的决定性因素之一。尽管在脂肪结晶控制方面已有一些研究成果,但如何在O/W 乳液生产加工过程中获得并稳定β′晶体方面尚缺乏具体的指导工具。如何根据产品脂肪含量选择适当的油基、如何合理设计产品配方中的TAGs 组分以弥补乳脂的不足或许能够成为指导重组稀奶油生产与研发工作的重要方向。但也有学者在使用cryo-TEM观察部分聚结行为时发现,晶体形态对影响部分聚结效率的贡献较固体脂肪含量而言较小。如果固态脂肪含量较低,大部分脂肪球中不存在脂肪晶体网络,即使脂肪球表面晶体尺寸增加也不太容易诱发部分聚结[18];如果固态脂肪含量较高,即使脂肪球表面仅有较光滑的小型突出晶体,部分聚结也可以顺利发生[16]。
2.2.3 乳化剂
重组稀奶油体系中,分布在水相中的脂肪球始终在做无规则的布朗运动,已经结晶的脂肪球与尚未结晶的脂肪球相互碰撞时将促进后者结晶过程的发展,即二次成核过程。二次成核的发生高度依赖液滴表面能。当表面能较低时,两液滴接触角θ小于90°,液滴中的油相将扩散到分散相中并促进晶体的生长;较大的接触角则会抑制油相的扩散,使得晶体的生长受到抑制,从而影响晶体形态。单甘酯等亲油乳化剂,则能够通过降低表面能影响接触角,促进界面非均质成核,诱导脂肪球结晶的发生,从而促进脂肪球的部分聚结[29]。小分子乳化剂的加入还可以改变界面膜的特性。两亲性乳化剂Tween 80 能够快速取代界面蛋白而竞争性吸附到油-水界面,使得界面膜更加柔软、更易受到剪切影响,使得部分聚结的发生更便利[30]。
另外,一些大分子的天然物质,例如纤维素、大豆蛋白、淀粉等,因其表面既可以被油相润湿也可以被水相润湿,而可以吸附在油-水界面上,使平均粒径增加,通过提供较大的空间位阻而减少脂肪球的部分聚集[31]。这些大分子乳化剂的存在有助于重组稀奶油的静态稳定,但会造成搅打起泡时的搅打时间延长、泡沫硬度降低,对应用性能产生不利影响。
3 结语
得益于烘焙、新中式茶饮市场的蓬勃生长,重组稀奶油在我国的市场规模正在以极高的速度不断增长,这为国内稀奶油生产企业带来了新的发展机遇。然而,国内的稀奶油市场长期被安佳、蓝风车等进口品牌与掌握国外先进技术的雀巢等合资企业所垄断,国内企业普遍只能在价格相对低廉的植脂稀奶油产品板块进行布局。对重组稀奶油的进一步研究有利于产品的持续迭代增质,促进行业的健康发展。
如何在保障重组稀奶油保质期内产品静态稳定性的同时使搅打充气性能得到提升是国内乳制品生产企业急需攻克的难题。然而,重组稀奶油的O/W 体系组成复杂、工艺繁复,许多研究中得出的结论不尽相同。本文介绍了重组稀奶油的静态稳定与搅打再稳定机理及其影响因素,能够对重组稀奶油的实际生产与研发过程提供一定的技术支持。
[1] WANG Y, WANG R, LI Y, et al. Beef tallow/lard blends in O/W emulsions: Characterization of fat crystals, partial coalescence,rheology, and aeration performance[J]. Food Research International, 2023, 172: 113140.
[2] NIE Y, WANG L, JIANG J. Fat crystallization and physical characteristics of mung bean protein-based frozen whipped emulsions: Effect of lipophilic surfactants and quinoa hydrolysate[J]. Food Hydrocolloids, 2024, 146: 109297.
[3] LIANG Y, GILLIES G, PATEL H, et al. Physical stability,microstructure and rheology of sodium-caseinate-stabilized emulsions as influenced by protein concentration and non-adsorbing polysaccharides[J]. Food Hydrocolloids, 2014,36: 245-255.
[4] LOI C C, EYRES G T, BIRCH E J. Effect of milk protein composition on physicochemical properties, creaming stability and volatile profile of a protein-stabilised oil-in-water emulsion[J]. Food Res Int, 2019, 120: 83-91.
[5] JIANG J, JIN Y, LIANG X, et al. Synergetic interfacial adsorption of protein and low-molecular-weight emulsifiers in aerated emulsions[J]. Food Hydrocolloids, 2018, 81: 15-22.
[6] 傅礼玮, 曾茂茂, 何志勇, 等. 不同乳化剂对大豆基搅打稀奶油的影响[J]. 食品工业科技, 2019, 40(12): 96-162.FU L W, ZENG M M, HE Z Y, et al. Effects of different emulsifiers on soy whipped cream[J]. Science and Technology of Food Industry, 2019, 40(12): 96-162.
[7] LOI C C, EYRES G T, BIRCH E J, et al. Application of a novel instantized glycerol monooleate ingredient in a protein-stabilized oil-in-water emulsion[J]. Foods, 2020, 9(9): 1237-1253.
[8] LIU Z, CAO Z, ZHAO M, et al. Synergistic influence of protein particles and low-molecular-weight emulsifiers on the stability of a milk fat-based whippable oil-in-water emulsion[J]. Food Hydrocolloids, 2022, 127:
[9] HUYST A M R, VAN DER MEEREN P, HOUSMANS J A J, et al. Improved coalescence and creaming stability of structured oil-in-water emulsions and emulsion gels containing ovalbumin amyloid-like fibrils produced by heat and enzymatic treatments[J]. Food Hydrocolloids, 2023, 145: 109142.
[10] CURLEJ J, ZAJAC P, CAPLA J, et al. The effect of heat treatment on cow's milk protein profiles[J]. Foods, 2022, 11(7):1023-1038.
[11] JEELANI S A K, HOSIG R, WINDHAB E J. Kinetics of low reynolds number creaming and coalescence in droplet dispersions[J]. AIChE Journal, 2004, 51(1): 149-161.
[12] HAZLETT R N. Fibrous bed coalescence of water. steps in the coalescence process[J]. Industrial and Engineering Chemistry Fundamentals, 2002, 8(4): 625-632.
[13] OTAZO M R, WARD R, GILLIES G, et al. Aggregation and coalescence of partially crystalline emulsion drops investigated using optical tweezers[J]. Soft Matter, 2019, 15(31): 6383-6391.
[14] HAN J, ZHOU X, CAO J, et al. Microstructural evolution of whipped cream in whipping process observed by confocal laser scanning microscopy[J]. International Journal of Food Properties, 2018, 21(1): 593-605.
[15] HANAZAWA T, SAKURAI Y, MATSUMIYA K, et al. Effects of solid fat content in fat particles on their adsorption at the air–water interface[J]. Food Hydrocolloids, 2018, 83: 317-325.
[16] FULLER G T, CONSIDINE T, GOLDING M, et al. Aggregation behavior of partially crystalline oil-in-water emulsions: Part II –Effect of solid fat content and interfacial film composition on quiescent and shear stability[J]. Food Hydrocolloids, 2015, 51:23-32.
[17] WANG Y, HARTEL R W, LI Y, et al. Crystal networks, partial coalescence, and rheological properties of milk fat fraction model systems[J]. Journal of Dairy Science, 2023, 106(11):7486-7500.
[18] FREDRICK E, WALSTRA P, DEWETTINCK K. Factors governing partial coalescence in oil-in-water emulsions[J].Advances Colloid and Interface Science, 2010, 153(1-2): 30-42.
[19] HINRICHS J, KESSLER H G. Fat content of milk and cream and effects on fat globule stability[J]. Journal of Food Science.1997, 62(5): 992-995.
[20] 姚喜喜, 刘温, 徐成体, 等. 季节性放牧对牧草、牦牛瘤胃液和乳脂中脂肪酸组成的影响及其关联分析[J]. 动物营养学报,2022, 34(5): 3046-3055.YAO X X, LIU W, XU C T, et al. Effects of seasonal grazing on fatty acid composition in forage, yak rumen fluid and milk fat and their correlation analysis[J]. Chinese Journal of Animal Nutrition, 2022, 34(5): 3046-3055.
[21] HASAN T, THOO Y Y, CHEW C L, et al. Blends of palm kernel oil, soybean oil and palm stearin as an alternative to milk fat for frozen dessert application[J]. Journal of Food Science and Technology, 2022, 59(8): 3010-3019.
[22] 王筠钠, 李妍, 李扬, 等. 光谱学技术在稀奶油乳脂肪研究中的应用[J]. 光谱学与光谱分析, 2019, 39(6): 1773-1778.WANG Y N, LI Y, LI Y, et al. Application of spectroscopic in the study of milk fat in dairy cream[J]. Spectroscopy and Spectral Analysis, 2019, 39(6): 1773-1778.
[23] TANG D, MARANGONI A G. Modeling the rheological properties and structure of colloidal fat crystal networks[J].Trends in Food Science & Technology, 2007, 18(9): 474-483.
[24] PRATAMA Y, BURHOLT S, BAKER D L, et al. Polymorphism of a highly asymmetrical triacylglycerol in milk fat: 1-butyryl 2-Stearoyl 3-Palmitoyl-glycerol[J]. Crystal Growth and Design,2022, 22(10): 6120-6130.
[25] TRAN T, ROUSSEAU D. Influence of shear on fat crystallization[J]. Food Research International, 2016, 81:157-162.
[26] LIU C, ZHENG Z, CAO C, et al. The partial coalescence behavior of oil-in-water emulsions: Comparison between refrigerated and room temperature storage[J]. Food Chemistry,2019, 300: 125219. 1-125219. 10.
[27] LIU P, HUANG L, LIU T, et al. Whipping properties and stability of whipping cream: The impact of fatty acid composition and crystallization properties[J]. Food Chemistry,2021, 347: 128997. 1-128997. 8.
[28] DETRY R, HOED V V, STERCKX J, et al. Physicochemical properties of palm oil- based puff pastry model margarines related to their baking performance in long- term storage[J]European Journal of Lipid Science and Technology, 2021,123(1): 1-12.
[29] GOIBIER L, LECOMTE S, LEAL-CALDERON F, et al. The effect of surfactant crystallization on partial coalescence in O/W emulsions[J]. Journal of Colloid and Interface Science, 2017,500: 304-314.
[30] WARREN M M, HARTEL R W. Effects of emulsifier, overrun and dasher speed on ice cream microstructure and melting properties[J]. Journal of Food Science, 2018, 83(3): 639-647.
[31] SALAS C, NYPELö T, RODRIGUEZ-ABREU C, et al.Nanocellulose properties and applications in colloids and interfaces % J Current Opinion in Colloid & Interface Science[J].2014, 19(5): 383-396.