The Inhibition and Interaction Effect of Whole Grain Highland Barley Extract on α-glucosidase Inhibitory Activity
糖尿病是一种以高血糖为典型特征并在全球范围内普遍存在的慢性代谢综合症[1]。过去二十年来,被诊断为糖尿病的人数呈爆炸性增长。根据国际糖尿病联合会(International Diabetes Federation,IDF)最新发布的《IDF Diabetes Atlas》可知,截止到2021 年,在全球20~79 岁的成年人中,糖尿病发病率为10.5%,这意味着全球每10个成年人中就有1 个以上患有糖尿病。而中国糖尿病患者人数已有近1.4 亿人,占全球患者总人数的26.2%[2]。
餐后高血糖是糖尿病的典型特征。膳食中的淀粉、糖原和各种低聚糖可以通过α-淀粉酶水解成麦芽糖、麦芽三糖和寡聚糖,然后通过α-葡萄糖苷酶水解成游离葡萄糖,从而被吸收入血,增加血糖水平[3]。α-葡萄糖苷酶作为一种重要的碳水化合物水解酶,对餐后血糖水平的高低起着关键作用[4],已成为预防和治疗糖尿病的主要靶酶之一。
越来越多的证据表明全谷物具有良好的改善机体血糖代谢的功能,其富含的多酚、多糖和多肽等均已被证实具有良好的α-葡萄糖苷酶抑制活性[5]。青稞是我国特有的高原特色食品,富含酚类化合物、黄酮类化合物、β-葡聚糖、γ-氨基丁酸(GABA)等多种活性成分,具有降糖、降脂、抗炎、抗氧化等多种生理功能。我们前期研究已证实青稞全谷物具有较低的血糖生成指数[6],能够有效降低糖尿病小鼠的血糖水平[7]。
为了进一步明确青稞全谷物中的关键降糖因子,本研究以糖尿病治疗靶点之一α-葡萄糖苷酶的抑制活性为检测指标,在优化α-葡萄糖苷酶抑制活性测定方法的基础之上,对青稞全粉中的多酚、多糖、多肽进行α-葡萄糖苷酶抑制活性的测定及协同配伍分析。以期丰富青稞降糖理论体系,并为后续降糖物质的筛选和功能食品的开发提供参考。
北青3 号青稞(蛋白质9.6%、脂肪2.2%、淀粉60.7%、膳食纤维13.5%):山西东方亮生命科技股份有限公司;丙酮、正己烷:国药集团化学试剂有限公司;无水乙醇:北京化工厂,以上试剂均为分析纯;阿卡波糖(S11190)、碱性蛋白酶(S10154):上海源叶生物技术有限公司;α-葡萄糖苷酶(G0660)、对硝基苯-α-D-吡喃葡糖苷(PNPG,N0877):德国Sigma 公司。
F200-PRO 型酶标仪:瑞士TECAN 集团公司;THZ-82A 型水浴恒温振荡器:上海江星仪器有限公司;4-16KS 型冷冻离心机:德国Sigma 冻干机有限公司;KQ5200DB 型超声波清洗仪:北京天林恒泰科技有限公司;S30UV 型实验室纯水系统:上海和泰仪器有限公司;RE2000A 型旋转蒸发仪:上海亚荣生化仪器厂。
1.3.1 青稞全粉的脱脂
按照料液比1∶5(w/v)的比例加入正己烷,室温条件下500 r/min 搅拌5 min,真空抽滤除去正己烷,对剩余残渣重复上述操作2 次,所得脱脂青稞全粉40 ℃干燥2 h 后置于-20 ℃保存。
1.3.2 青稞全粉中活性物质的提取
1.3.2.1 青稞多酚的提取 称取定量青稞全粉,按照料液比1∶20(w/v)加入80%丙酮溶剂,功率100 W 超声提取20 min,室温条件以4 000 r/min 的速度离心10 min,重复3 次,合并上清液,冷冻干燥即得青稞多酚提取物,置于-20 ℃保存。
1.3.2.2 青稞多糖的提取 称取定量青稞全粉,按照料液比1∶10(w/v)加入蒸馏水,功率100 W超声提取160 s,在室温条件下以4 000 r/min 的速度离心10 min,调节上清液pH 值至10.5,加入3 倍体积的95%乙醇,以4 000 r/min的速度离心15 min,静置沉淀,冷冻干燥即得青稞多糖提取物,置于-20 ℃保存。
1.3.2.3 青稞多肽的提取 称取定量青稞全粉,按照料液比1∶25(w/v)加入蒸馏水,调节pH至11.0,40 ℃恒温水浴20 min,然后室温条件下以3 500 r/min 的速度离心10 min,收集上清液并水洗沉淀,将上清液pH 调至4.5,静置30 min 后离心,沉淀冷冻干燥即得青稞蛋白提取物,最后利用碱性蛋白酶在46 ℃,pH 为7.45 的条件下酶解3 h,即得青稞多肽提取物,置于-20 ℃保存。
1.3.3 单因素优化α-葡萄糖苷酶活性抑制实验
参照Han[8]的方法,以抑制率为观测指标进行单因素实验,依次选取α-葡萄糖苷酶浓度为0、0.1、0.3、0.5、0.7、0.9 U/mL,底物浓度为0、1、2、3、4、5、6 mmol/L,PBS 缓冲液浓度为0、20、40、60、80、100 mmol/L 以及反应时间为0、5、10、15、20、25 min 四个因素。考察一种因素时,固定其他参数不变。
1.3.4 响应面优化α-葡萄糖苷酶活性抑制实验
在单因素实验的基础上,选取α-葡萄糖苷酶浓度(U/mL)、底物浓度(mmol/L)和PBS 缓冲液浓度(mmol/L)三个因素,以阿卡波糖对α-葡萄糖苷酶活性抑制率(%)为响应值,设置酶浓度为0.3、0.5、0.7 U/mL,底物浓度4.0、5.0、6.0 mmol/L,PBS 浓度60.0、80.0、100.0 mmol/L 三因素三水平的优化体系,并对实验数据进行回归分析。
1.3.5 青稞全粉提取物对α-葡萄糖苷酶的抑制活性分析
按照上述优化后的α-葡萄糖苷酶抑制活性测定方法进行实验。多酚、多糖和多肽3 种青稞全粉提取物分别设置0、0.1、0.3、0.6、0.9 mg/mL5个浓度梯度,测定3 种提取物的α-葡萄糖苷酶抑制活性,并计算IC50 值。
1.3.6 青稞全粉提取物的协同配伍分析
为探究青稞多酚、青稞多糖、青稞多肽对α-葡萄糖苷酶抑制活性的相互作用关系,将3 种提取物通过两两复配的方式制得3 种样品,每种样品中青稞全粉提取物的添加比例为1∶1,然后对其α-葡萄糖苷酶抑制活性进行测定。
依照公式(1)所示等效线法[9]来判断3 种混合物的相互作用关系。
式中,γ 为相互作用指数,a、b 表示组分复配时的分别添加量,A 和B 代表单独添加1 种组分时达到与合用相等效应水平的添加量。判断依据为γ=1,相加;γ>1,拮抗;γ<1,协同。
采用SPSS 21.0 对所有数据进行统计分析,Duncan 检验进行显著性分析,P<0.05 表示显著,P<0.01 表示极显著,Design Expert 10.0 软件进行Box-Behnken 响应面实验设计,Graphpad Prism 9.5.1 对数据进行作图,所有数据以平均值±标准差(SD)表示。
2.1.1 酶浓度对α-葡萄糖苷酶活性抑制率的影响由图1A 可知,随着酶浓度的增加,抑制率呈现先上升后下降的趋势,当浓度为0.5 U/mL时,抑制率达到最高值40.95%±2.23%,且与其他浓度的抑制率具有显著差异(P<0.05)。这一结果与丛凯平[10]的研究结果一致。酶浓度的升高加快了酶解体系的进程,但是当酶浓度增加到一定量时,有限的底物浓度不能满足持续增加的酶浓度,使其活性降低或丧失[11],从而降低抑制率。因此在后续响应面优化实验中的加酶量取值范围选择0.3~0.7 U/mL。
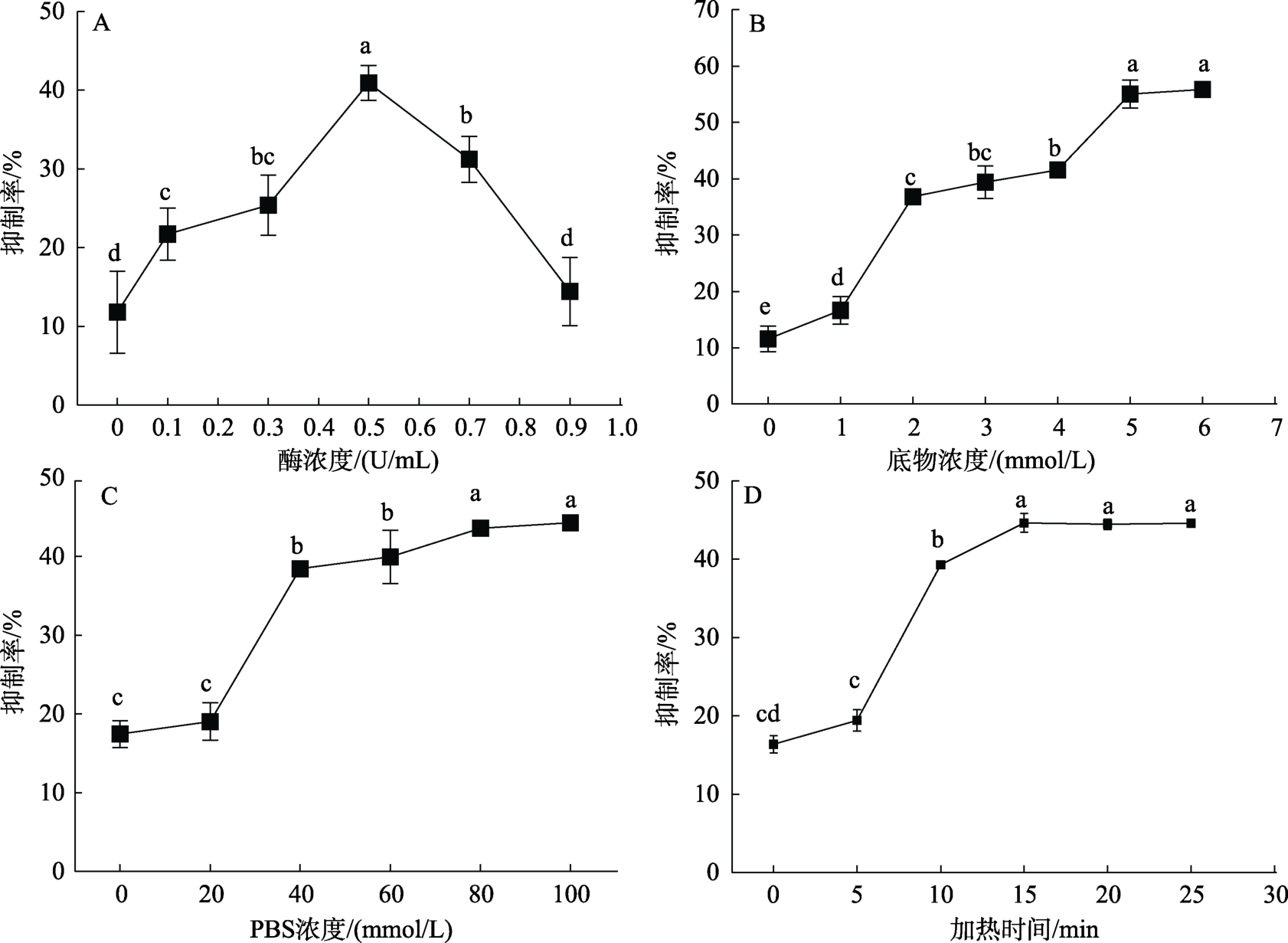
图1 不同单因素对α-葡萄糖苷酶抑制率的影响
Fig.1 Effects of different single factors on α-glucosidase inhibition rate
注:A:酶浓度;B:底物浓度;C:PBS 浓度;D:加热时间。不同小写字母表示显著性差异(P<0.05),测试取3 次平均值,下同。
Note: A: enzyme concentrations; B: substrate concentrations; C: PBS concentrations; D: heating time. Different lowercase letters indicated significant difference (P<0.05) and the average value of the test was taken for 3 times, same as below.
2.1.2 PNPG 浓度对α-葡萄糖苷酶活性抑制率的影响
由图1B 可知,随着PNPG 浓度的增加,抑制率呈现先上升后稳定的趋势,当PNPG 浓度为5 mmol/L时,抑制率为55.04%±2.48%,与6 mmol/L 的结果无显著差异(P>0.05)。这与朱娟娟[12]的研究结果基本一致。继续增加PNPG 浓度会造成原材料浪费。因此在响应面优化实验中的PNPG 浓度取值范围选择4~6 mmol/L。
2.1.3 PBS 缓冲液浓度对α-葡萄糖苷酶活性抑制率的影响
由图1C 可知,随着PBS 缓冲液浓度的升高,抑制率呈现先上升后稳定的趋势,其中缓冲液浓度为80 mmol/L 时的抑制率为43.58%±0.25%,与100 mmol/L 时的结果无显著差异(P>0.05)。缓冲液对维持反应体系正常pH 值具有重要作用,因此在响应面优化实验中的 PBS 浓度取值范围选择 60~100 mmol/L。
2.1.4 反应时间对α-葡萄糖苷酶抑制率的影响
由图1D 可知,随着反应时间的延长,抑制率呈现先上升后稳定的趋势,反应时间为15 min时,抑制率达到最高42.81%,此后反应趋于平稳(P>0.05)。为节约反应时间,加快实验进程,选择加热15 min 作为响应面优化实验的固定值。
2.2.1 响应面模型分析
按照表1 进行实验,对实验结果进行回归方程拟合,以抑制率为响应值求得二次回归模型如下:抑制率(Y)=56.31+3.65A+0.14B+0.10C+0.08AB-0.16AC-0.22BC-14.20A2-0.81B2-0.24C2,其中A为酶浓度,B 为底物浓度,C 为PBS 浓度。
表1 响应面实验设计与结果
Table 1 Design and results of response surface experiment
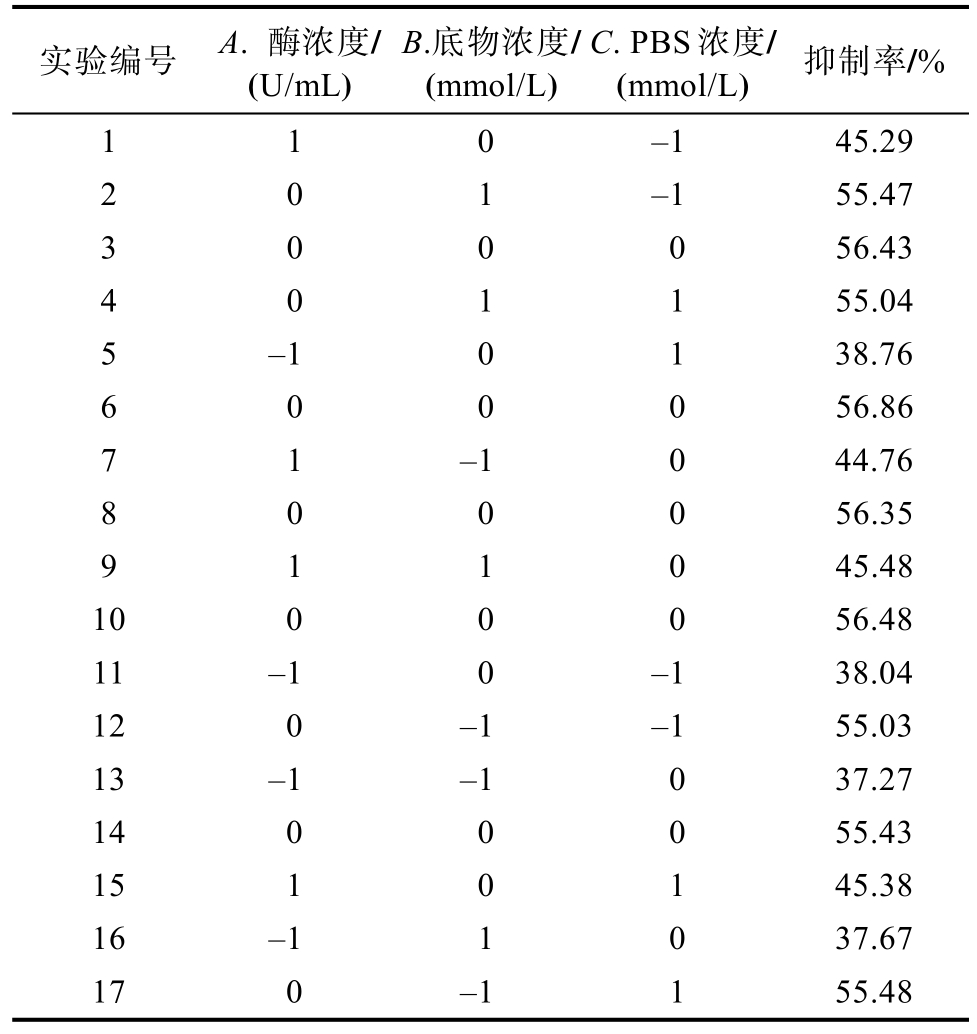
实验编号 A. 酶浓度/(U/mL)B.底物浓度/(mmol/L)C. PBS 浓度/(mmol/L) 抑制率/%1 1 0 -1 45.29 2 0 1 -1 55.47 3 0 0 0 56.43 4 0 1 1 55.04 5 -1 0 1 38.76 6 0 0 0 56.86 7 1 -1 0 44.76 8 0 0 0 56.35 9 1 1 0 45.48 10 0 0 0 56.48 11 -1 0 -1 38.04 12 0 -1 -1 55.03 13 -1 -1 0 37.27 14 0 0 0 55.43 15 1 0 1 45.38 16 -1 1 0 37.67 17 0 -1 1 55.48
对该模型进行方差分析,该模型是极显著的(P<0.000 1),而失拟项P 值为0.657 1 不显著,表明该模型具有统计学意义,可以对抑制率进行预测。相关系数R2=0.998 3,调整后R2=0.996 2,综合来看,各因素与α-葡萄糖苷酶抑制活性呈现出了比较明显的二次抛物线关系,这说明该模型具有较高的拟合度。各因素对α-葡萄糖苷酶活性的影响顺序为:酶浓度>底物浓度>PBS 浓度,其中酶浓度对α-葡萄糖苷酶抑制率影响显著(P<0.000 1)。
2.2.2 等高线图及响应曲面图分析
各个因素交互作用对α-葡萄糖苷酶抑制能力如图2A 所示,酶浓度和底物浓度交互作用最为显著;其次是酶浓度与PBS 浓度的交互作用;而底物浓度和PBS 浓度交互作用对抑制率影响较小。等高线图及响应曲面图再次表明α-葡萄糖苷酶的浓度是影响体系反应效率的最关键因素。

图2 交互作用对α-葡萄糖苷酶抑制率的影响(A)和青稞多酚-多糖-多肽之间的分子相互作用示意图(B)
Fig.2 (A) Effect of interactions on α-glucosidase inhibition (A) and schematic of molecular interactions between highland barley polyphenols-polysaccharides-peptides (B)
注:绿色,氢键;蓝色,疏水相互作用;红色,静电相互作用。实线为文献已报道的分子相互作用,虚线为推测的分子相互作用。
Note: Green, hydrogen bond; Blue, hydrophobic interaction; Red, ionic interactions. The solid lines were the molecular interactions reported in the literature, and the dashed lines were the presumed molecular interactions.
2.2.3 响应面优化分析
根据单因素实验与响应面法优化的结果,可知α-葡萄糖苷酶活性抑制实验的最佳反应条件如下:酶浓度为0.53 U/mL,底物浓度为5.08 mmol/L,PBS 缓冲液浓度为82.18 mmol/L。为便于操作将条件调整为:酶浓度为0.5 U/mL,底物浓度为5 mmol/L,PBS 缓冲液浓度为80 mmol/L。以该条件进行验证实验,得到阿卡波糖对α-葡萄糖苷酶抑制能力为55.23%,与理论值56.56%相近,且与雷李涛[13]的优化结果接近,表明优化后的工艺参数可靠,具有较强可行性。
本研究 3 种提取物中青稞多糖的提取率最高,为6.18%±0.13%,其次为青稞多肽、青稞多酚,提取率分别为5.31%±0.42%、3.16%±0.12%。不同提取物对 α-葡萄糖苷酶活性的抑制效果如图3 所示,青稞多糖、青稞多酚、青稞多肽对α-葡萄糖苷酶的抑制能力均与其浓度呈剂量依赖关系。当三者浓度均为0.9 mg/mL 时,青稞多酚对 α-葡萄糖苷酶活性的抑制效果最好,达到83.63%± 2.92%,对应的IC50 为0.18 mg/mL,这可能与青稞多酚具有的羟基、没食子酰基、吡喃环的立体化学结构以及烷间键等有关[14]。青稞多糖对 α-葡萄糖苷酶活性的抑制率次之,为76.86%±3.12%,对应的IC50 为0.27 mg/mL,此抑制活性大小与其糖苷键、一级结构和单糖组成均密切相关[14];不同多肽的功效取决于氨基酸的种类和排列顺序[15],本研究中青稞多肽对α-葡萄糖苷酶活性的抑制率最弱,为56.49%±2.75%,对应的IC50 为0.66 mg/mL。
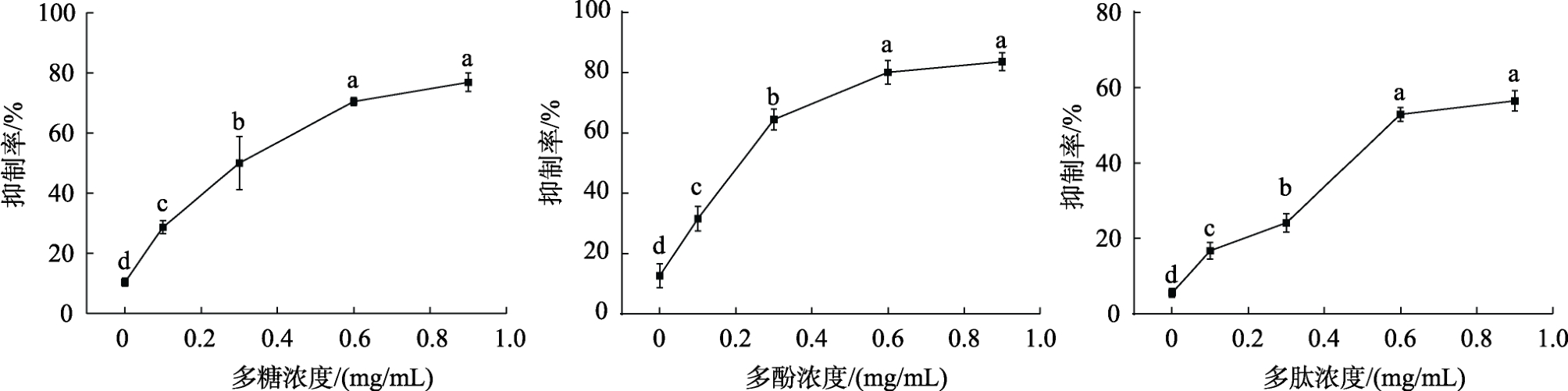
图3 青稞多糖、青稞多酚、青稞多肽对α-葡萄糖苷酶抑制率的影响
Fig.3 Effects of polysaccharides, polyphenols and peptides on the inhibition rate of α-glucosidase
协同配伍可用于评价性能、功效相类似的物质配合应用是否可以增强其原有疗效。如丹酚酸与丹参酮配伍对糖尿病肾病具有协同作用[9]。考虑到食物本身就是一个复杂的有机整体,本研究引入协同配伍评价,继续探究了青稞多酚、青稞多糖以及青稞多肽之间的相互作用。
由表2 可知,青稞多酚、多糖、多肽经过配伍(1∶1)之后均表现出对α-葡萄糖苷酶的抑制作用,并且随着配伍组分添加量的升高,对α-葡萄糖苷酶的抑制作用也在升高。经等效线法分析评价其相互作用系数,其中多酚-多糖组(γ=0.95)、多酚-多肽组(γ=0.70)以及多糖-多肽组(γ=0.67)的γ 指数均<1,表明任意两种组分配伍后均表现出明显的协同效应,实现了“1+1>2”的合力效果。
表2 三种组分配伍对α-葡萄糖苷酶活性的影响与相互作用(n = 3)
Table 2 Effects and interactions of the three components in combination on α-glucosidase activity (n = 3)
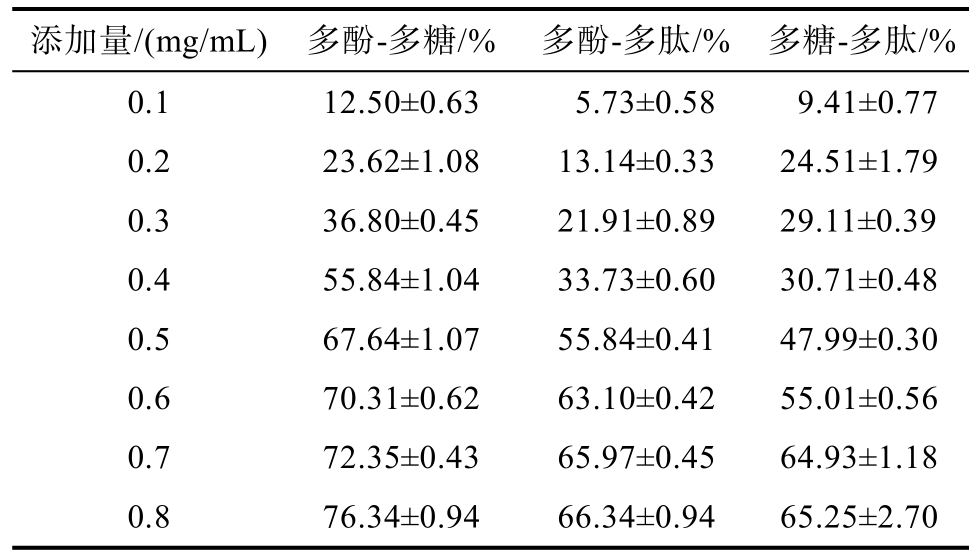
添加量/(mg/mL) 多酚-多糖/% 多酚-多肽/% 多糖-多肽/%0.1 12.50±0.63 5.73±0.58 9.41±0.77 0.2 23.62±1.08 13.14±0.33 24.51±1.79 0.3 36.80±0.45 21.91±0.89 29.11±0.39 0.4 55.84±1.04 33.73±0.60 30.71±0.48 0.5 67.64±1.07 55.84±0.41 47.99±0.30 0.6 70.31±0.62 63.10±0.42 55.01±0.56 0.7 72.35±0.43 65.97±0.45 64.93±1.18 0.8 76.34±0.94 66.34±0.94 65.25±2.70
食品功能性成分之间的相互作用方式主要包括共价结合和非共价结合,且以非共价结合更为常见[16]。青稞多酚、多糖、多肽之间的分子相互作用如图2B 所示。青稞多酚和青稞多糖均具有许多羟基,可形成分子间氢键,并且具有能产生极化分子的官能团,可先形成氢键使得多酚和多糖分子间的距离变短,为范德华力的形成创造条件。多酚所具有的苯环以及苯环上携带的甲氧基与多糖上的乙酰基、甲氧基酰胺基团可形成疏水相互作用。对于果胶等酸性多糖,官能团更加多样化,其中的羧酸基团、羟基和乙酰基等都可以通过离子力、亲水力或疏水相互作用等多种方式与多酚相互作用。此外,侧链较少的多糖也会增加与多酚相互作用的潜力[17]。
青稞多酚与青稞多肽之间存在氢键、疏水相互作用以及离子健等相互作用力。其中多肽所具有的咪唑、四氢吡咯基团能够与多酚所具有的苯环基团发生疏水相互作用,多酚中的酚羟基与肽键可以形成氢键,多肽上的氨基也可以与酚羟基发生离子相互作用。影响多酚与蛋白相互作用的因素包括多酚的分子量、构象的柔韧性和多酚对水的亲和力,多肽的大小、构象和氨基酸组成[18],其中高分子量、柔韧性好以及较低亲和力的青稞多酚更容易与青稞多肽结合。
对于带电荷的青稞多糖,静电相互作用起主要作用,青稞多肽所具有的咪唑、四氢吡咯基团也可能与多糖所具有的乙酰基、甲氧基酰胺基团发生疏水相互作用,多糖中的羟基、羧酸基团也可能与肽键形成氢键,而疏水相互作用和氢键对两者的相互作用影响较小[19]。将带正电的蛋白和阴离子多糖混合,可以形成强大而有吸引力的静电复合物[20],如氨基和羧基之间可能发生静电相互作用,而阴离子多糖和净负电荷或电荷接近零的蛋白质往往形成较弱的可逆复合物,从而影响多糖-多肽复合物的稳定性,进而影响α-葡萄糖苷酶抑制活性。
本研究首先利用单因素以及响应面实验优化确定了α-葡萄糖苷酶抑制活性的实验条件,即酶浓度为0.5 U/mL,底物浓度为5 mmol/L,PBS 缓冲液浓度为80 mmol/L;然后分别提取青稞中活性成分(多酚、多糖、多肽),通过体外实验对比3 种青稞全粉提取物的α-葡萄糖苷酶活性抑制能力,其中青稞多酚>青稞多糖>青稞多肽;进而分析协同配伍后组分之间的相互作用,青稞多酚、青稞多糖、青稞多肽在等效线法的评价体系下γ<1,说明各组分两两配伍后均具有了协同增效作用。本研究结果将促进青稞等全谷物食品的消费,并对后续功能性食品开发中生物活性物质的复配具有一定的指导意义。
[1] LI Y, ZHANG W, ZHAO R, et al. Advances in oral peptide drug nanoparticles for diabetes mellitus treatment[J]. Bioact Mater,2022, 15: 392-408.
[2] OGURTSOVA K, GUARIGUATA L, BARENGO N C, et al.IDF diabetes Atlas: Global estimates of undiagnosed diabetes in adults for 2021[J]. Diabetes research and clinical practice, 2022,183: 109118.
[3] RUSSELL W R, BAKA A, BJORCK I, et al. Impact of diet composition on blood glucose regulation[J]. Crit Rev Food Sci Nutr, 2016, 56(4): 541-590.
[4] DONG Q, HU N, YUE H, et al. Inhibitory activity and mechanism investigation of hypericin as a novel alpha-glucosidase inhibitor[J]. Molecules, 2021, 26(15): 4566.
[5] GONG L X, FENG D N, WANG T X, et al. Inhibitors of α-amylase and α-glucosidase: Potential linkage for whole cereal foods on prevention of hyperglycemia[J]. Food science nutrition,2020, 8(12): 6320-6337.
[6] 任欣, 王林萱, 张敏, 等. 模拟口腔加工对馒头体外淀粉消化特性的影响[J]. 食品科学技术学报, 2022, 40(5): 129-138.REN X, WANG L X, ZHANG M, et al. Effect of simulated oral processing on starch digestion characteristics in vitro of steamed bread[J]. Journal of Food Science and Technology, 2022, 40(5):129-138.
[7] REN X, ZHANG F L, ZHANG M, et al. Fecal microbiota transplantation: whole grain highland barley improves glycolipid metabolism by changing gut microbiota[J]. Food Science and Human Wellness, 2024, 13(4): 9250167.
[8] HAN L, FANG C, ZHU R, et al. Inhibitory effect of phloretin on alpha-glucosidase: Kinetics, interaction mechanism and molecular docking[J]. Int J Biol Macromol, 2017, 95: 520-527.
[9] 王钦汶. 丹酚酸与丹参酮组分配伍对糖尿病肾病协同效应的研究[D]. 南京中医药大学, 2021.WANG Q W. Study on the synergistic effect of salvianolic acid and tanshinone on diabetic kidney disease[D]. Nanjing University of Chinese Medicine, 2021.
[10] 丛凯平, 李婷婷, 吴彩娥, 等. 桑叶1-脱氧野尻霉素含量快检方法建立及其对α-葡萄糖苷酶的抑制作用[J]. 林业工程学报,2022, 7(5): 93-98.CONG K P, LI T T, WU C E, et al. Development of rapid method for determination of 1-deoxynojirimycin in Morus alba L. leaves and its inhibitory effect on α-glucosidase[J]. Journal of Forestry Engineering, 2022, 7(5): 93-98.
[11] 胡杨, 杨莉莉, 熊善柏, 等. 水解进程对酶法制备的鱼鳞胶原蛋白肽性能的影响[J]. 华中农业大学学报, 2017, 36(1):103-109.HU Y, YANG L L, XIONG S B, et al. Hydrolysis process of fish scale and its effect on properties of collagen peptide[J]. Journal of Huazhong Agricultural University, 2017, 36(1): 103-109.
[12] 朱娟娟, 尹忠平, 陈继光, 等. 微量α-葡萄糖苷酶抑制剂筛选模型及抑制类型的判断方法[J]. 现代食品科技, 2016, 32(12):164-170.ZHU J J, YIN Z P, CHEN J G, et al. A model for screening trace amounts of α-glucosidase inhibitors and methods for judging inhibition type[J]. Modern Food Science and Technology, 2016,32(12): 164-170.
[13] 雷李涛, 周永昌, 蒲秀瑛. 苦荞黄酮类化合物的制备及抗氧化及降糖作用研究[J]. 中国食品工业, 2023(2): 102-104+112.LEI L T, ZHOU Y C, PU X Y. Preparation of flavonoids from Tartary buckwheat and their antioxidant and hypoglycemic effects[J]. China Food Industry, 2023(2): 102-104+112.
[14] 王立东, 李晓强, 李振江, 等. 杂粮中活性组分对血糖调控作用的研究进展[J]. 粮食与油脂, 2021, 34(12): 17-21.WANG L D, LI X Q, LI Z J. Research progress on the regulation of blood glucose by active components in coarse cereals[J].Cereals & Oils 2021, 34(12): 17-21.
[15] KONG F, KANG S, ZHANG J, et al. The non-covalent interactions between whey protein and various food functional ingredients[J].Food Chemistry, 2022, 394: 133455.
[16] BORDENAVE N, HAMAKER B R, FERRUZZI M G. Nature and consequences of non-covalent interactions between flavonoids and macronutrients in foods[J]. Food & function, 2014, 5(1):18-34.
[17] WEBER F. Noncovalent polyphenol-macromolecule interactions and their effects on the sensory properties of foods[J]. Journal of Agricultural and Food Chemistry, 2021, 70(1): 72-78.
[18] Le BOURVELLEC C, RENARD C M G C. Interactions between polyphenols and macromolecules: Quantification methods and mechanisms[J]. Critical reviews in food science and nutrition,2012, 52(3): 213-248.
[19] RODRÍGUEZ PATINO J M, PILOSOF A M R. Proteinpolysaccharide interactions at fluid interfaces[J]. Food Hydrocolloids,2011, 25(8): 1925-1937.
[20] BOUROUIS I, PANG Z, LIU X. Recent advances on uses of protein and/or polysaccharide as fat replacers: Textural and tribological perspectives: A review[J]. Journal of Agriculture and Food Research, 2023: 100519.