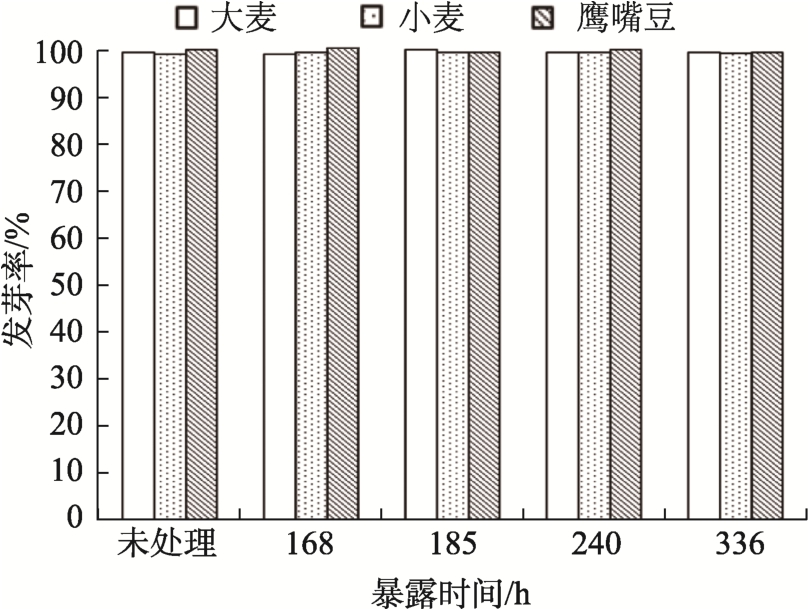
图1 暴露于150 mg/m3 浓度二硫化碳不同时间的样品发芽率
Fig.1 Percentage germinability of samples at dose 150 mg/m3 of CS2 and for different time of exposure
任永林教授主持“安全高效熏蒸 助力节粮减损”特约国际专栏文章之一
A New Look at Carbon Disulphide as a Grain Fumigant (Chinese and English versions)
二硫化碳(CS2)是一种古老的熏蒸剂,用于谷物大规模商业储藏的虫害防治,是美国第一种获得专利的熏蒸剂(1867 年,第64667 号),1896年在美国登记注册为谷物熏蒸剂。1869 年,法国曾用它来防治葡萄根瘤蚜。将二硫化碳用作谷物和土壤的熏蒸剂来控制害虫是应用昆虫学史上的一个里程碑[1]。此后多年,二硫化碳广泛用作谷物、土壤和空间熏蒸剂。但当时由于二硫化碳易燃且残留时间较磷化氢长,二硫化碳已被弃用,磷化氢和甲基溴取代其成为谷物熏蒸剂。
二硫化碳制剂,如与二氧化碳(CO2)等不可燃气体的混合,仍在世界上某些地区使用,如中国[2-4]。澳大利亚新南威尔士州的种植者也在使用这种熏蒸剂[5]。中国对20 多个种子品种进行大量研究后表明,即使二硫化碳的浓度为200 mg/m3也不会影响种子的活力[6]。Ghaly[7]研究表明,即使在400~800 mg/m3 高剂量下,对Nahda 水稻品种的发芽率和幼芽长度也没有影响。在400 mg/m3浓度和13%~19%含水量情况下,二硫化碳熏蒸对稻米的物理特性(如硬度、破碎率和出米率)和品质(如蒸煮实验、过氧化值、淀粉和酸价)均无影响[7]。
二硫化碳穿透性很好,不逊色于磷化氢。在中国,二硫化碳用于无环流系统的立筒仓中[1-2]。谷物、小麦粉、精米和豆类对二硫化碳的吸附量比甲基溴低,主要是物理吸附,大部分气体可回收[3,8]。Mapes 和Shrader[9]在使用120 mg/m3 和40 mg/m3 二硫化碳进行商业化熏蒸处理小麦时发现,二硫化碳残留在熏蒸3 个月后和之前相比分别降至<2.5 mg/m3 和<0.25 mg/m3。Munsey[10]等在商业烘焙面粉中添加了10 mg/m3 的二硫化碳,然后进行了烘焙研究,与未经处理的面粉制成的面包相比,处理组面包未检出额外二硫化碳。Mapes和Shrader[11]通过降低二硫化碳的浓度,可以减少制粉馏分中的残留,即将二硫化碳的剂量降低3 倍(从120 mg/m3 降至38 mg/m3)时,面粉中的残留量可降低 40 倍(从 6.00 mg/m3 降至0.14 mg/m3)。新研究表明,在密闭环境下应用二硫化碳可以降低应用剂量,通过强制通风可以进一步降低残留量[5]。
本文旨在重新评估二硫化碳在当今储存条件和质量管理下作为熏蒸剂的可能性。特别由于磷化氢是一种登记注册的谷物熏蒸剂,易于获得且成本低,因此全世界过度依赖磷化氢(PH3),导致昆虫对其抗药性越来越强[12]。另外,硫酰氟(SF)需要高浓度或长时间暴露才能完全控制卵态,且它是一种氟化气体,寿命为36 年,20 年的全球变暖潜能值(GWP)为7510(GWP 是衡量温室效应的指标),使用硫酰氟作为熏蒸剂存在潜在的环境安全挑战[13-14]。因此,迫切需要开发快速杀死全虫态的经济熏蒸剂,我们从降低应用剂量、减少残留和燃爆风险、安全和防效标准等方面重新对二硫化碳进行了评估。
1.1.1 样品与化学试剂
实验室测试中使用含水量10.6%澳大利亚白麦(ASW)、含水量10.3%(w/w 湿基)澳大利亚大麦:var.Schooner;含水量11.5%(w/w 湿基)鹰嘴豆:Desi-typevar.Amethyst;含水量10.5%豌豆(w/w 湿基)、含水量10.5%水稻和含水量11.5%高粱测试发芽率和吸附性,含水量均为w/w 湿基法,所用样品均不含杀虫剂。
99.9%纯度液体二硫化碳,密度为1 250 g/L:澳大利亚Ajax 公司;纯度99.8%甲基溴:Matheson Gas Products(加利福尼亚州,库卡蒙加)购买;磷化氢采用FAO 方法制备[15]。
1.1.2 仪器与设备
螺旋式微量钝化阀:Alltech 24 mm 螺口瓶盖阀,代号95326;螺旋式微压阀:Alltech 24 mm 螺口瓶盖阀,代号95326;微波炉:配备有时间和功率编程功能,松下;气相色谱仪:GC6AM,岛津。
1.1.3 发芽实验
分别取10 g 小麦、大麦和鹰嘴豆样品装入带有Mininert 注射塞的250 mL 瓶中,注入150 mg/m3浓度的二硫化碳,温度设定为(25±2)℃,每隔一段时间测定瓶内空间的二硫化碳浓度,熏蒸暴露7~14 天后测定发芽率。
发芽实验参照国际种子检验协会方法[16],该方法由Ghaly 和VanDerTouw[17]进行了改编。用40 mL 蒸馏水将50 粒种子浸泡,并用500 mm×330 mm 滤纸包好、喷湿并平铺于实验台上,一半滤纸压上250 mm×330 mm 的种子计数板,计数板上铸有30 mm 间距排列的圆孔,在圆孔里放入浸泡样品籽粒,然后将空白的另一半滤纸折叠,从250 mm 端卷曲成卷,用橡皮筋将其固定,装入自封袋中,悬挂在25 ℃培养箱中。第8 天记录发芽种子率和测量幼芽长度。每个实验重复4次,数据进行了标准误差和方差统计分析。
1.1.4 测定谷物和豆类对二硫化碳吸附性
将180 g 的谷物和豆类样品(小麦、大麦、稻谷、高粱、豌豆和鹰嘴豆)装入带有螺旋式微量钝化阀的250 mL 瓶子中,注入25 mg/m3 熏蒸剂。空瓶也注入25 mg/m3 熏蒸剂,作为对照计算所用浓度。从注入熏蒸剂开始按时间间隔抽取瓶顶空的熏蒸剂,注入气相色谱仪进行分析,制作浓度和时间曲线,按照顶空浓度(C)与初始浓度(Co)的比值(C/Co)计算(25±2)℃和90%~95%填充率条件下的吸附量,所有样品均一式三份。
1.1.5 测定二硫化碳在小麦粮堆的扩散情况
按照Desmerchelier[18]方法,采用长1.1 m、容积为7.9 L 的小麦柱,将10 mL PH3 和MeBr 气体以及20 μL CS2 液体分别注入柱底部的500 mL 烧瓶中,通过200 mL/min 的气流速度将熏蒸剂带入柱中,并在柱顶部测量通过的熏蒸剂浓度。
1.1.6 二硫化碳残留分析
采用两种方法测定小麦、小麦各部分(如表皮、糊粉层、胚乳和胚)和小麦粉制品(如海绵蛋糕、面包、未煮熟的意大利面和未煮熟的面条)中的二硫化碳残留量:
(1)方法 A:该方法由 Ren[19]和 Ren 与Desmarchelier[20]开发。将15 g 样品放入250 mL带有螺旋式微压阀的压缩瓶中,利用微波炉进行微波辐照,然后抽取顶空气体进行气相色谱分析,静置50 s,重复操作,直到顶空气体浓度保持不变或开始下降。
(2)方法B:该方法基于Daft[21]修订的AOAC标准方法,通过结合气密系统和顶空色谱法作进一步修改[22]。将50 g 小麦样品和50 mL “Daft 溶液”(80%纯度丙酮溶于25%磷酸溶液)[21]混合物放入270 mL 装有隔膜的锥形瓶中,在(25±3)℃下浸泡(31±3)h 后,测定顶空气体浓度。
将已知体积的二硫化碳液体加入装有5 粒玻璃珠的500 mL 锥形瓶中制备稀释的二硫化碳标准物质,如在 500 mL 中加入 2 mL 得到6.25 mg/m3。经振荡混合后,稀释的气体用于制备加标样品和标准品。将已知体积的稀释气体标准品注入装有50 g 未处理小麦和50 mL “Daft 溶液”混合物的270 mL 锥形瓶中,制备加标样品。
1.1.7 测定二硫化碳浓度
气相色谱参数:进样口温度,200 ℃;柱温,140 ℃;检测器,FPD;硫过滤器;玻璃填充柱,HayeSep Q(1 m × 3 mm)(Alltech2801)。
分析溶剂或液相顶空的二硫化碳,每次气相色谱进样前需要对色谱柱中的溶剂或溶剂蒸汽完全洗脱,因此进样间隔时间最少为15 min。
1.2.1 实仓实验
实仓实验在SGRL 的一个小麦筒仓进行,筒仓结构为焊接钢制自卸式,仓容为55 m3。入粮前,用SilasticTM 对仓内铆钉和螺栓孔进行密封。装入约40 t 小麦,按照Banks 和Annis[23]的方法进行气密压力测试,半衰期大于4 min。将1 500 g(1 200 mL)二硫化碳(38 mg/m3,w/w 或27 g/m3),密闭6 天,出仓后继续通风散气1 天。气体采样点包括粮仓中心、粮堆表层下1、2、3和4 m 处、以及粮仓底部和顶部空间的4 个等距方向和中心。通过DYNAVC 泵(ODI 型)从引出的尼龙管(内径3 mm)采集气体样本,装入Tedlar气体采样袋中,利用气相色谱法测量。出仓时,取3 t 小麦接入三个Bulka 袋中,每袋装1~1.5 t,装袋过程中用玻璃瓶从小麦流中抽取10~15 个0.5 kg 的样本。
试虫为赤拟谷盗(50 只成虫和50 只幼虫)、谷蠹(50 只成虫)和米象(50 只成虫)。所用虫笼为直径22 mm、高100 mm 的不锈钢带孔圆筒,两端制成锥状体,以便插入粮堆中。虫笼内装有由95%小麦和5%小麦粉组成的试虫饲料。将虫笼埋入粮堆表层1.5 m 深处,以中心位点和四周布置五个不同检测点。熏蒸散气后取出虫笼,检查记录即时害虫死亡率,并将这些试虫样品在30 ℃下继续培养4 周和8 周,统计死亡率。
实仓实验中使用含水量10.6%的澳大利亚白麦(ASW),不含杀虫剂。
1.2.2 制粉和烘焙实验
出仓后5 h 内将3 t 小麦送至面包研究所(BRI),进行小麦清理和制粉实验。烘焙、面条和意大利面加工方法参照面包研究所的常规商业配方和步骤。采用气相色谱法测量二硫化碳的含量。
2.1.1 CS2 对发芽和芽长的影响
150 mg/m3 二硫化碳熏蒸后小麦、大麦和鹰嘴豆的发芽率如图1 所示。所有实验重复4 次,50粒种子的标准误差均小于2.5%,3 种种子的萌发潜力均没有降低,即无论是150 mg/m3 高浓度还是14 d 的长时间暴露,二硫化碳都不会对小麦、大麦和鹰嘴豆的萌发产生有害影响。这一结果与前期对用200 mg/m3 二硫化碳熏蒸20 种种子和谷物(包括禾谷、豆类、含油种子和蔬菜种子)48 h后结果一致[6]。Xiu 还指出,熏蒸剂对20 种种子发芽的影响顺序为环氧乙烷>甲基溴>硫酰氟>二硫化碳,其中二硫化碳的植物毒性较低。Ghaly[7]研究表明,即使400~800 mg/m3 高剂量和48 h 长时间暴露,二硫化碳对16%含水量的Nahda 品种水稻的发芽率和幼芽长度也没有影响。Verma[24]也研究了高剂量二硫化碳长时间熏蒸对种子发芽率的影响,发现低含水量小麦的发芽率不受影响,但随着含水量的增加,发芽率会降低。

图1 暴露于150 mg/m3 浓度二硫化碳不同时间的样品发芽率
Fig.1 Percentage germinability of samples at dose 150 mg/m3 of CS2 and for different time of exposure
所有处理组幼芽长度的标准误差都小于平均值的8%。二硫化碳对小麦、大麦和鹰嘴豆的发芽幼芽长度没有影响(图2)。与氰化氢(HCN)不同,较高浓度的二硫化碳也不会使幼芽长度降低,与用100 mg/m3 硫化二羰基对小麦幼芽长度的影响相似[19]。
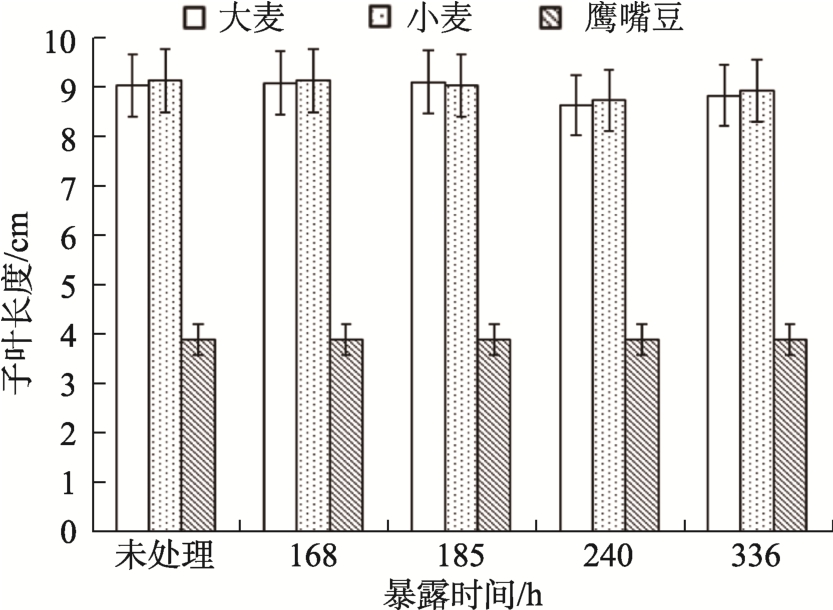
图2 暴露于150 mg/m3 浓度二硫化碳不同时间的样品幼芽长度
Fig.2 Plumule length of samples at dose 150 mg/m3 of CS2 and for different time of exposure
2.1.2 熏蒸剂在谷物上的吸附作用
吸附结果表明,二硫化碳在所测谷物和豆类上的吸附量比甲基溴弱。图3 表示测定浓度与施用浓度比值(C/Co)与时间的关系曲线(所有处理组熏蒸剂吸附的标准误差都小于平均值的4%),均为经典吸附曲线,熏蒸剂衰减模式符合预期,即最初快速吸附到10 h 后趋于平缓。
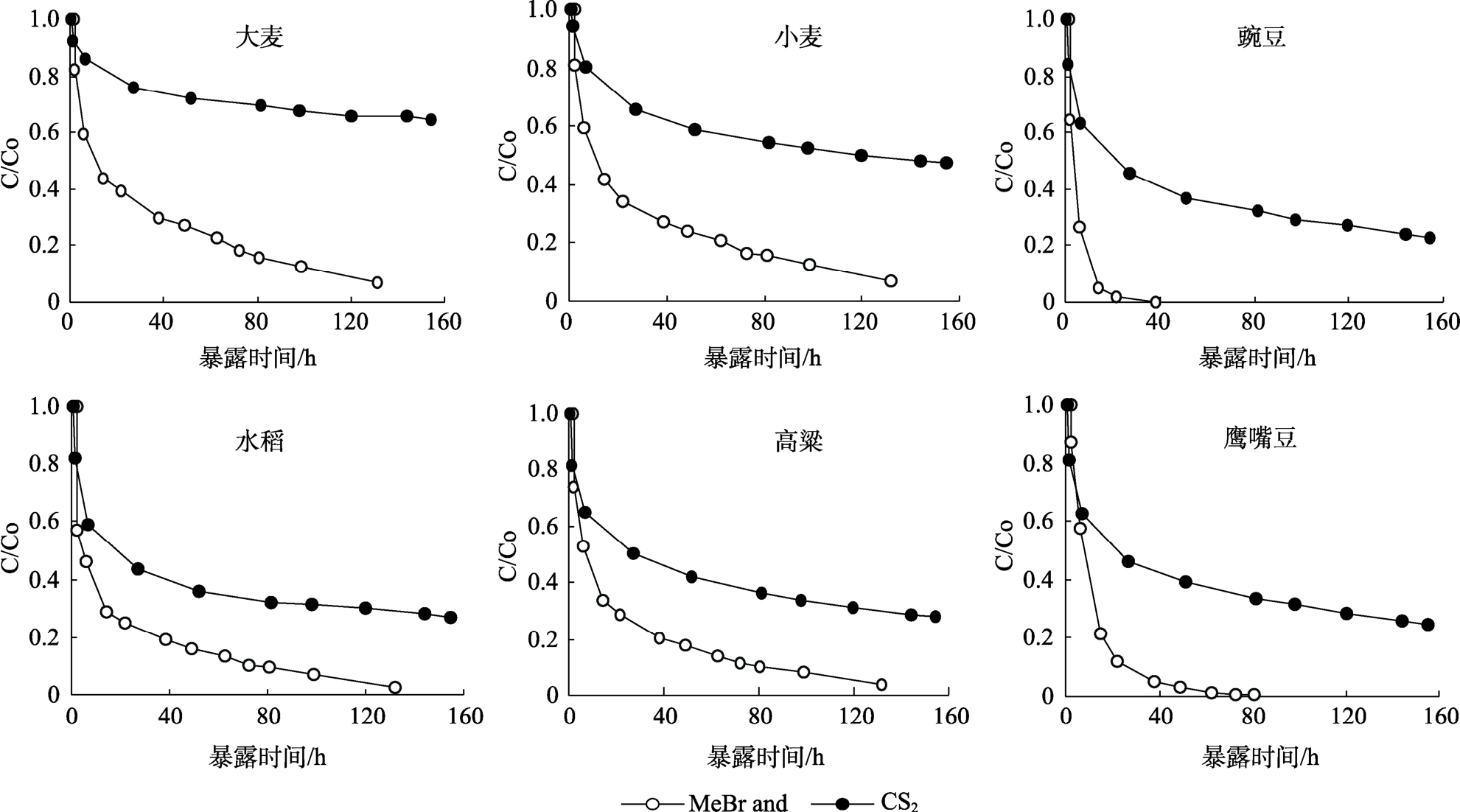
图3 二硫化碳和甲基溴在谷物豆类上的吸附曲线
Fig.3 Comparative sorption data for CS2 and MeBr, taken from measurement of loss of fumigant concentration in the headspace
熏蒸10 h 后,二硫化碳浓度下降平缓。熏蒸160 h,小麦、大麦和豌豆中的损失率分别在50%、30%和75%以下,而高粱、水稻和鹰嘴豆在70%以下。二硫化碳衰减速度相对较慢,整个暴露时间仍然存在有效防治剂量。本研究中,所测禾谷和豆类对甲基溴吸附速度非常快,如在豌豆和鹰嘴豆或稻谷和高粱几天后就会发生反应而消失。
2.1.3 熏蒸剂在小麦中的扩散
图4 显示三种熏蒸剂在小麦柱中的扩散性,从小麦柱远端排出气体浓度均大于 1 mg/m3(v/v)。二硫化碳在小麦中的扩散特性与磷化氢和溴甲烷两种最广泛使用的熏蒸剂相似。磷化氢和二硫化碳的色谱分析图在保留时间、峰宽和拖尾程度方面基本相同,甲基溴峰宽更宽,拖尾明显,吸附性更强。二硫化碳能快速穿透麦柱,麦粒间空气中的含量低于1 mg/m3。
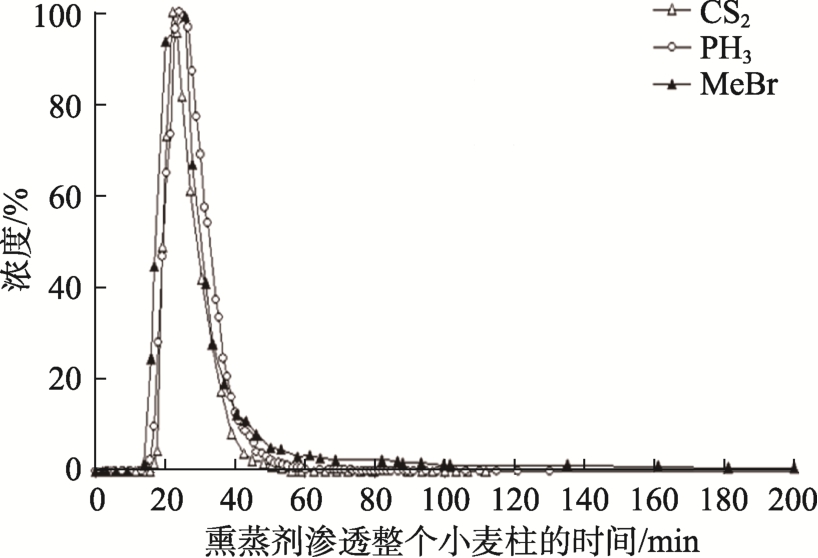
图4 在200 mL/min 的气流流速下,1.1 m 麦柱远端熏蒸剂浓度与时间的关系图
Fig.4 Concentration of fumigant, (% of maximum GC area)eluting from a 1.1 m column of wheat, at an air flow of 200 mL/min, plotted against time
注:熏蒸剂浓度(%,为最大浓度的占比),从1.1 m 的小麦柱中洗脱,风速为200 mL/min。
Note: Concentration of fumigant, (% of maximum concentration) eluting from a 1.1 m column of wheat, at an air flow of 200 mL/min.
熏蒸剂在麦柱中穿透性是熏蒸剂吸附、解吸、渗透和扩散等因素的综合效应[25]。由于二硫化碳能快速且容易穿透小麦粮堆,所以它也可以通过通风方式快速从熏蒸谷物中解吸。这些优点是作为理想熏蒸剂的基本要求,由于能快速扩散解吸,从而保障谷物出仓和运输环节操作工人的健康安全。
2.2.1 密闭仓中二硫化碳的防虫效果
防虫效果如表1 所示,熏蒸结束后,受试昆虫死亡率为100%,并在30 ℃条件下培养4 周和8 周后,没有后代出现。实验发现,二硫化碳平均浓度在第 4 天时降至 10.5 mg/m3,第 6 天7.7 mg/m3。二硫化碳对所有受试昆虫的CT 值(浓度×时间)在1 000~1 500 (mg/h)/L,说明其对受试昆虫都有剧毒,起到快速防治作用。
表1 实仓实验中害虫死亡率和子代数量
Table 1 Insect mortality and progeny in field trials
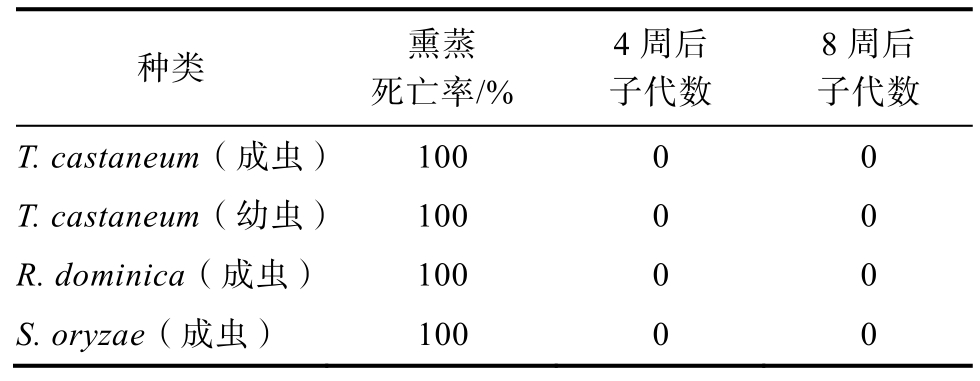
种类 熏蒸死亡率/%4 周后子代数8 周后子代数T. castaneum(成虫)100 0 0 T. castaneum(幼虫)100 0 0 R. dominica(成虫)100 0 0 S. oryzae(成虫) 100 0 0
2.2.2 清洗和润麦对小麦中二硫化碳残留的影响
本研究测定了熏蒸后的小麦经过清洗和润麦不同工序后二硫化碳的残留量,如图5 所示,残留量逐渐减少。从SGRL 工厂的筒仓出仓时,小麦中的二硫化碳含量约为7 mg/kg(ppm,w/w),低于澳大利亚规定的最高残留限量10 mg/kg。未经熏蒸的小麦中天然含有少量二硫化碳(0.03~0.08 mg/kg),这是因为在自然条件下,硫化羰基(COS)和硫氰酸盐的转化和分解可产生二硫化碳。本实验残留水平比Hilton[5]使用80 mg/m3 二硫化碳处理气密性差且无通风散气农场仓中的燕麦时低4~6 倍。
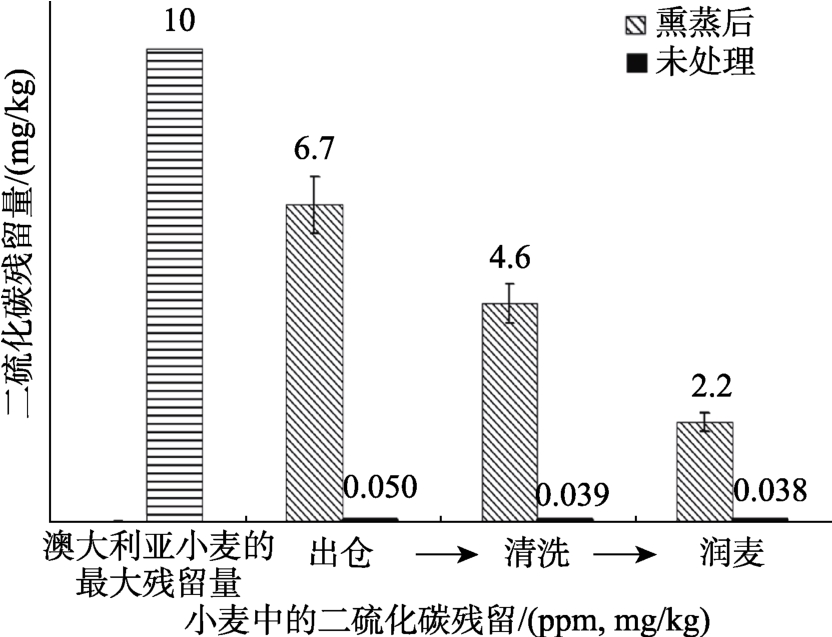
图5 在小麦加工过程中二硫化碳残留量逐渐减少
Fig.5 Carbon disulphide residues in wheat are progressively reduced during processing of wheat
小麦清洗后,二硫化碳残留量从6.7 mg/kg 降至4.5 mg/kg。也就是说,清洗过程可清除大约30%的二硫化碳残留物(图5)。小麦的润麦可进一步将残留量从4.5 mg/kg 降低到2.2 mg/kg,约30%残留量(图5)。67%的二硫化碳残留物可在出仓、清洗和润麦过程中去除。在所有情况中,工作环境中的二硫化碳浓度都低于 10 mg/kg(v/v)的有害物最高允许浓度(TLV)。
2.2.3 加工对小麦粉制品中二硫化碳残留的影响
测定了制粉和烘烤不同工序对二硫化碳熏蒸后的小麦粉制品中残留量的影响,结果如图6 所示。碾磨产品中,面粉或后路粉中的残留量最低,胚中的残留量最高,为5.45 mg/kg,但这一水平也低于最高残留限量,高于润麦小麦的平均残留水平。也就是说,残留集中在胚中。麸皮中的残留量(2.62 mg/kg)略高于润麦后的平均残留水平。面粉或后路粉中的二硫化碳残留量分别为未处理小麦中含量的3 倍和10 倍。

图6 BRI 商业规模制粉实验小麦粉制品中的二硫化碳残留量
Fig.6 Carbon disulphide residues in wheat milled products on a commercial scale milling trials at the BRI site
2.2.4 烘焙和加工对小麦粉制品中二硫化碳残留的影响
采用熏蒸和未熏蒸的小麦磨出的面粉进行烘焙研究,烘焙和加工产品中的二硫化碳的残留量如图7 所示。在面包和海绵蛋糕中含有少量二硫化碳残留物,含量为0.2~2.5 ng/kg。即使在生的通心粉和生的面条中也仅发现少量二硫化碳残留物含量,为2.2~4.0 ng/kg。在大多数情况下,处理组与对照组的数值差异不显著,与Munsey[10]的研究结果一致,在用二硫化碳处理过的小麦粉制成的面包中检测出二硫化碳,与对照组不存在显著差异。
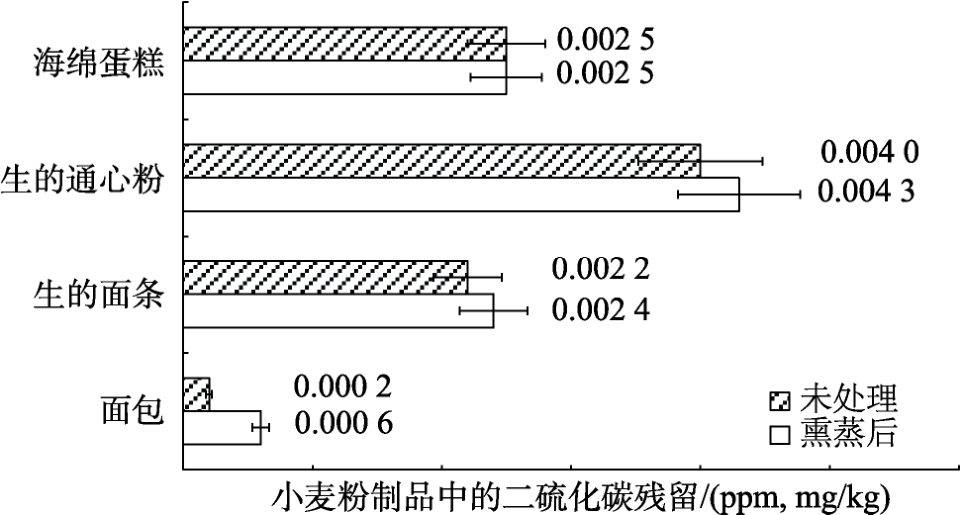
图7 BRI 现场商业规模制粉实验小麦加工最终产品中的二硫化碳残留量
Fig.7 Carbon disulphide residues on processed wheat end products on a commercial scale milling trials at the BRI site
本研究结果表明,二硫化碳对昆虫活性高,CT 值为1 000~1 500 mg/m3/h,杀虫速度快。与甲基溴不同,它的植物毒性低,即使在>150 mg/m3高浓度下,对各种测试种子的发芽率和幼芽长度无影响。二硫化碳在谷物上的吸附性低于甲基溴,主要是物理吸附。二硫化碳会在谷物上残留,但在储藏和加工过程中能得到很大程度地降解。小麦最终产品中的二硫化碳残留量没有超过天然含量。因此,二硫化碳可取代甲基溴,用于密封农仓中种子熏蒸处理。
致谢:感谢乔纳森·班克斯(Jonathan Banks)提供的建议,并对澳大利亚谷物研究开发公司(GRDC)和澳大利亚LeTrang Vu 提供的技术支持表示感谢。
[1] BOND E J. Manual of fumigation for insect control. FAO plant production and protection paper 54[M]. Room: Food and Agriculture Organization of the United Nations, 1984.
[2] NI Z Z. Fumigation trials with carbon disulphide: carbon tetrachloride (20: 80) in silo bins[C]. Proceedings of an international symposium “Practical Aspects of Controlled Atmosphere and Fumigation in Grain Storage” Edited by RIPP B E. held from 11 to 22 April 1983 in Perth, Western Australia,1989: 657-662.
[3] TAN X C. Residue of common chemicals in stored grain and hygiene evaluation[J]. Grain Storage, 1994, 23(2): 43-55.
[4] YANG S H, WANG Y N, XU X Z. Experimental report of control Rhyzopertha dominica with mixture of CS2 and CCl4[C].Proceedings of the 7th International Working Conference on Stored Product Protection, Beijing, China: Sichuan Publishing House of Science and Technology, 1998.
[5] HILTON S J, CASSELLS J A, BANKS H J. Fumigation of unsealed farm bins with carbon disulphide. CSIRO Division of Entomology, Stored Grain Research Laboratory (Research report), 1997.
[6] XIU G G, ZHANG Y H, HE G C, et al. The safety of cropseeds fumigated with four fumigants and the effects of the vacuum and carbon dioxide to control the stored product insects[J]. Grain Storage, 1987, 16(2): 8-20.
[7] GHALY T H. Fumigation of rice against insect pests and its effects on the quality of the grain[D]. Master, Thesis, Cairo University, Egypt, 1960.
[8] RAIE M. Fumigation of agricultural products. X. —Sorption of carbon disulphide by wheat and flour[J]. Journal of the Science of Food and Agriculture, 1954, 5: 536-541.
[9] MAPES D A, SHRADER S A. Residues in commercially fumigated grains[J]. Journal of Association of Official Agricultural Chemists, 1957, 40(1): 196-198.
[10] MUNSEY V E, MILLS P A, KLEIN A K. Effect of cooking on fumigant residues[J]. Association of Official Agricultural Chemists, 1957, 40(1): 201-202.
[11] MAPES D A, SHRADER S A. A residues in laboratory fumigated wheat and its buhler mill fractions[J]. Journal of Association of Official Agricultural Chemists, 1957, 40(1):191-192.
[12] REN Y L, O'BRIEN I G, DESMARCHELIER J M. Effect of hydrogen cyanide and carbonyl sulphide on the germination and plumule vigour of wheat[J]. Pesticide Science, 1996, 47(1): 1-5.
[13] PPC. Climate Change 2022: Mitigation of Climate Change,2022. https://www.ipcc.ch/report/sixth-assessment-report-workinggroup-3/.
[14] Californian Air Resources Board. Response to Petition to Regulate Sulfuryl Fluoride to Reduce the Use of the High Global Warming Potential Pesticide, 2023. https: //ww2. arb. ca.gov/sites/default/files/2023-02/Pesticide%20Petition%20Respon se_approved02242023. pdf.
[15] ANON. Recommended methods for the detection and measurement of resistance of agricultural pests to pesticides 16[J]. FAO Plant Protection Bulletin, 1975, 23: 12-25.
[16] International Seed Testing Association. International rules for seed testing[M]. Switzerland: Seed Science and Technology,1976, 4: 3-177.
[17] GHALY T H, VAN DER TOUW J W. Heat damage studies in relation to high temperature disinfestation of wheat[J]. Journal of Agricultural Engineering Research, 1982, 27(4): 329-336.
[18] DESMARCHELIER J M. Carbonyl sulphide as a fumigant for control of insects and mites[C]. Proceedings of the 6th International Working Conference Stored Product Protection Edited by HIGHLEY E , WRIGHT E J, BANKS H J, et al.Canberra, Australia, 17-23 April 1994. Wallingford, UK: CAB International, 1994: 78-82.
[19] REN Y L. Carbonyl sulphide as a fumigant for grain timber efficacy towards organisms and formation of residues[D]. Ph. D.thesis, University of Canberra, Australia, 1997.
[20] REN Y L, DESMARCHELIER J M. Release of fumigant residues from grain by microwave irradiation[J]. Journal of AOAC International, 1998, 81(3): 673-678.
[21] DAFT J. Determining multifumigants in whole grains and legumes, milled and low-fat grain products, spices, citrus fruit,and beverages[J]. Journal of Association of Official Analytical Chemists, 2020, 70(4): 734-739.
[22] DESMARCHELIER J M, ALLEN S E, REN Y. Modifications of a method for determining multifumigant residues[J]. Journal of AOAC International, 1998, 81(3): 638-644.
[23] BANKS H J, ANNIS P C. Conversion of existing grain storage structures for modified atmosphere use. In Controlled atmosphere storage of grains Edited by SHEJBAL J., ed[M].Amsterdam: Elsevier, Developments in agricultural engineering,1980: 1461-1473.
[24] VERMA B R. Effect of multiple fumigants on seed germination[J]. Seed Research, 1988, 16(2): 241-244.
[25] MUTHU M. Some aspects of phosphine as a fumigant. In Fumigation and gaseous pasteurisation[M]. India: Academy of pest control sciences, 1973: 28-29.