黑米表皮富含花色苷,具有抗氧化、抗炎和抗癌的功效,营养价值优于普通大米,在食品和医药领域均有很大发展潜力。黑米花色苷主要存在黑米的稻壳和种皮中,含量可达3 251.90 mg/kg[1]。黑米花色苷在机体内主要以花色苷完整结构或其降解产物等形式被消化吸收,进入各组织器官发挥功能,另外花色苷对肠道微生物具有调节潜力,能够上调双歧杆菌、乳杆菌等有益菌群,下调大肠杆菌、金黄色葡萄球菌等有害菌群[2]。基于花色苷的化学结构特性,其具有较强抗氧化活性的同时,容易受到光、温度、pH等因素的影响从而发生降解,花色苷结构的不稳定性降低了其生物利用度。通过酰基化和糖基化等化学修饰,或添加辅色剂等可使花色苷形成更稳定的复合物。而利用生物大分子对花色苷进行微胶囊化包被,可以保持其原有的结构,提高其稳定性,并且能够使花色苷在肠道中靶向释放,从而被更加有效的吸收利用[3]。
微胶囊技术是指将功能活性物质固定在一定空间内形成微球,通过密闭的或半透性的壁膜将目的物与周围环境隔离,从而达到保护和稳定芯材、屏蔽气味或颜色、控制释放芯材等目的。微胶囊技术问世以来,其制备方法和工艺一直是很多学者研究的重点。据统计,目前已有的微胶囊制备方法多达200余种[4]。进行活性物质和细胞微胶囊制备的过程必须保证整个流程中操作温和、迅速,保护芯材的生理活性。微胶囊的乳化凝胶化制备技术是将水相含有芯材的混合液与有机相混合形成油包水型乳液,除去油相并分离收集即可得到微胶囊。乳化凝胶化法在制作过程中对物质的存活率影响较小,目前在医药领域应用广泛[5]。使用这种方法包埋的微胶囊可以有一个较小的平均粒径,其粒径可控制在0.1~1 mm之间,可通过调节搅拌速度、水油比、乳化剂类型、乳化时间等来调控颗粒粒径[6]。
本研究以海藻酸钙为壁材,以乳化凝胶化为制备工艺,实现黑米花色苷的微囊化包埋,通过比较包被前后花色苷的功能和活性变化,评估微囊化技术对粮油功能活性物质的保护作用及应用前景。
1 材料与方法
1.1 材料与试剂
黑米花色苷提取物(纯度≥80%):南京景竹生物技术公司;海藻酸钠、碳酸钙:北京索莱宝科技有限公司;石蜡油:上海生工生物工程股份有限公司;司班85、冰乙酸:上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
MYP2011-250电动搅拌器:上海梅颖浦仪器仪表制造有限公司;RCT温控磁力搅拌器:德国IKA艾卡集团;2300多功能酶标仪:美国铂金埃尔默股份有限公司;Bettersize2600激光粒度分布仪:丹东百特仪器有限公司;IX71倒置显微镜:日本奥林巴斯;冷冻碾磨仪:上海净信科技有限公司;TES-1337B照度计:台湾泰仕。
1.3 实验方法
1.3.1 黑米花色苷微胶囊的制备
配制黑米花色苷提取物的水溶液,称取1.2 g的海藻酸钠和0.5 g碳酸钙溶于80 mL花色苷水溶液,放入转子在磁力搅拌器上搅拌至完全溶解,形成水相。在石蜡油中加入0.1%的乳化剂司班85,混匀形成油相。取20 mL油相置于100 mL烧杯中,调整电动搅拌器的功率为300~400 W,搅拌状态下,缓慢加入与油相体积为1∶3的水相进行乳化。继续搅拌,加入200 μL冰醋酸。调节搅拌器功率为200~300 W,边搅拌边加入氯化钙溶液,反应30~60 s后完成制备。经过2~3次清洗,自然沉降5~10 min后收集微胶囊沉淀。
1.3.2 花色苷含量的测定
以矢车菊素-3-葡萄糖苷(C3G)含量为黑米花色苷含量,参考刘长姣等的方法[7],绘制吸光度-C3G质量浓度标准曲线,在冷冻碾磨仪中用4℃、25 Hz处理60 s破碎微胶囊,提取花色苷后测定吸光度,通过标准曲线计算出样品中C3G的质量浓度,得到微胶囊花色苷含量。
1.3.3 包埋率和荷载量的计算
微胶囊花色苷的荷载量与包埋率的计算公式为:荷载量(%)=微胶囊中花色苷含量/微胶囊总质量×100%;包埋率(%)=微胶囊中花色苷含量/制备过程中加入花色苷总量×100%。
1.3.4 微胶囊的形态和粒径分布
将收集的微胶囊置于平皿中,在倒置显微镜下观察微胶囊形态,选择合适的视野进行拍照。
参考Walton的方法[8],用激光衍射粒度分析仪,选择湿法测量,以超纯水为溶剂,在1~2 000 μm范围内测量样品的粒径分布。
1.3.5 微胶囊稳定性测定
本研究采用花色苷的保留率为指标,表征其在不同处理条件下的活性变化。此外,Chisté R.C(2010)和 Elivaldo Nunes Modesto Junior(2023)的动力学模型研究表明,花色苷的半衰期在4 h内[9-10],因此本研究对花色苷的处理周期选择4 h,即将未包被黑米花色苷和微囊化包被黑米花色苷分别进行以下处理,每个处理进行4 h,每隔一小时进行取样,累计取样4次,测定花色苷的保留率变化。
光照对黑米花色苷的影响:用照度计测量距离白炽灯不同位置的光照强度,选择光强为5 000 lux的位置,将花色苷进行光照处理实验。
pH值对黑米花色苷的影响:将花色苷用pH为 4.0的盐酸溶液进行处理。
温度对黑米花色苷的影响:将花色苷置于60 ℃高温烘箱中,进行处理。
1.3.6 黑米花色苷微胶囊在模拟肠胃液中的释放实验
参考孟翔宇等的方法[11],配制人工模拟胃肠液,评价微胶囊花色苷在人工模拟胃肠液中的释放特性。花色苷释放率计算公式为:释放率(100%)=测量时间胃肠液中的花色苷含量/微胶囊中花色苷总含量×100%。
1.4 数据处理
使用GraphPad Prism 8 Software进行统计分析,所有结果均以平均值±标准误差(SEM)表示。采用单因素方差分析(one-way ANOVA)确定两组间是否有显著性差异,P值< 0.05为差异显著。
2 结果与分析
2.1 黑米花色苷微胶囊的制备
黑米花色苷微胶囊的最佳制备工艺为海藻酸钠浓度15 g/L,水油体积比为1∶3,壁芯比M(NaAlg)∶M(C3G)为1∶2,溶液pH4.5。此参数制备得到黑米花色苷微胶囊的包埋率可达92.02%± 4.43%。倒置显微镜形态学观察如图1所示,微胶囊形态较好,花色苷均匀的分布在微胶囊之中,未见明显空泡或空白区域。用Bettersize2600激光粒度分布仪测定微胶囊的粒径分布,得到花色苷微胶囊的平均粒径大小在700 μm左右,具有较好的粒径均匀性,如图2所示。

图1 黑米花色苷微胶囊倒置显微镜40×
Fig.1 Phase contrast optical image of black rice anthocyanin microcapsule, 40×

图2 黑米花色苷微胶囊粒径分布图
Fig.2 Grain size distribution diagram of black rice anthocyanin microcapsules
目前关于植物花色苷微胶囊的制备已有多个报道,如采用锐孔法制备的黑米花色苷微胶囊,其包埋率最高为94.69%[6];采用喷雾干燥法制备的紫玉米花色苷微胶囊,其包埋率最高为95.2%[13],用造粒机制备黑米花色苷微胶囊,其包埋率最高可达99.28%[14]。本研究方法的最大包埋率已达到与这些包埋方式制备花色苷微胶囊的同等水平。且本研究采用乳化凝胶化原理,不依赖高压静电发生器、喷雾干燥器等特殊造粒设备,在容易实现大规模生产的同时,可有效避免高温、光照和高压等条件对花色苷活性的影响。
2.2 黑米花色苷微胶囊的体外稳定性评价
2.2.1 光照对黑米花色苷稳定性的影响
花色苷对光照非常敏感,研究表明,在室内日光灯照射10天内的花色苷,活性损失率可达70.7%[14]。不同功率的日光灯,以及花色苷距离光源的远近,均会导致花色苷对光照的敏感程度表现出差异。低于1 000 lux的白炽灯和荧光灯对花色苷稳定性的影响较弱,当用4 000 lux日光灯照射时,强光增强了花色苷原子活性,从而易受到亲水基团攻击,加速发生降解[15]。由于日光灯需要距离很近才能达到4 000 lux光强,为方便实验操作,本实验改用白炽灯,将光强提高至5 000 lux进行处理,以测试花色苷对光照的稳定性。结果如图3所示,在5 000 lux白炽灯光源的光照条件下,随着处理时间的增加,微胶囊化的黑米花色苷保留率显著高于游离黑米花色苷,在处理4 h后,游离花色苷为9.9%,微囊化花色苷为50.7%,高于游离花色苷40.8%(P<0.05)。表明微胶囊包被在一定程度上保护了黑米花色苷免受光氧化降解的影响。

图3 光照对花色苷稳定性影响
Fig.3 Effect of light on the stability of anthocyanin microcapsules
2.2.2 温度对黑米花色苷稳定性的影响
高温会引起花色苷的变性,不利于花色苷的保存,研究表明,在40、50、60、70、80、90 ℃等温度处理下,花色苷均会发生热降解,而60 ℃高温处理后每小时花色苷保存率均会有显著变化[16],因此本研究选择60 ℃测试微囊化花色苷对温度的稳定性。结果图4所示,在60 ℃条件下,微胶囊化黑米花色苷的保留率显著高于游离状态黑米花色苷,处理4 h后,微囊化花色苷含量(92.7%)比游离花色苷(50.1%)高42.6%(P<0.05)。说明在高温条件下,微胶囊包被能有效提高黑米花色苷的稳定性。
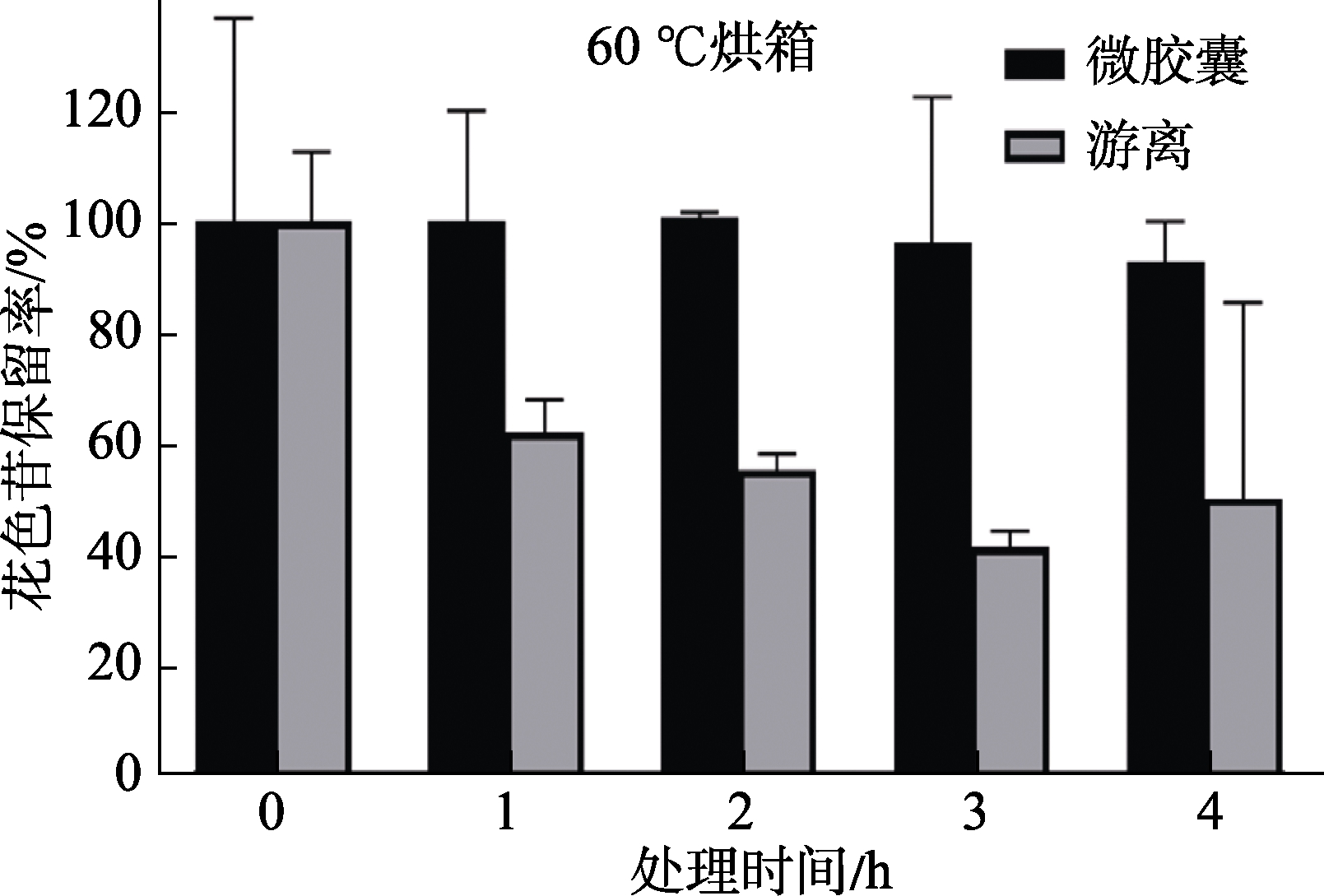
图4 温度对花色苷稳定性影响
Fig.4 Effect of temperature on the stability of anthocyanin microcapsules
2.2.3 pH对黑米花色苷稳定性的影响
pH值是影响花色苷稳定性的主要因素,当pH值较低时花色苷以黄烊盐阳离子的形式稳定存在,随着pH值升高,当pH大于3时花色苷便迅速降解[17]。因此本研究选择pH=4的盐酸溶液测试微囊化花色苷的稳定性,结果如图5所示,随着时间的延长,游离花色苷在pH=4的盐酸溶液中活性迅速降低,4 h时降低至16.6%,而微胶囊包被后的花色苷活性降低不明显,4 h时仍可达88.6%,高于游离花色苷72.0%(P<0.05)。说明微胶囊包被黑米花色苷对pH值的敏感性降低,稳定性增强。
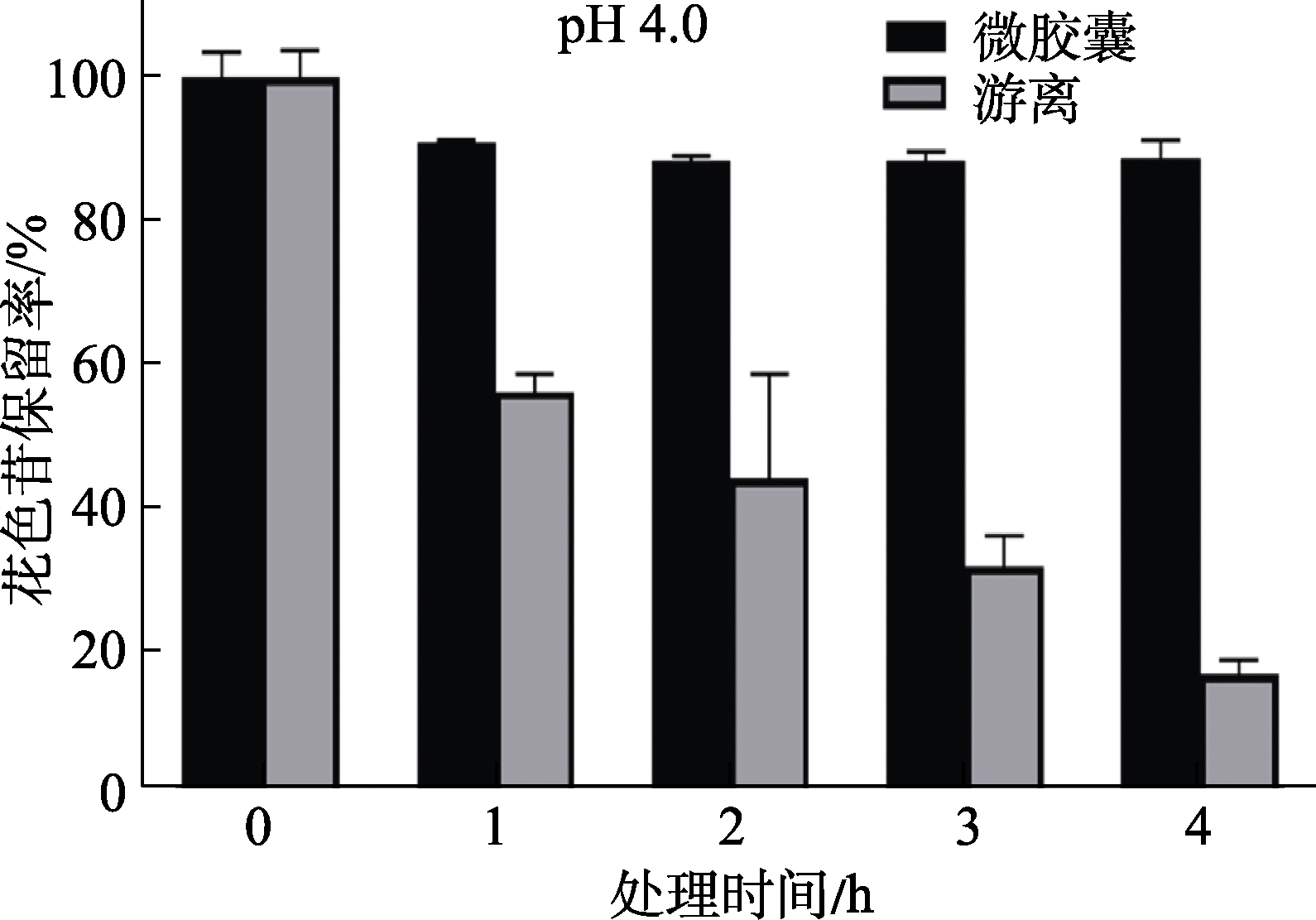
图5 pH值对花色苷稳定性影响
Fig.5 Effect of pH value on the stability of anthocyanin microcapsules
2.3 黑米花色苷微胶囊的体外释放性能研究
通常食物在胃中可以存在2.0~6.0 h左右;花色苷在胃部,能够通过胃黏膜,同时以糖苷形式被胃部快速吸收。黑米花色苷的主要作用之一就是其对肠道微生物的有益调节能力[18],而体内的益生菌大多存在于肠道中,因此花色苷应在胃液中存在4.0 h以上且不被全部溶解吸收,然后到达肠道,在肠道内进一步溶解,才能更好地实现花色苷对肠道益生菌的增殖促进作用和对机体的健康促进作用[19]。因此,本研究进一步检测了黑米花色苷微胶囊的在模拟胃肠液中的释放特性,如图6所示,微胶囊在模拟胃液和模拟肠液中的释放速度比游离花色苷明显缓慢(图6)。当在模拟胃液中消化30 min时,游离花色苷和微胶囊花色苷的释放度接近,均为20%左右。随着消化时间增加,游离花色苷释放度迅速上升,达到89.6%,而微囊化花色苷释放率仅有28.1%(图6-A)。在模拟肠液中,微胶囊花色苷的释放速率同样明显低于游离花色苷,但3 h后微胶囊花色苷可达90%以上释放度,具有明显的缓释效果(图6-B)。

图6 (A)模拟胃液中花色苷的释放效率,(B)模拟肠液中花色苷的释放效率
Fig.6 The releasing of anthocyanin in the stomach(A) and intestine (B) simulated liquid
有研究报道,锐孔法制备的花色苷微胶囊同样有良好的缓释效果,如用锐孔法制备的短梗五加果花色苷微胶囊在人工胃液中4.5 h的释放率为42.8%,在人工肠液中2.5 h完全释放[15]。锐孔法制备的玫瑰茄花色苷微胶囊在人工胃液中4 h的释放率为35%,在人工肠液中3.5 h完全释放[13]。本研究制备的黑米花色苷微胶囊在人工胃液中4 h的释放率为28.1%,在人工肠液中4 h释放率为95.7%,实现完全释放。因此,本研究制备微胶囊实现了更好的花色苷胃部部分释放和肠道缓释效果。
3 结论
本研究以海藻酸钠为壁材,采用内部乳化凝胶化法制备黑米花色苷微胶囊,所采用工艺参数为:海藻酸钠浓度15 g/L,水油体积比为1∶3,壁芯比M(NaAlg)∶M(C3G)为1∶2,溶液pH 4.5。在此工艺条件下制备的黑米花色苷微胶囊球形度好,粒径集中度高。微胶囊包被后的黑米花色苷,在光照、温度和pH等不同环境因素的影响下,与游离花色苷相比都具有显著较高的稳定性。在模拟胃肠液中实现了更好的胃部部分释放和肠道缓释效果,能更好的保证黑米花色苷在人体的活性和吸收利用。
体外实验不能完全反映花色苷在体内的活性变化和吸收模式,有研究表明同时摄入水果蔬菜和花色苷,由于共消化可以提高特定花色苷的稳定性和吸收利用度[17]。花色苷与肠道菌群调节的相互作用,能促进肠道健康,更好的发挥其功能活性[19]。因此需要结合体内实验进一步明确微囊化的黑米花色苷的活性保护效果和靶向递送功能。
[1] HEIM K E, TAGLIAFERRO A R, BOBILYA D J.Flavonoid antioxidants: Chemistry, metabolism and structure-activity relationships[J].The Journal of nutritional biochemistry, 2002,13(10): 572-584.
[2] 张曼莉.黑米花青素对益生菌和有害菌的体外活性研究及其分子修饰[D].合肥工业大学, 2015.ZHANG M L.Study on in vitro activity of black rice anthocyanins against probiotics and harmful bacteria and its molecular modification[D].Hefei University of Technology, 2015.
[3] 赵磊, 潘飞, 周娜, 等.提高黑米花色苷颜色稳定性辅色剂的筛选及其作用机制[J].食品科学, 2021, 42 (14): 8.ZHAO L, PAN F, ZHOU N, et al.Screening of auxochromes to improve the color stability of black rice anthocyanins and their mechanism of action[J].Food Science, 2021, 42 (14): 8.
[4] 韩路路, 毕良武, 赵振东, 等.微胶囊的制备方法研究进展[J].生物质化学工程, 2011, 45 (3): 6.HAN L L, BI L W, ZHAO Z D, et al.Research progress on preparation methods of microcapsules[J].Biomass Chemical Engineering, 2011, 45(3): 6.
[5] G ORIVE R M, HERNÁNDEZ A R, GASCÓN G, et al.History,challenges and perspectives of cell microencapsulation[J].Trends in Biotechnology, 2004, 22 (2): 87-92.
[6] 娄秋艳, 孙汉巨, 王鑫, 等.黑米花青素微胶囊制备的工艺研究[J].食品安全质量检测学报, 2015: 1999-2005.LOU Q Y, SUN H J, WANG X, et al.Study on the preparation technology of black rice anthocyanin microcapsules[J].Journal of Food Safety and Quality, 2015: 1999-2005.
[7] 刘长姣, 郑霞, 熊湘炜, 等.分光光度法测定黑米花青素方法的建立[J].粮食与油脂, 2019, 32(1): 73-77.LIU C J, ZHENG X, XIONG X W, et al.Establishment of a spectrophotometric method for the determination of anthocyanins in black rice[J].Food and Oil, 2019, 32(1): 73-77.
[8] WALTON M C, MCGHIE T K, REYNOLDS G W, et al.The flavonol quercetin-3-glucoside inhibits cyanidin-3-glucoside absorption in vitro[J].Journal of Agricultural and Food Chemistry,2006, 54 (13): 4913-4920.
[9] MODESTO JUNIOR E N, MARTINS M G, PEREIRA G A,et al.Stability kinetics of anthocyanins of grumixama berries(eugenia brasiliensis lam.) during thermal and light treatments[J].Foods, 2023, 12 (3): 565.
[10] CHEN X, GUAN Y, ZENG M, et al.Effect of whey protein isolate and phenolic copigments in the thermal stability of mulberry anthocyanin extract at an acidic pH [J].Food Chemistry,2022, (30): 377.
[11] 孟翔宇, 赵彦巧, 李钰琨, 等.玫瑰茄花色苷微胶囊的制备及其稳定性与释放性的评价[J].食品工业科技, 2019, 40 (14): 8.MENG X Y, ZHAO Y Q, LI Y K, et al.Preparation, stability and release evaluation of rose anthocyanin microcapsules[J].Science and Technology of Food Industry, 2019, 40 (14): 8.
[12] 王宇滨, 张超, 马越, 等.紫玉米花色苷微胶囊化工艺和性能研究[J].食品科学, 2011, 32 (8): 4.WANG Y B, ZHANG C, MA Y, et al.Study on microencapsulation technology and properties of purple corn anthocyanins[J].Food Science, 2011, 32 (8): 4.
[13] 梅薇, 吴荣书.锐孔法对玫瑰花花青素微胶囊包埋工艺的优化[J].贵州农业科学, 2017, 45 (7): 5.MEI W, WU R S.Optimization of microencapsulation technology of rose anthocyanins by perforation method[J].Guizhou Agricultural Sciences, 2017, 45 (7): 5.
[14] LIAO Z G, ZHANG J, LUO Y X, et al, Ocular delivery of cyanidin-3-glycoside in liposomes and its prevention of seleniteinduced oxidative stress[J].Drug Development and Industrial Pharmacy, 2016, 42 (4): 546-553.
[15] 赵丽艳, 王磊, 任婷, 等.黑米花色苷微胶囊的制备[J].食品研究与开发, 2020, 41 (24): 5.ZHAO L Y, WANG L, REN T, et al.Preparation of black rice anthocyanin microcapsules[J].Food Research and Development,2020, 41 (24): 5.
[16] BORDENAVE N, HAMAKER B R, FERRUZZI M G.Nature and consequences of non-covalent interactions between flavonoids and macronutrients in foods[J].Food and Function, 2013: 5.
[17] 郭松年, 徐驰, 刘兴华, 等.温度、pH值和光照对石榴汁花色苷稳定性的影响[J].食品与发酵科技, 2009, 5: 29-31.GUO S N, XU C, LIU X H, et al.Effects of temperature, pH and light on the stability of anthocyanins in pomegranate juice[J].Food and Fermentation Technology, 2009, 5: 29-31.
[18] WU Y, HAN Y B, TAO Y, et al.In vitro gastrointestinal digestion and fecal fermentation reveal the effect of different encapsulation materials on the release, degradation and modulation of gut microbiota of blueberry an, thocyanin extrac[J].Food Research International, 2020, 132: 109098.
[19] HORINCAR G, ENACHI E, BARBU V, et al.Value-added pastry cream enriched with microencapsulated bioactive compounds from eggplant (solanum melongena l.) peel[J].Antioxidants, 2020, 9 (4): 351.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。