甜醅是我国具有悠久历史的传统全谷物发酵食品和饮品,也是具有地域特色的文化小吃。甜醅以燕麦等全谷物为原料经过传统发酵工艺制作而成,营养丰富,酸甜适口,含有多种有益微生物。目前关于甜醅的研究还较缺乏,少量报道关注了其营养和工艺[1-3],而对于其微生物区系鲜有系统研究报道。国外虽未有甜醅,但微生物发酵燕麦研究获得不少关注,多关注乳酸菌等发酵促进燕麦改性,提升口感风味,改善蛋白质溶解度并增加产品营养价值[4-6]。传统发酵食品是微生物资源的宝库,因此对其微生物区系的研究越来越受到重视。高通量测序技术在传统发酵食品的微生物研究中得到了广泛应用[7-8]。Illumina MiSeq测序技术因灵敏度高、读数长和效率高等特点,能助力发酵食品中微生物群落信息的发掘[7-8]。然而,关于甜醅微生物多样性与营养化学成分之间的相关性研究,尤其是真菌群落与甜醅的营养化学成分之间的相关性研究,仍然需要更深入的探索。
本研究以我国西北地区五种代表性燕麦甜醅样品为对象,通过Illumina Miseq测序技术开展了燕麦甜醅样品真菌微生物区系研究,利用多元统计学解析其真菌群落结构信息,并研究了米根霉发酵对甜醅性质的影响,以期为传统发酵全谷物食品微生物群落研究、资源挖掘、产品改性及品质提升等提供理论参考。
1 材料与方法
1.1 材料试剂
研究用五种代表性燕麦甜醅样品TP1、TP2、TP3、TP4、TP5:西北甘肃巩昌、兰州、临夏、定西地区家庭作坊。用于Illumina测序的每种甜醅样品3个生物学重复。米根霉发酵用燕麦原料:十月稻香的全谷物燕麦。
甜醅总基因组通过QIAGEN DNeasymericon Food Kit提取:美国QIAGEN公司;胶回收利用AxyPrep DNA Gel Extraction Kit:美国Axygen Biosciences 公司;扩增子建库测序使用NEXTflexTM Rapid DNA-Seq Kit:美国Bioo Scientific公司;甜醅营养化学性质测定用试剂盒:苏州格锐思生物科技公司。
1.2 仪器与设备
超微量分光光度计(NanoDrop2000):美国Thermo Scientific 公司;振荡培养箱(MQD-SIR):上海旻泉仪器有限公司;酶标仪(SynergvHT):美国BIOTEK公司;台式冷冻离心机(BECKMAN Allegra X-22R):美国BECKMAN公司;PCR仪(ABI GeneAmp® 9700 型):美国ABI公司;SBA-40E生物传感分析仪:山东省科学院生物研究所。
1.3 实验方法
1.3.1 燕麦甜醅样品宏基因组的提取
燕麦甜醅搅拌均匀,每份样品称取1 g,参照试剂盒方法提取燕麦甜醅样品的宏基因组。每样品燕麦甜醅取3个生物学重复。确保燕麦甜醅宏基因组OD260 nm/OD280 nm值在1.8~2.0之间。
1.3.2 真菌ITS rDNA扩增、纯化及测序
燕麦甜醅样品真菌ITS2 区域利用引物ITS3F(GCATCGATGAAGAACGCAGC)和ITS4R(TCCTCCGCTTATTG AT ATGC)PCR扩增。扩增程序为95 ℃ 预变性 5 min,33 个循环(包括95 ℃ 变性 35 s,50 ℃ 退火 35 s,72 ℃ 延伸 42 s),72 ℃ 再延伸 10 min后4 ℃保存。扩增反应体系包括5×PCR Mix 4 μL,引物ITS3F 1.2 μL,引物ITS4R 1.2 μL,宏基因组1.5 μL,用ddH2O补足至20 μL。PCR扩增产物纯化,检测定量,构建文库,并利用Illumina Miseq PE300测序平台,在上海美吉生物医药科技有限公司完成真菌扩增子测序。真菌扩增子测序的数据上传至NCBI数据库(序列号PRJNA839505)。
1.3.3 生物信息学分析
采用Fastp[9]0.20.0软件来质控原始真菌扩增子序列,利用FLASH[10]1.2.7软件进行序列拼接。质控去除reads尾部质量值小于20的碱基,根据双向末端 reads之间的重叠关系拼接序列,其中最小重叠长度为10 bp;根据标记序列及引物区分相应样品,调整好序列方向,其中最大引物错配数值为2。利用UPARSE[11] 7.1软件,以97%的相似度对序列进行可操作分类单元(OTU)聚类并剔除嵌合体序列。通过RDP classifier[12] 2.2对序列进行UNITE数据库比对并进行物种分类注释。LEfSe被用来筛选燕麦甜醅样品的真菌标志物。
1.3.4 米根霉发酵燕麦及甜醅性质的测定
将燕麦浸泡2 h,蒸煮1 h,沥水晾干后接种2%米根霉。在发酵0、24、48、72和96 h分别测定发酵甜醅的营养化学性质。发酵温度为25 ℃。甜醅营养化学性质黄酮、氨基酸、蛋白、淀粉、纤维素、游离脂肪酸、还原糖含量测定使用相应试剂盒测定。乳酸含量测定利用生物传感分析仪。
2 结果与讨论
2.1 序列概况及燕麦甜醅真菌多样性
分析研究了5种燕麦甜醅样品(15个甜醅样本)的真菌多样性数据,通过优化共有序列955 475条,327 651 802 bp,序列平均长度342 bp。经过物种注释结果统计,燕麦甜醅样品包含真菌的7门、20纲、41目、67科、90属、111种及202个OTU。燕麦甜醅样品真菌群落α多样性指数如表1所示。所有样品的Coverage值大于0.999,说明测序覆盖率和测序深度都适合,样品数据值得信赖可用于进一步分析。研究选用Chao1、Shannon和Simpsoneven分别代表样品真菌群落丰度、多样性和均一性。燕麦甜醅样品TP1具有最高的丰度、多样性,而TP5具有最高的均一性;TP4丰度最低、TP3多样性最低、TP2均一性值最低。
表1 燕麦甜醅真菌α多样性指数
Table 1 α diversity index of oats Tianpei
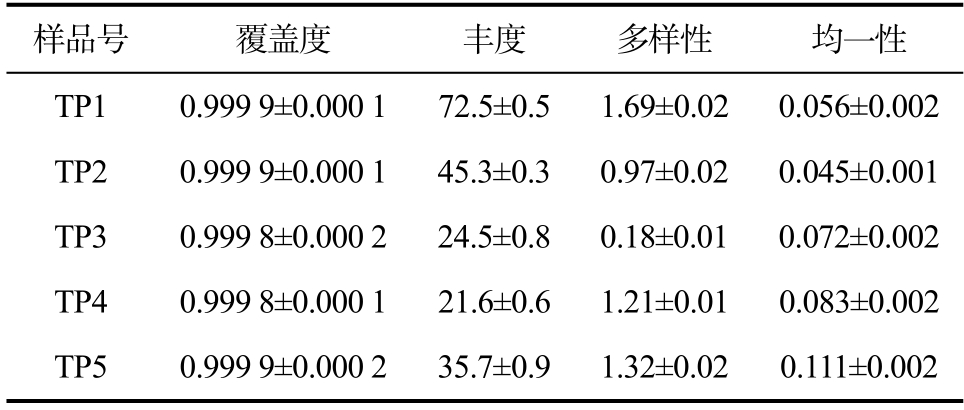
样品号覆盖度 丰度 多样性 均一性TP1 0.999 9±0.000 172.5±0.5 1.69±0.02 0.056±0.002 TP2 0.999 9±0.000 145.3±0.3 0.97±0.02 0.045±0.001 TP3 0.999 8±0.000 224.5±0.8 0.18±0.01 0.072±0.002 TP4 0.999 8±0.000 121.6±0.6 1.21±0.01 0.083±0.002 TP5 0.999 9±0.000 235.7±0.9 1.32±0.02 0.111±0.002
燕麦甜醅真菌β多样性分析通过主成分分析(PCA)进行。5种燕麦甜醅样品形成各自的聚集群落(图1)。甜醅样品真菌群落差异特性值PC1 为55.93%,PC2为30.01%。非参数多元方差分析(PERMANOVA)也证实了5种甜醅样品真菌群落结构存在差异(所有组P <0.05)。此外,有报道表明受到不同地区水、土、光照等多种因素影响[8],微生物群落组成会不同。能够帮助解释5种甜醅样品间不同的真菌多样性及真菌结构。
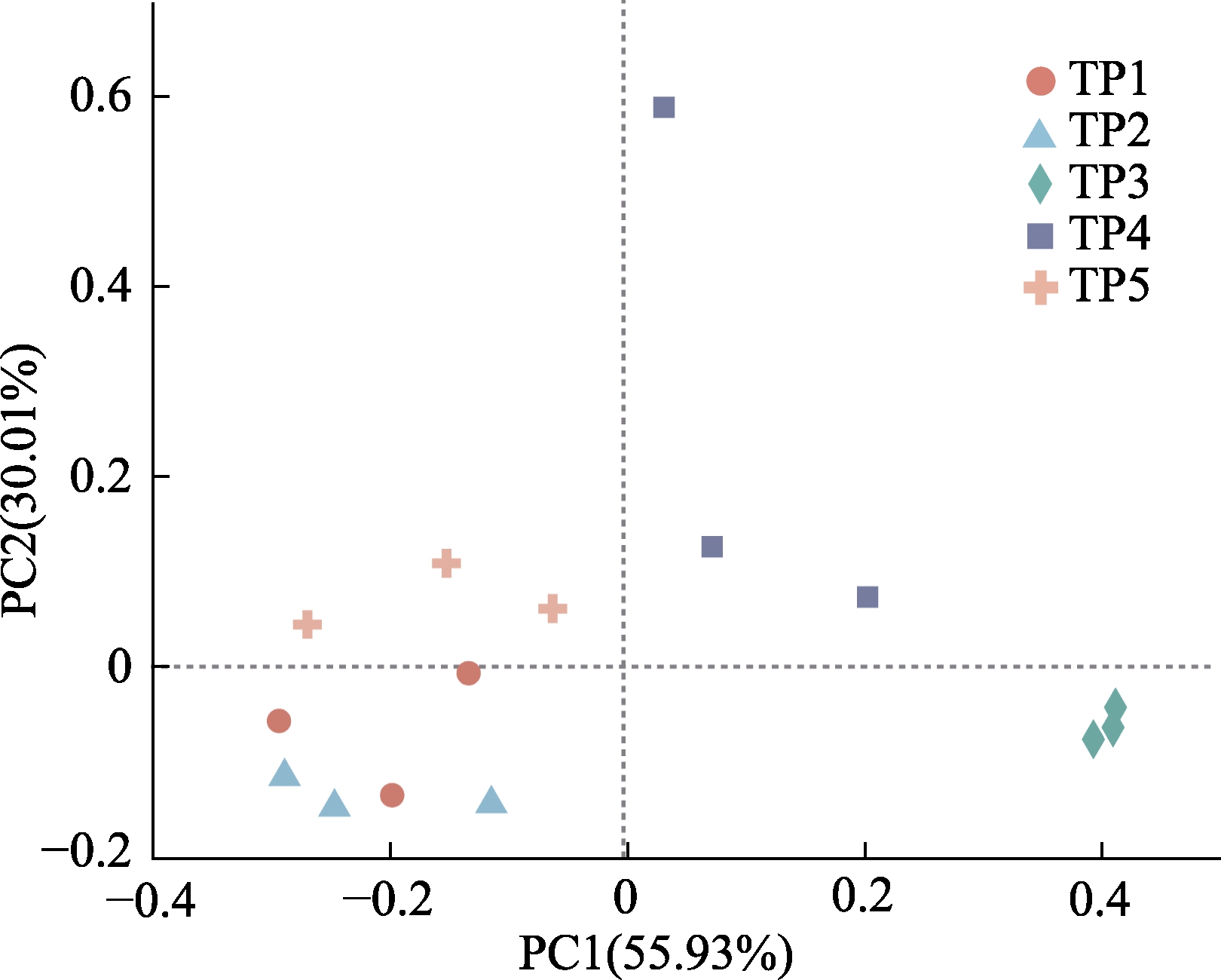
图1 燕麦甜醅真菌PCA图
Fig.1 PCA diagram of fungal community among oats Tianpei samples
2.2 燕麦甜醅真菌群落组成
研究发现,燕麦甜醅样品中毛霉菌门(Mucoromycota)和子囊菌门(Ascomycota)类群含量最高,还有少量担子菌门(Basidiomycota)真菌(图2a)。毛霉真菌作为现代生物炼制的强大细胞工厂,具有多种高产油脂真菌和高值微生物油脂资源[13-14]。子囊菌成员分布广泛,在豆酱等多种发酵食品中占优势[8]。

图2 燕麦甜醅真菌组成图
Fig.2 Diagrams of fungal composition among oats Tianpei samples
注:A.Circos图门水平; B.Circos图属水平; C.维恩图。
Note: A.Circos diagram at phylum level; B.Circos diagram at genus level;C.Venn diagram.
在真菌属水平,燕麦甜醅样品中根霉属(Rhizopus)含量最高,其次是未能准确分类的子囊菌(unclassified_p_Ascomycota),酵母菌属(Saccharomyces)和伊萨酵母属(Issatchenkia)(图2b)。五种甜醅样品共有11个OTUs(图2c),大多隶属于根霉属(Rhizopus)、酵母菌属(Saccharomyces)、伊萨酵母属(Issatchenki)和有孢汉逊酵属母(Hanseniaspora)。根霉(Rhizopus)可被用来固定化发酵产富马酸[15],也是甜酒曲的主要成分,根霉(Rhizopus)可用于固态发酵改善全粒燕麦理化、营养和抗氧化特性[16]。根霉在燕麦甜醅样品TP3中含量最多。酵母菌属(Saccharomyces)在食醋、酿酒等过程中作为生产加工菌广泛被应用[17-18]。伊萨酵母属(Issatchenki)成员多在酒类酿造过程中发现[19]。有孢汉逊酵母(Hanseniaspora)在葡萄皮等中多有发现,能促进葡萄酒香味物质酯类和萜烯类物质的合成[20],还可与酿酒酵母混和酿造低醇葡萄酒[21]。
2.3 燕麦甜醅样品真菌Lefse分析
Lefse被用来识别样品分类群的属性,能很好地解释不同生物条件或环境下的差异,以及这些特征对样本之间差异的影响程度。对于本研究的5种燕麦甜醅样品,通过Lefse分析发现了甜醅相关的真菌生物标志分类群,不同样品间差异显著(图3)。以LDA值> 3为标准进行了真菌标志类群筛选,甜醅样品TP1,TP2和TP4存在显著的真菌标志分类群。燕麦甜醅TP1中存在多个真菌标志分类群,在属水平,包括了毛霉(Mucor)和毕赤酵母(Pichia)。甜醅样品TP2中为复膜酵母(Saccharomycopsis)。TP4中为Apiotrichum和伯林德纳氏酵母(Cyberlindnera)。

图3 燕麦甜醅样品真菌LEfSe分析图
Fig.3 LEfSe diagram of fungal community among oats Tianpei samples
注:A.样品LEfSe图; B.LDA分布图。
Note: A.LEfSe cladogram of different taxa among samples; B.LDA value distribution graph.
本研究中燕麦甜醅样品真菌群落多为根霉和酵母类群,其真菌标志分类群中也多为根霉和酵母类群。毕赤酵母(Pichia)在发酵食品中普遍存在,可酿造泡菜,产乙醇、乙酸、乙酸乙酯等[22]。毕赤酵母(Pichia)还可作为模式菌株用作构建基因编辑工具,用作细胞工厂产生多种物质[23]。复膜酵母(Saccharomycopsis)可用在清香型麸曲白酒生产中[24]。产油酵母真菌Apiotrichum porosum可将挥发性脂肪酸生物转化为脂类[25]。伯林德纳氏酵母(Cyberlindnera)可酿造黄酒,也可作为生香酵母产酯, 还可产生羰基还原酶[26]。
2.4 燕麦甜醅真菌与甜醅性质关系
根据表2中所列的5种甜醅样品的属性,包括乳酸、游离脂肪酸、氨基酸、纤维素、还原糖、蛋白、黄酮和淀粉含量。利用关联分析研究发现,甜醅真菌结构与甜醅性质显著相关(图4)。研究表明其中游离脂肪酸含量和真菌组成相关性与其他测定物质含量和真菌组成的相关性表现相反。Spearman分析发现根霉属(Rhizopus)与甜醅的乳酸含量、蛋白含量、还原糖含量、黄酮含量和氨基酸含量显著相关。而伊萨酵母属(Issatchenkia)和伯林德纳氏酵母属(Cyberlindnera)与游离脂肪酸含量显著相关。燕麦发酵研究多关注乳酸菌等发酵促进燕麦改性,并提升口感风味等方面[4-6]。本研究可为目前较少研究的真菌群落与燕麦甜醅理化性质相关性研究提供参考,也提示我们可以利用相关菌株调控甜醅的性质。通过我们前期研究发现细菌类群魏斯氏属(Weissella)、乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)等和全谷物甜醅性质显著相关[27],今后可进一步研究相关细菌和真菌之间的相互作用以及其在优化甜醅性质方面的复合效应。

图4 db-RDA真菌分析图
Fig.4 db-RDA diagram of fungal community among oats Tianpei samples
注:LA—乳酸;F—黄酮;AA—氨基酸;P—蛋白;S—淀粉;C—纤维素;FA—游离脂肪酸;RS—还原糖。
Note: LA—lactic acid; F—flavonoid; AA—amino acid; P—protein; S—starch; C—cellolose; FA—free fatty acid; RS—reducing sugar.
表2 燕麦甜醅样品化学成分
Table 2 Chemical composition of oats Tianpei samples
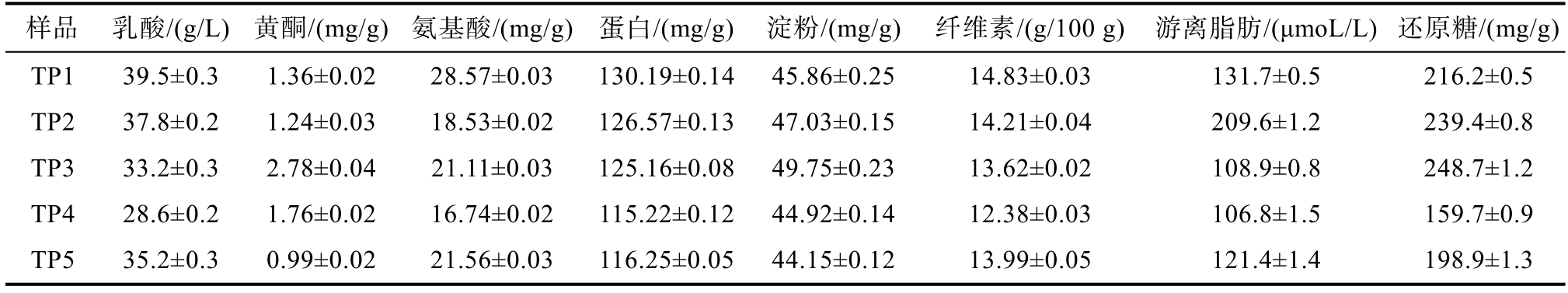
样品 乳酸/(g/L) 黄酮/(mg/g)氨基酸/(mg/g) 蛋白/(mg/g)淀粉/(mg/g)纤维素/(g/100 g)游离脂肪/(μmoL/L) 还原糖/(mg/g)TP1 39.5±0.3 1.36±0.02 28.57±0.03 130.19±0.1445.86±0.2514.83±0.03 131.7±0.5 216.2±0.5 TP2 37.8±0.2 1.24±0.03 18.53±0.02 126.57±0.1347.03±0.1514.21±0.04 209.6±1.2 239.4±0.8 TP3 33.2±0.3 2.78±0.04 21.11±0.03 125.16±0.0849.75±0.2313.62±0.02 108.9±0.8 248.7±1.2 TP4 28.6±0.2 1.76±0.02 16.74±0.02 115.22±0.1244.92±0.1412.38±0.03 106.8±1.5 159.7±0.9 TP5 35.2±0.3 0.99±0.02 21.56±0.03 116.25±0.0544.15±0.1213.99±0.05 121.4±1.4 198.9±1.3
2.5 米根霉发酵对甜醅性质的影响
多样性分析发现,燕麦甜醅真菌群落中根霉属(Rhizopus)丰度最高,因此研究利用其代表菌株米根霉(Rhizopus oryzae),进行发酵全谷物燕麦制作甜醅。并对发酵过程中甜醅的一些化学成分进行了测定(图5)。25 ℃发酵从0 h到96 h,乳酸、纤维素、还原糖含量从0 h至72 h一直上升并在72 h到达最高值,而淀粉含量却相反,应为发酵过程中淀粉被分解导致。与未进行发酵相比,发酵显著提高了甜醅相关化学成分含量。米根霉(Rhizopus oryzae)发酵可以改善全粒燕麦理化、营养和抗氧化等特性[23]。米根霉(Rhizopus oryzae)可以分泌大量糖化酶,使得还原糖含量明显增加[28],并且较高量的还原糖在增加燕麦甜醅的甘甜口感的同时可以延长其存储时间[28-29]。另外,有研究报道48 h时,米根霉数量最高,淀粉酶活力均达到峰值,12~60 h内,还原糖含量明显增加[28];发酵温度为30 ℃,发酵时间48 h时,还原糖的含量为23.9%[28]。这与本研究发酵72 h大多化学成分达到最高值略有差别,与本发酵实验为温度较低(25 ℃)、未加入酵母、曲霉等其他菌株协同互作因素有关,今后需进一步开展相关优化研究。

图5 米根霉发酵燕麦甜醅中化学成分变化图
Fig.5 Chemical composition change diagram of Rhizopus oryzae fermented for oats Tianpei
注:A.乳酸;B.淀粉;C.纤维素;D.还原糖。
Note: A.lactic acid; B.starch; C.cellulose; D.reducing sugar.
3 结论
本研究对西北地区5种代表性燕麦甜醅样品的真菌微生物多样性进行了研究,结果表明:甜醅样品中毛霉菌门(Mucoromycota)和子囊菌门(Ascomycota)丰度最高。根霉属(Rhizopus)含量最高。β多样性分析显示5种样品甜醅样品形成独自的真菌群落结构。燕麦甜醅样品的真菌生物标志分类群包括毛霉(Mucor)和毕赤酵母(Pichia)等。燕麦甜醅真菌组成与甜醅性质显著相关。米根霉发酵燕麦可显著提高甜醅化学成分含量,25 ℃下发酵72 h时大多的甜醅化学成分含量达到最高值。今后可进一步结合甜醅细菌相关研究,开展菌株复配优化以提升甜醅品质,并根据不同发酵阶段的组学研究等阐明微生物在甜醅营养功能物质和风味形成中的作用。
[1] 史晓萌, 陈建国, 党艳婷, 等.响应曲面法优化燕麦甜醅发酵工艺的研究[J].食品工业, 2018, 39(4): 88-92.SHI X M, CHEN J G, DANG Y T, et al.Optimization of fermentation technology of sweet fermented oat by response surface methodology[J].Food Industry, 2018, 39(4): 88-92.
[2] 高昆, 朱宪铭.益生菌发酵青稞甜醅的生产技术[J].青海科技, 2020, 27(1): 26-27.GAO K, ZHU X M.Production technology of probiotics fermented sweet fermented naked barley[J].Qinghai Technology,2020, 27(1): 26-27.
[3] 张伟彬, 袁亮.复合酒曲对燕麦发酵甜醅的品质影响[J].食品工业, 2019, 40(10): 48-51.ZHANG W B, YUAN L.The quality influence of compound distiller’s yeast to oats fermented sweet grains[J].Food Industry,2019, 40(10): 48-51.
[4] WRONKOWSKA M, ROSTEK D, LENKIEWICZ M, et al.Oat flour fermented by Lactobacillus strains-Kinetics of volatile compound formation and antioxidant capacity[J].Journal of Cereal Science, 2021, 103, 103392.
[5] MASIÁ C, GEPPEL A, JENSEN P E, et al.Effect of Lactobacillus rhamnosus on physicochemical properties of fermented plantbased raw materials[J].Foods, 2021, 10(3): 573.
[6] APARICIO-GARCÍA N, MARTÍNEZ-VILLALUENGA C,FRIAS J, et al.Production and characterization of a novel gluten-free fermented beverage based on sprouted oat flour[J].Foods, 2021, 10(1): 139.
[7] HU X, DU H,REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental Microbiology, 2016, 82: 2506-2515.
[8] REN F, YAN D H, LIU Y C, et al.Bacterial and fungal communities of traditional fermented Chinese soybean paste(doujiang) and their properties[J].Food Science and Nutrition,2021, 9: 5457-5466.
[9] CHEN S, ZHOU Y, CHEN Y, et al.Fastp: an ultra-fast all-inone FASTQ preprocessor[J].Bioinformatics, 2018, 34(17): i884-i890.
[10] MAGOČ T, SALZBERG S L.FLASH: fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011, 27(21): 2957-2963.
[11] EDGAR R C.UPARSE: highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods, 2013, 10(10):996-998.
[12] WANG Q, GARRITY G M, TIEDJE J M, et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied Environment Microbiology,2007, 73(16): 5261-5267.
[13] ZHAO H, LV M, LIU Z, et al.High-yield oleaginous fungi and high-value microbial lipid resources from Mucoromycota[J].BioEnergy Research, 2020, 14: 1-11.
[14] DZURENDOVA S, LOSADA C B, DUPUY G, et al.Mucoromycota fungi as powerful cell factories for modern biorefinery[J].Applied Microbiology and Biotechnology, 2021,106: 1-15.
[15] 赵士杰.少根根霉固定化发酵生产富马酸的工艺研究[D].北京: 北京化工大学, 2019.ZHAO S J.Study on the process of immobilized fermentation of fumaric acid from Rhizopus arrhizus[D].Beijing: Beijing University of chemical technology, 2019.
[16] WU H, LIU H N.Synergetic effects of Lactobacillus plantarum and Rhizopus oryzae on physicochemical, nutritional and antioxidant properties of whole-grain oats (Avena sativa L.)during solid-state fermentation[J].LWT-Food Science and Technology, 2022, 154: 112687.
[17] 胡超凡.古法手酿绍兴黄酒发酵微生态及功效组分解析[D].杭州: 浙江大学, 2021.HU C F.Study on fermentation microflora and functional components of Shaoxing traditionally handmade rice wine[D].Hanzhou: Zhejiang University, 2021.
[18] 李敏.夏冬两季食醋微生物群落演替特征及其特征微生物研究[D].太原: 太原理工大学, 2019.LI M.Succession characteristics of microbiota and characteristic microbes in vinegar brewing during summer and winter[D].Taiyuan: Taiyuan University of Technology, 2019.
[19] 刘婷婷.白云边酒酿造微生物分析及东方伊萨酵母发酵特性研究[D].武汉: 武汉工业学院, 2011.LIU T T.Brewing microbes analyzing and fermentation study of Issatchenkia Orientalis in Baiyunbian liquor[D].Wuhan: Wuhan Polytechnic University, 2011.
[20] 申静云, 刘沛通, 段长青, 等.不同有孢汉逊酵母与酿酒酵母混合发酵对威代尔冰葡萄酒香气的影响[J].食品与发酵工业,2017, 43(10): 16-23.SHEN J Y, LIU P T, DUAN C Q, et al.Effects of mixed fermentation by different Hanseniaspora genus yeasts and Saccharomyces cerevisiae on the aroma compounds in Vidal ice wine[J].Food and Fermentation Industries, 2017, 43(10): 16-23.
[21] 崔艳, 刘尚, 邓琪缘, 等.葡萄汁有孢汉逊酵母与酿酒酵母混酿低醇葡萄酒[J].食品工业, 2020, 41(8): 60-64.CUI Y, LIU S, DENG Q Y, et al.Mixed fermentation of hanseniaspora uvarum and saccharomyces cerevisiae for low alcohol white wine[J].Food Industry, 2020, 41(8): 60-64.
[22] 毕娈娈, 邱勋瀚, 曾思连, 等.泡菜水中产生物表面活性剂酵母菌株的筛选[J].微生物学通报, 2022, 49(1): 153-162.BI L L, QIU X H, ZENG S L, et al.Screening of yeast with biosurfactant production from pickled vegetables[J].Microbiology China, 2022, 49(1): 153-162.
[23] 陈鑫洁, 钱芷兰, 刘启, 等.毕赤酵母底盘芳香族氨基酸合成途径改造生产肉桂酸及对香豆酸[J].中国生物工程杂志,2021, 41(10): 52-61.CHEN X J, QIAN Z L, LIU Q, et al.Modification of aromatic amino acid synthetic pathway in Pichia pastoris to produce cinnamic acid and ρ-coumaric acid[J].China Biotechnology,2021, 41(10): 52-61.
[24] 马美荣, 刘小改, 李洪媛, 等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技, 2021, 42(21): 133-13912.MA M R, LIU X G, LI H Y, et al.The application of two kinds of saccharomycopsis fibuligera in mild-flavour fuqubaijiu production[J].Science and Technology of Food Industry, 2021,42(21): 133-139.
[25] QIAN X, ZHOU X, CHEN L et al.Bioconversion of volatile fatty acids into lipids by the oleaginous yeast Apiotrichum porosum DSM27194[J].Fuel, 2021, 290: 119811.
[26] 肖美娟, 朱治任, 刘月旺, 等.响应面法优化羰基还原酶产生菌Cyberlindnera saturnus发酵培养基[J].生物加工过程,2021, 19(1): 47-53.XIAO M J, ZHU Z R, LIU Y W, et al.Medium optimization for carbonyl reductase producing strain Cyberlindnera saturnus by response surface methodology[J].Chinese Journal of Bioprocess Engineering, 2021, 19(1): 47-53.
[27] 任菲, 谭斌, 刘明, 等.传统甜醅细菌多样性及其与甜醅性质关系研究[J].粮油食品科技, 2023, 31: 145-153.REN F, TAN B, LIU M, et al.Bacterial diversity and their correlations with the properties of traditional Tianpei from China[J].Science and Technology of Cereals, Oils and Foods,2023, 31(4): 145-153.
[28] 史晓萌, 陈建国, 梁寒峭, 等.燕麦发酵过程中微生物、理化指标及活性成分变化规律[J].食品与发酵工业, 2018, 44: 49-52.SHI X M, CHEN J G, LIANG H Q, et al.Analysis of microorganism, physicochemical parameters and active components during fermentation of oats[J].Food and Fermentation Industries, 2018, 44: 49-52.
[29] 任飞, 韩珍琼.甜酒酿发酵机理的初步研究[J].中国酿造,2012, 31: 140-143.REN F, HAN Z Q.Study on the fermentation mechanism of rice wine[J].China Brewing, 2012,2012, 31: 140-143.
备注:文中所有菌株属名和种名为拉丁名,均为斜体;本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。