研究表明,食用全谷物具有降低患心血管疾病、肥胖、癌症和II型糖尿病的风险以及改善肠道消化吸收能力等多种益处[1],对健康有积极影响。全谷物基本组成包括谷粒的胚乳、胚芽与麸皮,其健康功效主要归因于谷物麸皮中含有的功能性成分[2]。黑小麦具有很高的营养价值,是常见的健康谷物原料。麸皮是黑小麦面粉加工的副产物,含量约为籽粒重量的22%~25%[3]。除六大营养素外,黑小麦麸皮因其所富含的天然成分(如多酚类物质、膳食纤维、抗营养因子、烷基间苯二酚等)具有生理活性功能被广泛研究[3-5],成为功能性食品的重要谷物来源。
多酚类物质作为重要的天然活性成分之一,具有抗氧化、抑菌、抗癌、保护心脑血管健康以及降低血脂血糖等多种功能[6-8]。植物多酚是一大类植物的次生代谢产物,种类繁多,结构复杂。目前已发现了8 000多种[9]多酚类物质,但至今还没有一种统一的分类体系,分类方法多样。若根据化学结构分类,其可分为五类,包括酚酸类化合物、黄酮类化合物、木酚素、二苯乙烯和其他酚类化合物,其中最常见的是黄酮类化合物和酚酸类化合物[10]。据报道[11],黑小麦中具有生理活性的多酚类物质主要存在于其麸皮中。
随着人们对全谷物营养保健功能的认识增长,全谷物食品的研究开发逐渐兴起。仅使用黑小麦全麦粉或麸皮粉制成的面制品口感较差,食用口味欠佳,虽然有着一定的营养保健效果,依旧得不到大部分人的喜爱[12]。针对以上问题,不少学者已经开始以黑小麦及其加工副产物为原料开发新种类功能性食品,并着力于研究黑小麦及其麸皮的深加工[13-15]。
当前,国内外对于黑小麦及其麸皮的研究主要针对于天然活性物质的提取利用及其生理活性功能的评估。Kaszuba等[16]提取了黑小麦中的酚酸类物质,并用于面包配方改良,郝教敏等[17]利用黑小麦多酚提取物的抗氧能力延长了猪肉丸保质期,Dornan等[18]提取了黑小麦中的烷基间苯二酚,研究了其在慢性疾病中的生理作用。截至目前已有的文献报道[19],有机溶剂提取是多酚提取的主要方法之一,但由于有机溶剂提取方法的局限性,提取的黑小麦麸皮多酚通常是粗提物,其中含有糖类、蛋白质等非酚类物质,成分复杂,纯度有限,限制了麸皮多酚在食品行业的应用。目前对黑小麦麸皮中天然活性物质提取物的纯化工艺的优化及组成成分鉴定分析的系统性研究较少。
随着食品科学与技术的发展,黑小麦及其麸皮制品将会是谷物食品中不可缺少的一部分。对黑小麦麸皮进一步的研究利用,可以增加食品种类的多样性,使黑小麦应用范围不断扩大,能使这一优质谷物资源得到充分利用,以期望能够研发出全新的、具有较高营养价值的全谷物食品,改善人们的膳食结构。
本文通过超声辅助提取黑小麦麸皮中的多酚类物质,并对多酚粗提物的纯化工艺进行优化,以提高最终产品的纯度;同时对黑小麦麸皮中多酚类物质的成分进行分析。以期为之后开发黑小麦麸皮相关食品提供营养健康方面的理论依据、为改善膳食结构、推动特色谷物资源的开发利用提供参考。
1 材料与方法
1.1 实验主要材料与试剂
黑小麦麸皮:源路(内蒙古)食品科技有限公司;没食子酸、无水乙醇、氢氧化钠、盐酸(均为分析纯):国药集团化学试剂有限公司;无水甲醇、乙腈、甲酸(均为色谱纯):国药集团化学试剂有限公司;无水碳酸钠(分析纯)、福林酚试剂、AB-8型大孔吸附树脂:上海源叶生物科技有限公司。
1.2 仪器与设备
电子天平,BSA224S型:德国Sartorius集团;超声波清洗器,SB120-DT型:宁波新芝生物科技股份有限公司;离心机,L550型:湖南湘仪实验室仪器开发公司;涡旋振荡器,VORTEX-3型:德国艾卡公司;电热恒温水浴锅,HWS-24型:上海一恒科学仪器有限公司;多功能酶标仪,Multiscan Go型:美国Thermo Fisher公司;水浴恒温振荡器,HZ-9212SB型:太仓市华利达实验设备有限公司;循环水真空泵,SHZ-95A型:上海子期实验设备有限公司;恒流泵,HL-2S型:河南省郑州市南北仪器有限公司;离子交换柱,Φ3×90 cm:南京腾辉实验科技有限公司;旋转蒸发仪,R-300型:瑞士步琦有限公司;冷冻干燥机,LGJ-10E型:北京四环科学仪器厂有限公司;液质联用仪,Waters Quattro Ultima:美国沃特世公司。
1.3 黑小麦麸皮多酚的提取
采用超声波辅助提取法,基于单因素实验,通过响应面法优化提取工艺,按照优化后工艺提取黑小麦麸皮中多酚类物质:提取溶剂为58.5%乙醇溶液,超声时间为39 min,提取3次,料液比为1∶31 g/mL。提取液离心(4 000 r/min,15 min),收集上清液,即为多酚粗提液。粗提液在旋转蒸发仪中蒸发除去乙醇,浓缩液冷冻干燥得黑小麦麸皮多酚粗提物的固体粉末,-20 ℃保存备用。
1.4 多酚含量的测定
采用福林酚比色法测定多酚含量,以没食子酸当量(Gallic Acid Equivalent,GAE)为多酚含量的衡量指标。参考向莉等[20]的测定方法,并稍作修改。
配制没食子酸含量为200 mg/L的溶液作为标准溶液,避光保存备用。
精确吸取0.0、0.2、0.4、0.6、1.0、1.5 mL没食子酸标准溶液于10 mL容量瓶中,分别用60%乙醇溶液定容,得工作液。逐一吸取80 μL工作液于离心管中,依次加入200 μL福林酚试剂,于涡旋振荡器上混合均匀,随后按顺序加入15% Na2CO3溶液200 μL,去离子水320 μL,振荡均匀,于避光处40 ℃水浴加热1 h,静置,待白色沉淀沉降,吸取200 μL上清液于96孔板中,于760 nm波长处测定标准系列溶液的吸光度D760,每个样品三个复孔。
没食子酸标准曲线如图1所示。
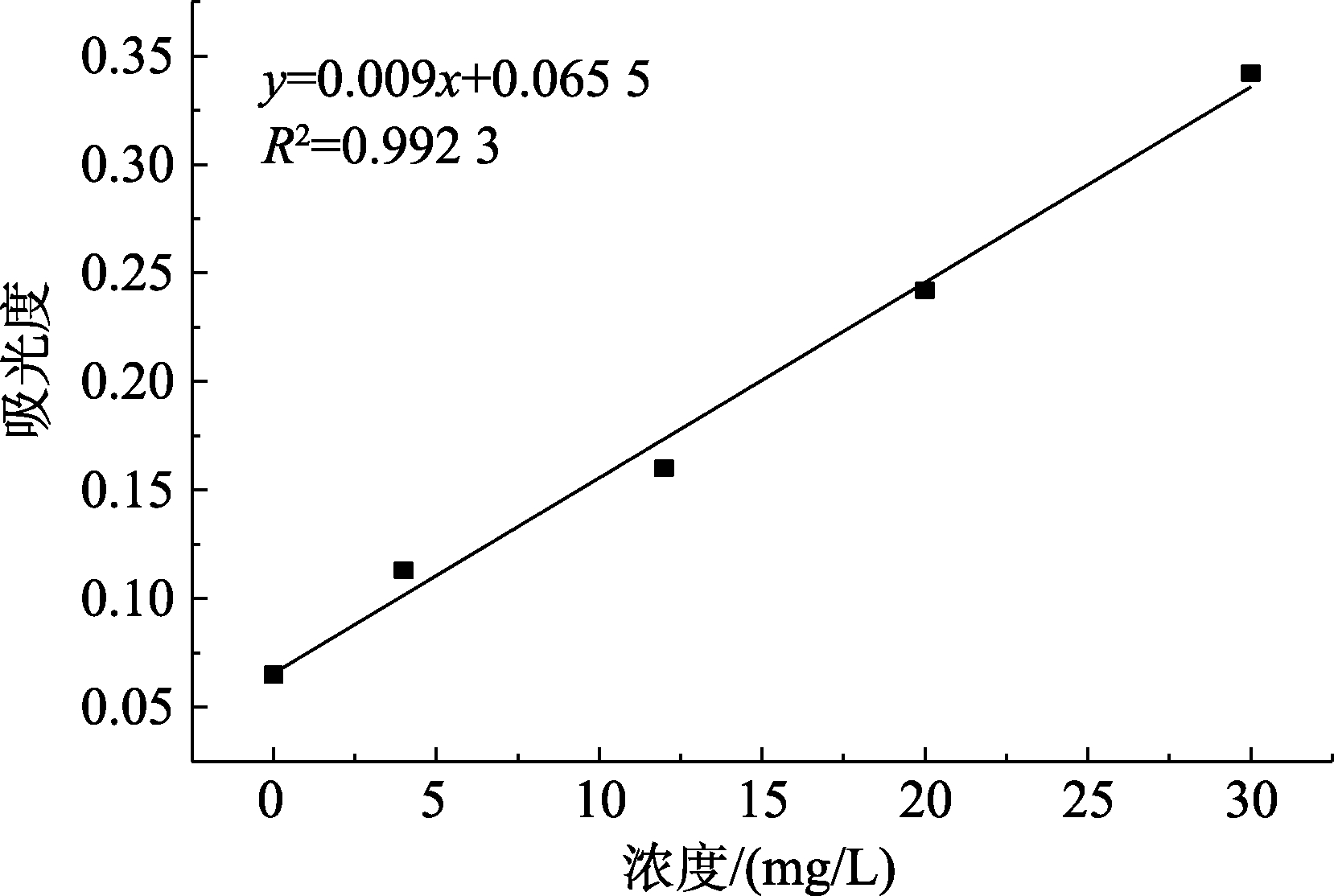
图1 没食子酸溶液标准曲线
Fig.1 Standard curve of gallic acid solution
拟合曲线的线性回归方程y=0.009x+0.065 5,R2=0.992 3,线性关系良好,拟合度较高。提取液多酚含量测定结果表示为每毫克没食子酸当量每升(mg GAE/L)。
1.5 黑小麦麸皮多酚的纯化
1.5.1 大孔树脂的预处理
大孔吸附树脂内部通常会有未聚合的单体、剩余的致孔剂、引起剂、分散剂及防腐剂等杂质存在,所以大孔吸附树脂必须经过预处理后才可使用。AB-8型大孔吸附树脂参考向莉[21]的方法进行预处理,预处理完成后的大孔吸附树脂于去离子水中密封浸泡暂存备用。
1.5.2 大孔树脂静态吸附-解吸实验
1.5.2.1 大孔树脂静态吸附量的测定 粗提物以去离子水复溶。预处理完成的树脂进行抽滤,称取树脂约1.0 g于50 mL离心管中,加10 mL已知初始浓度的粗提物溶液,常温黑暗处振荡处理6 h,测定上清液多酚含量。吸附率按式(1)计算。
式中:Q为吸附率(mg GAE/g);C0为溶液初始多酚含量(mg GAE/L);C1为溶液中剩余多酚含量(mg GAE/L);V为多酚粗提物溶液体积(mL);N为多酚粗提物溶液稀释倍数。W为树脂质量(g)。
1.5.2.2 大孔树脂静态解吸率的测定 抽滤预处理完成的树脂,重复1.5.2.1中操作使树脂吸附饱和。吸附量按公式(2)计算。
抽滤吸附饱和的树脂,用去离子水冲洗。分别使用不同浓度的乙醇溶液解吸洗净并滤干的树脂,常温黑暗处振荡处理6 h,测定上清液多酚含量。解吸率按照公式(3)计算。
式中:Qs为吸附量(mg GAE);C0为溶液初始多酚含量(mg GAE/L);C1为溶液中剩余多酚含量(mg GAE/L);V为多酚粗提物溶液体积(mL);N为多酚粗提物溶液稀释倍数。

式中:F为解吸率(%);C为解吸液中多酚含量(mg GAE/L);V为解吸液体积(mL);N为解吸液稀释倍数;Qs为吸附量(mg GAE)。
1.5.3 大孔树脂动态吸附-解吸实验
1.5.3.1 进样流速 预处理后的树脂湿法装柱。多酚粗提物溶液的质量浓度为1.20 mg/mL,在进样流速分别设置为1.00、1.50、2.00 mL/min的条件下进样,进样体积为200 mL,每10 mL收集一次流出液,测定每10 mL流出液中的多酚含量(mg GAE/L)。绘制大孔树脂动态吸附泄漏曲线以分析不同进样流速下树脂的吸附情况。
1.5.3.2 洗脱液流速 预处理后的树脂湿法装柱。多酚粗提物溶液的质量浓度为1.20 mg/mL,设置进样流速为1.50 mL/min开始进样,进样体积为150 mL,令树脂吸附至饱和。树脂吸附完成后,通入去离子水清洗,去除树脂表面杂质,至树脂柱上方液层无色为止。以60%乙醇溶液洗脱,流速分别设置为1.00、2.00、3.00 mL/min,洗脱溶剂用量为250 mL。同1.5.3.1中操作收集流出液,绘制大孔树脂动态解吸曲线以分析不同洗脱液流速下树脂的解吸情况。
1.5.4 多酚纯度的测定
提取物以去离子水复溶,测定多酚含量并参照田富林[22]的方法,按照公式(4)计算提取物的多酚纯度。

式中:P为多酚纯度(%);C为复溶液中多酚含量(mg GAE/L);C1为复溶液质量浓度(mg/L)。
1.6 液相色谱与质谱联用(LC-MS)测定方法
1.6.1 待测样品溶液的制备
按照优化后的大孔树脂纯化工艺纯化多酚粗提物。纯化后所得的溶液在旋转蒸发仪中蒸发至无液体残留,用1 mL色谱级甲醇复溶,-4 ℃保存备用。
1.6.2 液相色谱条件
进样体积为2 μL;流动相A为乙腈;流动相B为125 mM甲酸;流动相梯度洗脱程序见表1。
表1 流动相梯度洗脱程序
Table 1 Mobile phase gradient elution procedure
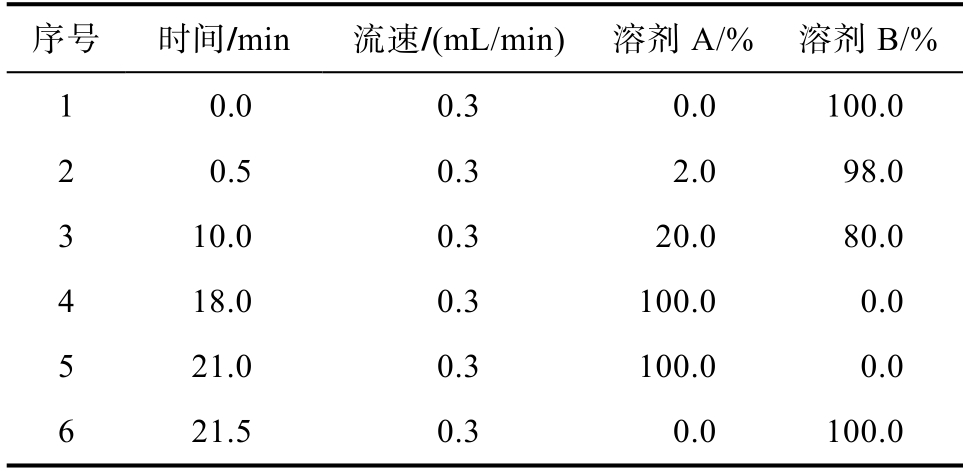
序号时间/min流速/(mL/min) 溶剂A/% 溶剂B/%1 0.0 0.3 0.0 100.0 2 0.5 0.3 2.0 98.0 3 10.0 0.3 20.0 80.0 4 18.0 0.3 100.0 0.0 5 21.0 0.3 100.0 0.0 6 21.5 0.3 0.0 100.0
1.6.3 质谱条件
离子化方式:电喷雾离子源(ESI);极性:ESI-;毛细管电压: 2.50 kV;源温度:120 ℃;脱溶剂温度:450 ℃;锥形气体流量:50 L/h;脱溶剂气体流量:800 L/h;检测模式:多反应检测(MRM)。
1.7 数据处理
通过Excel 2019软件进行数据计算处理与统计分析;Origin 2019软件进行绘图。实验结果用平均值±标准差来表示。图像中不同的小写字母表示多酚得率随影响因素的变化差异显著(P<0.05)。通过Masslynx4.1软件、Waters UNIFI软件对谱图进行处理。
2 结果与讨论
2.1 大孔树脂静态吸附-解吸实验结果分析
2.1.1 样品溶液质量浓度的选择
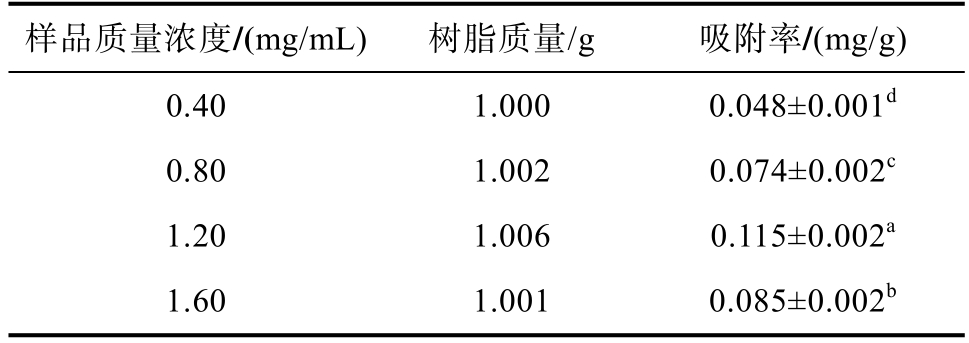
根据公式(1)计算出的树脂对不同质量浓度样品溶液的吸附率,结果如表2所示。
表2 大孔树脂静态吸附实验
Table 2 Static adsorption experiment of macroporous resin
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),a代表最大值,测试取3次平均值。
Note: The values in the table are the means±standard deviation.Different letters in the same column indicate significant differences(P<0.05).Letter a represents the maximum value.All tests were performed at three replicates.
样品质量浓度/(mg/mL) 树脂质量/g 吸附率/(mg/g)0.40 1.000 0.048±0.001d 0.80 1.002 0.074±0.002c 1.20 1.006 0.115±0.002a 1.60 1.001 0.085±0.002b
不同质量浓度样品溶液对树脂吸附率的影响如图2所示。
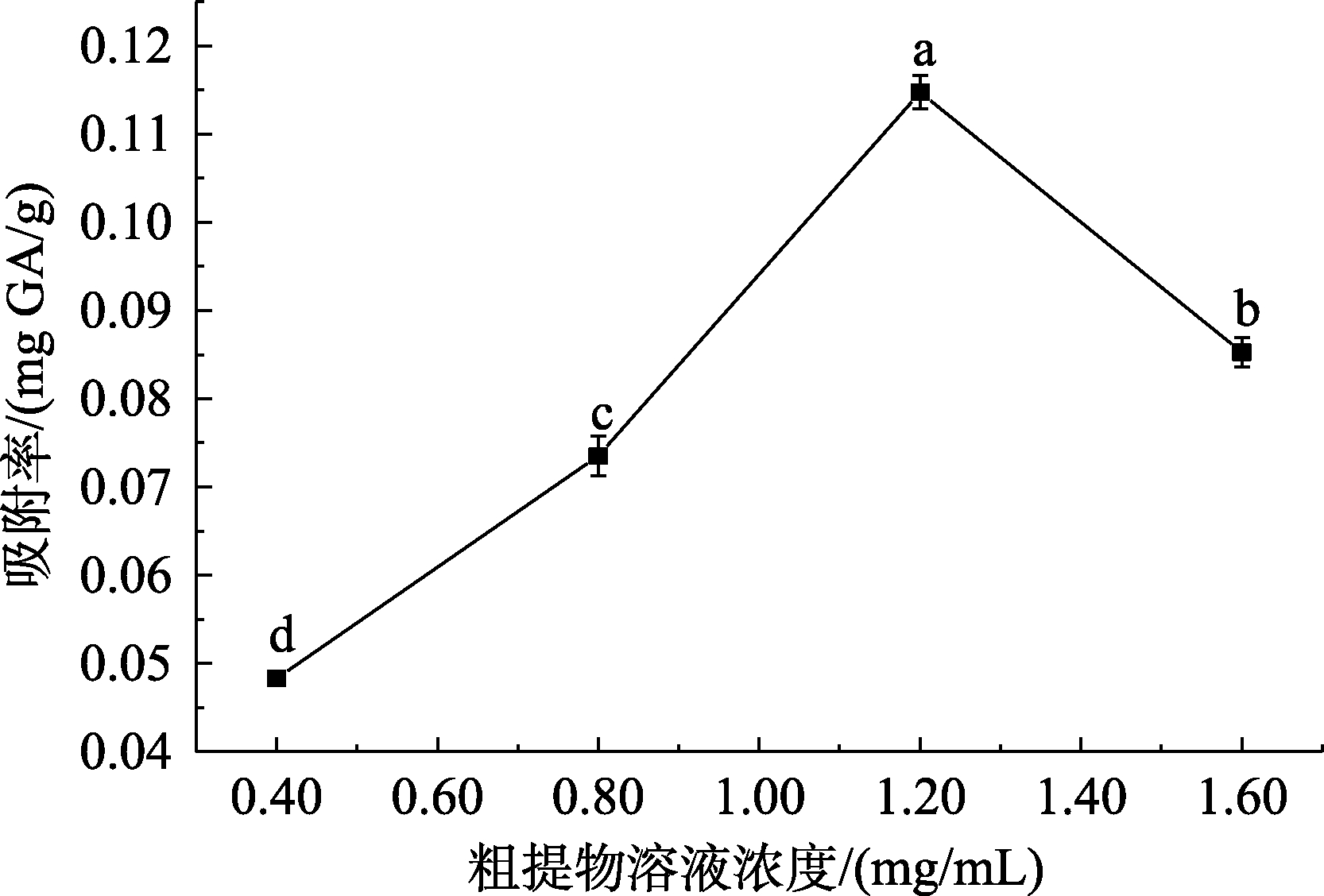
图2 样品溶液浓度对吸附率的影响
Fig.2 Effects of sample solution concentration on adsorption rate
分析表2与图2可知,在0.40~1.20 mg/mL范围内,大孔树脂随着样品溶液质量浓度的增加吸附率上升,符合吉布斯吸附等温式规律;质量浓度超过一定范围后,由于杂质增多,与多酚类物质存在竞争吸附,导致多酚类物质不能充分与树脂内表面接触。故样品溶液进样时质量浓度选择1.20 mg/mL较为合适。
2.1.2 乙醇溶液浓度的选择
根据公式(2)计算出的树脂对0.80 mg/mL样品溶液的吸附量、公式(3)计算出的不同浓度乙醇溶液对树脂的解吸率,计算结果如表3所示。
表3 大孔树脂静态解吸实验
Table 3 Static desorption experiment of macroporous resin
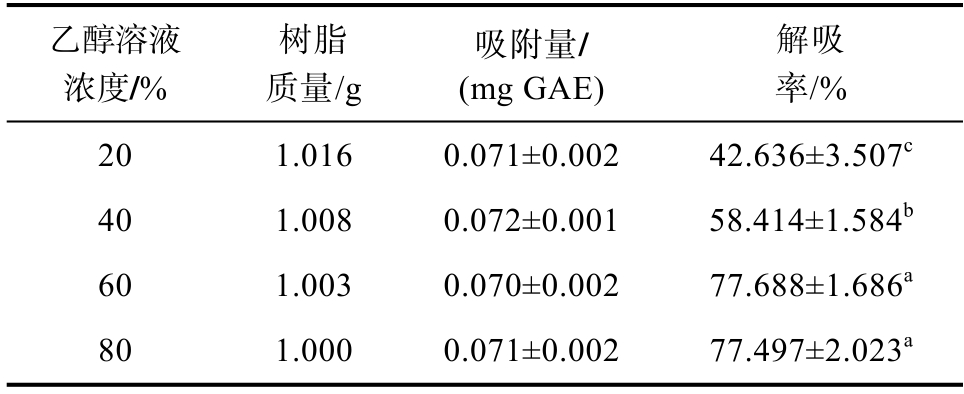
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),a代表最大值,测试取3次平均值。
Note: The values in the table are the means±standard deviation.Different letters in the same column indicate significant differences(P<0.05).Letter a represents the maximum value.All tests were performed at three replicates.
乙醇溶液浓度/%树脂质量/g吸附量/(mg GAE)解吸率/%20 1.016 0.071±0.002 42.636±3.507c 40 1.008 0.072±0.001 58.414±1.584b 60 1.003 0.070±0.002 77.688±1.686a 80 1.000 0.071±0.002 77.497±2.023a
不同浓度乙醇溶液对树脂的静态解吸率的影响如图3所示。
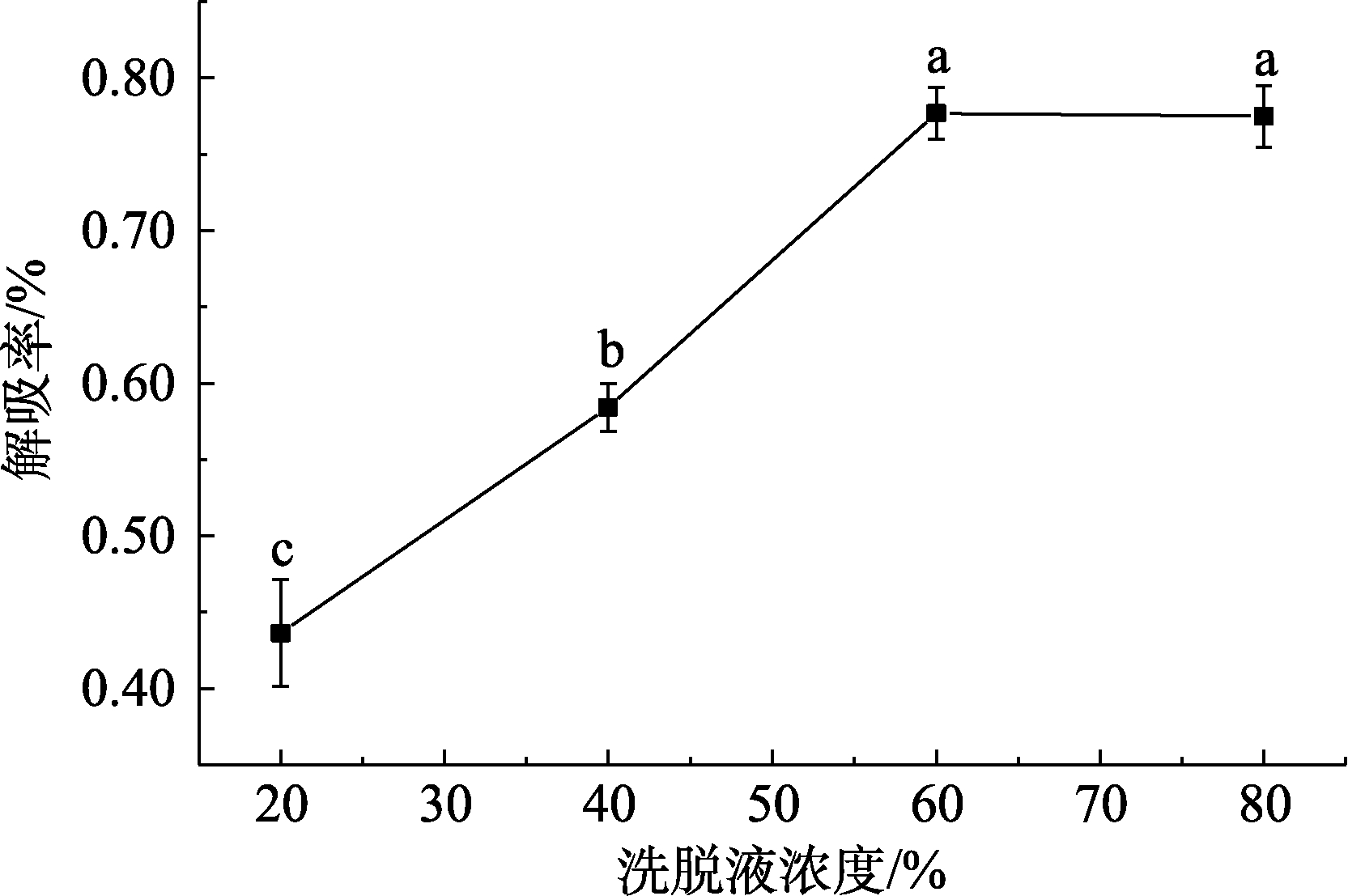
图3 不同浓度乙醇溶液对树脂的静态解吸率的影响
Fig.3 Effects of different concentration of ethanol solution on static desorption rate of resin
由表3与图3可知,浓度越高的乙醇溶液对树脂吸附的多酚的洗脱效果越好。但浓度超过60%后,对树脂解吸率的上升影响并不显著。考虑到经济效益与浓缩效率,选择浓度60%的乙醇溶液作为洗脱溶剂。
2.2 大孔树脂动态吸附-解吸实验结果分析
2.2.1 进样流速的选择
不同进样流速下大孔树脂动态吸附泄漏曲线如图4所示。
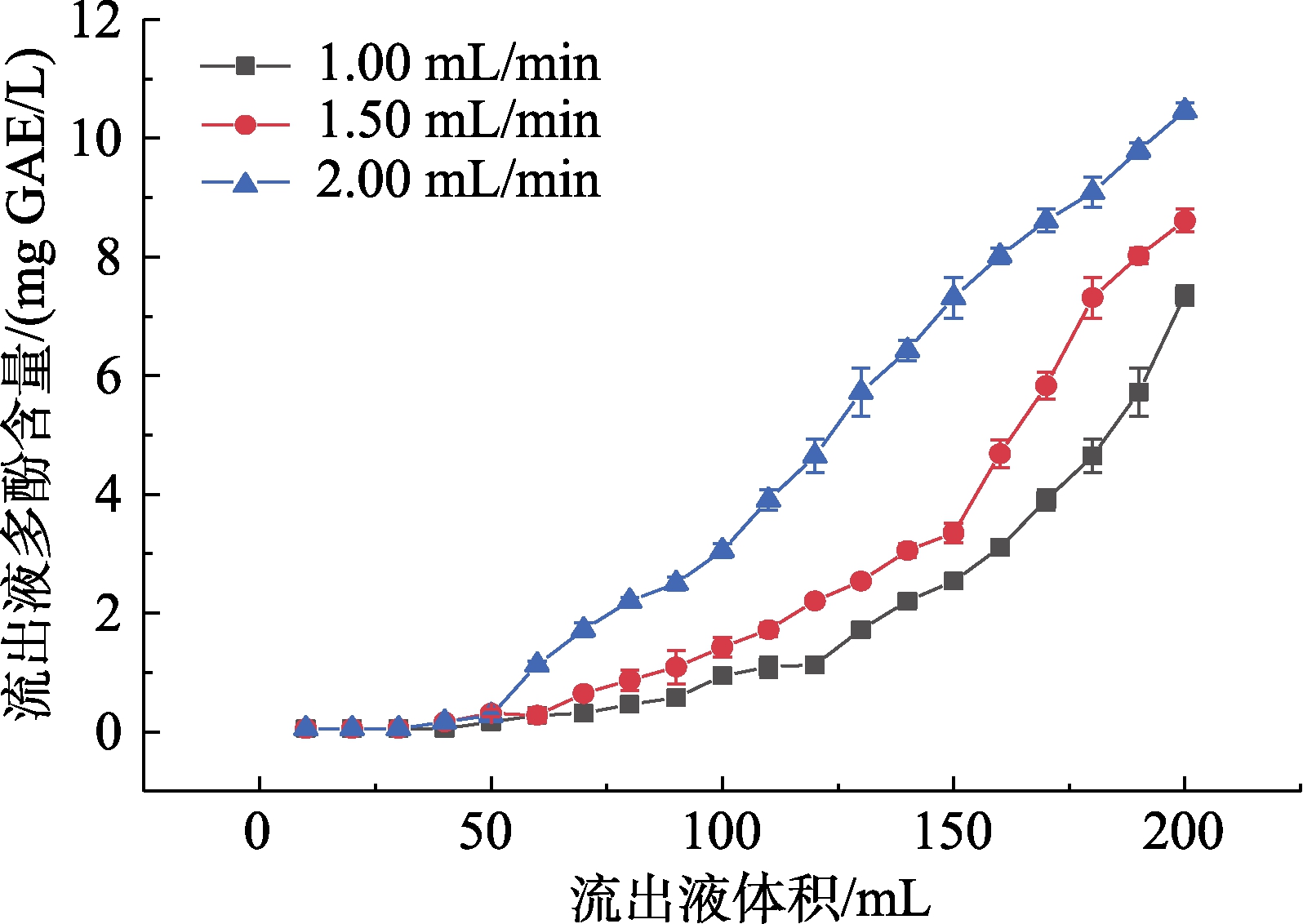
图4 不同进样流速下大孔树脂动态吸附泄漏曲线
Fig.4 Dynamic adsorption and leakage curves of macroporous resin at different injection flow rates
当流出液中多酚含量为进样液多酚浓度的10%时,认为达到泄露点,树脂吸附能力下降,此时的进样溶液体积被认为是最佳上柱体积[22]。由图4可知,当进样体积达到最佳上柱体积时,进样流速为1.00、1.50、2.00 mL/min的树脂吸附量分别约为4.82、4.49、3.01 mg GAE。综合分析吸附量和动态吸附泄漏曲线,进样流速过低会导致吸附时间长,工作效率过低;流速过高时,溶液中的多酚类物质会随溶液直接流出,无法被树脂充分吸附。最终进样流速定为1.50 mL/min。
2.2.2 洗脱溶剂流速的选择
不同洗脱速度下大孔树脂动态解吸曲线如图5所示。
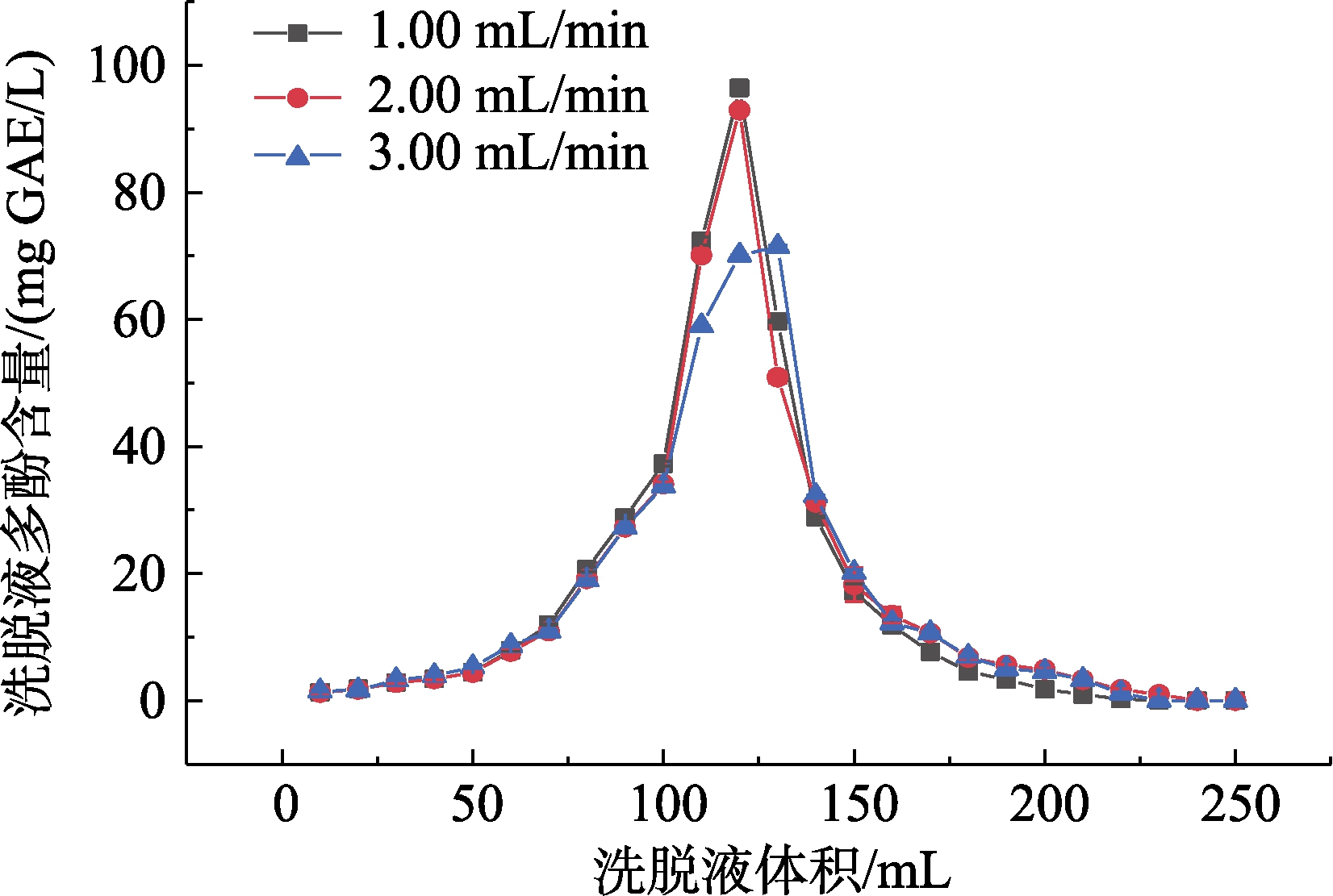
图5 不同洗脱液流速下大孔树脂动态解吸曲线
Fig.5 Dynamic desorption curves of macroporous resin at different eluent flow rates
根据公式(2)计算出在最佳上柱体积进样,进样流速1.50 mL/min,进样溶液质量浓度1.20 mg/mL条件下,树脂吸附量约为(4.49±0.02)mg GAE。结合图5可知,洗脱溶剂流速为1.00、1.50、2.00 mL/min时,洗脱量分别约为4.25、4.23、4.12 mg GAE,则洗脱率分别约为94.65%、94.00%、91.31%。洗脱溶剂流速提高,则洗脱量、洗脱率随之降低,说明高流速不利于洗脱。这是因为在洗脱溶剂流速较高的情况下,溶剂无法充分进入树脂的孔缝,导致多酚无法充分溶解,在洗脱液中被带出。考虑工作效率与洗脱效果,故选择洗脱溶剂流速为1.50 mL/min。
2.3 多酚纯度的测定结果
较优纯化条件下,纯化前后的多酚纯度分别为2.60%±0.28%、14.27%±0.13%,纯化后多酚纯度约为纯化前的5.48倍,有效纯化了黑小麦麸皮中的多酚提取物。
2.4 液相色谱与质谱联用(LC-MS)结果分析
对于纯化后的黑小麦麸皮多酚,通过Waters UNIFI软件数据库分析色谱及质谱图,与各物质的特征离子比对,可以鉴定出黑小麦麸皮中存在的部分多酚类物质,如表4所示。
表4 黑小麦麸皮中存在的多酚类物质
Table 4 Polyphenols in black wheat bran
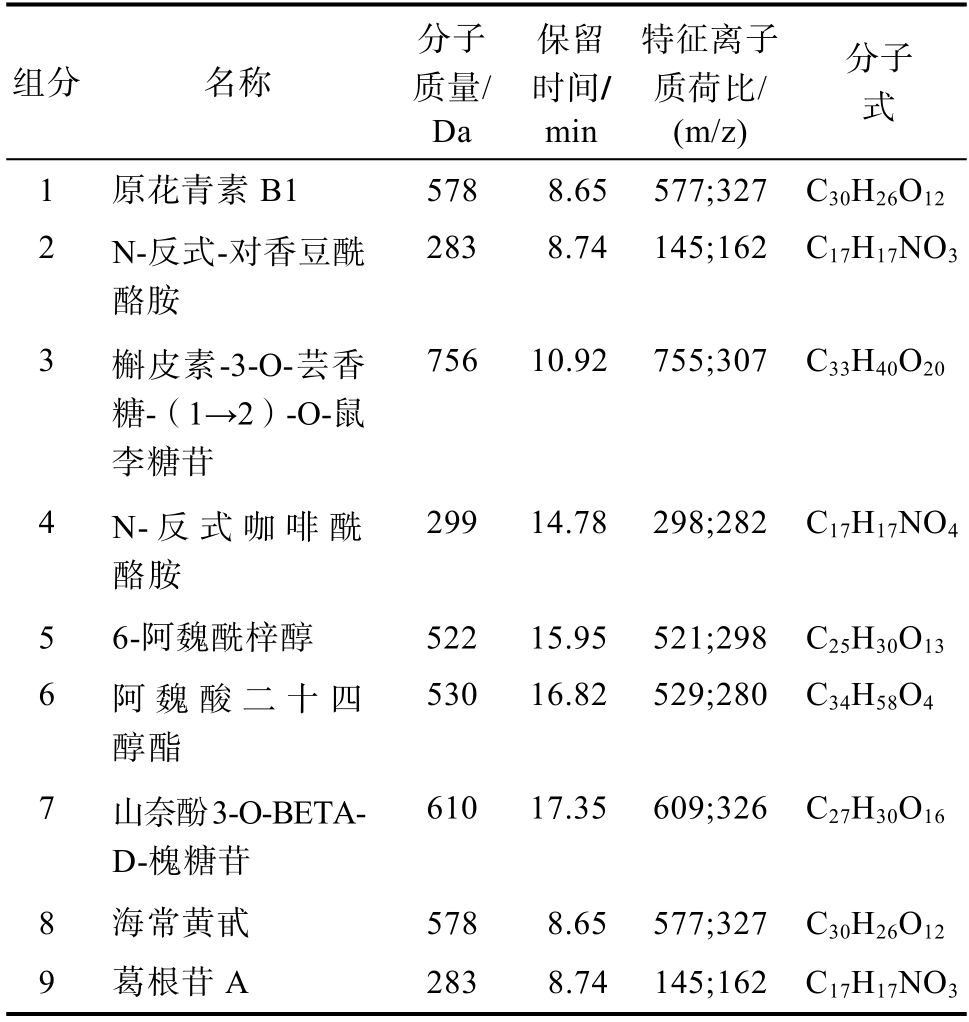
组分 名称分子质量/Da保留时间/min特征离子质荷比/(m/z)分子式1 原花青素B1 578 8.65 577;327 C30H26O12 2 N-反式-对香豆酰酪胺283 8.74 145;162 C17H17NO3 3 槲皮素-3-O-芸香糖-(1→2)-O-鼠李糖苷756 10.92 755;307 C33H40O20 4 N-反式咖啡酰酪胺299 14.78 298;282 C17H17NO4 5 6-阿魏酰梓醇 522 15.95 521;298 C25H30O13 6 阿魏酸二十四醇酯530 16.82 529;280 C34H58O4 7 山奈酚3-O-BETAD-槐糖苷610 17.35 609;326 C27H30O16 8 海常黄甙 578 8.65 577;327 C30H26O12 9 葛根苷A 283 8.74 145;162 C17H17NO3
采用液相色谱与质谱联用(LC-MS),经过Masslynx4.1与Waters UNIFI软件处理,结合Waters数据库,推测出了黑小麦麸皮中所含的九种多酚类物质:原花青素B1、N-反式-对香豆酰酪胺、槲皮素-3-O-芸香糖-(1→2)-O-鼠李糖苷、N-反式咖啡酰酪胺、6-阿魏酰梓醇、阿魏酸二十四醇酯、山奈酚3-O-BETA-D-槐糖苷、海常黄甙、葛根苷A。九种多酚类物质里面,原花青素B1、N-反式-对香豆酰酪胺、槲皮素-3-O-芸香糖-(1→2)-O-鼠李糖苷、山奈酚3-O-BETA-D-槐糖苷是黄酮类化合物,共有4种黄酮类物质。N-反式咖啡酰酪胺、6-阿魏酰梓醇、阿魏酸二十四醇酯是酚酸衍生物,根据其结构分析并结合孙元琳等[23]报道,咖啡酸与阿魏酸在麸皮中主要以结合态存在,其与纤维素、脂蛋白等紧密结合,只有小部分衍生物能被提取,大部分会保留在提取过后的麸皮残渣中。
3 结论
本研究以黑小麦麸皮为原料,通过超声辅助提取麸皮多酚,以AB-8型大孔吸附树脂作为吸附剂,采用乙醇溶液作为解吸溶剂,对粗提物进行纯化,确定了合适的进样浓度、洗脱溶剂浓度、进样流速和洗脱液流速。保证纯化效果的同时,考虑到工作效率和经济效益,最终确定较优的纯化条件为:进样浓度1.20 mg/mL、进样流速1.50 mL/min、洗脱溶剂浓度60%、洗脱速度1.50 mL/min。在较优条件下,纯化前后的多酚纯度分别为2.60%±0.28%、14.27%±0.13%,纯化后多酚纯度约为纯化前的5.48倍,有效地纯化了黑小麦麸皮中的多酚提取物。通过LC-MS技术,检测出了黑小麦麸皮多酚提取物中所含的九种多酚类物质:原花青素B1、N-反式-对香豆酰酪胺、槲皮素-3-O-芸香糖-(1→2)-O-鼠李糖苷、N-反式咖啡酰酪胺、6-阿魏酰梓醇、阿魏酸二十四醇酯、山奈酚3-O-BETA-D-槐糖苷、海常黄甙、葛根苷A。以上结论为黑小麦麸皮多酚纯化工艺优化提供参考,为麸皮相关产品开发与生产提供理论依据。
[1] KHAN J, KHAN M Z, MA Y, et al.Overview of the composition of whole grains' phenolic acids and dietary fibre and their effect on chronic non-communicable diseases[J].Int J Environ Res Public, Health.2022, 19(5): 3042.
[2] ZHU F.Triticale: Nutritional composition and food uses[J].Food Chem.2018, 241: 468-479.
[3] 于章龙, 刘瑞, 宋昱, 等.黑小麦麸皮抗氧化活性成分提取及其抗氧化能力评价[J].粮油食品科技, 2021, 29(1): 71-76.YU Z L, LIU R, SONG Y, et al.Extraction of antioxidant active components from wheat bran and evaluation of antioxidant capacity[J].Science and Technology of Cereals, Oils and Food,2021, 29(1): 71-76
[4] HE M, RIMM E, QI L, et al.Whole-grain, cereal fiber, bran, and germ intake and the risks of all-cause and cardiovascular diseasespecific mortality among women with type 2 diabetes mellitus[J].Circulation.2010, 121(20): 2162-8.
[5] ZABOLOTNEVA A A, SHATOVA O P, SADOVA A A, et al.An overview of alkylresorcinols biological properties and effects[J].J Nutr Metab, 2022, 5: 4667607
[6] BOUARAB C L, DEGRAEVe P, FERHOUt H, et al.Plant antimicrobial polyphenols as potential natural food preservatives[J].J Sci Food Agric, 2019, 99(4): 1457-1474.
[7] PICCOLELLA S, CRESCENTE G, CANDELA L, et al.Nutraceutical polyphenols: New analytical challenges and opportunities[J].J Pharm Biomed Anal, 2019, 175: 112774.
[8] CHIU H F, VENKATAKRISHNAN K, GOLOVINSKAIA O, et al.Gastroprotective effects of polyphenols against various gastrointestinal disorders: a mini-review with special focus on clinical evidence[J].Molecules, 2021, 26(7): 2090.
[9] LUND M N.Reactions of plant polyphenols in foods: impact of molecular structure[J].Trends in Food Science and Technology,2021, 112: 241-251.
[10] ZHOU Y, ZHENG J, LI Y, et al.Natural polyphenols for prevention and treatment of cancer[J].Nutrients, 2016, 8(8): 515.
[11] 王菁, 靳雯雯.黑小麦麸皮在食品中的应用研究进展[J].食品工程, 2021, (4):37-40.WANG J, JIN W W.Research progress of application of black wheat bran in food[J].Food Engineering, 2021, (4): 37-40.
[12] LORENZ K.Triticale[M].Encyclopedia of food sciences and nutrition (second edition).Academic Press, 2003: 5873-5877
[13] 程立坤, 司乾康, 邱宏昌, 等.黑小麦藜麦饼干加工工艺研究[J].现代食品, 2021, (12): 81-85+90.CHENG L K, SI G K, QIU H C, et al.Study on processing technology of wheat quinoa biscuit[J].Modern Food, 2021, (12):81-85+90.
[14] LEONOVA S, BADAMSHINA E, KOSHCHINA E, et al.Triticale flour in bakery and rusk products[J].Food Sci Technol Int, 2022, 28(6): 524-534.
[15] 李楠, 郭佳丽.黑小麦芽酸奶工艺优化及其抗氧化活性[J].食品工业, 2020, 41(8): 26-30.LI N, GUO J L.Process optimization and antioxidant activity of black wheat sprout yogurt[J].Food Industry, 2020, 41(8): 26-30.
[16] KASZUBA J, KAPUSTA I, POSADZKA Z.Content of phenolic acids in the grain of selected polish triticale cultivars and its products[J].Molecules, 2021, 26(3): 562.
[17] 郝教敏, 杨文平, 靳明凯, 等.黑麦多酚提取物对猪肉丸冷藏期间氧化稳定性和品质的影响[J].食品科学, 2020, 41(9):175-181.HAO Z M, YANG W P, JIN M K, et al.Effects of rye polyphenol extract on oxidation stability and quality of pork meatballs during refrigeration[J].Food Science, 2020, 41(9): 175-181.
[18] DORNAN K, GUNENC A, OOMAH B D, et al.Odd chain fatty acids and odd chain phenolic lipids (alkylresorcinols) are essential for diet [J].Journal of the American Oil Chemists’Society, 2021, 98(8): 813-824.
[19] 钟烜钰, 王弘, 杨金易, 等.植物基原料游离多酚的提取与分离纯化方法研究进展[J].食品安全质量检测学报, 2022,13(20): 6620-6627.ZHONG X Y, WANG H, YANG J Y, et al.Research progress on extraction, separation and purification of free polyphenols from plant-based raw materials[J].Journal of Food Safety and Quality Inspection, 2022, 13(20): 6620-6627.
[20] 向莉, 王琪, 徐远阳, 等.Folin-Ciocalteu法测定黑粒小麦麸皮中多酚含量的研究[J].粮食与饲料工业, 2012, (1): 57-60.XIANG L, WANG Q, XU Y Y, et al.Study on the determination of polyphenols in black wheat Bran by Folin-Ciocalteu method[J].Food and Feed Industry, 2012, (1): 57-60.
[21] 向莉.黑粒小麦多酚的提取纯化及抗氧化活性的研究[D].武汉工业学院, 2012.XIANG L.Extraction, purification and antioxidant activity of black grain wheat polyphenols[D].Wuhan Institute of Technology,2012.
[22] 田富林, 黄文晶, 张驰, 等.HPD600型大孔树脂纯化麦麸多酚及其抗氧化活性和定性分析[J].食品与机械, 2022, 38(5):173-178+242.TIAN F L, HUANG W J, ZHANG C, et al.Purification of wheat bran polyphenols by HPD600 macroporous resin and its antioxidant activity and qualitative analysis[J].Food and Machinery, 2022, 38(5): 173-178+242.
[23] 孙元琳, 崔璨, 顾小红, 等.黑小麦麸皮酚酸物质的定性分析与阿魏酸含量测定[J].中国粮油学报, 2014, 29(11): 113-117.SUN Y L, CUI C, GU X H, et al.Qualitative analysis of phenolic acid in wheat bran and determination of ferulic acid in wheat bran[J].China Journal of Cereals and Oils, 2014, 29(11):113-117.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。