吗啉胍是一种非核苷类广谱抗病毒药,常被非法用作兽药以防治和治疗动物疾病[1-2]。吗啉胍作为一种廉价、广谱的农药,也被广泛应用于黄瓜、烟草、水稻等作物病毒病的预防和治疗中[3-4]。2005年,中华人民共和国农业部公告560 号文明确规定吗啉(双)胍(病毒灵)为禁用兽药,但仍有一些兽药生产企业和养殖户为了自身利益在兽药制剂中,如黄芪多糖注射液中非法添加利巴韦林、吗啉胍等违禁药物[5-8]。目前文献中报道的吗啉胍残留量测定多以动物源性食品、水稻、蜂蜜、烟叶为主要研究基质[9-18],植物源食品中吗啉胍残留量的测定研究较少,对吗啉胍不确定度分析评价从一定程度上能反映检测方法及测定结果的可靠性与准确性[19]。
本研究建立超高效液相色谱-质谱/质谱法测定吗啉胍残留量,并根据CNAS-GL 06《化学分析中不确定度的评估指南》和JJF 1059.1—2012《测量不确定度评定与表示》对前期建立的方法过程进行不确定度评估分析,建立不确定度评定方法,分析实验中的关键点和影响不确定度的主要因素,为生菜中吗啉胍残留量的测定及正确评价为测定结果提供依据。
1 材料与方法
1.1 实验材料
盐酸吗啉胍标准品(纯度99.8%,1 g):北京中科质检生物技术有限公司;甲醇、乙腈、乙酸铵(质谱纯):德国Merk 公司;乙醇、三氯乙酸、庚烷磺酸钠、氯化钠、乙酸钠、无水硫酸镁(分析纯):天津市大茂化学试剂厂。
生菜购于市场随机样品。
1.2 仪器与设备
安捷伦液质联用仪1290-6470,配有电喷雾离子源(ESI)、固相萃取装置:美国Agilent;Multitube Vortexer MV-3000 多管振荡器:成都莱普科技有限公司;自动氮吹浓缩仪:美国Organomation氮吹仪;离心机:德国SIGMA;0.22 µm 滤膜(有机系):天津市领航实验设备股份有限公司;Milli-Q 去离子水发生器:美国Milipore 公司;HLB固相萃取柱200 mg/6 mL:AgelaCleanert PEP-2 SPE;ME 203 分析天平:瑞士梅特勒托利多公司;十八烷基硅烷键合硅胶(C18,40~60 µm)、N-丙基乙二胺(PSA,40~60 µm)、石墨化碳黑(GCB,40~60 µm):上海博升生物科技有限公司。
1.3 实验方法
1.3.1 标准溶液配制
吗啉胍标准储备液:准确称取0.012 13 g 盐酸吗啉胍标准品,用甲醇溶解并定容至10 mL,配制成浓度为1.0 mg/mL 的标准储备液。
吗啉胍中间标准液:准确吸取0.05 mL 标准储备液,用甲醇定容至50 mL,浓度为1.0 µg/mL。
吗啉胍标准使用液:准确吸取1.0 mL 标准储备液,用初始流动相定容至10 mL,浓度为0.1 µg/mL。现配现用。
吗啉胍标准工作液:根据需要吸取适量吗啉胍标准使用液,用空白样品提取液稀释成适当浓度的基质工作溶液,使用前配制。
1.3.2 样品前处理
称取2.0 g 试样于离心试管中,加入1.0 g 氯化钠、1.0 g 乙酸钠及10 mL 乙腈,涡旋振荡5 min,超声提取5 min,加入3.0 g 无水硫酸镁,涡旋振荡2 min,以8 000 g 离心5 min,吸取上清液2 mL,加入500 mg 无水硫酸镁,50 mg PSA,50 mg C18,10 mg GCB,涡旋1 min,10 000 g 离心5 min,取上清液过滤上机测定。
1.3.3 色谱条件
色谱柱:ACQUITY UPLC BEH HILIC(50 mm×2.1 mm,1.7 µm);流动相:含0.1%甲酸的5 mmol/L乙酸胺缓冲溶液(A)-乙腈(B),流速:0.3 mL/min,进样体积:1 µL,柱温:35 ℃。梯度洗脱程序:0~1.0 min,95%B;1.0~4.0 min,95%~40%B;4.0~4.5 min,40% B;4.5~4.6 min,40%~95%B;4.6~6.5 min,95%B。
1.3.4 质谱条件
电离方式:ESI 源正离子扫描;检测方式:多反应离子监测;毛细管电压:4.0 kV;离子源温度:320 ℃;脱溶剂气温度:400 ℃;脱溶剂气流量:35 Arb;质谱参数见表1。
表1 吗啉胍主要质谱参数
Table 1 Main mass spectrometry parameters of moroxydine

注:*为定量离子。
Note: *Quantitative ion.
组分 定性离子对m/z定量离子对m/z Collision Energy/V RF Lens/V吗啉胍172.3>113.1*172.3>113.1 19.20 39 172.3>130.116.67 39
1.4 数学模型的建立
本实验中,水果、蔬菜中吗啉胍含量的测量数学模型:
式中:X 表示试样中吗啉胍的含量,单位为微克每千克(µg/kg);c 表示由标准曲线得出的测定液中吗啉胍的浓度,单位为微克每升(µg/L);V 表示测定液体积,单位为毫升(mL);m 表示试样的质量,单位为克(g)。
1.5 不确定度的来源分析
结合不确定度数学模型和实验过程分析,实验从样品的称量、定容、环境条件、标准溶液及标准曲线配制、标准曲线拟合、重复性测定等方面对水果、蔬菜中吗啉胍含量测定的不确定度进行分析,具体如图1 所示。
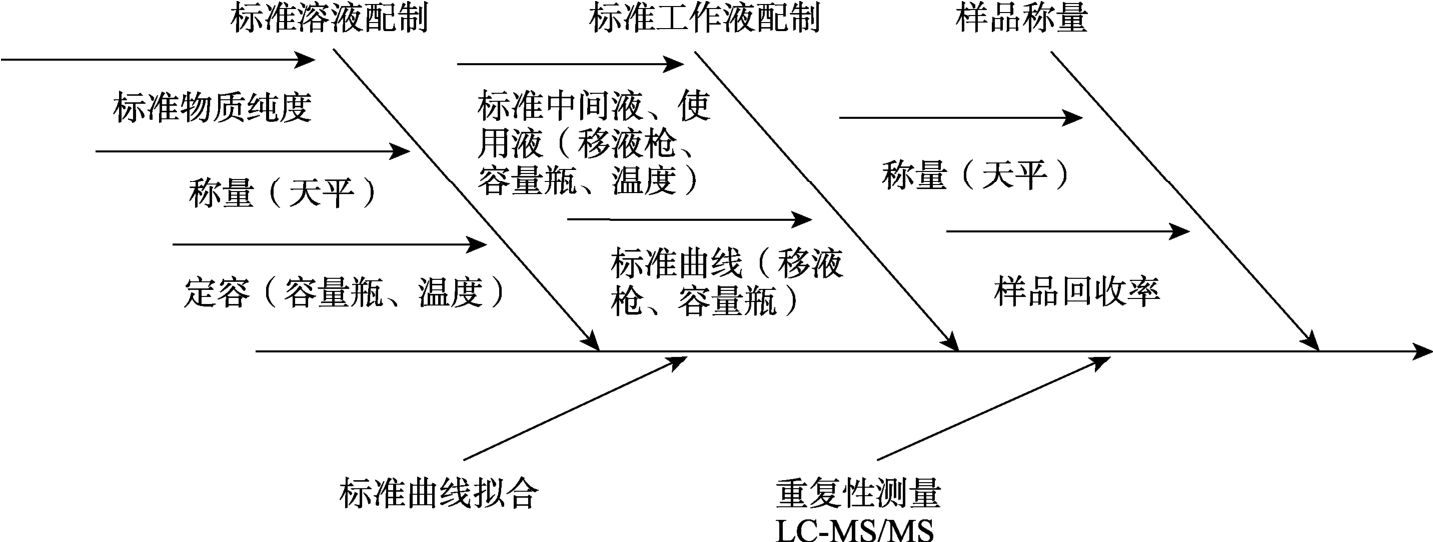
图1 主要不确定度来源示图
Fig.1 Schematic diagram of the main sources of uncertainties
2 结果与讨论
2.1 生菜中吗啉胍残留量的测定
2.1.1 线性范围与检出限
根据实验前处理过程,用空白基质提取液配置成0.1、0.5、1.0、2.0、5.0、10.0 和20.0 µg/L的吗啉胍基质标准工作液,上机测定,以质量浓度X(µg/L)为横坐标,峰面积Y 为纵坐标,绘制标准曲线,回归方程为 Y=102 791x-17 457(R2=0.999 3),线性关系良好,能对目标化合物进行准确定量。通过向空白样品中添加逐级降低浓度的标准物质,经前处理后,上机测定,对有信号检出的最低浓度加标样品重复进样3 次,用3 次进样响应的信噪比(S/N)均大于3 和10 确定吗啉胍的检出限为0.5 µg/kg,定量限为1.5 µg/kg。
2.1.2 回收率与精密度
在空白样品中添加低、中、高3 个水平的吗啉胍标准物质(n=6),进行加标回收实验,结果见表2。吗啉胍在0.5、5.0 和10.0 µg/kg 添加水平的回收率在 84.08%~98.06%,相对标准偏差为3.58%~5.26%,满足检测要求。
表2 样品加标回收率及相对标准偏差(n=6)
Table 2 Recoverandrelative standard deviation of samples(n=6)

化合物 添加水平/(µg/kg)样品编号回收率/% RSD/% 平均回收率/%平均RSD/%1 90.28 0.5 2 89.07 3 83.12 4 87.67 5 84.08 6 92.34 3.58 1 95.94吗啉胍5.0 2 84.89 3 84.33 4 93.67 5 88.80 6 86.37 4.81 88.8 4.94 1 85.06 10.0 2 89.14 3 84.08 4 98.06 5 93.02 6 87.67 5.26
2.1.3 实际样品检测结果
选择大型超市、小超市、农贸市场、路边摊贩、农户棚区等不同区域的具有代表性的样品各10批次,共50 批次样品,按照该方法进行定量检测,发现路边摊贩一批次生菜样品中吗啉胍残留量为17.5 µg/kg,其余样品中吗啉胍残留量均未检出。
2.2 各不确定分量的评定
2.2.1 标准储备液配制过程引入的不确定度urel(Cst)
标准物质的纯度、称量过程、稀释过程及环境温度引起的体积变化等是标准溶液配制过程中引入不确定度的主要来源。由证书可知,盐酸吗啉胍标准品的纯度为99.8%,不确定度为±1.0%(k=2),则标准物质纯度引入的不确定度为u(P)=1.0×0.01/2=0.005 0;相对标准不确定度为urel(P)=0.005/0.998=0.005 0。使用分度值为0.000 1 g,最大允许误差为±0.000 05 g 的电子天平称量标准物质,按均匀分布考虑,称样量0.012 13 g 时,标准物质称量引入的不确定度为u(m1)=0.000 05/ 3=0.000 029;相对标准不确定度为urel(m1)=0.000 029/0.012 13=0.002 4。参考JJG 196—2006《常用玻璃量器检定规程》,10 mL A 级容量瓶的允差为±0.02 mL,近似于矩形分布,则标准储备液配制过程中定容容器引入的不确定度为u(V1)=0.02/ 3=0.012 mL;相对标准不确定度为urel(V1)=0.012/10=0.001 2 mL。实验室温度在(20±5)℃波动,容量瓶检定环境温度为20 ℃,此时的玻璃膨胀系数为2.5×10-5/℃,甲醇的体积膨胀系数为1.18×10-3/℃[19],则由环境温度引入的不确定度为:urel(T1)=(1.18×10-3-2.5×10-5) ×10×5/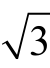 =0.033。综上不确定度分量,则标准储备液配制过程引入的相对不确定度为
=0.033。综上不确定度分量,则标准储备液配制过程引入的相对不确定度为
2.2.2 标准中间液配制过程引入的不确定度urel(Cs)
使用10~100 µL 微量移液器移取50 µL 标准储备液,根据JJG 646—2006《移液器检定规程》,容量允差为±3%,按均匀分布k=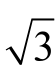 ,则标准储备液移取体积引入的相对不确定度为 urel(Vst)=0.03/
,则标准储备液移取体积引入的相对不确定度为 urel(Vst)=0.03/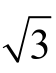 =0.017。标准中间液定容至50 mL A 级容量瓶,允差为±0.050 mL,按均匀分布k=
=0.017。标准中间液定容至50 mL A 级容量瓶,允差为±0.050 mL,按均匀分布k=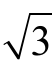 ,则定容容器引入的相对不确定度为u(Vs)=0.050/
,则定容容器引入的相对不确定度为u(Vs)=0.050/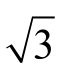 =0.029 mL。相对标准不确定度为urel(Vs)=0.029/10=0.002 9 mL。实验室温度在(20±5)℃波动,容量瓶检定环境温度为20 ℃,此时的玻璃膨胀系数为2.5×10-5/℃,甲醇的体积膨胀系数为1.18×10-3/℃[20],则由环境温度引入的不确定度为:urel(Ts)=(1.18×10-3-2.5×10-5)×10×5/
=0.029 mL。相对标准不确定度为urel(Vs)=0.029/10=0.002 9 mL。实验室温度在(20±5)℃波动,容量瓶检定环境温度为20 ℃,此时的玻璃膨胀系数为2.5×10-5/℃,甲醇的体积膨胀系数为1.18×10-3/℃[20],则由环境温度引入的不确定度为:urel(Ts)=(1.18×10-3-2.5×10-5)×10×5/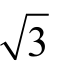 =0.033。综上不确定度分量,则标准中间液配制引入的相对不确定度为
=0.033。综上不确定度分量,则标准中间液配制引入的相对不确定度为![]()
2.2.3 标准使用液配制过程引入的不确定度urel (Cm)
使用10~1 000 µL 微量移液器移取1.0 mL 标准中间液,其容量允差为±1%,按均匀分布,标准储备液移取体积引入的相对不确定度为urel(Vms)=0.01/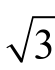 =0.005 8。标准使用液定容至10 mL A 级容量瓶,其允差为±0.050 mL,按均匀分布,定容容器引入的相对不确定度为 u(Vm)=0.050/
=0.005 8。标准使用液定容至10 mL A 级容量瓶,其允差为±0.050 mL,按均匀分布,定容容器引入的相对不确定度为 u(Vm)=0.050/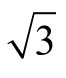 =0.029 mL。相对标准不确定度为urel(Vm)=0.029/10=0.002 9 mL。实验室温度在(20±5)℃波动,标准使用液用初始流动相定容,容量瓶检定环境温度为20 ℃,玻璃膨胀系数为2.5×10-5/℃,水的体积膨胀系数为2.08×10-4/℃,乙腈的体积膨胀系数为1.37×10-3/℃,则标准使用液定容环境温度引入的不确定度为urel(Tms)=(1.31×10-3-2.5×10-5)×10×5/
=0.029 mL。相对标准不确定度为urel(Vm)=0.029/10=0.002 9 mL。实验室温度在(20±5)℃波动,标准使用液用初始流动相定容,容量瓶检定环境温度为20 ℃,玻璃膨胀系数为2.5×10-5/℃,水的体积膨胀系数为2.08×10-4/℃,乙腈的体积膨胀系数为1.37×10-3/℃,则标准使用液定容环境温度引入的不确定度为urel(Tms)=(1.31×10-3-2.5×10-5)×10×5/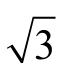 =0.037。综上不确定度分量,标准使用液配制引入的相对不确定度为
=0.037。综上不确定度分量,标准使用液配制引入的相对不确定度为
2.2.4 标准工作曲线配制过程引入的不确定度urel(M)
参考移液器检定规程,按照均匀分布,标准工作曲线配制过程由移液器引入的不确定度见表3。则由标准曲线配制过程引入的不确定度为
表3 标准工作曲线配制过程移液器引起的不确定度
Table 3 Uncertainty introduced by pipette in preparation of standard working curve

标准溶液 20~200 µL 移液器 20~200 µL 移液器 移取体积/µL(次数) 20(1) 50(2) 容量允差/% ±4.0 ±2.75 计算公式容量相对不确定度 urel(Mv1)0.023 urel(Mv2)0.023溶剂 10~1 000 µL 移液器 10~1 000 µL 移液器 移取体积/µL(次数) 980(1) 950(2) 容量允差/% ±1.0 ±1.0 计算公式容量相对不确定度 urel(Mv5)0.005 8 urel(Mv6)0.008 220~200 µL 移液器 20~200 µL 移液器100(3) 200(1)±2.0 ±1.5允差3 urel(Mv3)0.021 urel(Mv4)0.008710~1 000 µL 移液器 10~1 000 µL 移液器900(3) 800(1)±1.0 ±1.0允差3 urel(Mv7)0.010 0 urel(Mv8)0.005 8
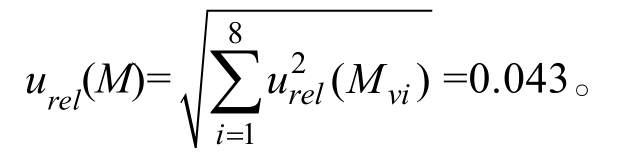
2.2.5 标准曲线拟合引入的不确定度urel(S)
由2.1.1 可知,吗啉胍在0.1、0.5、1.0、2.0、5.0、10.0 和20.0 µg/L 的浓度范围时呈良好线性,回归方程为Y=102 791x-17 457(R2=0.999 3),斜率b 和截距a 分别为102 791 和-17 457。对试样测定6 次,测得峰面积y,由标准工作曲线的线性回归方程计算得出生菜样品中吗啉胍的浓度分别为3.51、3.49、3.57、3.54、3.46、3.49 µg/L,平均值为x0=3.51 µg/L。根据贝塞尔公式计算标准曲线的残差的标准偏差SR,由贝塞尔方程计算实验的标准曲线引入的不确定度为
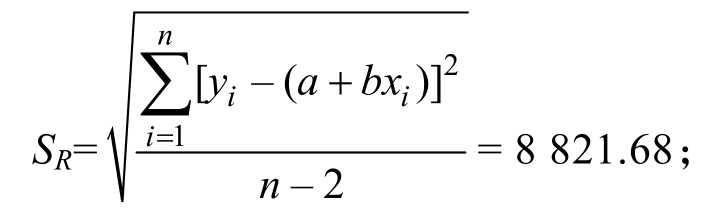
其中p=6(样品重复检测次数),n=21(标曲溶液测定的次数),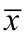 =5.51(标准曲线系列质量浓度的算术平均值),xi 为标准曲线中对应的质量浓度,yi 为标准曲线中对应的峰面积,将各值分别代入公式,得
=5.51(标准曲线系列质量浓度的算术平均值),xi 为标准曲线中对应的质量浓度,yi 为标准曲线中对应的峰面积,将各值分别代入公式,得
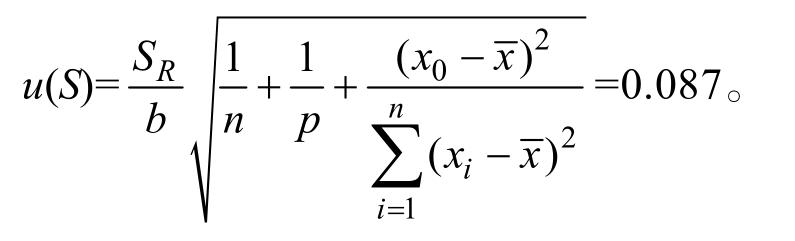
则标准曲线拟合引入的相对不确定度为urel(S)=![]()
2.2.6 样品称量引入的不确定度urel(Ym)
样品称量使用分度值为0.001 g 的天平,最大允许误差为±0.005 g,按照均匀分布,称取2 g 时,样品称量引入的不确定度为 u(Ym)=0.005/ 3=0.002 9;相对标准不确定度为urel(Ym)=0.002 9/2=0.001 4。
2.2.7 重复性引入的不确定度urel (Yr)
实验对实际样品进行测定,发现一批次生菜样品中吗啉胍残留量检出,重复测量6 次,结果依次为17.6、17.4、17.8、17.7、17.3、17.4 µg/kg,则样品重复性测定引入的不确定度为:重复性标准偏差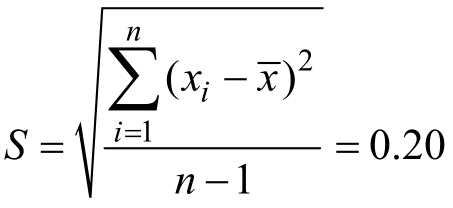 ;重复性不确定度
;重复性不确定度![]() ;重复性相对不确定度u xel (Y r )=
;重复性相对不确定度u xel (Y r )=![]()
2.2.8 样品加标回收引入的不确定度urel(YR)
实验以生菜基质为例,在空白样品中添加0.5,5.0 和10.0 µg/kg 这3 个水平的标准品,每个水平重复测定6 次,进行回收率实验得回收率见表2。样品加标回收引入的不确定度为:样品加标回收标准偏差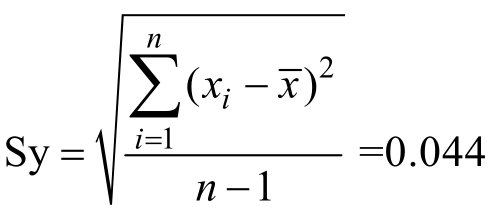 ;样品加标回收不确定度
;样品加标回收不确定度![]() ;样品加标回收相对不确定度
;样品加标回收相对不确定度![]()
2.3 合成不确定度及扩展不确定度的计算
测量不确定度分量如表4 所示。
表4 测量不确定度分量
Table 4 Uncertainty components of measurement

符号 来源 相对标准不确定度urel(Cst) 标准储备液配制 0.033 urel(Cs) 标准中间溶液配制 0.037 urel(Cm) 标准使用液配制 0.038 urel(M) 标准工作曲线配制 0.043 urel(S) 标准曲线拟合 0.025 urel(Yr) 重复性测定 0.004 7 urel(Ym) 样品称量 0.001 4 urel(YR) 样品回收率 0.012
合成相对标准不确定度为:
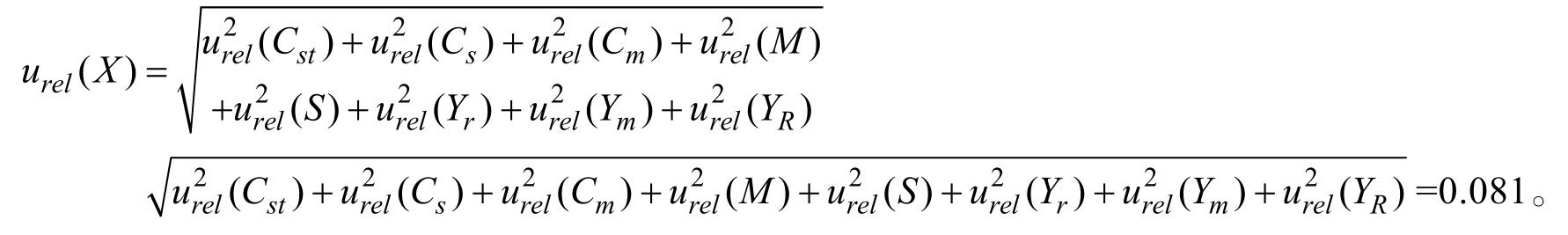
实验所得阳性样品中吗啉胍的平均含量为17.5 µg/kg,则合成标准不确定度为u(X)=17.5×0.081=1.42 μg/kg。
按95%置信水平计算测量结果的扩展不确定度,取扩展因子k=2,则U=2u(X)=2×1.42=2.84 μg/kg。
2.4 测量不确定度的结果报告
根据实验所建的方法测定的生菜样品,其含量测定结果为(17.5±2.84) μg/kg,k=2。
3 结论
实验建立生菜中吗啉胍残留量UPLC-MS/MS检测方法,结果显示,吗啉胍在0.1~20 µg/L 范围内呈良好线性,基质标准曲线方程为Y=102 791x-17 457(R2=0.999 3)。在低、中、高3 个水平的加标回收率为84.08%~98.06%(n=6),相对标准偏差为3.58%~5.26%(n=6)。方法灵敏度高,定性、定量结果可靠,能够满足实验要求。经随机抽取的实际样品检测结果显示,市面上已存在含有吗啉胍残留的生菜流通,通过对检测过程及阳性样品结果进行不确定度评价,结果表明,取样量2 g 时,k=2(95%置信度),生菜中吗啉胍检测结果为(17.5±2.84) μg/kg。检测过程的不确定度分析表明,标准曲线配制过程引入的不确定度因移液器的使用频次及不同量程的代入而显示最大。因阳性样品含量的不确定性,为同时满足检出限及可能检出的样品浓度值,标准工作液一般会选取较大范围的浓度值,这直接导致测量值偏离标准曲线中点使标准工作曲线拟合产生较大的不确定度,实际检测中可通过重复测定及选择合适范围的标准工作曲线来降低此类问题产生的不确定度,提高检测结果的准确性。实验对生菜中吗啉胍残留量的检测和不确定度评价为国家制订相关标准及打击药物非法添加提供技术支撑,具有较高的实用价值。
[1] AN M Y, YI D J, QIU J X, et al. Measurement and correlation for solubility of moroxydine hydrochloride in pure and binary solvents[J]. Journal of Chemical & Engineering Data, 2020, 65:2611-2618.
[2] MAGRI A, REILLY R, SCALACCI N, et al. Rethinking the old antiviral drug moroxydine: discovery of novel analogues as anti-hepatitis C virus (HCV) agents[J]. Bioorg Med Chem Lett,2015, 25, 5372-5376.
[3] 白利. 辽宁凌源地区越冬茬黄瓜病毒病防治[J]. 农业工程技术, 2020, 32(22): 40-41.BAI L. Control of cucumber virus disease in overwintering crop in Liaoning Ling Yuan area[J]. Agricultural Engineering Technology,2020, 32(22): 40-41.
[4] 乔柯. 食品中抗病毒类药物残留检测方法研究进展[J]. 食品安全导刊, 2017, 18(86): 112.QIAO K. Advances in detection methods for antiviral drug residues in food[J]. Food Safety Guide, 2017, 18(86): 112.
[5] 王丽琼, 吴丽. 高效液相色谱法同时测定感冒清胶囊中对乙酰氨基酚和盐酸吗啉胍含量[J]. 中国药业, 2019, 28(21):38-40.WANG L Q, WU L. Simultaneous determination of paracetamol and moraxydine hydrochloride in ganmaoqing capsules by HPLC[J]. China Pharmceuticals, 2019, 28(21): 38-40.
[6] 张树强. 高效液相色谱法测定盐酸吗啉胍注射液的含量[J].中国药业, 2011, 20(22): 46-47.ZHANG S Q. Determination of morpholine guanidine hydrochloride injection by high performance liquid chromatography[J]. China Pharmceuticals, 2011, 20(22): 46-47.
[7] 孙海新, 许娜, 张慧, 等. 鸡蛋中金刚烷胺、金刚乙胺、利巴韦林和吗啉胍多残留检测方法的研究[J]. 中国家禽, 2015,37(23): 22-26.SUN H X, XU N, ZHANG H, et al. Multi-residues determination method of amantadine,rimantadine, ribavirin and moroxydine in eggs[J]. China Poultry, 2015, 37(23): 22-26.
[8] 张艳, 王全胜, 吴银良. 分散固相萃取-液相色谱-串联质谱法同时测定鸡蛋中7 种抗病毒类药物和利巴韦林代谢物残留量[J]. 食品安全质量检测学报, 2022, 13(6): 1872-1879.ZHANG Y, WANG Q S,WU Y L. Simultaneous determination of 7 kinds of antiviral drugs and ribavirin metabolite residues in eggs by dispersive solid phase extraction coupled with liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality, 2022, 13(6): 1872-1879.
[9] LI J, MING M T, HUAI W H, et al. Fast and simple determination of moroxydine residues in pig and chicken samples by ultra-performance liquid chromatography-tandem mass spectrometry[J]. Food Additives & Contaminants: Part A,2018, 35(11): 2111-2119.
[10] 田亚平, 陈洋, 冯若天, 等. UPLC-MS/MS 法测定鸡肉中盐酸吗啉胍残留量[J]. 畜牧与兽医, 2016, 48(3): 89-91.TIAN Y P, CHEN Y, FENG R T, et al. Determination of morpholine guanidine hydrochloride residues in chicken meat by UPLCMS/MS[J]. Animal Husbandry & Veterinary Medicine, 2016,48(3): 89-91.
[11] LIU Z C, YANG F, YAO M N, et al. Simultaneous determination of antiviral drugs in chicken tissues by ultra high performance liquid chromatography with tandem mass spectrometry[J].Journal of Separation Science, 2015, 38(10): 1784-1793.
[12] ZHANG Q Y, XIAO C G, WANG W, et al. Chromatography column comparison and rapid pretreatment for the simultaneous analysis of amantadine, rimantadine, acyclovir, ribavirin, and moroxydine in chicken muscle by ultra high performance liquid chromatography and tandem mass spectrometry[J]. Journal of Separation Science, 2016, 39(20): 3998-4010.
[13] MU P Q, XU N N, CHAI T T, et al. Simultaneous determination of 14 antiviral drugs and relevant metabolites in chicken muscle by UPLC-MS/MS after QuEChERS preparation[J]. Journal of Chromatography B, 2016, 1023-1024+17-23.
[14] 杨旭, 刘正才, 杨方, 等. 固相萃取UPLC-MS/MS 法同时检测鸡肉中8 种抗病毒药物的残留量[J]. 药物分析杂志, 2016,36(3): 513-521.YANG X, LIU Z C,YANG F, et al. Simultaneous determination of eight antiviral drugs residues in chicken by solid-phase extraction combined with UPLC-MS/MS[J]. Chinese Journal of Pharmaceutical Analysis, 2016, 36(3): 513-521.
[15] WANG Z D, WANG X R, WANG Y H, et al. Simultaneous determination of fifive antiviral drug residues and stability studies in honey using a two-step fraction capture coupled to liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2021, 1638, 1-9.
[16] 郑幸果, 赵珊, 李曦, 等. 超高效液相色谱-串联质谱法同时测定蜂蜜中4 种抗病毒类药物残留[J]. 食品安全质量检测学报, 2021, 12(10): 4110-4117.ZHENG X G, ZHAO S, LI X, et al. Simultaneous determination of 4 kinds of antiviral drug residues in honey by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality, 2021, 12(10): 4110-4117.
[17] 王柯, 陈燕, 李晓雯, 等. 液相色谱-四极杆飞行时间质谱法同时测定动物源性食品中的5 种抗病毒类药物[J]. 食品安全质量检测学报, 2016, 7(7): 2720-2726.WANG K, CHEN Y, LI X W, et al. Simultaneous determination of 5 kinds of antivirus drug residues in animal-derived food by high performance liquid chromatography-quadrupole-time of flight mass spectrometry[J]. Journal of Food Safety and Quality,2016, 7(7): 2720-2726.
[18] 周健, 龚道新, 吴亮, 等. HPLC 法测定烟叶和烟田土壤中盐酸吗啉胍残留[J]. 环境监测管理与技术, 2015, 27(2):39-42.ZHOU J, GONG D X, WU L, et al. Detection of moroxydine hydrochloride residues by HPLC in tobacco leaves and soil[J].The Administration and Technique of Environmental Monitoring,2015, 27(2): 39-42.
[19] 王赛楠. 高效液相色谱法测定水果罐头中阿斯巴甜的不确定度评估[J]. 食品安全质量检测学报, 2019, 10(3): 734-739.WANG S N. Uncertainty evaluation for determination of aspartame in canned fruits by high performance liquid chromatography[J]. Journal of Food Safety and Quality, 2019,10(3): 734-739.
[20] 郭立净, 王赛楠. 液相色谱-高分辨质谱法测定豆芽中4-氯苯氧乙酸的不确定评估[J]. 食品安全质量检测学报, 2020,11(15): 5203-5208.GUO L J, WANG S N. Uncertainty evaluation for determination of 4-chlorophenoxyacetic acid in bean sprouts by liquid chromatography-high resolution mass spectrometry[J]. Journal of Food Safety and Quality, 2020, 11(15): 5203-5208.