植物蛋白饮料是以植物的种子、果实或组织为原料经深加工而制成的产品[1],含有大量磷、钾、钙及微量元素,因其坚果味、奶油质地、脂肪酸组成和药用价值,成为动物奶的良好替代品[2]。植物蛋白饮料在市场上的需求不断提高,生产商为了利润最大化,常以便宜原料大豆、花生等代替昂贵材料核桃、榛子,随后用香精勾兑成植物蛋白饮料,以降低生产成本[3],于是在植物蛋白饮料中不能检出相应的植物源性成分[4]。食品掺假是消费者普遍遇到的问题,因为他们无法用肉眼分辨出掺假的食品[5]。因此,食品相关组织需要建立和使用有效的方法来检测掺假,从而确保植物蛋白饮料的真实性和纯度[6]。
现阶段植物蛋白饮料植物源性的检测技术主要为理化检测、红外光谱技术、ELISA、分子生物学技术、液相色谱联用技术[7]。分子生物学方法已成为植物源性成分鉴定的首选方法,该方法依据植物种类特定保守基因或蛋白质进行检测,主要包括蛋白质水平的检测和核酸水平的检测[8]。荧光PCR 因其可实现高效定量检测,特异性高,灵敏度好的特性成为主流的核酸水平检测手段[9]。但在实际检测中由于食品添加剂的使用使得检测结果出现假阴性。食品添加剂被广泛添加到植物蛋白饮料中,以保持色泽、风味、增强味道、改变外观、延长保质期,提高加工、储存和包装过程中的食品质量和安全性[10-11]。甜味剂可以增强产品口味、增加食欲,这些甜味剂的强度是蔗糖的数千倍,并且无残留味道[12]。抗氧化剂包括自由基清除剂、还原剂、过氧化物和其他活性氧物质的灭活剂以及金属螯合剂[13]。通过降低氧含量,中断氧化路径,破坏催化酶活性,活化核酸内切酶等途径降低食品氧化反应[14-15]。增味剂谷氨酸钠的增味效果是其他食物不可替代的[16],其与肌苷酸二钠混合时产生协同效应,可使鲜度提高数倍至数十倍[17];这些添加剂被大量应用于食品生产中。现阶段的检测手段可单独检测添加剂的含量,亦可检测植物源性成分[18-20],研究添加剂对植物源性成分荧光PCR 检测方法的影响较少。
本实验选取常见甜味剂(安赛蜜、甜蜜素)、抗氧化剂(抗坏血酸、D-异抗坏血酸钠)、增味剂(肌苷酸二钠、谷氨酸钠)、氯化钾7 种添加剂,探究不同浓度添加剂对大豆DNA 荧光PCR 反应的干预情况,并测定假阴性限值;利用DNA 紫外吸收峰的变化确定添加剂对大豆DNA 的影响机理;并在人工添加剂污染的模型中比较深加工食品DNA 试剂盒提取方法,深加工食品DNA 试剂盒+氯仿提取方法,国家食品药品监督管理总局《植物蛋白饮料中植物源性成分鉴定》(BJS201707)提取方法三种方法中相应引物扩增Ct 值的大小,为改善国标检测方法提供依据。
1 材料与方法
1.1 材料与试剂
东北非转基因大豆:河北石家庄农贸市场;深加工食品DNA 提取试剂盒:天根生化科技(北京)有限公司;安赛蜜分析纯:上海阿拉丁生化科技股份有限公司;甜蜜素、抗坏血酸、D-异抗坏血酸钠分析纯:北京索莱宝科技有限公司;肌苷酸二钠、谷氨酸钠分析纯:天津市光复精细化工研究所;氯化钾分析纯:天津博迪化工股份有限公司。
1.2 仪器与设备
UV-2700 紫外可见分光光度计:岛津仪器(苏州)有限公司;SHA-B 水浴恒温振荡器:常州润华电器有限公司;Sigma 3K15 冷冻离心机:德国Sigma 公司;Light Cycler 480 II 实时荧光定量PCR仪:德国罗氏诊断有限公司;IKA MS3 basic 涡旋振荡器:德国IKA 集团;ME204/02 电子天平:梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
称取100 mg 大豆样本,组织研磨机研磨,依据DNA 提取试剂盒提取大豆DNA,纯大豆DNA为对照,并设不同浓度的添加剂,提取物DNA的OD260/280 值在1.7~1.9 之间时,进行荧光PCR扩增。大豆源性成分Lectin 基因检测用引物(对)序列为:
大豆5’端引物:5’-GCCCTCTACTCCACCCCCA-3’
大豆 3’端引物:5’-GCCCATCTGCAAGCCTTTTT-3′
大豆探针:5’-FAM-AGCTTCGCCGCTTCCTTCAACTTCAC-TAMRA-3’
反应体系为:Premix 12.50 μL、Primer-F 0.75 μL、Primer-R 0.75 μL、Probe 0.50μL、DNA 2.00 μL、ddH2O 8.50 μL。含有添加剂的荧光PCR 反应体系为添加剂X μL,ddH2O(8.50-X)μL。反应参数为50 ℃ 2 min;95 ℃ 15 min;95 ℃ 15 s,60 ℃ 1 min,40 个循环。Ct 值≤35.00,判定阳性;值≥40.00,判定阴性;35.00<Ct 值<40.00,重复实验一次。
随后选取浓度为荧光PCR 阳性的结果,加入到提取的纯大豆DNA 中,纯DNA 组为对照,紫外分光光度计测量其溶液在200~500 nm 波长的光吸收曲线,检测DNA 紫外吸收峰的变化程度,探究食品添加剂与DNA 相结合的方式。
将测到的影响荧光PCR 反应的最低添加剂浓度,添加到大豆样本中,制成人工添加剂污染的模型,并分别选取深加工食品DNA 试剂盒提取,深加工食品DNA 试剂盒+氯仿提取,国家食品药品监督管理总局《植物蛋白饮料中植物源性成分鉴定》(BJS201707)方法提取DNA,用相应引物扩增,比较三种提取方法Ct 值的大小。
1.4 数据分析
利用Sigma Plot 进行数据分析,所有数据均采用单因素方差分析进行分析,以确定各组之间的差异。在本研究中,如果P<0.05,则认为两组添加剂组间差异显著性。
2 结果与讨论
2.1 食品添加剂在植物蛋白饮料中的限量
不同食品添加剂在植物蛋白饮料中的添加量不同,本实验选择7 种常见的食品添加剂并查阅其使用限量,在《食品安全国家标准食品添加剂使用标准》GB2760—2014 中规定,除安赛蜜和甜蜜素外其余5 种都可根据口味需要添加,安赛蜜和甜蜜素的使用限量分别为0.3 g/kg 和0.65 g/kg,在实际操作中,2 mL 的植物蛋白饮料基本可以提取200 μL 的适宜浓度的DNA 用于荧光PCR 的检测,根据此比例即可算出食品添加剂在DNA 中的残留量(表1)。
表1 GB2760—2014 中不同添加剂在植物蛋白饮料中的使用限量
Table 1 Limits of use of different additives in vegetable protein beverages in GB2760—2014

注:“—”表示根据添加剂添加量计算,残留量无具体数值。
Note: “-” indicates that the residual amount is calculated according to the additive amount.
添加剂种类 使用限量/(g/kg) DNA 中残留量/(μg/μL)安赛蜜 0.3 ≈3.0甜蜜素 0.65 ≈6.5抗坏血酸 适量使用 —D-异抗坏血酸钠 适量使用 —肌苷酸二钠 适量使用 —谷氨酸钠 适量使用 —氯化钾 适量使用 —
2.2 大豆样本DNA 纯度测定
大豆样本经DNA 提取试剂盒提取,测定其OD260/280 值为1.80,浓度为:48.90 ng/μL。符合荧光PCR 反应要求DNA 浓度和OD260/280 值。
2.3 甜味剂对大豆DNA 荧光PCR 反应干预
由图1 可知在25 μL 荧光PCR 反应体系中,CT 值随着添加剂的浓度增大而增大,当安赛蜜在DNA 溶液中的浓度大于105.00 μg/μL,甜蜜素浓度大于100.00 μg/μL 时,CT 值均大于35,对荧光PCR 反应产生明显抑制作用。由表1 可知在实际生产中,二者的最大添加量分别为0.30 g/kg 和0.65 g/kg,即在DNA 中的残留量约为3.0 μg/μL和6.5 μg/μL,所以在正常使用范围内,这两种添加剂会抑制荧光PCR 的反应但不足以使荧光PCR检验结果出现假阴性。
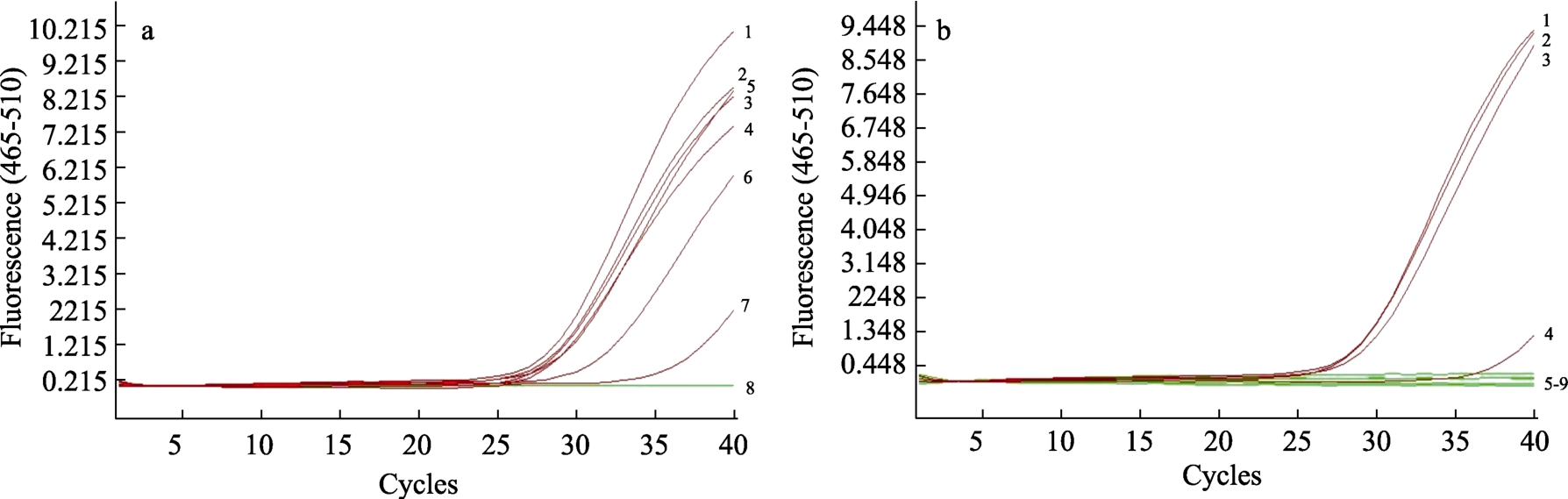
图1 甜味剂对荧光PCR 反应的干预
Fig.1 Intervention of sweeteners on fluorescent PCR reactions
注:a 为安赛蜜1-8:0,30.00,45.00,60.00,75.00,90.00,105.00,127.50 μg/μL 对应CT 值分别为28.71,28.66,28.58,28.52,29.27,31.62,35.00,>35.0
b 为甜蜜素1-9:0,33.38,66.75,100.00,133.38,166.75,200.00,233.50,283.50 μg/μL 对应CT 值分别为29.18, 28.99, 29.67,35.00, >35.0,>35.0,>35.0,>35.0,>35.0
2.4 抗氧化剂对大豆DNA 荧光PCR 反应干预
不同浓度抗氧化剂对大豆DNA 荧光PCR 反应的干预结果图2,由图可知在2 μLDNA 中随着添加剂浓度的不断增大对荧光PCR 反应的抑制作用也越强,虽然CT 值没有发生明显变化但荧光信号强度随着添加剂浓度的增大而不断降低,显示在反应体系中有抑制反应的物质存在,当抗坏血酸浓度大于等于108.30 μg/μL、D-异抗坏血酸钠浓度大于等于132.00 μg/μL 时,对荧光PCR 反应体系产生明显抑制作用,使得结果出现假阴性。GB2760 中规定抗坏血酸、D-异抗坏血酸钠可以根据口味适量使用,因此在用荧光PCR 检测植物蛋白饮料植物源性成分时,需要关注添加剂的含量,选取适宜的DNA 提取方法,以保证检验结果的准确性。

图2 抗氧化剂对荧光PCR 反应的干预
Fig. 2 Intervention of antioxidants on fluorescent PCR reaction
注:a 为抗坏血酸1-9:0,21.65 ,43.35,65.00,86.65,108.30,130.00,151.65 ,184.15 μg/μL,对应CT 值分别为29.40,29.21,28.99,28.66,28.26,>35.0,>35.0,>35.0,>35.0
b 为D-异抗坏血酸钠1-9:0,26.38,52.75,79.13,105.50,132.00,158.38,184.75,224.25 μg/μL,对应CT 值分别为28.43,28.48,28.29,29.41,34.59,>35.0,>35.0,>35.0,>35.0
2.5 增味剂对大豆DNA 荧光PCR 反应干预
由图3 可知,随着添加剂的浓度不断增大对荧光PCR 反应的抑制作用也越强,当肌苷酸二钠浓度大于335.00 μg/μL,谷氨酸钠大于150.00 μg/μL时,对荧光PCR 反应体系产生影响,反应结果显示为假阴性。GB2760 中规定肌苷酸二钠、谷氨酸钠在生产中可以适量添加,因此在检测植物源性蛋白饮料时,需要考虑该两种添加剂的含量,在超过荧光PCR 反应限量的添加剂浓度时,需注意检测方法的选择。
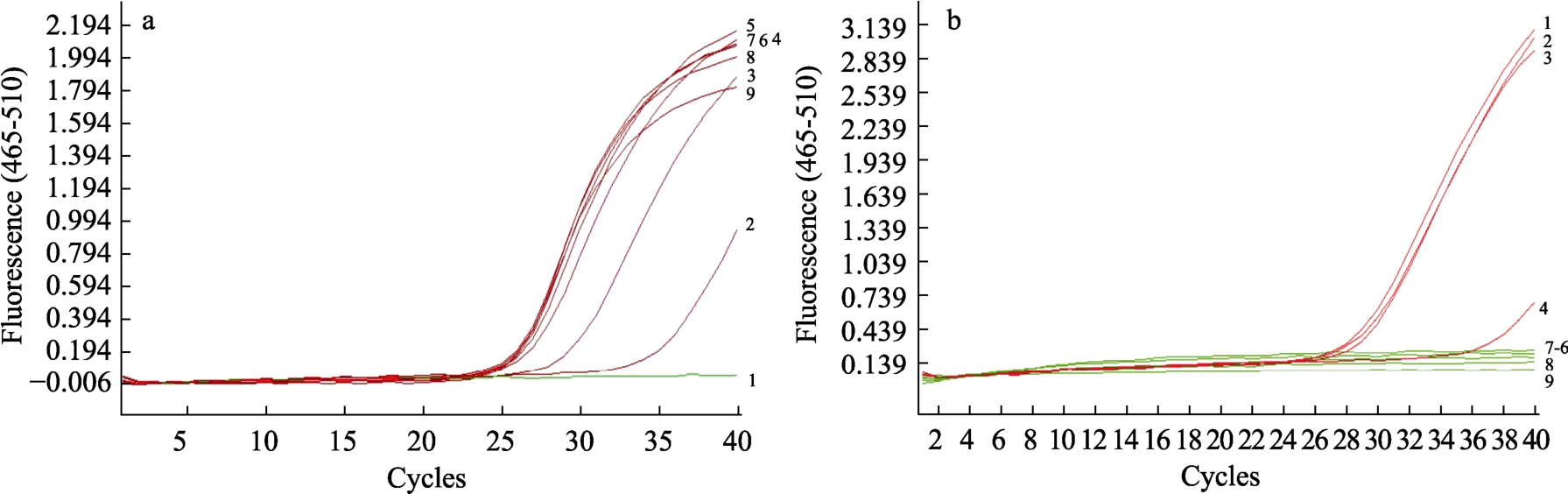
图3 增味剂对荧光PCR 反应的干预
Fig. 3 Intervention of flavor enhancers on fluorescent PCR reaction
注:a 为肌苷酸二钠1-9: 0,47.50,95.00,143.75,191.25,238.75,298.75,335.00,406.25 μg/μL,对应CT 值分别为25.64,25.75, 25.75, 25.90, 26.25, 26.79, 29.46, 35.00,>35.0
b 为谷氨酸钠1-9:0,50.00,100.00,150.00,200.00,250.00,300.00,350.00,425.00 μg/μL 对应CT 值分别为29.29,28.89,29.26,5.00,>35.0,>35.0,>35.0,>35.0,>35.0
2.6 氯化钾对大豆DNA 荧光PCR 反应干预
当氯化钾的添加浓度大于37.85 μg/μL,对反应体系产生明显的抑制作用,反应结果呈假阴性如图4。氯化钾的添加含量为适量添加,因此在测定植物源性DNA 成分时,需考虑该添加剂的浓度对荧光PCR 反应的影响,选定最适的检测方法。
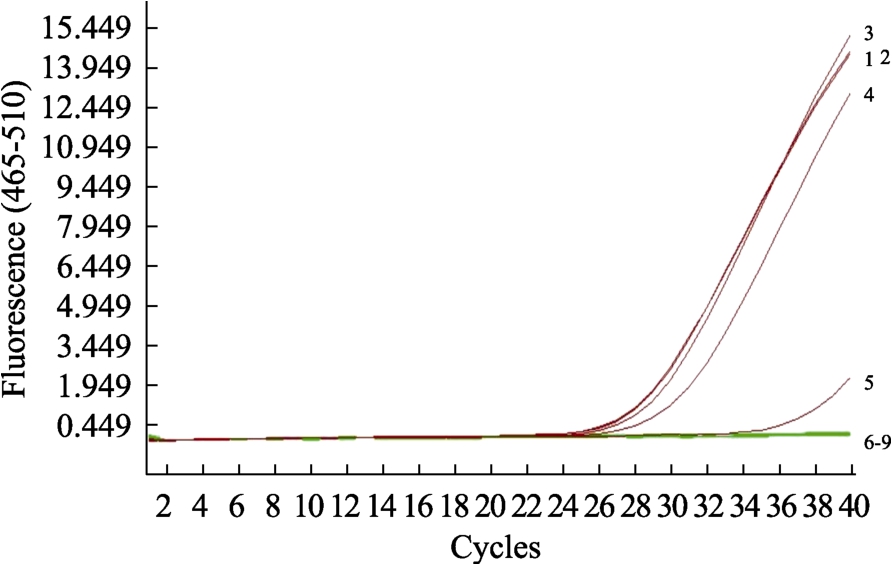
图4 氯化钾对荧光PCR 反应的干预
Fig. 4 Intervention of potassium chloride on fluorescent PCR reaction
注:氯化钾1-9:0,10.00,20.00,30.05,37.85,50.00,60.15,70.15,85.00 μg/μL,对应CT 值分别为28.64, 28.52, 29.24,30.54, 35.00,>35.0,>35.0,>35.0,>35.0
2.7 添加剂对DNA 紫外吸收峰的影响
DNA 紫外吸收峰值显示(表2),添加一定浓度的安赛蜜、甜蜜素、抗坏血酸,D-异抗坏血酸钠、肌苷酸二钠,对大豆DNA 的紫外吸收峰均有影响。当安赛蜜浓度大于75.00 μg/μL,甜蜜素浓度大于 133.38 μg/μL,抗坏血酸浓度大于65.00 μg/μL,D-异抗坏血酸79.13 μg/μL,肌苷酸二钠335.00 μg/μL 时,检测不到DNA 紫外吸收峰,但安赛蜜、抗坏血酸、D-异抗坏血酸钠、肌苷酸二钠浓度在该浓度时荧光PCR 反应为阳性。后续实验有待进一步确定这些添加剂对DNA的影响方式。谷氨酸钠与氯化钾在各浓度范围内均能检测到紫外吸收峰值,但谷氨酸钠大于150.00 μg/μL,氯化钾的浓度大于50.00 μg/μL 时,荧光PCR 反应成假阴性,有待进一步确定这两种添加剂对荧光PCR 反应的影响方式。298.75 μg/μL浓度的肌苷酸二钠、100.00 μg/μL、200.00 μg/μL的谷氨酸钠与对照组紫外吸收峰差异显著,说明肌苷酸二钠、谷氨酸钠达到一定浓度时会通过影响DNA 峰值而影响荧光PCR 反应的准确性,后续实验有待进一步确定添加剂对DNA 纯度的影响。其他添加剂组与对照组紫外吸收峰差异不显著。
表2 不同浓度添加剂对DNA 紫外吸收峰的影响(n≥3)
Table 2 Effects of different concentrations of additives on the UV absorption peaks of DNA (n≥3)
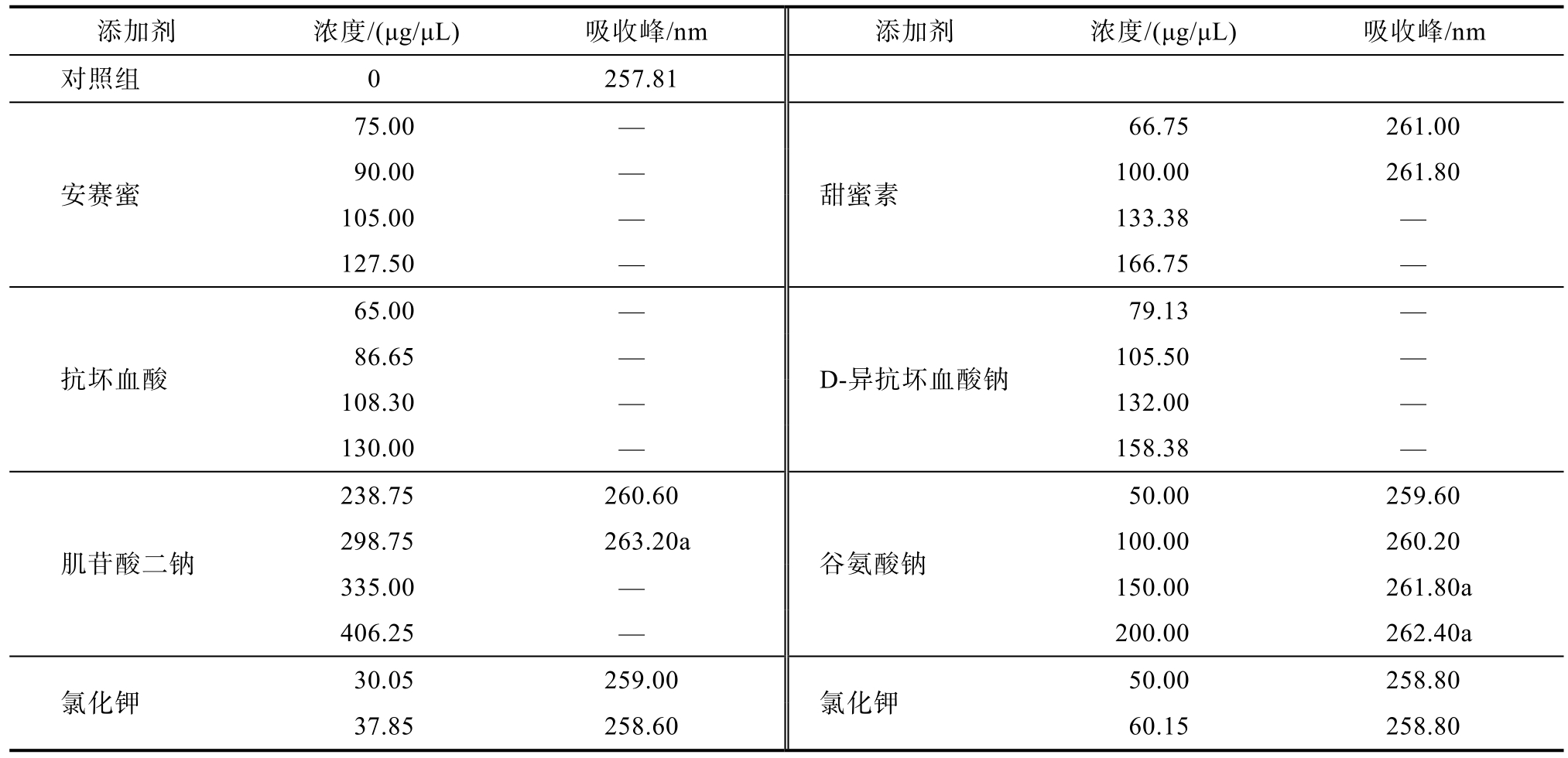
注:没有吸收峰表示为“—”,不同浓度间差异显著(P<0.05)用肩标a、b、c 表示。
Note: No absorption peak is represented as "--", and significant differences among different concentrations (P < 0.05) are represented by shoulder label a, b and c.
添加剂 浓度/(μg/μL) 吸收峰/nm 添加剂 浓度/(μg/μL) 吸收峰/nm对照组 0 257.81 75.00 —66.75 261.00安赛蜜90.00 — 100.00 261.80甜蜜素105.00 — 133.38 —127.50 — 166.75 —65.00 —79.13 —抗坏血酸86.65 — 105.50 —D-异抗坏血酸钠108.30 — 132.00 —130.00 — 158.38 —238.75 260.60 50.00 259.60肌苷酸二钠298.75 263.20a 100.00 260.20谷氨酸钠335.00 — 150.00 261.80a 406.25 — 200.00 262.40a氯化钾 30.05 259.00 氯化钾 50.00 258.80 37.85 258.60 60.15 258.80
2.8 植物蛋白饮料DNA 提取方法优化
采用三种提取方法提取含安赛蜜、甜蜜素、抗坏血酸、D-异抗坏血酸钠、肌苷酸二钠、谷氨酸钠、氯化钾的大豆DNA,并检测其大豆源性成分,并比较三种不同提取方法Ct 值的大小,结果显示使用BJS 方法提取的大豆的DNA 进行荧光PCR 反应其Ct 值最小,并且与试剂盒、试剂盒+氯仿方法差异显著。
表3 不同提取提取方法对荧光PCR 反应Ct 值的影响(n≥3)
Table 3 Effect of different extraction methods on Ct value of fluorescence PCR reaction
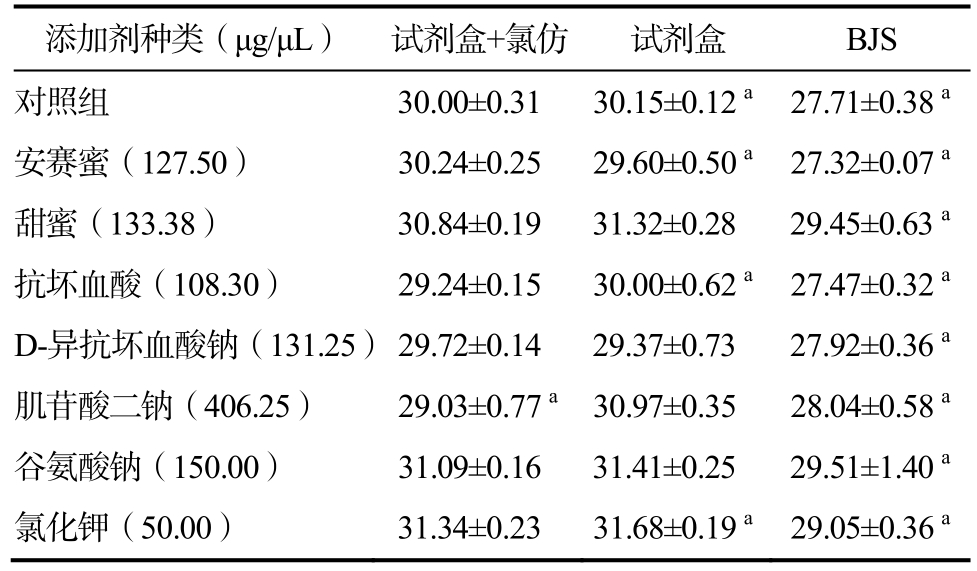
注:不同提取方法差异显著(P<0.05)用肩标a、b、c 表示。
Note: There were significant differences among different extraction methods (P < 0.05), which were indicated by shoulder label a, b and c.
添加剂种类(μg/μL) 试剂盒+氯仿 试剂盒 BJS对照组 30.00±0.31 30.15±0.12 a 27.71±0.38 a安赛蜜(127.50) 30.24±0.25 29.60±0.50 a 27.32±0.07 a甜蜜(133.38) 30.84±0.19 31.32±0.28 29.45±0.63 a抗坏血酸(108.30) 29.24±0.15 30.00±0.62 a 27.47±0.32 a D-异抗坏血酸钠(131.25)29.72±0.14 29.37±0.73 27.92±0.36 a肌苷酸二钠(406.25) 29.03±0.77 a 30.97±0.35 28.04±0.58 a谷氨酸钠(150.00) 31.09±0.16 31.41±0.25 29.51±1.40 a氯化钾(50.00) 31.34±0.23 31.68±0.19 a 29.05±0.36 a
3 结论
小分子食品添加剂化学性质差异大,对DNA是否有影响难以确定。本实验结果表明甜蜜素浓度大于133.38 μg/μL 时,检测不到DNA 紫外吸收峰,荧光PCR 反应亦呈假阴性,说明甜蜜素对DNA 的纯度有影响,需要继续确定甜蜜素与DNA的反应方式,从而选择对荧光PCR 假阴性反应较小的DNA 提取方法。安赛蜜、抗坏血酸、D-异抗坏血酸、肌苷酸二钠、检测不到DNA 紫外吸收峰的浓度远小于荧光PCR 假阴性的浓度,这些物质影响了DNA 的紫外吸收峰,但未影响荧光PCR 反应结果,有待进一步确定其与DNA 的作用方式和对荧光PCR 的影响方式。298.75 μg/μL浓度的肌苷酸二钠、100.00 μg/μL 的谷氨酸钠与对照组紫外吸收峰差异显著,此浓度小于荧光PCR 反应显假阴性浓度,可能与其在水溶液的溶解度有关。可能在荧光PCR 反应过程中随着温度的升高影响其与DNA 的作用方式,使得其出现假阴性的浓度高于对DNA 紫外吸收峰的影响浓度。本研究证明了添加剂对植物源性成分荧光PCR 检测具有影响作用,超过一定浓度的添加剂使得检测结果出现假阴性,会通过影响DNA 峰值而影响荧光PCR 反应的准确性。
已有研究表明柠檬酸、碳酸钠等添加剂浓度大于3.90 μg/μL、1.31 μg/μL 时对荧光PCR 反应产生抑制作用,与本次实验结果相吻合。证明了食品添加剂超过限值会使植物源性成分荧光PCR反应呈现假阴性。因此在进行植物蛋白饮料植物源性成分检测时,需要关注添加剂的含量,选取适宜的DNA 提取方法,以保证检验结果的准确性。
[1] OMS O, ODRIOZOLA S, MARTÍN B. Metabolomics for assessing safety and quality of plant-derived food[J]. Food Research International, 2013, 54(1): 1172-1183.
[2] QAMAR S, MANRIQUE Y, PAREKH H, et al. Nuts, cereals,seeds and legumes proteins derived emulsifiers as a source of plant protein beverages: a review[J]. Critical Reviews In Food Science And Nutrition, 2020, 35(16): 2742-2762.
[3] FORNASIER F, BEN D, FILODA P, et al. Fast methodology for identification of olive oil adulterated with a mix of different vegetable oils (article)[J]. Food Analytical Methods, 2019, 12(1):293-304.
[4] 丁清龙, 曾晓琮, 周露, 等. 广东省植物源性饮料掺假情况摸底调查[J]. 食品安全质量检测学报, 2018, 9(12): 2953-2957.DING Q L, ZENG X Z, ZHOU L, et al. Investigation of plantderived drinks adulteration in Guangdong[J]. Journal of Food Safety & Quality, 2018, 9(12): 2953-2957.
[5] MARKUS F, MARINA C. Food profiling analytical strategies for food authentication[J]. Journal Of Agricultural And Food Chemistry, 2020, 12(49): 14321-14322.
[6] CHOON H T, KONG I, IRFAN U, et al. Edible oils adulteration:a review on regulatory compliance and its detection technologies[J].Journal of Oleo Science, 2021, 13(10): 1343-1356.
[7] 张淑霞, 李珂, 祝伟霞, 等. 我国植物蛋白饮料掺假检测技术研究现状[J]. 粮食与食品工业, 2020, 27(1): 55-59.ZHANG S X, LI K, ZHU W X, et al. Research status of adulteration detection techonlogy for plant protein beverages in china[J]. Cereal & Food Industry, 2020, 27(1): 55-59.
[8] CHEN J J, XIA L X, WU X L, et al. A practical test system for sensitive, rapid screening and authentication of peanut allergens in imported and exported food products in Chinese customs[J].Food Control, 2012, 23(1): 154-158.
[9] 杨硕, 李诗瑶, 王鸣秋, 等. 市售椰子汁(植物蛋白饮料)中椰子、大豆、花生源性成分鉴定的分子生物学方法[J]. 基因组学与应用生物学, 2018, 37(10): 4511-4517.YANG S, LI S Y, WANG M Q, et al. Digital dropect PCR for the determination of peanut and soybean-derived component in coconut protein drink[J]. Genomics and Applied Biology, 2018,37(10): 4511-4517.
[10] FCOL M, MA S, SOUZA D E. Analytical methods in food additives determination: Compounds with functional applications[J].Food Chemistry, 2019, 8(2): 732-750.
[11] WANG R, HU S W, CHEN J. Analysis of citric acid and d-isoascorbic acid in beverages by high performance liquid chromatography[J]. E3S Web of Conferences, 2021, 251(3):2047-2053.
[12] 尹立明, 李旭, 魏莹, 等. 浅谈我国酱腌菜的生产现状及发展[J]. 中国调味品, 2012, 37(9): 16-18.YING L M, LI X, WEI Y, et al. Talking about the deveiopment of pickle[J]. China Condiment, 2012, 37(9): 16-18.
[13] 张洁, 刘元涛, 郝武斌. 食品增味剂模块化理论探讨[J]. 中国食品添加剂, 2019, 30(8): 172-176.ZHANG J, LIU Y T, HAO W B. Preliminary study on modularization theory of food flavor enhancer[J]. China Food Additives, 2019, 30(8): 172-176.
[14] YANG C, HO C, ZHANG J, et al. Antioxidants: differing meanings in food science and health science[J]. Journal Of Agricultural And Food Chemistry, 2018, 66(12): 3063-3068.
[15] 李银聪, 阚建全, 柳中. 食品抗氧化剂作用机理及天然抗氧化剂[J]. 中国食物与营养, 2011, 17(2): 24-26.LI Y C, KAN J Q, LIU Z. Food antioxidants mechanism and natural antioxidant[J]. Food and Nutrition in China, 2011, 17(2): 24-26.
[16] MASRE S, RAZALI N, NANI N, et al. Biochemical and histological effects of low dose of monosodium glutamate on the liver of adult male sprague-dawley rats[J]. Jurnal Sains Kesihatan Malaysia, 2019, 17(2): 107-112.
[17] 杜建中, 曾秀文, 黄少春, 等. 毛细管电泳法测定增味剂中的5′-肌苷酸二钠和5′-鸟苷酸二钠的含量[J]. 食品工业科技,2010, 31(12): 335-337.DU J Z, ZENG X W, HUANG S C, et al. Study on the determination of disodium 5'-inosinate, 5'-guanylate by capillary electrophoresis[J]. Science and Technology of Food Industry,2010, 31(12): 335-337.
[18] 毛琼丽, 李先芝, 严玲, 等. 酒类产品中10 种甜味剂含量检测方法[J]. 食品与发酵科技, 2021, 57(6): 113-119.MAO Q L, LI X Z, YAN L, et al. Simultaneous determination of 10 sweeteners in alcoholic drinks by HPLC-MS[J]. Food and Fermentation Science & Technology, 2021, 57(6): 113-119.
[19] 谭慧, 王洋, 潘峰, 等. 植物源性转基因食品PCR检测技术研究[J]. 中国卫生检验杂志, 2004, 13(4): 407-409.TAN H, WANG Y, PAN F, et al. PCR for identification of genetically modified plants in food[J]. Chinese Journal of Health Laboratory, 2004, 13(4): 407-409.
[20] 杨飞帆. 高效液相色谱法同时测定饮料中7 种防腐剂和2 种甜味剂[J]. 食品安全导刊, 2022, (8): 89-93.YANF F F. Rapid detection method of multipe 7 preservatives and 2 sweeteners in beverages by high performance liquid chromatography[J]. China Food Safety Magazine, 2022, 11(8):89-93.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。