花生是我国重要的油料作物之一,其蛋白含量在25%以上,营养价值与动物蛋白接近,约占世界蛋白质消费量的11%[1]。花生中含有8 种人体必需氨基酸[2],还具有改善脑血管、抗癌等功效,被称为“长生果”[3]。但是,花生蛋白乳化性与水溶性较差,这大大限制了其在食品,尤其在饮料中的应用。
酶工程技术是现代生物技术的重要组成部分,采用水酶法提取花生蛋白是以水作为媒介,经过破碎、提取、破乳和分离四个阶段,不使用有机溶剂,具有绿色环保、作用温和、安全等特点。目前水酶法提取工艺被广泛应用于棕榈[4]、向日葵籽[5]和油菜籽[6]等植物油提取。Chen 等[7]研究发现经纤维素酶处理后的花生细胞壁被破坏,油脂、蛋白更易提取而不破坏蛋白质的功能性。李响等[8]用酶法、挤压膨胀与挤压协同酶法处理的花生蛋白聚集物减少,溶解性提高,蛋白的起泡性与乳化性也得到改善。Tirgarian 等[9]使用Neutrase 与Pectinex 复合两种酶制剂辅助水提取(EAAE)工艺提取芝麻油与蛋白水解物,得到的蛋白水解物具有更高的碳水化合物含量,pH4.0 是蛋白为最低的溶解度和乳化活性。李佳笑等[10]用高压均质与中性蛋白酶制备的蛋白粉提高了在酸性条件下的溶解度,提高蛋白在酸性饮料中的应用。水酶法提取蛋白的优势是利用酶解大分子,促进蛋白和油脂释放,有利于蛋白提取,水解液根据密度差异和蛋白与油脂对水的亲和力进行分离[11],提高蛋白的溶解性、乳化性等功能性质。
目前水酶法提取植物蛋白大多采用单一的酶,采用复合酶制剂的研究比较少,本研究以多种酶分步水解花生蛋白,提高蛋白提取率,并优化试验,为花生蛋白的利用提供依据。
1 材料与方法
1.1 材料与试剂
山东鲁花11 号花生:千禾花生合作社;市售花生蛋白粉:浙江多味生物科技有限公司;Celluclast 1.5 L 复合纤维素酶、Neutrase 0.8 L 中性蛋白酶、Alcalase 2.4 L 碱性蛋白酶:诺维信公司;2709 碱性蛋白酶:庞博生物公司;氢氧化钠、磷酸氢二钠、磷酸二氢钠:天津索罗门生物科技有限公司;8-苯胺萘磺-1-酸盐(ANS):天津市江天化工技术股份有限公司。上述所有试剂均为分析纯。
1.2 仪器与设备
FA22048 分析天平:上海佑科仪器仪表有限公司;K9860 凯氏定氮仪:海能仪器股份有限公司;FE28 精密酸度计:梅特勒-托利多仪器(上海)有限公司;ACHH-4 数显恒温水浴锅:常州普天仪器制造有限责任公司;HK-08 摇摆式粉碎机:广州市旭朗机械设备有限公司;BeNano 90 Zate 纳米粒度电位分析仪、Bettersize2600 激光粒度分析仪:丹东百特仪器有限公司;SU1510 扫描电子显微镜:日本日立公司;UV-1800 紫外分光光度计:上海美谱达仪器有限公司;F-2500 荧光分光光度计:上海善福电子科技有限公司。
1.3 实验方法
1.3.1 酶制剂的筛选
选取Celluclast 1.5 L 复合纤维素酶、Neutrase 0.8 L 中性蛋白酶、Alcalase 2.4 L 碱性蛋白酶、2709 碱性蛋白酶四种酶对花生进行水解,参照最适宜条件进行实验,根据酶解条件pH 确定分步酶解。
1.3.2 花生蛋白的提取
取20 g 花生以1∶5 的料液比混合后超声处理,60 ℃碱提30 min,调节溶液pH 选择Celluclast 1.5 L 复合纤维素酶、Neutrase 0.8 L 中性蛋白酶进行酶解,结束后沸水灭菌15 min;再次调节溶液pH 选择Alcalase 2.4 L 碱性蛋白酶、2709 碱性蛋白酶进行第二步酶解,灭酶 15 min,最后4 000 r/min 离心15 min,120 ℃喷雾干燥收集蛋白粉密封保存。
1.3.3 蛋白提取率的计算
花生蛋白含量采用微量凯氏定氮法[12]测定,提取率计算公式如下:
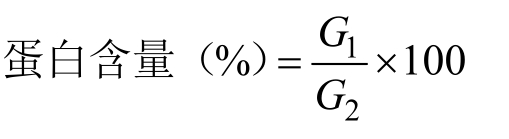
式中:G1 为水解液蛋白粉的蛋白质量(g);G2 为花生蛋白质量(g)。
1.3.4 复合酶提取工艺优化
固定第一步酶解条件,Celluclast 1.5 L 复合纤维素酶和Neutrase 0.8 L 中性蛋白酶的酶解温度45 ℃,pH6.5,时间2 h,选择复合酶(Celluclast 1.5 L 复合纤维素酶∶Neutrase 0.8 L 中性蛋白酶∶2709 碱性蛋白酶∶Alcalase 2.4 L 碱性蛋白酶=6∶5∶6∶4)的添加量、第二步酶解温度和pH 进行单因素工艺优化实验,在三个单因素实验基础下进行以蛋白提取率为指标的三因素三水平响应面优化实验,响应面因素与水平如表1。
表1 Box-Behnken 实验设计因素与水平
Table 1 Factors and levels of Box-Behnken test design

因素水平 酶添加量A/%酶解温度B/℃pH C-1 1.5 50 8.5 0 2.0 55 9.0 1 2.5 60 9.5
1.3.5 Zate 电位的测定
将蛋白粉溶解后稀释,用注射器将样液加入到Zate 电位测量池中,由电位分析仪,在室温温度25 ℃条件下平衡120 s 后对电位进行测定。
1.3.6 粒径分布的测定
参照孙协军等[13]的方法测定花生蛋白粒径分布,取蛋白粉样品分散在蒸馏水中,室温磁力搅拌2 h,将样品滴加到激光粒度分析仪的分散单元进行自动粒度测定,设置分散相与分散介质的折射率分别为1.52 和1.33,在分散器中搅拌,根据测定蛋白粉颗粒物的粒径大小以及粒径区间内颗粒物含量绘制粒径分布图。
1.3.7 扫描电镜观察微观结构
取适量粉末样品分散在在导电胶上,用洗耳球吹平粉末铺开,进行喷金处理后,在加速电压下扫描,收集图片。
1.3.8 蛋白溶解性的测定
取0.50 g 蛋白粉溶解于PBS 缓冲液(pH7.0,0.1 mol/L),室温条件下磁力搅拌1 h,4 000 r/min离心取上清液,用凯氏定氮法测蛋白含量,蛋白溶解度计算公式如下:
式中:W1 为水溶液中蛋白含量(%);W2 为蛋白粉蛋白含量(%)。
1.3.9 蛋白乳化性和乳化稳定性的测定
参考Zhang 等[14]的方法,并加以修改。取蛋白样品溶解于PBS 缓冲溶液,配制一定质量浓度的蛋白溶液,取10 mL 样品溶液与20 mL 菜籽油在50 mL 离心管中混合均匀,并在高速均质机中均质1 min,分别在均质结束后0 min 和10 min,在油液最底层取50 μL 分散在SDS(0.1%,w/v)溶液中。在500 nm 处测定吸光值A0 与A10,乳化活性(EAI)与乳化稳定性(ESI)计算公式如下:

式中:N 为稀释倍数;ρ 为蛋白质量浓度(g/mL);φ 为体系油相所占比数;A0 和A10 分别为0 和10 min 的吸光值。
1.3.10 表面疏水性的测定
参考许英一等[15]的描述用ANS 荧光探针法对花生蛋白表面疏水性进行测定。取一定量花生蛋白粉溶于PBS 缓冲溶液中(pH7.0,10 mmol/L),室温下磁力搅拌30 min,4 000 r/min 条件下离心10 min,取上清液用考马斯亮蓝法测定蛋白含量,将蛋白样品稀释为 0.02、0.04、0.06、0.08 和0.1 mg/mL,分别取4 mL 稀释液加40 μL ANS(8 mmol/L)避光反应1 h 后测定。荧光条件:激发波长390、发射波长470、狭缝宽度5 nm。蛋白表面疏水性为荧光强度与蛋白浓度所得斜率。
1.4 数据处理
实验数据用 origin 2022、Design-Expert.V8.0.6.1 进行作图,采用IBM SPSS Statistics 23对数据进行显著性分析,其中不同字母(a、b、c、d、e)表示显著差异(P<0.05)。所有实验均为重复3 次,结果用平均值±标准偏差表示。
2 结果与分析
2.1 酶制剂筛选效果
如表2 所示,四种酶制剂的最适宜pH 存在很大差异,根据 pH 确定工艺为分步酶解,Celluclast 1.5 L 复合纤维素酶和Neutrase 0.8 L 中性蛋白酶进行第一步酶解,2709 碱性蛋白酶和Alcalase 2.4 L 碱性蛋白酶为第二步酶解,根据表2 可知碱性条件下对蛋白提取率的影响较大,所以针对碱性条件下的酶解进行工艺优化。
表2 四种酶制剂酶解效果
Table 2 Enzymolysis effect of four enzyme preparations

酶种类 最适pH 蛋白提取率/%2709 碱性蛋白酶 8.5 62.37 Neutrase 0.8 L 中性蛋白酶 7.0 32.35 Celluclast 1.5 L 复合纤维素酶 6.5 20.89 Alcalase 2.4 L 碱性蛋白酶 9.0 73.91
2.2 复合酶响应面结果分析
2.2.1 响应面分析方案、实验结果分析
响应面实验设计与结果见表3,方差分析结果见表4。
表3 Box-Behnken 实验设计方案与结果
Table 3 Box-Behnken design and corresponding experimental results

实验号酶添加量A/%酶解温度B/℃pH C蛋白提取率Y/%1 1.5 50 9.0 71.41 2 2.5 50 9.0 80.67 3 1.5 60 9.0 74.91 4 2.5 60 9.0 79.97 5 1.5 55 8.5 74.22 6 2.5 55 8.5 85.36 7 1.5 55 9.5 79.48 8 2.5 55 9.5 88.99 9 2.0 50 8.5 74.67 10 2.0 60 8.5 77.82 11 2.0 50 9.5 83.40 12 2.0 60 9.5 81.59 13 2.0 55 9.0 89.42 14 2.0 55 9.0 88.59 15 2.0 55 9.0 89.43 16 2.0 55 9.0 88.26
表4 蛋白得率模型系数方差分析
Table 4 Analysis of variance of protein yield model coefficient

注:P 值小于0.05 表明该项显著;*为显著,**为高度显著。
Note: P value less than 0.05 indicates significant significance;* is significant and ** is highly significant.
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型 586.209 65.13 51.07 <0.000 1**A 152.851 152.85 119.84 <0.000 1**B 2.141 2.14 1.68 0.236 3 NS C 57.201 57.20 44.85 0.000 3**AB 4.411 4.41 3.46 0.105 3 NS AC 0.661 0.66 0.52 0.494 4 NS BC 6.161 6.16 4.83 0.064 0 NS A2 91.471 91.47 71.71 <0.000 1**B2 224.561 224.56 176.06 <0.000 1**C2 17.351 17.35 13.60 0.007 8**残差 8.937 1.28失拟项6.913 2.30 4.56 0.088 5 不显著纯误差2.024 0.51总和 595.1316
利用Design Expert 软件对表3 中的实验结果进行回归分析,得到蛋白提取率对酶添加量(A)、酶解温度(B)和pH(C)的二次回归拟合方程:Y=88.70+4.37A+0.52B+2.67C-1.05AB-0.41AC-1.24BC-4.66A2-7.30B2-2.03C2。
从分析结果可以看出,该回归模型具有高度显著性(P<0.000 1),改变蛋白提取条件对其提取率的影响有显著差异。失拟项不显著(P=0.088 5),说明该模型拟合度较好。回归系数 R2=98.50%,R2Adj=96.57%,说明该模型与实验数据高度拟合且结果可靠,表中模拟一次项A、C 对蛋白提取率的影响极显著,二次项A2、B2、C2 对蛋白提取率影响均显著,由F 值可知各因素对蛋白提取率影响大小为酶添加量(A)>酶解 pH(C)>酶解温度(B)。
2.2.2 复合酶提取条件的响应面优化分析
图1 的等高线图和响应曲面更直观的表现酶添加量、温度、pH 三因素两两之间相互作用对蛋白提取率的影响,曲面的倾斜程度与影响成正比[16]。图中可以看出蛋白提取率随酶添加量与pH 的增大而增大,而温度影响值是先增大后减小。由曲面图可以看出对蛋白提取率的影响因素大小关系为酶添加量(A)>酶解 pH(C)>酶解温度(B),此结果与方差结果一致。

图1 两因素交互作用对蛋白提取率的影响
Fig.1 Effect of two-factor interaction on protein extraction rate
经Design-Expert.V8.0.6.1 分析结果预测,复合酶最优提取工艺为酶添加量 1.85%、温度54.81 ℃、pH9.25,此条件下蛋白提取率87.89%。结合实际情况调整为酶添加量1.8%、温度55 ℃、pH9.2,在此条件下进行3 次实验验证,经测定蛋白提取率为89.21%,与预测值相差1.32%。因此通过响应面设计的蛋白提取工艺参数准确可用。
2.3 蛋白粉的性能评估
2.3.1 Zate 电位
Zate 电位绝对值可以反应蛋白溶液中颗粒物相互作用的大小,电位绝对值与静电排斥力成正比,绝对值越大,溶液稳定性越好[17]。酶提取对蛋白粉Zate 电位的影响如图2 所示,所有蛋白样品的Zate 电位值均为负值,说明花生蛋白表面带负电荷。相比水提取与市售蛋白粉,Celluclast 1.5 L 复合纤维素酶对蛋白Zate 电位绝对值没有显著性变化,而其他酶制剂提取蛋白的Zate 电位绝对值都显著增大,说明这几种酶制剂有助于提高蛋白溶液的稳定性。
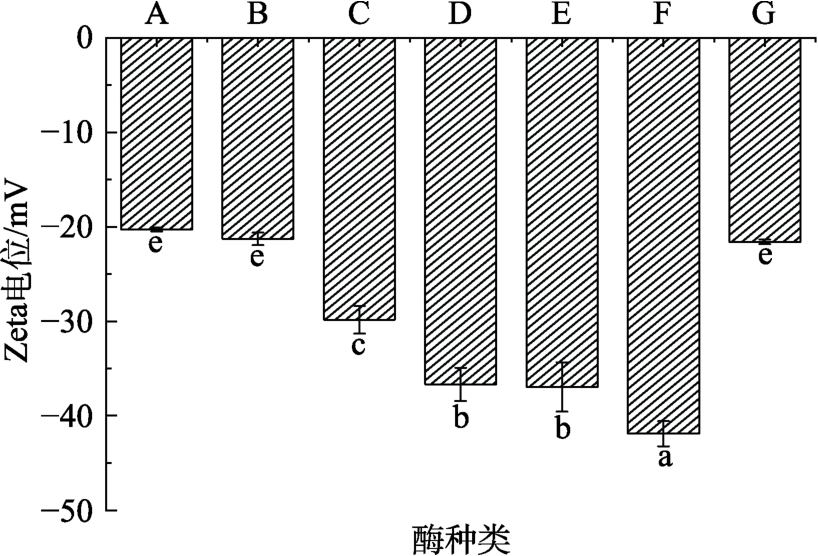
图2 酶法提取对蛋白Zate 电位的影响
Fig.2 Effect of enzymatic extraction on Zate potential of protein
(A:水提法;B:Celluclast 1.5 L 复合纤维素酶;C:Neutrase 0.8 L 中性蛋白酶;D:2709 碱性蛋白酶;E:Alcalase 2.4 L 碱性蛋白酶;F:复合酶;G:市售蛋白粉)
(A: Water extraction; B: Celluclast 1.5 L complex cellulase;C: Neutrase 0.8 L neutral protease; D: 2709 alkaline protease; E:Alcalase 2.4 L alkaline protease; F: Complex enzyme; G:Commercially available protein powder)
2.3.2 粒径分布
图3 为酶法提取得到的蛋白粉的粒径分布,以体积百分比表示,粒径越小其蛋白越有助于吸收[18]。从图中可以看出除了复合酶与市售蛋白粉为单峰,水提法与单一酶法得到的蛋白粉均出现两个峰,表明复合酶与市售蛋白粉分布均匀。复合酶与2709 碱性蛋白酶处理后小粒径体积分数增大,表明这两种酶处理后的蛋白有较多部分的聚集体发生解离,与乔菁华[19]研究结果相似。单一酶处理后的粒径变化明显,其峰均出现右移变宽,粒径变大,可能酶处理会使蛋白部分空间结构发生变化,蛋白发生聚集粒径变大。

图3 酶法提取对蛋白粒径的影响
Fig. 3 Effect of enzymatic extraction on protein particle size
2.3.3 微观结构
扫描电镜被用来观察不同蛋白酶处理得到的蛋白粉的微观结构,如图4 所示,被2.00 K 倍放大的样品基本以折叠或起皱的球状形式存在。水提法制备的蛋白样品与市售蛋白粉的颗粒物大、聚集明显。经过酶处理后聚集状态有所改善,相对于复合酶,单一酶处理得到的蛋白粉表面出现很多沟壑,而复合酶得到的蛋白粉表面分布均匀,结构疏松,这更有利于消化。

图4 酶法处理后蛋白粉扫描电子显微镜图
Fig.4 Scanning electron microscope image of protein powder after enzymatic treatment
(A:水提法;B:Celluclast 1.5 L 复合纤维素酶;C:Neutrase 0.8 L 中性蛋白酶;D:2709 碱性蛋白酶;E:Alcalase 2.4 L 碱性蛋白酶;F:复合酶;G:市售蛋白粉)
(A: Water extraction; B: Celluclast 1.5 L complex cellulase; C: Neutrase 0.8 L neutral protease; D: 2709 alkaline protease; E: Alcalase 2.4L alkaline protease; F: Complex enzyme; G: Commercially available protein powder)
2.3.4 蛋白溶解性
溶解性是蛋白在水中的溶解能力,在测定蛋白性质中起着重要作用,良好的溶解性对蛋白乳化性和起泡性至关重要,植物蛋白溶解性差,限制了其在食品中的应用[20]。蛋白溶解在水中时,蛋白质-蛋白质的作用力会转变为蛋白质-水分子的作用力[21],极性区域中蛋白相互作用力(氢键与静电力)被影响。对酶法提取得到的蛋白溶解性进行测定,结果如图5 所示,经过酶处理后的蛋白粉溶解性相比较水提法都显著增大,如图4(A)所示水提法得到蛋白粉具有较紧密的结构,蛋白溶解性较低。Celluclast 1.5 L 复合纤维素酶处理得到的蛋白质—COO-、—NH3+等极性基团增加,蛋白构象发生变化,更有利于亲水性。蛋白溶解性的提高也可能是经酶处理后的蛋白疏基断裂,分子质量降低,肽链舒展,更多的亲水基团暴露,不溶性聚集物含量降低,蛋白溶解性升高[22]。复合酶提取的蛋白粉溶解性达到97.69%,市售蛋白粉溶解性最低为73.83%。酶法处理得到的蛋白溶解性的大小顺序:复合酶>Alcalase 2.4 L 碱性蛋白酶>2709 碱性蛋白酶>Celluclast 1.5 L 复合纤维素酶>Neutrase 0.8 L 中性蛋白酶>水提法>市售蛋白粉。

图5 酶法提取对蛋白溶解性的影响
Fig.5 Effect of enzymatic extraction on protein solubility
(A:水提法;B:Celluclast 1.5 L 复合纤维素酶;C:Neutrase 0.8 L 中性蛋白酶;D:2709 碱性蛋白酶;E:Alcalase 2.4 L 碱性蛋白酶;F:复合酶;G:市售蛋白粉)
(A: Water extraction; B: Celluclast 1.5 L complex cellulase;C: Neutrase 0.8 L neutral protease; D: 2709 alkaline protease; E:Alcalase 2.4L alkaline protease; F: Complex enzyme; G:Commercially available protein powder)
2.3.5 蛋白乳化性能
蛋白质的乳化性(EAI)表征了其形成乳液的能力,而乳化稳定性(ESI)表征其乳液的稳定性与抵抗乳化因子的能力[23]。酶法提取蛋白的乳化性与乳化稳定性如图6 所示,Celluclast 1.5 L 复合纤维素酶、Neutrase 0.8 L 中性蛋白酶、2709 碱性蛋白酶、Alcalase 2.4 L 碱性蛋白酶、复合酶处理的蛋白质的乳化活性都出现显著升高,乳化活性分别为19.89、23.08、44.26、39.88、45.26 m2/g。蛋白质的物理化学性质如表面电荷、疏水性、溶解性等对蛋白的乳化性质至关重要[24],蛋白乳化性与溶解性存在一定的相关性,而乳化稳定性与溶解性不存在这种关系。由于酶的剪切作用,花生蛋白质中部分蛋白发生变性,内部分子结构发生变化,蛋白质的亲水基团表露出来,从而提高蛋白质的乳化能力,复合酶处理得到的蛋白粉的乳化性最高,同时证明蛋白质的乳化性与溶解性存在正相关关系。蛋白质的乳化稳定性差异性很小,Alcalase 2.4 L 碱性蛋白酶处理后的蛋白乳化稳定性最低,复合酶得到的蛋白质的乳化稳定性相比略高,可能是部分蛋白被过度水解为小分子多肽,使其在油水界面的相互作用受到抑制,肽段之间的电荷斥力造成乳状液的稳定性降低。

图6 酶法提取对蛋白乳化特性的影响
Fig.6 Effect of enzymatic extraction on emulsifying properties of protein
(A:水提法;B:Celluclast 1.5 L 复合纤维素酶;C:Neutrase 0.8 L 中性蛋白酶;D:2709 碱性蛋白酶;E:Alcalase 2.4 L 碱性蛋白酶;F:复合酶;G:市售蛋白粉)
(A: Water extraction; B: Celluclast 1.5 L complex cellulase;C: Neutrase 0.8 L neutral protease; D: 2709 alkaline protease; E:Alcalase 2.4 L alkaline protease; F: Complex enzyme; G:Commercially available protein powder)
2.3.6 蛋白表面疏水性
表面疏水性是影响蛋白功能性质的重要因素,也是影响蛋白大分子之间作用力的因素之一。表面疏水性是与周围体相水接触的蛋白质的非极性表面部分,可以用来表征蛋白质或肽分子表面疏水性氨基酸的分布[25]。结果如图7 所示,经过不同酶的处理,蛋白表面疏水性发生显著性变化,蛋白质长链展开疏水氨基酸暴露,从而表面疏水性增强。Bigelow 等[26]认为表面疏水性与溶解性、电荷频率存在着一定的关系,低表面疏水性、高电荷频率能够提高溶解性,但本实验经过酶处理,蛋白表面疏水性与溶解性并不存在这样的关系,可能是电荷频率对蛋白溶解性的影响高于表面疏水性,这与许英一[15]实验结果相同。

图7 酶法提取对蛋白表面疏水性的影响
Fig.7 Effect of enzymatic extraction on protein surface hydrophobicity
(A:水提法;B:Celluclast 1.5 L 复合纤维素酶;C:Neutrase 0.8 L 中性蛋白酶;D:2709 碱性蛋白酶;E:Alcalase 2.4 L 碱性蛋白酶;F:复合酶;G:市售蛋白粉)
(A: Water extraction; B: Celluclast 1.5 L complex cellulase;C: Neutrase 0.8 L neutral protease; D: 2709 alkaline protease; E:Alcalase 2.4 L alkaline protease; F: Complex enzyme; G:Commercially available protein powder)
3 结论
本研究开展了水酶法提取花生蛋白的工艺研究。通过酶制剂的筛选,选择多种酶分步酶解花生蛋白,采用响应面优化蛋白提取工艺,通过Box Behnken 实验设计建立数学模型,得出最优工艺条件为复合酶的添加量1.8%,最适宜温度55 ℃,适宜的 pH9.2,在此条件下蛋白提取率达到89.21%。经过蛋白粉性能评估,复合酶提取得到的蛋白粉在溶液中稳定性较高,小颗粒物质增多且分布均匀,蛋白溶解性高达97.69%,蛋白的乳化特性也得到极大改善。分步复合酶法提取工艺对花生蛋白溶解性与乳化性的改善为花生蛋白饮料行业的发展提供了更有价值的理论支持,在蛋白饮料行业将会有更广泛的应用。
[1] LIU Y, LIU K, ZHAO Y. Effect of storage conditions on the protein composition and structure of peanuts[J]. ACS Omega,2022, 7: 21694-21700.
[2] KOTTAPALLI K R, PAYTON P, RAKWAL R, et al. Proteomics analysis of mature seed of four peanut cultivars using two-dimensional gel electrophoresis reveals distinct differential expression of storage, anti-nutritional, and allergenic proteins[J].Plant Science, 2008, 175: 321-329.
[3] 于丽娜, 张初署, 毕洁, 等. 不同花生品种制作花生芽及营养成分分析[J]. 食品工业科技, 2017, 38: 304-309.YU L L, ZHANG C Z, BI J, et al. Preparation of peanut buds and analysis of nutritional constituents of different peanut varieties[J]. Science and Technology of Food Industry, 2017, 38:304-309.
[4] ZHANG W, LEONG S M, ZHAO F, et al. Viscozyme L pretreatment on palm kernels improved the aroma of palm kernel oil after kernel roasting[J]. Food Research International, 2018,107: 172-181.
[5] AQUINO D S, FANHANI A, STEVANATO N, et al. Sunflower oil from enzymatic aqueous extraction process: Maximization of free oil yield and oil characterization[J]. Journal of Food Process Engineering, 2019, 42: 13169.
[6] NIU Y X, LI W, ZHU J, et al. Aqueous enzymatic extraction of rapeseed oil and protein from dehulled cold-pressed double-low rapeseed cake[J]. International Journal of Food Engineering,2012, 8(3): 296-300.
[7] LIU C, HAO L, CHEN F, et al. Study on extraction of peanut protein and oil bodies by aqueous enzymatic extraction and characterization of protein[J]. Journal of Chemistry, 2020, 69:1-11.
[8] 李响, 张焕丽, 郭世龙, 等. 不同改性方法对花生蛋白理化特性影响研究[J]. 中国粮油学报, 2021, 36(9): 101-108.LI X, ZHANG H L, GUO S L, et al. Effects of different modification methods on physicochemical properties of peanut protein[J]. Journal of the Chinese Cereals and Oils Association,2021, 36(9): 101-108.
[9] TIRGARIAN B, FARMANI J, MLANI J M. Enzyme-assisted aqueous extraction of oil and protein hydrolysate from sesame seed[J]. Journal of Food Measurement and Characterization,2019, 13: 2118-2129.
[10] 李佳笑, 石爱民, 赵志浩, 等. 高压均质-酶解改性提高酸性条件下花生蛋白的溶解性及其稳定性研究[J]. 核农学报,2021, 35: 1356-1366.LI J X, SHI A M, ZHAO Z H, et al. Study on the solubility and stability of peanut protein modified by high pressure homogenization and enzymolysis under acidic conditions[J].Journal of Nuclear Agriculture, 2021, 35: 1356-1366.
[11] MAT YUSOFF M, GORDON M H, NIRANJAN K. Aqueous enzyme assisted oil extraction from emulsion de-emulsifying methods: A review[J]. Trends in Food oilseeds and Science &Technology, 2015, 41: 60-82.
[12] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中蛋白质的测定: GB 5009.5—2016[S]. 北京: 中国标准出版社, 2016.National Health and Family Planning Commission of the People’s Republic of China, State Food and Drug Administration.Determination of protein in food safety National Standard: GB 5009. 5—2016[S]. Beijing: Standards Press of China, 2016.
[13] 孙协军, 时广源, 魏雅静, 等. 超声波辅助冷冻对海鲈鱼肌原纤维蛋白理化性质的影响[J]. 食品与发酵科技, 2022, 58:20-24.SUN X J, SHI G Y, WEI Y J, et al. Effects of ultrasonic assisted freezing on physicochemical properties of myofibrillar proteins of sea bass[J]. Food and Fermentation Science and Technology,2022, 58: 20-24.
[14] ZHANG S B, LU Q Y. Characterizing the structural and surface properties of proteins isolated before and after enzymatic demulsification of the aqueous extract emulsion of peanut seeds[J]. Food Hydrocolloids, 2015, 47: 51-60.
[15] 许英一, 刘迪, 林巍, 等. 热处理改性燕麦蛋白部分性质与表面疏水性的关系[J]. 食品工业, 2021, 42: 176-179.XU Y Y, LIU D, LIN W, et al. Relationship between partial properties and surface hydrophobicity of oat protein modified by Heat treatment[J]. Food Industry, 2021, 42: 176-179.
[16] 马丽媛, 李杨, 尚尔坤, 等. 基于响应面法的杂粮粉酶解工艺优化[J]. 食品工业, 2021, 42: 6-9.MA L Y, LI Y, SHANG Er K, et al. Optimization of enzymatic hydrolysis process of multi-grain meal based on response surface method[J]. Food Industry, 2021, 42: 6-9.
[17] ZHANG Y, XIE L, FENG S, et al. Mechanistic study on the nanocomplexation between curcumin and protein hydrolysates from Great Northern bean (Phaseolus vulgaris L. ) for delivery applications in functional foods[J]. Lwt, 2021, 139: 110572.
[18] 崔亚丽, 李莹莹, 栾广忠, 等. 豆浆粒径与豆浆品质的关系研究[J]. 大豆科学, 2012, 31: 103-107.CUI Y L, LI Y Y, LUAN G Z, et al. Study on the relationship between soymilk grain size and soymilk quality[J]. Soybean Science, 2012, 31: 103-107.
[19] 乔菁华. 酶解法对缫丝废水分离蛋白表面性能的影响[J]. 大众科技, 2020, 22: 50-55.QIAO J H. Effect of enzymatic hydrolysis on the surface Properties of protein isolated from silk reeling wastewater [J].Science and Technology in Public, 2020, 22: 50-55.
[20] FAN Q, WANG P, ZHENG X, et al. Effect of dynamic high pressure microfluidization on the solubility properties and structure profiles of proteins in water-insoluble fraction of edible bird's nests[J]. Lwt, 2020, 132(1): 109923.
[21] 刘军军. 花生水代法提油过程中蛋白质结构变化规律及回收应用技术研究[D]. 无锡: 江南大学, 2020.LIU J J. Study on protein structure change and recovery technology of peanut oil extraction by water substitution method[D]. Wuxi: Jiangnan University, 2020.
[22] ZHENG X Q, WANG J T, LIU X L, et al. Effect of hydrolysis time on the physicochemical and functional properties of corn glutelin by Protamex hydrolysis[J]. Food Chemistry, 2015, 172:407-415.
[23] BOYE J I, AKSAY S, ROUFIK S, et al. Comparison of the functional properties of pea, chickpea and lentil protein concentrates processed using ultrafiltration and isoelectric precipitation techniques[J]. Food Research International, 2010,43: 537-546.
[24] GAO L L, LI Y Q, WANG Z S, et al. Physicochemical characteristics and functionality of tree peony (Paeonia suffruticosa Andr. ) seed protein[J]. Food Chemistry, 2018, 240:980-988.
[25] 江利华. 水酶法提取花生油和水解蛋白的中试工艺及花生ACE 抑制肽的研究[D]. 无锡: 江南大学, 2010.JIANG L H. Study on the pilot technology of water enzymatic extraction of Peanut oil and hydrolyzed protein and ACE inhibitory peptide of peanut[D]. Wuxi: Jiangnan University,2010.
[26] BIGELOW C C. On the average hydrophobicity of protein and the relation between it and protein structures[J]. Theoret Biol,1967, 16: 187-211.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。