黄曲霉毒素B1(Aflatoxin B1,AFB1)是黄曲霉和寄生曲霉等某些菌株产生的双呋喃环类毒素,含有一个双呋喃环和一个氧杂萘邻酮,主要污染花生、玉米等粮食作物。黄曲霉毒素B1耐热性强,温度达到280 ℃才开始裂解,故一般家庭的加工烹调温度难以将其破坏。黄曲霉毒素B1对肝脏组织的破坏性极强[1-3],被世界卫生组织(World Health Organization,WHO)确定为毒性最强的真菌毒素之一[4]。《食品安全国家标准 食品中真菌毒素限量》(GB 2761—2017)标准规定了花生及其制品中限量为20 μg/kg[5]。
目前广泛用于检测黄曲霉毒素B1的方法主要有荧光分光光度法、高效液相色谱法、高效液相色谱-质谱联用法、酶联免疫吸附法、薄层层析法、金标免疫层析检测技术等, 其中胶体金免疫层析方法目前已经是比较成熟的快速检测技术,并且已广泛地应用于细菌、病毒、药物安全、食品安全以及其他物质等领域的检测中[6-15]。
因为目前阶段我国的快检产品生产门槛相对较低,也没有发布有关花生及其制品中黄曲霉毒素B1胶体金快速检测试剂盒的相关评价标准,而且各个企业研发的水平也相差较远,各自的生产工艺也不尽相同,导致市面上销售的快检试剂盒的质量水平参差不齐,并且不排除低质量的以及不合格的快检产品进入市场,不仅影响了快检实验结果的准确率,更是严重影响了快检方法在基层食品检测中的推广。所以进行花生及其制品中黄曲霉毒素B1快速检测试剂盒的质量评价的研究工作极具良好的社会面效益。
本研究通过对市场调研以及考察市售试剂盒的绝对灵敏度和最大稀释比例,选取了3种花生及其制品中黄曲霉毒素B1快速检测胶体金试剂盒产品,以油炸花生、烘烤花生及花生酱为代表性的基质,优化样品提取的前处理条件,根据《食品快速检测方法评价技术规范》(食药监办科[2017]43号)中规定的性能指标,对检测限、特异性、灵敏度、假阳性率、假阴性率和相对准确度进行统一的技术评价,旨在为制定花生及其制品中黄曲霉毒素B1胶体金快速检测评价标准提供科学的依据。
1 材料与方法
1.1 材料与试剂
乙腈(C2H3N,色谱纯)、无水乙醇(C2H6O,分析纯)、盐酸(HCl,分析纯)、三羟甲基氨基甲烷(C4H11NO3,分析纯)、氯化钠(NaCl,分析纯)、胶体金试纸条、烘烤花生和油炸花生中黄曲霉毒素B1质控样品:北京美正检测技术有限公司;花生酱(四季宝)、黄曲霉毒素B1标准品:Sigma。
1.2 仪器与设备
高效液相色谱仪(WatersE2695)、色谱柱(XBridgeC18 150×4.6 mm 3.5 μm):美国Waters;Milli-Q 超纯水发生器:美国Millipore;电子天平(MS204TS、MS4002S):瑞士梅特勒公司;pH计(PHSJ-5):上海雷磁仪器厂;冷冻离心机(3-18KS)、移液枪(10 mL、5 mL、1 mL、200 μL):德国Eppendorf;涡旋仪(QL-866):海门市其林贝尔仪器制造有限公司。
检测器:荧光检测器(激发波长 360 nm;发射波长440 nm);衍生方式:光衍生;柱温:35 ℃;流动相(V甲醇∶V水=40∶60);流速0.8 mL/min;等度流脱;进样体积:10 μL。
1.3 实验方法
1.3.1 优化提取溶液
称取花生酱样品(黄曲霉毒素B1的浓度为5.24 μg/kg)5 g,分别用40%乙醇-水溶液、50%乙醇-水溶液、60%乙醇-水溶液、70%乙醇-水溶液、80%乙醇-水溶液、90%乙醇-水溶液、95%乙醇-水溶液、无水乙醇溶液、70%甲醇-水溶液和84%乙腈-水溶液等10种溶剂各20 mL进行提取。按《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》(GB 5009.22—2016)标准第三法进行测定并计算提取效率,同时称取5 g样品进行加标平行实验,加标量为11 μg/kg,并计算回收率。
1.3.2 溶剂体积的优化
称取花生酱样品(黄曲霉毒素B1的浓度为5.24 μg/kg)5 g,分别用50%乙醇-水溶液8、12、15、20、30 mL,和20.0 mL 84%乙腈-水溶液进行提取,按照GB 5009.22—2016标准第三法进行测定并计算提取效率,同时称取5 g样品进行加标平行实验,加标量为50 μg/kg,并计算回收率。
1.3.3 胶体金试纸条绝对灵敏度测试
用0.01 mol/L PBS缓冲溶液将黄曲霉毒素B1标准品稀释成0、0.1、0.2、0.3 ng/g以及0.05、0.06、0.07、0.08、0.09 ng/g 2个梯度的标准溶液系列。按照胶体金试纸条说明书操作步骤吸取150 μL(200 μL)的标准品至冻金孔中,混匀孵育后插入试纸条(或者点到检测卡)。对同品牌试纸条进行颜色比对,有明显颜色变化时的黄曲霉毒素的最小浓度确定为该试纸条的绝对灵敏度。
1.3.4 优化最佳稀释比例
采用空白样品加标的方式,加标浓度为10、16以及20 μg/kg。称取花生酱样品5 g,加50%乙醇-水溶液20 mL进行斡旋震荡,再4 000 r/min离心5 min,取100 μL上清液加不同体积的稀释液进行实验。
1.3.5 优化离心转速及时间
采用质控样的方式,称取5 g烘烤花生样品,加20 mL的50%乙醇-水溶液斡旋震荡后,分别2 000、4 000、6 000 r/min,离心3、5、7 min后,取100 μL上清液加2 200 μL稀释液后用试剂条检测。
1.3.6 稀释液pH的优化
根据企业提供的产品用缓冲液为1 mol/L Tris(pH=8.5)+1%氯化钠,采用质控样和空白样品加标的方式,称取5 g油炸花生、烘烤花生及花生酱样品,加20 mL的50%乙醇-水溶液斡旋震荡后,4 000 r/min离心5 min取100 μL上清液加2 200 μL稀释液,pH分别为8.0、8.5和8.9,用试剂条检测。
1.3.7 优化温育温度
采用质控样和空白样品加标的方式,称取5 g油炸花生、烘烤花生及花生酱样品,加20 mL的50%乙醇-水溶液斡旋震荡后,4 000 r/min离心5 min取100 μL上清液加2 200 μL稀释液,取200 μL待测液于红色微孔中,多次抽吸混合均匀后,分别在10、20、30、40、50 ℃温育条件下孵育3 min,将试纸条插入到微孔中,反应3 min后,取出试纸条,去掉下端样品垫,并进行结果判读。
1.3.8 待测液-微孔孵育时间以及试纸条-待测液反应时间测试
采用质控样和空白样品加标的方式,称取5 g油炸花生、烘烤花生及花生酱样品,加20 mL的50%乙醇-水溶液斡旋震荡后,4 000 r/min离心5 min取100 μL上清液加2 200 μL稀释液后,取200 μL待测液于红色微孔中,多次抽吸混合均匀后,分别孵育1、3、5、7 min,将试纸条插入到微孔中,分别反应1、3、5、7 min后,取出试纸条,去掉下端样品垫,并进行结果判读。
1.3.9 试纸条检出限测试
采用质控样和空白样品加标的方式,称取5 g油炸花生、烘烤花生及花生酱样品,加20 mL的50%乙醇-水溶液斡旋震荡后,4 000 r/min离心5 min取100 μL上清液加2 200 μL稀释液后用试剂条检测。
1.3.10 交叉反应
将脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、黄曲霉毒素M1的标准溶液用0.01 mol/L PBS缓冲溶液逐步稀释(0.1、1、10、100 μg/L和0.08~0.5 μg/L),进行交叉反应实验。
1.3.11 验证实验
采用质控样和空白样品加标的方式,称取5 g油炸花生、烘烤花生及花生酱样品,加20 mL的50%乙醇-水溶液斡旋震荡后,4 000 r/min离心5 min取100 μL上清液加2 200 μL稀释液后用试剂条检测。每个基质每个浓度各检测50个平行,并计算假阴性率、假阳性率、灵敏度、特异性、相对准确度等指标。
2 结果与分析
2.1 市场调研结果
目前市面上在售的检测黄曲霉毒素B1 的胶体金试剂盒厂家较多,但其中有部分厂家是代工生产的,其中应用较广泛的为以下16家企业的胶体金快检产品,产品概况见表1。
表1 黄曲霉毒素B1快速检测产品概况
Table 1 Overview of Aflatoxin B1 rapid detection products

序号 厂家 产品形式 判定形式 检出限/(μg/kg) 适用基质1 A 微孔定性 比色法 20 花生酱,花生制品2 B 微孔定性 比色法 20 花生酱,坚果籽类及其制品3 C 微孔定性 比色法 20 花生酱、烘烤花生、油炸花生4 D 微孔定性 比色法 20 粮谷类、花生及花生制品、植物油、饲料、牛奶等复合蛋白饮品5 E 微孔定性 比色法 3~5 谷物、饲料、花生、食用油6 F 微孔定性 比色法 20 粮油、食品、饲料7 G 微孔定性 比色法 20 食用植物油、粮食(谷物)、饲料及酱料8 H 微孔定性 比色法 / 谷物、食用油、饲料9 I 微孔定性 消线法 20 小麦、玉米等谷物及饲料和食用油10 J 微孔定性 消线法 20 粮食、饲料11 K 微孔定性 消线法 20 粮食作物(玉米、大米、花生、小麦、面粉 )、饲料及粮食发酵产物(酱油、食醋、米酒等)12 L 微孔定性 消线法 5~50 谷物、饲料13 M 微孔定性 消线法 5~100 谷物、饲料14 N 免疫层析法 读数仪 2 玉米15 O 酶联免疫定量 定量测定 5 谷物16 P 酶联免疫定性 定性 / 谷物、坚果、调味料
目前使用比较多的黄曲霉毒素B1快速检测产品其基质多为谷物、饲料、花生和食用油,以定性测定为主,定量法多为酶联免疫类产品,以比色法为主,也有小部分消线法产品。因消线法产品不能涵盖坚果类产品,且因消线法对金标抗体要求较为严格,以及画线工艺T线处有印迹而造成结果误判,近年来胶体金消线法产品的市场占有率在逐步下降。市场上销售的适用于花生及其制品基质的胶体金快检产品均为比色法,因此本方法研究过程选取了比色法产品。
2.2 提取溶液的优化结果
市场调研中统计了花生及其制品的黄曲霉毒素B1胶体金快检产品所采用的提取溶剂以及料液比见表2。
表2 市面上所售产品所采用的提取溶液和提取料液比
Table 2 The ratio of extraction solution and extraction material to liquid for commercially available products
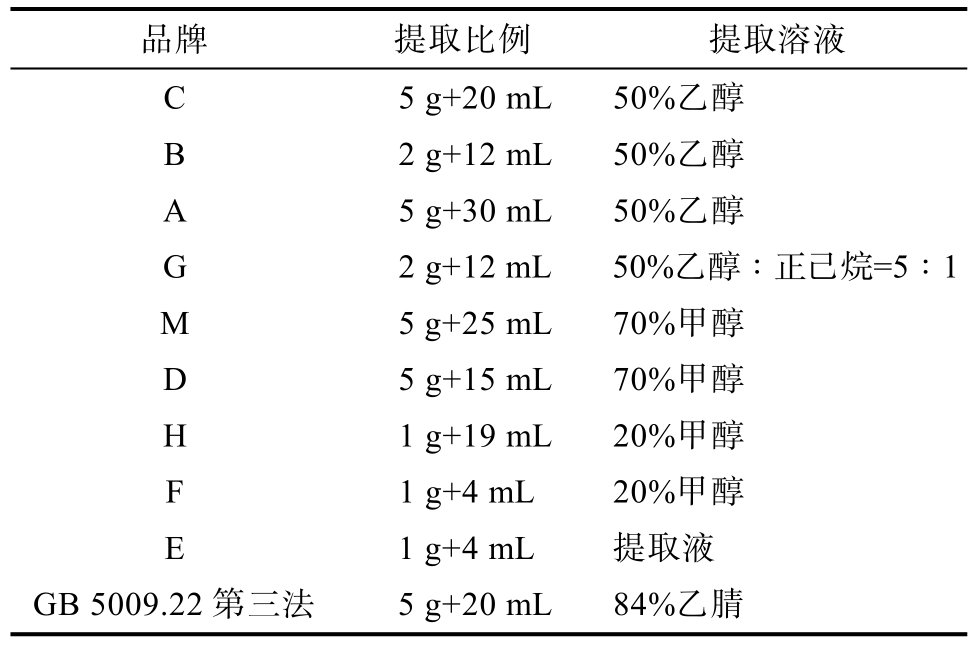
品牌 提取比例 提取溶液C 5 g+20 mL 50%乙醇B 2 g+12 mL 50%乙醇A 5 g+30 mL 50%乙醇G 2 g+12 mL 50%乙醇∶正己烷=5∶1 M 5 g+25 mL 70%甲醇D 5 g+15 mL 70%甲醇H 1 g+19 mL 20%甲醇F 1 g+4 mL 20%甲醇E 1 g+4 mL 提取液GB 5009.22第三法 5 g+20 mL 84%乙腈
样品测定结果和回收率情况详见图1 。
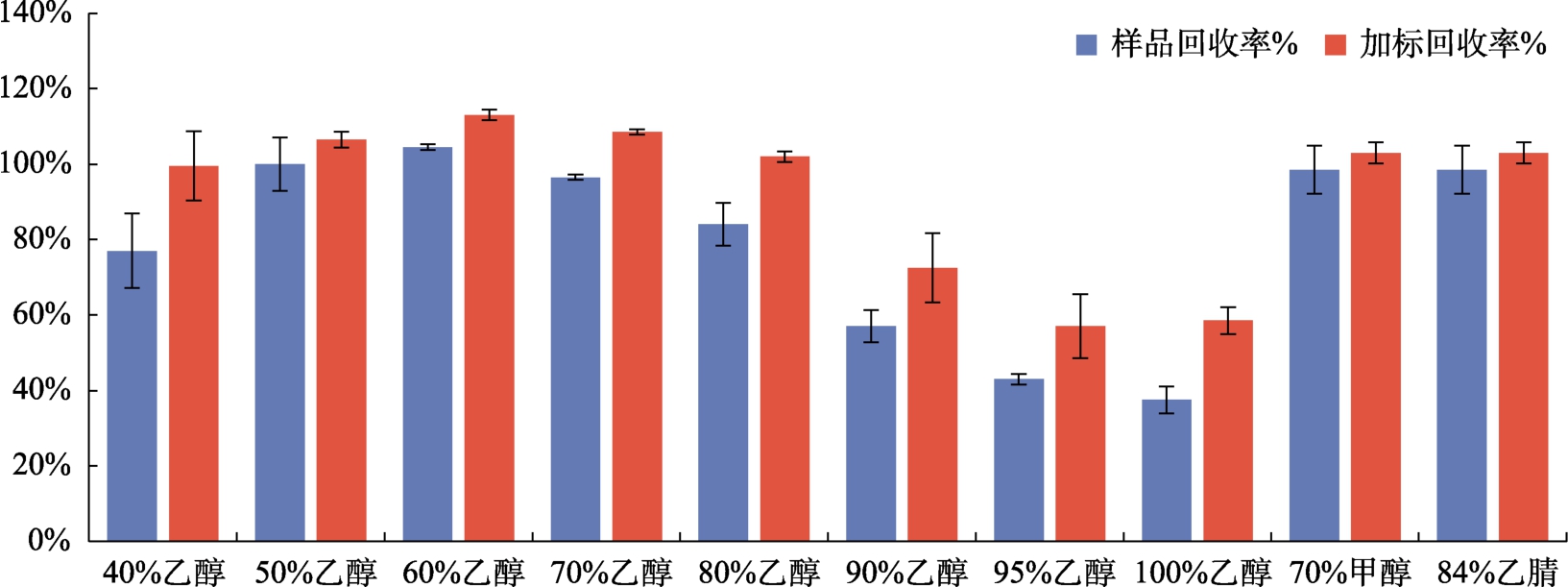
图1 不同提取溶液的提取效率
Fig.1 Extraction efficiency of different extraction solutions
由图1可知,随着提取溶液中乙醇浓度的增加,黄曲霉毒素B1的提取效率呈先上升后下降的趋势,在60%乙醇浓度时达到最高。而在GB 5009.22—2016第三法中使用的84%乙腈溶液和70%的甲醇溶液的提取效率为98%,加标回收率为103%。通过柱形图可以得出50%乙醇浓度时提取效率为100%,加标的回收率为107%,与GB 5009.22—2016第三法的溶剂回收率更接近,而60%乙醇浓度的加标回收率高达112%,误差较大。考虑到快检操作现场环境条件,GB 5009.22—2016方法用的乙腈-水溶液和甲醇-水溶液的毒性较大,因此在满足本方法对提取效率要求的前提下,本方法选取50%乙醇-水溶液作为提取溶液,但不做限定,可依据各厂家产品说明书规定的提取溶液进行操作。
2.3 提取用溶剂体积的优化结果
不同体积的50%乙醇-水溶液测定结果和回收率结果详见图2。
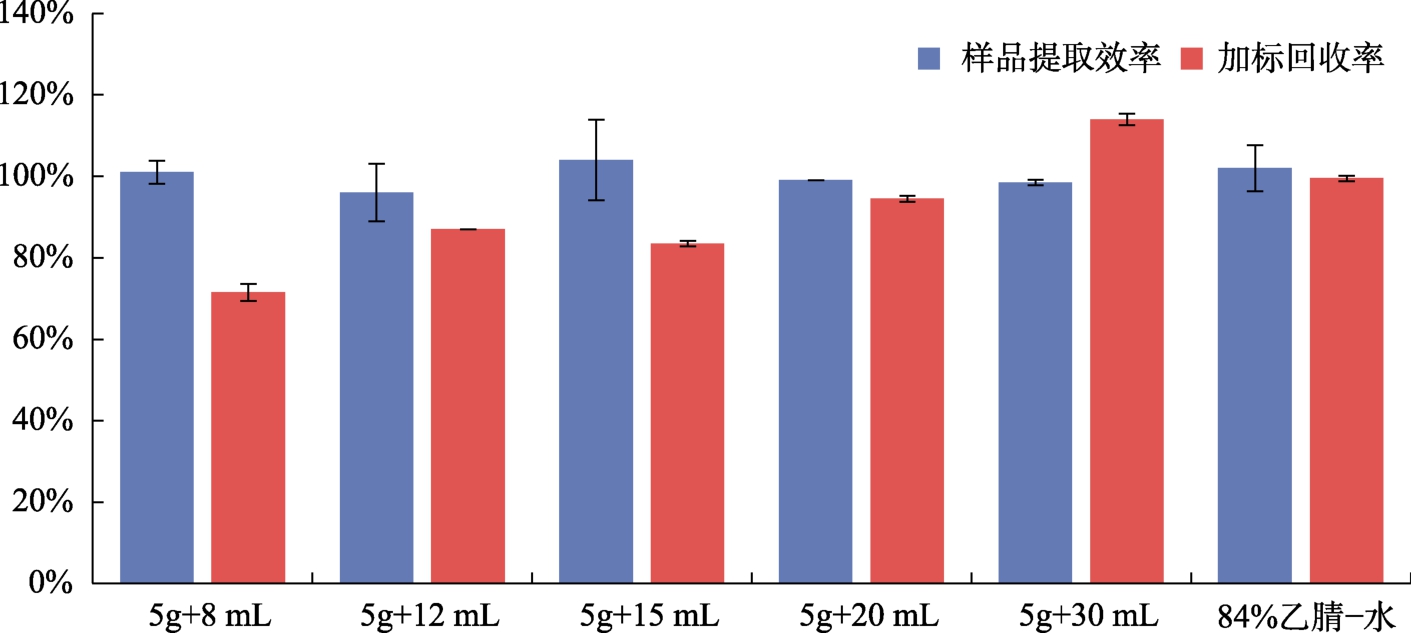
图2 不同提取比例的回收率
Fig.2 Recovery rates of different extraction proportions
由图2可知不同体积的乙醇-水溶液测定结果的提取效率都在96%~104%之间,参比方法84%乙腈-水溶液的提取效率为102%,而加标组的回收率随着提取溶液体积的增加呈上升的趋势,提取溶液体积为30 mL时,加标回收率为114%,误差较大,而参比方法84%乙腈-水溶液的加标回收率为99%。对比发现当称样量为5 g,提取溶液体积为20 mL时,样品提取效率和加标回收率均与参比方法84%乙腈-水溶液结果接近,因此,确定本方法的50%乙醇-水提取溶液的体积为20 mL,但不做限定,可依据不同厂家产品说明书规定的提取比例进行操作。
2.4 胶体金试纸条绝对灵敏度测试结果
该研究选择了7个品牌的试剂盒,其中包含了大中小不同规模的企业,绝对灵敏度测定结果见表3。
表3 不同品牌快检产品绝对灵敏度
Table 3 Absolute sensitivity of quick-check products of different brands ng/g
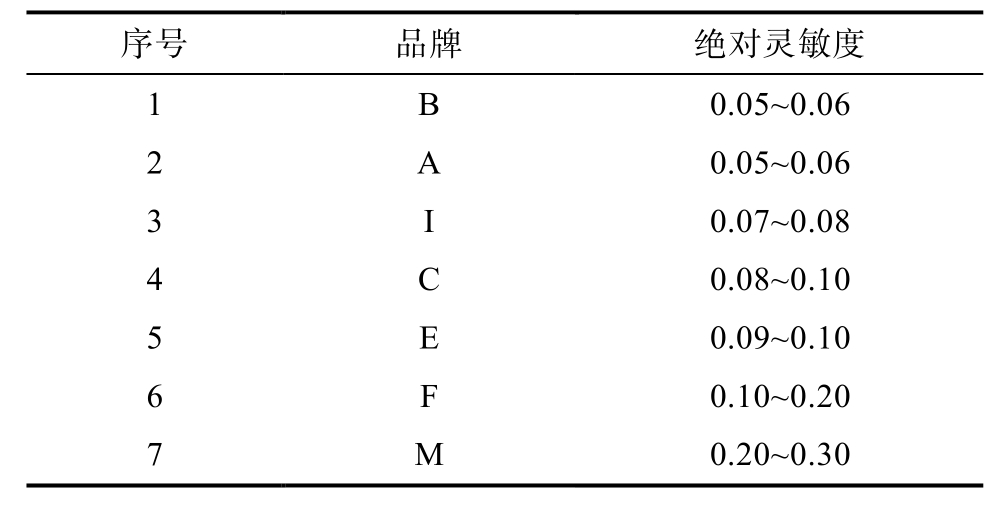
序号 品牌 绝对灵敏度1 B 0.05~0.06 2 A 0.05~0.06 3 I 0.07~0.08 4 C 0.08~0.10 5 E 0.09~0.10 6 F 0.10~0.20 7 M 0.20~0.30
首先使用0、0.1、0.2、0.3 ng/g浓度梯度,其中品牌B、A、I、C、E等品牌在0~0.1 ng/g之间都有明显的颜色变化,品牌F和M等品牌明显的颜色变化则出现在0.1~0.3 ng/g。因此再用0.05、0.06、0.07、0.08、0.09 ng/g梯度进行实验,品牌B、A在0.05~0.06 ng/g之间出现明显的颜色变化,品牌I在0.07~0.08 ng/g之间出现明显的颜色变化,品牌C明显的颜色变化是在0.08~0.1 ng/g,品牌E是在0.09~0.1 ng/g之间。品牌F在0.1~0.2 ng/g之间有明显的颜色变化,品牌M是在0.2~0.3 ng/g之间。以上各品牌试纸条的稀释液各不相同,使用厂家配置的稀释液可能有不同表现。
2.5 最佳稀释比例优化
本研究通过0.5倍检出限和1倍检出限时的测定结果分别来确定试纸条的最小稀释比例和最大稀释比例,结果如表4所示。
表4 不同品牌产品稀释比例比较
Table 4 Comparison of dilution ratio of different brands
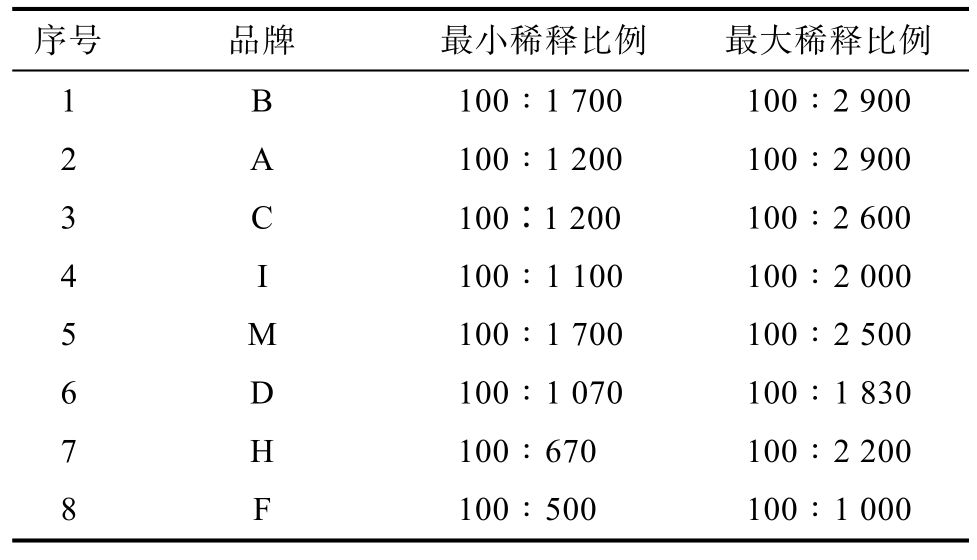
序号 品牌 最小稀释比例 最大稀释比例1 B 100∶1 700 100∶2 900 2 A 100∶1 200 100∶2 900 3 C 100∶1 200 100∶2 600 4 I 100∶1 100 100∶2 000 5 M 100∶1 700 100∶2 500 6 D 100∶1 070 100∶1 830 7 H 100∶670 100∶2 200 8 F 100∶500 100∶1 000
由表可知,各个品牌的稀释比例范围各不相同,差距较大,其中稀释比例较高的是B、A,最大稀释比例高达29倍,而F的最大稀释比例为10。考虑到市售胶体金试纸条的测定结果的误差范围大约为20%,因此本方法又考察了选取品牌的0.8倍检出限浓度的最大稀释比例。结果如表5所示。
表5 不同品牌产品最小稀释比例和最大稀释比例
Table 5 Minimum dilution ratio and maximum dilution ratio of different brands

品牌 0.5倍检出限 0.8倍检出限 1倍检出限B images/BZ_140_419_1571_768_2103.pngimages/BZ_140_863_1571_1289_2103.pngimages/BZ_140_1340_1571_1747_2103.pngimages/BZ_140_1800_1571_2192_2103.pngA images/BZ_140_414_2122_773_2654.pngimages/BZ_140_851_2122_1300_2654.pngimages/BZ_140_1340_2122_1747_2654.pngimages/BZ_140_1779_2122_2213_2654.pngC images/BZ_140_404_2672_783_3204.pngimages/BZ_140_856_2672_1295_3204.pngimages/BZ_140_1340_2672_1747_3204.pngimages/BZ_140_1783_2672_2209_3204.png
由表5可知,B和A试纸条0.5倍检出限浓度在16倍稀释比例下C线颜色深于T线颜色是阳性结果,而17倍稀释比例下T线与C线颜色一样为阴性,因此最小稀释比例为17,而0.8倍检出限浓度在26倍稀释比例下,T线与C线颜色一样,结果为阴性,而25倍稀释比例下C线颜色深于T线颜色,结果为阳性,因此确定其最大稀释比例为25倍。C试纸条0.5倍检出限浓度时10倍稀释比例下C线颜色深于T线颜色,是阳性结果,而12倍稀释比例下T线与C线颜色一样为阴性,因此最小稀释比例为12,而0.8倍检出限浓度在26倍稀释比例下,T线与C线颜色一样,结果为阴性,而25倍稀释比例下C线颜色深于T线颜色,结果为阳性,因此确定其最大稀释比例为25倍。
按照确定的最大稀释比例25倍进行产品验证时发现,1倍检出限的假阴性率较高。通过上表中0.8倍检出限浓度的结果发现,进行23倍、24倍以及25倍稀释比例时,试纸条颜色变化梯度不明显,而22倍稀释比例与其颜色变化的梯度明显,因此本方法最终选取了22倍稀释比例进行实验。
绝对灵敏度高的胶体金产品,说明所使用的原料金标抗原抗体较好。而灵敏度较低的胶体金产品,说明其所使用的原料金标抗原抗体较差,在检出限相同的情况下,提取液的稀释比例同样会比较小,基质干扰相应的提高,如果本方法选用绝对灵敏度较低的胶体金产品为研究对象,则降低了该类产品对原料金标抗原抗体的要求,市场准入条件降低,在此前提下,灵敏度较高的产品在相同的实验条件下,其检出限会低于标准检出限,从而该类产品会出现假阳性较高的问题。如果快检标准方法制定时采用低灵敏度试纸条为研究对象,则容易出现灵敏度高的产品带来的假阳率较高的现象,因此为了后期规范快检市场,以及促进企业开发更高特异性的原料金标抗原抗体,本方法选用绝对灵敏度相对较高和稀释比例较高的A、B以及C作为本方法研究对象进行方法学研究和后期验证实验。
2.6 离心转速及时间优化结果
从表6试纸条显色结果上看,离心3 min,随转速增加,烘烤花生样品试纸条T线颜色变浅,C线和T线对比度增加;离心5 min和7 min时,随转速增加,烘烤花生样品试纸条T线颜色先变浅后变深,在4 000 r/min时T线颜色最浅;而在4 000 r/min时,随离心时间增加,烘烤花生样品试纸条T线颜色先变浅后变深,C线和T线对比度增加,在5 min时T线颜色最浅。根据试纸条显色结果,本方法建议离心转速为4 000 r/min,离心时间为5 min,但不做限定,可依据产品说明书规定的试纸条-待测液反应时间进行操作。
表6 烘烤花生不同离心转速及时间试纸条的显色结果
Table 6 Color rendering results of test strips at different centrifugal speeds and times of roasted peanuts

实验条件 2 000 r/min 4 000 r/min 6 000 r/min 3 min images/BZ_141_1469_990_1704_1462.pngimages/BZ_141_1743_990_1969_1462.pngimages/BZ_141_1996_990_2232_1462.png5 min images/BZ_141_1471_1481_1702_1953.pngimages/BZ_141_1743_1481_1968_1953.pngimages/BZ_141_1997_1481_2231_1953.png7 min images/BZ_141_1473_1972_1700_2445.pngimages/BZ_141_1743_1972_1969_2445.pngimages/BZ_141_1996_1972_2231_2445.png
2.7 稀释液pH优化结果
不同pH条件下的显色情况,见表7。
表7 不同pH值缓冲溶液试纸条显色情况
Table 7 Color development of buffer solution test strips at different pH values

实验条件 pH8.0 pH8.5 pH8.9烘烤花生images/BZ_142_430_558_654_995.pngimages/BZ_142_691_558_929_995.pngimages/BZ_142_964_558_1179_995.png油炸花生images/BZ_142_430_1014_655_1451.pngimages/BZ_142_691_1014_929_1451.pngimages/BZ_142_966_1014_1178_1451.png花生酱images/BZ_142_431_1470_653_1907.pngimages/BZ_142_691_1470_929_1907.pngimages/BZ_142_964_1470_1181_1907.png
由表7可知,1 mol/L +1%氯化钠Tris溶液下pH分别为8.0、8.5、8.9时,随pH增加,油炸花生、烘烤花生及花生酱样品试纸条T线颜色先变浅后变深,在pH 8.5时,T线颜色最浅,C线和T线对比度最高。根据试纸条显色结果,本方法建议1 mol/L Tris(含1%氯化钠)溶液pH为8.5,但不做限定,可依据产品说明书规定的稀释溶液进行操作。
2.8 温育温度优化结果
在10、20、30、40、50 ℃温育条件下试纸条的显色结果,见表8。
表8 试纸条不同温育温度下显色情况
Table 8 Color development of test strips at different incubation temperatures

温育温度/℃油炸花生显色效果烘烤花生显色效果花生酱显色效果10images/BZ_142_1430_612_1691_1061.pngimages/BZ_142_1721_612_1975_1061.png20images/BZ_142_1442_1080_1679_1493.pngimages/BZ_142_1725_1080_1971_1493.pngimages/BZ_142_2000_1080_2235_1493.png30images/BZ_142_1440_1512_1681_1925.pngimages/BZ_142_1728_1512_1969_1925.pngimages/BZ_142_2001_1512_2234_1925.png40images/BZ_142_1432_1943_1689_2357.pngimages/BZ_142_1721_1944_1976_2357.png50images/BZ_142_1431_2376_1690_2790.pngimages/BZ_142_1719_2376_1977_2790.pngimages/BZ_142_1994_612_2240_1061.pngimages/BZ_142_1993_1943_2241_2357.pngimages/BZ_142_1993_2377_2241_2790.png
结果显示:随着温度增加,油炸花生基质、烘烤花生基质和花生酱基质C线与T线显色逐渐加深。低温下(10 ℃),试纸条C线与T线显色不明显,结果不好判定,而20~50 ℃试纸条阴阳性可明显识别,且阴阳性结果判别准确。综合C线与T线显色可识别度,以及试纸条检测准确性及操作环境舒适度,A黄曲霉毒素B1胶体金快速检测产品建议实验操作环境温度为20~40 ℃。方法文本中可依据各产品厂家进一步实验确认后说明书规定的反应温度条件进行操作。
2.9 待测液-微孔孵育时间以及试纸条-待测液反应时间优化结果
根据表9试纸条T线与C线显色结果显示,待测液-微孔孵育时间建议为3 min,但不作限定。试纸条-待测液反应时间建议为3 min,但不做限定。可依据产品说明书规定的待测液-微孔孵育时间、试纸条-待测液反应时间进行操作。
表9 待测液-微孔孵育时间以及试纸条-待测液反应时间优化结果
Table 9 Optimization results of liquid-to-microwell incubation time and reaction time of test strip to liquid-to-test min
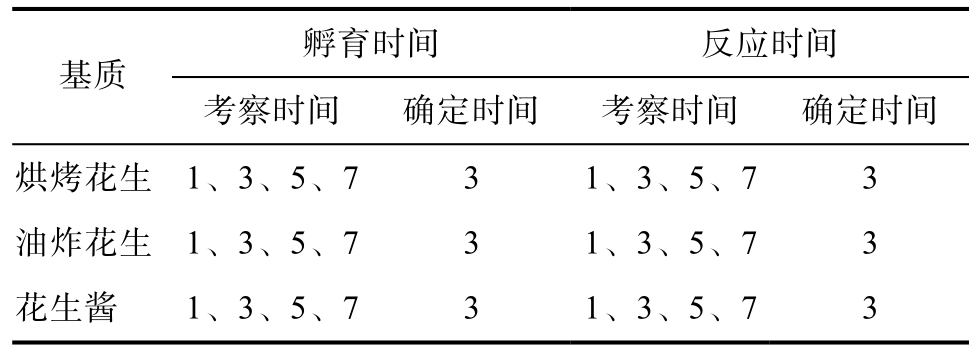
孵育时间 反应时间基质考察时间 确定时间 考察时间 确定时间烘烤花生 1、3、5、7 3 1、3、5、7 3油炸花生 1、3、5、7 3 1、3、5、7 3花生酱 1、3、5、7 3 1、3、5、7 3
2.10 试纸条检出限测试结果
烘烤花生黄曲霉毒素B1四个浓度的质控样品0、12.6、19.6、39.4 μg/kg,油炸花生黄曲霉毒素B1四个浓度的质控样品0、10.6、19.4、36.8 μg/kg,花生酱基质采用加标水平为0、10、20、40 μg/kg,T线比C线显色深或一致为阴性,T线比C线显色浅为阳性,结果见图3。由图可见,浓度为空白浓度、0.5倍检出限时,试纸条测定为阴性;浓度为1倍检出限、2倍检出限时,试纸条测定为阳性,则试纸条检出限为20 μg/kg。

图3 试纸条检出限测试
Fig.3 Detection limit test of strip
2.11 交叉反应
将脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、黄曲霉毒素M1的标准溶液用0.01 mol/L PBS缓冲溶液逐步稀释(0.1、1、10、100 μg/L和0.08~0.5 μg/L),进行交叉反应实验。
根据公式:交叉反应率(%)=C黄曲霉毒素B1/C待测物*100%,可知脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A与黄曲霉毒素B1无交叉反应,B、A品牌胶体金试纸条黄曲霉毒素B1检出限浓度为0.1 μg/L,对黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、黄曲霉毒素M1呈现阳性时的浓度分别为:0.125、0.125、0.125、0.5 μg/L,交叉反应率分别为:80%、80%、80%、20%,C品牌胶体金试纸条黄曲霉毒素B1检出限浓度为0.25 μg/L,对黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、黄曲霉毒素M1呈现阳性时的浓度分别为:0.312 5、0.312 5、0.312 5、1.25 μg/L,交叉反应率分别为:80%、80%、80%、20%,如表10。
表10 交叉反应验证结果
Table 10 Cross-reaction verification results
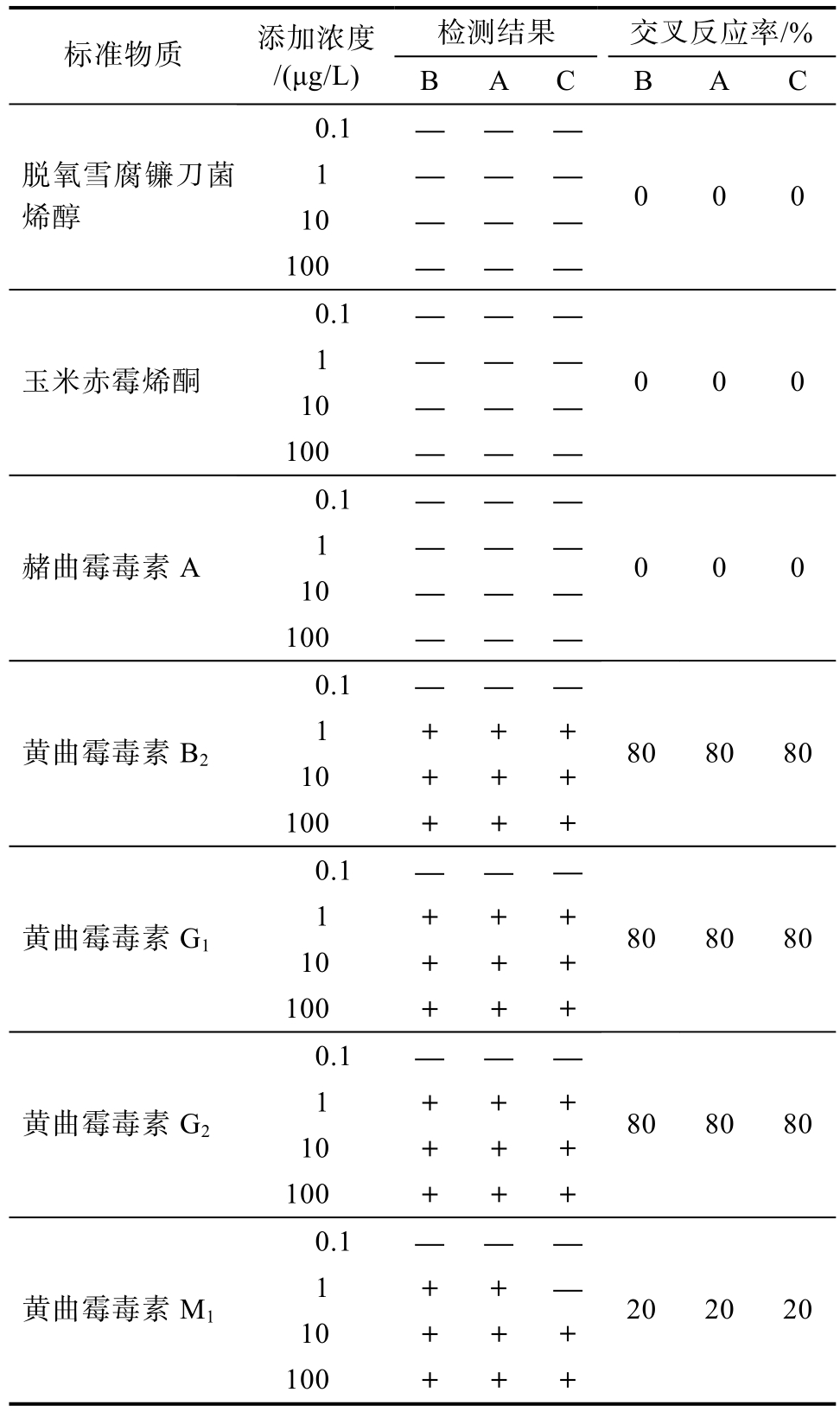
注:“—”表示阴性,“+”表示阳性。
Note: “—” means negative, “+” means positive.
检测结果 交叉反应率/%标准物质 添加浓度/(μg/L) B A C B A C 0.1 — — —1 — — —10 — — —脱氧雪腐镰刀菌烯醇100 — — —0 0 0 0.1 — — —1 — — —10 — — —玉米赤霉烯酮100 — — —0 0 0 0.1 — — —1 — — —10 — — —赭曲霉毒素A 100 — — —0 0 0 0.1 — — —1 + + +10 + + +黄曲霉毒素B2 100 + + +80 80 80 0.1 — — —1 + + +10 + + +黄曲霉毒素G1 100 + + +80 80 80 0.1 — — —1 + + +10 + + +黄曲霉毒素G2 100 + + +80 80 80 0.1 — — —1 + + —10 + + +黄曲霉毒素M1 100 + + +20 20 20
2.12 验证实验结果
油炸花生、烘烤花生及花生酱样品四个浓度的结果按照《食品快速检测方法评价技术规范》(食药监办科[2017]43号)附表快速检测方法性能指标计算表要求计算,详见表11。
表11 快速检测方法性能指标评价结果
Table 11 Performance index evaluation results of rapid detection methods %
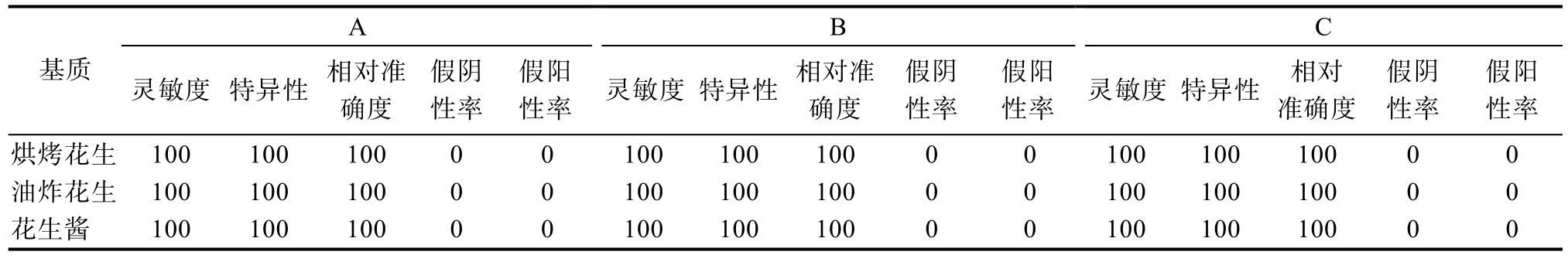
A B C基质 灵敏度 特异性 相对准确度假阴性率假阳性率 灵敏度 特异性 相对准确度假阴性率假阳性率 灵敏度 特异性 相对准确度假阴性率假阳性率烘烤花生 100 100 100 0 0 100 100 100 0 0 100 100 100 0 0油炸花生 100 100 100 0 0 100 100 100 0 0 100 100 100 0 0花生酱 100 100 100 0 0 100 100 100 0 0 100 100 100 0 0
使用本文建立的方法进行评价,所选取的品牌A、B、C对于油炸花生、烘烤花生及花生酱3种基质,验证结果为方法灵敏度为100%;相对准确度为100%;假阴性率和假阳性率为0%,详见表12。
表12 参比方法一致性分析情况
Table 12 Consistency analysis of reference methods μg/kg
烘烤花生 油炸花生 花生酱基质 空白 12.6 19.6 39.4 空白 10.619.4 36.8 空白 11.320.637.2 A 0 0 0 0 0 0 0 0 0 0 0 0 B 0 0 0 0 0 0 0 0 0 0 0 0 C 0 0 0 0 0 0 0 0 0 0 0 0
三种基质四个浓度水平的花生样品的50次平行测定结果,与参比方法《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》(GB 5009.22—2016)第三法光化学柱后衍生法结果无显著性差异。
3 结论
本研究通过市场调研市售花生及其制品中黄曲霉毒素B1快检试剂盒情况,优化了样品提取的前处理条件,对比了市售试剂盒的绝对灵敏度和最大稀释比例,选取了绝对灵敏度高、稀释比例大的三个品牌的产品作为研究对象,结合优化后的前处理条件,进一步优化了试剂盒操作的反应条件,在此基础上研究了花生及其制品中黄曲霉毒素B1快检评价的标准。进而开展对3个品牌产品性能的评价,结果显示,建立的方法可满足花生及其制品中黄曲霉毒素B1胶体金快速检测产品快速检测的要求。
[1] ABDEL-HADI A, SCHMIDTHEYDT M, PARRA R, et a1.A systems approach to model the relationship between aflatoxin gene cluster expression,environmental factors,growth and toxin production by Aspergillus flavus[J].Journal ofthe Royal Society Interface, 2012, 9(69): 757-767.
[2] SCHMIDT-HEYDT M,ABDEL-HADI A, MAGAN N, et a1.Complex regulation of the aflatoxin biosynthesis gene cluster of A.flavus in relation to various combinations of water activity and temperature[J].International Journal of Food Microbiology,2009, 1 35(3): 23l-7.
[3] MEDINA A, RODRIGUEZ A, MAGAN N, et al.Climate change factors and A.flavus:effects on gene expression, growth and aflatoxin production[J].World Mycotoxin Journal, 2014.8(2): 171-179.
[4] HOJNIK N, MODIC M, WALSH J L, et al.Unravelling the pathways of air plasma induced aflatoxin B1 degradation and detoxification[J].Journal of Hazardous Aterials, 2021, 403: 123593.
[5] 食品安全国家标准食品中真菌毒素限量: GB 2761—2011[S].National food safety standard maximum levels of mycotoxinsin foods: GB 2761—2011[S].
[6] 李少晖, 任丹丹, 谢云峰, 等.食品中黄曲霉毒素检测方法研究进展[J].食品安全质量检测学报, 2015, 6(4): 1108-1115.LI S H, REN D D, XIE Y F, et a1.Research progress on determination methods of aflatoxins in foodstuffs[J].J Food Saf Qual, 2015, 6(4): 1108-1115.
[7] 赵亮.粮油食品中的黄曲霉毒素检测技术分析[J].现代食品,2021, (14): 47-49.ZHAO L.Analysis of aflatoxin detection technology in cereals,oils and foods[J].Modern food, 2021, (14): 47-49.
[8] 翟雪华.粮油食品中黄曲霉毒素检测方法研究进展[J].现代食品, 2019, (1): 120-121.ZHAI X H.Research progress on detection methods of aflatoxins in cereals, oils and foods[J].Modern food, 2019, (1): 120-121.
[9] 叶群, 姚刚, 张绍英.污染黄曲霉毒素花生的检测及分选技术研究进展[J].农业工程, 2014, 4(6): 59-63.Y Q, YAO G, ZHANG S Y.Development of detection and sorting technology for aflatoxins contaminated peanuts[J].Agricultural Engineering, 2014, 4(6): 59-63.
[10] 黄洁.黄曲霉毒素检测方法研究进展[J].化学分析计量,2013, (3): 100-104.HUANG J.Research progress in detecting methods of aflatoxins[J].Chem Anal Meterage, 2013, (3): 100-104.
[11] 罗小虎, 王韧, 王莉, 等.高效液相色谱快速测定玉米中黄曲霉毒素的研究[J].中国粮油学报, 2014, (6): 99-103.LUO X H, WANG R, WANG L, et al.Rapid detection of aflatoxins in corns by high performance liquid chromatography[J].J Chin Cereal Oil Assoc, 2014, (6): 99-103.
[12] 李可, 丘汾.免疫亲和层析-超高效液相色谱法测定大米中4种黄曲霉毒素[J].中国卫生检验杂志, 2014, (16): 2328-2330.LI K, QIU F.Determination of four kinds of aflatoxins in rice by immunoaffinity chromatography-UPLC[J].Chin J Health Lab Technol, 2014, (16): 2328-2330.
[13] YIBADATIHAN S, JINAP S,MAHYUDIN N A.Simultaneous determination of multi—mycotoxins in palm kernel cake (PKC)using liquid chromatography-tandem mass spectrometry (LC—MS/MS)[J].Food AdditContam, 2014, 31(12): 2071-2079.
[14] 孙娟, 李为喜, 张妍, 等.用超高效液相色谱串联质谱法同时测定谷物中12种真菌毒素[J].作物学报, 2014, 40(4): 691-701.SUN J, LI W X, ZHANG Y, et a1.Simultaneous determination of twelve mycotoxins in cereals by ultra-high performance liquid chromatography-tandem mass spectrometry[J].ACTA AGRONOMICA SINICA, 2014, 40(4): 691-701.
[15] 成亚倩, 高志贤, 周焕英, 等.食品中黄曲霉毒素比色生物检测技术研究进展[J].分析实验室, 2021, 40(8): 966-976.CHENG Y Q, GAO Z X, ZHOU H Y, et al.Recent advance in colorimetric bioassay for detection of aflatoxins in food[J].Chinese Journal of Analysis Laboratory, 2021, 40(8): 966-976.