脱脂核桃粕作为核桃油加工副产品,具有较高的利用价值。脱脂核桃粕中蛋白质含量丰富(约50%),以往大部分被当成饲料造成较大浪费。核桃蛋白(Walnut protein, WP)的氨基酸组成合理,营养价值高,但由于其功能性质与其他蛋白相比有一定差距,尤其是目前从脱脂核桃粕中制备核桃蛋白存在水溶性差、得率低等问题[1],导致核桃蛋白在食品工业中的应用受限。为充分利用核桃蛋白,对其进行改性处理十分重要。
许多物理化学方法已应用于核桃蛋白改性研究中,物理改性方法主要影响蛋白质分子的高级结构和蛋白质分子间的聚集形式,常用的方法主要包括加热、高压、超声波、超髙压、微波辐射等[2]。由于核桃蛋白中70%以上为谷蛋白,且是核桃蛋白水溶性差的重要原因,所以针对谷蛋白的化学改性研究也较多,包括酰基化、磷酸化[3]及糖基化处理[4]。酶法改性主要通过采用酶制剂有限度地水解肽键及酰胺键,或者进行分子间共价交联,使蛋白质功能性质发生定向改变[5]。酶法改性后的蛋白表面活性剂作用增强,乳化性、溶解性等功能性质有所改善。因酶法改性其条件温和、操作简单等优点,近年来得到了广泛的应用,按照酶的种类可以将其对蛋白的作用机理分为四类,包括共价交联作用、脱酰胺作用、磷酸化作用以及水解作用[5]。高溶解性的核桃蛋白粉酶解产物主要应用于蛋白饮料,然而较高的水解度不仅会导致苦味肽的形成,还会由于蛋白结构过度展开暴露更多疏水基团而降低乳化活性[6]。而使用低限度酶往往能够得到各项指标综合改善的蛋白产品。
本研究通过选取不同酶制剂对核桃蛋白进行低限度酶改性,进而制备乳液,旨在综合考察核桃蛋白改性后制得的乳液的粒径、显微结构以及乳液稳定性等指标,继而比较得出最利于核桃蛋白乳液制备的酶种类,为核桃蛋白在食品研发方面的应用提供理论参考,提高核桃粕的综合利用率。
1 材料与方法
1.1 材料与试剂
脱脂核桃粕:晨光生物科技有限公司;木瓜蛋白酶、蛋白谷氨酰胺酶、胰蛋白酶、中性蛋白酶、菠萝蛋白酶:市售;其他试剂均为分析纯。
1.2 仪器设备
FA25 型高速剪切机:上海FLUKO流体机械制造有限公司;K9840自动凯氏定氮仪:济南海能仪器股份有限公司;OCA15EC视频光学接触角测量仪:德国德菲仪器股份有限公司;Mastersizer 2000型激光粒度分析仪:英国马尔文公司产品;AH2010高压均质机:上海ATS设备公司; PL-180偏正光显微镜:上海光学仪器厂。
1.3 实验方法
1.3.1 核桃蛋白的提取
采用碱溶酸沉法提取核桃蛋白[7]。将脱脂核桃粕与去离子水按料液比1∶10(w/v)混合,调节pH为11.0,室温搅拌90 min,6 000 rpm离心15 min后,收集上清液,调节pH为4.5,6 000 rpm离心15 min后收集沉淀,加水复溶并调节体系pH至中性,浓缩干燥后得到核桃蛋白粉,-20 ℃下保存备用。
1.3.2 核桃蛋白酶法改性
选用中性蛋白酶、菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶和蛋白谷氨酰胺酶这五种酶,将核桃蛋白粉以料液比1∶10分散于去离子水中,保温至各种蛋白酶的最适温度后,以酶添加量为0.5%(E/S,w/w)(以核桃蛋白质量计)加入酶反应30 min,所有反应均在每种酶的最适温度和pH下进行,酶解条件如表1。
表1 不同酶的最适酶解条件
Table 1 Optimum enzymolysis conditions of different enzymes
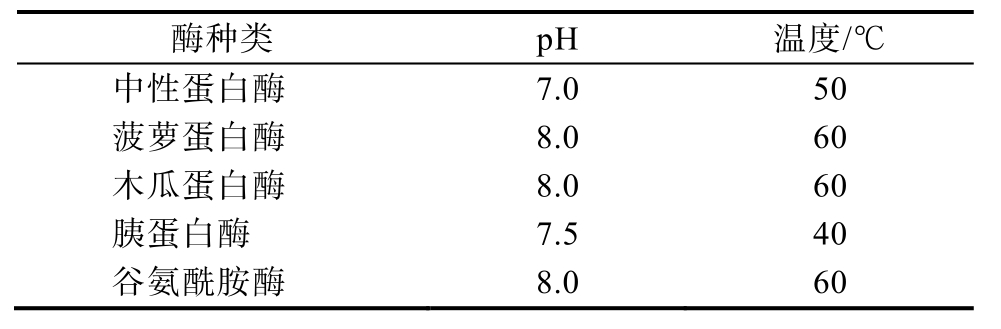
酶种类 pH 温度/℃中性蛋白酶 7.0 50菠萝蛋白酶 8.0 60木瓜蛋白酶 8.0 60胰蛋白酶 7.5 40谷氨酰胺酶 8.0 60
酶解结束后调节pH至中性,沸水浴灭酶,然后冰水浴冷却后将酶解液浓缩干燥,-20 ℃保存备用。
1.3.3 酶改性核桃蛋白性质
1.3.3.1 水解度的测定 核桃蛋白的水解度按照pH-stat方法测定,记录水解过程中标准NaOH溶液的消耗量。水解度计算公式为:
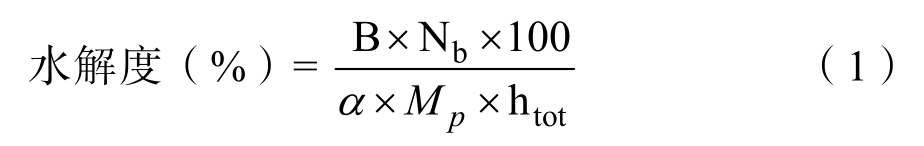
式中,B:NaOH 溶液的消耗量(mL);Nb:NaOH 的摩尔浓度(mol/L);Mp:核桃蛋白的质量(g);htot:核桃蛋白肽键总数(mmol/g),核桃蛋白为7.35 mmol/g;α:α-氨基的解离度,1/α为校准因子,对于中性蛋白酶和谷氨酰胺酶,1/α为2.27;对于菠萝蛋白酶和木瓜蛋白酶,1/α为1.08;对于胰蛋白酶,1/α为3.60。
1.3.3.2 氮溶指数(NSI)的测定 参考张丽娜的方法[9]略作修改,精确称量1.0 g样品,分散于去离子水中,定容至50 mL。室温下振荡2 h,于4 500 r/min的条件下离心10 min。氮溶指数按下式计算∶
式中,NSI为样品氮溶指数/%;N1为上清液中的可溶性氮总量/g;N为1 g样品中的总氮/g。
1.3.3.3 乳化性(EAI)和乳化稳定性(ESI)的测定 根据Pearce等[8]的方法,略作修改。配制0.5%(w/v)样品溶液,以油相分数为10%加入大豆油,10 000 rpm剪切2 min,分别在剪切后0 min和10 min时迅速取50 μL乳液溶于5 mL 0.1%SDS中,混匀,在波长500 nm处进行比色。以0.1%SDS溶液作为空白。样品蛋白质浓度用凯氏定氮法测定。
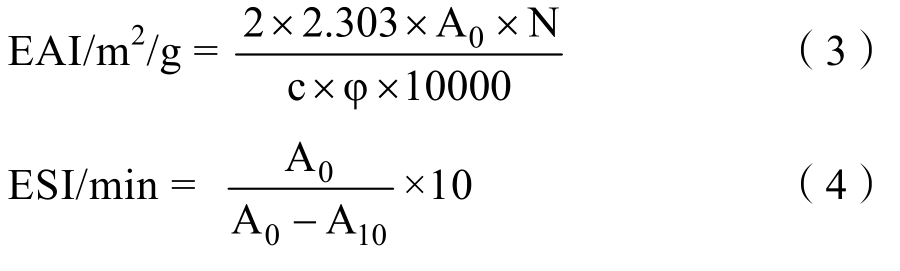
其中,A0—均质后0 min测定的吸光度;A10—均质后10 min时的吸光度;N—稀释倍数,100;c—蛋白溶液的质量浓度,g/mL;φ—油占总乳液的体积分数,0.10。
1.3.3.4 起泡性及起泡稳定性 取60 mL样品溶液置于200 mL烧杯中,使用剪切机以10 000 rpm的速度高速剪切2 min,记录剪切后泡沫液面的高度,记为V0。静置30 min后再次记录泡沫液面高度,记为V30。起泡能力(FC)和泡沫稳定性(FS)采用如下公式表示[12]:
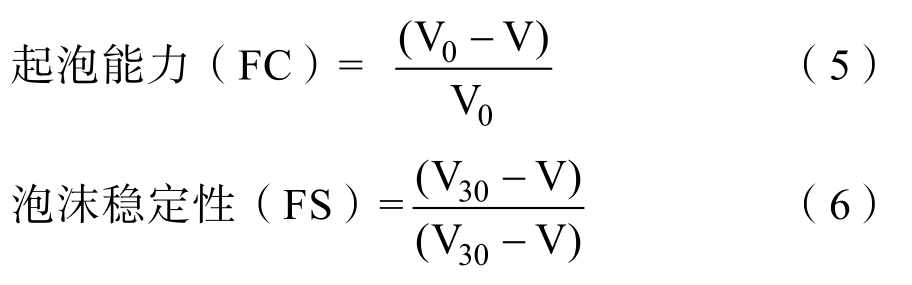
1.3.3.5 电泳表征相对分子质量分布 参考Schagger的Tricine-SDS-PAGE分析方法[9],略作修改。取0.5 mL待测样品与样品溶解液(4%SDS、20%甘油,pH6.8,0.125 mol/L Tris-HCl缓冲液)混合,稀释至蛋白浓度为1 mg/mL,再加入10 µL10%AP,10 µL溴酚蓝指示剂,还原电泳需加入20 μLDTT(1 mol/L)煮沸5 min,上样10 μL。浓缩胶和分离胶浓度分别为4%和16%,样品在浓缩胶中电压为30 V,等进入分离胶调整电压为100 V,直至电泳结束。将所得凝胶固定、染色和脱色后用凝胶成像仪扫描拍照,最后用Image Lab软件(伯乐,美国)分析电泳条带。
1.3.3.6 界面张力测定 油水界面张力的测定采用OCA15EC视频光学接触角测量仪。
1.3.4 乳液的制备
配制0.5%(w/v)蛋白溶液,以油相分数为10%(w/v)加入大豆油,以10 000 rpm剪切2 min,再于40 MPa下均质两次,均质后的乳液于80 ℃下热处理30 min后测定乳液的热稳定性。
1.3.4.1 乳液粒径测定 乳液的粒径大小和粒径分布通过激光粒度分析仪测定。实验采用体积平均粒径(d4,3)来表征乳液的粒径大小,粒径的分散程度通过跨度(Span)值来表示,Span值可由下式得出。
1.3.4.2 乳液微观结构观察 通过配备有CCD摄像机的PL-180偏正光显微镜观察(20x物镜)乳液中脂肪球的分布状态。
1.3.4.3 乳液稳定性 取乳液至30 mL样品瓶(直径2.5 cm,高度6.0 cm),在室温下放置并定期测定乳液的底部清层高度和总高度;另取10 mL新鲜乳液于带刻度离心管中,4 000 rpm离心8 min后测出下层析出的乳清高度。以乳析指数(creaming index,CI)表征乳液稳定性。乳析指数计算如式所示。
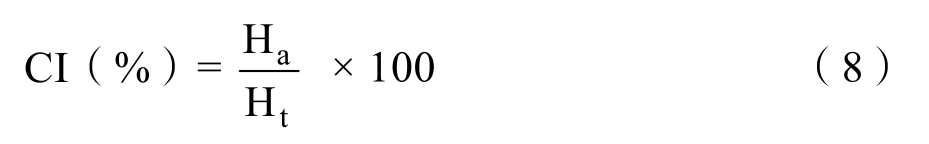
式中:CI,乳析指数;Ha,清层高度(cm);Ht,乳液的总高度(cm)。
1.3.5 数据分析
所有实验重复三次,结果表述为平均值±标准偏差,数据分析通过SPSS软件进行,ANOVA分析或t检验评估显著性差异,使用Origin 8.5和Excel 绘图分析。
2 结果与分析
在酶解之前对原料脱脂核桃粕的粗蛋白含量进行了测定,核桃粕蛋白质含量为50.98%。核桃蛋白经中性蛋白酶、菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶和蛋白谷氨酰胺酶处理30 min后,样品分别标记为WP-Z、WP-B、WP-M、WP-Y和WP-P。
2.1 核桃蛋白及其水解产物的特性
2.1.1 蛋白水解度与氮溶指数
经过五种酶酶解30 min后核桃蛋白的水解度见表2。
表2 核桃蛋白及其酶解产物的水解度及氮溶指数
Table 2 Hydrolysis degree and nitrogen solubility index of walnut protein and its enzymatic hydrolysis products %
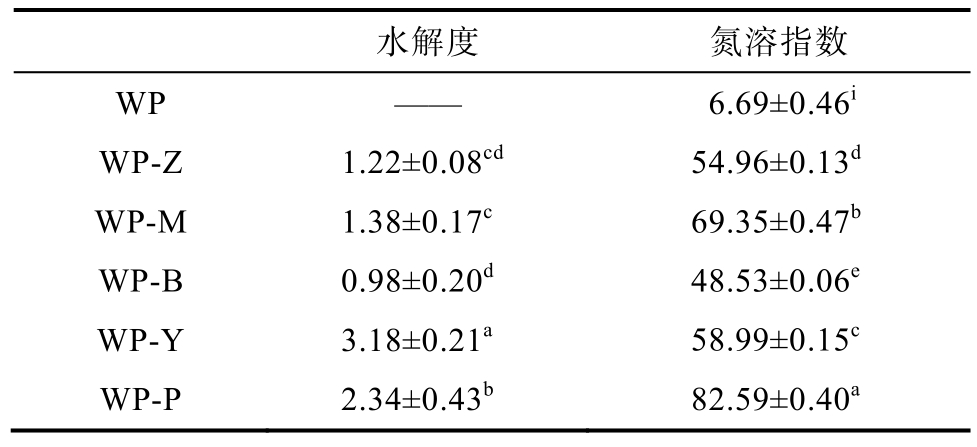
注:数值上标的不同小写字母表示差异显著(P<0.05)。
Note: Different lowercase letters on the upper index indicate significant difference (P<0.05).
水解度 氮溶指数WP —— 6.69±0.46i WP-Z 1.22±0.08cd 54.96±0.13d WP-M 1.38±0.17c 69.35±0.47b WP-B 0.98±0.20d 48.53±0.06e WP-Y 3.18±0.21a 58.99±0.15c WP-P 2.34±0.43b 82.59±0.40a
由表2可知,胰蛋白酶和蛋白谷氨酰胺酶处理后的核桃蛋白水解度最大,其次是中性蛋白酶和木瓜蛋白酶,两者水解度接近,水解度最小的是菠萝蛋白酶。可见在较低的酶添加量和较短的反应时间内,小范围反应条件的波动对蛋白水解度的影响较小,而蛋白水解位点的不同是造成水解度差异的主要因素。
不同蛋白酶水解产物的氮溶指数反映对应蛋白的溶解度。其中 WP-P溶解度最高,WP-B氮溶指数最小。PG酶的脱酰胺作用能使谷氨酰胺变为谷氨酸[10],进而增加蛋白溶解度,而WP-B水解度较小或直接导致其较低的溶解度。
2.1.2 乳化性与乳化稳定性
核桃蛋白及其酶解产物的乳化性及乳化稳定性如图1所示。
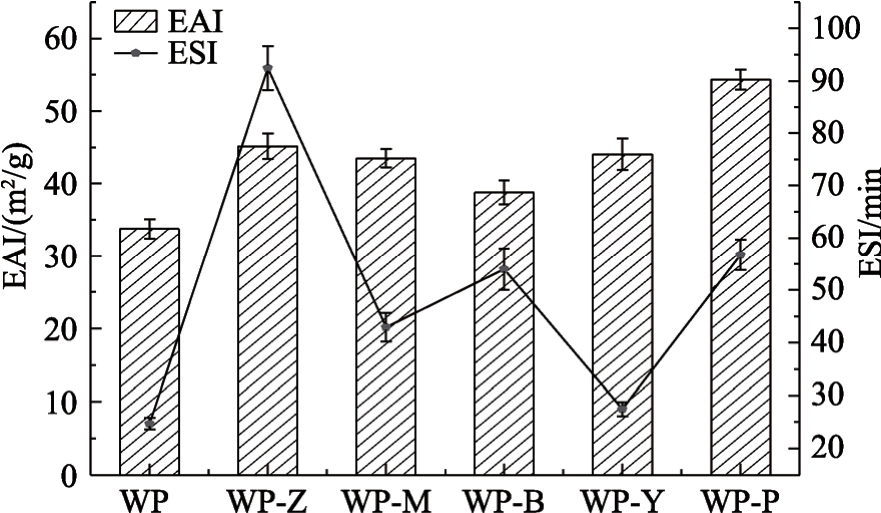
图1 酶解改性后核桃蛋白的乳化性与乳化稳定性
Fig.1 Emulsification and stability of walnut protein modified by enzymatic hydrolysis
由图1可见,经酶解改性核桃蛋白的乳化性由34.5 m2/g提高至39.0~54.1 m2/g,其中WP-P的乳化性最好。乳化性与蛋白结构相关,酶解后核桃蛋白会产生更多亲水基团从而整体降低疏水作用,乳液油滴表面吸附的肽层之间的静电斥力随之增加[11];其次,酶解加热处理的温度不同可能会导致核桃蛋白的展开程度不同,产生不同程度蛋白表面疏水基团的暴露,进而影响油水界面的吸附作用[12]。
此外,WP-Z的乳化稳定性最高,随后依次为WP-P、WP-B、WP-M和WP-Y。在疏水基团的暴露和二硫键的共同作用下,热处理后的蛋白可能会产生不稳定的聚集体,因此不同酶处理后蛋白乳化稳定性存在差异[13]。酶水解核桃蛋白更易吸附在油滴表面,其产生的空间斥力阻止了油滴的紧密接触,并减少了絮凝和聚结,使乳液体系更加稳定[14]。
2.1.3 起泡性与泡沫稳定性
核桃蛋白同时具有亲水基团和疏水基团,具有一定的起泡能力。核桃蛋白及其酶解产物的起泡能力和起泡稳定性如图2所示。
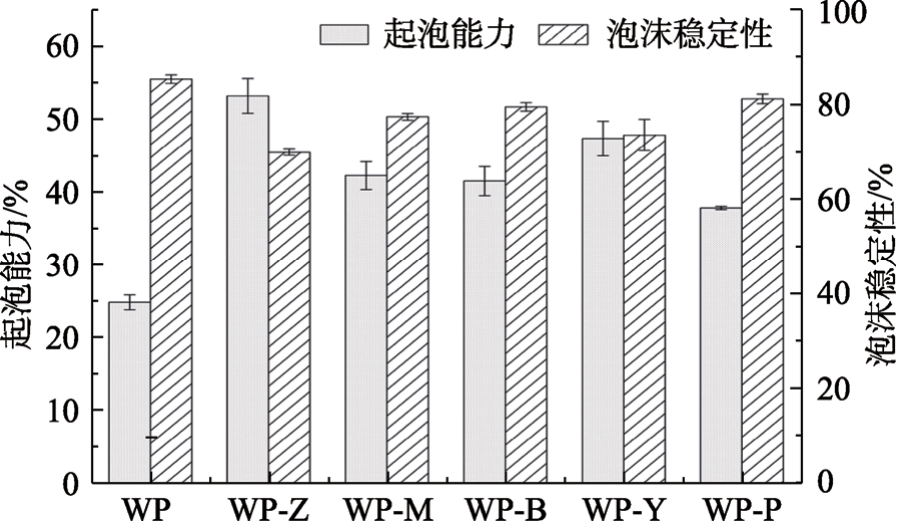
图2 核桃蛋白及其酶解产物的泡沫能力和起泡稳定性
Fig.2 Foaming ability and stability of walnut protein and its enzymatic hydrolysis products
不同蛋白酶水解核桃蛋白,由于其水解作用位点的差异,产生不同的蛋白肽段,具有不同的亲疏水性,从而直接影响了其在气水界面的性质。由图2可见,酶解样品的起泡性均显著高于核桃蛋白。推测其原因是酶处理后核桃蛋白极性基团增多提高了蛋白表面的疏水性,经快速搅打剪切后能够在空气-水界面上快速吸附,导致表面张力迅速降低[15]。泡沫稳定性与液膜的强度有关,起泡性增强后表面吸附膜的坚固性降低可能与泡沫稳定性降低有关。
2.1.4 SDS-PAGE分析
不同酶水解后的核桃蛋白经考马斯亮蓝染色后的还原SDS-PAGE图谱如图3。核桃蛋白还原电泳有四个主要区域,其分子量(MW)分别为9~12 kDa、18~24 kDa、31~35 kDa和50~72 kDa。
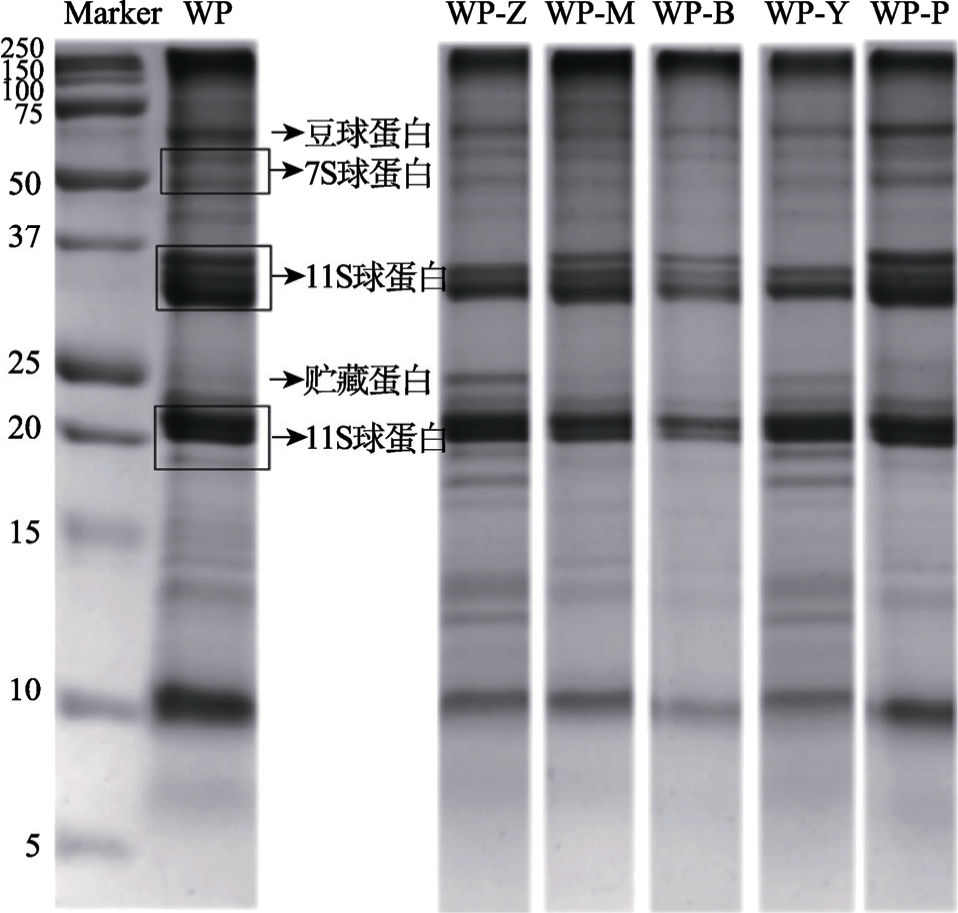
图3 核桃蛋白不同酶解产物的SDS-PAGE图谱
Fig.3 SDS-PAGE patterns of different enzymatic hydrolysis products of walnut protein
由图3可见,采用不同蛋白酶对核桃蛋白进行低限度水解后,酶解核桃蛋白的高相对分子质量条带均发生一定程度的水解,生成较低相对分子质量的条带,特别是豆球蛋白和7S球蛋白。其中WP-Z和WP-Y的35 kDa条带消失,转化为13~17 kDa的条带。但综合来看,低限度酶水解核桃蛋白中大分子量亚基仍占主导地位,进一步说明通过低限度水解,实现了对核桃蛋白的增溶作用。
2.1.5 界面张力
核桃蛋白及其酶解产物制得的蛋白溶液的油-水界面张力,如图4所示。
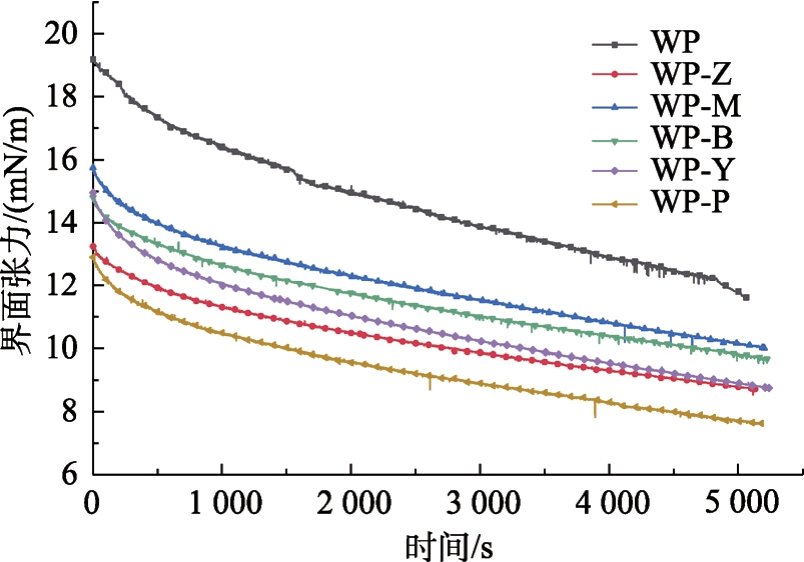
图4 核桃蛋白及其酶解产物制得的蛋白溶液的油-水界面张力
Fig.4 Oil-water interfacial tension of walnut protein solution and its enzymolysis products
室温下,油水两相的界面张力测得为32 mN/m。表面疏水性能够驱动蛋白质在油水界面上的初始锚定,进而降低油水界面张力[16]。酶解使蛋白质内部疏水基团暴露,界面张力降低。此外,谷氨酰胺酶的脱酰胺作用增强了蛋白质的亲水性[17],进一步促进了水解蛋白和脂质之间的相互作用,WP-Z的界面张力随时间的变化幅度小,趋势平缓,与乳化稳定性的结果相一致。
2.2 核桃蛋白乳液的性质研究
2.2.1 乳液粒径分布
核桃蛋白及其酶解产物制得的乳液平均粒径见表3。
表3 酶改性后后核桃蛋白乳液的平均粒径
Table 3 Average droplet size of walnut protein emulsion after enzyme modification
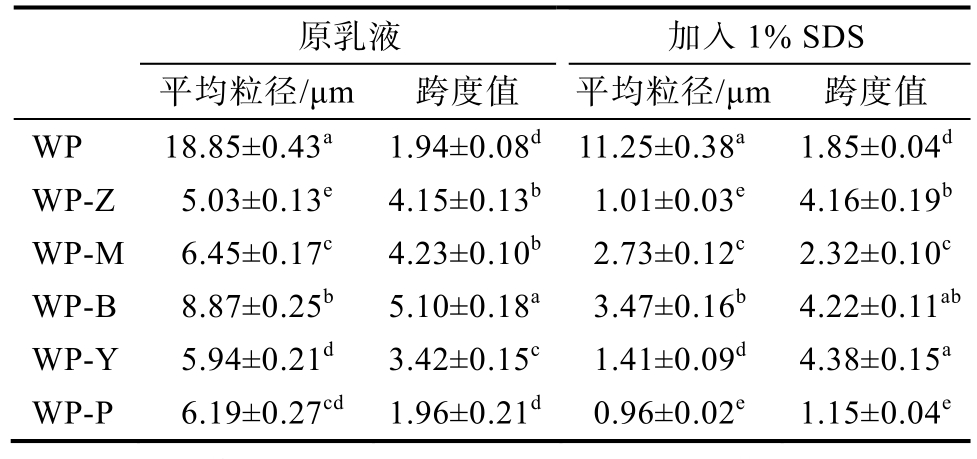
注:数值上标的不同小写字母表示差异显著(P<0.05)。
Note: Different lowercase letters on the upper index indicate significant difference (P<0.05).
原乳液 加入1% SDS平均粒径/μm 跨度值 平均粒径/μm 跨度值WP 18.85±0.43a 1.94±0.08d 11.25±0.38a 1.85±0.04d WP-Z 5.03±0.13e 4.15±0.13b 1.01±0.03e 4.16±0.19b WP-M 6.45±0.17c 4.23±0.10b 2.73±0.12c 2.32±0.10c WP-B 8.87±0.25b 5.10±0.18a 3.47±0.16b 4.22±0.11ab WP-Y 5.94±0.21d 3.42±0.15c 1.41±0.09d 4.38±0.15a WP-P 6.19±0.27cd 1.96±0.21d 0.96±0.02e 1.15±0.04e
由表3可知,核桃蛋白乳液的平均粒径为18.85 μm,酶解样品粒径均显著减小,为5~8 μm,其中WP-P的粒径分布较为集中。多种峰形形态可能与乳液易失稳相关。添加1%SDS中后,样品的平均粒径均显著减小。颗粒大小会直接影响乳液的稳定性,说明原样品发生了脂肪球的聚结或部分聚结[18]。
2.2.2 乳液显微结构显微结构可直观反映乳液中油滴的分散状态。核桃蛋白及其酶解产物所制得乳液的显微结构图5所示。

图5 低限度酶改性对乳液微观结构的影响
Fig.5 Effect of limited enzyme modification on microstructure of emulsion
如图5可见,WP在观察区域中出现了聚集体和较大的颗粒,说明乳液已经发生了絮凝和聚结,导致体系失稳。酶解样品中油滴颗粒显著减小,水解暴露出的疏水基团促进了蛋白质在油水界面的吸附,使各油滴之间能保持独立。部分酶解后的样品也出现了聚集,推测其原因是酶解后过小的多肽分子也可能不足以提供双亲集团,从而降低了界面吸附蛋白的活性导致油脂与蛋白之间的亲和力降低,被蛋白包裹的乳滴出现聚集[19]。
2.2.3 乳液稳定性
核桃蛋白及其酶解产物制得的乳液静置不同天数后的乳析指数如图6所示。
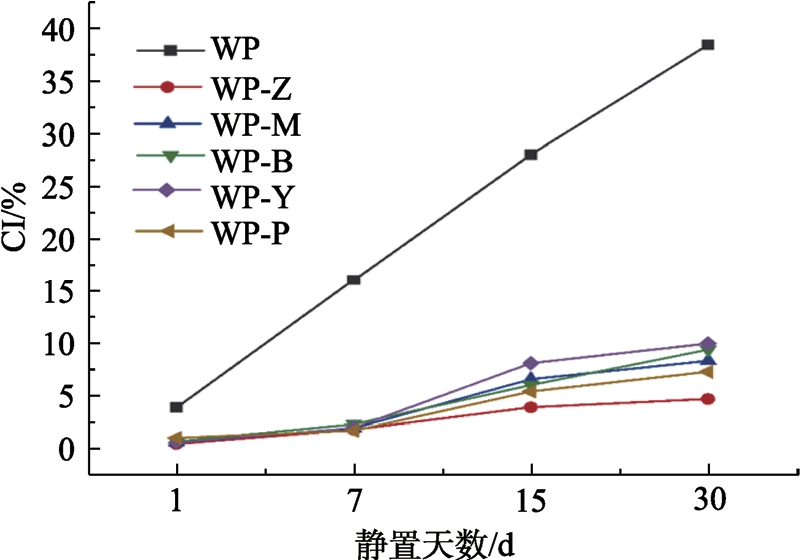
图6 室温静置不同天数后各样品的乳析指数
Fig.6 Creaming index of samples after standing at room temperature for different days
乳液在外力或者静置一段时间后会发生乳析现象,宏观表现为乳液底部析出清液。乳液指数越大,说明体系中油滴的絮凝、聚集程度越高。低乳化指数乳液表现出良好的乳化性和乳液稳定性。由图6可见,核桃蛋白在静置期间的乳析指数持续增加,而酶解可显著减缓乳析的发生,且静置30 d的乳析指数仍小于10%,表现出良好的乳液稳定性。
为更直观观测乳液的热稳定性,将核桃蛋白及其各酶解样品制得的乳液在室温下静置并记录乳析分层状态,结果如图7所示。

图7 室温静置不同天数后乳液直观图
Fig.7 Direct view of emulsion after standing at room temperature
由图7可见,核桃蛋白制成的乳液在放置1天后出现严重失稳,而酶解样品在短期内均保持较好的稳定性,静置7 d部分酶解样品底部也出现了较少的析水现象,静置时间达到15 d后,WP-B、WP-M和WP-Y上层出现明显的析油,且分层状态随着时间的推移越来越明显,推测其内部已产生了聚集絮凝。在第30天,WP-P也出现了上层析油以及下层微量的析水现象,所有样品中WP-Z的乳液体系最稳定。
3 结论
本文研究了低限度酶改性对核桃蛋白各项性质的影响,并用改性后的核桃蛋白制得乳液。结果表明:改性后的核桃蛋白的溶解性、乳化性及起泡性均有较大提高,其中WP-P表现出最好的溶解性,WP-Z的乳化性和乳化稳定性最好;电泳分析表明核桃蛋白发生了低限度酶水解。各酶解样品制得的乳液平均粒径均减小到5~8 μm范围内,油滴颗粒显微体积减小且分散更加均匀,乳析指数也大大降低(30天内均未超过10%),具有良好的乳化稳定性。
[1] 豁银强, 刘传菊, 聂荣祖, 等.核桃蛋白的组成、制备及特性研究进展[J].中国粮油学报, 2020, 35(12): 191-197.HUO Y Q, LIU C J, NIE R Z, et al.Research progress on the composition, preparation and properties of walnut protein[J].Journal of the Chinese Cereals and Oils Association, 2020,35(12): 191-197.
[2] 吴溪.超高压辅助木瓜蛋白酶改善大豆分离蛋白起泡性及其应用[D].东北农业大学, 2017.WU X.Improvement of foaming of soybean protein isolate by ultra-high pressure assisted papain and its application[D].Northeast Agricultural University, 2017.
[3] 孙乾, 张爱琴, 薛雨菲, 等.化学改性对核桃谷蛋白结构表征及功能特性的影响[J].食品科学, 2019, 40(20): 87-93.SUN Q, ZHANG A Q, XUE Y F, et al.Effect of chemical modification on structural characteristics and functional properties of walnut glutenin[J].Food Science, 2019, 40(20): 87-93.
[4] 张玥, 薛雨菲, 李芳, 等.糖基化修饰对核桃谷蛋白结构和功能特性的影响[J].食品与发酵工业, 2020, 46(17): 60-66.ZHANG Y, XUE Y F, LI F, et al.Effects of glycosylation on structural and functional properties of walnut gluten[J].Food and Fermentation Industries, 2020, 46(17): 60-66.
[5] 程云龙, 管军军, 李世豪.酶法改性大豆分离蛋白最新研究进展[J].粮食与饲料工业, 2015, 335(3): 20-23+27.CHENG Y L, GUAN J J, LI S H.Research progress on enzymatic modification of soybean protein isolate[J].Cereal and Feed Industry, 2015, 335(3): 20-23+27.
[6] 贾聪.大豆蛋白及其酶解产物复合阿拉伯胶的乳化性质研究[D].江南大学, 2017.JIA C.Study on the emulsifying properties of soy protein and its enzymatic hydrolysates complexed with gum arabic[D].Jiangnan University, 2017.
[7] 张丽娜.核桃蛋白水解物的抗氧化性及其二肽基肽酶Ⅳ抑制活性研究[D].江南大学, 2020.ZHANG L N.Study on antioxidant activity and dipeptidylpeptidase-IV inhibitory activity of walnut protein hydrolysates[D].Jiangnan University, 2017.
[8] PEARCE K N, KINSELLA J E.Emulsifying properties of proteins: evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[9] SCHAGGER H.Tricine-SDS-PAGE[J].Nature Protocols, 2006,1(1): 16-22.
[10] AGYARE K K, XIONG Y L, ADDO K.Influence of salt and pH on the solubility and structural characteristics of transglutaminasetreated wheat gluten hydrolysate[J].Food Chem, 2008, 107(3):1131-1137.
[11] 齐军茹, 彭志英.蛋白乳化活性与分子结构的关系[J].中国食品添加剂, 2004(2): 52-55.QI J R, PENG Z Y.Relationship between the emulsifying activity of protein and it’s molecular structure[J].China Food Additives, 2004(2): 52-55.
[12] 王中江, 王妍, 张雅娜, 等.热处理对大豆球蛋白乳化性的影响[J].食品工业科技, 2013, 34(16): 154-156+173.WANG Z J, WANG Y, ZHANG Y N, et al.Influence of heat treatment on soy protein emulsibility[J].Science and Technology of Food Industry, 2013, 34(16): 154-156+173.
[13] GUO F, XIONG Y L, QIN F, et al.Surface properties of heatinduced soluble soy protein aggregates of different molecular masses[J].Journal of Food Science, 2015, 80(2): C279-C287.
[14] CAESSENS P W J R, GRUPPEN H, SLANGEN C J, et al.Functionality of β-casein peptides: Importance of amphipathicity for emulsion-stabilizing properties[J].Journal of Agricultural and Food Chemistry, 1999, 47(5): 1856-1862.
[15] WILDE P J, CLARK D C.Foam formation and stability[J].Methods of testing protein functionality, 1996, 1: 110-152.
[16] LINARES E, LARRÉ C, LEMESTE M, et al.Emulsifying and foaming properties of gluten hydrolysates with an increasing degree of hydrolysis: role of soluble and insoluble fractions[J].Cereal Chemistry, 2000, 77(4): 414-420.
[17] SHEWRY P R, NAPIER J A, TATHAM A S.Seed storage proteins: structures and biosynthesis[J].The plant cell, 1995, 7(7):945.
[18] 陈雨杭, 谢朋凯, 范沁塬, 等.搅打稀奶油的乳液特征和打发性能研究[J].中国油脂, 2021, 46(12): 32-38.CHEN Y H, XIE P K, YAN Q Y, et al.Emulsion properties and whipping capabilities of commercial whipping creams[J].China Oils and Fats, 2021, 46(12): 32-38.
[19] 王立敏, 马文君, 孙红波, 等.生物解离大豆过程中形成的乳状液结构[J].食品科学, 2018, 39(12): 67-72.WANG L M, MA W J, SUN H B, et al.Structural study on emulsion formed during enzyme-assisted aqueous extraction from soybean oil[J].Food Science, 2018, 39(12): 67-72.