多孔淀粉通常是以生淀粉为原料,经多种酶协同作用制得的一种表面具有微孔结构的改性淀粉[1],特殊的孔状结构使其能够吸附和保护对光、氧气和温度敏感的物质[2]。在粉末化精油应用中,只需在室温下将精油与多孔淀粉按一定比例简单混合,精油即被吸附到多孔淀粉颗粒内部实现粉末化,该过程避免了精油的乳化、加热,可更好的保护精油的风味和有效成分[3]。然而,生淀粉有着致密的颗粒结构,在其颗粒内部支链淀粉侧链通过分子间氢键形成双螺旋进一步构成了淀粉的结晶区,在X-射线衍射图谱中呈现A型、B型、C型的结晶结构,常温下难溶于水,酶解效率低下,成孔率有限[4]。因此,传统方法制备多孔淀粉存在耗时长产物载油量不高等问题[6]。
V型颗粒态淀粉(VGS)是一种保留了天然淀粉的颗粒形态、具有单螺旋V型结晶结构和良好冷水溶解性的改性淀粉,目前主要通过乙醇碱法和高温高压醇法来制备[7]。制备原理是利用碱液或高温高压处理使淀粉分子双螺旋结构打开[7];乙醇的存在可以抑制淀粉颗粒的溶胀从而保持淀粉的颗粒形态[5],并与展开的淀粉链形成V型单螺旋复合物。在此过程中,生淀粉致密的双螺旋结构转变为VGS疏松的无定形或单螺旋结构,使VGS具备了冷水溶解性及更高的反应活性,同时,VGS的V型单螺旋空腔结构还具有包埋客体的能力[8]。因此,VGS是制备冷水可溶的高吸附能力多孔淀粉的潜在原料。
Chen等[5]曾将蜡质玉米淀粉得到的多孔淀粉继续用乙醇碱法处理来制备可溶性多孔淀粉,但多孔淀粉经乙醇碱法处理后淀粉颗粒黏连严重,且不具备V型结晶结构。与乙醇碱法相比,经高温高压醇法制备的VGS的颗粒形态与天然淀粉更为接近,有利于进一步酶解制备多孔淀粉。然而VGS极易水合,在水溶液中会失去颗粒结构,无法在水溶液中酶解VGS制备多孔淀粉。
非水相酶催化指的是酶在非水介质中对反应进行催化,通过改变反应介质来影响酶的活性中心和构象,从而使酶的催化活性发生改变[9]。酶在有机相中的酶活会受到一定程度的抑制,但残余酶活也能发挥不同程度的作用[10-11]。有报道指出,在有机相中酶解具有改变水解酶作用的方向,使反应向合成方向进行以及增加疏水性底物的溶解性等优势[12]。VGS反应活性高,那么在一定浓度乙醇溶液中酶解VGS,有望提高酶解效率[13],得到吸附能力强的新型多孔淀粉。但目前以VGS为原料制备多孔淀粉的相关研究还比较缺乏。
本团队前期在高醇浓度下制备了VGS,并经进一步酶解制备了V型多孔淀粉(VPS),其吸油率达到了241.70%[14],随后发现在较低醇浓度下(50%乙醇水溶液)制备的VGS具有更高的比表面积[15],可能更适宜制备高吸油率多孔淀粉。因此,本文拟以普通玉米淀粉(NMS)为原料,首先在50%乙醇水溶液中制备了高吸油性VGS,并进一步优化了在50%乙醇水溶液中酶解VGS制备VPS的反应条件。最后,以传统方法水相中酶解NMS制备了A型多孔淀粉(APS),对两种方法酶解前后所得四种淀粉(NMS、APS,VGS、VPS)的表观结构、晶体结构和吸附能力等理化性质进行比较,探究VPS高吸附性的原因。
1 材料与仪器
NMS:无锡浮云生物有限公司;大豆油:中粮福临门食品有限公司;可溶性淀粉、麦芽糖、3, 5-二硝基水杨酸、氢氧化钠、酒石酸钾钠、95%乙醇、无水乙醇等试剂均为分析纯:国药集团化学试剂有限公司;中温α-淀粉酶(源自Aspergillus oryzae power)、糖化酶(源自Aspergillus niger):Sigma-Aldrich(上海)贸易有限公司。
AL104型分析天平:英国Mettler Toledo仪器有限公司;EMS-30型恒温水浴搅拌器:上海百典仪器设备有限公司;TDL-5A型离心机、RH-LDL-50A低速立式大容量离心机:无锡市瑞江分析仪器有限公司:无锡市瑞江分析仪器有限公司;DHG-9123A型电热恒温鼓风干燥箱:上海柏欣仪器设备厂;V-1800型紫外可见分光光度计:上海普美达仪器有限公司;SU8100型冷场发射扫描电子显微镜:日本株式会社日立高新技术; SHB-Ⅲ型循环水式真空泵:长沙明杰仪器有限公司;D2 PHASER X-射线衍射仪:德国布鲁克AXS有限公司;ASAP2020MP全自动比表面积和孔隙度分析仪:美国Micromeritics公司;高速万能粉碎机:天津市泰斯特仪器有限公司;FLY-Z112B型摇床:上海申贤仪器设备厂;高温高压微反应器 HT-500C0型:上海霍桐科技股份有限公司。
2 实验方法
2.1 VGS的制备
将干基重为35 g的NMS分散于160 g体积分数为50%的乙醇水溶液中,将淀粉混合物倒入高温高压反应釜中进行反应,反应温度依次为80、90、100、110、120、130、140、150和160 ℃,转速为500 r/min,达到反应温度后保温30 min,待温度降至40 ℃后将反应物取出,抽滤后用95%乙醇洗涤2~3次,将产物置于110 ℃烘箱中干燥2 h,粉碎过80目筛,得到VGS,之后密封并存于干燥器中,用于后续性质测定。
2.2 吸油率的测定
淀粉对油的吸附属于无选择性吸附,可以通过吸油率来表征改性淀粉的成孔情况。称取1.00 g改性淀粉(质量为M1)置于50 mL离心管中(离心管质量M2),加入5 mL大豆油,在50 ℃,200 r/min条件下搅拌30 min,搅拌结束后在3 500 r/min下,离心15 min,离心后将上层的油倒出,直至离心管中半分钟内无油滴落下,用吸油纸擦拭管壁残余的油滴,记录此时离心管的重量为M3。淀粉吸油率计算公式如下[16]:
吸油率(%)=(M3-M1-M2)/M1×100。
2.3 多孔淀粉的制备
2.3.1 VPS的制备
根据2.2.1中的方法,以吸油率最佳的反应条件制备VGS,待反应温度降至40 ℃后,向反应釜中加入2 mLα-淀粉酶和糖化酶的复合液(其中α-淀粉酶:糖化酶=1∶4),在一定的温度、转速和反应时间下进行酶解。反应结束后,抽滤,用95%乙醇洗涤2~3次,在110 ℃烘箱中干燥2 h,冷却后磨粉、过筛,测定其吸油率。
2.3.1.1 单因素实验 反应温度45 ℃,转速500 r/min,分别在2、4、6、8、10 h下反应,研究反应时间对VPS吸油率的影响,得到最优反应时间;在最优反应时间下进行酶解温度单因素实验,以500 r/min为转速,分别在25、35、45、55、65 ℃下反应,研究反应温度对VPS吸油率的影响,得到最优反应温度;在最优反应时间和反应温度下进行酶解转速的单因素实验,分别在100、300、500、700、900 r/min下反应,研究反应温度对VPS吸油率的影响,得到最优反应温度。
2.3.1.2 正交实验 在单因素实验基础上,以酶解时间(A)、酶解温度(B)、反应转速(C)为影响因素,以吸油率为指标,进行L9(34)正交实验,来筛选最佳的工艺条件。
表1 50%醇浓度正交实验因素水平表
Table 1 Factors and levels of orthogonal test at 50% ethanol

水平 因素A酶解时间/h因素B酶解温度/℃因素C酶解转速/(r/min)1 3 20 200 2 4 25 300 3 5 30 400
2.3.2 传统A型多孔淀粉(APS)的制备
根据吴文琪[17]的方法制备传统的APS作为对照。将20.00 g淀粉与200 mL、pH为5.0的磷酸氢二钠-柠檬酸缓冲溶液加入250 mL的烧杯中,混合均匀后加入2 mL 配置好的酶液(淀粉酶∶糖化酶=1∶4),反应温度为45 ℃,转速为500 r/min,反应时间为6 h,向体系中加入1 mL浓度为4 mol/L的NaOH来终止反应,15 min后加入1 mL浓度为4 mol/L HCl使pH至中性。酶解液离心、倒去上清液,将沉淀洗涤2~3次,40 ℃烘箱中干燥24 h,磨粉过80目筛,密封并存于干燥器中,用于后续性质测定。
2.4 水解度的测定
取1 mL酶解液于10 mL离心管中,加入3 mL DNS试剂,沸水浴中加热5 min,冰水浴冷却至室温,离心(3 500 r/min,5 min)后分离上清液,用紫外可见分光光度计在575 nm下测得分光光度值,根据葡萄糖标准曲线计算出酶解液葡萄糖含量,再根据以下公式计算出水解度值[18]:
H(%)=(C×V)/M×100
式中:DH为水解度,%;C为葡萄糖浓度,mg/mL;V为酶解液体积,mL;M为反应前淀粉质量,mg。
2.5 多孔淀粉得率的测定
多孔淀粉得率代表酶解结束后获得的多孔淀粉的产出情况,计算公式如下:
得率(%)=M/M0×100
式中M为酶解结束后获得的多孔淀粉的质量,g;M0为酶解前普通玉米淀粉质量,g。
2.6 扫描电子显微镜分析
将待测样品均匀铺于有导电胶的载物台上,喷金处理后放置于样品室中观察,设置加速电压为5 kV,在5 000倍的放大倍数下观察样品的微观结构。
2.7 淀粉结晶结构分析
采用X射线衍射仪对样品的晶体结构进行了分析,扫描角度范围为3~36 °(2θ),扫描速度为0.05 °/s。使用MDI JADE软件计算淀粉V型结晶或A型结晶的相对结晶度,计算公式如下所示:
相对结晶度(%)=CDA×100/TDA
其中CDA为V型或A型特征结晶峰的面积之和,TDA为结晶区和非晶区衍射峰总面积。
2.8 低温氮吸附的测定
采用全自动比表面积分析仪对多孔淀粉的比表面积进行了表征。精确称取0.10~0.20 g淀粉样品,在ASAP 2020MP配套的膨胀计中,105 ℃下干燥4 h,用于脱除样品中的水分和气体。然后将样品置于-195.8 ℃的高纯度液氮中(氮浓度≥99.999%)。采用Brunauer-Emmett-Teller(BET)方程计算了相对压力范围P/P0=0.06~0.3(P表示氮分压,P0表示氮在吸附温度下的饱和蒸气压)下五个测量点的比表面积[17]。
2.9 堆积密度的测定
堆积密度是指粉体质量除以该粉体体积所求得的密度。称取一定质量的淀粉粉末自由落体至10 mL量筒中,轻轻敲击量筒,刮平量筒口的粉体,直至量筒中的粉末体积不再发生变化,测定粉末的质量。堆积密度按下式计算:
ρ=M/V
式中,ρ为堆积密度,g/cm3;M为淀粉质量,g;V为淀粉体积,cm3。
3 结果与分析
3.1 高吸附性VGS的制备
在不同反应温度下,VGS吸油率和V型结晶度的变化见图1,随着反应温度从80 ℃升高至140 ℃,吸油率和V型结晶度都呈现先增大后减小的趋势,在100 ℃时达到最大值。玉米淀粉在50%乙醇水溶液中加热,其A型结晶结构的熔融受到一定程度的抑制,熔融温度提高。Li等[15]研究发现,发生A型结晶结构向V型结晶结构转化的温度范围为80~90 ℃,当加热温度达到100 ℃,A型结晶几乎全部消失,随着反应温度的进一步升高,V型结晶结晶度的降低与高温下淀粉颗粒形态的破坏,溶出更多的直链淀粉以及淀粉的降解有关[8]。淀粉V型单螺旋空腔结构可以与更多的脂肪酸形成V型复合物,因此,V型结晶结晶度的变化趋势与吸油率的变化趋势相同,另外,淀粉的吸附性能还与其颗粒结构有关,过高的加热温度(>100 ℃)将导致淀粉颗粒结构的塌陷瓦解,使得吸油率大幅下降。
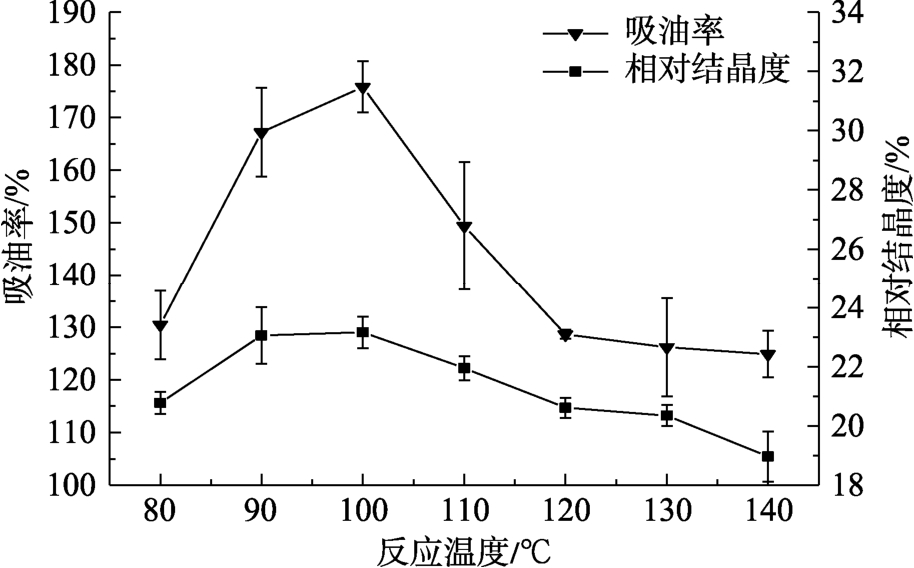
图1 50%乙醇中反应温度对VGS吸油率和结晶度的影响
Fig.1 Effect of reaction temperature on the oil absorption capacity and crystallinity of starch in 50% ethanol
综上,选择在50%乙醇溶液中100 ℃加热作为制备VGS的最优条件。
3.2 VPS的制备工艺优化
3.2.1 酶解时间的影响
在50%乙醇溶液中,以45 ℃为酶解温度,500 r/min为酶解转速来研究酶解时间对VPS的影响,不同酶解时间下得到的VPS的水解度和得率见图2。当酶解时间为2 h时,水解度已经达到45.23%,与传统的水相酶解法相比,酶解效率大幅度提高,说明作为底物的VGS即使在醇溶液中仍对酶有较高的敏感度,这与其颗粒比表面积较大,更有利于酶的进入有关。随着反应时间的加长,水解度逐渐增加,得率逐渐降低。
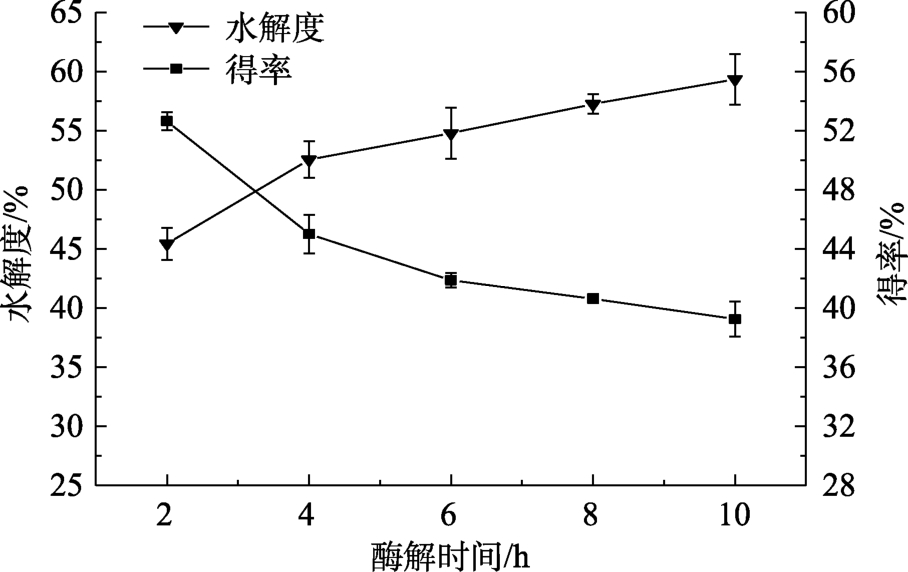
图2 酶解时间对VGS水解度和VPS得率的影响
Fig.2 Effect of enzymatic hydrolysis time on the hydrolysis degree of VGS and yield of VPS
不同酶解时间得到的VPS的吸油率见图3,随着酶解时间的加长,吸油率先增大后减小,在4 h时达到最大值。吸油率呈现先上升后下降的趋势,说明随着酶解时间的增长,酶解程度逐渐增大;酶解时间超过4 h后,吸油率的下降与酶解过度,淀粉颗粒塌陷以及V型空腔结构破坏导致的吸附性能下降有关。综上,选择吸油率最高的4 h作为酶解时间继续探究酶解温度的影响,此时水解度为52.54%,得率为45.00%,吸油率为370.12%。
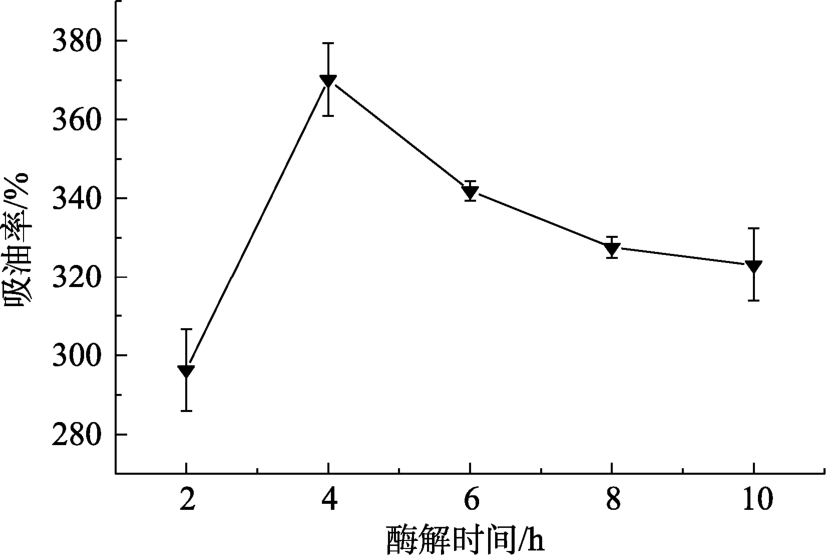
图3 VGS酶解时间对VPS吸油率的影响
Fig.3 Effect of enzymatic hydrolysis time of VGS on the oil adsorption capacity of VPS
3.2.2 酶解温度的影响
不同酶解温度反应后VPS的水解度和得率见图4。随着酶解温度的上升,淀粉的水解度逐渐上升,得率逐渐下降,当温度大于45 ℃时,二者的变化速率增大,这与随着温度的上升,α-淀粉酶和糖化酶复合酶的活力逐渐达到最适反应温度有关;当温度大于55 ℃时,二者的变化速率减小,这与高温下酶活的降低有关。
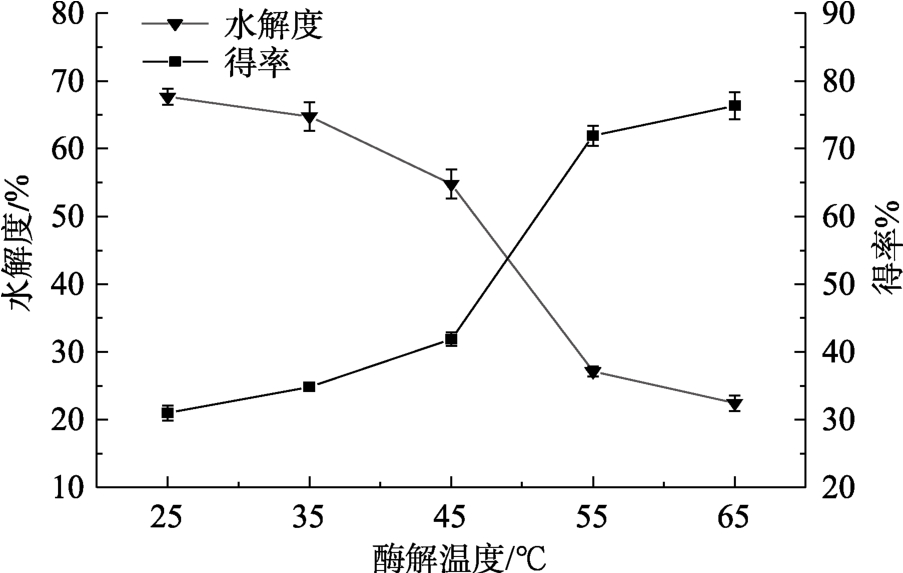
图4 酶解温度对VGS水解度和VPS得率的影响
Fig.4 Effect of hydrolysis temperature on the hydrolysis degree of VGS capacity and yield of VPS
不同酶解温度得到的VPS的吸油率见图5。随着温度的上升,吸油率逐渐下降,在25 ℃时达到最大值,这与高温下淀粉更易溶胀,颗粒形态的破坏更大,更容易塌陷有关,综上,选择25 ℃作为其酶解温度继续探究酶解转速的影响,此时,VPS的水解度为67.67%,得率为31.00%,吸油率为525.06%。
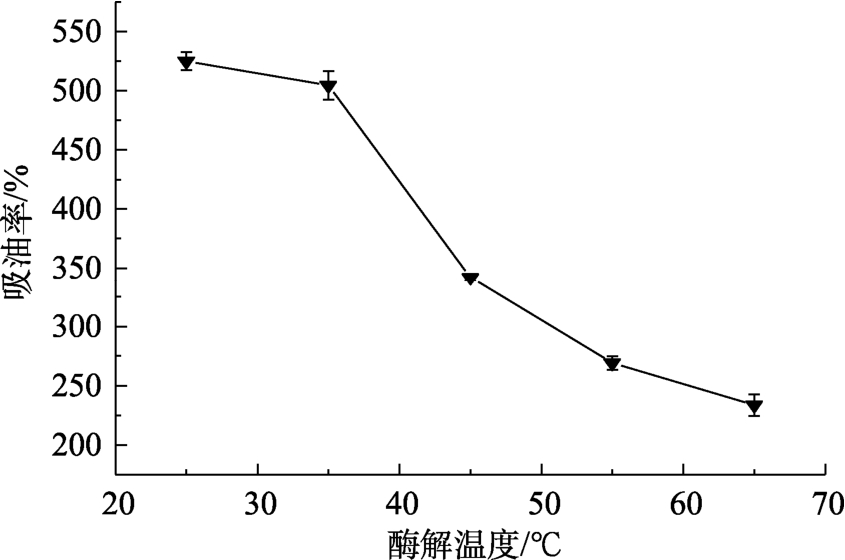
图5 VGS酶解温度对VPS吸油率的影响
Fig.5 Effect of hydrolysis temperature of VGS on the oil adsorption capacity of VPS
3.2.3 酶解转速的影响
不同酶解转速反应得到VPS的水解度和转速见图6,水解呈先增大后减小的趋势,在300 r/min时达到最大值,得率呈先减小后增大的趋势,在300 r/min时达到最小值。这与转速较低时,酶与底物不能充分接触反应,转速较高时,淀粉颗粒间的碰撞频率和强度较大,酶来不及和底物进行充分反应有关。
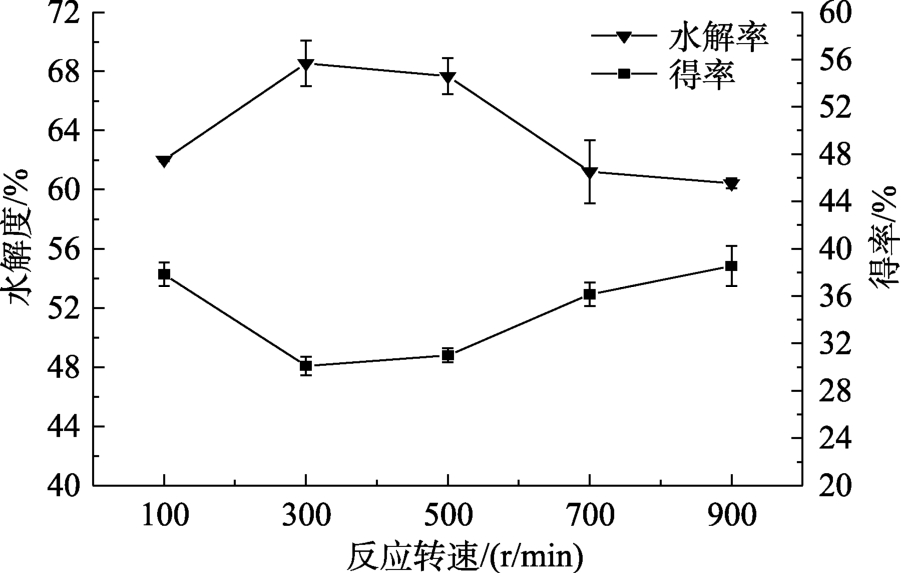
图6 VGS酶解转速对其水解度和VPS得率的影响
Fig.6 Effect of reaction speed on the hydrolysis degree of VGS and yield of VPS
不同酶解转速反应得到VPS的吸油率见图7,随着转速的增大,吸油率呈先增大后减小的趋势,在300 r/min时达到最大值,这与该转速下酶能够与底物充分接触反应,酶解效率达到最大有关。综上,该单因素实验中,转速在300 r/min时效果最佳,此时水解率为68.55%,得率为30.11%,吸油率为547.93%。
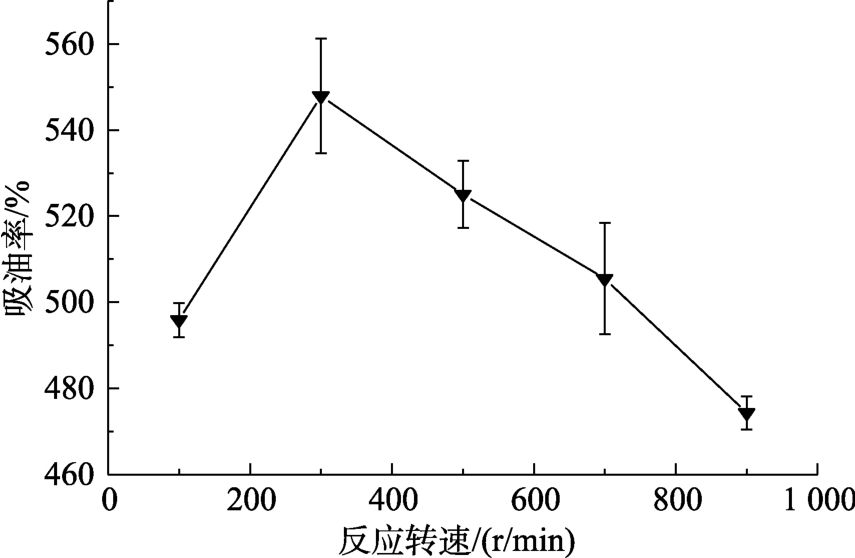
图7 VGS酶解转速对VPS吸油率的影响
Fig.7 Effect of reaction speed of VGS on the oil adsorption capacity of VPS
3.2.4 正交实验结果及验证
根据单因素实验的结果,进行三因素三水平的正交实验,实验结果分析见表2。以吸油率为考察指标,用直观分析法得出影响因素作用的主次关系为:酶解时间>酶解转速>酶解温度,结合极差分析可知最佳条件为A2B2C3,即VPS的最优制备条件为:酶解时间4 h,酶解转速400 r/min,酶解温度25 ℃,此时得到的VPS吸油率最高,为550.28%。通过验证实验,表明该条件下制得的VPS吸油率达到最高。
表2 正交实验结果分析表
Table 2 Results of orthogonal test
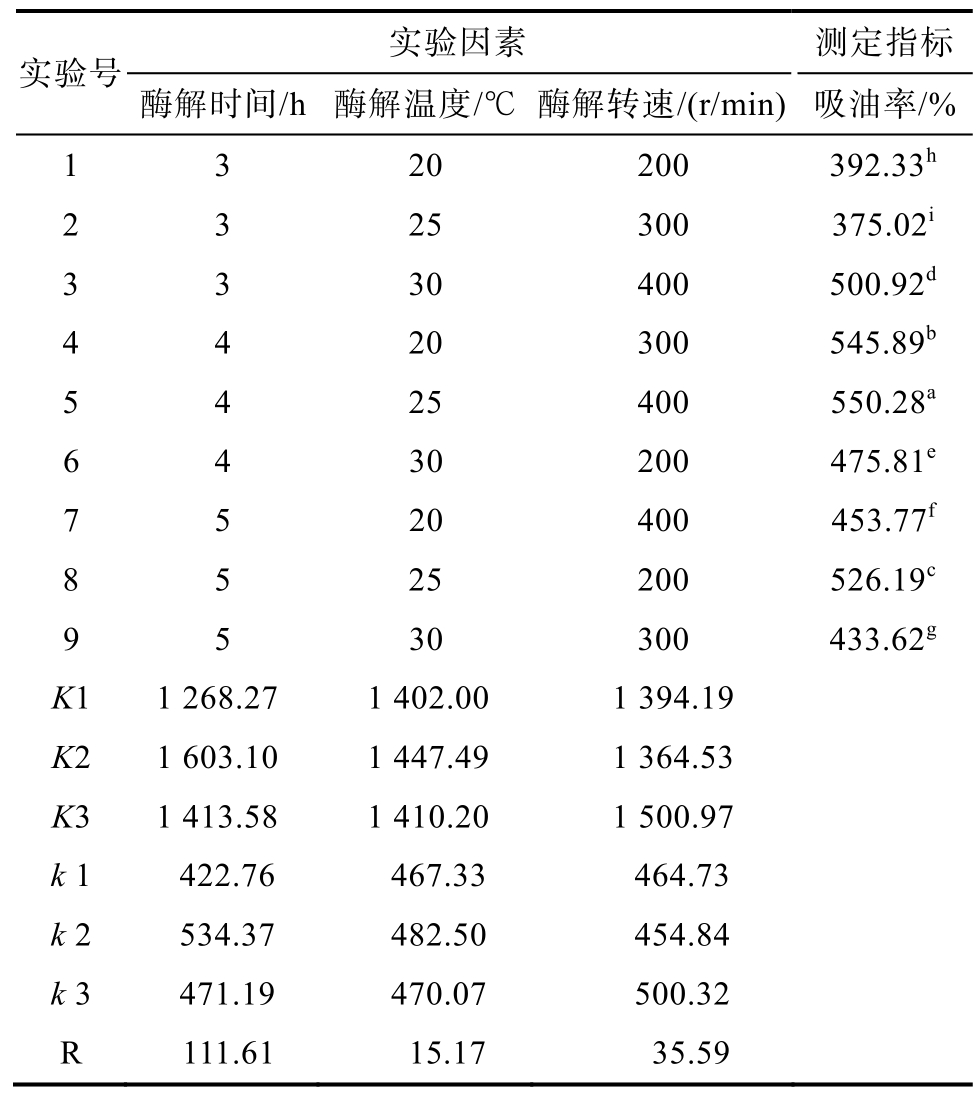
注:表中同一列中标有相同字母的数值间没有显著差异(P<0.05)。
Note: Values with the same letters in the same column are not signifcantly different (P < 0.05)
实验号 实验因素 测定指标酶解时间/h 酶解温度/℃ 酶解转速/(r/min)吸油率/%1 3 20 200 392.33h 2 3 25 300 375.02i 3 3 30 400 500.92d 4 4 20 300 545.89b 5 4 25 400 550.28a 6 4 30 200 475.81e 7 5 20 400 453.77f 8 5 25 200 526.19c 9 5 30 300 433.62g K1 1 268.27 1 402.00 1 394.19 K2 1 603.10 1 447.49 1 364.53 K3 1 413.58 1 410.20 1 500.97 k 1 422.76 467.33 464.73 k 2 534.37 482.50 454.84 k 3 471.19 470.07 500.32 R 111.61 15.17 35.59
3.3 VPS高吸附性的成因探究
为研究新方法制备的VPS高吸附性能的原因,与传统方法水相中酶解NMS制备的A型多孔淀粉(APS)作比较,测定了两种方法酶解前后所得四种淀粉(NMS、APS,VGS、VPS)的晶体结构、表观结构和吸附能力,结果如下。
3.3.1 结晶结构的变化
NMS、APS以及VGS和VPS的XRD图像及其对应晶型的相对结晶度见图8。可以发现VGS在酶解后得到的VPS仍呈现V型结晶结构,在2θ=7°、13°和21°时出现显著的V型特征峰,说明α-淀粉酶和糖化酶的复合醇相酶解并未改变淀粉的晶型[20]。VPS的相对结晶度显著提高,这可能是因为醇水热处理形成的V型结晶对直链淀粉有保护作用,酶解更多地作用于VGS中大量处于无定形区的支链淀粉簇。而对照组APS的结晶度略有提高,这与酶主要作用于NMS的无定形区中的直链淀粉α-1, 4糖苷键有关。
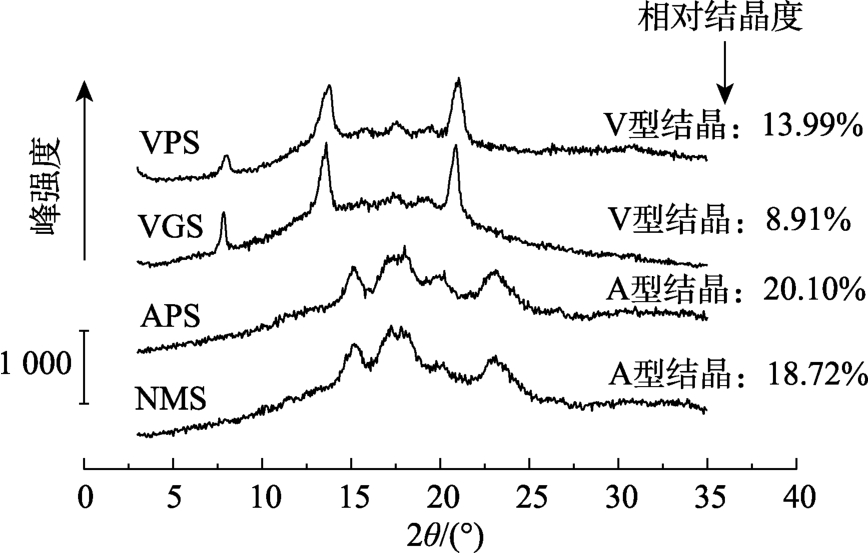
图8 四种淀粉(NMS、APS、VGS和VPS)的X射线衍射图谱及其对应晶型的相对结晶度
Fig.8 XRD pattern and relative crystallinity of four different starches (NMS、APS、VGS and VPS)
3.3.2 颗粒结构的变化
NMS、APS以及VGS和VPS的颗粒表观结构如图9所示。NMS呈多角形,表面有微小的孔洞。传统方法——水相中酶解NMS得到的APS,孔洞较大且相对比较稀疏。NMS经醇水热处理法制备得到的VGS仍保持着淀粉的颗粒形态,但表面有细小裂缝,这是因为50%的乙醇虽然可以抑制加热后淀粉颗粒的溶胀,但仍有一部分直链淀粉在高温条件下溶出[15]。VGS酶解后得到的VPS也保持了一定的颗粒形态,其表面呈现海绵状不规则的密集蜂窝状结构。VPS这种特殊的蜂窝状结构与其吸附性能密切相关。

图9 四种淀粉(NMS、APS、VGS和VPS)的微观结构
Fig.9 The microstructure of four different starches (NMS、APS、VGS and VPS)
3.3.3 VPS吸附能力的分析
NMS、APS以及VGS和VPS的比表面积、总孔体积、平均孔径、堆积密度和吸油率见表3,可以发现和传统的APS相比,VPS的比表面积增大了约27倍,总孔体积增大了约55倍,平均孔径增大了约9倍,使其颗粒整体的吸附能力显著增大。堆积密度可以表示淀粉的流动性,这一性质与粉末的运输、加工有关,是粉末材料的一项重要技术参数。较低堆积密度的淀粉具有更好的流动性,相同质量下会有更多体积的多孔淀粉,进而可以吸附更多的物质。VPS的堆积密度显著低于NMS和APS,这是由于VPS的酶解程度较高,比表面积更大,颗粒内外结构疏松,因此其吸油率也较高。NMS、APS、VGS和VPS的氮气吸附-脱附等温线见图10,从图中可知,氮吸附量VPS>VGS>APS>NMS。进一步验证了VGS在乙醇水溶液中的酶解效率要显著高于传统NMS在水相中的酶解效率,VGS对酶的敏感度显著提高。

图10 四种淀粉(NMS、APS、VGS和VPS)的吸附等温线
Fig.10 The adsorption isotherms of four starches (NMS、APS、VGS and VPS)
表3 四种淀粉的比表面积、总孔体积、平均孔径、堆积密度和吸油率
Table 3 Specific surface area, total pore volume, average pore diameter, bulk density and oil absorption capacity of four different starches

注:同一列中标有相同字母的数值间没有显著差异(P<0.05)。
Note: Values with the same letters in the same column are not signifcantly different (P < 0.05).
比表面积/(m2/g) 总孔体积/(×10-3cm3/g) 平均孔径/nm 堆积密度/(g/cm3) 吸油率/%NMS / / / 0.53±0.04c 121.90±2.90d APS 1.43±0.04c 4.32c 3.41c 1.20±0.10a 176.24±2.48c VGS 3.78±0.24b 5.87b 11.49b 0.75±0.02b 218.32±12.40b VPS 39.94±0.26a 239.85a 27.61a 0.19±0.07d 550.28±13.30a
4 结论
(1)以NMS为原料,在50%乙醇溶液中100 ℃加热制备的VGS颗粒结构疏松,反应活性高,在50%乙醇溶液中也易于被酶解。
(2)上述VGS在50%乙醇溶液中加入α-淀粉酶和糖化酶,25 ℃酶解时间4 h,反应转速300 r/min,可制得一种高吸油率多孔淀粉VPS,其吸油率高达550.28%。
(3)VPS的高吸油率是源于其海绵状不规则的密集蜂窝结构,以及较低的堆积密度0.19 g/cm3和较大的比表面积39.94 m2/g。
(4)本研究结果可为新型多孔淀粉材料的开发和应用提供理论依据。
[1] DURA A, BŁASZCZAK W, ROSELL C M.Functionality of porous starch obtained by amylase or amyloglucosidase treatments[J].Carbohydrate Polymers, 2014, 101: 837-845.
[2] BELINGHERI C, GIUSSANI B, RODRIGUEZ-ESTRADA M T, et al.Oxidative stability of high-oleic sunflower oil in a porous starch carrier[J].Food Chemistry, 2015, 166: 346-351.
[3] JU J, CHEN X Q, XIE Y F, et al.Simple microencapsulation of plant essential oil in porous starch granules: adsorption kinetics and antibacterial activity evaluation[J].Journal of Food Processing and Preservation ,2019, 43(10).
[4] 翟一潭, 柏玉香, 李晓晓, 等.酶法改性淀粉颗粒的研究进展[J].食品科学, 2021, 42(7): 319-328.ZHAI Y T, BAI Y X, LI X X, et al.Preparation, characterization,physicochemical property and potential application of enzymemodified starch: a review[J].Food Science, 2021, 42(7): 319-328.
[5] CHEN Y, DAI G, GAO Q.Preparation and properties of granular cold-water-soluble porous starch[J].International Journal of Biological Macromolecules, 2020, 144: 656-662.
[6] XIE Y, LI M, CHEN H, et al.Effects of the combination of repeated heat-moisture treatment and compound enzymes hydrolysis on the structural and physicochemical properties of porous wheat starch[J].Food Chemistry, 2019, 274: 351-359.
[7] LI J, ZHOU X, JIN Z.Effect of high-temperatures and aqueous ethanol treatment on the formation process and properties of V-type Granular Starch (VGS)[J].Carbohydrate Polymers, 2021,258: 117713.
[8] SHI L, FU X, HUANG Q, et al.Single helix in V-type starch carrier determines the encapsulation capacity of ethylene[J].Carbohydrate Polymers, 2017, 174: 798-803.
[9] WOODLEY J M.New opportunities for biocatalysis: making pharmaceutical processes greener[J].Trends Biotechnology, 2008,26(6): 321-327.
[10] 刘玉芳.蛋白酶在乙醇溶液中性质及其应用研究[D].无锡:江南大学, 2012: 15-25.LIU Y F.Study on properties and application of proteases in ethanol solution[D].Wuxi: Jiangnan University, 2012: 15-25.
[11] 陈翔, 曾朝玮, 申瑾, 等.中温结合乙醇处理对枯草芽孢杆菌芽孢皮层裂解酶活性及结构的影响[J].食品与发酵工业,2019, 45(23): 37-42.CHEN X, ZENG Z W, SHEN J, et al.Effect of moderate temperature combined with ethanol treatment on activity and structure of Bacillus subtilis spore cortex lyase[J].Food and Fermentation Industries, 2019, 45(23): 37-42.
[12] YU H, OU L, XU J.New trends in non-aqueous biocatalysis[J].Current Organic Chemistry, 2010, 14(14): 1424-1432.
[13] ZHONG Y, HERBURGER K, XU J, et al.Ethanol pretreatment increases the efficiency of maltogenic α-amylase and branching enzyme to modify the structure of granular native maize starch[J].Food Hydrocolloids, 2022, 123.
[14] ZHOU X, CHANG Q, LI J, et al.Preparation of V-type porous starch by amylase hydrolysis of V-type granular starch in aqueous ethanol solution[J].International Journal of Biological Macromolecules, 2021, 183: 890-897.
[15] LI J, ZHOU X, JIN Z.V-type granular starch prepared using aqueous-ethanol heat treatment at different ethanol concentrations[J].Food Hydrocolloids, 2022, 123: 107176.
[16] ZHAO A, YU L, YANG M, et al.Effects of the combination of freeze-thawing and enzymatic hydrolysis on the microstructure and physicochemical properties of porous corn starch[J].Food Hydrocolloids, 2018, 83: 465-472.
[17] 吴文琪.加酶挤压联合酶解法制备多孔淀粉及其在甜橙油粉末化中的应用[D].无锡: 江南大学, 2020: 10-18.WU W Q.Preparation of porous starch by bioextrusion combined with enzymolysis and its application in microencapsulation of sweet orange oil[D].Wuxi: Jiangnan University, 2020: 10-18.
[18] WU W, JIAO A, XU E, et al.Effects of extrusion technology combined with enzymatic hydrolysis on the structural and physicochemical properties of porous corn starch[J].Food and Bioprocess Technology, 2020, 13(3): 442-451.