真菌毒素是真菌在食品或饲料中滋生所产生的次级代谢产物,是农产品的主要污染物之一[1-2],可导致急、慢性中毒,严重时会危及人类和动物的生命安全[3-4]。脱氧雪腐镰刀菌烯醇(DON)又称呕吐毒素和玉米赤霉烯酮(ZEN)是最常见的真菌毒素之一,在全世界的谷物及其副产品污染广泛,主要存在于小麦、玉米和大麦等谷物之中[5-6]。玉米是世界上最重要的食粮之一,同时也是动物饲料必不可少的主要原料[7-8]。据研究发现,我国饲料用玉米及原料中这两种毒素检出率较高,在抽调样品中检出率常在 80%以上[9-11]。故研究建立同时检测DON和ZEN的快速、稳定、科学的定量分析方法,对于粮食类食品中 DON、ZEN的暴露和风险评估与控制具有重要意义。
真菌毒素快速检测在粮食仓储、基础生产等大量应用,大多以免疫层析法为主要检测方法,现有的免疫层析法由于单抗的应用,一张试纸只能针对一种真菌毒素实现快检应用,成本较高且效率较低。多毒素试纸条一般价格较高或在其中一种毒素的检出限较高,毒素含量低时,检测结果不稳定。在此基础上,我们研发了高特异性免疫识别真菌毒素快检试纸条如图1,在发光物与抗体构建偶联过程中,利用超导体材料进行半包被,超导体有极高的导电特性,将发光物与抗体间静电荷聚集在抗体侧向吸附,电荷对抗体中杂质及蛋白酶产生边缘控制吸附效应,从而提高单抗或者多抗的纯度,增加抗体稳定度,同时突破性改变免疫法对温度的耐受,实现了真菌毒素检测耗材常温储存及运输转变,避免了低温储存等苛刻条件带来的检测准确度下降及数值偏差的风险。方便在田间地头或仓储粮库现场应用。在提高检测精准度、平行性的同时,大大的提高了便利性;超导体包被免疫荧光试纸法可实现玉米中DON、ZEN的快速、定量检测,在真菌毒素监测和各环节监管中可以快速、高效、准确的反馈数据,为各方决策、导向提供了强有力的理论依据与技术支撑。
图1 超导体包被免疫荧光试纸条
Fig.1 The superconductor coated immunofluorescence test strips
1 材料与方法
1.1 材料与试剂
本研究选取的是天然收获玉米。
呕吐毒素快速定量检测卡(2~30 ℃密封储存):深圳市赛泰诺生物技术有限公司;呕吐毒素免疫亲和柱、玉米赤霉烯酮毒素免疫亲和柱:美国 ROMER公司;低浓度呕吐毒素玉米质控品(472±80 μg/kg)、中浓度呕吐毒素玉米质控品(990±130 μg/kg)、高浓度呕吐毒素玉米质控品(1 845±277 μg/kg)、低浓度玉米赤霉烯酮毒素玉米质控品(46.5±6.3 μg/kg)、中浓度玉米赤霉烯酮毒素玉米质控品(70.0±11 μg/kg)、高浓度玉米赤霉烯酮毒素玉米质控品(108.6±18.8 μg/kg):青岛普瑞邦生物工程有限公司。
1.2 仪器与设备
QD-Infinity系列霉菌毒素快速定量免疫荧光分析仪:深圳市赛泰诺生物技术有限公司;1260Ⅱ高效液相色谱仪,配DAD和FLD检测器:美国Agilent公司。
1.3 实验方法
1.3.1 超导体包被免疫荧光试纸法
取玉米待测样品500 g,经粉碎(研磨)机进行充分粉碎,过20目筛混匀样品,称取样品5 g于50 mL离心管中,加入55%甲醇溶液25 mL,混匀,涡旋震荡5 min,选择5 000 r/min离心2 min,收集上层甲醇提取液,移取提取液100 μL与ST缓冲液400 μL振荡混匀,从中移取75 μL待检液垂直滴入毒素检测卡的加样孔中,静置反应10 min后,检测卡经QD—Infinity快速免疫荧光分析仪检测分析。
1.3.2 超导体包被免疫荧光的制备
配置质控线C、检测线DON、ZEN的划线液,C划线液为0.7 L的0.4 mg/mL兔抗体加上3. 5μL的10%海藻糖和30.8 L的PBS缓冲液的混合液;DON划线液为2.33 μL的0.8 mg/mL抗DON抗体与32.67 μL PBS的混合液;ZEN划线液为2.33 μL的0.8 mg/mL抗ZEN抗体与32.67 μL PBS的混合液。再将硝酸纤维素膜贴到 PVC快检试纸条上,再将贴有PVC板的硝酸纤维素膜放至金标划膜仪上标记的指定位置,启动划线至贴有PVC板的硝酸纤维素膜上,完成 C-DON划线环节。然后再ZEN划线,完成后在37 ℃烘箱中烘干12 h,待用。
分别将0.44 μL 18.18 mg/mL羊抗兔抗体、11.11 mg/mL抗DON抗体、抗9.09 mg/mL抗ZEN抗体用0.1 mol/L碳酸钾调整pH为7.4按3∶1∶1进行配置,再放入配置好的金颗粒于旋转盘上旋转混匀15 min。将BSA封闭剂按每1 mL加100 μL的量加入标记好的金颗粒中涡旋15 min。再放至冷冻离心机中离心 4 ℃,5 min。取上清液,弃沉淀;再4 ℃离心20 min,弃去上清液,取沉淀物复溶,用复溶液按每标记1 mL复溶100 μL的量进行复溶。混合标记好的复溶金颗粒,羊抗兔抗体、抗ZEN抗体、抗DON抗体混合金颗粒按1∶1∶1进行混合后,取金标垫放到金标仪标记好的指定位置,用磁铁压住,以4.5 μL/cm进行喷金。完成后在37 ℃烘箱中烘干12 h。
1.3.3 免疫亲和柱液相色谱法
按照国标GB 5009.111—2016《食品安全国家标准食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定》[12]第二法免疫亲和层析净化高效液相色谱法进行试样提取、净化、上机。
按照国标 GB 5009.209—2016《食品安全国家标准 食品中玉米赤霉烯酮的测定》[13]第一法液相色谱法进行试样提取、净化、上机。
1.4 数据分析
各组实验重复3次,采用SPSS18.0进行统计分析,Origin 9.0软件进行作图处理,P<0.05为在统计学上显著性差异,结果以x±s来表示。
2 结果与分析
2.1 最低检出限和最低定量限
超导体包被免疫荧光试纸法检出限与定量限的确定是用连续独立测定20份空白样(天然的阴性玉米样本),分别按照 IUPAC推荐的公式s+3× b、s+ 10× b计算检出限与定量限[14],式中:s为20份空白样品检测值的平均值;b为标准偏差,数据分布见图2、表1和表2。

图2 超导体包被免疫荧光试纸法检测20份玉米空白样品的DON和ZEN的数据分布图
Fig.2 DON and ZEN data distribution of 20 blank maize samples detected by superconductor coated immunofluorescence test strip method
表1 超导体包被免疫荧光试纸法和液相色谱法测DON的最低检出限和定量限对比数据
Table 1 Superconductor coated immunofluorescence test strip method and HPLC method for the measurement of DON’s LOD and LOQ data
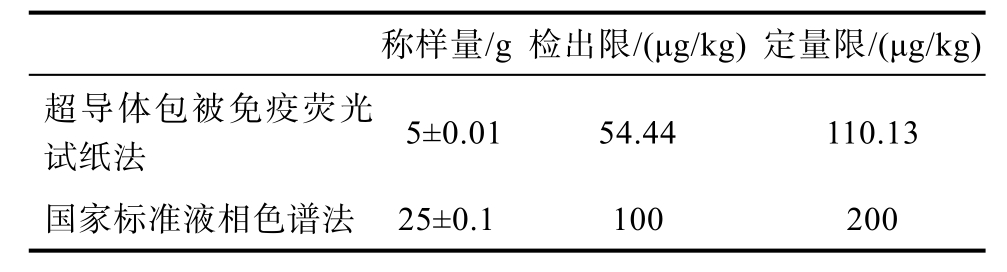
称样量/g 检出限/(μg/kg) 定量限/(μg/kg)超导体包被免疫荧光试纸法 5±0.01 54.44 110.13国家标准液相色谱法 25±0.1 100 200
表2 超导体包被免疫荧光试纸法和液相色谱法测ZEN的最低检出限和定量限对比数据
Table 2 Superconductor coated immunofluorescence test strip method and HPLC method for the measurement of EZN’s LOD and LOQ data
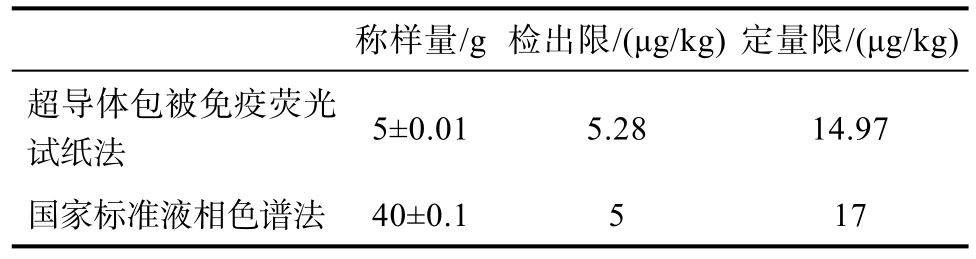
称样量/g 检出限/(μg/kg) 定量限/(μg/kg)超导体包被免疫荧光试纸法 5±0.01 5.28 14.97国家标准液相色谱法 40±0.1 5 17
由图2中数据可知超导体包被免疫荧光试纸法检测20份玉米空白样品中DON的测定值幅度在 14.1~45.8 μg/kg范围内,ZEN的测定幅度在0~5.6 μg/kg范围内,DON和ZEN的测定平均值分别是30.6 μg/kg和1.1 μg/kg,标准偏差分别为7.96%和1.38%。由表1和表2,可以看出超导体包被免疫荧光试纸法 DON、ZEN双联检测中DON检出限和定量限上是低于国家标准液相色谱法的规定,ZEN检出限和定量限略高于国家标准液相色谱法的规定。说明超导体包被免疫荧光试纸法在称取样品量减少,检测时间大大缩短的情况下,检测限量水平同液相色谱法相近。
2.2 准确性测定
用超导体包被免疫荧光试纸法快速定量检测系统在相同实验条件下,使用不同检测卡检测同一样品,分别测定3个毒素含量梯度的玉米质控样,每个样品平行检测3次,结果见表3和表4。
表3 超导体包被免疫荧光试纸法检测玉米质控样的DON含量
Table 3 Determination of DON content in maize quality control samples by superconductor coated immunofluorescence test strip method
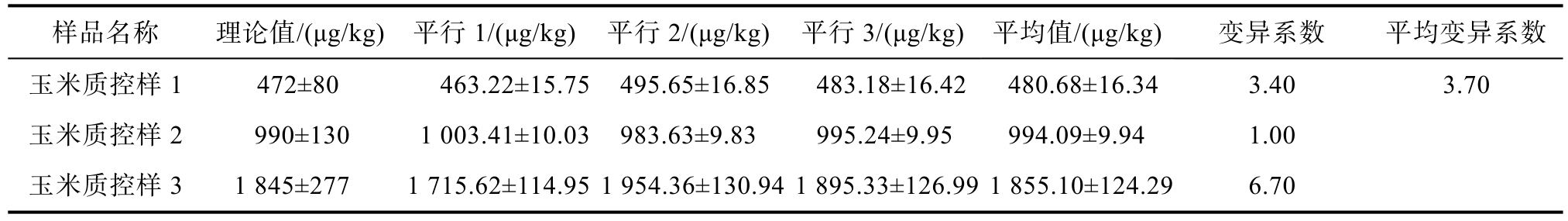
样品名称 理论值/(μg/kg) 平行1/(μg/kg) 平行2/(μg/kg) 平行3/(μg/kg) 平均值/(μg/kg) 变异系数 平均变异系数玉米质控样 1 472±80 463.22±15.75 495.65±16.85 483.18±16.42 480.68±16.34 3.40 3.70玉米质控样 2 990±130 1 003.41±10.03 983.63±9.83 995.24±9.95 994.09±9.94 1.00玉米质控样 3 1 845±277 1 715.62±114.95 1 954.36±130.94 1 895.33±126.99 1 855.10±124.29 6.70
表4 超导体包被免疫荧光试纸法检测玉米质控样的ZEN含量
Table 4 Determination of ZEN content in maize quality control samples by superconductor coated immunofluorescence test strip method
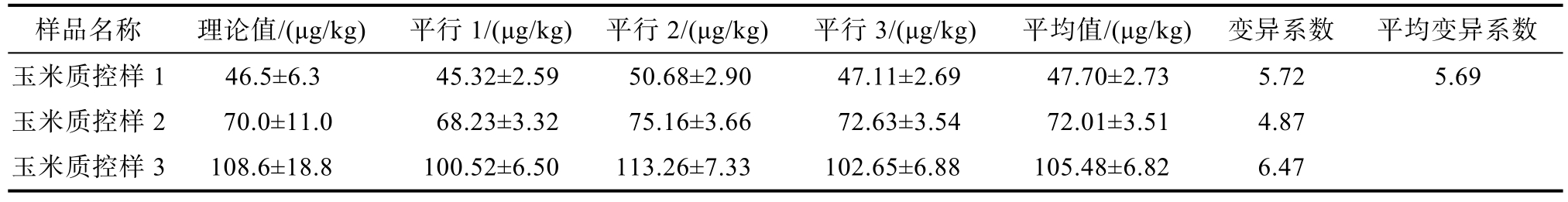
样品名称 理论值/(μg/kg) 平行1/(μg/kg) 平行2/(μg/kg) 平行3/(μg/kg) 平均值/(μg/kg) 变异系数 平均变异系数玉米质控样 1 46.5±6.3 45.32±2.59 50.68±2.90 47.11±2.69 47.70±2.73 5.72 5.69玉米质控样 2 70.0±11.0 68.23±3.32 75.16±3.66 72.63±3.54 72.01±3.51 4.87玉米质控样 3 108.6±18.8 100.52±6.50 113.26±7.33 102.65±6.88 105.48±6.82 6.47
检测结果均与质控样的理论值符合率达100%,质控样品的呕吐毒素含量重复测定的变异系数范围在1.00%~6.70%之间,玉米赤霉烯酮含量重复测定的变异系数范围在4.87%~6.47%之间,呕吐毒素平均变异系数为 3.70%,玉米赤霉烯酮含量重复测定的平均变异系数为 5.69%,检测的准确度符合实验要求。
2.3 回收率和方法精密度
在阴性玉米样品中添加DON标准品和ZEN标准品制成三个含量梯度的样品,样品中DON理论含量分别为 500 μg/kg、1 000 μg/kg、2 000 μg/kg、ZEN 理论含量分别为50 μg/kg、100 μg/kg、150 μg/kg,进行回收率和精密度测定,每个梯度测定6次,数据分布见图3。

图3 超导体包被免疫荧光试纸法检测加标玉米样品DON和ZEN的回收率分布图
Fig.3 Recovery distribution of DON and ZEN in spiked maize samples detected by superconductor coated immunofluorescence test strip method
取6次结果的平均值得三个含量梯度的玉米样品中DON加标回收率分别为107.45%、108.17%、103.72%,相对偏差分别为7.45%、8.17%、3.72%,ZEN加标回收率分别为 97.81%、111.27%、109.68%,相对偏差分别为2.19%、11.27%、9.68%,符合国标定量检测标准要求。由图2箱形图可以看出,DON和ZEN回收率检测结果波动范围在20%以内,回收率范围均在 80%~120%以内,符合加标回收要求。DON在三个含量梯度的检测数据较 ZEN检测数据要更集中。ZEN在检测低含量样品,理论含量为50 μg/kg时,检测数据较分散,回收率检测结果 81.72%~111.03%,在检测理论含量为150 μg/kg时,检测数据较集中,总体上DON和ZEN方法精密度,符合国标定量检测标准要求。
2.4 与液相色谱法比较测定
将 30份玉米样品同时用液相色谱法和超导体包被免疫荧光试纸法检测DON和ZEN,并对结果数据进行比较,由于快检卡数据 DON检测结果低于100 μg/kg,ZEN检测结果低于5 μg/kg的无法读出,故不做统计,其他检测数据比较见图4。

图4 液相色谱法和超导体包被免疫荧光试纸法检测玉米样品中DON和ZEN数据对比及相对偏差图
Fig.4 Comparison and relative deviation of DON and ZEN data in maize samples detected by HPLC method and superconductor coated immunofluorescence test strip method
由图4可知在测定的30组数据中,去除仪器无法读数的数据,液相色谱法和超导体包被免疫荧光试纸法检测DON和ZEN的结果符合率达到100%。2种方法的DON检测结果的相对偏差在–0.37%~9.04%之间,ZEN的相对偏差在–4.99%~6.54%之间,说明超导体包被免疫荧光试纸法的检测数据与液相色谱法的检测数据相一致,方法间偏差较小,精密度将近,结果可靠,符合国家标准偏差要求。
4 讨论与结论
本研究表明超导体包被免疫荧光试纸法能够同时快速定量检测玉米中DON和ZEN两种毒素的检测方法,测定法准确、可靠。本方法与国家标准液相色谱法相比,具有快速、灵敏、方便、科学、检测成本低的特点,与单联快检法相比,具有省时、节约成本、同时呈现2个毒素指标的特点。可以在满足农产品及其制品中真菌毒素快速检测需求。此外,本方法为内置标准曲线,不需要在实验中制作标准曲线,减少人为检测误差,保持每台仪器的稳定性。试纸条和试剂耗材在2~30 ℃储存的技术优势,便于在各种温度条件的运输和使用,可用于不同检测环境如田间调查,市场抽查等。随着现代检测技术迅猛发展,人们对食品、饲料安全日益重视,快速筛查、实时监控是检测发展的趋势,超导体包被免疫荧光试纸法同时快速定量检测玉米中DON和ZEN两种毒素的检测方法具有现实意义。
[1]WANG S, WU K T, XUE D F, et al. Mechanism of deoxynivalenol mediated gastrointestinal toxicity: Insights from mitochondrial dysfunction[J]. Food Chem Toxicol, 2021, 153: 112214.
[2]黄晓静, 王少敏, 毛丹, 等. 镰刀菌属真菌毒素的毒性研究进展[J]. 食品安全质量检测学报, 2017, 8(8): 3117-3128.HUANG X J, WANG S M, MAO D, et al. Research progress on toxicity of Fusarium mycotoxins[J]. Journal of Food Safety &Quality, 2017, 8(8): 3117-3128.
[3]BHATR, RAI R V, KARIM A A. Mycotoxins in food and feed:present status and future concerns[J]. Comprehensive Reviews in Food Science and Food Safety, 2010, 9(1): 57-81.
[4]李志霞, 聂继云, 闫震, 等. 果品主要真菌毒素污染检测、风险评估与控制研究进展[J]. 中国农业科学, 2017, 50(2):332-347.LI Z X, NIE J Y, YAN Z, et al. Progress in research of detection,risk assessment and control of the Mycotoxins in fruits and fruit products[J]. Scientia AgricμLtura Sinica, 2017, 50(2): 332-347.
[5]MOSAAD A, AZIZA A, ASMAA S, et al. Protective capabilities of silymarin and inμLin nanoparticles against hepatic oxidative stress, genotoxicity and cytotoxicity of deoxynivalenol in rats[J].Toxicon, 2018, 142: 1-13.
[6]武亭亭, 杨丹. 粮食加工品中玉米赤霉烯酮和呕吐毒素污染情况调查[J]. 食品安全质量检测学报, 2019, 10(12): 3674-3678.WU T T, YANG D. Investiation on zearalenone and deoxynivalenol contamination in grain-related food[J]. Journal of Food Safety &Quality, 2019, 10(12): 3674-3678.
[7]兰静, 赵琳, 孙向东, 等. 我国玉米生物毒素污染现状及预防措施[J]. 安徽农业科学, 2019, 47(19): 183-185+189.LAN J, ZHAO L, SUN X D, et al. Current situation and preventive measures of Mycotoxin contamination of maize in China[J]. Journal of Anhui AgricμLtural Sciences, 2019, 47(19):183-185+189.
[8]陈雨生, 周睿, 张婷. 中国饲料粮进口替代研究[J]. 农业技术经济, 2022(7): 64-77.CHEN L S, ZHOU R, ZHANG T. Study on import substitution of feed and grain in China[J]. Journal of Agrotechnical Economics,2022(7): 64-77.
[9]尚加英, 郑学玲, 赵波, 等. 粮食中呕吐毒素的物理消减方法研究进展[J]. 中国粮油学报, 2020, 35(9): 187-194.SHANG J Y, ZHEN X L, ZHAO B, et al. Research progress on physical abatement of emetic toxin in grain[J]. Journal of the Chinese Cereals and Oils, 2020, 35(9): 187-194.
[10]侯楠楠, 谢全喜, 王梅, 等. 2019年全国部分地区饲料及原料霉菌毒素污染状况调查[J]. 广东饲料, 2020, 29(10): 47-50.HOU N N, XIE Q X, WANG M, et al. Investigation on mycotoxin contamination of feed and raw materials in some areas of China in 2019[J]. Guangdong Feed, 2020, 29(10): 47-50.
[11]冯雪莲, 周英焕, 李留安, 等. 玉米赤霉烯酮的危害及物理吸附剂脱毒效果研究进展[J]. 现代农业科技, 2021(21): 133-135.FENG X L, ZHOU Y H, LI L A, et al. Research progress on harm of Zearalenone and its Detoxification effect of physical adsorbent[J]. Modern AgricμLtural Science and Technology,2021(21): 133-135.
[12]中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定: GB 5009.111—2016[S].National Health and Family Planning Commission of the People’s Republic of China, China Food and Drug Administration.national food safety standards Determination of deoxynivalenol and its acetylated derivatives in food: GB 5009.111—2016[S].
[13]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品安全国家标准 食品中玉米赤霉烯酮的测定: GB 5009.209—2016[S].National Health and Family Planning Commission of the People’s Republic of China, China Food and Drug Administration.national food safety standards Determination of zearalenone in food: GB 5009.209—2016[S].
[14]漆红兰, 李佳妮, 张成孝. 检出限与灵敏度关系及影响因素的探讨[J]. 大学化学, 2021, 36(9): 219-225.QI H L, LI J N, ZHANG C X. Discussion on the relationship and influence factors of the limit of detection and the sensitivity of analytical methods[J]. University Chemistry, 2021, 36(9):219-225.