油脂是人体所需三大营养素之一,其不仅可以为人体提供能量和必需脂肪酸,还是人体脂溶性维生素、甾醇、角鲨烯、多酚等多种功能性成分的重要供给来源[1]。2020至2021年度我国食用油消费量为 4 254.5万 t,2021年我国人均食用油消费量为 30.1 kg,显著超过世界人均食用油消费量27.0 kg的水平,日均摄入量也远远高于《中国居民膳食指南》的推荐值的上限(25~30 g/天)[2-3]。
食用油过量消费和不合理摄入导致慢性代谢类疾病风险因子升高,已经成为影响我国居民健康的重要因素之一。国务院在《“健康中国2030”规划纲要》中提出:推进健康中国建设,坚持预防为主,推行健康文明的生活方式,营造绿色安全的健康环境,减少疾病发生,降低社会医疗负担,为实现民族复兴打下健康基础。因此,保障人群营养与健康,预防慢性疾病是这一工作的重点。
油脂组学以其强有力的组学研究方法,已经成为油脂营养与人群健康相关研究的重要手段。基于油脂组学技术,研究膳食油脂因子对机体营养代谢的影响,最终实现营养素的精准靶向供给和人群慢病的定向防控,对于提升膳食油脂食用营养安全,提升全民健康水平,助力“健康中国”具有重要作用。本文对当前油脂组学在油脂营养与人体健康方面的主要研究手段和研究进展进行综述,并对未来发展方向和趋势进行了展望,以进一步阐明油脂组学概念,构建起油脂营养因子与人体健康之间的信息互作桥梁,为居民健康油脂膳食提供依据,有效防控慢性代谢类疾病。
1 油脂组学概念的提出
传统脂质组学作为代谢组学的重要分支,由HAN等[4]2003年提出,即系统、全面地研究和分析生物体、组织和细胞中脂质的组成、结构及含量等信息,推测与脂质代谢相互作用的生物分子的变化,进而阐释脂质代谢在基因调控与表达等各类生命现象中作用机制的一门学科。自概念提出以来,脂质组学一直是研究热点,并被广泛应用于疾病预防、药物研究和食品科学等不同领域。油脂组学的概念由笔者团队于2021年首次提出[5],随即引发关注和反响。油脂组学是一个包含广泛学科的新概念,其与脂质组学不同,油脂组学是基于多组学技术,研究油料生产、加工到消费使用和人类营养全链条过程中物理和化学特性、营养和安全问题的综合性学科,是食品组学的组成部分[5]。
油脂组学要求从油料脂质分子组成、油脂脂蛋白结构、油脂微量营养成分功能、油料油脂内外源成分特征,以及基于此的分子谱库和网络构建等方面,研究油料与油脂的品质特点和营养基础;实现高通量、高灵敏度、全覆盖地解析油脂组分、挥发性化合物、衍生物质等在油料油脂制备加工、油脂烹饪热加工和油脂作为食品配料加工等过程中动态变化规律。从营养组学、蛋白质组学和代谢组学等角度,阐释油脂成分及其伴随物的代谢途径和对慢性代谢疾病的调控作用,从基因组学、代谢组学和脂质组学角度,快速、高效、准确地评估油脂安全性、真伪性和可溯源性[5]。油脂组学的结构及其在油脂营养与健康方面的主要应用,如图1所示。
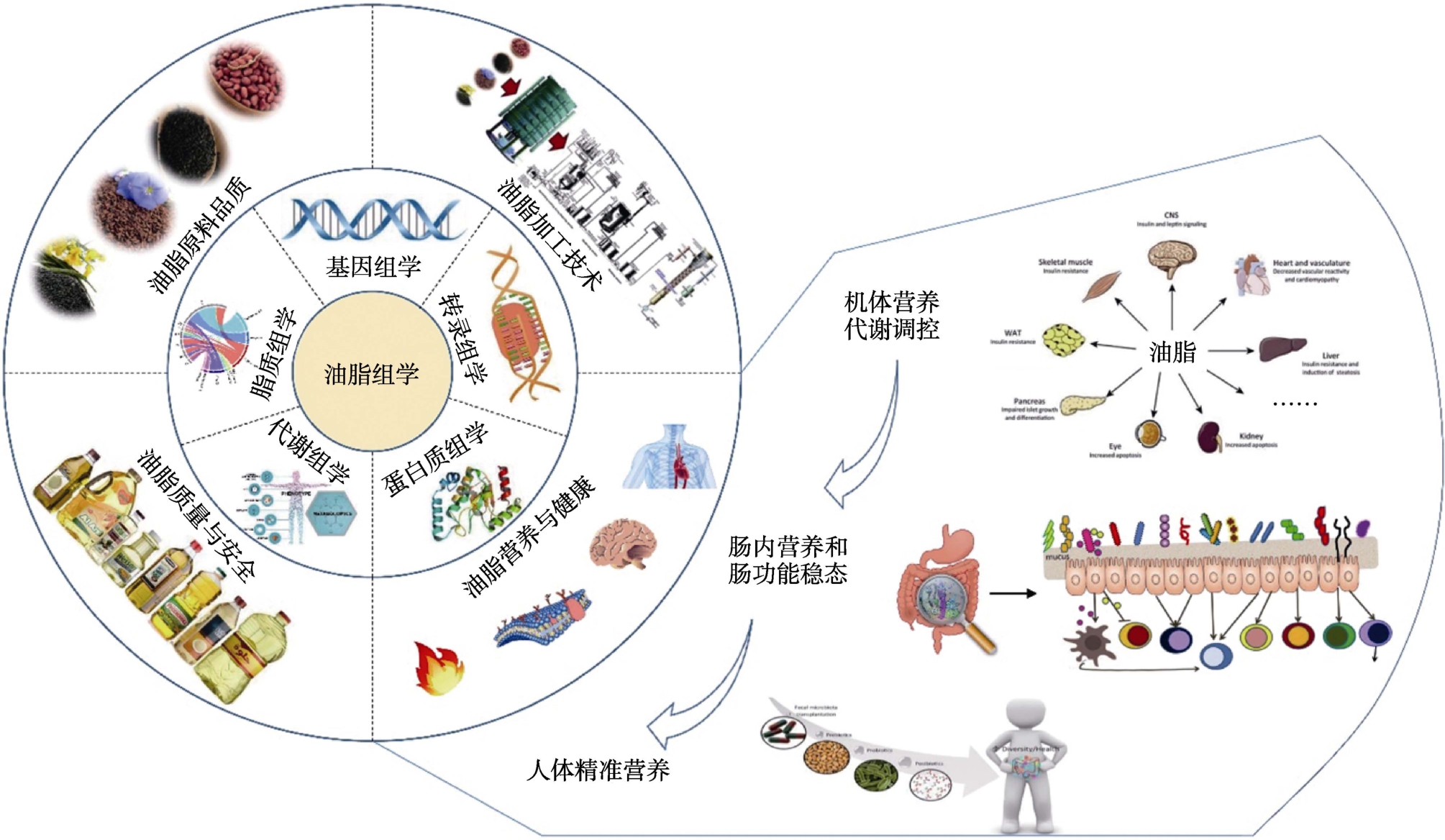
图1 油脂组学的结构及其在人体营养与健康方面的主要应用
Fig.1 The structure of oilomics and their major applications in the areas of human nutrition and health
2 油脂组学在人体营养与健康研究中的主要方法
油脂的加工方式、摄入类型、摄入量和应用场景等与机体营养和正常代谢状态密切相关[6-7]。由油脂组学的定义可知,广义的油脂组学研究方法包括基因组学、代谢组学、蛋白质组学和转录组学等组学技术,以及生物信息学技术对上述组学大数据的系统分析[5]。探讨膳食油脂与人类营养间的联系,对于明晰油脂营养特性、降低慢病风险,提升油脂加工过程中的营养安全保障水平具有极大促进作用。因此,油脂组学技术在人类营养与健康方面的研究方法,将重点包括基因组学、转录组学、蛋白质组学、代谢组学和脂质组学,以及基于上述组学技术的多组学联合技术(图1)。
基因组学包括基因结构及其功能的研究,以了解完整基因组的结构为目的,确定整个生物体的 DNA序列,是对一个生物体所有基因进行集体表征和量化,并研究它们之间的相互关系及对生物体的影响[8]。油脂摄入对机体代谢产生多重、多向性影响,整合单一因素产生的不同影响结果,一直是营养学相关研究的重要挑战,而现代基因组学技术可以通过表征生物细胞中大量的活跃的转录基因水平,从而明确油脂营养因子与生物体基因之间相互作用,可为油脂营养学研究提供便利[9]。这些年基于高通量基因组测序技术研究肠道微生物宏基因组受到广泛关注,也为揭示油脂摄入对慢性疾病的影响提供了新思路[10-11]。另一方面,通过基因组学技术对油料基因组进行分析,阐明油料作物的脂质和营养素生成和积累途径,明确环境因素导致油脂组分差异的调控机制,进而培育优良油料品种,从源头上提升油脂的营养品质,也是相关领域研究重点[12]。
转录组学是在基因组学之后兴起的组学技术,是一门从RNA水平上研究基因转录及转录调控规律的学科,是一种重要的生命科学研究手段,其以样品中的全部转录本为研究对象,从群体水平上研究功能基因的表达水平和转录调控规律[13]。转录组学中的定性和定量转录组方法主要分为基于杂交技术的基因芯片技术和基于测序分析的全基因组表达谱技术,目前,RNA-seq技术是基于测序分析方法的最新代表,已成为转录组学最受欢迎和最主要的研究手段[14-15]。应用高通量测序技术进行转录组研究,大大降低了测序所需时间和成本,使人们能够进行转录组和次生代谢相关基因的研究[16]。有研究者采用RNA-seq技术分析高、低脂营养下的北极狐肝脏组织中脂质代谢相关的差异基因表达情况,并筛选出与之相关的lncRNAs,并成功构建lncRNA-mRNA调控网络,为明晰实验动物对高脂摄入耐受的分子调控机理提供了基础[17]。
蛋白质组通常指一个细胞、一个基因组以及组织所表达的全部蛋白质[18]。蛋白质组学即为在整体水平上,研究细胞内蛋白质及其生命活动规律的学科,其主要采用蛋白质分离技术和蛋白质鉴定技术,对细胞或者组织内进行表达的所有蛋白质及其表达方式进行研究[19]。蛋白质组学技术对于解析油脂营养特性和代谢功能具有重要作用。研究者DE ROOS B等在富含饱和脂肪的食物中分别补充鱼油、共轭亚油酸和反式油酸,采用蛋白质组学技术考察其对ApoE*3-Leiden转基因小鼠(动脉粥样硬化模型小鼠)脂质代谢、糖代谢和肝脏蛋白组水平的影响,结果发现三者影响不同,肝脏蛋白有 65 种胞浆蛋白和 8种膜蛋白水平显著改变,其中较多蛋白质与脂质和糖代谢及氧化应激相关[20]。此外,还可利用蛋白质组学方法研究油料作物中脂质的形成机理,以及油脂摄入方式对于某些慢性代谢疾病的影响机制,或进行疾病标志物的鉴定和疾病筛查等[21-23]。
代谢组学是油脂组学研究中的另一种重要研究手段,它是通过分析生物体在受到刺激或扰动前后,如环境影响或基因沉默处理的代谢产物图谱和动态变化,以研究生物体系代谢网络的一种技术[24]。代谢组学技术的研究对象主要是相对分子质量小于 1 000的小分子代谢产物,如糖、有机酸、氨基酸、脂类等,通过对代谢产物进行同步检测和定性分析,可直接、准确地解析生物体在内外环境作用下代谢应答的变化情况[25-26]。代谢组学分为靶向代谢组学或非靶向代谢组学,前者重点是鉴定和定量特定的预期代谢产物,其通常需要更高水平的纯化,对代谢物的选择性提取;后者则侧重于检测尽可能多的代谢物种类,而不必鉴定或定量特定化合物[27]。代谢组学在油脂营养研究方面被广泛应用,例如,有研究采用代谢组学技术分析高脂膳食(HFD)下结直肠癌(CRC)的发生风险,结果发现HFD通过诱导肠道代谢物变化,如造成对机体有害的溶血磷脂酸(LPA)水平升高,促进CRC细胞增殖并损害细胞紧密连接性,而降低有益代谢物去甲二氢愈创木酸(NDGA)和神经酸的水平,引起肠道菌群失调和代谢紊乱,进而促进CRC的发生[28]。目前,在食品脂质营养研究方面常用的代谢组学分析手段有核磁共振(NMR)、气相色谱-质谱联用(GC-MS)、液相色谱-质谱联用(LC-MS)和毛细管电泳质谱(CE-MS)等技术[29]。
脂质组学是代谢组学的分支,其研究手段与代谢组学相同,它也是油脂组学在营养学研究方面的一种重要方法。脂质组学是系统、全面地分析研究生物体组织和细胞中的脂质功能,推测与脂质相互作用的生物分子的变化,进而揭示脂质代谢在蛋白质表达和基因调控等各类生命过程中作用机制的一门学科[30-31]。膳食油脂是人体生物脂质的重要来源,脂质参与生物体大量的生命活动,脂质组学技术对于人们了解油脂生物学功能以及不同膳食油脂摄入形式对机体影响,了解代谢分子调控网络,实现相关慢性代谢类疾病,如心脑血管疾病、糖尿病、肥胖等的预防具有重要意义[32]。之前研究者采用脂质组学技术,对比分析了健康个体和Ⅱ型糖尿病患者(T2MD)患者血浆中磷脂及其代谢物情况,结果表明,C16:0/C22: 6和C18: 0/C20: 4两种形式溶血磷脂酰胆碱(lyso-PC)和C16: 0与C18:0两种形式磷脂酰乙醇胺(PE)具有作为T2MD的潜在生物标志物的潜力[31,33]。
3 油脂组学在人体营养研究中的应用进展
油脂组学以其各种强有力的组学技术手段,在油脂营养与人体健康领域得到广泛应用,这些应用不仅集中于探明不同油脂类型中脂肪酸组成,如饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)、必需脂肪酸,以及各类非主要脂肪酸,如反式脂肪酸(TFA)、支链脂肪酸(BCFA)等对于机体营养代谢的影响,而且还应用于深入解析脂溶性维生素、磷脂、甾醇等油脂伴随物的营养价值及其对慢性代谢类疾病的调控作用。整合基因组学、蛋白质组学、转录组学、代谢组学、脂质组学和现代化生物信息学技术,用于油脂营养与代谢研究,有助于全面而系统地阐明油脂组分与机体营养之间的潜在联系,对于人群慢病调控、肠内营养支持和食品脂质精准营养策略构建等方面具有重要意义。油脂组学在油脂营养研究方面的典型应用总结见表1。
表1 油脂组学在油脂营养研究方面的典型应用
Table 1 Practical applications of oilomics in the studies related with nutrition of oils and fats

油脂类型 研究模型 主要结论 结合技术 文献 年份花生油 雄性SD大鼠 1)热榨和水酶法花生油改善高脂诱导大鼠血清和肝脏代谢紊乱;2)冷榨花生油组大鼠肝脏部分氨基酸、脂肪酸、磷脂和碳水化合物水平下降;3)水酶法花生油组肝脏中棕榈酸、尿酸和嘧啶水平升高;4)花生油微量成分与特定代谢物之间呈现强相关性。代谢组学 Fan Jiang,et al. [34]2020等热量低、中和高脂膳食(主要大豆油)高脂膳食(棕榈油)健康男性和女性成年人雌性和雄性C57BL/6J小鼠1)低脂膳食与肠道菌群的 α多样性相关,并增加 Blautia和Faecalibacterium菌丰度;高脂膳食与Alistipes菌和Bacteroides丰度增加,及Faecalibacterium菌丰度降低相关;2)高脂组SCFA水平,以及与代谢紊乱相关的甲苯酚和吲哚水平降低;3)高脂膳食与粪便ARA和LPS合成通路富集,以及血浆促炎因子升高有关;4)高脂膳食与健康人群肠道菌群、粪便代谢组和血清促炎因子不利改变有关,长期影响健康。1)高脂膳食造成心脏代谢组差异,增加几种酰基肉碱水平;2)代谢组差异与小鼠适应性使用脂肪酸作为氧化底物,以及与过氧化氢酶水平增加一致;3)雄性和雌性小鼠代谢组也表现出显著差异。代谢组学、转录组学Wan Yi,et al. [35]转录组学、代谢组学Leroy C.Joseph,et al. [36]2019 2022初榨橄榄油 Caco-2细胞 1)初榨橄榄油烹饪前后均对细胞脂质组分布产生显著影响;2)细胞差异标志物主要是与氧化应激相关的化合物,如氧化谷胱甘肽、二酮古洛糖酸、神经酰胺和TAG。脂质组学 Juli´an Lozano-Castell´on,et al. [37]2022鱼油、猪油、红花籽油DHA/EPA型 PC脂质体/乳液磷虾油、鱼油鱼油、猪油(等热量)雄性C57BL/6小鼠雄性 Balb/c小鼠健康女性成年人雄性C57BL/6J小鼠1)高ω3-PUFA摄入抑制p-mTOR和raptor的表达水平;2)ω3-PUFA摄入促进线粒体电子传递链和三羧酸循环途径;3)高ω3/ω6 PUFA比值组肝脏线粒体复合物活性升高,富马酸水平降低,氧化应激程度减轻;4)等热量,但ω3/ω6-PUFA比值高的高脂肪饮食长期摄入,通过调节mTORC1途径增强线粒体功能,缓解代谢综合征。1)脂质体组血清 DHA/EPA峰值水平高于乳液组;2)脂质体灌胃后,血清总磷脂和 DHA型磷脂在较长时间维持在高水平;3)DHA/EPA型PC在小肠中可能被PLA2水解速率更快。1)血浆中34个脂质组或亚组中有5种在磷虾油组浓度高于鱼油组;2)在鉴定出的701种脂质分子中,有27种,其中含5种醚磷脂,其在补充后存在显著差异;3)磷虾油摄入后,其中的DHA和EPA优先分配给磷脂分子;鱼油的DHA和EPA优先分配给中性脂质。1)猪油组小鼠的肠道菌群增加了肝脏胆固醇和CE水平,而鱼油组没有;2)血清胆固醇和 CE水平不受肠道菌群影响;3)猪油组小鼠肝脏编码胆固醇合成相关酶的基因被肠道菌群下调,鱼油组中表达水平较低,且与菌群无关。代谢组学 Run Liu,et al. [38]脂质组学 Shan Jiang,et al. [39]脂质组学 Hyunsin H. Sung,et al. [40]脂质组学 Robert Caesar,et al. [41]2020 2020 2019 2016
续表1

油脂类型 研究模型 主要结论 结合技术 文献 年份磷虾油 THP1细胞、约克夏白猪1)磷虾油通过诸如 NF-κB和 NOD样等信号通路,显著降低 LPS诱导的细胞IL-1β和TNF-α水平升高,且与COX2和IKK2抑制剂协同作用降低炎症;2)磷虾油缓解由感染型肠粘膜损伤和菌群紊乱;3)磷虾油通过抑制结肠粘膜中编码 L-组氨酸脱羧酶基因的表达水平,减少微生物源的组胺生物合成,进而降低与组胺代谢相关若干关键代谢物水平。转录组学、代谢组学、生物信息学Fang Liu,et al. [42]2020
3.1 油脂组学与机体营养代谢调控
膳食油脂来源广泛,主要分为动物、植物和微生物油脂三大类。虽然天然油脂均以不饱和脂肪酸为主,但是不同来源的油脂其组成存在差异,一般而言,植物油中的不饱和脂肪酸含量,尤其是PUFA含量比动物油高;热带植物油中SFA含量较非热带植物油高;并且动物油中还含有一定量胆固醇,不同油脂中的脂溶性活性成分含量也存在差异[43]。因此,不同类型、不同加工方式油脂的营养性质及对人体健康的影响不同,而采用油脂组学手段,探究它们在机体营养代谢调控方面作用,探索与慢性代谢疾病之间联系,一直是国内外的研究热点。
有研究采用代谢组学和微生物基因组学技术,对比了高油酸花生油和特级初榨橄榄油对膳食诱导的代谢综合征的缓解作用效果,结果鉴定出高油酸花生油组大鼠粪便和血清中各有8个和15个差异潜在生物标志;初榨橄榄油组各有 12个和6个差异潜在生物标志物。还发现补充两种油脂主要改变粪便和血清中氨基酸、肽类及其衍生物水平,支链氨基酸(BCAA)生物合成通路是这一调节作用的主要途径,这说明补充高油酸油脂可能具有通过BCAA生物合成途径来改善膳食诱导的代谢综合征[44]的作用。RUOCCO C等采用代谢组学技术分析了SFA膳食和等热量初榨橄榄油膳食对小鼠心血疾病患病风险的影响,对血浆和尿液中相关代谢标志物进行检测后,结果表明采用初榨橄榄油替代 SFA膳食表现出保护心血管和肝脏的作用[45]。然而,通过文献检索可知,采用油脂组学技术探讨橄榄油营养特性相关研究较多,而探讨其他油脂类型,如大豆油、花生油、菜籽油等国内大宗油脂摄入对人体营养健康的影响研究则相对较少,因此,随着组学技术的进步和研究的不断深入,后续相关研究有待进一步加强。
油脂中脂肪酸组成具有链长和饱和度的差异,脂肪酸分子在TAG中还存在位置异构,不同类型脂肪酸的性质具有差异,油脂的摄入方式不同,其对机体的营养代谢影响不同。高脂膳食(HFD)被普遍认为是不健康的膳食方式,其易诱发诸多慢性代谢类疾病,如肥胖、非酒精性脂肪肝(NAFLD)等[46-47]。研究者采用靶向代谢组学技术,对HFD诱导的NFALD大鼠血清中脂肪酸组成进行分析,其可定量血清中36种脂肪酸衍生物,且发现在NAFLD病理条件下,总脂肪酸、SFA、不饱和脂肪酸(UFA),如 ω6脂肪酸、脂肪生成指数、脂肪酸链延长酶指数和硬脂酰辅酶A去饱和酶1(SCD1)指数2均增加,而ω3脂肪酸、ω3/ω6脂肪酸比值和 SCD1指数1水平则降低,而潜在脂肪酸生物标志物(C16:0,C18:0,C18:1和C20:4)和血清指标(脂肪生成指数、链延长酶指数、SFA、UFA和ω6脂肪酸)与LDL-C、TC、TG、ALT和AST呈显著正相关[48]。还有研究结合代谢组学和转录组学探讨了 HFD对心血管病患病风险的影响,结果发现HFD不仅显著增加脂质积累,还导致代谢组显著变化,增加酰基肉碱的种类,进而可能引发线粒体功能障碍,转录组分析结果还表明上述变化与脂肪酸利用水平适应性增加和抗氧化蛋白催化酶水平增加一致[36]。
近年来间歇禁食被证明可有效降低代谢类疾病风险,有研究采用转录组学结合生化分析方法,对此进行研究,结果发现模拟禁食膳食方式可预防高脂依赖性高血糖、高胆固醇血症和高瘦素血症,改善葡萄糖和胰岛素耐受性;并且还影响脂肪细胞线粒体代谢和合成相关基因表达,促进小鼠体内酮体持续生成,进而降低其高脂膳食依赖性早死亡[49]。ω3和ω6脂肪酸是膳食油脂中典型的PUFA,也是人体必需脂肪酸,通过调节ω3/ω6脂肪酸比例,可以达到改善由HFD导致的慢性代谢综合征的目的,有研究采用定量代谢组学结合常规生化分析手段,对这其中的潜在机制进行了解析,结果发现高ω3-PUFA不仅抑制了p-mTOR和Raptor蛋白的表达,还促进了线粒体电子传递链和三羧酸循环途径,降低氧化应激水平,这表明高ω3/ω6脂肪酸比例可能通过调节mTORC1通路,增强线粒体功能,进而缓解代谢综合征[38]。鉴于ω3和ω6脂肪酸在生物体中发挥重要作用,许多相关研究采用脂质组学方法,探索ω3和ω6脂质介质,如前列腺素、白三烯、血栓素等,作为营养学研究中慢性炎症的生物标志物[50]。这些相关研究可为基于油脂组学技术,进而探索代谢疾病调控策略提供参考。
此外,由于不同油脂组成不同,油料预处理方式、油脂加工工艺和油脂的应用场景也均可能影响油脂组成,进而影响营养品质及其在人体营养代谢方面的调控作用。例如,研究者通过脂质组学探究发现,烘烤处理显著影响花生油脂质组成,特别是脂肪酸、磷脂和氧化脂肪酸含量,在烘烤过程中,磷脂的热降解、脂肪酸的氧化,以及氧化脂肪酸的分解是热烘烤过程中脂质组成变化的主要形式[51]。也有不少研究采用油脂组学手段对油料加工方式、油脂烹调应用场景对油脂品质的影响进行了分析[52-54]。笔者所在课题组采用代谢组学技术,考察了油脂的制取工艺对其营养品质的影响,结果表明,热榨和水酶法制取花生油,可加剧由HFD引起的血清和肝脏代谢紊乱,而冷榨花生油则表现出缓解作用,这种调控效果主要表现在下调部分氨基酸、脂肪酸、磷脂和碳水化合物等代谢物水平方面;此外还发现,大鼠脂质代谢水平的改善与花生油中微量活性成分表现出极强相关性[34]。本课题组通过代谢组学技术还发现,棕榈油在煎炸应用过程中产生的极性化合物可通过增加磷脂、脂肪酸和胆固醇水平,降低胆碱、甜菜碱和L-乙酰基肉碱而影响动物体脂代谢水平;其损伤三羧酸循环(TCA循环)和碳水化合物、氨基酸和嘌呤代谢通路,引起某些特定代谢物改变,造成机体氧化还原指数异常,增加代谢疾病风险[55]。
因此,油脂组学在明晰不同油脂功能品质、脂肪酸分子营养特征,以及油脂加工与应用方式对机体营养代谢调控作用等方面发挥重要应用,后续可通过油脂组学技术进一步深入探究不同油脂分子营养功能,及其在代谢通路中的调控作用机制,进而为构建油脂绿色制造体系和油脂相关慢病预防提供依据。
3.2 油脂组学与肠内营养和肠稳态
膳食油脂是通过在胃肠道中消化吸收后,进入人体各器官发挥营养和代谢调控功能。油脂种类不同和油脂组成的多样性将造成其胃肠道消化吸收过程的差异,也可能进一步导致其营养功能的不同,及对机体代谢影响的差异[6,56]。油脂的摄入量、种类和形式等与多种肠道疾病和代谢疾病,如糖尿病、肥胖等慢性疾病存在联系,膳食油脂不平衡摄入会影响肠道菌群组成和代谢活力、破坏肠稳态功能,这与上述慢性疾病的发生密切相关[1],例如,诸多研究已经证实,肠道粘膜屏障完整性的破坏和肠粘膜炎症,将导致代谢性内毒素,如脂多糖(LPS)向外周组织释放,引起全身性慢性炎症,而机体长期低水平炎症是肥胖、T2DM、心血管疾病等慢性代谢疾病风险增加的关键因素[57-58]。因此,采用油脂组学技术分析油脂摄入后消化吸收差异性,及其对肠道粘膜屏障功能的影响,进而从肠内营养和肠道稳态的角度,明确其营养功能特性及其在代谢类疾病调控方面的作用,也是当前重点研究方向。
油脂组学技术可用于分析不同脂质消化吸收后的产物的分布情况,明晰其营养差异性。有研究者通过脂质组学技术,对比分析了 DHA/EPA-磷脂酰胆碱(PC)型脂质体和乳液消化吸收特性,结果表明,小鼠在饲喂DHA/EPA-PC脂质体后,血清中总磷脂(PL)和PL-DHA可以在长时间保持较高水平,这可能是因为脂质体形式的 DHA/EPA-PC在小肠内中被PLA2消化得更缓慢[39]。乳脂是自然界中最复杂的脂质之一,但通过脂质组技术可对消化产物,包括 TAG、DAG、MAG和FFA的含量进行定性定量,研究者对牛乳和羊乳脂消化产物进行分析后,共鉴定出105种TAG、64种DAG、14种MAG和30种FFA,并且还确定了各自的浓度范围,方法验证可靠[59],这为后续进一步分析乳脂的营养功能特性奠定了基础。SUNG H H等采用脂质组学技术,对摄入补充有磷虾油和鱼油的人群餐后血清进行了表征,探讨对两种不同油脂的吸收差异性,结果发现,在34种脂质中有5种在磷虾油组高于鱼油组;在总共的701种脂质分子中有27种,包括5种醚磷脂在餐后存在显著差异,此外,补充磷虾油后,DHA和EPA更倾向于形成磷脂分子;而补充鱼油后,它们更倾向于形成中性脂质[40],这说明人体对不同类型的油脂吸收功能存在显著不同。
油脂组学在基于研究肠粘膜屏障和肠内稳态功能,进而明确不同油脂分子营养代谢特征,阐明代谢相关疾病调控通路和分子机制等方面同样被广泛应用,并占据着重要地位。研究者通过非靶向代谢组学结合基于特征分子的质谱网络分析技术,探究小鼠肠道菌群中脂质依赖性菌群类型,结果发现,粪便中约有 24.8%脂质分子具有菌群依赖性,是抗生素处理小鼠中的10倍以上,这其中有一些特殊的菌群相关脂质,如酰基α-羟基脂肪酸。对985种脂质和16s rRNA测序结果进行综合分析,可以预测调控这些特殊脂质生物合成对应的肠道菌群类别,这为明晰脂质代谢和肠道菌群组成和宿主表型之间联系提供参考[60]。肠道菌群作为重要的肠道屏障之一,不同营养素摄入对其结构影响不同,对血脂组成的影响也不同,代谢组学和转录组学研究也发现,过量大豆油和猪油摄入导致小鼠严重胰岛素抵抗,并影响血浆血脂谱组成,增加肝脏和脂肪组织中TLR4表达水平,表明代谢性内毒素可促进机体炎症和胰岛素抵抗[61]。
不良膳食习惯或环境因素可通过破坏肠粘膜屏障功能造成肠内稳态失衡,进而导致慢性代谢类疾病风险增加,这其中的调控机制错综复杂,通过油脂组学技术,明确“环境(膳食)因子—肠内功能—慢性疾病”之间的互作关系,筛查慢病早期标志物,对于相关慢病预防具有重要意义,当前有不少研究也集中于此。磷虾油富含 ω3型PUFA,有研究者采用多组学方法,对其调节肠道微生物和代谢组的机制进行了研究,结果发现,磷虾油可通过NF-κB和NOD-样受体通路,显著降低LPS诱导巨噬细胞炎症因子分泌,这一过程与COX2和IKK2抑制剂具有协同作用;补充磷虾油可有效恢复由鞭毛虫诱导的肠粘膜损伤和肠道菌群紊乱,降低 Rickettsiales菌和若干Lactobacillus菌的丰度,此外,基于靶向代谢组学技术,明确了磷虾油对组氨酸代谢的抑制作用,即其通过抑制结肠粘膜中编码L-组氨酸脱羧酶的基因表达,以及降低组氨酸微生物合成,进而降低与组氨酸代谢相关关键代谢物水平,这有助于抗炎作用的发挥[42],其也为通过膳食(油脂)干预,调控肠道微生态环境和机体分子代谢,进而实现慢病预防提供了理论思路。还有研究通过油脂组学手段,分析了肠道菌群与膳食油脂互作,调节肝脏和血浆脂质组成的效果,结果表明,猪油和鱼油组小鼠肝脏脂质组表现出差异,肠道菌群也影响肝脏脂质组成;猪油组小鼠肠道菌群可增加肝脏中胆固醇和胆固醇酯的水平,而血清胆固醇和胆固醇酯的水平不受肠道菌群影响,猪油组小鼠肝脏中编码胆固醇生物合成相关酶的基因被肠道微生物群下调,然而,其在鱼油组小鼠肝脏中表达水平较低,且与肠道菌群无关[41],这表明肠道菌群诱导的肝脏胆固醇代谢调控受到膳食脂质组成的影响。
3.3 油脂组学与人体精准营养
食品精准营养也称食品个性化营养,是相对于公共营养而言,其是指依据饮食中的特定成分,对不同人群或不同情况个体,量身定制不同的饮食方案,进而达到精准营养补给和代谢疾病调控的目的,其中肠道菌群是食品精准营养的关键特征之一,目前的研究相对较多[62-64]。西方研究者很早就开始研究食品精准营养,并对其应用原则、政策管理和未来发展趋势进行了探讨[65-66];2020年末在上海召开的“2020中国精准营养峰会”上,相关专家首次在国内提出了精准营养研究及转化原则,并将其上升至新的高度[67]。油脂组学对于明晰油脂营养功能和其摄入对机体营养代谢的影响,明确代谢调控靶点,进而构建膳食因子与精准营养之间的桥梁,实现膳食因素营养的定量化、精准化起到至关重要的作用。
NAFLD是由肝脏中TG异常积累引起的最典型的膳食诱导型慢性代谢类疾病,也被称为肝脏单纯脂肪变性。Jung等[68]采用油脂组学技术,对非肥胖型和肥胖型 NAFLD人群血清中脂质特征进行研究,结果发现其表现出特异性脂质组成,特别是饱和鞘磷脂(SM)的种类不同,其水平与机体整体和脂肪组织胰岛素抵抗相关;在两类人群血清中各筛出了7个和5个潜质脂质代谢标志物,包括DAG、TAG和SM,这些标志物组合表现出对非肥胖型和肥胖型 NAFLD具有良好的诊断能力,这为代谢慢病精准诊断和后续精准营养调控提供了参考。膳食油脂摄入不平衡还可能导致其他慢性疾病问题,可以借助油脂组学手段探明影响机理和分子通路,例如,GUTTENPLAN K A 等[69]通过特异性地敲除小鼠星形胶质细胞中的饱和脂质合成酶(延伸因子极长链脂肪酸样蛋白1,ELOVL1)基因,避免长链饱和脂质的形成,发现其可以减轻星形胶质细胞介导的神经毒性,而参与此过程介导作用的是APOE和APOJ颗粒中的脂质分子而非蛋白质。该研究结果不仅揭示了星形胶质细胞在中枢神经(CNS)损伤和神经退行性疾病中的重要作用,还确定了脂质在CNS信号转导过程中的特定功能。不仅如此,在冠心病患者糖脂代谢调控相关研究中,COHAIN A T等[70]结合基因表达、代谢组和临床数据,构建了高度保守的葡萄糖脂质代谢调控网络,通过该网络发现了脂质和葡萄糖代谢之间的逆向调节关系,其还可用于揭示糖脂代谢调节基因之间的相互作用,此作用是确定血浆脂质和血糖代谢双重调控的基础,通过在小鼠体内对该调控网络主要调节因子羊角甾醇合酶(LSS)进行验证,确定了模型所预测的葡萄糖和脂质水平的逆向调节关系,为冠心病人群基于糖脂代谢调控,实施营养干预提供了机制方面的基础。
不仅如此,在明确膳食因子或活性营养素的精准营养功能方面,油脂组学同样具有广阔的应用潜力。PASTOR Ó等[71]采用脂质组学技术,评估了补充 ω3脂肪酸对人体健康的作用,研究发现囊性纤维化患者在补充ω3脂肪酸十二月后,ω3脂肪酸在血浆中的不同脂质中分布不同,高不饱和胆固醇酯(CE)和磷脂酰胆碱(PC)中 DHA含量更高;而其在磷脂酰乙醇胺(PE)和 TAG中分布较低,研究者还开发了一种高效表征DHA/花生四烯酸(ARA)比率的方法,其可用于简化富含DHA膳食干预的营养效果评价。FENG K等[72]的研究也发现,膳食补充 0.04%和 0.08%的橘皮素不仅可以显著降低高脂膳食诱导的小鼠体重增加量、血清TC和LDL水平,而且还改善了肝脏脂肪变性。通过对肝脏脂质组学分析表明,这些有益的效果与其降低肝脏脂肪酸、DAG、TAG、神经酰胺和 CE水平有关,进一步分析还发现,这是因为橘皮素的摄入下调了脂质生成相关基因,而上调了脂质氧化和胆汁酸合成相关基因的表达水平,此外,在这一过程中有21种脂质,包括DAG和PE,可以作为潜在脂质生物标志物,这为橘皮素作为活性膳食因子为高脂诱导的代谢慢病精准调控提供了理论依据。
由这些前人研究总结可知,油脂组学技术在明晰膳食诱导慢性疾病特征,寻找精准调控靶点和缓解策略,进而研究针对人群特征,调节膳食模式和膳食结构,实现慢性疾病精准预防方面具有独特优势。
4 总结与展望
油脂组学以其基因组学、转录组学、蛋白质组学、代谢组学和脂质组学等强有力的组学技术手段,在油脂营养与健康方面发挥着重要作用,其被广泛应用于阐明机体营养代谢调控靶点和分子通路,明确膳食因子对肠内营养和肠道内稳态的影响,以及实现食品精准营养和膳食诱导的慢性疾病预防等。
针对当前油脂组学在人体营养健康方面的研究现状,未来研究一方面需要继续在高灵敏度、高分辨率和高通量组学分析技术的开发方面做深入工作,并且基于多组学联合,进一步完善组学数据库和开发组学数据高效分析和处理方案;另一方面,应该开展大规模人群队列研究,借助油脂组学技术,结合互联网大数据、云计算、人工智能和机器学习等现代化数字化技术手段,建立基于人群性别、年龄、地域和环境等特征的机体营养需求数据库,以及基于食品各类营养素的营养和功能特征的全营养谱,进而构建食物营养“供给”和机体营养“需求”定向的、量化的精准调控网络。最后,基于精准营养理论,实现食品原料的品质控制,以及食品的智能设计与智能制造,从食品原料保障、食品健康制造和营养素精准供给等方面,促进人群慢病调控和防控,全面提升人群营养水平,助力实现健康中国。
[1]黄艳芳, 阮海健, 李少华. 油脂营养特性及其对肠道健康影响的研究进展[J/OL]. 中国油脂, 2022, https://kns.cnki.net/kcms/detail/61.1099.TS.20220117.1619.018.html(网络首发).HUANG Y F, RUAN J H, LI S H. Progress in nutritional characteristics of oil and fat and its influence on intestinal health[J/OL]. China Oils and Fats, 2022, https://kns.cnki.net/kcms/detail/61.1099.TS.20220117.1619.018.html (In press).
[2]中国营养学会. 中国居民膳食指南科学研究报告(2021)[R].北京: 中国营养学会, 2021.Chinese Nutrition Society. Scientific Research Report of Dietary guidelines for Chinese Residents (2021)[R]. Beijing: Chinese Nutrition Society, 2021.
[3]王瑞元. 关于2021年我国粮油产销和进出口情况简介[R]. 北京: 中国粮油学会, 2022.WANG R Y. Brief introduction to China’s grain and oil production, marketing, import and export in 2021[R]. Beijing:Chinese Cereals and Oils Association, 2022.
[4]HAN X. Lipidomics for studying metabolism[J]. Nature Reviews Endocrinology, 2016, 12(11): 668-679.
[5]杜润峰, 徐勇将, 刘元法. 油脂组学的发展及其应用[J]. 食品科学, 2021, 42(23): 349-354.DU R F, XU Y J, LIU Y F. Development and application of oilomics[J]. Food Science, 2021, 42(23): 349-354.
[6]叶展. 典型膳食油脂胃肠道消化吸收特性及其对肠道健康的影响研究[D]. 江南大学, 2020.YE Z. Studies on characteristics of typical dietary oil gastrointestinal digestion and absorption, and their influences on gut health[D]. Jiangnan University, 2020.
[7]JU J J, ZHENG Z J, XU Y J, et al. Influence of total polar compounds on lipid metabolism, oxidative stress and cytotoxicity in HepG2 cells[J]. Lipids in Health and Disease,2019, 18(1): 37.
[8]LUCA. D G, CRISTINA C. Molecular profiling: methods and protocols[M]//Chapter 6: Introduction to Genomics. Humana Press, 2012: 79-88.
[9]ROBERTS M A, MUTCH D M, GERMAN J B. Genomics: food and nutrition[J]. Current Opinion in Biotechnology, 2001, 12(5):516-522.
[10]仲召鹏, 胡小松, 郑浩, 等. 膳食脂肪、肠道微生物与宿主健康的研究进展[J]. 生物工程学报, 2021, 37(11): 3836-3852.ZHONG Z P, HU X S, ZHENG H, et al. Crosstalk among dietary lipids, gut microbiome, and host metabolic health[J]. Chinese Journal of Biotechnology, 2021, 37(11): 3836-3852.
[11]叶雷, 闫亚丽, 陈庆森, 等. 高通量测序技术在肠道微生物宏基因组学研究中的应用[J]. 中国食品学报, 2016, 16(7):216-223.YE L, YAN Y P, CHEN Q S, et al. Application of highthroughput sequencing technology in studying matagenomics of intestinal microbiota[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(7): 216-223.
[12]沈玥. 油料作物酰基脂类代谢基因和转录因子及油体钙蛋白的基因组学分析[D]. 西北农林科技大学, 2016.SHEN Y. Genome-wide investigation of acyl-lipid metabolism and caleosins in oil crops[D]. Northwest A&F University, 2016.
[13]步雨珊, 杨慧, 易华西, 等. 转录组学在乳酸菌研究中的应用[J]. 食品安全质量检测学报, 2019, 10(13): 4370-4375.BU Y S, YANG H, YI H X, et al. Application of transcriptomics in the research of lactic acid bacteria[J]. Journal of Food Safety and Quality, 2019, 10(13): 4370-4375.
[14]王雨, 焦珊瑶, 刘亚, 等. 食品组学研究进展[J]. 食品与发酵工业, 2018, 44(5): 277-283.WANG Y, JIAO S Y, LIU Y, et al. Advance in foodomics research[J]. Food and Fermentation Industries, 2018, 44(5):277-283.
[15]PASQUALE F. The future of analytical chemistry in foodomics[J]. Current Opinion in Food Science, 2018, 22:102-108.
[16]王龑, 许文涛, 赵维薇, 等. 组学技术及其在食品科学中应用的研究进展[J]. 生物技术通报, 2011, 11: 26-32.WANG Y, XU W T, ZHAO W Y, et al. Advances in omics technology and application in food science research[J].Biotechnology Bulletin, 2011, 11: 26-32.
[17]赵子雅. 高、低脂营养条件下北极狐肝脏的转录组学分析[D].河北科技师范学院, 2021.ZHAO Z Y. Transcriptome analysis of the liver of arctic fox under high and low fat nutrition conditions[D]. Hebei Normal University Of Science & Technology, 2021.
[18]孙丽翠, 王琴, 刘轶群, 等. 蛋白质组学技术在营养学研究中的应用[J]. 卫生研究, 2013, 42(6): 1036-1040.SUN L C, WANG Q, LIU Y Q, et al. Application of proteomics in nutrition research[J]. Journal of Hygiene Research, 2013,42(6): 1036-1040.
[19]蒋与刚, 王红霞. 营养蛋白质组学: 机遇与挑战[J]. 营养学报, 2008, 30(6): 537-541.JIANG Y G, WANG H X. Nutritional proteomics: opportunities and challenges[J]. Acta Nutrimenta Sinica, 2008, 30(6): 537-541.
[20]DE ROOS B, DUIVENVOORDEN I, RUCKLIDGE G, et al.Response of apolipoprotein E*3-Leiden transgenic mice to dietary fatty acids: combining liver proteomics with physiological data[J]. FASEB Journal, 2005, 19(7): 813-815.
[21]时小东, 肖含磊, 秦小波. 基于组学数据的藜麦油脂储存蛋白的生物信息学分析[J]. 江西农业学报, 2020, 32(12): 65-69.SHI X D, XIAO H L, QIN X B. Bioinformatics analysis of storage oil protein in quinoa based on omics data[J]. Acta Agriculturae Jiangxi, 2020, 32(12): 65-69.
[22]李伟, 唐认桥, 吴建新. 蛋白质组学在肥胖症研究中的应用[J]. 现代生物医学进展, 2016, 16(19): 3771-3775.LI W, TANG R Q, WU J X. Proteomic application in the research of obesity[J]. Progress in Modern Biomedicine, 2016,16(19): 3771-3775.
[23]马丽丽, 王先敏. 代谢性疾病的蛋白质组学研究进展[J]. 医学综述, 2018, 24(7): 1299-1302.MA L L, WANG X M. Research advances in proteomics of metabolic diseases[J]. Medical Recapitulate, 2018, 24(7):1299-1302.
[24]FIEHN O. Metabolomics: the link between genotypes and phenotypes[J]. Plant Molecular Biology, 2002, 48(1-2): 155-171.
[25]吴瑞, 张立实, 陈锦瑶, 等. 代谢组学技术在营养学的应用[J]. 营养学报, 2021, 43(6): 609-614.WU R, ZAHNG L S, CHEN J Y, et al. Application of metabolomics in nutrition[J]. Acta Nutrimenta Sinica, 2021,43(6): 609-614.
[26]FIEHN O, KOPKA J, DORMANN P, et al. Metabolite profiling for plant functional genomics[J]. Nature Biotechnology, 2000,18(11): 1157-1161.
[27]孙祥瑞, 张淼, 孔令强, 等. 代谢组学在食品科学与工程领域的研究进展[J]. 中国食品添加剂, 2021, 32(9): 175-181.SUN X R, ZHANG M, KONG L Q, et al. Research progress of metabolomics in food science and engineering[J]. China Food Additives, 2021, 32(9): 175-181.
[28]YANG J, WEI H, ZHOU Y, et al. High-fat diet promotes colorectal tumorigenesis through modulating gut microbiota and metabolites[J]. Gastroenterology, 2022, 162(1): 135-149.
[29]CAJKA T, FIEHN O. Toward merging untargeted and targeted methods in mass spectrometry-based metabolomics and lipidomics[J]. Analytical chemistry, 2016, 88(1): 524-545.
[30]HAN X, GROSS R W. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J]. Journal of Lipid Research, 2003, 44(6): 1071-1079.
[31]崔益玮, 王利敏, 戴志远, 等. 脂质组学在食品科学领域的研究现状与展望[J]. 中国食品学报, 2019, 19(1): 262-270.ZENG Y W, WANG L M, DAI Z Y, et al. Recent advances and prospect of lipidomics in food science[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(1): 262-270.
[32]蔡潭溪, 刘平生, 杨福全, 等. 脂质组学研究进展[J]. 生物化学与生物物理进展, 2010, 37(2): 121-128.CAI T X, LIU P S, YANG F Q, et al. The research advances in the field of lipidomics[J]. Progress in Biochemistry and Biophysics, 2010, 37(2): 121-128.
[33]WANG C, KONG H, GUAN Y, et al. Plasma phospholipid metabolic profiling and biomarkers of type 2 diabetes mellitus based on high-performance liquid chromatography/electrospray mass spectrometry and multivariate statistical analysis[J].Analytical Chemistry, 2005, 77(13): 4108-4116.
[34]JIANG F, YUAN L, SHU N, et al. Foodomics revealed the effects of extract methods on the composition and nutrition of peanut oil[J]. Journal of Agricultural and Food Chemistry, 2020,68(4): 1147-1156.
[35]WAN Y, WANG F, YUAN J, et al. Effects of dietary fat on gut microbiota and faecal metabolites, and their relationship with cardiometabolic risk factors: a 6-month randomised controlled-feeding trial[J]. Gut, 2019, 68(8): 1417-1429.
[36]JOSEPH L C, SHI J, NGUYEN Q, et al. Combined metabolomic and transcriptomic profiling approaches reveal the cardiac response to high-fat diet[J]. iScience, 2022 (In press).
[37]LOZANO-CASTELLÓN J, ROCCHETTI G, VALLVERDÚQUERALT A, et al. New insights into the lipidomic response of CaCo-2 cells to differently cooked and in vitro digested extra-virgin olive oils[J]. Food Research International, 2022,155: 111030.
[38]LIU R, CHEN L, WANG Y, et al. High ratio of omega-3/omega-6 polyunsaturated fatty acids targets mTORC1 to prevent high-fat diet-induced metabolic syndrome and mitochondrial dysfunction in mice[J]. The Journal of Nutritional Biochemistry,2020, 79: 108330.
[39]JIANG S, ZHANG T T, CONG P X, et al. Comparative study on the digestion and absorption characteristics of n-3 LCPUFA-enriched phospholipids in the form of liposomes and emulsions[J]. Food Research International, 2020, 137: 109428.
[40]SUNG H H, SINCLAIR A J, HUYNH K, et al. Differential plasma postprandial lipidomic responses to krill oil and fish oil supplementations in women: A randomized crossover study[J].Nutrition, 2019, 65: 191-201.
[41]CAESAR R, NYGREN H, ORESIC M, et al. Interaction between dietary lipids and gut microbiota regulates hepatic cholesterol metabolism[J]. Journal of Lipid Research, 2016,57(3): 474-481.
[42]LIU F, SMITH A D, SOLANO-AGUILAR G, et al. Mechanistic insights into the attenuation of intestinal inflammation and modulation of the gut microbiome by krill oil using in vitro and in vivo models[J]. Microbiome, 2020, 8(1): 83.
[43]GUNSTONE. The chemistry of oils and fats[M]. Blackwell Pub., CRC Press, 2004.
[44]ZHAO Z, SHI A, GUO R, et al. Protective effect of high-oleic acid peanut oil and extra-virgin olive oil in rats with diet-induced metabolic syndrome by regulating branched-chain amino acids metabolism[J]. Journal of Integrative Agriculture, 2022, 21(3):878-891.
[45]RUOCCO C, RAGNI M, TEDESCO L, et al. Molecular and metabolic effects of extra-virgin olive oil on the cardiovascular gene signature in rodents[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2022 (In press).
[46]HATORI M, VOLLMERS C, ZARRINPAR A, et al.Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet[J]. Cell Metabolism, 2012, 15(6): 848-860.
[47]LIAN C Y, ZHAI Z Z, LI Z F, et al. High fat diet-triggered non-alcoholic fatty liver disease: A review of proposed mechanisms[J]. Chemico-Biological Interactions, 2020, 330:109199.
[48]YAN X, LI L, LIU P, et al. Targeted metabolomics profiles serum fatty acids by HFD induced non-alcoholic fatty liver in mice based on GC-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2022, 211: 114620.
[49]MISHRA A, MIRZAEI H, GUIDI N, et al. Fasting-mimicking diet prevents high-fat diet effect on cardiometabolic risk and lifespan[J]. Nature Metabolism, 2021, 3(10): 1342-1356.
[50]DASILVA G, MEDINA I. Lipidomic methodologies for biomarkers of chronic inflammation in nutritional research:omega-3 and omega-6 lipid mediators[J]. Free Radical Biology& Medicine, 2019, 144: 90-109.
[51]ZHANG D, GUO X, WANG Q, et al. Investigation on lipid profile of peanut oil and changes during roasting by lipidomic approach[J]. LWT-Food Science and Technology, 2022, 154:112594.
[52]SUN J Y, FENG X N, LYU C M, et al. Effects of different processing methods on the lipid composition of hazelnut oil: a lipidomics analysis[J]. Food Science and Human Wellness, 2022,11(2): 427-435.
[53]XIAO Y, LIU H, LU Q, et al. Lipid profile variations in high olecic acid peanuts by following different cooking processes[J].Food Research International, 2022, 155: 110993.
[54]LOZANO-CASTELLÓN J, ROCCHETTI G, VALLVERDÚQUERALT A, et al. New vacuum cooking techniques with extra-virgin olive oil show a better phytochemical profile than traditional cooking methods: A foodomics study[J]. Food Chemistry, 2021, 362: 130194.
[55]YUAN L, JIANG F, CAO X, et al. Metabolomics reveals the toxicological effects of polar compounds from frying palm oil[J].Food & Function, 2020, 11(2): 1611-1623.
[56]刘阳. 不同商品植物油品质评价及对高脂膳食 SD大鼠脂代谢的影响[D]. 江南大学, 2017.LIU Y. Quality evaluation and effects on lipid metabolism in high-fat diet SD rats of different commercial vegetable oils[D].Jiangnan University, 2017.
[57]MARTEL J, CHANG S H, KO Y F, et al. Gut barrier disruption and chronic disease[J]. Trends in Endocrinology and Metabolism, 2022, 33(4): 247-265.
[58]TILG H, ZMORA N, ADOLPH T E, et al. The intestinal microbiota fuelling metabolic inflammation[J]. Nature Reviews Immunology, 2020, 20(1): 40-54.
[59]TENG F, REIS M G, YANG L, et al. In-depth lipidomic analysis of tri-, di-, and mono-acylglycerols released from milk fat after in vitro digestion[J]. Food Chemistry, 2019, 297: 124976.
[60]YASUDA S, OKAHASHI N, TSUGAWA H, et al. Elucidation of gut microbiota-associated lipids using LC-MS/MS and 16S rRNA sequence analyses[J]. iScience, 2020, 23(12): 101841.
[61]WATANABE Y, FUJISAKA S, IKEDA K, et al. Gut microbiota,determined by dietary nutrients, drive modification of the plasma lipid profile and insulin resistance[J]. iScience, 2021, 24(5):102445.
[62]田韵仪, 董志忠, 郑钜圣. 肠道微生物、精准营养与健康[J].生物产业技术, 2019, 6: 13-25.TIAN Y Y, DONG Z Z, ZHENG J S. Gut microbiota, precision nutrition and health[J]. Biotechnology & Business, 2019, 6:13-25.
[63]WANG S, ZHANG L, WANG D, et al. Gut microbiota composition is associated with responses to peanut intervention in multiple parameters among adults with metabolic syndrome risk[J]. Molecular Nutrition & Food Research, 2021, 65(18):2001051.
[64]ZHAO L P, ZHANG F, DING X Y, et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J]. Science,2018, 359(6380): 1151-1156.
[65]GALANAKIS. Trends in personalized nutrition[M]//Chapter 1:An Introduction to Personalized Nutrition, Academic Press,2019: 3-32.
[66]AGOSTONI C, BOCCIA S, BANNI S, et al. Sustainable and personalized nutrition: From earth health to public health[J].European Journal of Internal Medicine, 2021, 86: 12-16.
[67]林旭, 张旭光. 精准营养白皮书[R]. 上海: 中国科学院上海营养与健康研究所, 2021.LIN X, ZHANG X G. Precision nutrition white book[R].Shanghai: Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences, 2021.
[68]JUNG Y, LEE M K, PURI P, et al. Circulating lipidomic alterations in obese and non-obese subjects with non-alcoholic fatty liver disease[J]. Alimentary Pharmacology & Therapeutics,2020, 52(10): 1603-1614.
[69]GUTTENPLAN K A, WEIGEL M K, PRAKASH P, et al.Neurotoxic reactive astrocytes induce cell death via saturated lipids[J]. Nature, 2021, 599(7883): 102-107.
[70]COHAIN A T, BARRINGTON W T, JORDAN D M, et al. An integrative multiomic network model links lipid metabolism to glucose regulation in coronary artery disease[J]. Nature Communications, 2021, 12: 547.
[71]PASTOR Ó, GUZMÁN-LAFUENTE P, SERNA J, et al. A comprehensive evaluation of omega-3 fatty acid supplementation in cystic fibrosis patients using lipidomics[J]. Journal of Nutritional Biochemistry, 2019(63): 197-205.
[72]FENG K, LAN Y, ZHU X, et al. Hepatic lipidomics analysis reveals the antiobesity and cholesterol-lowering effects of tangeretin in high-fat diet-fed rats[J]. Journal of Agricultural and Food Chemistry, 2020, 68(22): 6142-6153.