螺旋藻是一种低等的原核蓝藻生物,是地球上发现的最古老的物种之一[1]。藻体营养组成丰富,含有许多有益营养元素[2]。主要由蛋白质(55%~70%)、碳水化合物(15%~20%)、脂质(约7%)等组成的[3]。由于丰富的营养成分组成,可作为营养保健品和潜在药物的来源,螺旋藻越来越受到医学科学家的关注[4-5],特别是在螺旋藻的药理活性研究方面,包括抗氧化、抗肿瘤和提高免疫力等活性。目前,螺旋藻在保健食品行业得到广泛栽培,常被用作人、动物、饲料添加剂和医药产品的食品等[6]。螺旋藻藻渣是生产螺旋藻粉的过程中的出现的沉积物,在加工生产过程中一般以废物的形式排放出去,未被应用在产品制作过程中,这既不利于充分利用螺旋藻资源,也增加了螺旋藻相关产品的经济负担。因此,开发利用螺旋藻藻渣对于提高螺旋藻的经济价值,扩大天然植物资源的应用范围有良好的现实研究意义。
膳食纤维(Dietary fiber,DF)被列为人类饮食中的七大营养素之一[7]。大多数研究报道了膳食纤维对人体健康的积极作用,DF来源广泛,可分为可溶性膳食纤维(Soluble dietary fiber,SDF)和不溶性膳食纤维(Insoluble Dietary Fiber,IDF)[8]。SDF含量是评价DF生理功能的重要指标,包括寡糖和一些不易消化的多糖,具有良好的粘性和吸收性。而IDF包括植物细胞壁多糖和寡糖(纤维素、半纤维素)和非碳水化合物木质素成分,具有低粘度的特性,但具有良好的溶胀性[9-10]。DF的大分子结构赋予它高持水性、吸附作用等一些独特的物化特性,从而使DF具有降低血清胆固醇、预防结肠癌等生理功能。这些理化性质能影响DF在食品挤压、搅拌、均质过程中与其他配料结合程度,从而影响食品的品质。
如今,越来越多的患者因肥胖而感染慢性病,如糖尿病、癌症、肠道感染等非传染性疾病,全球疾病发病率的增加导致人类死亡率上升[11]。研究表明,DF可以参与人体新陈代谢,治疗慢性病[12-13]。因此,探讨DF的理化性质与生理功能的关系,在功能性食品中生产含有DF的产品,即富含纤维的食品,在食品工业中得到应用上的跃进。而螺旋藻藻渣是生产DF的优质原料,也可作为优质DF的来源[14-16],但螺旋藻藻渣尚未得到合理有效的开发利用。因此,本研究以螺旋藻藻渣为原料,分析螺旋藻藻渣营养成分组成及膳食纤维的理化特性,评价螺旋藻藻渣的可利用资源,为后续对其进行科学合理的开发利用提供一条新途径。
1 材料与方法
1.1 实验材料
螺旋藻藻渣:浙江宾美生物科技有限公司。
1.2 仪器与设备
SHJ-6ABS 磁力搅拌水浴锅:常州金坛良友仪器有限公司;MS 3 basic漩涡混匀器:德国 IKA公司;FOSS膳食纤维测定仪 Fibertec E:瑞典FOSS分析有限公司;PYRAMID TX马弗炉:北京皮尔美特科技有限公司;rapid N cube氮分析仪:德国Elementar Analysensysteme GmbH公司;JJ-1大功率电动搅拌器:常州国华电器有限公司;L580卢湘仪离心机:上海卢湘仪离心机仪器有限公司;S 220多参数测试仪、ML 204电子分析天平(最小称重 10 mg):梅特勒-托利多仪器(上海)有限公司;BGZ-140电热鼓风干燥箱:上海博讯实业有限公司医疗设备厂;FW80、FW100 高速万能粉碎机:天津市泰斯特仪器有限公司;Nicolet iN10-iZ10傅里叶变换显微红外光谱仪:赛默飞世尔科技公司;D8 advance X-射线衍射仪:德国Bruker公司
1.3 实验方法
1.3.1 常规营养成分的测定
水分含量采用105 ℃恒温干燥法测定,具体参照GB/T 6435—2006《饲料中水分和其他挥发性物质含量的测定》;蛋白质含量采用考马斯亮蓝法测定,具体参照GB/T 5009.5—2016《食品安全国家标准食品中蛋白质的测定》;灰分和总糖采用马弗炉快速焚烧法和差值法测定,具体参照 GB/T 6438—2007《饲料中粗灰分的测定》及 DB12/T 847—2018《饲料中总糖的测定分光光度法》。
称取2.00 g螺旋藻藻渣并使用自动氨基酸分析仪测定氨基酸含量,具体根据《食品安全国家标准食品中氨基酸的测定》GB/T 5009.124—2003的规定测定。脂肪酸成分分析参照《国家食品安全标准食品中脂肪酸的测定》GB/T 5009.168—2003的方法测定。
1.3.2 金属元素和重金属含量的测定
金属元素和重金属砷、铅、铬、镉和汞均采用电感耦合等离子体原子发射光谱法(ICP-OES)测定,具体参照相应的食品安全国家标准[17]的规定测定。
1.4 螺旋藻藻渣膳食纤维(DF)的制备
制备步骤根据文献[18]修改。称取螺旋藻残渣,放入烘箱70 ℃烘烤1 h,90 ℃水浴加热1 h,减压过滤浓缩。滤液用4倍体积的无水乙醇处理,静置24 h沉淀,离心得到沉淀物,105 ℃干燥,研磨成粉末即得螺旋藻藻渣粗多糖。将上述提取多糖后的藻渣干燥以去除多余水份,用4倍体积的乙酸乙酯制备脱脂样品,抽滤。滤饼漂洗至中性,加入NaOH溶液,在65 ℃水浴中处理2 h,除去蛋白质。减压过滤后漂洗至中性。用HCl溶液处理后,置于80 ℃水浴中加热1.5 h以除去样品中的淀粉,然后减压过滤。将滤料漂洗至中性,烘干称重,将试样研磨成粉末,过40目筛,得成品。
1.5 膳食纤维(DF)的理化性质
1.5.1 持水力(Water holding capacity,WHC)
IDF样品的持水量(WHC)根据Hassan等[19]方法进行测定,过程稍作修改。每份样品称取0.2 g至1.5 mL离心管,称重为M,与蒸馏水混合,室温静置2 h,然后以7 000 r/min离心10 min。弃上清后,称量离心管中的残渣,记为M1。WHC根据公式计算为:
WHC(g/g)=M1/M
1.5.2 持油量(Oil holding capacity,OHC)
根据Jeddou等[20]方法稍加修改进行测定。具体过程如下:称取试样0.2 g,记重量为M,在离心管中与少量核桃油混合,室温静置 2 h。然后以7 000 r/min离心管15 min。小心地除去离心管中的油并称量吸油样品。重量记为M1。OHC按公式计算为:
OHC(g/g)=M1/M
1.5.3 溶胀能力(Swelling capacity,SC)
IDF 样品的溶胀能力(SC)根据Wang等[21]方法略微修改后进行测定。每个样品称取0.5 g,记为M,置于5 mL量筒中,加入少量蒸馏水。室温下放置24 h,取样并记录最终体积,记为V。SC计算方程如下:
SC(mL/g)=V/W
1.6 膳食纤维(DF)对NO2–吸附能力的测定
将 NaNO2标准液(100 μmol/L)(0,0.2,1.0,2.0,3.0,4.0,5.0 mL)小心加入到封口的试管中,加入0.4 mL对氨基苯磺酸溶液(0.4%)并均匀混合,静置4 min。然后加入0.2 mL萘乙二胺盐酸盐(0.2%)并用蒸馏水定容至10 mL,搅拌15 min后,于分光光度计538 nm处测量吸光度。用标准溶液的浓度作为横坐标,以对NO2-的吸附浓度作为纵坐标的吸光度制备标准曲线。
实验分别在 pH=7和 pH=2的吸附环境下进行,以模拟小肠和胃的环境。取 0.2 g水不溶性膳食纤维粉加入100 mL 100 μmol/L NaNO2溶液,在37 ℃下搅拌10、20、30和40 min,然后以7 000 r/min离心5 min,用移液枪精确吸取离心管中的上清液,并根据标准曲线法确定其吸光度。
根据从标准曲线获得的线性方程,计算上清液中剩余 NO2-的量,并且根据下式计算 NO2-的吸附量:
样品的质量为 S0/g,在吸附前的溶液中的NO2-含量为S1/μM,吸附后上清液中的残留NO2-含量为 S2/μM,以吸附时间横坐标,NO2-浓度(μM/mL)是纵坐标,并抽取NO2-上的膳食纤维的吸附曲线。
1.7 膳食纤维(DF)对胆酸钠吸附能力的测定
胆酸钠标准曲线的制作:配制2 mg/mL胆酸钠标准溶液。分别取 0、0.2、0.4、0.6、0.8、1.0 mL胆酸钠标准溶液装入编号试管中,用蒸馏水定容至1.0 mL。依次加入6 mL 45%硫酸溶液和1 mL 0.3%糠醛溶液,摇匀。在65 ℃水浴中反应30 min后,冷却至室温。在620 nm 处的吸光度。
取0.2 g膳食纤维加入50 mL 0.15 mol/L NaCl溶液(含0.1 g胆酸钠,pH=6.0),在37 ℃水浴并搅拌均匀。每10 min取样一次,以7 000 r/min离心5 min,用可调移液枪准确吸取1 mL样品溶液,按标准曲线法测定吸光度。根据标准曲线线性方程,计算残留在上清液中的胆酸钠浓度。
1.8 数据分析
上述测定指标均为 3次重复。全部数据用Origin 9.0软件进行绘图,计算平均值和标准偏差。
2 结果与分析
2.1 螺旋藻藻渣的营养价值
结果显示,螺旋藻藻渣中蛋白质含量最高,平均占干物质的54.80%,其次是碳水化合物和水分,分别占干物质的11.20%和9.07%(表1)。由此看出,螺旋藻渣的主要营养成分蛋白质含量和碳水化合物含量高,脂肪极少,具有一定的利用价值。从分类上看,通常把不可溶的膳食纤维叫粗纤维,膳食纤维是健康饮食不可缺少的,纤维在保持消化系统健康上扮演着重要的角色,同时摄取足够的纤维也可以预防心血管疾病、癌症、糖尿病以及其它疾病。
表1 螺旋藻藻渣常规成分及含量
Table 1 Conventional nutrients and content of algae residue %
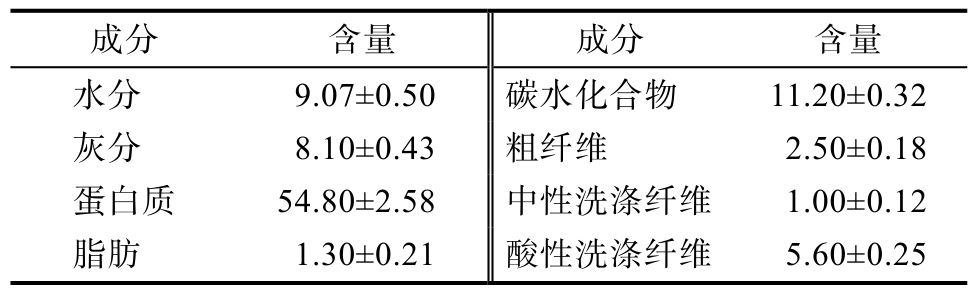
成分 含量 成分 含量水分 9.07±0.50 碳水化合物 11.20±0.32灰分 8.10±0.43 粗纤维 2.50±0.18蛋白质 54.80±2.58 中性洗涤纤维 1.00±0.12脂肪 1.30±0.21 酸性洗涤纤维 5.60±0.25
藻渣中的矿物质元素含量见表2。藻渣中磷、镁、钙含量最高,分别为 623、1 070、19 200 mg/kg。铜、锌、钠、铬、铅、铁、总砷的含量明显低于其他三种。此外,藻渣中汞和镉的含量极低,对人体和动物无影响
表2 藻渣中的矿物质成分含量
Table 2 Mineral composition (mg/kg dry matter) mg/kg
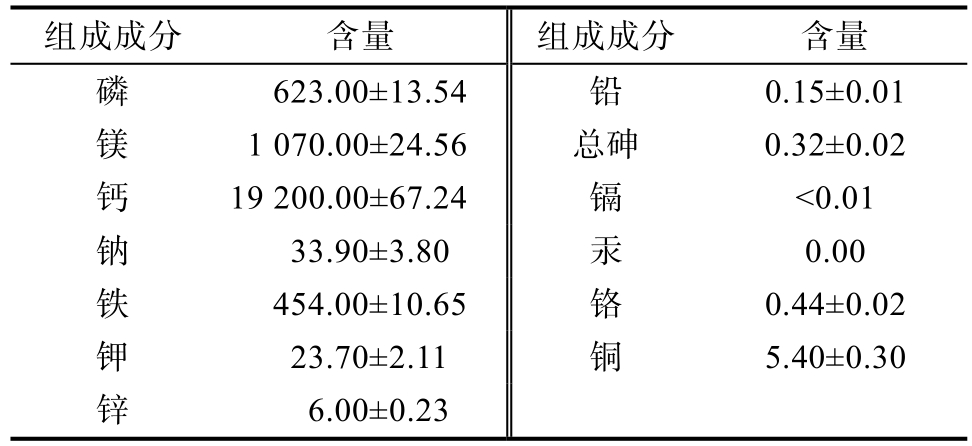
组成成分 含量 组成成分 含量磷 623.00±13.54 铅 0.15±0.01镁 1 070.00±24.56 总砷 0.32±0.02钙 19 200.00±67.24 镉 <0.01钠 33.90±3.80 汞 0.00铁 454.00±10.65 铬 0.44±0.02钾 23.70±2.11 铜 5.40±0.30锌 6.00±0.23
2.2 螺旋藻藻渣氨基酸组成分析
衡量蛋白质质量的关键特征是氨基酸[22]。构成螺旋藻藻残基的总可食用氨基酸如表3所示。在18种蛋白质氨基酸中,有8种被称为必需氨基酸(EAA),是人体不能合成或合成量远不能满足人体需要,必须由食物蛋白质提供。藻渣中所含的 10种 EAA含量接近或超过世界卫生组织(WHO)推荐的要求[23]。其中,EAA的四种重要的功能氨基酸,包括赖氨酸和三种支链氨基酸(支链氨基酸;缬氨酸、亮氨酸和异亮氨酸)在藻渣中含量丰富。此外,螺旋藻藻渣也是某些功能性非必需氨基酸(NEAA)的丰富来源,尤其是精氨酸、谷氨酰胺和谷氨酸。
表3 藻渣中氨基酸含量及WHO推荐的成人氨基酸需要量
Table 3 The amino acid content of algae residue and the amino acid requirement recommended by WHO g/100 g蛋白
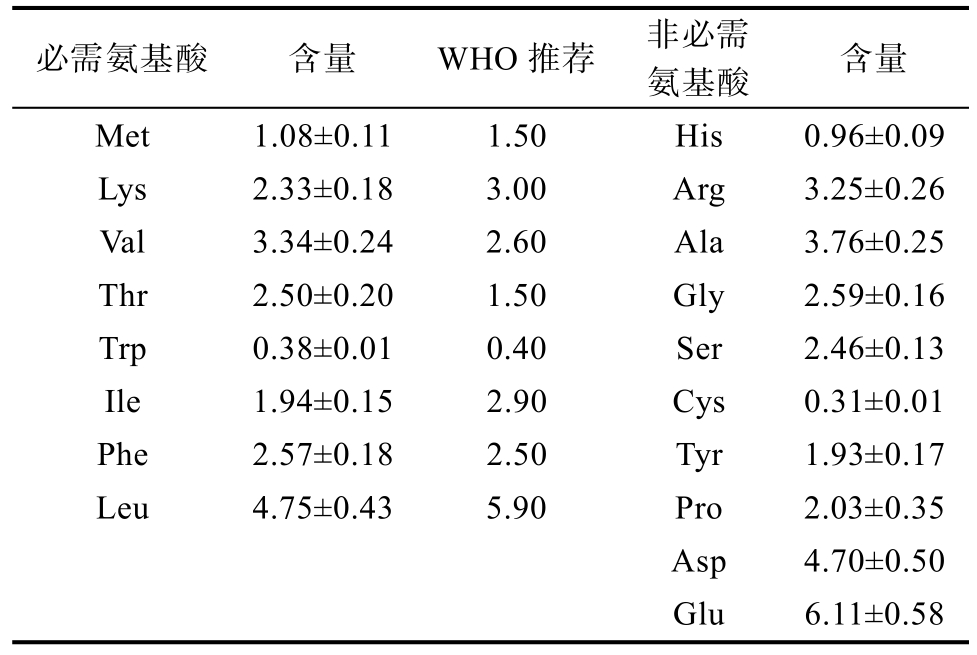
注:Met-甲硫氨酸;Lys-赖氨酸;Val-缬氨酸;Thr-苏氨酸;Trp-色氨酸;Ile-异亮氨酸;Phe-苯丙氨酸;Leu-亮氨酸;His-组氨酸;Arg-精氨酸;Ala-丙氨酸;Gly-甘氨酸;Ser-丝氨酸;Cys-半胱氨酸;Tyr-酪氨酸;Pro-脯氨酸;Asp-天冬氨酸;Glu-谷氨酸
Note: Met-methionine; Lys-lysine; Val-valine; Thr-threonine;Trp-tryptophan; Ile-isoleucine; Phe-phenylalanine; Leu-leucine;His-histidine; Arg-arginine; Ala-alanine; Gly-glycine; Ser-serine;Cys-cysteine; Tyr-tyrosine; Pro-proline; Asp-aspart amino acid;Glu-glutamic acid
必需氨基酸 含量 WHO推荐 非必需氨基酸 含量Met 1.08±0.11 1.50 His 0.96±0.09 Lys 2.33±0.18 3.00 Arg 3.25±0.26 Val 3.34±0.24 2.60 Ala 3.76±0.25 Thr 2.50±0.20 1.50 Gly 2.59±0.16 Trp 0.38±0.01 0.40 Ser 2.46±0.13 Ile 1.94±0.15 2.90 Cys 0.31±0.01 Phe 2.57±0.18 2.50 Tyr 1.93±0.17 Leu 4.75±0.43 5.90 Pro 2.03±0.35 Asp 4.70±0.50 Glu 6.11±0.58
2.3 螺旋藻藻渣脂肪酸组成
螺旋藻藻渣中脂肪酸的组成见表 4。天然植物是必需脂肪酸的良好来源,尤其是不饱和脂肪酸[24]。许多天然食品中的多不饱和脂肪酸已被证明在降低淀粉水解速率方面非常有效[25-26]。由表4看出,在螺旋藻藻渣中,多不饱和脂肪酸占主导地位,占总脂肪酸的一半以上。螺旋藻渣可在高血糖人群的饮食中发挥重要作用。
表4 螺旋藻藻渣脂肪酸组成(以脂肪计)
Table 4 Fatty acids compositions of Spirulina algae residue (calculated by fat) %

注:DHA-二十二碳六烯酸;EPA-二十碳五烯酸
Note: DHA-docosahexaenoic acid; EPA-eicosapentaenoic acid
成分 含量饱和脂肪酸 55.90±2.44二十二碳六烯酸 8.10±0.56二十碳五烯酸 54.80±3.06多烯脂肪酸 36.20±1.77单烯脂肪酸 7.70±0.62
2.4 螺旋藻藻渣DF的WHC、OHC和SC
从螺旋藻藻渣中制备的DF得率为20.82%。如表5所示,螺旋藻藻渣IDF具有一定的WHC、OHC和SC,接近国内常用麸皮膳食纤维的性能指标。研究发现,DF的WHC、OHC和SC与其维持肠道健康的能力密切相关,可以阻碍人体对脂肪和胆固醇的吸收,降低血清甘油三酯。由此看出,制备的DF对于干预高血脂具有一定作用。
表5 螺旋藻藻渣DF的持水力、持油量和溶胀能力
Table 5 The WHC, OHC and SC of algae residue dietary fiber

样品 IDF持水力/(g/g) 3.68±0.13持油量/(g/g) 0.77±0.05溶胀能力/(mL/g) 2.11±0.09
2.5 螺旋藻藻渣DF对NO2–的吸附能力
图1显示了DF对NO2-的吸附趋势变化图。如图所示,当模拟人体大肠环境 pH=7时,膳食纤维对NO2-的吸附能力较弱,曲线不明显。当模拟人体胃环境 pH=2时,随着吸附时间的增加,DF对NO2-的吸附能力逐渐明显,吸附能力逐渐上升至平坦状态。结果表明,在pH=2时,DF具有良好的 NO2-吸附能力,可以促进 NO2-从人体胃部排出。
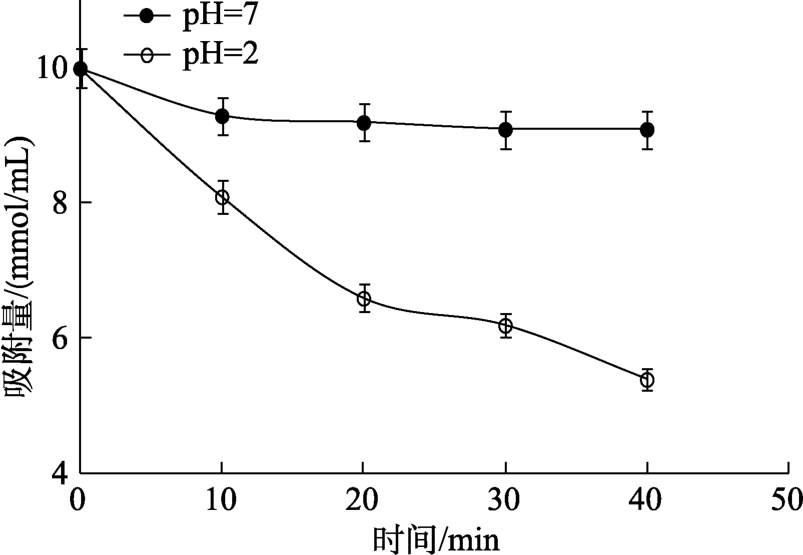
图1 螺旋藻藻渣DF对NO2–的吸附曲线
Fig.1 Adsorption curve of spirulina dietary fiber to NO2–
2.6 螺旋藻藻渣DF对胆酸钠的吸附能力
图 2显示藻渣膳食纤维对胆酸钠的吸附曲线。样品对胆酸钠有很强的吸附能力,胆酸钠浓度从2 mg/mL下降至1.06 mg/mL。吸附容量随时间逐渐增大,一段时间后达到最大吸附容量。
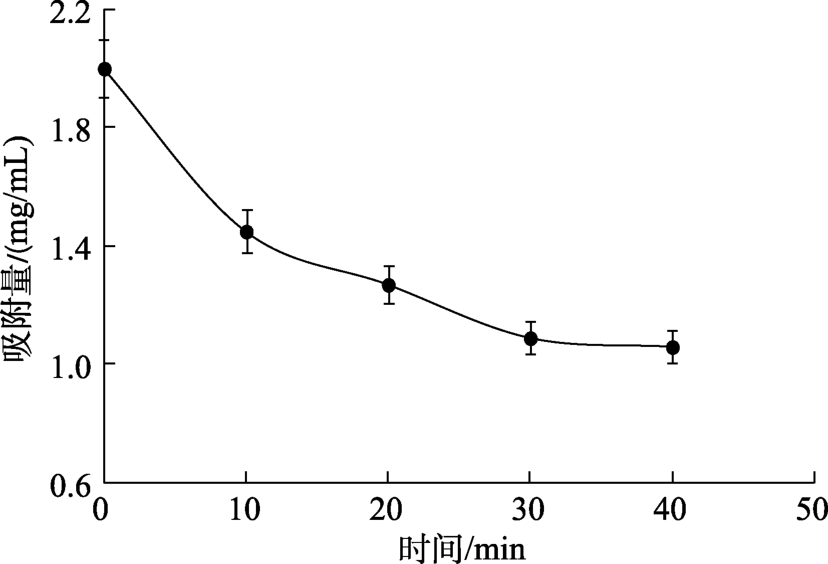
图2 螺旋藻藻渣DF对胆酸钠的吸附曲线
Fig.2 Adsorption curve of Spirulina dietary fiber to Sodium Cholate
3 讨论与结论
螺旋藻藻渣是一种很有前途的高营养能量来源。藻渣中含有许多不饱和的必需脂肪酸、氨基酸和矿物质,均对人体健康有益,可制备加工为天然新型食品;其中,螺旋藻中膳食纤维是最新发现的,并值得应用于制备药食产品的成分,已知在消化系统能发挥重要作用,可增加饱足感,又能促进肠胃蠕动,舒解便秘[27]。
螺旋藻藻渣膳食纤维具备一般植物膳食纤维的理化特性,包括持水量、持油量和溶胀能力,对疾病的预防起着至关重要的作用。持水量和持油量可以治疗肥胖并有效果;溶胀能力对糖尿病的防御能力影响最大;与此同时吸附能力也直接影响癌症的感染,本实验在模拟肠道的 pH 环境中,机体中胆酸钠浓度越高时,膳食纤维对胆酸盐的吸附量也越高,说明膳食纤维对维护机体对食物中脂类物质的正常代谢有利[28];而亚硝酸是人和动物的致癌物,膳食纤维对NO2-的吸附在酸性条件下较强,食物对NO2-的清除也是主要发生在胃部,说明螺旋藻藻渣中的膳食纤维能预防机体癌症病发[29]。
综上所述,螺旋藻藻渣的营养成分含量丰富,其膳食纤维的功能特性明显,且对于螺旋藻的制备过程简单绿色,功能优异,具有成为功能食品的潜力。
[1] 何善生, 王力, 李健, 等.螺旋藻研究进展[J].食品工业,2017, 38(12): 263-267.HE S S, WANG L, LI J, et al.Research progress of Spirulina[J].Food Ind, 2017, 38(12): 263-267.
[2] TEOH M L, CHU W L, MARCHANT H, et al.Influence of culture temperature on the growth, biochemical composition and fatty acid profiles of six Antarctic microalgae[J].J Appl Phycol,2004, 16(6): 421-430.
[3] MATHOR M.Bioactive molecules of spirulina: A food supplement[M].Springer Cham, 2018, 1-22.
[4] MUNAWAROH H, GUMILAR G G, ALIFIA C R, et al.Photostabilization of phycocyanin from spirulina platensis modified by formaldehyde[J].Process Biochem, 2002, 94: 297-304.
[5] KUMAR M, SHARMA M K, KUMAR A.Spirulina fusiformis:a food supplement against mercury induced hepatic toxicity[J].Nurs Health Sci, 2005, 51(6): 424-430.
[6] MICHAEL A, KYEWALYANGA M S, LUGOMELA C V.Biomass and nutritive value of Spirulina (Arthrospira fusiformis)cultivated in a cost-effective medium[J].Ann Microbiol, 2019,69(13): 1387-1395.
[7] WANG C H, MA Y L, ZHU D Y, et al.Physicochemical and functional properties of dietary fiber from Bamboo Shoots(Phyllostachys praecox)[J].Emir J Food Agric, 2017, 29(7):509-517.
[8] LI B, YANG W, NIE Y.Effect of steam explosion on dietary fiber, polysaccharide, protein and physicochemical properties of okara[J].Food Hydrocoll, 2019, 94: 48-56.
[9] YAMG C, KAMESHWAR A S, ZHANG J, et al.Ultrafine grinding a promising method for improving the total dietary fiber content and physico-chemical properties of potato peel waste [J].Waste Biomass Valorization, 2019, 11(2): 3057-3070.
[10] TUNGLAND B, MEYER D.Nondigestible oligo-and polysaccharides (Dietary Fiber): their physiology and role in human health and food[J].Compr.Rev.Food Sci.Food Saf,2002, 1(3): 90-109.
[11] HIYE A H.Nutritional epidemiology of chronic disease and defining“Healthy Diet”[J].Global Food History, 2018, 4(2): 207-225.
[12] YU J, AHMEDNA M.Functional components of grape pomace:their composition, biological properties and potential applications[J].Int J Food Sci Tech, 2013, 48(2): 221-237.
[13] ZHANG T H, YANG Y, LIANG Y, et al.Beneficial effect of intestinal fermentation of natural polysaccharides[J].Nutrients,2018, 10(8): 1055-1076.
[14] ARTHOR S, TRACI M, YIKYUNG P, et al.Dietary fiber and whole-grain consumption in relation to colorectal cancer in the NIH-AARP Diet and Health Study1-5[J].Am.J.Clin.Nutr.,2007, 85(5): 1353-1360.
[15] 杨胜远, 洪纳禧.茶游离氨基酸总量测定方法的改进[J].食品科技, 2012, 37(9): 296-300.YANG S Y, HONG N X.Improvement on determination of free amino acids content in tea[J].Food Sci Technol, 2019, 37(9):296-300.
[16] REN L J, HUANG H, XIAO A H, et al.Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply in Schizochytrium sp.HX-308[J].Bioprocess Biosyst Eng, 2009, 32(6): 837.
[17] 陈亚茹, 张巧凤, 付必胜, 等.中国小麦微核心种质籽粒铅、镉、锌积累差异性分析及低积累品种筛选[J].南京农业大学学报, 2017, 40(3): 393-399.CHEN Y R, ZHANG Q F, FU B S, et al.Analysis of differences in the accumulation of lead, cadmium and zinc in Chinese wheat micro-core germplasm and screening of low accumulation varieties[J].Journal of Nanjing Agricultural University, 2017,40(03): 393-399.
[18] SANTOS J, PETRY F C, TOBARUELA E, et al.Brazilian native passion fruit (Passiflora tenuifila Killip) is a rich source of proanthocyanidins, carotenoids, and dietary fiber[J].FOOD RES INT, 2021, 147(12): 110521-110521.
[19] HASSAN F A, ISMAIL A, HAMID A A, et al.Characterisation of fibre-rich powder and antioxidant capacity of Mangifera pajang K.fruit peels[J].Food Chem, 2011, 126(1): 283-288.
[20] JEDDOU K B, CHAARI F, MAKTOUF S, et al.Structural,functional, and antioxidant properties of water-soluble polysaccharides from potatoes peels[J].Food Chem., 2015,205(8): 97-105.
[21] WANG T L, LIANG X H, RAN J J, et al.Response surface methodology for optimisation of soluble dietary fibre extraction from sweet potato residue modified by steam explosion[J].Int J Food Sci Tech, 2017, 52(3): 741-747.
[22] QIU L Y, DENG Z Y, ZHAO C D, et al.Nutritional composition and proteomic analysis of soft-shelled turtle (Pelodiscus sinensis)egg and identification of oligopeptides with alpha-glucosidase inhibitory activity[J].Food Res Int, 2011, 145(7): 110414-110414.
[23] TSL A, YNC A, SYLA B.Current applications and future perspectives on elemental analysis of non-invasive samples for human biomonitoring[J].Talanta, 2021, 234(1): 122683-122683.
[24] LI S H, ZHAO W, LIU S Y, et al.Characterization of nutritional properties and aroma compounds in different colored kernel varieties of foxtail millet (Setaria italica)[J].Journal of Cereal Science, 2021, 100(1): 103248.
[25] ANNOR G A, MARCONE M, CORREDIG M, et al.Effects of the amount and type of fatty acids present in millets on their in vitro starch digestibility and expected glycemic index (eGI) [J].J Cereal Sci, 2015, 64(0733-5210): 76-81.
[26] METHOR S, ORHAN I, AHSAN Z, et al.Fatty acid composition of seed oil of different sorghum bicolor varieties[J].Food Chem, 2008, 109(4): 855-859.
[27] LI Y N.Comparison the structural, physicochemical, and prebiotic properties of litchi pomace dietary fibers before and after modification[J].Foods, 2022, 11(3): 248-248.
[28] 欧仕益, 高孔荣, 黄惠华.麦麸水不溶性膳食纤维对 NO2-清除作用的研究[J].食品科学, 1997, 18(3): 6-9.OU Y Y, GAO K R, HUANG H H.Study on NO2- scavenging effect of wheat bran water-insoluble dietary fiber[J].Food Sci.,1997, 18(3): 6-9.
[29] 吴婧, 刘祚祚, 吴杰, 等.滇橄榄果渣膳食纤维的提取及其体外吸附性能研究[J].食品工业科技, 2022, 43(2):174-181.WU J, LIU Z Z, WU J, et al.Extraction of dietary fiber from Yunnan olive pomace and its in vitro adsorption properties[J].Sci., 2022, 43(2): 174-181.