驴产业是我国名优新特产业,正处于发展的重要战略机遇期,逐渐向肉用、药用、保健及生物制品开发等多用途的“活体经济”转变[1]。驴的众多副产品中,驴骨性平、味甘,入脾、肝、肾经,具有滋阴补肾,强筋壮骨的功效[2]。驴骨不仅含有丰富的钙质,还含有骨蛋白、骨多肽、骨多糖,以及磷、镁、锰、锌、铜等骨生长必需的全骨营养素[3]。其中驴骨胶原多肽在食品、化妆品行业都具有较大的应用前景。在目前国内消费市场上,大多数驴骨胶原多肽的开发利用以补充胶原蛋白和钙质为主要方向,制备生产相应的驴骨胶原钙片、驴骨胶原肽粉等[4-5],鲜有研究关注驴骨胶原特征氨基酸对其他微量元素的潜在作用。
铁是人体必需的微量元素之一,影响人体各代谢通路,铁摄入不足或吸收受到抑制时会发生缺铁性贫血(iron deficiency anemia,IDA),出现疲劳、虚弱等临床症状[6-7]。针对缺铁的主要饮食策略是补充与强化[8]。在各类补铁剂中,多肽铁螯合物可通过肽转运体系被机体吸收,因其较高的生物利用度与较低的副作用成为当前研究开发的热点[9]。曹丛丛[10]的研究表明,阿胶在消化过程中产生的活性肽能够与铁离子螯合,形成的螯合物可有效促进铁离子的吸收,具备潜在的补血活性。进一步动物试验研究证明,这一螯合物可以提高铁的生物利用率并改善机体铁稳态,有效改善IDA[11],同时改善IDA小鼠的肠道炎症,缓减IDA引起的肠道菌群失调[12]。另外,研究发现[13],驴骨胶和驴皮胶的胶原蛋白基本相同,同宗同源,但具体氨基酸含量有所差异,驴骨胶总蛋白含量高,为 75.3%,对比驴皮胶为 75.1%,与补血、免疫调节相关的氨基酸(甘氨酸、脯氨酸、赖氨酸、丙氨酸)含量更高。
基于前期研究,我们推测驴骨胶原肽是一种潜在的活性成分,与驴皮胶类似,具有螯合保护亚铁离子、促进亚铁离子吸收的作用。因此,本研究采用酶解法制备驴骨胶原肽,并采用正交法优化酶解条件,探究其与亚铁离子的螯合能力,以期为后续探究驴骨胶原肽的潜在补血活性奠定基础,为开发驴骨胶原肽相关产品提供科学参考。
1 材料与方法
1.1 材料与试剂
剔肉驴骨段:市场购置;胰蛋白酶(1∶250)、木瓜蛋白酶(≥800 U/mg)、碱性蛋白酶(≥200 U/mg)、复合蛋白酶(≥120 U/mg)、风味蛋白酶(≥20 U/mg):阿拉丁生物科技有限公司;浓盐酸、石油醚、氢氧化钠、乙二胺四乙酸二钠、冰醋酸、抗坏血酸、七水合硫酸亚铁(FeSO4·7H2O)、邻菲罗啉、无水乙醇等试剂均为分析纯:国药化学试剂有限公司;BCA试剂盒:翌圣生物科技(上海)股份有限公司。
1.2 仪器与设备
破骨机:河北德科机械科技有限公司;KJ-300超声波发生器:无锡市科洁超声电子设备有限公司;高压灭菌锅:致微(厦门)仪器有限公司;Centrifuge 5430R台式高速冷冻离心机:德国Eppendorf公司;HH-3A恒温水浴锅:常州国华电器有限公司;ST3100 pH计:常州奥豪斯仪器有限公司;Epoch酶标仪:美国 Biotek公司;SCIENTZ-10N冷冻干燥机:宁波新芝生物股份有限公司;冷场发射扫描电子显微镜:日本株式会社日立高新技术公司。
1.3 实验方法
1.3.1 驴骨粉的制备
取解冻后的驴骨段,去除骨髓,并浸入5%(w/v)NaOH溶液中1 h,且骨与溶液之比为1∶2(w/v)。浸泡完毕后,用去离子水反复洗涤3次并除去附着于骨段的肉,待骨段晾干至恒重后称量。将骨段与沸程为60~90 ℃的石油醚以1∶2(w/v)的比例混合,每2 h更换溶剂并去除油脂。油脂去除后,用去离子水洗涤骨段3次并在干燥器中晾至骨段表面无明显水分残留后,使用 0.5 mol/L盐酸溶液以1∶10料液比对骨段进行脱钙处理,每三天更换一次盐酸,共更换三次。将脱脂、脱钙后的骨段使用粉碎机粉碎,放入烘箱中,在37 ℃下烘干至恒重并称量。驴骨粉避光保存于干燥器中。
1.3.2 驴骨蛋白酶解预处理
为了提高酶解效率,需要对蛋白质作变性预处理,该研究采用热处理法。烘干后的驴骨粉与蒸馏水以1∶20的比例进行混合,在没有酶参与的条件下,于121 ℃的高压灭菌锅中,对其进行加热预处理。分别处理0、10、20、30、40 min。随后离心,取上清液使用 BCA法测蛋白浓度,以确定最佳热处理时间。
1.3.3 驴骨酶解液的制备
取适量高温蒸煮过的驴骨液于4 ℃,6 000 r/min下离心20 min,取上清液20 mL于50 mL离心管中,添加相应量的蛋白酶,并调节温度和pH值,酶解相应时间后高温灭酶,冷却至室温后,于4 ℃,4 000 r/min离心20 min得到上清液,用0.45 μm水系微孔滤膜过滤得到滤液,即驴骨酶解液。
1.3.4 驴骨胶原肽铁螯合物的制备
取2 mL驴骨酶解液放入离心管中,空白组取2 mL同等条件下保温的驴骨原液,调节pH至5.5,加入1 mL乙酸钠缓冲溶液,为防止Fe2+被氧化,加入200 μL抗坏血酸溶液(20 mg/mL),然后加入 1 mL FeSO4·7H2O 溶液(100 μg/mL),于恒温振荡器中保持37 ℃螯合30 min。
1.3.5 螯合率的测定
参考曹丛丛[10]邻菲罗琳比色法测亚铁离子含量的方法并稍作改进。
1.3.5.1 标准曲线的绘制 配制 10 μg/mL FeSO4·7H2O 溶液,分别取 0、0.2、0.4、0.8、1.2、1.6、2.0、3.0 mL于10 mL离心管中,加水稀释至6 mL,而后依次加入20 mg/mL抗坏血酸0.2 mL,乙酸钠缓冲液1 mL,0.5%邻菲罗啉0.4 mL,混匀,加水稀释至10 mL。静置反应15 min,吸取200 μL至96孔板中,用酶标仪测定在510 nm波长下的吸光值。以吸光度值作为纵坐标,Fe2+浓度作为横坐标,绘制Fe2+浓度标准曲线,并计算线性回归方程,得到回归方程 y=0.102 8x-0.006 3,R²=1。
1.3.5.2 样品铁螯合率的测定 取螯合完成的样品,加入400 μL邻菲罗琳溶液,用去离子水定容至10 mL,混合,静置15 min,测定在510 nm波长下的吸光值。根据标准曲线与样品吸光值计算样品在体系中的浓度。
螯合率计算公式为:
式中:X为螯合率;C1为空白阿胶体系中的游离亚铁离子浓度;C2为样品体系中的游离亚铁离子浓度。
1.3.6 最适蛋白酶筛选
取适量高温蒸煮过的驴骨液于4 ℃,6 000 r/min下离心20 min,取上清液20 mL于50 mL离心管中,分别添加等酶活的复合蛋白酶、木瓜蛋白酶、碱性蛋白酶、风味蛋白酶、胰蛋白酶,在各自最佳酶解温度和pH值下,酶解3 h后,制备驴骨胶原肽铁螯合物并测定驴骨肽与亚铁离子螯合率,以螯合率为主要指标,得到酶解效果最好的蛋白酶。各蛋白酶的最适温度、pH见表1。
表1 各蛋白酶的最适温度、pH
Table 1 Optimum temperature and pH of each protease

酶的种类 最适温度/℃ pH复合蛋白酶 50 7.0木瓜蛋白酶 45 6.5碱性蛋白酶 45 9.0风味蛋白酶 50 7.0胰蛋白酶 55 8.0
1.3.7 最佳蛋白酶单因素酶解实验
确定最佳蛋白酶后,选取酶底比、酶解pH、酶解温度、酶解时间四个因素对进行考察。
1.3.7.1 酶底比对螯合率的影响 固定反应条件酶解时间3 h、温度50 ℃、pH=7.0,设定酶底比为750、1 000、1 250、1 500、1 750 U/mL,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.7.2 酶解 pH对螯合率的影响 固定反应条件酶解时间3 h、温度50 ℃、酶底比为1 250 U/mL,设定酶解pH为5.0、6.0、7.0、8.0、9.0,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.7.3 酶解温度对螯合率的影响 固定反应条件酶解时间3 h、酶解pH 7.0、酶底比为1 250 U/mL,设定酶解温度为 30、40、50、60、70 ℃,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.7.4 酶解时间对螯合率的影响 固定反应条件酶解温度50 ℃、酶解pH 7.0、酶底比为1 250 U/mL,设定酶解时间为1、2、3、4、5 h,以亚铁离子螯合率为主要考察指标,酶解制备驴骨胶原蛋白肽,与亚铁离子进行螯合,探究酶底比对螯合率的影响。
1.3.8 正交法优化酶解条件
根据单因素实验结果,考虑交互作用的影响,设计四因素三水平的正交实验,选用 L27(313)正交表进行相应的正交实验,计算每次实验驴骨胶原肽和亚铁离子的螯合率,设计如表2。
表2 螯合正交因素水平表
Table 2 Chelate orthogonal factor level table

水平 A酶底比/(U/mL) B时间/h C温度/℃ D pH 1 1 000 3 30 7 2 1 250 4 40 8 3 1 500 5 50 9
1.3.9 螯合产物形态与微观结构表征
将最优配方得到的螯合产物冷冻干燥后放置阴凉、密闭环境下储存。拍照记录产物形态;采用冷场发射扫描电子显微镜(FESEM)扫描,分别放大1 000倍、5 000倍观察其微观结构。
1.4 数据分析
实验数据用Graphpad Prism 8.0软件进行数据处理以及作图,正交法优化采用SPSS 26.0,数据为3次实验的平均值。显著性分析采用单因素方差分析,Duncan多重比较检验,以P<0.05表示为差异显著,用小写字母a、b、c、d表示差异。
2 结果与分析
2.1 驴骨蛋白酶解预处理时间的确定
高温蒸煮可使驴骨中的蛋白溶出,这可能是由于骨蛋白受热变性,内部非极性基团暴露到分子表面,增强了骨蛋白的水溶性[14]。同时,热预处理会导致分子间和分子内的重排,暴露隐藏的裂解位点,增加水解部位,利于酶解[15]。
由图1可知,随着预处理时间的延长,酶解驴骨蛋白的蛋白浓度逐渐增高,在121 ℃下高温加热30 min时蛋白浓度达到最高。超过该时间,蛋白浓度逐渐下降,原因可能为高温加热时间过长使大多数蛋白质发生变性,其分子内部和分子间发生聚合,形成了不溶解的产物。张永秀等[16]以牛骨粉为原料,发现经121 ℃,30 min的加热预处理能显著提高蛋白质水解度和氮溶出率,与本实验结果类似,说明蛋白质在不同变性程度时对水解度影响很大,变性程度过高反而不利于水解。因此确定驴骨蛋白酶解预处理条件为在121 ℃下高温加热30 min。
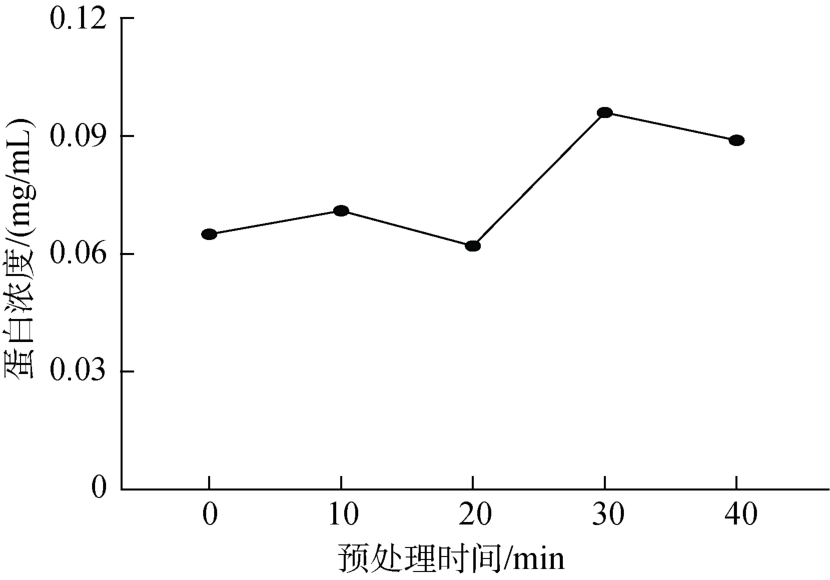
图1 不同预处理时间的蛋白液吸光度和蛋白浓度
Fig.1 Absorbance and protein concentration of protein solution at different pretreatment times
2.2 最适蛋白酶筛选
酶解是制备降血压肽、抗氧化肽、免疫肽等生物活性肽的有效方法。酶解可以改善食品的功能特性,而不影响其营养价值[17]。由于酶的不同切割特异性,选择合适的蛋白水解酶至关重要,这会影响蛋白肽的释放量[18]。由图2可知,5种不同的食品级蛋白酶在各自最适反应条件下反应,保持酶活相同,对驴骨蛋白的水解能力不同,酶解后的产物多肽与铁的螯合率也不同。酶解得到的驴骨胶原肽与铁螯合能力为:木瓜蛋白酶>胰蛋白酶>碱性蛋白酶>风味蛋白酶>复合蛋白酶。木瓜蛋白酶为含疏基肽链内切酶,能适当降解结缔组织、胶原蛋白及弹性蛋白,其酶解 pH范围为5~11,在酸性、中性、碱性环境下均能分解蛋白[19],跨度较大,利于设变量梯度。结合酶解效果,选择木瓜蛋白酶进行下一步实验。
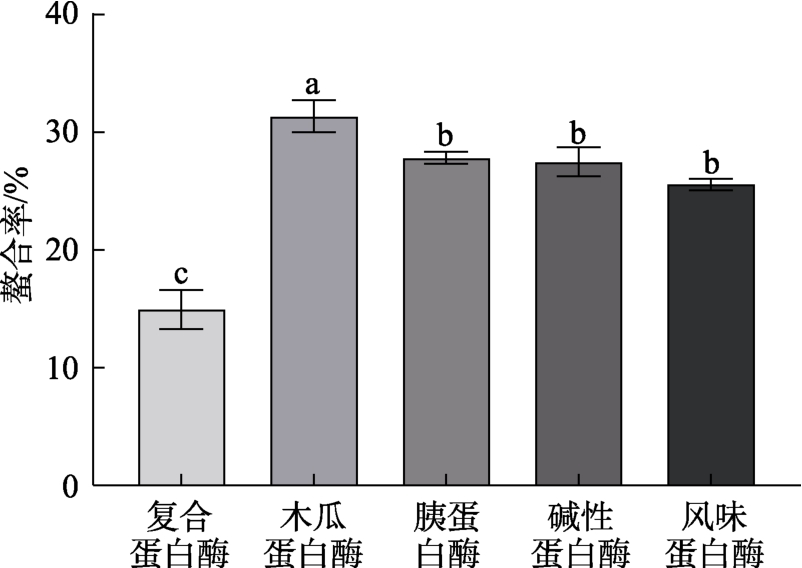
图2 不同蛋白酶酶解效果比较
Fig.2 Comparison of enzymatic hydrolysis effects of different proteases
注:用不同小写字母表示有显著性差异(P<0.05),下面的图片用同样方法标注。
Note: Different lower-case letters showed statistical significance(P<0.05).The following figures are marked in the same way.
2.3 木瓜蛋白酶酶解条件优化
2.3.1 酶底比对螯合率的影响
不同酶底比对铁螯合率的影响如图3所示。由图可知,酶底比在750~1 000 U/mL的范围内,螯合率随着酶添加量的增多几乎不变,无显著差异(P>0.05),在1 250 U/mL时螯合率出现最大值,显著高于其他组螯合率水平(P<0.05),而后螯合率不断下降。这可能是由于酶底比小于1 000 U/mL时,酶与底物接触点较少,水解出的多肽含量低,螯合位点少[20]。随着加酶量不断增加,多肽含量增加,螯合位点增加,但是当加酶量达到饱和之后, 酶会继续水解小分子蛋白质及多肽,蛋白质水解会更加彻底,从而导致多肽含量的降低,螯合位点减少[21],故最适酶底比为1 250 U/mL。
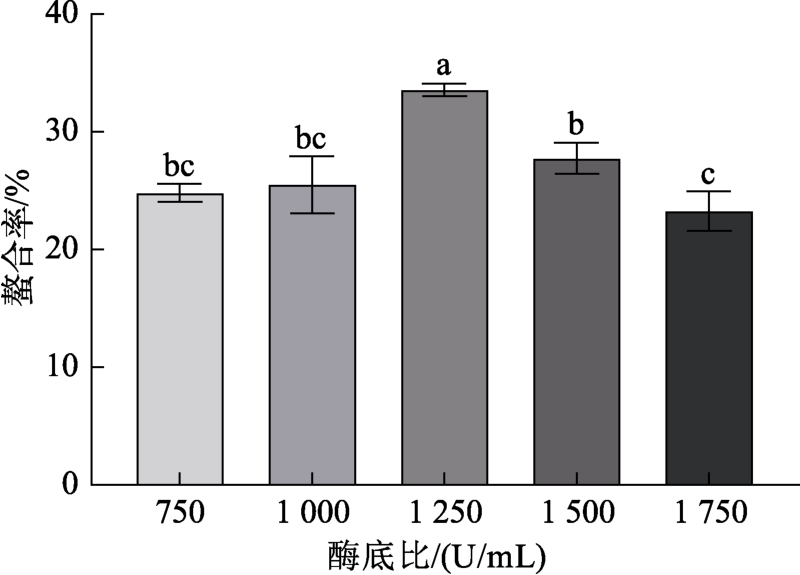
图3 不同酶底比对螯合率的影响
Fig.3 Effect of different enzyme substrate ratios on chelation rate
2.3.2 酶解时间对螯合率的影响
不同酶解时间对螯合率的影响如图4所示。在酶解时间为1~3 h的范围内,铁螯合率基本不变,无显著差异(P>0.05),在4 h时铁螯合率最大,显著高于其他组(P<0.05),4 h后铁螯合率逐渐降低。其原因可能在于反应初期,底物质量浓度较高,蛋白酶与底物蛋白有充足的位点相互结合,暴露出较多的酶切位点,有利于蛋白酶进行酶切,从而产生多肽,提供了大量的螯合位点[22]。此外酶切位点的暴露需要时间,但是当酶解时间过长时,多肽进一步被水解成氨基酸,多肽产率降低,螯合位点减少。同时,随着酶解时间的增加,底物特异性位点基本被完全反应,继续反应不会导致额外的活性基团暴露。因此,最适酶解时间选择4 h。
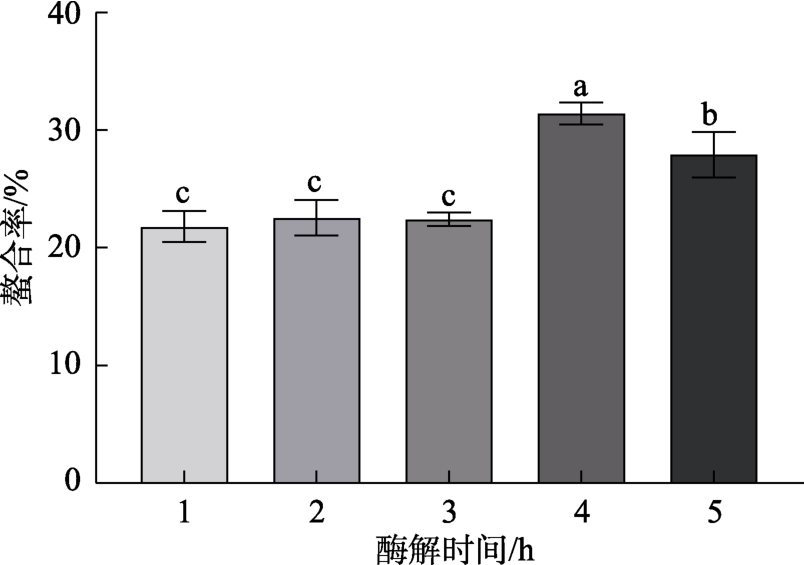
图4 不同酶解时间对螯合率的影响
Fig.4 Effect of different enzymolysis time on chelation rate
2.3.3 酶解温度对螯合率的影响
不同酶解温度对铁螯合率的影响如图 5所示。温度在30~40 ℃范围内,铁螯合率随温度升高而显著提高(P<0.05),在40 ℃达到最大值后下降。这是因为在相对较低的温度下,酶的活性较小,分子的动能较小,酶与底物之间的碰撞也较少,反应效率低[23]。随着温度的升高,分子中的非共价键和二硫键逐渐断裂,导致蛋白质的解聚和去折叠,有利于暴露更多酶切位点,从而产生更多具有免疫活性的肽段[15]。而当超过其最适温度后,酶活性降低,导致酶解作用减弱。此时,过高的温度开始引起底物逐渐变性(热聚集),暴露出的酶切位点减少,具有铁螯合能力的肽段减少,螯合能力下降。因此,最适酶解温度选取40 ℃。
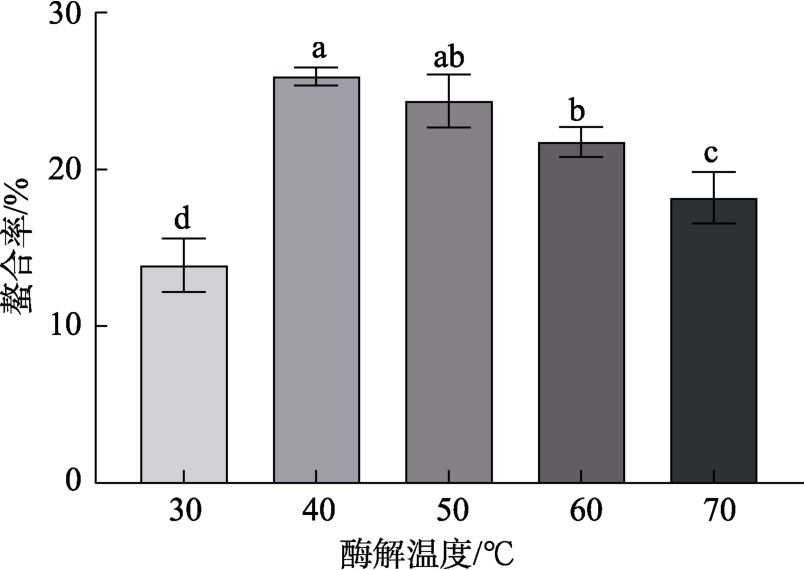
图5 酶解温度对螯合率的影响
Fig.5 Effect of enzymatic hydrolysis temperature on chelation rate
2.3.4 酶解pH对螯合率的影响
作为生物催化剂,pH对蛋白酶的催化活性影响很大。研究表明,pH主要通过影响底物的解离状态、酶的空间结构、活性中心及与底物结合程度等影响酶解反应。YU等[24]认为,蛋白酶的空间结构改变会引起更多的活性位点暴露;在一定的pH范围内,底物蛋白中的肽键被破坏会产生一些抗氧化水解物,可以增加DPPH自由基清除活性。
不同酶解pH对铁螯合率的影响如图6所示。蛋白酶作为生物活性物质,具有发挥作用的最适pH范围,过酸和过碱都会使得酶活力下降,致使多肽产率降低,螯合位点减少。在 pH高于实验酶的最适 pH条件下,驴骨液中较多的 OH-可能会抑制水解反应的发生,影响酶对蛋白质的水解效果[25]。pH为 8时,水解效果最好,螯合率最高,因此最适酶解pH选择8。
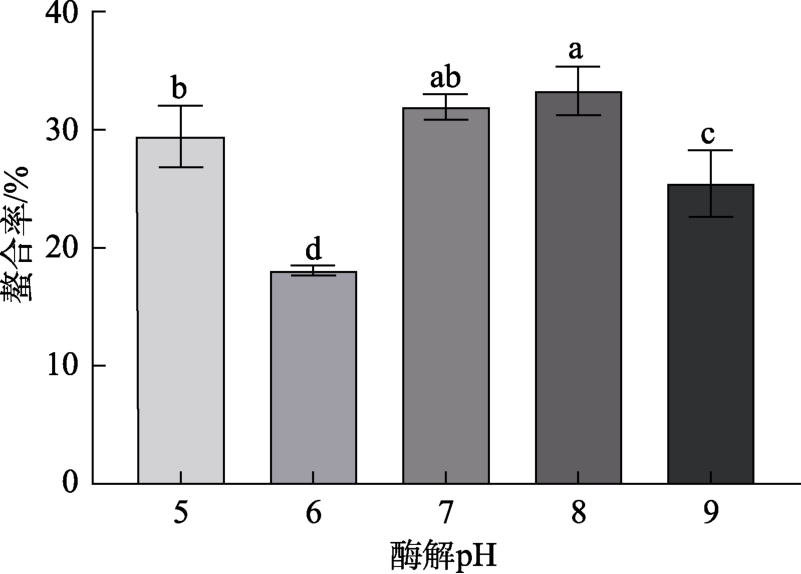
图6 酶解pH对螯合率的影响
Fig.6 Effect of enzymatic hydrolysis pH on chelation rate
2.4 正交实验
根据正交表安排实验,同时留取3列空白,作为误差估计。按正交表实施实验,共27个组合,考察各组合的铁螯合率。对正交实验结果进行了极差和方差分析,见表3和表4。
表3 正交实验极差分析表
Table 3 Range analysis table of orthogonal test

编号 A B AB AB C AC AC BC 空列 空列 BC 空列 D 螯合率/%1 1 1 1 1 1 1 1 1 1 1 1 1 1 29.28 2 1 1 1 1 2 2 2 2 2 2 2 2 2 33.60 3 1 1 1 1 3 3 3 3 3 3 3 3 3 32.64 4 1 2 2 2 1 1 1 2 2 2 3 3 3 34.08 5 1 2 2 2 2 2 2 3 3 3 1 1 1 34.56 6 1 2 2 2 3 3 3 1 1 1 2 2 2 33.60 7 1 3 3 3 1 1 1 3 3 3 2 2 2 29.76 8 1 3 3 3 2 2 2 1 1 1 3 3 3 25.91 9 1 3 3 3 3 3 3 2 2 2 1 1 1 31.20 10 2 1 2 3 1 3 3 1 3 2 1 2 3 29.28 11 2 1 2 3 2 1 1 2 1 3 2 3 1 29.76 12 2 1 2 3 3 2 2 3 2 1 3 1 2 28.32 13 2 2 3 1 1 3 3 2 1 3 3 1 2 31.68 14 2 2 3 1 2 1 1 3 2 1 1 2 3 24.47 15 2 2 3 1 3 2 2 1 3 2 2 3 1 20.63 16 2 3 1 2 1 3 3 3 2 1 2 3 1 28.80 17 2 3 1 2 2 1 1 1 3 2 3 1 2 28.32 18 2 3 1 2 3 2 2 2 1 3 1 2 3 22.07 19 3 1 3 2 1 3 2 1 2 3 1 3 2 26.39 20 3 1 3 2 2 1 3 2 3 1 2 1 3 34.56 21 3 1 3 2 3 2 1 3 1 2 3 2 1 24.47 22 3 2 1 3 1 3 2 2 3 1 3 2 1 23.03 23 3 2 1 3 2 1 3 3 1 2 1 3 2 28.80 24 3 2 1 3 3 2 1 1 2 3 2 1 3 27.35 25 3 3 2 1 1 3 2 3 1 2 2 1 3 21.59 26 3 3 2 1 2 1 3 1 2 3 3 2 1 23.51 27 3 3 2 1 3 2 1 2 3 1 1 3 2 27.84 K1j 284.61 268.28 253.88 245.23 253.88 262.52 255.32 244.27 247.15 255.80 253.88 266.84 245.23 K2j 243.31 258.20 262.52 266.84 263.48 244.75 236.11 267.80 257.72 251.96 259.64 243.79 268.28 K3j 237.55 238.99 249.07 253.40 248.11 258.20 274.04 253.40 260.60 257.72 251.96 254.84 251.96 k1j 31.62 29.81 28.21 27.25 28.21 29.17 28.37 27.14 27.46 28.42 28.21 29.65 27.25 k2j 27.03 28.69 29.17 29.65 29.28 27.19 26.23 29.76 28.64 28.00 28.85 27.09 29.81 k3j 26.39 26.55 27.67 28.16 27.57 28.69 30.45 28.16 28.96 28.64 28.00 28.32 28.00 Rj 5.23 3.25 1.49 2.40 1.71 1.97 4.21 2.61 1.49 0.64 0.85 2.56 2.56
表4 正交实验结果方差分析表
Table 4 Analysis of variance of orthogonal test results
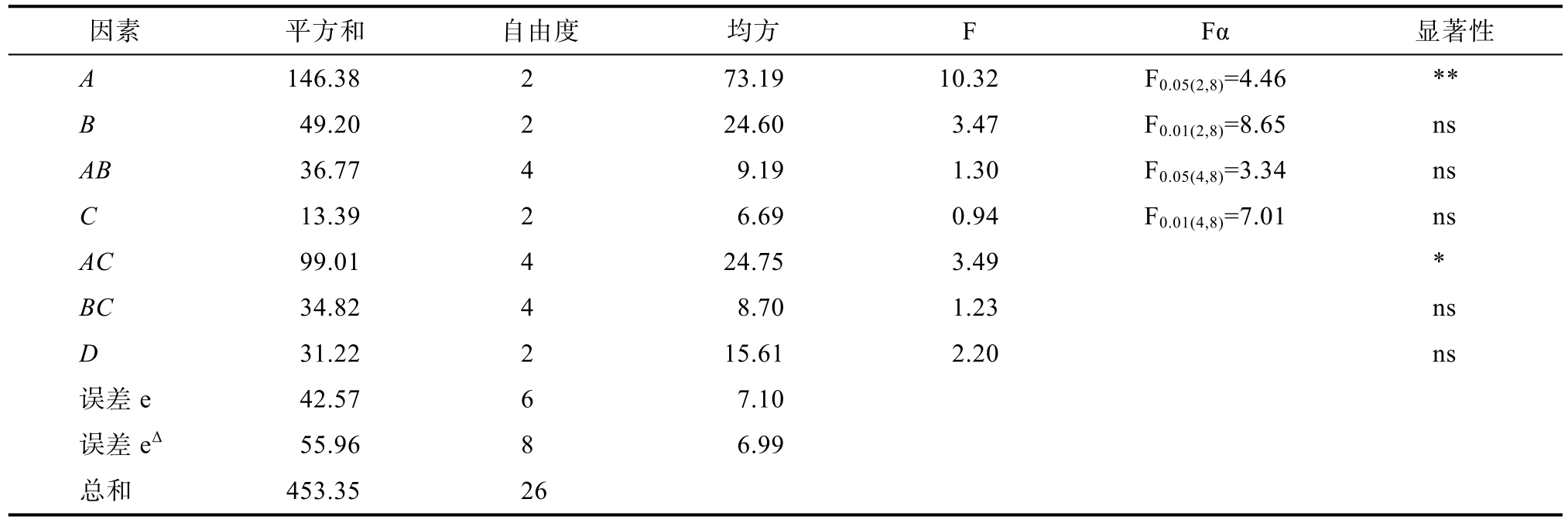
注:*为有显著性(P<0.05),**表示极显著(P<0.01),ns表示无显著性。
Note: * is significant (P<0.05), ** is extremely significant (P<0.01), ns is not significant.
因素 平方和 自由度 均方 F Fα 显著性images/BZ_216_238_2552_510_2591.png 146.38 2 73.19images/BZ_216_1331_2552_1623_2591.pngF0.05(2,8)=4.46 **images/BZ_216_238_2611_510_2650.png 49.20 2 24.60 3.47 F0.01(2,8)=8.65 nsimages/BZ_216_238_2671_510_2709.png36.77 4 9.19 1.30 F0.05(4,8)=3.34 nsimages/BZ_216_238_2730_510_2768.png 13.39 2 6.69 0.94 F0.01(4,8)=7.01 nsimages/BZ_216_238_2789_510_2827.png99.01 4 24.75 3.49 *images/BZ_216_238_2848_510_2886.png34.82 4 8.70 1.23 nsimages/BZ_216_238_2907_510_2946.png 31.22 2 15.61 2.20 nsimages/BZ_216_238_2961_510_3010.png 42.57 6 7.10images/BZ_216_238_3021_510_3069.png55.96 8 6.99images/BZ_216_238_3080_510_3128.png453.35 26
本实验指标为螯合率,要求越大越好。分析可得,因素 A、AC具有显著性(P<0.05),其他因素对指标的影响不显著,可忽略不计,并记入误差。因素影响主次顺序为A>AC>B>D>AB>BC>C,对于高度显著的因素A,直接由K值判断取A1为优水平。其中AC交互项的影响因素比C要大,所以通过二元表获得C的优先水平,如表5所示。
表5 A、C交互作用二元表
Table 5 A and C interaction binary table
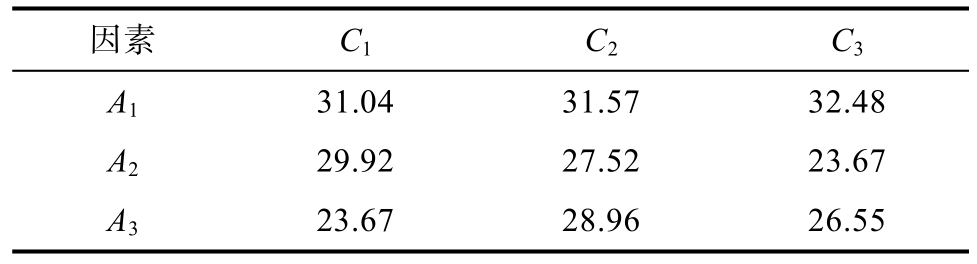
因素 C1 C2 C3 A1 31.04 31.57 32.48 A2 29.92 27.52 23.67 A3 23.67 28.96 26.55
A1C3螯合率最大,且与A因素选择一致,所以C因素选取C3,根据K值,并结合生产实际,确定优水平组合为A1B1C3D1,由于此组合在正交实验中并没有出现,进行模拟。比较发现螯合率为38.40%,高于表4中各组螯合率,这一表现也优于同为产业副产品的椰子球蛋白多肽(30.67%)[26]、浒苔多糖(19.6%)[27]等,具有一定的开发利用价值。因此得到最优水平为A1B1C3D1,即酶底比1 000 U/mL,时间为3 h,温度为50 ℃,pH 7.0。
2.5 螯合产物形态与微观结构表征
对螯合产物拍照观察。如图7所示,该产物表面疏松干燥,颗粒均匀,呈现棕褐色粉末状结构。

图7 螯合产物外观图
Fig.7 Appearance diagram of chelating product
使用冷场发射扫描电子显微镜对螯合产物进行扫描,分别放大1 000倍和5 000倍,观察其微观形态,如图8。可以发现,该产物的微观结构为疏松多孔的片状结构,孔洞大小较为均匀,但片状大小不一,可能是在冷冻干燥过程中产生了断裂。

图8 螯合产物的电镜扫描图(1 000倍、5 000倍)
Fig.8 Scanning electron micrographs of chelated products(1 000 times, 5 000 times)
(a)螯合产物的电镜扫描图(1 000x)(b)螯合产物的电镜扫面图(5 000x)
(a) Scanning electron micrographs of chelate product (1 000x) (b)Scanning electron micrographs of chelate product (5 000x)
3 结论
本研究建立了一种酶解制备驴骨胶原肽的方法,通过单因素和正交优化实验,优化了酶解条件,并考察了驴骨胶原肽与亚铁离子的螯合能力。结果发现,热处理可以提高驴骨蛋白肽的产率,121 ℃蒸煮处理30 min,可以得到溶出蛋白含量最高的驴骨蛋白溶液。使用木瓜蛋白酶,在酶底比1 000 U/mL、酶解pH 7.0、酶解温度50 ℃时酶解 3 h,得到与亚铁离子螯合能力最强的驴骨胶原肽,螯合率达到38.40%。对螯合产物进行冷冻干燥,此时产物为疏松的棕褐色粉末状,其微观形态呈现疏松多孔的片状结构。对驴骨胶原肽酶解条件的优化有利于提高酶解效率,使其表现出更高的铁螯合能力和促铁吸收潜力。这为后续研究驴骨胶原肽与亚铁离子的螯合机制以及产物功效评价奠定了基础。
[1] 豆海港, 杨改, 曹徳玉, 等.畜禽骨加工技术研究[J].中国调味品, 2019, 44(3): 169-70+88.DOU H G, YANG G, CAO D Y, et al.Study on the processing technology of bones of livestock and poultry[J].China Condiment, 2019, 44(3): 169-70+88.
[2] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社, 1999.Editorial board of Chinese materia medica of the State Administration of traditional Chinese Medicine.Chinese Materia Medica[M].Shanghai: Shanghai Scientific & Technical Publishers, 1999.
[3] 南京中医药大学.中药大辞典[M].上海: 上海科学技术出版社, 2006.Nanjing University Of Chinese Medicine.Dictionary of traditional Chinese Medicine[M].Shanghai: Shanghai Scientific& Technical Publishers, 2006.
[4] 董金豹, 潘玉柱, 何涛.一种利用驴骨胶原蛋白及驴骨多肽制备补钙制品的方法: 中国, CN109007847A[P].2018-12-18.DONG J B, PAN Y Z, HE T.The invention relates to a method for preparing calcium supplement products by using donkey bone collagen and donkey bone polypeptide: China, CN109007847A[P].2018-12-18.
[5] 李兰杰, 魏子翔, 刘桂芹, 等.一种驴骨胶原粉、驴骨粉和驴骨油的制备方法: 中国, CN111041058A[P].2020-04-21.LI L J, WEI Z X, LIU G Q, et al.The invention relates to a preparation method of donkey bone collagen powder, donkey bone powder and donkey bone oil: China, CN111041058A[P].2020-04-21.
[6] 王蕾, 王子琼, 于露, 等.铁代谢及铁稳态失衡的研究进展[J].公共卫生与预防医学, 2022, 33(3): 1-5.WANG L, WANG Z Q, YU L, et al.Research progress of iron metabolismand iron homeostasis imbalance[J].Journal of Public Health and Preventive Medicine, 2022, 33(3): 1-5.
[7] OU K, LIU Y, ZHANG L, et al.Effect of neutrase, alcalase, and papain hydrolysis of whey protein concentrates on iron uptake by Caco-2 cells[J].Journal of agricultural and food chemistry,2010, 58(8): 4894-900.
[8] BRYSZEWSKA M A.Comparison study of iron bioaccessibility from dietary supplements and microencapsulated preparations[J].Nutrients, 2019, 11(2): 273.
[9] 管玲娟, 曹丛丛, 屠飘涵, 等.缺铁对肠道免疫功能的影响及新型补铁剂的研究进展[J].食品与发酵工业, 2020, 46(19):264-70.GUAN L J, CAO C C, TU P H, et al.Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J].Food and Fermentation Industries, 2020,46(19): 264-70.
[10] 曹丛丛.阿胶促铁吸收的活性成分及其铁螯合物的补血作用研究[D].无锡: 江南大学, 2021.CAO C C.Study on the active components of Colla Corii Asini promoting iron absorption and hematopoietic effect of their iron chelates[D].Wuxi: Jiangnan University, 2021.
[11] 曹丛丛, 管玲娟, 屠飘涵, 等.具有潜在补血活性的阿胶肽铁螯合物的结构表征[J].食品与发酵工业, 2021, 47(24):28-34.CAO C C, GUAN L J, TU P H, et al.Structural characterization of Ejiao peptide-iron chelates with potential hematopoietic effect[J].Food and Fermentation Industries, 2021, 47(24):28-34.
[12] CHENG X R, GUAN L J, MUSKAT M N, et al.Effects of Ejiao peptide-iron chelates on intestinal inflammation and gut microbiota in iron deficiency anemic mice[J].Food & Function,2021, 12(21): 10887-902.
[13] 潘玉柱, 董金豹.驴骨胶主料的生产方法和驴骨胶的生产方法: 中国, CN105558859A[P].2016-05-11.PAN Y Z, DONG J B.Production method of donkey bone glue main material and production method of donkey bone glue:China, CN105558859A[P].2016-05-11.
[14] 缪福俊, 熊智, 康柳.酶法制备驴骨多肽的工艺研究[J].安徽农业科学, 2010, 38(31): 17720-2+40.MIU F J, XIONG Z, KANG L.Study on enzymatic preparation technology of donkey bone peptide[J].Journal of Anhui Agricultural Sciences, 2010, 38(31): 17720-2+40.
[15] PAN A D, ZENG H Y, ALAIN G B, et al.Heat-pretreatment and enzymolysis behavior of the lotus seed protein[J].Food Chemistry, 2016, 201(2016): 230-6.
[16] 张永秀, 王世平, 周若兰.Flavourzyme蛋白酶酶解牛骨制备低聚肽的处理条件研究[J].食品工业科技, 2006, (7): 141-3.ZHANG Y X, WANG S P, ZHOU R L.Study on processing conditions of oligopeptides prepared by enzymatic hydrolysis of bovine bone with flavourzyme protease[J].Science and Technology of Food Industry, 2006(7): 141-3.
[17] LIN Y J, LE G W, WANG J Y, et al.Antioxidative peptides derived from enzyme hydrolysis of bone collagen after microwave assisted acid pre-treatment and nitrogen protection[J].International Journal of Molecular Sciences, 2010, 11(11): 4297-308.
[18] HE P, WANG Q, ZHAN Q, et al.Purification and characterization of immunomodulatory peptides from enzymatic hydrolysates of duck egg ovalbumin[J].Food Function, 2021,12(2): 668-81.
[19] 白玲燕.木瓜蛋白酶处理对牛肉品质影响的研究[J].食品安全导刊, 2021, (26): 122-4.BAI L Y.Effect of papain treatment on beef quality[J].China Food Safety Magazine, 2021(26): 122-4.
[20] 余杰, 陈美珍.酶法制备水解鳗鱼头蛋白及其应用的研究[J].食品工业科技, 2001, (1): 45-7.YU J, CHEN M Z.Enzymatic preparation of hydrolyzed eel head protein and its application[J].Science and Technology of Food Industry, 2001(1): 45-7.
[21] 尹乐斌, 何平, 刘桠丽, 等.酶解豆清液制备生物活性多肽工艺优化及抗氧化能力研究[J].食品安全质量检测学报,2021, 12(20): 8192-7.YIN L B, HE P, LIU Y L, et al.Optimization of enzymatic hydrolysis of soybean clear liquid for preparation of biologically active peptides and its antioxidant capacity[J].Journal of Food Safety & Quality, 2021, 12(20): 8192-7.
[22] 尹家琪, 康明丽, 韩敏义, 等.酶法制备鸡肺抗氧化肽及其序列分析[J].食品工业科技, 2021, 43(9): 1-20.YIN J Q, KANG M L, HAN M Y, et al.Enzymatic preparation and sequence analysis of antioxidant peptides from chicken lung[J].Science and Technology of Food Industry, 2021, 43(9): 1-20.
[23] 廖慧琦, 曹少谦, 杨华, 等.鲐鱼免疫活性肽的酶解工艺优化[J].食品工业科技, 2022: 1-11.LIAO H Q, CAO S Q, YANG H, et al.Enzymatic hydrolysis of immune active peptide in chub mackerel[J].Science and Technology of Food Industry, 2022: 1-11.
[24] YU L, SUN J, LIU S, et al.Ultrasonic-assisted enzymolysis to improve the antioxidant activities of peanut (Arachin conarachin L.) antioxidant hydrolysate[J].International Journal of Molecular Sciences, 2012, 13(7): 9051-68.
[25] 侯钰柯, 陆逸峰, 蒋宇飞, 等.肉杂鸡鸡骨架酶解工艺优化及其分析评价[J].食品工业科技, 2022, 43(9): 232-42.HOU Y K, LU Y F, JIANG Y F, et al.Optimization and evaluation of enzymatic hydrolysis process of hybrid broilers skeleton[J].Science and Technology of Food Industry, 2022,43(9): 232-42.
[26] 郑亚军, 史攀琪, 王国龙, 等.椰子球蛋白多肽-亚铁螯合物的制备工艺[J].热带作物学报, 2021, 42(5): 1485-91.ZHEN Y J, SHI P Q, WANG G L, et al.Preparation of coconut globulin peptide-ferrous chelate[J].Chinese Journal of Tropical Crops, 2021, 42(5): 1485-91.
[27] 崔洁芬, 杜春影, 迟永洲, 等.浒苔多糖铁的制备工艺优化及其结构表征[J].食品工业科技, 2018, 39(5): 161-5+70.CUI J F, DU C Y, CHI Y Z, et al.Optimization of preparation process of Enteromorpha prolifera polysaccharide-iron and its structure characterization[J].Science and Technology of Food Industry, 2018, 39(5): 161-5+70.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。