小米谷糠是小米加工过程中产生的副产物。小米谷糠中蛋白质组分含量约占15%,小米谷糠蛋白是人们广泛食用的优质谷物蛋白,小米谷糠蛋白氨基酸组成合理,比较接近世界卫生组织推荐的蛋白质的氨基酸比例,小米谷糠蛋白消化率高并且具有很低的过敏性,非常适合开发特殊人群及婴幼儿营养食品。小米谷糠蛋白还具有保健及抑制肿瘤细胞的作用[1]。
表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)在绿茶儿茶素成分中占比最高,EGCG含有多个酚羟基,具有抗菌、抗氧化、抗炎及抗病毒等特性[2]。由于EGCG安全性高且生物活性强,能够提高食品中蛋白质的营养价值或赋予食品更好的性能,延长食品保质期,因而广泛应用于各类食品[3]。
在食品体系中,EGCG会和蛋白质发生相互作用,进而改变食品体系中蛋白质的结构、功能,并进一步影响蛋白质的消化性质。因此EGCG与食品蛋白质相互作用的研究成为热点。近年来富含小米谷糠蛋白和 EGCG的相关食品已有报道[4-6],而并没有 EGCG与小米谷糠蛋白相互作用的研究,本文采用内源荧光光谱、同步荧光光谱、三维荧光光谱和紫外-可见光谱法研究 EGCG与小米谷糠蛋白的相互作用,为开发含有EGCG和小米谷糠蛋白天然成分的复合食品及改善其品质提供相应的理论基础。
1 材料与方法
1.1 主要材料与试剂
小米谷糠:河北威县保荣米业有限公司;EGCG(纯度≥98%):上海源纯生物科技有限公司;其它试剂均为分析纯:国药集团化学试剂有限公司等。
1.2 主要仪器与设备
Sorvall LYNX 6000高速落地离心机:美国Thermo Fisher公司;真空冷冻干燥机:北京亚星仪科科技发展有限公司;F4700荧光分光光度计:日本日立公司;T6紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 小米谷糠蛋白提取
参考曹阔[7]的方法并稍作修改。以小米谷糠为原料,磨粉过80目筛,然后用正己烷充分浸泡小米谷糠,料液比为1∶5(w/v),然后密封置于35 ℃的恒温箱中浸泡 12 h,后倒出上层溶剂,重复进行上述操作。抽滤后自然晾干就可得到脱脂小米谷糠。将小米谷糠与去离子水混合,料液比为1∶10(w/v),超声30 min后,将料液置于45 ℃的恒温搅拌器中充分搅拌4 h,搅拌期间不断用1 mol/L NaOH调整料液pH,并使得pH值始终保持在9.0,然后在4 ℃,8 500 r/min的条件下,将悬浮液离心 15 min,并将上清液用1 mol/L HCL调pH至4,静置20 min,然后在4 ℃,8 000 r/min的条件下将料液离心20 min,沉淀用水洗3次,加入适量的去离子水,将蛋白沉淀分散均匀,并用1 mol/L NaOH将蛋白调pH至7.0,冷冻干燥后得到实验用小米谷糠蛋白。
1.3.2 内源荧光光谱测定
用pH 7.4的0.02 mol/L磷酸盐缓冲液配制小米谷糠蛋白溶液浓度至1.5 mg/mL,将2 mL小米谷糠蛋白溶液加入10 mL试管中,随后加入不同体积浓度为2 mg/mL的EGCG溶液,再用pH 7.4的0.02 mol/L磷酸盐缓冲液将体积定容至3 mL,使得小米谷糠蛋白最终浓度为1 mg/mL,得到质量比为(1∶0、1∶0.005、1∶0.01、1∶0.02、1∶0.04、1∶0.06、1∶0.08、1∶0.10,小米谷糠蛋白∶EGCG,w/w)的小米谷糠蛋白- EGCG混合液,并将两者充分混合均匀,扫描前将样品置于17、25、37 ℃的恒温水浴锅中保温5 min。激发波长设置为 290 nm,发射波长设置为 300~450 nm,激发和发射狭缝宽度依次设置为5和10 nm,扫描速度设置为1 200 nm/min,在上述条件下测定小米谷糠蛋白的内源荧光光谱。
1.3.3 同步荧光光谱测定
样品制备方式同1.3.2,测定温度条件为298 K,分别设置Δλ=15 nm和Δλ=60 nm,激发狭缝宽度为5 nm,发射狭缝宽度为10 nm,扫描速度设置为1 200 nm/min,扫描波长范围为250~450 nm的小米谷糠蛋白同步荧光光谱。
1.3.4 三维荧光光谱测定
样品制备方式同1.3.2,测定温度条件为298 K,起始激发波长设置为 200 nm,激发波长范围为200~350 nm,发射波长范围为300~500 nm,激发狭缝宽度为5 nm,发射狭缝宽度为10 nm,扫描速度设置为1 200 nm/min,每间隔10 nm记录1次,共扫描21次。
1.3.5 紫外-可见光谱测定
配置浓度为1 mg/mL的小米谷糠蛋白溶液,取3 mL上述蛋白溶液于石英比色池中,扫描波长范围为250~500 nm内的吸收光谱,测定温度条件为298 K,扫描完毕后,将不同质量浓度的小米谷糠蛋白-EGCG混合液充分混匀后静置5 min加入到比色池中,在温度条件为298 K时扫描吸收光谱。将浓度为1 mg/mL的小米谷糠蛋白溶液作为空白,记录小米谷糠蛋白溶液的紫外-可见吸收差谱。
1.3.6 EGCG与小米谷糠蛋白结合距离的测定
配制浓度均为2×10-5 mol/L 的小米谷糠蛋白和EGCG溶液,在25 ℃的条件下恒温水浴保温5 min。EGCG的紫外光谱测定:移取2×10-5 mol/L的EGCG溶液3 mL于石英比色池中,扫描300~400 nm的紫外吸收光谱。小米谷糠蛋白溶液荧光光谱测定:移取3 mL小米谷糠蛋白溶液于石英比色池中,激发波长设置为290 nm,发射波长范围为300~400 nm,激发狭缝宽度为5 nm,发射狭缝宽度为10 nm,扫描速度设置为1 200 nm/min,测定温度条件为298 K。
1.4 数据分析
所有实验平行测定3次。采用Microsoft Excel 2010和Origin Pro 8处理数据和绘制图形。
2 结果与分析
2.1 EGCG与小米谷糠蛋白相互作用的荧光光谱
2.1.1 EGCG浓度对小米谷糠蛋白内源荧光光谱的影响
小米谷糠蛋白的内源荧光光谱可以反映蛋白中色氨酸、酪氨酸及苯丙氨酸残基附近微环境的改变。在本实验条件下,由于EGCG的浓度很小,所产生的荧光发射信号很弱,可以忽略EGCG对小米谷糠蛋白荧光信号的干扰,因而不考虑文中“内滤光效应”的干扰问题[8]。图1表明,随着EGCG浓度的增大,小米谷糠蛋白的荧光强度显著降低,说明EGCG大幅度淬灭了小米谷糠蛋白的内源荧光;同时,小米谷糠蛋白最大荧光发射波长由345 nm红移至368 nm,表明随着EGCG浓度的逐渐增大,小米谷糠蛋白的芳香族氨基酸残基微环境疏水性降低,极性增强,小米谷糠蛋白空间结构逐渐变得更加延伸[9]。
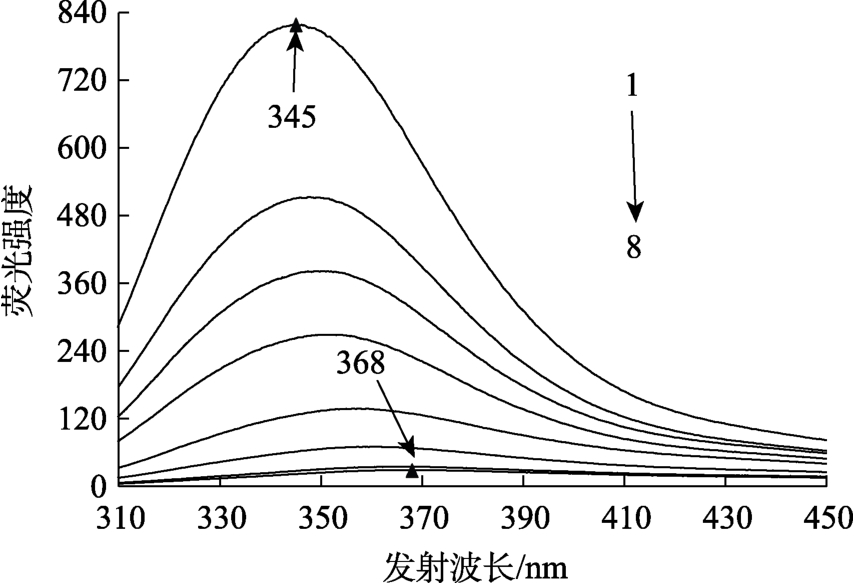
图1 不同浓度EGCG对小米谷糠蛋白内源荧光光谱的影响
Fig.1 Endogenous fluorescence spectra of millet bran protein at different concentrations of EGCG
注:小米谷糠蛋白质量浓度为1 mg/mL;1~8:EGCG质量浓度分别为 0、0.005、0.01、0.02、0.04、0.06、0.08、0.10 mg/mL。图2、图4同。
Note: The mass concentration of millet gluten protein is 1 mg/mL; 1-8: the mass concentration of EGCG is 0, 0.005, 0.01,0.02, 0.04, 0.06, 0.08, 0.10 mg/mL for curves 1 to 8.Figures 2 and 4 are the same as this one.
2.1.2 EGCG浓度对小米谷糠蛋白同步荧光光谱的影响
同步荧光光谱不仅可以区分开小米谷糠蛋白酪氨酸残基和色氨酸残基特征光谱,还可进一步判断EGCG与小米谷糠蛋白相互作用位点更接近酪氨酸残基或色氨酸残基。Δλ=15 nm 和 Δλ=60 nm时分别显示酪氨酸残基和色氨酸残基的光谱特征[10]。由图2可以看出,Δλ=15时,小米谷糠蛋白酪氨酸残基的同步荧光强度随着EGCG浓度的增加而降低,最大发射波长由359.4 nm红移至367.4 nm,当Δλ=60 nm时,小米谷糠蛋白色氨酸残基的同步荧光强度随着EGCG浓度的增加降低,最大发射波长由289.4 nm红移至292.2 nm,随着EGCG浓度的升高,色氨酸残基的同步荧光强度降低程度更明显,表明EGCG和小米谷糠蛋白相互作用同时影响酪氨酸残基和色氨酸残基微环境的疏水性,但对色氨酸残基周围微境影响程度更大,EGCG在小米谷糠蛋白上的结合位点更靠近色氨酸残基,小米谷糠蛋白结构变得疏松,与内源荧光光谱结果一致。由于不考虑“内滤光效应”的干扰,Δλ=15 nm 的光谱峰型出现锯齿状,笔者认为其与灵敏度参数设置有关,具体原因有待进一步研究。
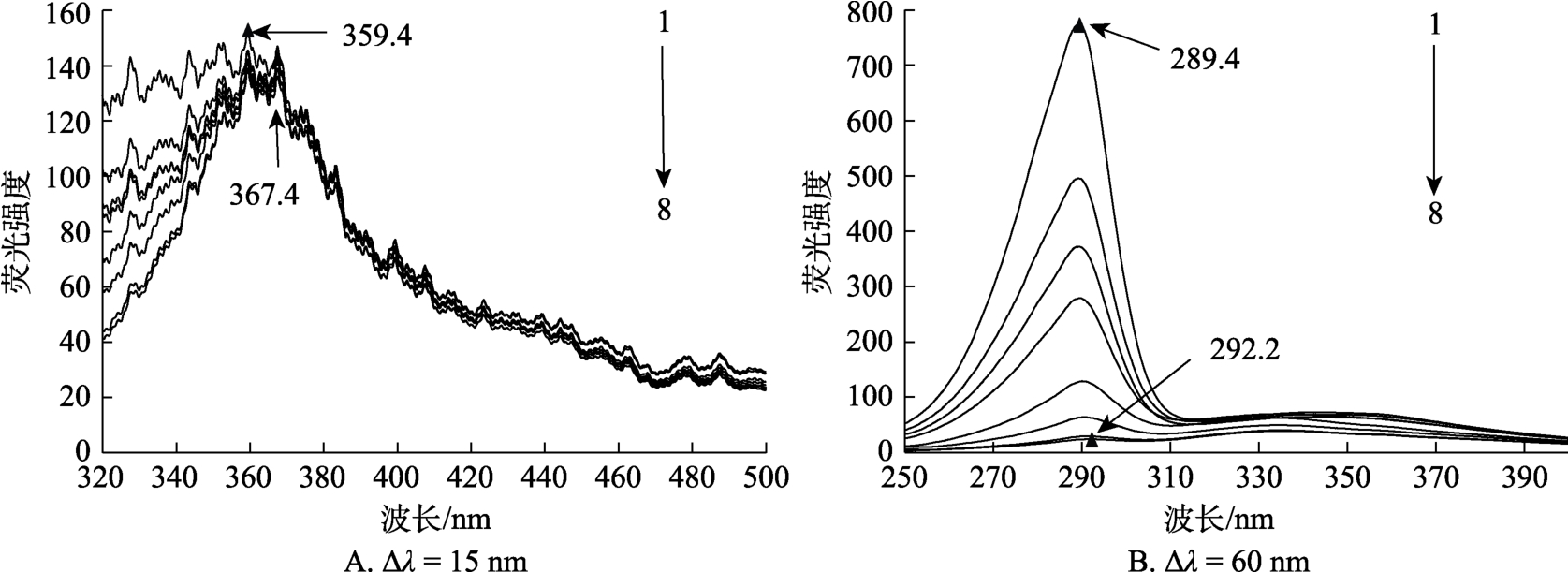
图2 不同浓度EGCG对小米谷糠蛋白同步荧光光谱的影响
Fig.2 Synchronous fl uorescence spectra of millet bran protein with different concentrations of EGCG
2.1.3 EGCG浓度对小米谷糠蛋白三维荧光光谱的影响
三维荧光光谱中的峰位、颜色和指纹信息可以反映蛋白质的荧光强度和构象变化。如图3所示,峰a(Ex=Em)为瑞利散射峰,峰b(Em= 2Ex)为二级散射峰,峰1为小米谷糠蛋白色氨酸和酪氨酸残基特征峰,峰2代表多肽链主链上的C==O结构的π→π*跃迁产生的荧光峰[9]。如图3所示,加入EGCG后,峰1颜色明显变浅,等高线变得明显稀疏,表明EGCG能淬灭小米谷糠蛋白荧光,EGCG与小米谷糠蛋白之间存在相互作用。峰 2颜色变浅,面积发生改变,表明小米谷糠蛋白质多肽链骨架结构发生改变。表1中的峰1数据显示,小米谷糠蛋白的色氨酸和酪氨酸残基的最大发射波长出现了红移,说明小米谷糠蛋白色氨酸和酪氨酸残基周围的微环境极性增强,疏水性降低,与小米谷糠蛋白的内源荧光和同步荧光光谱变化结果一致。峰b的荧光强度下降的原因可能是两者相互作用使小米谷糠蛋白表面的保护水层受到破坏,小米谷糠蛋白更加分散,导致小米谷糠蛋白粒径变小,降低了小米谷糠蛋白的光散射作用,从而降低二级散射峰的荧光强度,表明EGCG和小米谷糠蛋白相互作用形成不发光基态复合物。
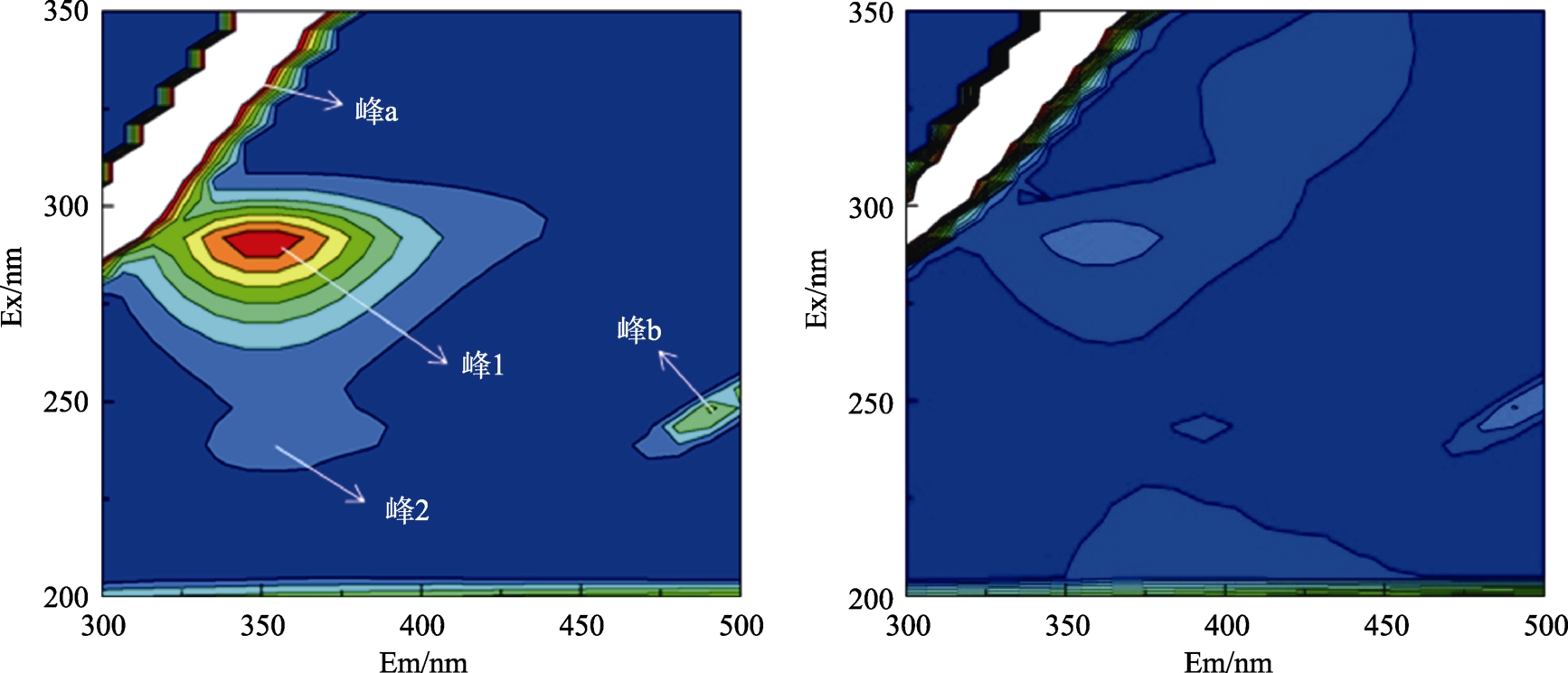
图3 未添加EGCG和EGCG浓度为0.04 mg/mL的小米谷糠蛋白等高线图
Fig.3 Contour map of millet bran protein and EGCG-millet bran protein system (0.04 mg/mL)
表1 EGCG-小米谷糠蛋白体系三维荧光光谱特征参数
Table 1 Characteristic parameters for the three-dimensional fluorescence spectra of EGCG and millet bran protein system
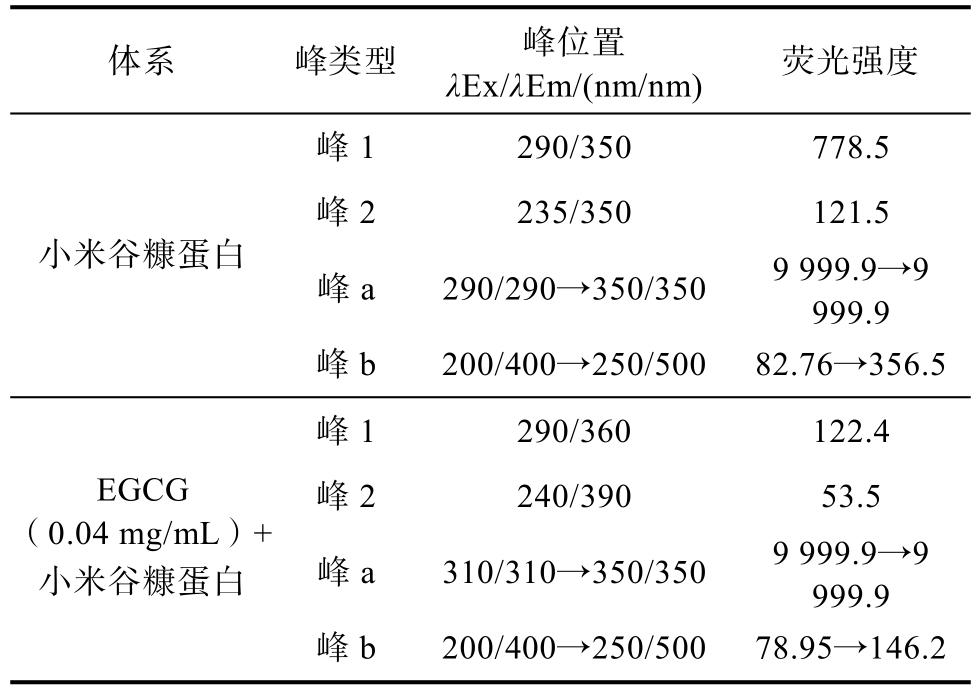
体系 峰类型 峰位置λEx/λEm/(nm/nm) 荧光强度峰1 290/350 778.5峰2 235/350 121.5峰a 290/290→350/350 9 999.9→9 999.9小米谷糠蛋白峰b 200/400→250/500 82.76→356.5峰1 290/360 122.4峰2 240/390 53.5峰a 310/310→350/350 9 999.9→9 999.9 EGCG(0.04 mg/mL)+小米谷糠蛋白峰b 200/400→250/500 78.95→146.2
2.2 EGCG与小米谷糠蛋白相互作用的紫外-可见吸收光谱
紫外-可见吸收光谱是研究复合物形成和蛋白质结构变化的简单而有效的方法[11]。动态猝灭只影响到蛋白分子的激发态,不会改变蛋白的紫外吸收光谱,静态猝灭由于生成新的基态复合物而导致吸收光谱的改变。蛋白的特征吸收峰(大约280 nm)主要是包括色氨酸、酪氨酸、苯丙氨酸在内的芳香族氨基酸的吸收峰[12]。由图4可得,随着EGCG含量增加,小米谷糠蛋白吸光度逐渐上升,表明EGCG与小米谷糠蛋白相互作用形成基态复合物。随着EGCG浓度的增加,芳香族氨基酸最大吸收峰波长发生红移,与同步荧光结果的变化一致,一方面可能是由于小米谷糠蛋白中色氨基酸残基被EGCG结合,另一方面可能是两者相互作用使色氨酸残基位置发生移动,新的共轭体系由此产生,使π-π*跃迁能量增大[13]。耿子蔚[12]等研究不同茶汤与乳清蛋白相互作用时紫外-可见吸收光谱峰型也出现锯齿状,笔者认为其与灵敏度参数设置有关,具体原因有待进一步研究。
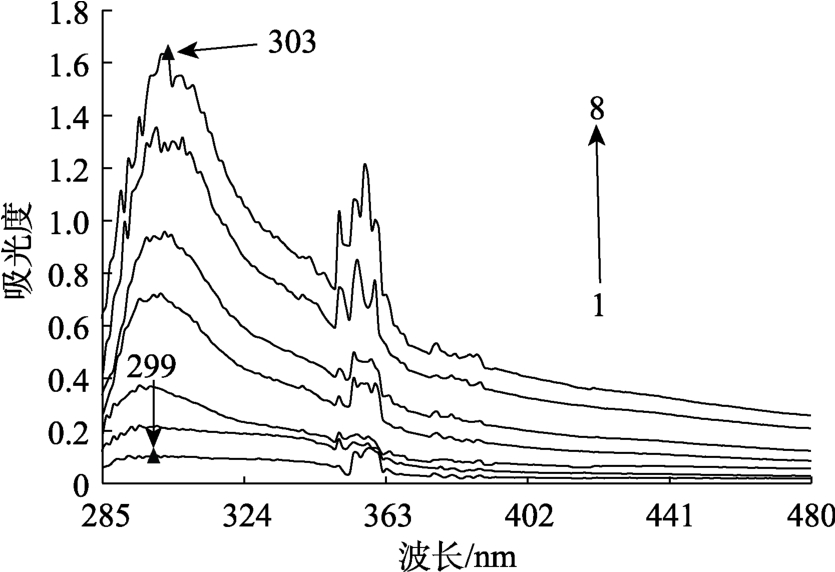
图4 不同浓度EGCG对小米谷糠蛋白紫外-可见吸收光谱的影响
Fig.4 UV-Vis absorption spectra of millet bran protein with different mass concentrations of EGCG
2.3 EGCG与小米谷糠蛋白相互作用机制
2.3.1 荧光淬灭机制
内源荧光光谱结果表明,EGCG能显著淬灭小米谷糠蛋白的荧光,分析它们的淬灭机制可以更准确地判断两者相互作用是否形成了复合物。荧光淬灭机制总共包括3类,分别为静态淬灭机制、动态淬灭机制和动态静态混合淬灭机制。动态猝灭是猝灭剂和处在激发态的荧光物质碰撞而引发,随着温度升高,动态猝灭常数增大。静态猝灭是猝灭剂和处于基态的荧光物质形成了复合物,随着温度升高,复合物的稳定性下降,因此猝灭常数随着温度升高而降低[14]。可采用Stern-Volmer方程[13]计算不同温度下的淬灭常数,由此判断EGCG与小米谷糠蛋白相互作用淬灭机制。
Stern-Volmer方程如下:
式中:F0和F分别是EGCG加入前后的小米谷糠蛋白荧光强度;[Q]是EGCG浓度(mol/L);Kq 为双分子猝灭速率常数(L/(mol·s));Ksv 为动态猝灭常数(L/mol);τ0为不存在猝灭剂时荧光体的寿命(生物大分子的平均寿命约为10-8 s)。
由图5中直线的斜率得到Ksv,由τ0得到Kq(表2)。当R2不大于0.98时,表明淬灭机制可能为动态静态混合淬灭[15]。由图5所示,EGCG浓度较低时,Stern-Volmer曲线呈现较好的线性关系,EGCG浓度较高时,Stern-Volmer曲线逐渐偏向纵坐标轴,表明EGCG与小米谷糠蛋白相互作用同时存在静态淬灭和动态淬灭[16],随着温度升高,Ksv的值不断增大,表明 EGCG与小米谷糠蛋白相互作用存在动态淬灭机制。另外,由于不同温度下Kq达到1012或1013,显著高于最大动态猝灭速率常数(约为 2×1010 L/(mol·s)),表明 EGCG 对小米谷糠蛋白的猝灭机制也存在静态淬灭,结合分析荧光光谱和紫外-可见吸收光谱的变化结果,静态淬灭在EGCG淬灭小米谷糠蛋白荧光过程中起主导作用 [17]。
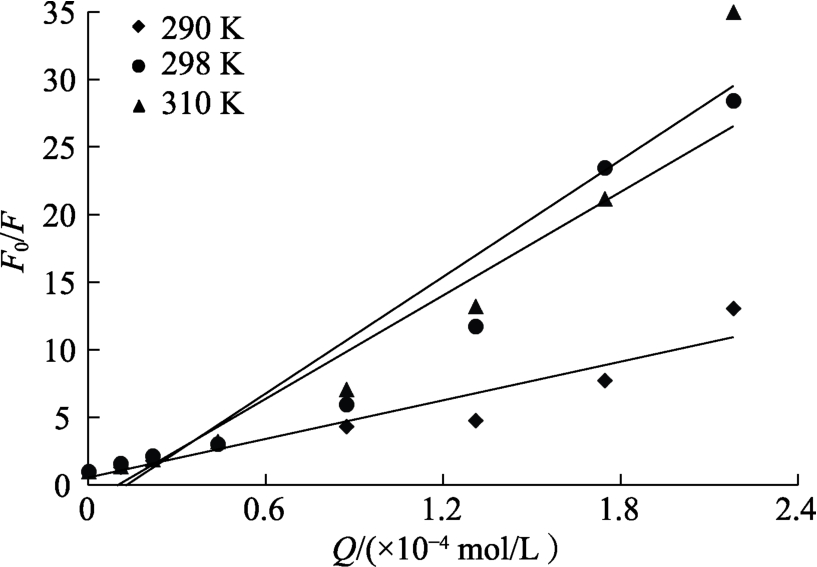
图5 不同温度条件下EGCG对小米谷糠蛋白荧光猝灭的Stern-Volmer方程曲线图
Fig.5 Stern-Volmer plots of millet bran protein interacting with EGCG at different temperatures
表2 EGCG-小米谷糠蛋白复合物的荧光淬灭常数及相关系数
Table 2 Quenching rate constants and correlation coef fi cients of millet bran protein and EGCG

温度/K Ksv/(L/moL) Kq/(L/(mol·s)) 相关系数R2 290 4.761 0×104 4.761 0×1012 0.910 3 298 1.276 4×105 1.276 4×1013 0.940 0 310 1.439 7×105 1.439 7×1013 0.928 2
2.3.2 EGCG-小米谷糠蛋白复合物的结合常数、结合位点数
可以采用以下等式确定结合常数(KA)和结合位点数(n)[12]:
式中:F0表示没有加入EGCG时的荧光强度;F表示加入EGCG时的荧光强度;KA为表观结合常数;n为结合位点数;[Q]为EGCG的浓度。
从图6和表3中可以看出,结合常数KA的数量级为106,相关研究报道EGCG与乳清蛋白[12]相互作用KA数量级是104,表明EGCG与小米谷糠蛋白之间结合力更强,可能是由于小米谷糠蛋白与乳清蛋白结构不同导致两者数量级出现差异。随着温度升高,KA值不断增大,一方面说明EGCG对小米谷糠蛋白的淬灭反应是吸热反应,同样也表明其淬灭过程有动态淬灭。在三个不同温度条件下,结合位点数n全部约等于1,表明EGCG和小米谷糠蛋白形成1个结合位点。
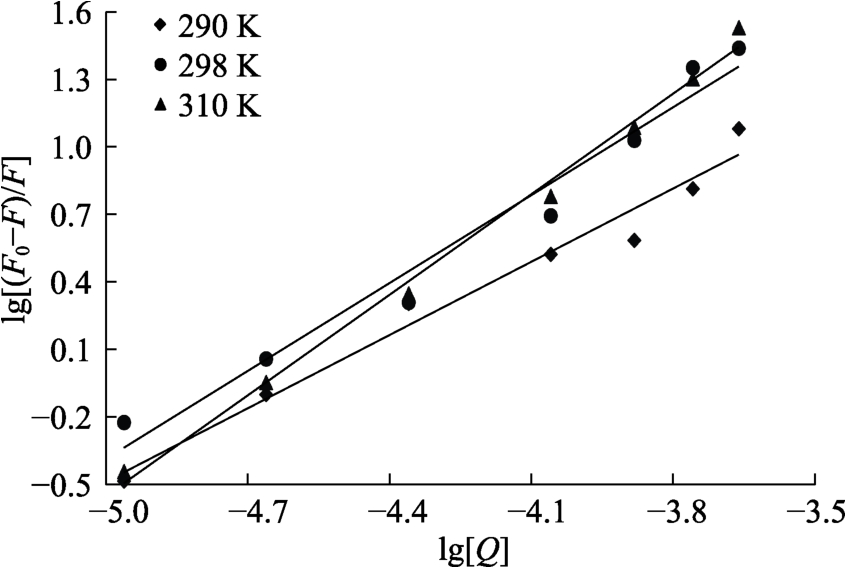
图6 不同温度条件下EGCG荧光猝灭小米谷糠蛋白的双对数曲线
Fig.6 Double logarithmic curves of millet bran protein quenched by EGCG at different temperatures
表3 EGCG-小米谷糠蛋白复合物的结合位点数、表观结合常数及相关系数
Table 3 Apparent binding constants, binding sites numbers,and correlation coefficients of millet bran protein and EGCG
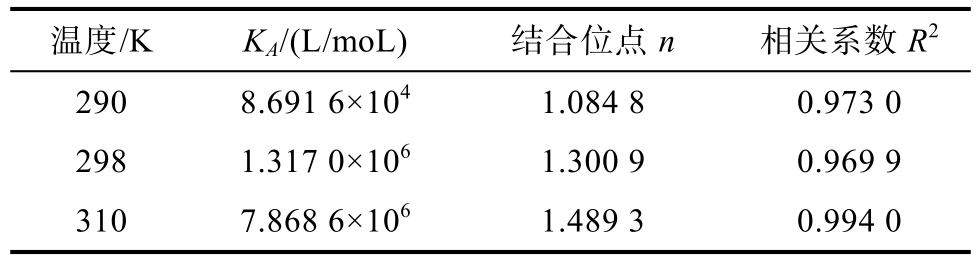
温度/K KA/(L/moL) 结合位点n 相关系数R2 290 8.691 6×104 1.084 8 0.973 0 298 1.317 0×106 1.300 9 0.969 9 310 7.868 6×106 1.489 3 0.994 0
2.3.3 EGCG-小米谷糠蛋白复合物的热力学参数和作用力类型
反应条件相对温和时(如酸性、中性等),多酚类小分子和蛋白质形成复合物的作用力主要包括疏水相互作用、氢键、范德华力、静电引力等非共价结合作用,作用力的主要类型由热力学参数 ΔH和 ΔS是来判断。当 ΔH>0、ΔS>0时,作用力主要是疏水相互作用;当ΔH<0、ΔS<0时,作用力主要是氢键和范德华力;当 ΔH<0、ΔS>0时,作用力是静电引力;当ΔH>0、ΔS<0时,分子间的作用力类型主要是疏水相互作用和静电引力[18]。可采用 Van’t Hoff方程[18]来判断 EGCG 与小米谷糠蛋白的作用力类型。
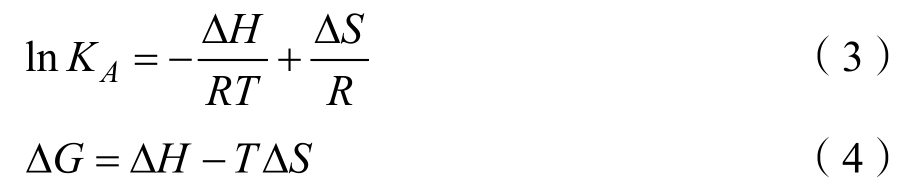
式中:R为气体常数 8.314 J/(K·mol);T 为实验温度;KA为不同温度的结合常数(见表3)。
如表4所示,ΔG<0,表明EGCG与小米谷糠蛋白的反应可自发进行。ΔH>0,表明 EGCG与小米谷糠蛋白之间反应为吸热反应,升温有利于反应进行,这与表3计算的KA随温度升高而增大一致。ΔH>0、ΔS>0表明EGCG与小米谷糠蛋白相互作用力类型主要是疏水相互作用。
表4 不同温度下EGCG与小米谷糠蛋白相互作用的热力学参数
Table 4 Thermodynamic parameters for interaction between EGCG and millet bran protein
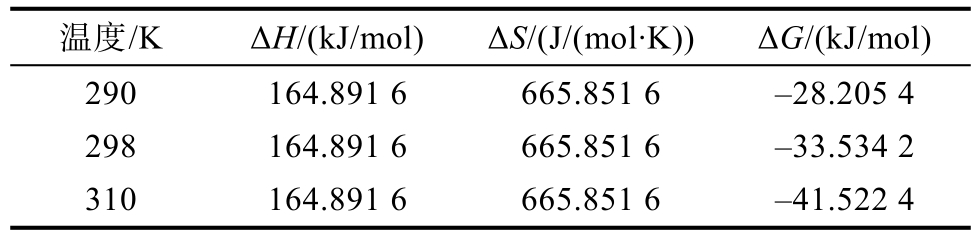
温度/K ΔH/(kJ/mol) ΔS/(J/(mol·K)) ΔG/(kJ/mol)290 164.891 6 665.851 6 -28.205 4 298 164.891 6 665.851 6 -33.534 2 310 164.891 6 665.851 6 -41.522 4
2.3.4 EGCG与小米谷糠蛋白的能量转移和结合距离
根据 Föster’s偶极-偶极非辐射能量转移理论,蛋白质和小分子配体之间发生能量转移需要满足以下条件:蛋白质给体能发射荧光,蛋白荧光发射光谱与小分子配体的紫外吸收光谱有重叠,蛋白质与配体间结合距离小于7 nm。由以下公式可计算两者重叠积分J、能量转移效率E、结合距离r及临界能量转移距离R0[19]。
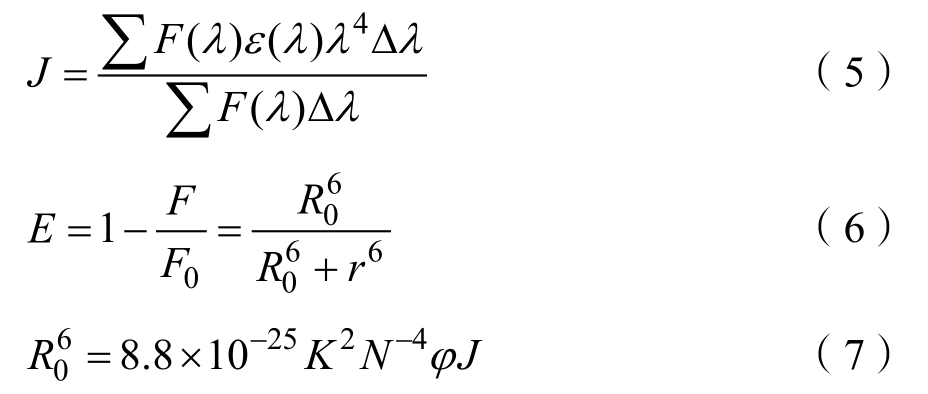
式中,F(λ)为蛋白质给体在波长 λ处的荧光强度;E为能量转移效率;F和F0分别表示添加淬灭剂前后蛋白荧光强度;ε(λ)则为小分子配体在波长 λ处摩尔消光系数;J是重叠面积积分;R0是指能E=50%时的临界距离;r为结合距离;K2为偶极空间取向因子(值为2/3);N为介质折射指数(值为1.336);Φ为给体荧光量子效率(值为 0.118)。
由图 7根据公式(7)计算得 J=1.207 2×10-14 (cm3·L/mol),E=0.602 9,R0=2.530 1 nm,r=2.341 8 nm。结合距离远远小于7 nm,而且结合距离符合0.5 R0<r<1.5 R0,这表明小米谷糠蛋白与EGCG存在非辐射能量转移。EGCG淬灭小米谷糠蛋白荧光原因可能是两者之间存在非辐射能量转移引起的[19]。同时,EGCG与小米谷糠蛋白结合距离r值较小同样表明两者之间存在相互作用。
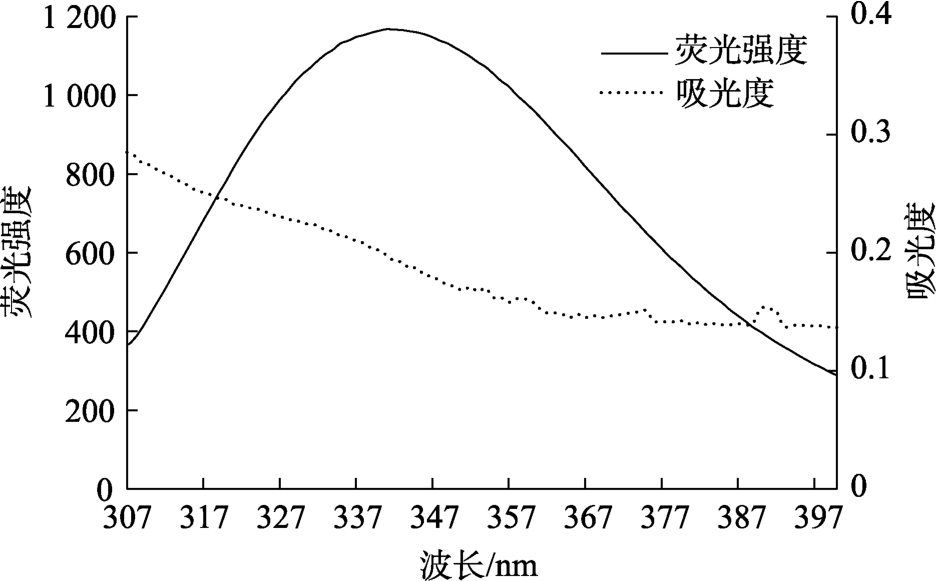
图7 EGCG紫外吸收光谱和小米谷糠蛋白荧光发射光谱重叠图
Fig.7 Spectral overlap of EGCG absorption spectrum and millet bran protein fl uorescence spectrum
2.3.5 EGCG与小米谷糠蛋白结合率的预测
EGCG的小米谷糠蛋白结合率能直观的体现出EGCG-小米谷糠相互作用强度。当两者相互作用达到动态平衡时,同时两者结合位点数接近 1时,可以建立两者结合率的理论模型。以下公式可表征结合常数(KA)和结合率(Y)之间的关系[20]:
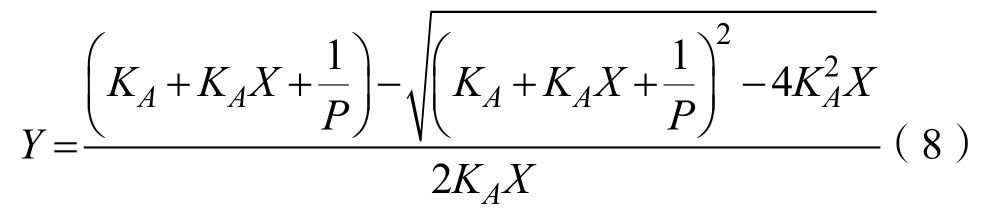
式中,Y是结合率;KA结合常数;P是小米谷糠蛋白浓度;X是EGCG与小米谷糠蛋白的浓度比。运用公式(8)计算不同温度时 EGCG的小米谷糠蛋白结合率。
如图8所示,EGCG 的小米谷糠蛋白结合率具有明显的浓度依赖性,随着EGCG浓度增大,结合率逐渐减小,温度变化对结合率产生影响,尤其是 290 K时变化较明显。由图 8得到温度290、298、310 K时的两者浓度比与结合率曲线方程如下:
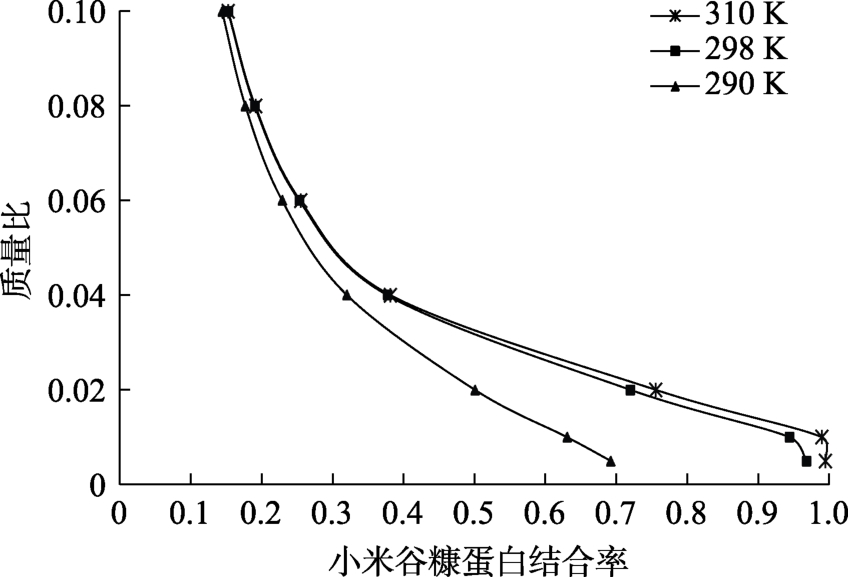
图8 不同温度条件下EGCG与小米谷糠蛋白的结合率
Fig.8 Binding rate of millet bran protein and EGCG at different temperatures
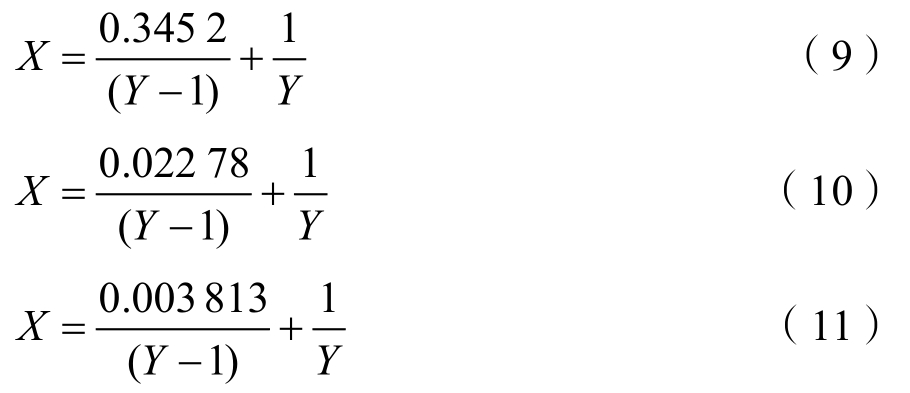
由公式可见,当EGCG与小米谷糠蛋白浓度在一定范围内波动时,EGCG的小米谷糠蛋白结合率可能出现指数级变化,可以通过测定EGCG和小米谷糠蛋白浓度比,由公式(9)~(11)计算其结合率。
3 结论
通过内源荧光光谱、同步荧光光谱、三维荧光光谱和紫外-可见光谱法研究了 EGCG与小米谷糠蛋白的相互作用,内源荧光光谱结果和同步荧光光谱结果均表明EGCG与小米谷糠蛋白之间存在相互作用,主要影响的是色氨酸残基在空间结构中所处的微环境。三维荧光、紫外-可见光谱均证明EGCG影响了色氨酸和酪氨酸残基微环境并使小米谷糠蛋白质多肽链的骨架发生变化。EGCG引起的小米谷糠蛋白荧光淬灭机制是动静态混合猝灭,但以静态淬灭为主。EGCG和小米谷糠蛋白结合常数KA的数量级可达106,且结合位点数约为1。热力学参数表明EGCG和小米谷糠蛋白主要以疏水相互作用结合形成复合物,反应可自发进行。同时,EGCG与小米谷糠蛋白之间结合距离远小于7 nm,两者存在能量转移。最后,建立了EGCG与小米谷糠蛋白结合率的理论模型,发现 EGCG的小米谷糠蛋白结合率随着EGCG浓度的增大而减小,温度变化对EGCG的小米谷糠蛋白结合率产生影响。
[1] 曹阔, 吴兴雨, 孙凯杨, 等.响应面分析法优化酶法提取小米谷糠蛋白工艺[J].江苏农业科学, 2021, 49(18): 169-173.CAO K, WU X Y, SUN K Y, et al.Response surface methodology to optimize enzymatic extraction of millet bran protein[J].Jiangsu Agricultural Sciences, 2021, 49(18): 169- 173.
[2] PANG X H, YANG Y, BIAN X, et al.Hemp (Cannabis sativa L.) seed protein-EGCG conjugates: Covalent bonding and functional research[J].Foods, 2021, 10(7): 1618.
[3] YANG R, LIU Y Q, XU J J, et al.Interaction between rice bran albumin and epigallocatechin gallate and their physicochemical analysis[J].Food Science and Biotechnology, 2018, 27(6):1561-1569.
[4] 吴茜, 周崇禅, 张任虎, 等.一种川式泡椒风味特色调味料及其制备方法[P].四川省: CN114098043A, 2022-03-01.WU Q, ZHOU C C, ZHANG R H, et al.A Sichuan-style pickled pepper flavor special seasoning and its preparation method[P].Sichuan Province: CN114098043A, 2022-03-01.
[5] 王慕贞.一种降血脂功能性饮料及其制备方法[P].广东省:CN109463595A, 2019-03-15.WANG M Z.A hypolipidemic functional drink and its preparation method[P].Guangdong Province: CN109463595A,2019-03-15.
[6] 冯翠萍, 常明昌, 孟俊龙, 等.具有小米风味的食用菌食品及其制备方法[P].山西省: CN113907333A, 2022-01-11.FENG C P, CHANG M C, MENG J L, et al.Edible mushroom food with millet flavor and its preparation method[P].Shanxi Province: CN113907333A, 2022-01-11.
[7] 曹阔.小米谷糠蛋白的分离提取及功能性质研究[D].河北北方学院, 2019.CAO K.Isolation, extraction and functional properties of millet bran protein[D].Hebei North University, 2019.
[8] 苗向硕, 吴伟, 吴晓娟.表没食子儿茶素没食子酸酯和米糠蛋白的相互作用[J].中国粮油学报, 2019, 34(12): 19-26.MIAO X S, WU W, WU X J.Interaction between epigallocatechin gallate and rice bran protein[J].Chinese Journal of Cereals and Oils, 2019, 34(12): 19-26.
[9] YOU Y, YANG L, CHEN H, et al.Effects of Epigallocatechin-3-gallate on the functional and structural properties of soybean protein isolate[J].Journal of Agricultural and Food Chemistry,2021, 69(10): 2306-2315.
[10] 黄渊, 岳世阳, 熊善柏, 等.2种天然抗氧化剂与鲢鱼肌球蛋白的相互作用[J].食品科学, 2019, 40(4): 14-20.HUANG Y, YUE S Y, XIONG S B, et al.Interaction between two natural antioxidants and silver carp myosin[J].Food Science, 2019, 40(4): 14-20.
[11] 吴云雪, 李娟, 高晴, 等.EGCG与乳清蛋白相互作用的光谱分析[J].食品研究与开发, 2020, 41(1): 7-13.WU Y X, LI J, GAO Q, et al.Spectral analysis of the interaction between EGCG and whey protein[J].Food Research and Development, 2020, 41(1): 7-13.
[12] 耿子蔚, 丁玉婕, 童群义.不同茶汤与乳清蛋白相互作用的研究[J/OL].食品与发酵工业, 2022: 1-10.GENG Z W, DING Y J, TONG Q Y.Study on the interaction between different tea soups and whey protein[J/OL].Food and Fermentation Industry, 2022: 1-10.
[13] YANG Y X, WANG Q M, LEI L A, et al.Molecular interaction of soybean glycinin and β-conglycinin with -epigallocatechin gallate induced by pH changes-ScienceDirect[J].Food Hydrocolloids,2020, 108: 1-10.
[14] HE Z Y, CHEN J, MOSER S E, et al.Interaction of β-casein with (-)-epigallocatechin-3-gallate assayed by fluorescence quenching: effect of thermal processing temperature[J].International Journal of Food Science and Technology, 2016,51(2): 342-348.
[15] 李军, 毕艳兰, 孙尚德, 等.叔丁基对苯二酚及其氧化产物与牛血清蛋白的相互作用[J].中国粮油学报, 2017, 32(4):133-140.LI J, BI Y L, SUN S D, et al.Interaction of tert-butyl hydroquinone and its oxidation products with bovine serum albumin[J].Chinese Journal of Cereals and Oils, 2017, 32(4):133-140.
[16] BOSE A.Interaction of tea polyphenols with serum albumins: A fluorescence spectroscopic analysis[J].Journal of Luminescence,2016, 169: 220-226.
[17] HE Z Y, CHEN Y, MOSER S E, et al.Interaction of beta-casein with (-)-epigallocatechin-3-gallate assayed by fluorescence quenching: effect of thermal processing temperature[J].International Journal of Food Science and Technology, 2016: 51: 342-348.
[18] 付珊琳, 钟俊桢, 姚文俊, 等.去折叠态β-乳球蛋白与表没食子儿茶素没食子酸酯的相互作用[J].食品科学, 2019,40(4): 7-13.FU S L, ZHONG J Z, YAO W J, et al.Interaction between unfolded β-lactoglobulin and epigallocatechin gallate[J].Food Science, 2019, 40(4): 7-13.
[19] JIA J J, GAO X, HAO M H, et al.Comparison of binding interaction between β-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J].Food Chemistry, 2017, 228: 143-151.
[20] LIU X, YING X X, LI Y L, et al.Identification differential behavior of Gd@C-82(OH)(22) upon interaction with serum albumin using spectroscopic analysis[J].Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 2018, 203:383-396.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。