玉米种植历史悠久,世界范围内广泛种植。2012年起,我国玉米的种植面积和产量均首次超越水稻,成为我国第一大粮食作物[1]。玉米中淀粉含量最高,约为 64%~78%,玉米淀粉由直链淀粉和支链淀粉组成。根据直链淀粉含量不同,玉米可分为普通玉米、蜡质玉米、高直链玉米。普通玉米来源广泛、价格低廉。普通玉米淀粉通常是由23%~27%的直链淀粉和 73%~77%的支链淀粉组成,淀粉糊黏度高,易形成凝胶,在食品工业中常用作增稠剂、稳定剂、胶凝剂[2]。脂肪酸是构成油脂的重要组分,油脂是食品加工的重要配料,能有效改善食品的风味、口感、外观和货架期。食品加工中,脂肪酸可通过疏水相互作用与淀粉相互作用,形成具有单链螺旋结构的淀粉-脂肪酸复合物,提高淀粉的抗消化能力[3-4],避免餐后血糖水平急剧升高,为人们提供健康有益的低血糖食品[5]。
淀粉-脂肪酸复合物制备方法很多,如HCl/KOH法、二甲亚砜/H2O法、蒸汽喷射法、挤压蒸煮法等[5]。与其他方法相比,挤压法制备淀粉-脂肪酸复合物具有加工周期短、能耗低、生产加工连续性强等优点[6]。Bhatnagar等[7]和Cervantes-Ramírez等[1]研究表明挤压处理能促进淀粉与脂肪酸形成淀粉-脂肪酸复合物。与单一挤压处理相比,挤压处理后再进行低温贮藏处理能有效提高淀粉的抗消化性。Neder-Suárez等[6]研究表明挤压玉米淀粉经低温冷藏处理后,抗性淀粉含量明显增加。Zhang等[8]研究表明挤压处理结合低温贮藏能提高大米淀粉的相对结晶度和老化焓值。目前挤压处理结合低温贮藏主要集中于单一淀粉消化性质的研究,挤压法制备淀粉-脂肪酸复合物的研究也多集中于复合物理化性质、晶体结构、消化性质等方面,然而挤压处理结合低温贮藏制备淀粉-脂肪酸复合物及其对复合物的结构和消化性质影响的研究很少。本研究以普通玉米淀粉和月桂酸为原料,采用差示扫描量热仪、X射线衍射仪等方法系统研究了挤压处理结合低温贮藏对普通玉米淀粉-月桂酸复合物糊化度、复合指数、热性质、结晶结构及消化性质的影响,以期为淀粉-脂肪酸复合物和抗消化淀粉食品的制备提供参考。
1 材料与方法
1.1 材料与试剂
普通玉米淀粉:诸城兴贸玉米开发有限公司;月桂酸:天津市巴斯夫化工有限公司;猪胰α-淀粉酶(1.96×104 U/g):美国Sigma公司;糖化酶(1×105 U/g):潍坊康地恩生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
DS30-Ⅱ实验双螺杆主机(螺杆直径30 mm,长径比22.67,螺杆长度820 mm,圆形模头,模孔直径为4 mm):济南赛信机械有限公司;MB25水分测定仪:奥豪斯仪器(常州)有限公司;DSC1型差示扫描量热仪:瑞士Mettler-Toledo集团;is10型傅里叶红外光谱分析仪:美国热电尼高力公司。
1.3 实验方法
1.3.1 样品制备
(1)挤压普通玉米淀粉
将普通玉米淀粉的水分含量调至40%,装入密封袋中,室温下平衡水分12 h。设置双螺杆挤压机机腔三个区的温度分别为:40 ℃、100 ℃、120 ℃,主机转速15 Hz,喂料速度15 Hz。挤出后样品分为两部分:一部分样品直接在 40 ℃鼓风干燥箱中干燥 12 h,粉碎过 100目筛,记为CS40;另一部分置于4 ℃储藏12 h,再在40 ℃鼓风干燥箱中干燥12 h,粉碎过100目筛,样品记为CSR40。未经挤压处理的淀粉样品记为对照CS。
(2)挤压普通玉米淀粉-月桂酸复合物
向普通玉米淀粉中添加4%的月桂酸,混合均匀后将水分含量调至40%,装入密封袋中,室温下平衡水分12 h。设置双螺杆挤压机机腔三个区的温度分别为:40 ℃、100 ℃、120 ℃,主机转速15 Hz,喂料速度15 Hz。挤出后样品分为两部分:一部分样品直接在 40 ℃鼓风干燥箱中干燥12 h,粉碎过100目筛,记为CSLA40;另一部分置于4 ℃储藏12 h,再在40 ℃鼓风干燥箱中干燥 12 h,粉碎过 100目筛,样品记为CSLAR40。
1.3.2 糊化度测定方法
称取50 mg样品置于10 mL离心管中,加入4 mL醋酸缓冲液(pH 4.75),置于59 ℃水浴中。加入1 mL糖化酶(50 U/mL),混匀。水浴震荡45 min,期间每隔10 min涡旋一次。然后沸水浴加热10 min,灭酶。3 500 r/min离心10 min。取上清液50 μL,用DNS法测定还原糖含量。未经挤压处理的普通玉米淀粉作为空白对照,其他操作处理同上。糊化度为样品吸光值与全糊化样品吸光值的比值。
1.3.3 复合指数的测定
参照作者[5]之前的实验方法,并进行改进。称取0.01 g样品,加入0.1 mL无水乙醇,再加入0.9 mL NaOH溶液,沸水浴10 min。沸水浴后加入2 mL乙醇和5 mL水,3 500 r/min离心10 min。取上清液0.12 mL,加入2.88 mL水和4 mL碘液,静置10 min,在690 nm条件下测定吸光值。复合指数(complex index, CI)计算公式如下:
CI=(原淀粉的吸光值-复合物的吸光值)/原淀粉的吸光值×100%
1.3.4 热性质分析
参照赵阳等[9]的方法,准确称取样品干重7 mg,置于铝坩埚中,样品与水的质量比为1∶3,压盖后常温静置24 h以平衡水分。设定温度扫描范围30~130 ℃,升温速率10 ℃/min,记录起始糊化温度(To)、峰值糊化温度(Tp)、终止糊化温度(Tc)和糊化焓(ΔH)。
1.3.5 X射线衍射分析
参照陈海华等[4]的方法,采用单色Cu-Ka射线,管电压40 kV,管电流40 mA,2θ扫描范围4°~45°,扫描速率 5°/min。测定 CSLA 复合物的X射线衍射图谱。利用Jade 5.0软件对X射线图谱进行分析,计算样品的相对结晶度。
1.3.6 营养片段分析
(1)葡萄糖标准曲线的测定
采用 3,5-二硝基水杨酸(DNS)法测定还原糖含量。在540 nm波长测定光透射强度,并绘制葡萄糖标准曲线。拟合葡萄糖浓度与吸光值关系方程为:y=1.220 7x-0.032 2, R2=0.996 7,其中x为葡萄糖浓度,单位mg/mL,y为540 nm透射光相对强度。
(2)营养片段测定
根据Englyst等[10]的方法,称取400 mg样品于50 mL离心管中,加入25 mg瓜尔豆胶,5个玻璃球,20 mL缓冲液(pH 5.2),于37 ℃下平衡 5 min。加入 10 mL酶液(猪胰 α-淀粉酶290 U/mL,糖化酶 15 U/mL),每支离心管加酶时间间隔1 min,便于准确计时。在37 ℃下水浴震荡,频率为160次/min。20 min、120 min时,取1 mL酶解液,加于事先准备的9 mL 66%的乙醇中,涡旋,3 500 r/min离心3 min。取0.5 mL上清液用DNS法测定葡萄糖的浓度。
根据葡萄糖标准曲线,计算样品中快速消化淀粉(RDS)、慢速消化淀粉(SDS)、抗性淀粉(RS)的含量。
RDS(%)=(G20-FG)×0.9×100/TS
SDS(%)=(G120-G20)×0.9×100/TS
RS(%)=(TS-RDS-SDS)×100/TS
式中:G20—水解20 min后样品中的葡萄糖含量(mg);G120—水解120 min后样品中的葡萄糖含量(mg);FG—水解前样品中的葡萄糖含量(mg);TS—样品中总淀粉干基含量(mg)。
1.4 数据分析
每组实验重复三次,利用 Jade 5.0软件对X-ray图谱进行分析,采用SPSS17.0对数据进行统计学分析,采用Origin进行数据图表分析。
2 结果与分析
2.1 糊化度
谷物挤出过程中,受到高温、高压和高剪切力的作用,淀粉的结晶区发生熔融、糊化及降解,由颗粒状态转变为熔融状态。糊化度反映糊化淀粉占样品总质量的比值,是淀粉糊化与降解综合作用的结果[11]。如图 1所示,CS40的糊化度为89%。与CS40相比,添加脂肪酸后,CSLA40的糊化度明显下降至75%,说明添加月桂酸能降低普通玉米淀粉的糊化度。Wang等[12]研究发现添加脂肪酸能降低小麦淀粉的糊化程度。Singh等[13]发现添加硬脂酸与肉豆蔻酸能抑制淀粉颗粒的溶胀,影响淀粉糊化。这可能是挤压过程中,高温、高压和高剪切作用导致淀粉颗粒破碎、发生糊化,糊化淀粉易与脂肪酸形成淀粉-脂肪酸复合物,抑制淀粉颗粒的溶胀[14]。另一个原因可能是脂肪酸包裹在淀粉颗粒表面,形成一层油膜,阻碍淀粉与水分子之间接触,影响淀粉的糊化程度[4]。与CS40相比,CSR40的糊化度略有降低,但不明显。这可能是糊化淀粉通过挤压机模口被挤出时,其压力由高压骤降至常压,水分迅速蒸发汽化,使糊化淀粉固定化,因而低温贮藏对CSR40的糊化度影响较小[15]。
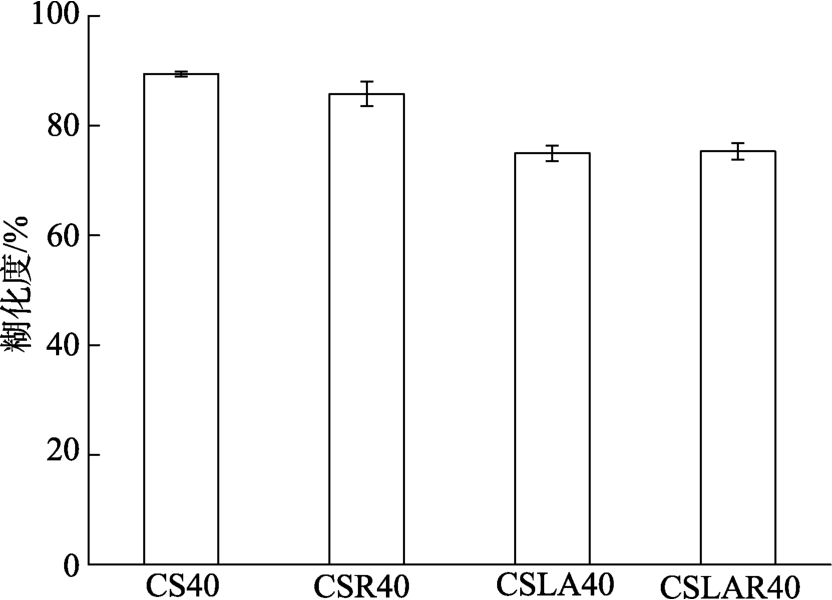
图1 低温贮藏对挤压普通玉米淀粉-月桂酸复合物糊化度的影响
Fig.1 Effect of cool storage on gelatinization degree of extruded common corn starch-lauric acid complex
与CSLA40相比,CSLAR40的糊化度变化不明显,说明低温贮藏不影响挤压淀粉-脂肪酸复合物的糊化度。这与贺平[16]研究结果一致,他发现4 ℃低温贮藏的糯米淀粉-月桂酸复合物的老化焓值略有增加,但变化不明显,说明脂肪酸存在时,低温贮藏对淀粉老化无明显影响。这可能是挤压过程中形成的淀粉-脂肪酸复合物抑制了低温贮藏过程中直链淀粉双螺旋结构的形成,因而低温贮藏对糊化度的影响较小[17]。
2.2 复合指数
复合指数可以表征淀粉-脂肪酸复合物的数量。淀粉与脂肪酸结合后,与碘结合能力降低,通过测定淀粉-碘复合物的含量,可以反映淀粉与脂肪酸结合的程度[18]。由图2可知,CSLA40的复合指数为29%,表明普通玉米淀粉与月桂酸经挤压处理后形成了淀粉-脂肪酸复合物。Mercier等[19]研究表明双螺杆挤压处理能使淀粉与脂肪酸形成V型复合物。这可能是挤压过程中的高温、高压和高剪切力促使淀粉颗粒糊化形成具有疏水空腔的单螺旋结构,能通过疏水相互作用与脂肪酸络合形成复合物[9]。经老化处理,CSLAR40的复合指数为35%,比CSLA40提高了约6%,说明低温贮藏能进一步提高淀粉与脂肪酸之间的复合程度。Sun等[18]研究表明较低复合温度下能提高玉米淀粉与油酸的复合程度。
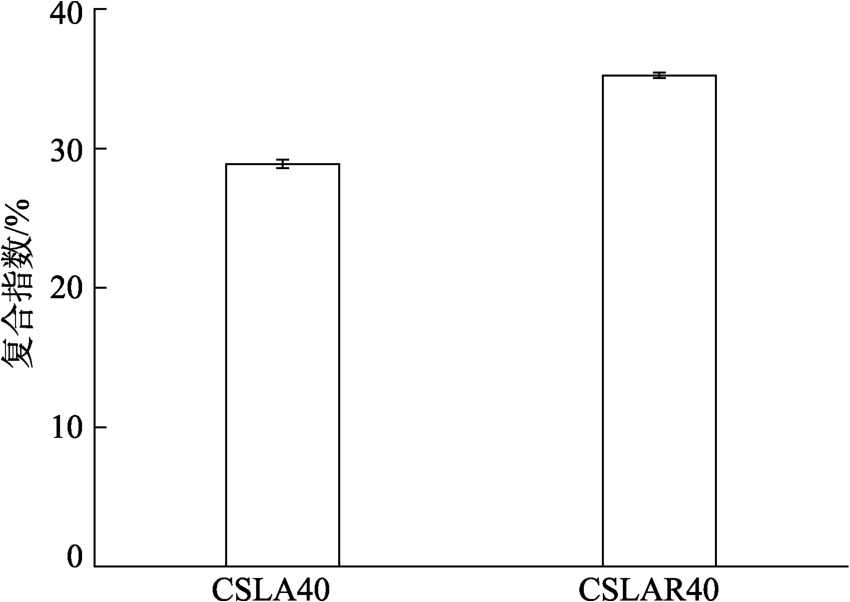
图2 低温贮藏对挤压普通玉米淀粉-月桂酸复合物复合指数的影响
Fig.2 Effect of cool storage on complexing index of extruded common corn starch-lauric acid complex
2.3 热性质分析
由图3和表1可知,普通玉米淀粉在65~76 ℃存在一个吸热峰。这与Wang等[20]研究结果一致。CS40存在两个吸热峰,温度范围分别为46~60 ℃和105~115 ℃,第一个吸热峰的温度范围低于原淀粉,对应支链淀粉重结晶和内源性VII-型淀粉-脂肪酸复合物的熔融。Hasjim等[21]研究发现挤压处理普通玉米淀粉在 41~73 ℃和 104~120 ℃出现两个吸热峰。Sievert等[22]研究发现热处理后的玉米淀粉和小麦淀粉分别在 40~70 ℃和 100~124 ℃存在两个吸热峰。第一个吸热峰可能是低温贮藏导致糊化的支链淀粉分子链重结晶[22]。第二个吸热峰出现的原因可能是淀粉中存在少量内源性脂肪酸,挤压过程中与淀粉形成了淀粉-脂肪酸复合物[22]。CSLA40存在三个吸热峰,糊化温度范围分别为 38~44 ℃、91~101 ℃和 106~117 ℃,分别对应月桂酸结晶的熔融峰、VI-型淀粉-脂肪酸复合物的熔融峰和 VII-型淀粉-脂肪酸复合物的熔融峰。CSLAR40则有四个吸热峰,温度范围分别为 38~44 ℃、47~58 ℃、89~101 ℃和106~117 ℃。上述结果表明挤压后部分月桂酸以游离状态存在,未与淀粉形成复合物。Reddy等[23]发现淀粉与硬脂酸混合物经热处理后分别在 63~67 ℃、97~115 ℃和 112~135 ℃出现三个吸热峰,分别对应硬脂酸、VI-型淀粉-脂肪酸复合物和VII-型直链淀粉-脂肪酸复合物的熔融峰。Wang等[20]研究表明普通玉米淀粉-月桂酸复合物中存在游离月桂酸、VI-和VII-型淀粉-脂肪酸复合物的熔融峰。与CSLA40相比,CSLAR40在47~58 ℃出现吸热峰,这可能与低温贮藏过程中淀粉重结晶有关[22]。
表1 挤压处理结合低温贮藏的普通玉米淀粉-月桂酸复合物热特性参数
Table 1 Effect of cool storage on thermal properties of extruded common corn starch-lauric acid complex
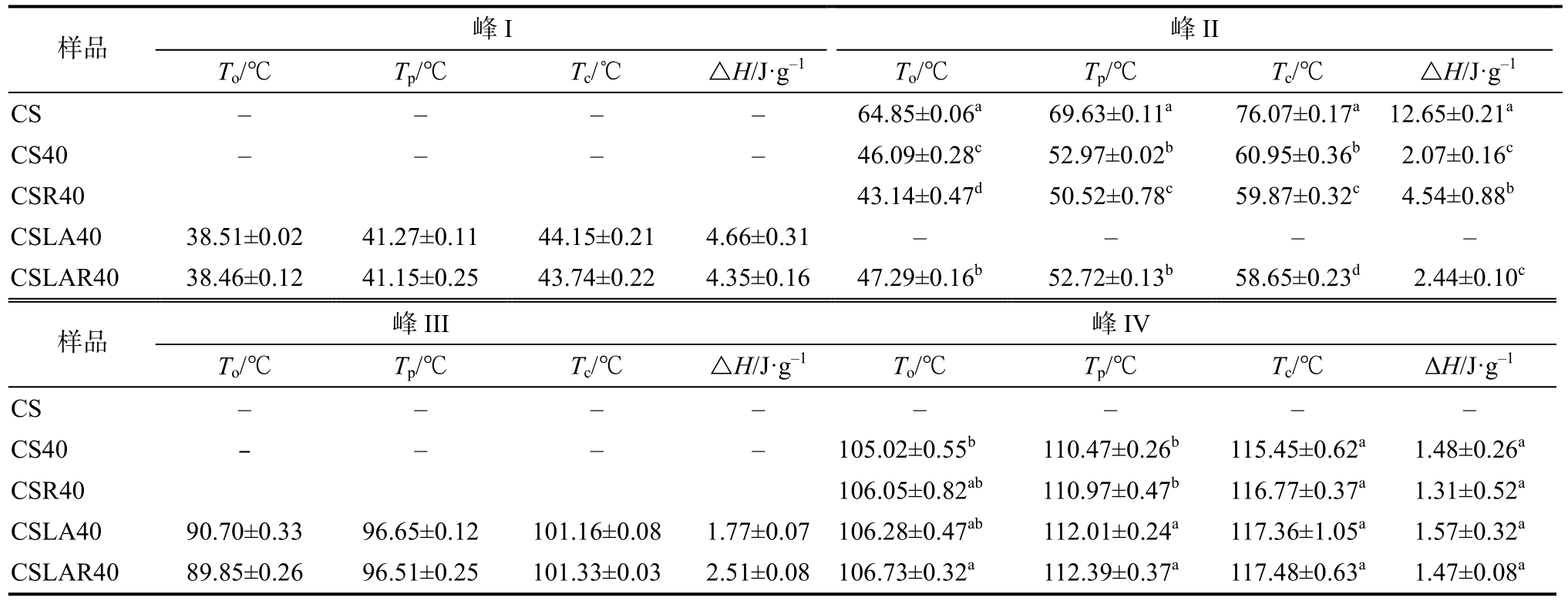
注:同列数据,小写字母不同表示差异显著(P<0.05),相同表示差异不显著(P>0.05),下同。
Note: Different lower case letters in the same column indicated the mean values were significantly different (P<0.05).Same lower case in the same column indicated the mean values were insignificantly different (P> 0.05).
峰I峰II样品 To/℃ Tp/℃ Tc/℃ △H/J·g-1 To/℃ Tp/℃ Tc/℃ △H/J·g-1 CS - - - - 64.85±0.06a 69.63±0.11a 76.07±0.17a 12.65±0.21a CS40 - - - - 46.09±0.28c 52.97±0.02b 60.95±0.36b 2.07±0.16c CSR40 43.14±0.47d 50.52±0.78c 59.87±0.32c 4.54±0.88b CSLA40 38.51±0.02 41.27±0.11 44.15±0.21 4.66±0.31 - - - -CSLAR40 38.46±0.12 41.15±0.25 43.74±0.22 4.35±0.16 47.29±0.16b 52.72±0.13b 58.65±0.23d 2.44±0.10c峰III 峰IV样品 To/℃ Tp/℃ Tc/℃ △H/J·g-1 To/℃ Tp/℃ Tc/℃ ΔH/J·g-1 CS - - - - - - - -CS40 - - - - 105.02±0.55b 110.47±0.26b 115.45±0.62a 1.48±0.26a CSR40 106.05±0.82ab 110.97±0.47b 116.77±0.37a 1.31±0.52a CSLA40 90.70±0.33 96.65±0.12 101.16±0.08 1.77±0.07 106.28±0.47ab 112.01±0.24a 117.36±1.05a 1.57±0.32a CSLAR40 89.85±0.26 96.51±0.25 101.33±0.03 2.51±0.08 106.73±0.32a 112.39±0.37a 117.48±0.63a 1.47±0.08a
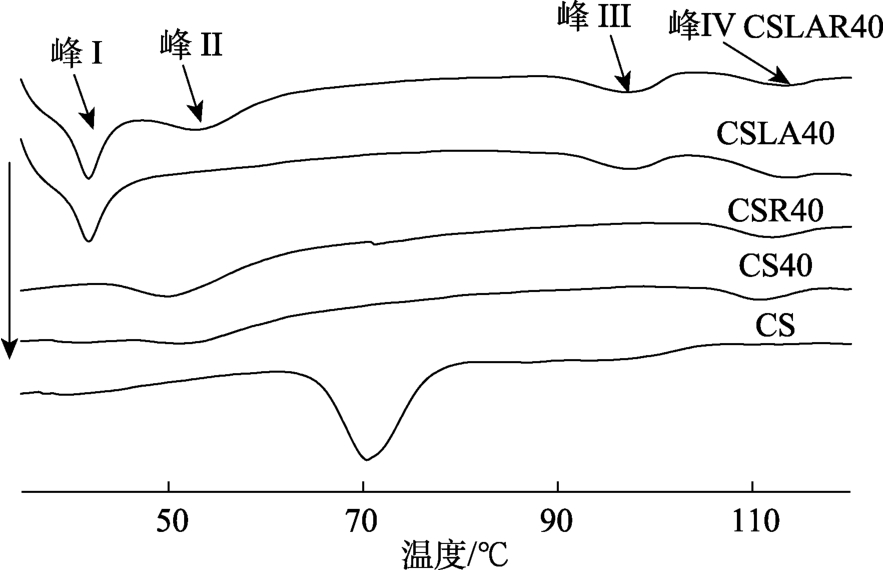
图3 挤压处理结合低温贮藏的普通玉米淀粉-月桂酸复合物的DSC曲线
Fig.3 DSC thermal curves of extruded common corn starch-lauric acid complex
与 CS相比,挤压处理或挤压处理结合低温贮藏后所有淀粉样品的糊化焓值均显著降低,这与Cervantes-Ramírez等[1]研究结果一致。这可能是挤压处理导致部分淀粉糊化[1]。与CS40相比,CSR40对应峰II的糊化焓升高2.47 J/g,说明低温贮藏促进了淀粉的老化。房子蔚等[24]研究表明低温贮藏能够提高普通玉米淀粉的老化焓值。这可能是贮藏过程中淀粉分子重新排列发生重结晶[24]。与CSLA40相比,CSLAR40对应峰III的熔融焓值升高,与复合指数增加的结果一致。房子蔚等[24]和 Yu等[2]研究表明低温贮藏使普通玉米淀粉-油酸复合物和小麦淀粉-硬脂酸复合物的熔融焓值增加。这可能是低温贮藏更有利于直链淀粉与月桂酸相互作用形成稳定的直链淀粉-脂肪酸复合物[25],导致糊化焓值升高。与CS40相比,CSR40、CSLA40和CSLAR40对应峰IV的糊化焓值无显著差异,说明低温贮藏和添加月桂酸均对峰IV的糊化焓值无显著影响。此外,CS40和 CSR40均未出现峰 III。上述结果表明淀粉与内源性脂肪酸形成的复合物以 VII-型复合物为主,而淀粉与外源性脂肪酸形成的复合物以 VI-型复合物为主。
2.4 X射线衍射结果分析
由图 4可知,CS 在 2θ为 15°、17°、18°和23°处存在衍射峰,表现为典型的A-型结晶结构。这与 Wang等[20]和陈海华等[4]研究结果一致。CS40 在 2θ 为 13°、17°、20°、23°存在衍射峰,表现为A+V型结晶结构。与CS相比,CS40的衍射峰发生明显变化,2θ为 13°和 20°处出现新的衍射峰,2θ为 17°和18°处的双峰变为 17°的单峰。Li等[26]研究表明挤压处理的普通玉米淀粉和高直链玉米淀粉均呈现“A+V型”结晶结构。Chen等[14]研究表明热处理的玉米淀粉结晶结构由 A-型转变为“A+V型”。这可能是挤压处理导致淀粉结晶区熔融、糊化或者降解,引起淀粉晶型的改变。另一个原因可能是原淀粉中存在少量的内源性游离脂肪酸,挤压过程中与淀粉形成V-型结构的淀粉-脂肪酸复合物[20]。CSLA40和CSLAR40在 2θ为 13°和 20°处存在两个较强的衍射峰,2θ为7°处存在一个较弱的衍射峰,呈现V-型结晶结构,说明挤压过程中形成了淀粉-月桂酸复合物。此外,CSLA40和CSLAR40在2θ为21.6°处存在一个衍射峰,可能是复合物中游离月桂酸的结晶峰。Wang等[20]研究表明普通玉米淀粉-月桂酸复合物具有V-型结晶结构。Cervantes-Ramírez等[1]研究表明玉米淀粉与硬脂酸、油酸形成V-型复合物。Chang等[27]研究认为2θ为21°的衍射峰对应月桂酸的结晶峰。Wang等[20]研究表明淀粉-月桂酸复合物存在游离脂肪酸衍射峰。本文与其结果一致。与CSLA40相比,CSLAR40在2θ为17°处的衍射峰增强,可能与老化的淀粉分子链有关[28]。Reddy等[23]研究表明低温贮藏使高直链玉米淀粉-硬脂酸复合物在2θ为17°处的衍射峰强度增强。这可能是低温贮藏能促进直链淀粉重结晶,使衍射峰强度增强[28]。
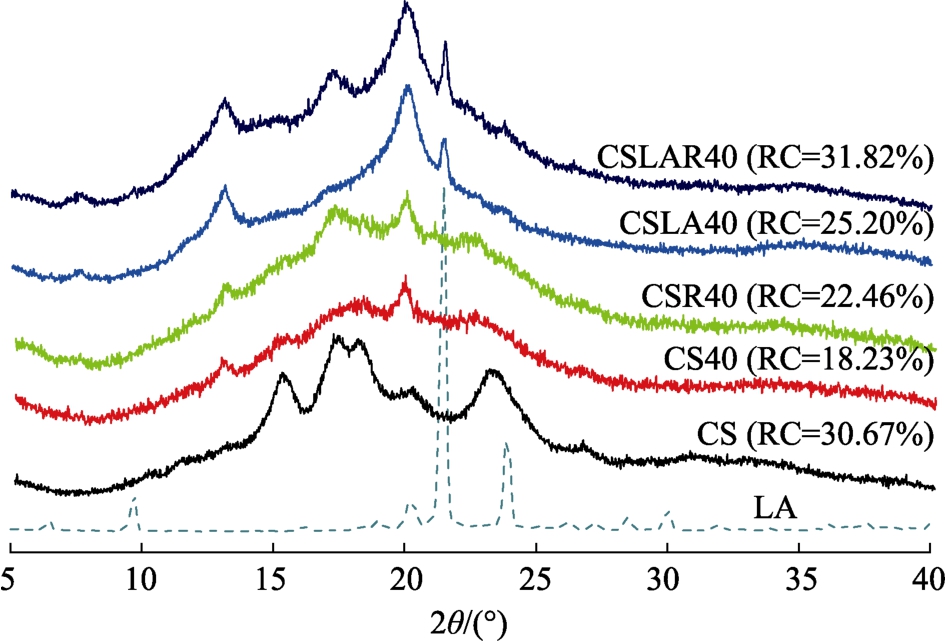
图4 挤压处理结合低温贮藏的普通玉米淀粉-月桂酸复合物的X射线衍射图谱和RC值
Fig.4 X-ray diffraction pattern and RC values of CSLA prepared by extrusion combined with cool storage
与 CS相比,CS40的相对结晶度 RC从30.67%下降至 18.23%。Zhang等[8]和 Li等[26]研究表明挤压处理使大米淀粉、普通玉米淀粉和高直链玉米淀粉RC值降低。本研究结果与其一致。这可能是挤压过程中的高温、高压及剪切作用导致淀粉糊化,结晶结构被破坏,淀粉有序度降低[19]。与CS40相比,CSR40的RC值从18.23%明显增加至22.46%。这与DSC结果中CSR40老化焓值增加的结果相一致。Yu等[2]研究表明4 ℃贮藏时小麦淀粉的RC值明显增加。Zhang等[8]研究表明低温冷藏处理能提高小麦淀粉的RC值。本文研究结果与其类似。这可能是低温贮藏能促进淀粉分子链重新排列,形成有序的双螺旋结构[8]。与CS40相比,CSLA40的 RC值从 18.23%增加至25.20%。Liu等[29]研究表明添加没食子酸能提高大米淀粉的相对结晶度。这可能是淀粉与脂肪酸复合后,促进淀粉形成有序的 V-型结晶结构[29]。与CSLA40相比,CSLAR40的RC值从25.20%增加至 31.82%,说明低温贮藏能够促进淀粉-脂肪酸复合物的形成。Yu等[2]研究表明低温贮藏有助于提高小麦淀粉-脂肪酸复合物的RC值。本研究结果与其一致。这可能是由于淀粉的相对结晶度主要取决于支链淀粉双螺旋结构和淀粉-脂肪酸复合物的含量[27],淀粉-脂肪酸复合物含量增加,相对结晶度增加。
2.5 营养片段分析
依据水解速率快慢,淀粉可分为快速消化淀粉RDS,缓慢消化淀粉SDS和抗性淀粉RS[10]。由表2可知,挤压处理和低温贮藏显著影响了玉米淀粉的RDS和RS含量。与CS相比,CS40的RDS、SDS含量明显升高,但 RS含量却明显降低。这可能是挤压处理能破坏淀粉的结晶结构,引起淀粉糊化,导致淀粉分子链伸展,因而淀粉酶容易作用于淀粉链,使淀粉被水解[30]。陈海华等[4]研究表明与原淀粉相比,糊化后普通玉米淀粉的RDS和SDS含量升高,RS含量下降。Robin等[30]和 Zhang等[31]研究表明挤压处理普通玉米淀粉、菠萝蜜种子淀粉,RDS含量增加,RS含量下降。本研究与其一致。与 CSG相比,CS40的RDS含量降低,RS含量增加。这可能是挤压处理时淀粉的水分含量较低,只有部分淀粉发生糊化[31]。与CS40相比,CSR40的RDS含量降低2.6%,SDS含量增加3.1%,表明低温贮藏能促进淀粉老化,抑制淀粉的消化。Neder-Suárez等[6]研究表明冷藏处理能够增强玉米淀粉的抗消化能力,本文与其研究结果一致。这可能是挤压处理引起淀粉糊化,而后在低温贮藏时,糊化的直链淀粉分子与支链淀粉分子侧链、直链淀粉分子之间通过氢键发生重结晶,使淀粉消化速率下降[8]。这与DSC测定的CSR40老化焓值增加的结果一致。与CS40相比,CSLA40的RDS和SDS含量分别下降了3.4%和7.2%,RS含量增加10.7%,说明添加月桂酸能够提高淀粉的抗消化能力。Kawai等[32]研究表明淀粉-脂肪酸复合物的形成能够降低淀粉的消化性。Okumus等[33]发现扁豆淀粉与脂肪酸复合后RS含量明显增加,RDS含量显著下降。作者[5]之前研究表明与小麦淀粉相比,小麦淀粉-油酸复合物的RDS含量下降,RS含量增加。本研究与其一致。这可能是月桂酸进入淀粉螺旋空腔内部与淀粉结合,阻碍了淀粉酶对淀粉的作用,提高其抗消化性[3]。与 CSLA40相比,CSLAR40的 RDS与 SDS含量分别降低2.8%、9.0%,RS含量增加11.8%,说明低温贮藏能够提高普通玉米淀粉-月桂酸复合物的抗消化能力。Qin等[25]研究表明低温贮藏能够提高高直链玉米淀粉-肉豆蔻酸复合物的RS含量,本研究与其相似。这可能是低温贮藏有利于形成具有抗消化性的直链淀粉双螺旋结构和淀粉-脂肪酸复合物,使抗性淀粉含量增加,抗消化能力增强[25]。复合指数的结果也表明低温贮藏后普通玉米淀粉-脂肪酸复合物含量增加,与RS含量变化趋势相符合。
表2 挤压处理结合低温贮藏的普通玉米淀粉-月桂酸复合物的营养片段含量
Table 2 RDS, SDS and RS contents of CSLA prepared by extrusion combined with cool storage %
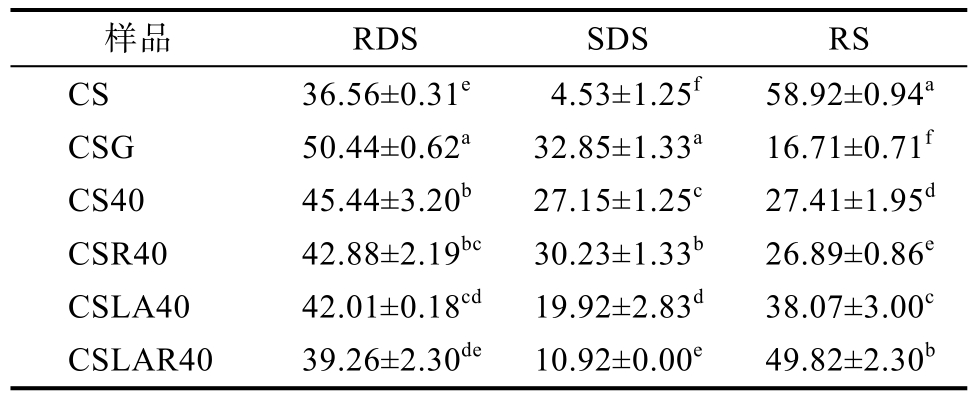
注:同列数据,小写字母不同表示差异显著(P<0.05),相同表示差异不显著(P>0.05),下同。CSG为全糊化的普通玉米淀粉。
Note: Different lower case letters in the same column indicated the mean values were significantly different (P<0.05).Same lower case in the same column indicated the mean values were insignificantly different (P>0.05).CSG represented the fully gelatinized common corn starch.
样品 RDS SDS RS CS 36.56±0.31e 4.53±1.25f 58.92±0.94a CSG 50.44±0.62a 32.85±1.33a 16.71±0.71f CS40 45.44±3.20b 27.15±1.25c 27.41±1.95d CSR40 42.88±2.19bc 30.23±1.33b 26.89±0.86e CSLA40 42.01±0.18cd 19.92±2.83d 38.07±3.00c CSLAR40 39.26±2.30de 10.92±0.00e 49.82±2.30b
3 结论
本文研究了挤压处理结合低温贮藏对普通玉米淀粉-月桂酸复合物理化性质和消化性质的影响。与挤压处理相比,挤压处理结合低温贮藏有利于普通玉米淀粉-月桂酸复合物的形成,表现为复合指数增加,相对结晶度升高。挤压处理结合低温贮藏能提高淀粉的抗消化能力,这可能是低温贮藏有利于支链淀粉的重结晶和淀粉-脂肪酸复合物的形成,使抗性淀粉含量增加。与挤压处理相比,挤压处理结合低温贮藏使普通玉米淀粉的糊化焓值增加,相对结晶度升高,这可能是贮藏过程中淀粉分子重新排列发生重结晶导致。上述结果表明挤压处理结合低温贮藏可为制备具有抗消化性的淀粉-脂肪酸复合物提供理论基础。
[1] CERVANTES-RAMÍREZ J E, CABRERA-RAMIREZ A H,MORALES-SÁNCHEZ E, et al.Amylose-lipid complex formation from extruded maize starch mixed with fatty acids[J].Carbohydrate Polymers, 2020, 246: e116555.
[2] YU Z, WANG Y S, CHEN H H, et al.The gelatinization and retrogradation properties of wheat starch with the addition of stearic acid and sodium alginate[J].Food Hydrocolloids, 2018,81: 77-86.
[3] CUI R, OATES C G.The effect of amylose-lipid complex formation on enzyme susceptibility of sago starch[J].Food Chemistry, 1999, 65(4): 417-425.
[4] 陈海华, 王雨生, 王慧云, 等.脂肪酸碳链长度与不饱和度对脂肪酸-普通玉米淀粉包合物体外消化性质的影响[J].现代食品科技, 2016, 32(2): 19-26.CHEN H H, WANG Y S, WANG H Y, et al.Effect of fatty-acid chain length and unsaturation in fatty acid-normal corn starch complexes on in vitro digestibility[J].Modern Food Science and Technology, 2016, 32(2): 19-26.
[5] 徐澎聪, 王雨生, 陈海华, 等.制备方法对小麦淀粉-油酸包合物的热性质及消化性质的影响[J].食品科学, 2017, 38(3): 7-12.XU P C, WANG Y S, CHEN H H, et al.Effect of preparation methods on thermal properties and digestibility of wheat starch-oleic acid inclusion complexes[J].Food Science, 2017,38(3): 7-12.
[6] NEDER-SUÁREZ D, AMAYA-GUERRA C A, QUINTERORAMOS A, et al.Physicochemical changes and resistant-starch content of extruded cornstarch with and without storage at refrigerator temperatures[J].Molecules, 2016, 21(8): e1064.
[7] BHATNAGAR S, HANNA M A.Amylose-lipid complex formation during single-screw extrusion of various corn starches[J].Cereal Chemistry, 1994, 71(6): 582-587.
[8] ZHANG Y J, LIU W, LIU C M, et al.Retrogradation behaviour of high-amylose rice starch prepared by improved extrusion cooking technology[J].Food Chemistry, 2014, 158: 255-261.
[9] 赵阳, 王雨生, 陈海华, 等.共轭亚油酸对小麦淀粉理化性质的影响[J].中国粮油学报, 2015, 30(10): 21-24.ZHAO Y, WANG Y S, CHEN H H, et al.Effect of conjugated linoleic acid on the physicochemical properties of wheat starch[J].Journal of the Chinese Cereals and Oils Association,2015, 30(10): 21-24.
[10] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992,46(S2): 33-50.
[11] CAI W, DIOSADY L L.Model for gelatinization of wheat starch in a twin-screw extruder[J].Journal of Food Science, 1993, 58(4):872-875.
[12] WANG S J, WANG J R, YU J L, et al.Effect of fatty acids on functional properties of normal wheat and waxy wheat starches:A structural basis[J].Food Chemistry, 2016, 190: 285-292.
[13] SINGH J, SINGH N, SAXENA S K.Effect of fatty acids on the rheological properties of corn and potato starch[J].Journal of Food Engineering, 2002, 52: 9-16.
[14] CHEN X, HE X W, ZHANG B, et al.Structure, physicochemical and in vitro digestion properties of ternary blends containing swollen maize starch, maize oil and zein protein[J].Food Hydrocolloids, 2018, 76: 88-95.
[15] 杨铭铎.谷物淀粉膨化α化的研究[J].中国粮油学报, 1988(1):53-58.YANG M D.Study on α-expansion of cereal starch[J].Journal of the Chinese Cereals and Oils Association, 1988(1): 53-58.
[16] 贺平.低温预冷对糯米淀粉凝胶老化特性的影响[D].郑州:河南农业大学, 2016.HE P.Effects of low temperature on retrogradation of waxy rice starch gel[D].Zhengzhou: Henan Agricultural University, 2016.
[17] CHEN X, HE X W, FU X, et al.Complexation of rice starch/flour and maize oil through heat moisture treatment:Structural, in vitro digestion and physicochemical properties[J].International Journal of Biological Macromolecules, 2017, 98:557-564.
[18] SUN S L, HONG Y, GU Z B, et al.An investigation into the structure and digestibility of starch-oleic acid complexes prepared under various complexing temperatures[J].International Journal of Biological Macromolecules, 2019, 138: 966-974.
[19] MERCIER C, CHARBONNIERE R, GREBAUT J, et al.Formation of amylose-lipid complexes by twin-screw extrusion cooking of manioc starch[J].Cereal Chemistry, 1980, 57(1): 4-9.
[20] WANG Y S, LIU W H, ZHANG X, et al.Preparation of VII-type normal cornstarch-lauric acid complexes with high yield and stability using a combination treatment of debranching and different complexation temperatures[J].International Journal of Biological Macromolecules, 2020, 154: 456-465.
[21] HASJIM J, JANE J L.Production of resistant starch by extrusion cooking of acid-modified normal-maize starch[J].Journal of Food Science, 2009, 74(7): C556-C562.
[22] SIEVERT D, POMERANZ Y.Enzyme-resistant starch.Ⅱ.Differential scanning calorimetry studies on heat-treated starches and enzyme-resistant starch residues[J].Cereal Chemistry, 1990,67(3): 217-221.
[23] REDDY C K, CHOI S M, LEE D J, et al.Complex formation between starch and stearic acid: Effect of enzymatic debranching for starch[J].Food Chemistry, 2018, 244: 136-142.
[24] 房子蔚, 王雨生, 于真, 等.油酸和麦芽糖醇对玉米淀粉老化特性的影响[J/OL].食品科学.(2022-02-26)[2022-07-20].http://kns.cnki.net/kcms/detail/11.2206.TS.20220224.1729.010.html.FANG Z W, WANG Y S, YU Z, et al.Effects of different proportions of oleic acid and maltitol mixture on the retrogradation properties of corn starch[J/OL].Food Science.(2022-02-26)[2022-07-20].http://kns.cnki.net/kcms/detail/11.2206.TS.20220224.1729.010.html.
[25] QIN R B, YU J L, LI Y F, et al.Structural changes of starchlipid complexes during postprocessing and their effect on in vitro enzymatic digestibility[J].Journal of Agricultural and Food Chemistry, 2019, 67(5): 1530-1536.
[26] LI M, HASJIM J, XIE F W, et al.Shear degradation of molecular, crystalline, and granular structures of starch during extrusion[J].Starch-Stärke, 2014, 66(7-8): 595-605.
[27] CHANG F D, HE X W, HUANG Q.The physicochemical properties of swelled maize starch granules complexed with lauric acid[J].Food Hydrocolloids, 2013, 32(2): 365-372.
[28] LI Q Q, WANG Y S, CHEN H H, et al.Retardant effect of sodium alginate on the retrogradation properties of normal cornstarch and anti-retrogradation mechanism[J].Food Hydrocolloids, 2017, 69: 1-9.
[29] LIU Y F, CHEN L, XU H S, et al.Understanding the digestibility of rice starch-gallic acid complexes formed by high pressure homogenization[J].International Journal of Biological Macromolecules, 2019, 134: 856-863.
[30] ROBIN F, HEINDEL C, PINEAU N, et al.Effect of maize type and extrusion-cooking conditions on starch digestibility profiles[J].International Journal of Food Science & Technology,2016, 51(6): 1319-1326.
[31] ZHANG Y T, ZHANG Y J, LI B, et al.In vitro hydrolysis and estimated glycemic index of jackfruit seed starch prepared by improved extrusion cooking technology[J].International Journal of Biological Macromolecules, 2019, 121: 1109-1117.
[32] KAWAI K, TAKATO S, SASAKI T, et al.Complex formation,thermal properties, and in-vitro digestibility of gelatinized potato starch-fatty acid mixtures[J].Food Hydrocolloids, 2012, 27(1):228-234.
[33] OKUMUS B N, TACER-CABA Z, KAHRAMAN K, et al.Resistant starch type V formation in brown lentil (Lens culinaris Medikus) starch with different lipids/fatty acids[J].Food Chemistry, 2018, 240: 550-558.
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。