虾青素(Astaxanthin)化学名称为3,3'-二羟基-4,4'-二酮基-b'b-胡萝卜素,是一种酮式类胡萝卜素[1],是从真菌、植物、鲑鱼、蟹等多种来源中分离得到的天然产物[2]。其在体内外均有潜在的生物活性,是目前已知比维生素、胡萝卜素有更强抗氧化能力的天然抗氧化剂[3]。大量研究表明,虾青素在抗炎[4]、抗癌[5]、抗氧化[6]、抗疲劳[7]、增强免疫力[8]等方面具有较强的生物活性。其被用作食品、饲料或水产生产中的色素,也用于化妆品和制药产品[9]。
尽管虾青素因其多种生物学功能备受关注,但由于虾青素水溶性差、疏水性强、熔点高、化学稳定性差等特点,很难有效地传递给器官[10],造成其在生物体内的生物利用度较低,限制了虾青素的应用。因此,关于虾青素及其制剂的研究还有很大空间。目前,虾青素已被制成脂质体、微胶囊、包合物、纳米粒等制剂[11-12],这些剂型都能增强虾青素性能的优势,包括稳定性、抗氧化潜力、生物活性和药物释放。《中国药典》对微球剂定义为活性成分溶解或分散在辅料中形成的微小球状实体(一般规定其粒径范围1~250 μm)[13],微球剂可提高难溶性药物溶解度和增强稳定性,能够实现靶向给药、缓控释放药物,抵抗紫外线、水分、氧气等环境因素干扰特点。
本实验研究采用明胶、阿拉伯胶为载体,通过乳化交联法制备虾青素微球,制备径粒更小,更易于分散,且稳定性、包封率和载药量较好的虾青素微球,有效克服虾青素易被氧化,性质不稳定,水溶性较差以及气味难闻等问题,并对虾青素微球制备工艺进行研究,同时也为开发各类载药微球药实验基础。
1 材料与方法
1.1 材料与试剂
虾青素油(虾青素含量为5%):昆明医科大学;虾青素分析对照品(纯度≥98%):北京索莱生物科技有限公司;丙酮(分析纯):汕滇药业有限公司;戊二醛(分析纯)、液体石蜡:天津市大茂化学试剂厂;吐温80(分析纯):天津市风船化学品试剂科技有限公司;明胶:天津市轩昂科工贸有限公司;阿拉伯胶:天津市致远化学试剂有限公司;娃哈哈纯净水:杭州娃哈哈集团有限公司;异丙醇(分析纯):成都市科隆化学品有限公司。
1.2 仪器与设备
BT25S分析天平:赛多利斯仪器有限公司;SK3300超声仪:上海科导超声仪器有限公司;DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;winner2000激光粒度仪:济南微纳有限责任公司;光学显微镜:Nikon Eclipse Eloo;循环水式真空泵:巩义市予华仪器有限公司;UV-2000型紫外分光光度计:尤尼柯仪器有限公司。
1.3 实验方法
1.3.1 虾青素明胶-阿拉伯胶微球的制备方法
分别称取15%明胶和阿拉伯胶,用10 mL水溶解后将两者混合后混匀,在一定乳化温度下加入虾青素,在一定搅拌速度下,乳化10 min,制得虾青素初乳;将适量含有2%司盘-80的液体石蜡50 mL加热到与初乳相同的温度,将虾青素初乳缓慢倒入液体石蜡中,再乳化10 min,制成复乳;迅速将复乳放到0 ℃冰浴中,在搅拌下胶凝30 min,并加入0.75 mL浓度为50%戊二醛,交联固化30 min,再加入40 mL异丙醇,脱水5 min,抽滤,用异丙醇洗涤,避光干燥[14]。即得红色粉末。
1.3.2 虾青素标准曲线的建立
精密称定15.00 mg虾青素分析对照品于25 mL容量瓶中,用丙酮溶解,定容至刻度,超声混匀;分别吸取0.5,1.0,1.5,2.0,2.5 mL虾青素丙酮溶液加到10 mL容量瓶中,用丙酮定容至刻度,摇匀。以丙酮作为空白对照,在476 nm处用紫外分光光度法测定虾青素对照品的吸光度A,以吸光度A对浓度C进行线性回归。得到标准曲线方程为A=0.148 1C-0.052 9(R2=0.999 4)。
1.3.3 微球载药量与包封率的测定方法
1.3.3.1 微球载药量计算公式 微球载药量 =W1/W2×100%
式中:W1:微球中虾青素的含量 W2:虾青素微球的总质量
1.3.3.2 微球包封率计算公式 微球包封率 =W3/W4×100%
式中:W3:微球中虾青素总量 W4:虾青素的投药量
1.3.3.3 粒径跨度计算 粒径跨度(μm)=(D90-D10)/D50
式中:D10,D50和D90分别表示在粒径累积分布图中相应于累积频率10%,50%和90%处的粒径[15]。
1.3.4 虾青素明胶-阿拉伯胶微球综合评价方法
根据载药量、包封率和粒径跨度三个指标对微球制剂的影响,并对三个指标进行评分[16]。
综合评分=[(各组载药量/最大载药量)× 0.5+(各组包封率/最大包封率)×0.2-(各组粒径跨度/最大粒径跨度)×0.3]×100
1.3.5 单因素考察
根据文献查阅,选择明胶/阿拉伯胶浓度、乳化温度、载体与药物的配比和搅拌速度作为影响因素,进行单因素实验。
1.3.6 因素水平表
根据单因素考察的相关数据,以载药量、包封率以及粒径跨度作为指标,选择明胶阿拉伯胶浓度、乳化温度、载体与药物的配比和搅拌速度四个因素进行正交实验,因素水平表见表1。
表1 因素水平表
Table 1 Factor level table

A(明胶和阿拉伯胶溶液浓度)/%B(乳化温度)/℃C(明胶和阿拉伯胶/虾青素油)D(搅拌速度)/r/min 1 10% 40 3∶1 500 2 15% 50 4∶1 600 3 20% 60 5∶1 700
1.3.7 虾青素明胶-阿拉伯胶表观微球形态及粒径分布
1.3.7.1 微球形态观察 按照制备工艺所得虾青素微球经光学显微镜(物镜和目镜放大倍数均为100)和电子显微镜(真空条件下喷金)观察微球形态。
1.3.7.2 微球粒径分布 取0.1 g虾青素明胶-阿拉伯胶微球,用100 mL纯净水分散后,超声30 s使微球分散均匀,用winner2000激光粒度分析仪测量微球的粒径分布。
1.3.8 虾青素微球体外释放
1.3.8.1 建立线性关系 精密称取15.60 mg虾青素分析对照品于25 mL容量瓶中,用丙酮定容至刻度,超声混匀。分别移取0.1、0.2、0.4、0.6、0.8和1.0 mL浓度62.4 μg/mL的虾青素丙酮溶液加入到10 mL容量瓶中,分别加入丙酮至体积为l mL,用pH 7.4的PBS溶液稀释至10 mL,得到浓度为0.312、0.624、2.496、3.744、4.992、6.240 μg/mL虾青素分散介质的对照品溶液。将丙酮和pH 7.4的PBS溶液按照1∶9的体积比制备参比溶液,将对照品溶液在最大吸收波长476 nm处测吸光值,绘制标准曲线。方程为A=0.055 4C-0.000 6(R2=0.997 4)
1.3.8.2 虾青素明胶-阿拉伯胶微球体外释放度的测定 称取100 mg载虾青素微球加入透析袋中,加入含10%丙酮的PBS溶液(pH 7.4)3 mL,将微球分散,透析袋两头用夹子夹紧,放入转篮内,加入150 mL含10%丙酮的PBS溶液(pH 7.4),搅拌速度为100 r/min,(37±0.5 ℃)恒温水浴保温,分别于0.5、1、2、4、6、8、10和24 h取样5 mL,同时用5 mL新鲜的溶出介质进行补充,持续取样24 h,实验重复3次,结果取平均值,计算微球累计释放率。利用紫外分光光度计测定取出上清液的吸光度值,并计算虾青素的浓度,得出虾青素的释放率[17]。再称100 mg虾青素油(虾青素含量为5%)作为对照,同上述方法测定虾青素油的体外释放率。累计释放百分率公式为[18]:
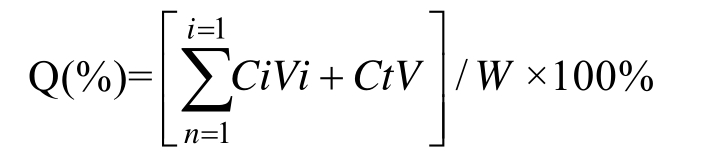
式中:Ci为i时间点释放介质中虾青素的浓度,Ct为第n时间点释放介质中虾青素的浓度,Vi为取样体积,V为释放介质的总体积。
1.3.8.3 虾青素微球释药模型 采用零级释放模型、一级释放模型、Higuchi方程的数学模型,对虾青素明胶-阿拉伯胶微球累计释放率数据进行拟合,求出相应特征指数。
1.4 数据分析
运用excel、Origin 2019等软件对数据进行数据处理分析。
2 结果分析
2.1 虾青素明胶-阿拉伯胶微球的制备单因素实验结果
单因素实验结果见表2~5。
表2 不同明胶/阿拉伯胶与虾青素的比对综合评分的影响
Table 2 The effect of different ratios of gelatin/acacia and Astaxanthin on the comprehensive score

明胶和阿拉伯胶/虾青素油包封率/%载药量/%粒径跨度/μm综合评分/分1∶1 62.11 5.25 0.84 39.38 3∶1 68.81 8.17 1.92 45.59 5∶1 68.07 8.27 1.71 48.59 7∶1 63.40 5.65 2.25 24.69 9∶1 52.30 4.23 2.42 10.78
表3 不同乳化温度对综合评分的影响
Table 3 The effect of different emulsification temperatures on the comprehensive score

温度/℃ 包封率/% 载药量/% 粒径跨度/μm 综合评分/分20 29.94 7.86 1.26 17.33 30 32.58 6.37 1.89 3.90 40 77.38 14.33 1.75 45.24 50 55.12 10.60 2.12 21.23 60 50.10 8.95 1.92 17.00
表4 不同明胶/阿拉伯胶浓度对综合评分的影响
Table 4 The effects of different gelatin/gum arabic concentrations on the composite score

明胶和阿拉伯胶浓度/%包封率/%载药量/% 粒径跨度/μm综合评分/分5 40.25 4.22 0.95 17.15 10 25.82 10.80 1.16 39.73 15 28.07 8.26 1.38 25.19 20 63.40 10.57 1.74 41.31 25 52.30 8.48 1.89 25.75
表5 不同搅拌速度对综合评分的影响
Table 5 The effect of different stirring speeds on the comprehensive score

搅拌速度/(r/min)包封率/%载药量/% 粒径跨度/μm综合评分/分200 35.82 5.37 1.66 8.53 400 31.41 8.26 1.95 14.59 600 68.81 12.74 1.76 45.67 800 55.12 10.60 2.17 27.62 1 000 52.35 10.32 1.96 28.62
2.2 虾青素明胶-阿拉伯胶微球的制备正交实验结果
根据表6数据可知,各因素对虾青素明胶-阿拉伯胶微球包封率的影响大小顺序是:A>D>C>B,即:明胶-阿拉伯胶浓度>搅拌速度>载体与药之比>乳化温度。确定的最佳处方工艺条件为A2B3C2D2,即明胶-阿拉伯胶溶液浓度为15%,乳化温度为60 ℃,明胶-阿拉伯胶/虾青素为4∶1,速度为600 r/min。
表6 虾青素微球制备工艺的正交实验结果
Table 6 Orthogonal test results of Astaxanthin microspheres preparation process

实验号 A B C D 载药量/% 包封率/% 粒径跨度/μm 综合评分/分1 1 1 1 1 9.86 53.28 1.92 22.27 2 1 2 2 2 9.18 73.45 1.66 27.86 3 1 3 3 3 6.08 63.79 1.61 13.71 4 2 1 2 3 10.06 88.52 1.16 42.55 5 2 2 3 1 9.64 93.16 0.94 45.23 6 2 3 1 2 12.07 79.65 0.65 56.93 7 3 1 3 2 8.35 81.45 0.73 40.68 8 3 2 2 3 11.02 67.75 1.41 38.17 9 3 3 2 1 K1 21.280 35.163 39.123 42.317 K2 48.233 37.087 40.183 44.383 K3 43.000 40.263 33.207 31.473 R 26.953 5.100 6.976 10.350 11.27 92.45 1.05 50.15
2.3 方差分析
表7方差分析说明明胶-阿拉伯胶浓度对微球工艺有显著影响,乳化温度、明胶和阿拉伯胶/虾青素油及搅拌速度对微球制备工艺无显著性影响。
表7 虾青素微球方差分析
Table 7 Variance analysis of Astaxanthin microspheres

因素 偏差平方和 自由度 F比 F临界值 显著性A 1 225.628 2 30.795 19.000 P<0.05 B 39.800 2 1.000 19.000 C 84.804 2 2.131 19.000 D 173.876 2 4.369 19.000误差 39.800 2
2.4 验证实验
按表8所得最佳制备工艺,进行三组平行,实验结果显示平均载药量为9.91%,平均载药量为93.28%,与正交实验预测值基本一致。说明工艺合理,可行性较好。
表8 虾青素微球制备工艺验证实验结果
Table 8 Verification results of Astaxanthin microspheres preparation process %

组数 载药量 平均载药量 包封率 平均包封率1 9.20 91.98 9.906 2 10.43 93.67 3 10.09 93.28 94.20
2.5 虾青素微球形貌特征及体外释放结果
2.5.1 虾青素微球形貌特征
根据最佳工艺制备,得到的虾青素微球外观圆整,为红色,分散性良好,较少粘连。经光学显微镜(物镜和目镜放大倍数均为10)和电子显微镜观察,虾青素完全包裹在微球中,电镜下的微球有少量孔洞,可能在干燥过程中溶剂挥发所致。

图1 虾青素微球显微图(×100)
Fig.1 Microphotograph of Astaxanthin microspheres (×100)
2.5.2 微球粒径分析结果
由图3可知虾青素微球粒径分布在0~160 μm之间,平均粒径为39.75 μm,此条件下,微球粒径分布较为均匀,分散性较好。

图2 虾青素微球扫描电镜照片(×1 000)
Fig.2 SEM photographs of Astaxanthin microspheres (×1 000)

图3 虾青素微球粒径分布图
Fig.3 Particle size distribution of Astaxanthin microspheres
2.5.3 微球体外释放率测定结果
在pH=7.4的PBS丙酮溶液中,虾青素明胶-阿拉伯胶微球的溶解度明显高于虾青素油,将虾青素油制成微球,释放时间第1 h时,微球释放率明显增强。累计释放率24 h达到51.94%,而虾青素油的累计释放率仅2.57%;虾青素油存在释药速度过慢的问题,无法满足人体吸收代谢的需要。因此,虾青素油要满足食用或者药用等需求,制成微球可行。

图4 虾青素微球体外释放实验结果
Fig.4 Results of in vitro release of Astaxanthin microspheres
2.5.4 微球体外释药模型
由表9可知一级释放模型的R2值为0.979 1,说明其拟合程度最高,体外释药规律符合一级模型。
表9 虾青素微球释药模型拟合结果
Table 9 Fitting results of astaxanthin gelatin-gum arabic microsphere release model

模型 方程式 相关系数(R2)零级释放模型 Q=0.019 8t+0.135 1 0.742 6一级释放模型 In(100-Q)=0.136 0t+0.910 9 0.979 1 Higuchi方程 Q=0.124 2t1/2-0.014 5 0.918 8
3 结论
本研究通过单因素实验考察了明胶-阿拉伯胶浓度、油水体积比、搅拌速度、乳化温度4个因素,在单因素考察的基础上,对较大的影响因素设计正交实验,得出最佳工艺方案——载体与药比为4∶1,明胶阿拉伯胶浓度为15%,乳化温度为60 ℃。在此方案下所制得的虾青素微球圆整,粒径大小较均匀,分散性良好,较少粘连。通过紫外分光光度法测定微球中的药物含量,计算得平均载药量为9.91%,平均包封率达93.28%。电镜扫描下,微球表面有明显的孔洞,在测定累计释放率时在第2 h出现明显的突释现象,24 h累计释放率达51.94%,说明微球具有明显的缓释效果。结果表明,使用明胶-阿拉伯胶作为载体制作微球是可行的,所得微球载药量和包封率都较高。
采用乳化交联法制作虾青素微球,步骤简单,重现性好,易于操作[19]。以明胶阿拉伯胶作为载体价格低廉,其来源广、无毒、可生物降解,有利于进行大规模的研究和生产。明胶水溶液中可离解出正离子(-NH3+)和负离子(-COO-);阿拉伯胶水溶液中,分子仅离解出负离子(-COO-),携带负电荷[20],二者结合有利于虾青素包合进入载体中,增加虾青素微球的稳定性。考虑是由于微球之间交联过度,相邻微球之间的一些基团相互交叉,分子与分子相互纠缠,从而导致了微球粘连,使被包封药物容易渗出。同时该方法与其他方法制备的虾青素微球相比,具有设备简单,原料来源丰富,产率高等优点,证明了使用此方法制备虾青素微球有广阔的应用前景。
[1] 赵英源, 王昭萱, 薛文杰, 等. 虾青素聚集体的研究进展[J].现代食品科技, 1-8.ZHAO Y Y, WANG Z X, XUE W J, et al. Progress in the study of H and J aggregates of astaxanthin[J]. Modern Food Science and Technology, 1-8.
[2] ASHRAFIZADEH M, AHMADI Z, YARIBEYGI H, et al.Astaxanthin and Nrf2 signaling pathway: a novel target for new therapeutic approaches[J]. Mini Rev Med Chem, 2022, 22(2):312-321.
[3] 张舟艺, 曲雪峰, 胡文力, 等. 虾青素的检测及生物活性研究进展[J]. 食品安全质量检测学报, 2020, 11(5): 1431-1438.ZHANG Z Y, QU X F, HU W L, et al. Research progress on detection and biological activity of astaxanthin[J]. Journal of Food Safety and Quality, 2020, 11(5): 1431-1438.
[4] KWAK M S, LIM J W, KIM H. Astaxanthin Inhibits Interleukin-6 Expression in Cerulein/Resistin-Stimulated Pancreatic Acinar Cells[J]. Mediators Inflamm, 2021, 2021: 5587297.
[5] LU Z Z, LONG Y, LI J X, et al. Simultaneous inhibition of breast cancer and its liver and lung metastasis by blocking inflammatory feed-forward loops[J]. Journal of controlled release: official journal of the Controlled Release Societ, 2021, 662-679.
[6] ZHOU X Y, CAO Q M, ORFILA C, et al. Systematic review and meta-analysis on the effects of astaxanthin on human skin ageing[J]. Nutrients, 2021, 13(9): 2917.
[7] 张丽婧, 刘臻, 刘冬英, 等. 水溶性雨生红球藻虾青素粉对小鼠抗疲劳功能研究[J]. 食品安全质量检测学报, 2020, 11(10):3100-3104.ZHANG L J, LIU Z, LIU D X, et al. Study on anti-fatigue function of water soluble astaxanthin powder from Haematococcus pluvialis in mice[J]. Journal of Food Safety and Quality, 2020,11(10): 3100-3104.
[8] 刘颖芬, 辛乃宏, 李炳乾, 等. 雨生红球藻虾青素对小鼠免疫调节的研究[J]. 食品研究与开发, 2017, 38(20): 183-187.LIU Y F, XIN N H, LI B Q, et al. Study of astaxanthin from haematococcus pluvialis on immune regulation function in mice[J]. Food Research And Development, 2017, 38(20): 183-187.
[9] VILLARÓ S, CIARDI M, MORILLAS-ESPAÑA A, et al.Microalgae derived astaxanthin: research and consumer trends and industrial use as food[J]. Foods, 2021, 10(10): 2303.
[10] 韩吉平, 江宁, 诸永志, 等. 天然虾青素的制备和功能研究进展[J]. 江苏农业科学, 2021, 49(8): 56-60.HAN J P, JIANG N, ZHU Y Z, et al. Research progress on preparation and function of natural astaxanthin[J]. Jiangsu Agricultural Science, 2021, 49(8): 56-60.
[11] 彭宇, 任晓丽, 陈林, 等. 虾青素制剂技术及其对虾青素稳定性影响的研究进展[J]. 中国油脂, 2019, 44(4): 115-121.PENG Y, REN X L, CHEN L, et al. Advance in preparation technology of astaxanthin and its effects on stability of astaxanthin[J]. China Oils and Fats, 2019, 44(4): 115-121.
[12] 潘丽, 常振刚, 陈娟, 等. 虾青素的生理功能及其制剂技术的研究进展[J]. 河南工业大学学报(自然科学版), 2019, 40(6):123-129.PAN L, CHANG Z G, CHEN L, et al. Research progress on the physiological function of astaxanthin and its preparation technology[J]. Journal of Henan University of Technology(Natural Science Edition), 2019, 40(6): 123-129.
[13] 张奇珍, 尹明明, 余曼丽, 等. 载药明胶微球剂的制备及应用研究进展[J]. 农药学学报, 2021, 23(4): 657-667.ZHANG Q Z, YIN M M, YU M L, et al. Research progress of the preparation and application of gelatin microspheres[J].Chinese Journal of Pesticide Science, 2021, 23(4): 657-667.
[14] 赵丹, 马云淑, 李婧瑜, 等. 苍艾鼻用微球的制备工艺及其性能表征[J]. 时珍国医国药, 2014, 25(12): 2904-2906.ZHAO D, MA Y S, LI J Y, et al. Preparation and characterization of Cangai Nasal -Microspheres[J]. Lishizhen Medicine and Materia Medica Reacherch, 2014, 25(12): 2904-2906.
[15] 詹国平, 郝丽. 艾叶挥发油明胶微球的制备及其性能表征[J].中南大学学报(自然科学版), 2011, 42(8): 2239-2244.LU G P, HAO L. Preparation and characterization of gelatin microspheres of volatile oils from Folium Artemisiae Argyi[J].Journal of Central South University (Science and Technology),2011, 42(8): 2239-2244.
[16] 张兴德, 郁红礼, 周玲玲, 等. 正交法筛选莪术油微球制备工艺[J]. 南京中医药大学学报, 2007(5): 304-306.ZHANG X D, YU H L, ZHOU L L, et al. Orthogonal method for screening preparation technique for oleum curcumae wenchowensis microballoon[J]. Journal of Nanjing TCM University, 2007(5): 304-306.
[17] 张秀娟, 李文娟, 查纯婷, 等. 虾青素-海藻酸钙/壳聚糖缓释微球、制备方法和应用CN201810440049.7[P]. 2018.05.02 ZHANG X J, LI W J, ZHA C T, et al. Astaxanthin-calcium alginate/chitosan sustained-release microspheres and preparation method and application thereof.CN201810440049.7[P]. 2018.05.02
[18] 车坷科, 王丽娟, 张如超, 等. 关节腔注射用雷公藤甲素PLGA微球的制备与体外释放研究[J]. 中国新药杂志, 2016,25(23): 2745-2749.CHE K K, WANG L J, ZHANG R T, et al. Preparation and release in vitro of triptolide-loaded poly(lactic-co-glycolic acid) microspheres for intra-articular injection[J]. Chinese Journal of New Drug, 2016, 25(23): 2745-2749.
[19] 李春兰, 杨小云, 孙昌霞. 穿心莲内酯微球制备工艺的优化[J]. 中国医药科学, 2018, 8(15): 44-46.LI C L, YANG X Y, SUN C X. Optimization of preparation technology of andrographolide Microsphere[J]. China Medicine and Pharmacy, 2018, 8(15): 44-46.
[20] 赵绿英, 李云贵, 姚海伦, 等. “薄荷素油微囊的制备”实验报告分析[J]. 科技创新与生产力, 2020(12): 70-73.ZHAO L Y, LI Y G, YAO H L, et al. Experimental report analysis on “preparation of peppermint oil microcapsules”[J]. Technological Innovation and Productivity, 2020(12): 70-73.