功能性油脂如中链甘油三酯(MCT)、共轭亚油酸(CLA)、ω-3系列不饱和脂肪酸等已经广泛用于肥胖、心脑血管疾病治疗中。其中,中链甘油三酯具有消化吸收快、快速供能等代谢特点[1-2],除用于术后快速补给、为脂肪代谢障碍的患者和早产婴儿提供能量等临床应用外[3],近几年其在健康食品以及养殖业[4]领域也具有广泛应用。共轭亚油酸是一种具有多生理功能的不饱和脂肪酸,可以通过影响细胞周期、促进脂肪细胞凋亡等来减少脂肪细胞数量,亦可通过降低PPARγ基因在脂肪细胞中的表达进而减少脂质的积累[5]。ω-3系列不饱和脂肪酸如α-亚麻酸[6-7]、二十二碳六烯酸(DHA)[8-10]等在心脑血管健康、代谢健康等方面也具有非常高的应用价值。
功能油脂对于肥胖的益处非常明显,相关研究报道亦很多,但对于健康个体的研究报道较少。实际上,无论是在食品业还是养殖业,中链甘油三酯、不饱和脂肪酸等功能油脂用于健康个体的营养干预以及疾病预防则更为普遍。2020年Tyler Maher等[11]以MCT和CLA为受试物、以体重正常人群和肥胖人群为研究对象,评估MCT/CLA干预后两种人群饱腹感及食欲的差异,结果发现MCT介导的胃排空延迟、β-羟丁酸(β-HB)浓度的升高和胃饥饿素(ghrelin)浓度的抑制在健康体重和肥胖个体中作用趋势类似,并且MCT对于健康体重个体胃排空延迟以及β-HB浓度的升高优于其对肥胖个体的作用,该结果提示健康体重个体对于MCT可能更加敏感。
基于此,本试验以健康体重大鼠为研究对象,在基础饲喂条件下灌胃功能油脂,综合考察功能油脂对健康体重大鼠脂肪囤积以及认知功能的影响,并评估其对大鼠脂肪代谢以及部分器官功能的影响。本试验选取中链甘油三酯、共轭亚油酸、富含α-亚麻酸的紫苏籽油、富含DHA的藻油为试验样品,其中复合物MCT含量在47%~73%之间波动,以重点观察MCT含量变化对于健康体重个体的影响。
1 材料与方法
1.1 试验材料
70%中链甘油三酯粉末、60%共轭亚油酸酯粉末、50%紫苏籽油粉末、10% DHA藻油粉、纯猪油:麦和(广州)实业有限公司;肿瘤坏死因子(TNF)-α ELISA试剂盒:北京四正柏生物科技有限公司;无水乙醇、二甲苯:国药集团化学试剂有限公司;HE染液、AB-PAS染色液:永津生物;中性树胶:国药集团化学试剂有限公司实验所用水均为蒸馏水。
1.1.2 试验动物
60只SD雄性大鼠,110~130 g,动物合格证号44822700002441,许可证SCXK(粤)2020-0051:珠海百试通生物科技有限公司。
1.2 仪器与设备
Morris水迷宫视频分析系统:上海移数科技有限公司;脱水机JJ-12J、包埋机JB-P5:武汉俊杰电子有限公司;病理切片机RM2016:上海徕卡仪器有限公司;组织摊片机KD-P:浙江省金华市科迪仪器设备有限公司;烤箱GFL-230:天津市莱玻瑞仪器设备有限公司;全自动生化分析仪7080:日立;全波长酶标仪:赛默飞世尔科技(中国)有限公司。
1.3 试验方法
1.3.1 试验材料
中链甘油三酯粉末(纯度70%)、共轭亚油酸酯粉末(60%)、紫苏籽油粉末(50%)、DHA藻油粉(10%)、纯猪油,为提高功能油脂的稳定性、生物利用度以及更有利于动物给药,本试验以酪蛋白酸钠、抗性糊精为主要辅料,将中链甘油三酯、共轭亚油酸、紫苏籽油、DHA藻油进行微囊化包裹处理,根据每种油脂特性及包裹率的差异分别制成不同含量的粉末,制备而成的粉末微囊粉具有水溶性强、稳定性好、生物利用度高等优点。
1.3.2 试验剂量
在食品行业为防止油脂摄入过多带来的脂肪囤积风险,相关法规规定了部分油脂的使用量,共轭亚油酸及其酯化物每日最大摄入量不超过6 g(国家卫健委2021年第7号公告),DHA每日最大摄入量≤300 mg(原卫生部2010年第3号公告),中链甘油三酯和紫苏籽油无摄入量限制。本研究所用DHA藻油粉含10%DHA,也就是相当于DHA藻油粉每日最大摄入量≤3 g,所以在本试验“健康油脂组”中DHA藻油粉最大添加比例为30%。
粉末共轭亚油酸甘油酯含60%CLA,相当于粉末共轭亚油酸甘油酯每日最大摄入量不超过10 g。共轭亚油酸每日限量为6 g,而研究[12]表明日摄入低于1 g即可起到抑制脂肪囤积的作用,食品行业出于安全、经济考量通常控制每日摄入量为1~3 g甚至更低,本试验粉末共轭亚油酸最大添加量为“复合物高剂量组”3 g,即共轭亚油酸1.8 g。本试验按照梯度浓度设计组别,选取日摄入量10 g进行动物给药折算。
60只SD雄性大鼠随机分为对照组、猪油组、健康油脂组、复配油脂低、中、高剂量组,共6组,每组10只,灌胃28 d。
对照组:按照动物体重1 mL/100 g灌胃蒸馏水。
猪油对照组:按照动物体重0.9 g/kg灌胃[13]。
健康油脂组(ω-3脂肪酸组):取50%粉末紫苏籽油、10% DHA藻油粉按照质量比7∶3进行混合,按照动物体重0.9 g/kg给药。
复合油脂低剂量(MCT:47%)组:取70%粉末中链甘油三酯、60%粉末共轭亚油酸酯、50%粉末紫苏籽油、10%DHA藻油粉按照质量3.5∶1.5∶3.5∶1.5进行混合,按照动物体重0.9 g/kg给药。
复合油脂中剂量(MCT:60%)组:取70%粉末中链甘油三酯、60%粉末共轭亚油酸酯、50%粉末紫苏籽油、10%DHA藻油粉按照质量5∶2∶2∶1进行混合,按照动物体重0.9 g/kg给药。
复合油脂高剂量(MCT:73%)组:取70%粉末中链甘油三酯、60%粉末共轭亚油酸酯按照质量比7∶3进行混合,按照动物体重0.9 g/kg给药。
1.4 一般情况
每3天记录大鼠体重和摄食量,每天记录饮水量,灌胃油脂每日现称现用。最后一日,麻醉大鼠测量大鼠体长及体重,计算Lee’s指数。
1.5 水迷宫试验
最后4天对各组大鼠进行水迷宫测试。定向巡航试验:连续进行3天,试验按照第I、III、IV象限的顺序将大鼠面向池壁分别从3个入水点放入水中,系统记录其在2 min内寻找到平台的时间(逃避潜伏期,Escape Latency,EL)。如大鼠在2 min内未能找到平台,则由试验人员使用木棒将其引导至平台水囊,让大鼠停留10 s,在放回笼中。全部大鼠完成1个象限的测试后再进行下一个象限的测试,直至完成所有测试。
空间探索试验:于试验的第4天,将平台撤去,将大鼠放入水池中,记录并分析2 min内大鼠的游泳轨迹,统计数据包括:逃避潜伏期、平台穿越次数、小鼠在中央区域游泳的路程和时间以及首次路过平台前的路程。
1.6 脂肪情况
末次水迷宫试验后,大鼠麻醉后腹主动脉取血,随后分离并称重肾周脂肪、腹部脂肪、附睾脂肪和心外膜脂肪。
1.7 血液指标情况
末次水迷宫试验后,大鼠麻醉后腹主动脉取血。采用全自动生化分析仪检测血液生化指标,包括瘦素(leptin)、总胆固醇(TC)、血清甘油三酯(TG)、血清高密度脂蛋白胆固醇(HDL-C)、血清低密度脂蛋白胆固醇(LDL-C)。ELISA法测肿瘤坏死因子(TNF)-α水平。
1.8 病理情况
大鼠腹主动脉取血后,统一取出肝小叶及小肠,用生理盐水冲洗,除去淤血及内容物,滤纸吸干后及时置于4%多聚甲醛液中固定,HE染色后在显微镜下观察。
1.9 数据分析
采用SPSS19.0统计软件,数据以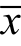 ±s表示,两组间比较采用独立样本T检验,多组样本间比较采用ANOVA分析,根据方差齐性检验结果选择LSD或Dunnett’s检验,以P<0.05为有统计意义。
±s表示,两组间比较采用独立样本T检验,多组样本间比较采用ANOVA分析,根据方差齐性检验结果选择LSD或Dunnett’s检验,以P<0.05为有统计意义。
2 结果与分析
2.1 大鼠一般情况
大鼠按分组灌胃4周后,各组大鼠体重及Lee’s指数无差异。与对照组相比,猪油组空腹血糖值无显著差异。与猪油组相比,健康油脂组和复配不同剂量组空腹血糖值显著降低。说明4周油脂灌胃不会对大鼠的生长造成明显的影响,但复配油脂和健康油脂显然在控制血糖上有一定的优势。见图1。
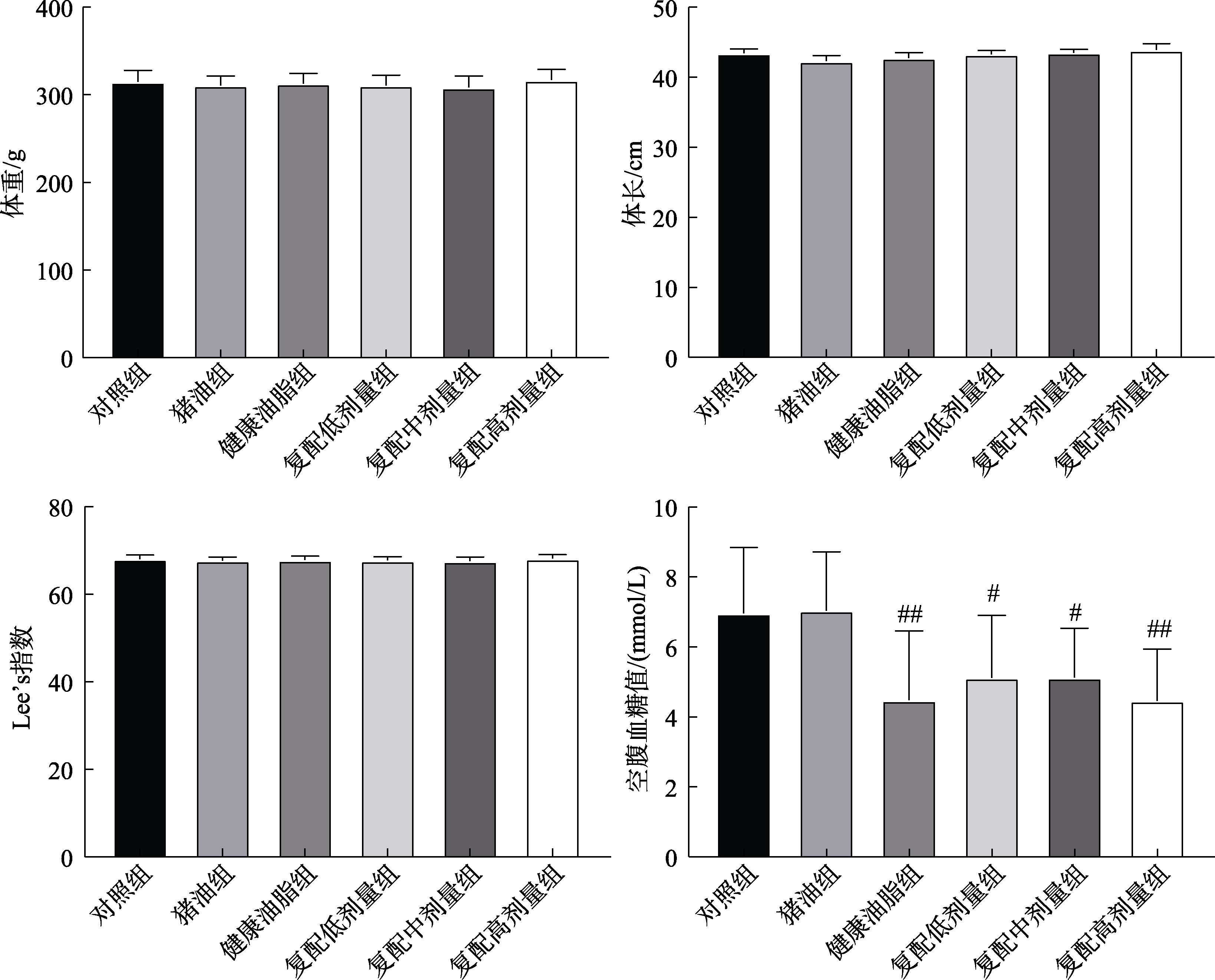
图1 各组大鼠体重、体长、Lee’s指数及空腹血糖值
Fig.1 Bodyweight, body length, Lee’s index and fasting glucose values of rats in each group
注:“#”与猪油组比,P<0.05;“##”与猪油组比,P<0.01,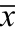 ±s。
±s。
Note: “#” compared with lard group, P<0.05; “##” compared with lard group, P<0.01,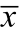 ±s.
±s.
2.2 大鼠脂肪情况
大鼠按分组灌胃4周后,各组大鼠腹部脂肪无显著差异;与对照组相比,猪油组肾周脂肪、附睾脂肪和心外膜脂肪重量显著升高;与猪油组相比,健康油脂组、复配低和高剂量组肾周脂肪、附睾脂肪和心外膜脂肪重量显著降低。长期食用动物油脂造成了大鼠多个部位脂肪的积累,是一种不健康的现象。健康油脂及复配油脂在控制体脂上优势明显。见图2。

图2 各组大鼠脂肪囤积情况
Fig.2 Fat accumulation in each group of rats
注:“*”与对照组比,P<0.05;“##”与猪油组比,P<0.01,x±s。
Note: “*” compared with control group, P<0.05; “##” compared with lard group, P<0.01,x±s.
2.3 大鼠记忆力情况
Morris水迷宫测试提示各组大鼠间的逃避潜伏期、穿台次数、上台前路程、上台前路程与时间比值,这五个指标均无显著性差异。有研究表明,肥胖会造成记忆力障碍[14],因此本试验探究了油脂对记忆力的影响,尽管猪油组大鼠出现了明显的肥胖,但在记忆力上未见明显的变化,说明短期的油脂高摄入对记忆力影响不大,但长期摄入仍需注意。见表1和2。
表1 各组大鼠定位航行逃避潜伏期
Table 1 Latency of localized navigation evasion for each group of rats
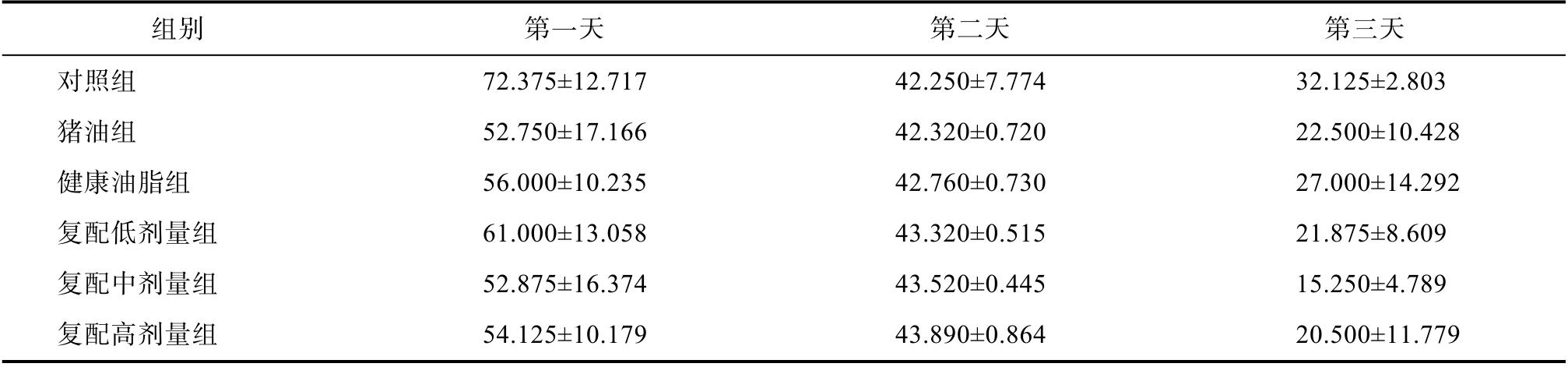
组别 第一天 第二天 第三天对照组 72.375±12.717 42.250±7.774 32.125±2.803猪油组 52.750±17.166 42.320±0.720 22.500±10.428健康油脂组 56.000±10.235 42.760±0.730 27.000±14.292复配低剂量组 61.000±13.058 43.320±0.515 21.875±8.609复配中剂量组 52.875±16.374 43.520±0.445 15.250±4.789复配高剂量组 54.125±10.179 43.890±0.864 20.500±11.779
2.4 大鼠血脂、肝功及血清炎症水平
与对照组相比,猪油组血清中TNF-α和谷丙转氨酶水平显著升高;与猪油组相比,健康油脂组和复配中剂量组谷丙转氨酶水平显著降低,复配高剂量组血清TNF-α和谷丙转氨酶水平显著降低。上述结果证实4周猪油摄入会使得肝脏受到较大负荷,引起肝功损伤,而复配油脂对肝功影响不大亦不会引起炎症因子水平上升。见图3和4。

图3 各组大鼠血清中相关指标
Fig.3 Relevant indexes in the serum of each group of rats
注:“△”与健康油脂组比,P<0.05,“##”与猪油组比,P<0.01,x±s。
Note: “△” compared with health oil group, P<0.05; “##” compared with lard group, P<0.01,x±s.

图4 各组大鼠血清中相关指标
Fig.4 Relevant indexes in the serum of each group of rats
注:“*”与对照组比,P<0.05;“**”与对照组比,P<0.01;“#”与猪油组比,P<0.05;“##”与猪油组比,P<0.01,x±s。
Note: “*” compared with control group, P<0.05; “**” compared with control group, P<0.01; “#” compared with lard group, P<0.05;“##” compared with lard group, P<0.01,x±s.
2.5 大鼠肝脏和小肠的组织病理结构变化
如图所示,28 d的油脂灌胃后,各组大鼠的肝脏组织结构排列紧密,结构清晰,无明显组织结构变化。各组大鼠小肠组织完整,杯状细胞结构稳定,无明显组织水肿或上皮脱落,无明显组织结构变化,说明摄入这几种油脂28 d尚不会引起器质性脏器损伤。见图5和6。

图5 肝脏组织HE染色
Fig.5 Hematoxylin-eosin staining of liver tissue
表2 各组大鼠空间探索情况
Table 2 Spatial exploration of rats in each group

组别 穿台次数/次 上台前路程/cm 路程比值 时间比值对照组 5.900±2.025 26 781.240±2 364.260 8.870±3.486 6.754±2.610猪油组 7.500±1.78027 292.210±2 329.520 7.770±1.474 6.695±1.530健康油脂组 7.700±2.214 27 169.200±2 287.550 7.821±1.720 6.068±0.864复配低剂量组 7.100±3.315 26 245.120±4 159.440 8.074±1.792 5.760±2.279复配中剂量组 6.300±2.541 26 399.520±2 486.000 8.282±2.946 6.707±2.454复配高剂量组 7.100±2.846 24 458.180±5 640.480 7.786±2.158 4.966±2.265

图6 小肠组织HE染色
Fig.6 Hematoxylin-eosin staining of small intestine tissue
3 讨论与结论
合理的膳食结构对维持健康极为重要,与植物油相比,猪油等动物油所含的大多是饱和脂肪酸,这种物质能够促进胆固醇合成,为机体合成胆酸、构成细胞膜、合成激素等活动提供能量。然而过量的动物油摄入会给机体带来极大的负担,猪油灌胃大鼠4周尽管对体重、Lee’s指数等无明显影响,但外周脂肪比例显著性增加,外周血清炎症指标上升。过量动物油脂的摄入虽然在短期内对肝脏和小肠的病理结构没有造成显著性破坏,但肝功已经出现了异常,可预见性的长期摄入会给机体造成极大负担进而引发损伤。
已有文献报道,肥胖会导致记忆力的降低[15-16]。而在本研究中,短时间的试验并未使动物体重出现明显变化,脂肪的过度积累亦未造成记忆力衰退,证实肥胖引起的记忆力变化是一个慢性的、长期的过程。脂肪堆积是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态,合理的复配油脂在降低甘油三酯方面有着明显的优势,但无明显的剂量依赖性则说明配方油脂的合理性对控制油脂摄入导致的甘油三酯水平偏高有着重要意义。
[1] CARLSON S J, NANDIVADA P, CHANG M I, et al. The addition of medium-chain triglycerides to a purified fish oil-based diet alters inflammatory profiles in mice[J]. Metabolism, 2015,64(2): 274-282.
[2] 钱平, 李晓莉, 韩培涛, 等. 灌胃中链甘油三酯不同时程对小鼠抗疲劳作用的影响[J]. 中国油脂, 2019, 44(1): 56-60.QIAN P, LI X L, HAN P T, et al. Effects of gastric administration of medium-chain triglycerides with different time courses on anti -fatigue function in mice[J]. China Oils and Fats, 2019, 44(1):56-60.
[3] 刘小杰, 何国庆, 陶飞, 等. 中链甘油三酯及其在食品工业中的应用[J]. 食品科学, 2005(8): 469-472.LIU X J, HE G Q, TAO F, et al. Medium-chain triglyceride and its application in food industry[J]. Food Science, 2005(8): 469-472.
[4] 崔志娟, 齐鸣, 谭碧娥. 中链脂肪酸甘油三酯在仔猪中的消化吸收及生理功能[J]. 动物营养学报, 2021, 33(10): 5441-5448.CUI Z J, QING M, TAN B E. Digestion, absorption and physiological function of medium-chain fatty acid triglyceride in piglets[J]. Chinese Journal of Animal Nutrition, 2021, 33(10):5441-5448.
[5] 邹朝霞, 李影. 共轭亚油酸减少动物脂肪沉积的分子机制研究进展[J]. 中国细胞生物学学报, 2021, 43(10): 2061-2070.ZOU Z X, LI Y. Advances in the molecular mechanism of conjugated linoleic acids in decreasing fat deposition[J]. Chinese Journal of Cell Biology, 2021, 43(10): 2061-2070.
[6] KAMALASHIRAN C, PATTARAARCHACHAI J,MUENGTAWEEPONGSA S. Feasibility and safety of perilla seed oil as an additional antioxidative therapy in patients with mild to moderate dementia[J]. Journal of Magnetic Resonance Imaging, 2018, 2018: 5302105.
[7] 吴璟, 李红兵, 杨洋. 紫苏油对大鼠慢性脑低灌注损伤所致认知损害的保护作用[J]. 华西药学杂志, 2012, 27(6): 639-640.WU J, LI H B, YANG Y. Effect of perilla oil on chronic hypoperfusion of the brain induced cognitive injury in rats[J].West China Journal of Pharmaceutical Sciences, 2012, 27(6):639-640.
[8] 于金慧, 王瑜, 彭振英, 等. 裂殖壶藻藻油DHA对高脂饮食诱导肥胖小鼠的影响[J]. 微生物学通报, 2017, 44(11): 2679-2688.YU J H, WANG Y, PEN Z Y, et al. Effects of docosahexaenoic acid from Schizochytrium sp. on high fat diet induced obesity in mice[J]. Microbiology China, 2017, 44(11): 2679-2688.
[9] CHENG L, HU T, SHI H, et al. DHA reduces hypothalamic inflammation and improves central leptin signaling in mice[J].Life Sciences, 2020, 257: 118036.
[10] GAO Y, SU J, ZHANG Y, et al. Dietary DHA amplifies LXA4 circuits in tissues and lymph node PMN and is protective in immune-driven dry eye disease[J]. Mucosal Immunology, 2018,11(6): 1674-1683.
[11] MAHER T, DELEUSE M, THONDRE S, et al. A comparison of the satiating properties of medium-chain triglycerides and conjugated linoleic acid in participants with healthy weight and overweight or obesity[J]. European Journal of Nutrition, 2021, 60(1): 203-215.
[12] 李彤, 黄芳, 陈杰东, 等. 共轭亚油酸对高脂饲料诱导肥胖大鼠脂质蓄积和肠道菌群的影响[J]. 食品工业科技, 2022,43(2): 346-353.LI T, HUANG F, CHEN J D, et al. Effects of conjugated linoleic acid on lipid accumulation and intestinal microbiota in obese rats induced by high-fat diet[J]. Science and Technology of Food Industry, 2022, 43(2): 346-353.
[13] 张月华, 姬凤彩, 姚刚. 不同动物油脂对大鼠血糖血脂及血液相关因子的影响研究[J]. 新疆农业大学学报, 2013, 36(4):275-280.ZHANG Y H, JI F C, Y G, et al. Effects of different animal fatty oils on plasma glucose, lipids and related blood factors in rats[J].Journal of Xinjiang Agricultural University, 2013, 36(4): 275-280.
[14] ARNORIAGA-RODRIGUEZ M, MAYNERIS-PERXACHS J,BUROKAS A, et al. Obesity impairs short-term and working memory through gut microbial metabolism of aromatic amino acids[J]. Cell Metabolism, 2020, 32(4): 548-560.
[15] LUCHSINGER J A, TANG M X, SHEA S, et al. Caloric intake and the risk of Alzheimer disease[J]. Archives of Neurology,2002, 59(8): 1258-1263.
[16] CHOI J M, LEE S I, CHO E J. Effect of vigna angularis on high-fat diet-induced memory and cognitive impairments[J].Journal of medicinal Food, 2020, 23(11): 1155-1162.