谷子是我国主要杂粮作物之一,属耐干旱和耐贫瘠作物,对于缓解农业用水压力,有效利用旱地、半旱地资源具有极其重要意义[1-2]。谷子去壳后留有胚芽部分和糠层部分为糙小米,糙小米再经精制为小米,小米营养丰富,每100 g小米含碳水化合物63~70 g、粗蛋白约13 g、脂肪2.8~8.0 g[3],另外还富含多酚和类胡萝卜素等功能成分[4]。目前谷子以生产小米粥为主要加工方式,加工方式单一严重限制着谷子产业的发展。
近年来,发芽技术因其成本低、速度快、无污染的特点,广泛受到关注[5]。谷物发芽过程中,蛋白质、氨基酸、维生素、黄酮类化合物均会有显著的提高,对调整谷物营养,提高谷物的功能特性具有重要意义[6]。谷物发芽会导致蛋白质的水解,促进游离氨基酸的升高。郑艺梅[7]等分析了发芽糙米对蛋白质和氨基酸组成的影响,发现糙米发芽后,易于被消化吸收的谷蛋白增加了,同时游离氨基酸含量也提高了。李欣[8]等对4个品种的糙米进行发芽处理后,必需游离氨基酸组分增加了0.6~15.6倍,充分增加了蛋白质的消化率。另外,发芽还会促进谷物γ-氨基丁酸(GABA)的增加,提高谷物的生理功能活性。
然而,目前对于玉米[5]、大米[7-8]、小麦[9]和大豆[10]等的发芽研究较多,对糙小米发芽的研究较少。发芽糙小米作为一种重要的谷子深加工产品,在发芽过程中可以提高GABA的含量,宁亚维[11]等优化了糙小米的发芽工艺,使GABA含量高达184.75 mg/100g,比未发芽的糙小米提高了8.44倍,远高于糙米(大米)发芽后GABA的含量(20~90 mg/100g)[12-13],因此以糙小米为原料进行发芽处理对于富集GABA有积极意义。
温度和时间是影响谷物发芽的两个重要因素,进而影响着谷物游离氨基酸的积累,而游离氨基酸对于改善谷物营养价值有重要意义。糙小米颗粒小,发芽速度快,对发芽温度和时间较为敏感。本研究分析了糙小米在发芽过程中不同温度和时间对游离氨基酸变化的影响,描述了发芽技术在改善糙小米营养价值和提高糙小米功能特性方面的潜力。
1 材料与方法
1.1 材料与试剂
实验所用谷子为中谷2号品种,为春夏谷兼播品种,适应性广,可在华北、西北、东北、新疆播种,米质优良,2019年收割于河北省石家庄市藁城区马庄实验站。
次氯酸钠(有效氯≥10%),分析纯:天津市百世化工有限公司;无水氯化钙,分析纯:天津永晟化工有限公司;盐酸,分析纯:天津市大茂化学试剂厂;实验用水为纯水,Heal Force水净化系统:上海康雷分析仪器有限公司。
1.2 仪器与设备
恒温培养箱,SPX型:北京科伟永兴仪器有限公司;超声波清洗器,KQ-300DE:昆山市超声仪器有限公司;全自动氨基酸分析仪,L-8900型:日本日立公司;真空冷冻干燥机,D37520:德国Martin Christ公司;粉碎机,MDJ-D4072型:广东小熊电器有限公司。
1.3 实验方法
1.3.1 发芽糙小米的制备
糙小米发芽过程中会因脂肪酸氧化而产生不良气味,前期发现糙小米发芽24 h时气味较淡,再延长发芽时间,将会使发芽糙小米产生不良气味,为了考察氨基酸随发芽时间的变化,在本实验特意将发芽时间延长至30 h。具体发芽过程如下:500 g谷子经脱壳后留下胚芽形成糙小米。糙小米经纯水漂洗,除去悬浮的瘪粒和杂质,用10%(v/v)的次氯酸钠溶液消毒5 min,再用纯水洗净,然后于恒温培养箱中用0.5%(w/v)的氯化钙溶液浸泡12 h,浸泡后的糙小米均匀置于铺有纱布的白瓷托盘中发芽,浸泡温度和发芽温度相同,设置为20、25、30、35、40 ℃,每个温度下的发芽时间为0,6,12,18,24、30 h,每个样品3次重复。糙小米发芽期间,用蒸馏水喷洒保持湿润,每个时间段的发芽糙小米经冷冻干燥后,粉碎过100目筛,并于-20 ℃下保存备用。
1.3.2 发芽糙小米游离氨基酸的测定
游离氨基酸的测定根据文献[14]的报道,并作一定的修改。准确称取1 g试样(精确至0.000 1 g)于100 mL容量瓶内,加入80 mL的0.02 mol/L盐酸溶液,振荡混匀后,超声处理30 min,再用0.02 mol/L盐酸溶液定容至刻度,混匀后吸取2 mL溶液l0 000 r/min离心5 min,上清液经0.22 μm滤膜过滤供全自动氨基酸分析仪测定。
1.4 数据分析
实验中总氨基酸为各游离氨基酸组分的加和;利用MultiExperiment Viewer 4.9.0软件(网络免费软件)进行聚类分析,其中化合物的峰面积需要经过标准化处理(auto-scaling,离均差除以标准偏差),距离度量(Distance metric)选择Pearson相关性;利用SPSS 21.0(美国IBM公司)软件进行多重比较分析(Duncan test)和Pearson相关性分析。
2 结果与分析
2.1 不同发芽温度和时间对发芽糙小米游离氨基酸的影响
发芽初始阶段,不同处理的发芽糙小米氨基酸含量差异不大,在发芽过程中氨基酸含量才有了明显的变化,说明消毒和浸泡阶段对发芽糙小米中氨基酸的积累作用不大。发芽温度和时间是糙小米发芽的两个关键因素,对发芽糙小米游离氨基酸的变化有着重要影响。图1a显示在不同的温度下(20~40 ℃)随着发芽时间的增加,游离氨基酸的总量均有明显的增加,说明发芽能够促进氨基酸的富集。发芽温度过高或过低均会影响总游离氨基酸的增加,其中30 ℃下总游离氨基酸增加最多,最高值在第30 h达到(810.7±69.0) mg/100g,约为0 h的8.4倍;温度在20和25 ℃下,总游离氨基酸增加较为缓慢;35 ℃下总游离氨基酸增加最快,但是在18 h后氨基酸增加开始变缓;40 ℃下反而不利于氨基酸的增加。种子发芽过程中,蛋白酶会水解蛋白质促进游离氨基酸的增加[7,15],蛋白酶的活性跟温度有着重要关系,温度过高或过低均会影响蛋白酶的活性,影响游离氨基酸的积累[16]。
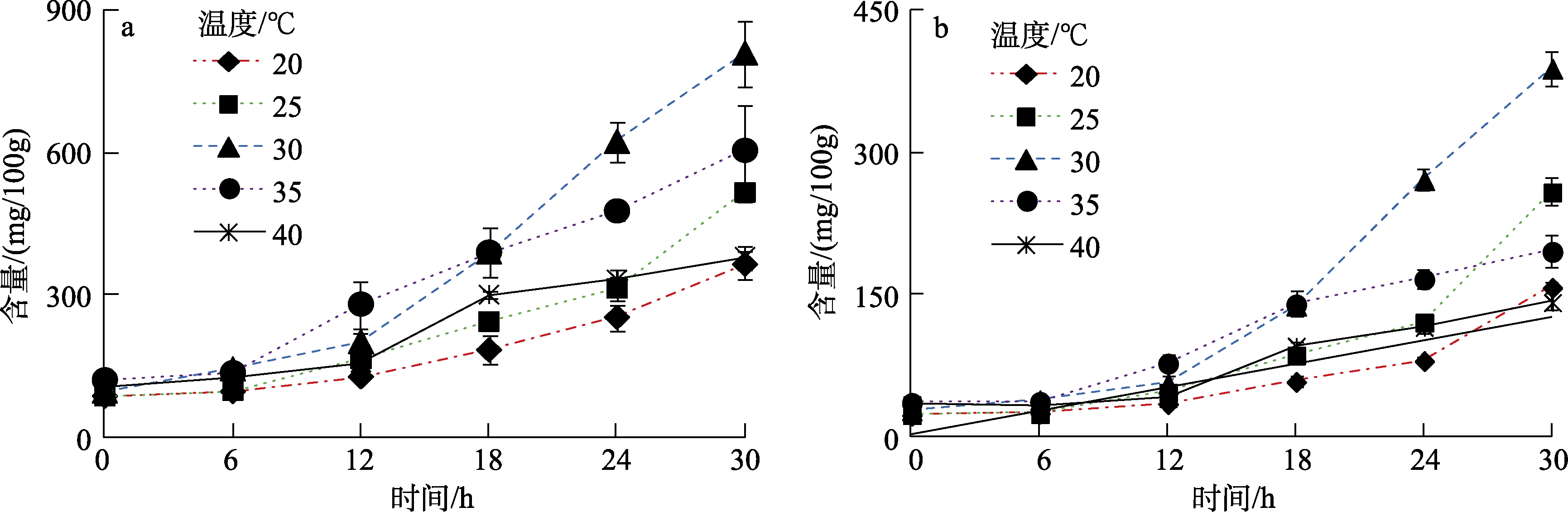
图1 不同温度和时间下发芽糙小米总游离氨基酸(a)和总必需游离氨基酸变化(b)
Fig.1 Variations of the contents of total free amino acids (a), and total essential amino acids(b) during the germination of the foxtail millet at different temperatures and time
发芽糙小米必需游离氨基酸的总量也有明显的增加(图1b),发芽之后的总必需游离氨基酸量约为发芽前的4.1~12.9倍,其中以30 ℃增加最多,为(367.8±30.2) mg/100g,说明发芽能够调整谷子的营养,提高必需游离氨基酸的含量,这一现象已经在大米发芽中得到了证明[7]。
2.2 发芽过程中不同类型氨基酸含量变化
发芽过程会促进蛋白质的水解,促进游离氨基酸的增加,而游离氨基酸的增加又会提高蛋白质的生物利用率。在发芽过程中,一些功能性氨基酸含量也会提高,从而促进糙小米相关活性的提高。
2.2.1 天冬氨酸族氨基酸的变化规律分析
在柠檬酸循环中,草酰乙酸可以合成天冬氨酸,在天冬氨酸族氨基酸中,天冬氨酸是蛋氨酸、苏氨酸、异亮氨酸和赖氨酸的前体物质[17]。天冬氨酸(Asp)属于非必需氨基酸,具有改善心肌功能,增强肝脏功能和消除疲劳的作用,在30 ℃下发芽糙小米天冬氨酸含量可达到最高,为(14.0±2.0) mg/100g(图2a)。苏氨酸(Thr)属于必需氨基酸,主要为食品添加剂和饲料强化剂,对促进机体生长发育具有积极作用[18],在30 ℃下发芽可达到(106±1.0) mg/100g,远高于其它发芽温度下形成的苏氨酸含量(图2b)。蛋氨酸(Met)属于必需氨基酸,为含硫氨基酸,可用于防治慢性或者急性肝炎,也可用于缓解有机试剂引起的中毒反应,在30 ℃下发芽可达到(28.0±3.0) mg/100g(图2c)。异亮氨酸(Ile)属于必需氨基酸,具有增加饮食和抗贫血的功效,并且能够治疗精神障碍,在30 ℃下发芽可达到(32.0±4.0) mg/100g(图2d)。赖氨酸(Lys)属于必需氨基酸,并且在谷物中属于第一限制氨基酸[19],对于提高人体发育,增强免疫力和提高中枢神经组织功能具有积极作用,随着发芽温度的升高其积累量也逐渐增高,40 ℃下发芽可达到(12.0±3.0) mg/100g(图2e),约为发芽前的2~3倍,但是发芽后的赖氨酸含量依然很低,仍为限制性氨基酸。天冬氨酸在生物合成中是蛋氨酸、苏氨酸、异亮氨酸和赖氨酸的前体物质,在糙小米发芽过程中均呈现了增加趋势,原因可能是蛋白质的水解增加了这几种氨基酸的含量。

图2 不同温度和时间下发芽糙小米天冬氨酸族氨基酸的变化规律
Fig.2 Variations of aspartic acid family from brown foxtail millet during different germination time and temperatures
2.2.2 谷氨酸族氨基酸的变化规律分析
在柠檬酸循环中,α-酮戊二酸是谷氨酸的前体物质,谷氨酸又可以合成脯氨酸和精氨酸[20]。谷氨酸(Glu)为非必需氨基酸,且属于酸性氨基酸,在自然界中普遍存在,具有降低人体血氨、维持和促进脑细胞功能,治疗肝功能不足等作用,在30 ℃下积累达到最高,达到(54.0±3.0) mg/100g,为发芽前的5.4倍(图3a)。脯氨酸(Pro)为环状的亚氨基酸,属于非必需氨基酸,具有维持皮肤和结缔组织健康的功能,在30 ℃下发芽可达到最高,为(54.0±9.0) mg/100g(图3b)。精氨酸(Arg)为碱性氨基酸,属于非必需氨基酸,能够参与鸟氨酸循环,有降低血氨和促进生殖的功能[21],在30和35 ℃下发芽,糙小米中精氨酸含量可达到最高,分别为(43.0±4.0)和(41.0±3.0) mg/100g(图3c)。在生物合成氨基酸中,谷氨酸为脯氨酸和精氨酸的前体物质,在糙小米发芽过程中,这3种氨基酸均有了显著增加的趋势。

图3 不同温度和时间下发芽糙小米谷氨酸族氨基酸的变化规律
Fig.3 Variations of glutamic acid family from brown foxtail millet during different germination time and temperatures
2.2.3 丝氨酸族氨基酸的变化规律分析
在糖酵解过程中,由甘油酸-3-磷酸可以形成丝氨酸,而丝氨酸可以形成甘氨酸[22]。丝氨酸(Ser)属于非必需氨基酸,是合成生物体内嘌呤、嘧啶、磷脂等的重要前体物质。糙小米在30 ℃下发芽其含量可以达到最高,为(42.0±4.0) mg/100g。甘氨酸为最简单的氨基酸,可用于治疗重症肌无力,并且常用于食品和饲料的添加剂,在糙小米发芽过程中甘氨酸在30 ℃下达到了(13.0±2.0) mg/100g。
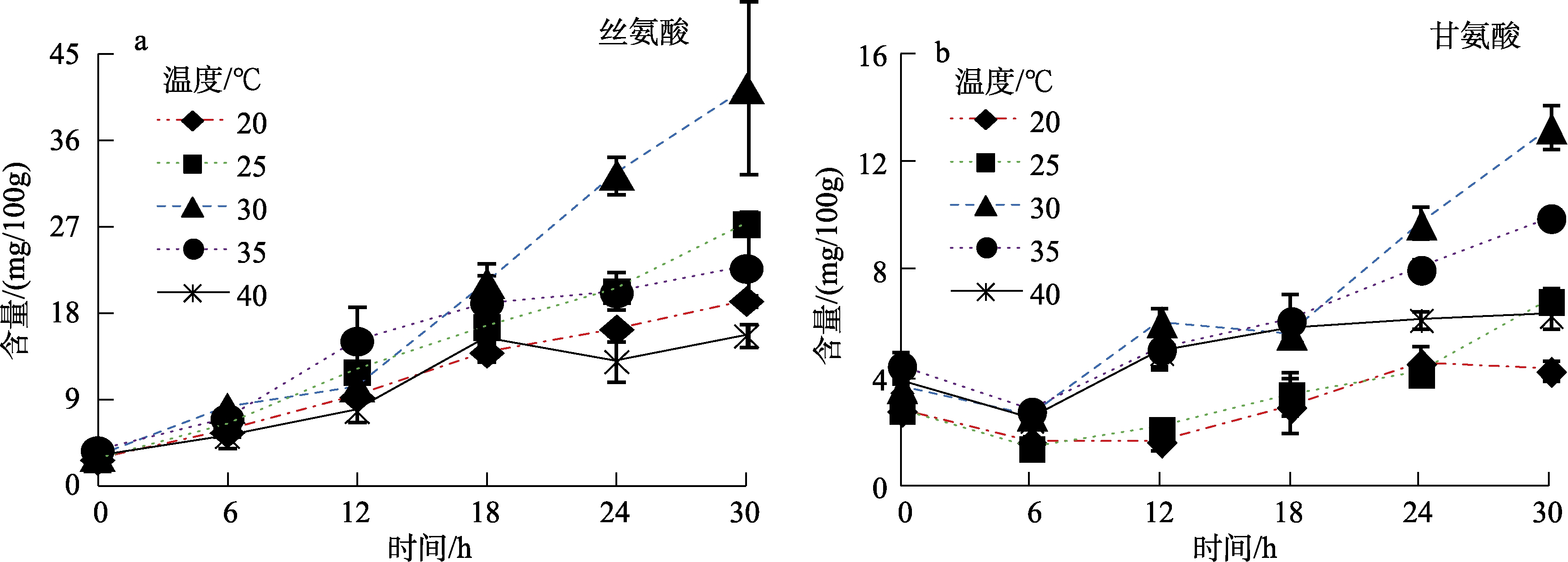
图4 不同温度和时间下发芽糙小米丝氨酸族氨基酸的变化规律
Fig.4 Variations of serine family from brown foxtail millet during different germination time and temperatures
2.2.4 丙酮酸族氨基酸的变化规律分析
丙酮酸为糖酵解途径的最终产物,可以合成丙氨酸、缬氨酸和亮氨酸[23]。丙酮酸族氨基酸包括丙氨酸、缬氨酸和亮氨酸,其中丙氨酸具有促进葡萄糖代谢,延缓低血糖的功能,在30和35 ℃下发芽,糙小米中丙氨酸含量可达到最高,分别为(120.0±12.0)和(115.0±14.0) mg/100g。缬氨酸和亮氨酸均属于必需氨基酸,具有促进机体生长和调节血糖的功能,30 ℃下发芽,糙小米中缬氨酸含量可达到最高,达到(51.0±6.0) mg/100g;40 ℃下发芽,糙小米中亮氨酸含量可达到最高,达到(60.0±10.0) mg/100g。
2.2.5 磷酸戊糖途径中形成的氨基酸的变化规律分析

图5 不同温度和时间下发芽糙小米丙酮酸族氨基酸的变化规律
Fig.5 Variations of pyruvic acid family from brown foxtail millet during different germination time and temperatures
磷酸戊糖途径形成的氨基酸主要有苯丙氨酸、酪氨酸、色氨酸和组氨酸,其中苯丙氨酸和色氨酸属于必需氨基酸。苯丙氨酸可以转化形成酪氨酸,而酪氨酸具有形成黑色素和抗抑郁的功能,糙小米在30 ℃下发芽时苯丙氨酸和酪氨酸含量可达到最高,分别为(37.0±3.0)和(37.0±2.0) mg/100g。色氨酸具有防治癞皮病和改善睡眠的功能,在30 ℃下发芽时色氨酸含量可达到最高,为(26.0±2.0) mg/100g。组氨酸属于半必需氨基酸,能够产生组胺,具有扩张血管的功能[24],在30 ℃下发芽时含量可达到最高,为(29.0±2.0) mg/100g。

图6 不同温度和时间下发芽糙小米磷酸戊糖途径形成的氨基酸的变化规律
Fig.6 Variations of amino acids in pentose phosphate pathway from brown foxtail millet during different germination time and temperatures
2.2.6 GABA的变化规律分析
糙小米在发芽过程中GABA也会逐渐积累,尤其是在35 ℃增加到最高,可达到(60.1±1.8) mg/100g,远高于发芽前的(15.7±1.3) mg/100g(图7)。宁亚维[11]等在糙小米发芽过程中检测到GABA含量可达184.75 mg/100g,远高于本实验中GABA的含量,可能原因是宁亚伟等在检测GABA时采用的分光光度法,测定的结果容易偏高。Glu是糙小米中的主要氨基酸,不同发芽温度下的发芽糙小米中含量差异较大,其中在35 ℃含量较低,为(42±3.7) mg/100g(图3a)。GABA的前体物质为Glu,对发芽30 h过程中Glu和GABA含量的变化进行Pearson相关性分析,相关系数为-0.831,二者呈现显著负相关(P=0.032),说明糙小米芽过程中GABA的增加可能由Glu形成。GABA是一种非蛋白质氨基酸,具有降血压、利尿、镇定等功能[25],在人脑中Glu在谷氨酸脱羧酶的作用下可转化生成GABA[26-27],但是随着年龄的增加和生活压力的加大,GABA的积累会逐渐降低,因此从外界获取GABA尤为必要[28]。经研究,GABA在自发性高血压大鼠(SHR)中口服的有效最低剂量为0.3~1 mg/kg[29-30]。在本实验中,发芽糙小米中的GABA含量可达(60.1±1.8) mg/100g,可以作为一种潜在的功能食品被开发和利用。
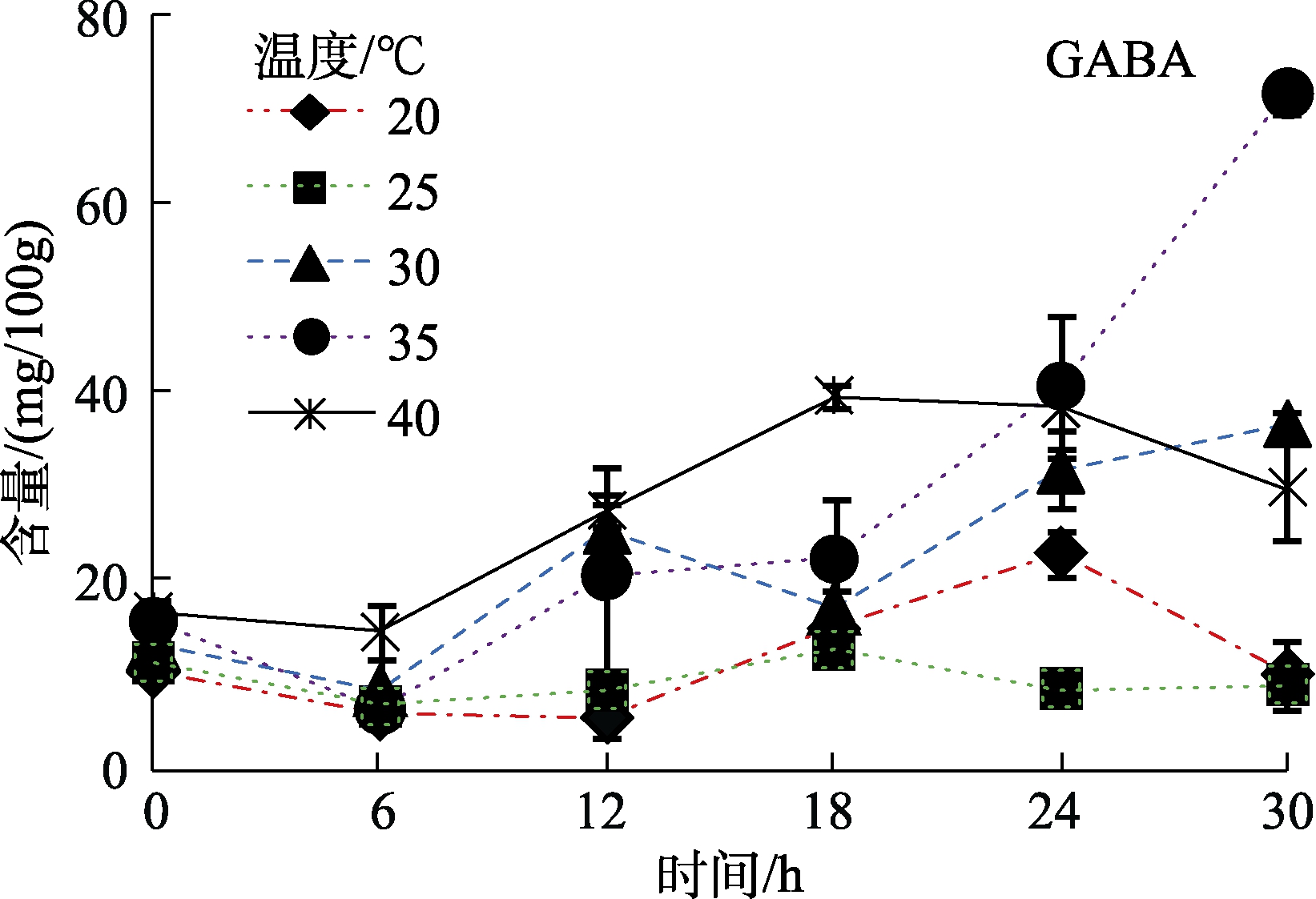
图7 不同温度和时间下发芽糙小米牛磺酸和GABA的变化规律
Fig.7 Variations of taurine and γ-aminobutyric acid from brown foxtail millet during different germination time and temperatures
在糙小米发芽过程中,不同种类的氨基酸含量均会提高,其中在30 ℃下,大多数氨基酸含量增加最多。氨基酸的增加一方面促进了蛋白质消化率的提高,另一方面一些功能氨基酸的增加也会提高发芽糙小米的功能特性。
2.3 多元统计分析糙小米发芽过程中氨基酸的变化规律
热图分析属于聚类分析,能够将具有相同变化规律的化合物或样品聚类,通过颜色显示化合物的变化规律。对不同温度和时间下发芽糙小米游离氨基酸组分进行热图分析(图8),发现21种氨基酸组分随着发芽时间的增加均呈现增加现象,但是不同温度下各氨基酸组分的增加速率和增加量不一致。在20 ℃下,大多数氨基酸增加不明显;30 ℃下直到发芽30 h氨基酸组分才有了明显的增加;35 ℃下在发芽18 h便有明显的增加,到30 h氨基酸组分增加到最大;而在35 ℃下,氨基酸从12 h便开始有所增加,然而最终的增加量却低于30 h;在40 ℃下,大多数氨基酸组分在18 h开始有明显增加,但是之后的增加速率变缓慢了。不同温度和时间下发芽糙小米游离氨基酸组分的变化趋势和总游离氨基酸的变化趋势较为一致,最终氨基酸的含量受温度的影响较大。

图8 不同温度和时间下发芽糙小米游离氨基酸组分的变化
Fig.8 Variations of the contents of free amino acid components during the germination of the foxtail millet at different temperatures and time
注:A、B、C、D和E分别表示20、25、30、35和40 ℃,1、2、3、4、5和6分别表示发芽0、6、12、18、24和30 h。红色区域表示氨基酸含量高于平均值,绿色区域表示低于平均值。
Note: A, B, C, and D represent the germination temperatures of 20, 25, 30, 35, and 40 ℃; 1, 2, 3, 4, 5, and 6 represent the germination time of 0, 6, 12, 18, 24, and 30 h. Green indicates that the level of the amino acid was less than the mean level, whereas red indicates that the level of the amino acid was higher than the mean level.
主成分分析属于一种降维分析,能够将多个变量转化为少数变量的分析,解决变量太多而不易统计分析的问题,并且也可以观察到变量在不同样品中的分布规律。主成分分析发现,5个发芽温度下的样品被分成了5组,但是在发芽初期分组并不明显,随着发芽时间的增加,分组才越来越明显(图9a),并且随着发芽时间的增加,氨基酸含量也开始增加,并且在30 ℃下发芽氨基酸积累量达到最高(图9b)。

图9 不同温度和时间下发芽糙小米游离氨基酸组分的变化
Fig.9 Variations of the contents of free amino acid components during the germination of the foxtail millet at different temperatures and time
注:A、B、C、D和E分别表示20、25、30、35和40 ℃,1、2、3、4、5和6分别表示发芽0、6、12、18、24和30 h。红色区域表示氨基酸含量高于平均值,绿色区域表示低于平均值。
Note: A, B, C, and D represent the germination temperatures of 20, 25, 30, 35, and 40 ℃; 1, 2, 3, 4, 5, and 6 represent the germination time of 0, 6, 12, 18, 24, and 30 h. Green indicates that the level of the amino acid was less than the mean level, whereas red indicates that the level of the amino acid was higher than the mean level.
发芽糙小米中游离氨基酸的增加,可以调整谷子营养,促进营养成分的吸收,提高糙小米的生物利用率,尤其是功能氨基酸GABA的增加,可赋予发芽糙小米安神、降血压和改善记忆力的功效。另外游离氨基酸的增加还会赋予发芽糙小米特殊的风味,鲜味氨基酸(谷氨酸、天冬氨酸)、甜味氨基酸(苏氨酸、丝氨酸、甘氨酸、丙氨酸、蛋氨酸、脯氨酸、鸟氨酸)和苦味氨基酸(缬氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸、精氨酸、赖氨酸、组氨酸、色氨酸)的增加丰富了谷子的滋味,赋予了发芽糙小米微苦回甘的滋味特征。因此,从营养、功能和滋味上来看,发芽糙小米对于谷子产品的进一步开发具有积极意义。
本实验显示发芽30 h后游离氨基酸依然有继续增加的趋势,然而,随着发芽时间的延长,发芽糙小米会因脂肪酸败而产生不良气味,影响发芽糙小米的品质,因此不宜发芽时间过长。发芽过程中,谷物的维生素、黄酮类化合物、酚酸类成分等也会有显著的提高,因此糙小米发芽过程中其它成分的提高有待进一步研究。
3 结论
糙小米在不同温度的发芽过程中,21种氨基酸组分均会有不同程度的增加。温度过低,游离氨基酸需要较长的发芽时间才会有一定程度的积累,温度过高,游离氨基酸的积累会受到影响,因此温度对发芽糙小米游离氨基酸的影响很大。其中,30 ℃下发芽30 h时总游离氨基酸和总必需氨基酸积累到最大,分别达(810.7±69.0)和(367.8±30.2) mg/100g,说明糙小米发芽可以促进游离氨基酸的增加和营养的改善。在所有氨基酸中,丙氨酸和苏氨酸增加量最高,其中丙氨酸在30和35 ℃下其含量达到(120.0±12.0)和(115.0±14.0) mg/100g,苏氨酸在30 ℃下达到(106.0±1.0) mg/100g。GABA在35 ℃下发芽的糙小米中积累到最大,达到(60.1±1.8) mg/100g,说明发芽糙小米能改善谷物的营养价值,并可作为一种潜在的功能食品被开发和利用。
[1] 王自力, 刘忠玲, 秦家范, 等. 洛阳丘陵旱地谷子种植效益分析及栽培技术研究[J]. 河北农业科学, 2010, 14(11): 30-32.WANG Z L, LIU Z L, QIN J F, et al. Planting benefit and cultivation techniques of millet on hilly arid land in Luoyang[J].Journal of Hebei Agricultural Sciences, 2010, 14(11): 30-32.
[2] ZHANG G, LIU X, QUAN Z, et al. Genome sequence of foxtail millet (Setaria italica) provides insights into grass evolution and biofuel potential. Nat Biotechnol[J]. Nature Biotechnology,2012, 30(6): 549-554.
[3] 孙蕾, 沈群. 小米饮料的最佳液化、糖化及稳定条件研究[J].食品工业科技, 2012(13): 182-185+189.SUN L, SHEN Q. Study on the best conditions of liquefaction,mashing and stabilizing-agents using in millet beverage[J].Science and Technology of Food Industry, 2012(13): 182-185+189.
[4] LI Z Z, RUI H L. Phenolic and carotenoid profiles and antiproliferative activity of foxtail millet[J]. Food Chemistry,2015, 174: 495-501.
[5] 姚英政, 董玲, 黎剑, 等. 甜玉米发芽条件对其营养品质的影响[J]. 四川大学学报(自然科学版), 2015, 52(4): 906-910.YAO Y Z, DONG L, LI J, et al. Effect of germination conditions on the nutritional quality of sweet corn[J]. Journal of Sichuan University (Natural Science Edition), 2015, 52(4): 906-910.
[6] WU Z, SONG L, FENG S, et al. Germination dramatically increases isoflavonoid content and diversity in chickpea (Cicer arietinum L. ) seeds[J]. Journal of Agricultural and Food Chemistry, 2012, 60(35): 8606-8615.
[7] 郑艺梅, 李群, 华平. 发芽对糙米蛋白质及氨基酸组成特性的影响[J]. 中国粮油学报, 2007(5): 7-11.ZHENG Y M, LI Q, HUA P. Effects of germination on protein and amino acid composition in brown rice[J]. Journal of the Chinese Cereals and Oils Association, 2007(5): 7-11.
[8] 李欣, 陈威, 陈嘉东, 等. 发芽糙米游离氨基酸和蒸煮特性的品种差异分析[J]. 广东农业科学, 2013(5): 84-87.LI X, CHEN W, CHEN J D, et al. Variations of free amino acids and cooking properties of germinated brown rices with different amylose contents[J]. Guangdong Agricultural Sciences, 2013(5):84-87.
[9] YANG F, BASU T K, OORAIKUL B. Studies on germination conditions and antioxidant contents of wheat grain[J].International Journal of Food Sciences and Nutrition, 2001,52(4): 319-330.
[10] ISHIKAWA Y, HASEGAWA S, KASAI T, et al. Changes in amino acid composition during germination of soybean[J].Journal of the Agricultural Chemical Society of Japan, 2008.31(4): 490-493.
[11] 宁亚维, 刘祥贵, 王志新, 等. 小米糙米发芽富集γ-氨基丁酸[J]. 食品与生物技术学报, 2019, 38(1): 59-63.NING Y W, LIU X G, WANG Z X, et al. Improve γ-aminobutyric acid content by the germination of brown foxtail millet[J]. Journal of Food Science and Biotechnology, 2019,38(1): 59-63.
[12] 康文瀚, 田洪磊, 程卫东, 等. 糙米发芽富集γ-氨基丁酸工艺优化的研究[J]. 食品工业, 2016(5): 78-82.KANG W H, TIAN H L, CHENG W D, et al. Based on response surface analysis of brown rice enriches γ-aminobutydc acid research[J]. Food Industry, 2016(5): 78-82.
[13] 程威威, 周婷, 吴跃, 等. 高效液相色谱法测定发芽糙米中γ-氨基丁酸含量[J]. 食品科学, 2014, 35(12): 98-101.CHENG W W, ZHOU T, WU Y, et al. HPLC analysis of γ-amino butyric acid in germinated brown rice[J]. Food Science, 2014,35(12): 98-101.
[14] 蒋芮, 李雅婷, 欧阳鹏凌, 等. 发芽对黑大麦游离氨基酸及其他营养成分的影响[J]. 食品工业科技, 2018, 39(6): 38-42.JIANG R, LI Y T, OUYANG P L, et al. Effects of germination on free amino acids and other nutrients in black barley[J].Science and Technology of Food Industry, 2018, 39(6): 38-42.
[15] 张笑, 孙丽华. 大麦发芽过程中内源激素对大麦蛋白组分及蛋白酶活力影响[J]. 酿酒科技, 2012(10): 90-93.ZHANG X, SUN L H. Effects of hormone on protein composition and protease activity in the process of the malting of barley[J]. Liquor-Making Science and Technology, 2012(10):90-93.
[16] 曹志洋, 韦志彦, 李兴军. 高温高湿处理对稻谷发芽率与糖类、蛋白质及氨基酸含量的影响[J]. 河南工业大学学报(自然科学版), 2009, (1): 22-28.CAO Z Y, WEI Z Y, LI X J. Effect of high temperature and high humidity on the germination and contents of sugars, protein and amino acids of rice grains[J]. Journal of Henan University of Technology (Natural Science Edition), 2009, (1): 22-28.
[17] 吴瑶瑶, 裘娟萍. 天冬氨酸家族主要氨基酸高产菌株的选育策略[J]. 氨基酸和生物资源, 2012, 34(1): 35-41.WU Y Y, QIU J P. Metabolic engineering strategies of bacterial strains for overproduction of L-threonine and L-lysine[J]. Amino Acids and Biotic Resources, 2012, 34(1): 35-41.
[18] 李仁德, 李光玉, 王凯英. 苏氨酸对动物的生物学作用研究进展[J]. 饲料工业, 2017(8): 36-39.LI R D, LI G Y, WANG K Y. Research advances on biological function of threonine for animal[J]. Feed Industry, 2017(8):36-39.
[19] 李金华, 李博. 全谷物膳食中我国4种杂粮的蛋白质营养综合评价[J]. 食品科技, 2019, 44(12): 151-157.LI J H, LI B. Comprehensive evaluation of protein nutrition of four kinds of miscellaneous grain in China[J]. Food Science and Technology, 2019, 44(12): 151-157.
[20] 刘剑, 赵策, 储炬, 等. 溶氧对谷氨酸棒杆菌发酵产谷氨酸代谢的影响[J]. 华东理工大学学报(自然科学版), 2012, (4):69-74.LIU J, ZHAO C, CHU J, et al. Influence of dissolved oxygen on metabolism of glutamic acid biosynthesis by Corynebacterium glutamicum[J]. Journal of East China University of Science and Technology (Natural Science Edition), 2012, (4): 69-74.
[21] 陈澄, 王洪梅, 李小童, 等. 超高效液相质谱法测定人肝细胞中L-精氨酸、L-鸟氨酸、L-瓜氨酸和尿素含量[J]. 生物化工,2017, 3(6): 55-58.CHEN C, WANG H M, LI X T, et al. Determination of L-arginine, L-ornithine, L-citrulline and urea in human liver cells by ultra performance liquid chromatography mass spectrometry[J].Biological Chemical Engineering, 2017, 3(6): 55-58.
[22] 郭雯, 赖联贺, 张晓梅, 等. 加强表达3-磷酸甘油醛脱氢酶对谷氨酸棒杆菌产L-丝氨酸的影响[J]. 食品与发酵工业, 2016,42(9): 15-20.GUO W, LAI L H, ZHANG X M, et al. Effects of glyceraldehyde-3-phosphate dehydrogenase overexpression on L-serine production in corynebacterium glutamicum[J]. Food and fermentation industries, 2016, 42(9): 15-20.
[23] 孙秀梅, 张纪秀, 张海军, 等. 镉胁迫对拟南芥中氨基酸及其衍生物的影响[J]. 环境化学, 2010, (1): 25-28.SUN X M, ZHANG J X, ZHANG H J, et al. Effect of cadmium on amino acid and their derivatives in arabidopsis thaliana[J].Environmental Chemistry, 2010, (1): 25-28.
[24] 周霞, 陈蕊蕊, 郑晨妮, 等. 酶法合成组胺的研究[J]. 杭州师范大学学报(自然科学版), 2019, 18(3): 274-279.ZHOU X, CHEN R R, ZHENG C N, et al. Emzymatic synthesis of histamine[J]. Journal of Hangzhou Normal University(Natural Sciences Edition), 2019, 18(3): 274-279.
[25] 白青云, 曾波, 顾振新. 粟谷发芽期间贮藏物质动员及γ-氨基丁酸富集技术[J]. 食品与发酵工业, 2010(3): 65-69.BAI Q Y, ZENG B, GU Z X. Study on mobilization of stored reserves and accumulation of γ-aminobutyric acid in foxtail millet during germination[J]. Food and Fermentation Industries,2010(3): 65-69.
[26] 王玉萍, 韩永斌, 蒋振辉, 等. 培养温度对发芽糙米生理活性及GABA等主要物质含量的影响[J]. 中国粮油学报, 2006,21(3): 19-22.WANG Y P, HAN Y B, JIANG Z H, et al. Effect of temperature on physiological activities, γ - amino butyric acid and other essential substances in germinating brown rice[J]. Journal of the Chinese Cereals and Oils Association, 2006, 21(3): 19-22.
[27] WELKE J E, MANFROI V, ZANUS M, et al. Differentiation of wines according to grape variety using multivariate analysis of comprehensive two-dimensional gas chromatography with timeof-flight mass spectrometric detection data[J]. Food Chemistry,2013, 141(4): 3897-3905.
[28] 许建军, 江波, 许时婴. γ-氨基丁酸(GABA)—种新型的功能食品因子[J]. 食品工业科技, 2003(1): 109-110+42.XU J J, JIANG B, XU S Y. Gamma-aminobutyric acid-a novel functional factor for nutraceuticals[J]. Science and Technology of Food Industry, 2003(1): 109-110+42.
[29] KIMURA M, HAYAKAWA K, SANSAWA H. Involvement of gamma-aminobutyric acid (GABA) B receptors in the hypotensive effect of systemically administered GABA in spontaneously hypertensive rats[J]. Japanese journal of pharmacology, 2002, 89(4): 388-394.
[30] KAZUHITO H, MASAYUKI K, KEIKO K, et al. Effect of a gamma-aminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J]. British Journal of Nutrition, 2004, 92(3):411-417.