缩略语
CVD:Cardiovascular disease,心血管疾病
HUFA:Highly unsaturated fatty acids,高度不饱和脂肪酸
HO:High oleic acid,高油酸
PUFA:Polyunsaturated fatty acids,多不饱和脂肪酸
RUTF:Ready-to-Use Therapeutic Foods,即食治疗食物
O6:Omega-6 fatty acids,Omega-6脂肪酸
LA6:Linoleic acid Omega-6,Omega-6亚油酸
ARA6:Arachidonic acid Omega-6,Omega-6花生四烯酸
O3:Omega-3 fatty acids,Omega-3脂肪酸
ALA3:Alpha-linolenic acid Omega-3,Omega-3 α-亚麻酸
EPA3:Eicosapentaenoic acid Omega-3,Omega-3二十碳五烯酸
DHA3:Docosahexaenoic acid Omega-3,Omega-3二十二碳六烯酸
人类是有非凡大脑的动物[1-2],人脑比任何同等大小的陆地动物的大脑都要大得多,且消耗的能量占体重的百分比也要大得多。从这个意义上说,人脑是独一无二的。
所有哺乳动物大脑的组成成分是相似的,尽管与其他器官相比显得很独特。大脑中的脂类,主要由特殊的高度不饱和脂肪酸(HUFA),特别是 Omega-3(O3)二十二碳六烯酸(DHA3)和Omega-6(O6)花生四烯酸(ARA6)构成。因此,哺乳动物大脑的大小,在某种程度上讲,是由机体通过食物获取大脑的主要构成成分(特别是DHA3)的能力决定的[3]。
食物提供所有代谢功能所必需的脂肪酸。虽然机体的脂肪酸代谢整体类似,但构成身体和大脑的脂肪酸成分明显不同。虽然 O3脂肪酸缺乏会导致大脑高级功能的异常发育,但对于身体而言,有2%能量的O6亚油酸(LA6)(即使无O3摄入)能明显满足身体需要。本文综述O6和O3脂肪酸的营养特性,重点关注其在营养不良儿童大脑发育中的最新研究成果。
1 HUFA合成简介
笔者最近综述了关于PUFA的生化合成途径和遗传学[4-5]相关细节问题,在此总结一些关键点。
多不饱和脂肪酸(PUFA)包含两个必需脂肪酸家族:O6脂肪酸家族和O3脂肪酸家族,分别主要以现代饮食中所提供的LA6和ALA3为前体合成。这些脂肪酸通过基因编码的酶 FADS2、FADS1、ELOVL5、ELOVL2,催化代谢后转化为具有生物活性的 HUFA。也有证据表明,可变剪切转录本可调节相关酶的特异性[6]。因此,PUFA两个家族的主要C18前体——LA6和ALA3,在饮食水平上的平衡至关重要。下式表示 PUFALA6和ALA3,分别是HUFA-ARA6和EPA3/DHA3的主要合成前体。
Omega-6 (O6): LA6→→→ARA6
Omega-3 (O3): ALA3→→→EPA3→DHA3
PUFA/HUFA主要的生理功能包括:ARA6是100多个信号分子的前体,并且是一些神经细胞质膜的关键结构成分。DHA3是神经系统必需的结构组成成分,而Omega-3二十碳五烯酸(EPA3)可平衡Omega-6花生四烯酸(ARA6)信号通路。
2 身体所需的O6脂肪酸
人体可以从大多数饮食,包括动物食品(肉类、海鲜、鸡蛋、奶制品)以及海洋植物和其他一些植物中摄入 HUFA。纯素饮食者则只摄入LA6和 ALA3,虽然纯素饮食是一个相对较新的概念,因为人类自祖先以来的饮食中一直包含动物产品。饮食中的HUFA可通过产物抑制内源性HUFA合成,最近的研究也发现了更多的一些可以影响内源HUFA生物合成的饱和脂肪酸[5,7]。因此,饮食中脂肪酸的组成,包括饱和与不饱和脂肪酸,均会影响机体内源HUFA的合成。然而,诸如必需脂肪酸和“母体”脂肪酸等概念是在啮齿类动物中建立的,这些动物的饮食中的脂类几乎仅含有LA6和ALA3,因此,需要考虑这种特定的背景对其生物学功能的影响。
现知LA6仅在皮肤脂质中具有不可被其它脂肪酸替代的代谢功能。必需脂肪酸缺乏的最早发现且最显著的症状是皮肤屏障功能的损害,导致皮肤损伤和身体水分通过皮肤病理性流失。饮食中摄入的LA6能迅速治愈这种疾病,ARA6通过转化为LA6也同样能迅速治愈这种疾病[8],并且,饮食中的ARA6比LA6对于改善皮肤的完整性更有效。
含有LA6且不含或仅含少量ALA3的饮食,可以支撑身体(体重和身高)的正常生长发育及正常繁殖。而大脑功能是复杂、微妙的,需要仔细的测试分析来揭示诸如“解决问题”、“情绪稳定”等高级心理功能是否正常。早期并没有条件测试大脑功能,但随着研究的发展,大脑功能异常现在可以被测试出来。
LA6是一种特殊的膳食脂肪酸。传统的以低成本生产的高质量种子油中通常富含LA6,例如大豆油(53%的 LA6)、花生油(25%的 LA6)、菜籽油(25%的 LA6),以及美国产的葵花籽油(70%的LA6)和红花油(70%的LA6)。而茶油(10% LA6)、橄榄油(6%~15% LA6)、棕榈油(6%~15% LA6)和动物脂肪中LA6含量则较低。近年来,食用高含量LA6油脂逐渐变得广泛。饮食中的LA6,可通过干扰酰基辅酶a合成酶对生化途径的激活,抑制HUFA的生物合成,进而抑制所有Omega-3脂肪酸,包括ALA3、EPA3、DHA3的合成和组织积累。同时,可能是由于 O3脂肪酸的快速氧化,LA6会以远超 O3脂肪酸的量在白色脂肪组织中积累。
LA6最多在约 4%的卡路里(cal)水平引起ARA6水平上升[9]。再高水平LA6会导致强生物活性的ARA6在组织中积累饱和。ARA6的进一步增加就需要摄入预制的 ARA6。大多数商品化的饮食的平均LA6含量远高于4% cal,美国人平均摄入的LA6超过10% cal。用惰性脂肪酸(如油酸,18:1n-9)替代饮食中LA6,将美国人的饮食 LA6含量从 10%降至 5%,对血液循环中的ARA6浓度没有影响,因为组织中ARA6含量已经达到最大值。饮食 LA6含量需要低于 4% cal方可观察到血液循环中ARA6浓度的变化。
3 血液循环中的脂肪酸水平与健康:O3脂肪酸指数和其它脂肪酸
在哺乳动物机体内的生物化学反应中,膳食脂肪酸特别是LA6和ALA3之间,存在着明显的竞争性。20世纪 60年代初的多项喂养实验研究表明,若饮食中的脂类仅添加LA6和ALA3,则可准确预测出组织中所有的PUFA含量[10-12]。此类研究已经被重复了很多次,并且均可以对PUFA准确定量[9,13-15]。可以说,饮食中的脂肪酸组成和个体的遗传差异决定了机体组织的构成成分和部分功能。
近年来,血液中的脂类检测相关技术发展迅速,特别是 O3脂肪酸的测试分析技术,可以检查出机体内脂肪酸状态,进而对饮食变化进行合理化建议。
膳食脂肪酸,特别是饱和脂肪酸与不饱和脂肪酸的平衡,几十年来一直被认为是心血管疾病的生物标志物。具体来说,富含LA6的油脂可以降低血清中的胆固醇和低密度脂蛋白胆固醇。然而,由于血液循环中的低密度脂蛋白颗粒存在不同类型,因此,并不能把低密度脂蛋白与血管疾病致病因子之间直接划等号,至少在低密度脂蛋白血液浓度低于200 mg/dL(5.2 mmol/L)水平时是如此。有研究表明,饱和脂肪替代LA6会提高血清低密度脂蛋白含量,但不会增加患心血管疾病的风险[16]。在日本,血清低密度脂蛋白指标低于200 mg/dL不会考虑其是心血管疾病的诱因[17]。
现在,被检测者甚至不用出家门便可完成脂肪酸指标检测。被检测者在家中自己采集一滴指血样本,放在处理过的纸上密封,然后邮寄到检测实验室。检测实验室会对指血样本进行脂肪酸指标检测,并分析是否存在患病风险。
在近15年里,全血液中的O3脂肪酸,已被成功开发为检测心血管疾病的标志物,准确性与胆固醇标志物一样好,例如,HS的O3脂肪酸指数[18]和O3-HUFA检测[13,19]。
此外,还有其他一些指标也可以影响心血管疾病的生物标记物水平,包括特定的饱和脂肪酸和单不饱和脂肪酸,还有其属的奇数碳原子脂肪酸。目前,这些方法主要用于新生儿筛查,在成年人中的应用仍处于实验室研究阶段。但大量数据表明,随着人们对健康饮食方式深入了解的需求不断增加,这些检测标志物将在个体案例分析中发挥重要作用。
4 对体和脑的O6和O3脂肪酸的平衡
与LA6不同,目前还没有发现依赖于ALA3的特定代谢功能。饮食来源的 ALA3,并不会存储起来,而是迅速通过以下三条路线中的一种进行新陈代谢:a)被氧化生成乙酸以作为碳源,或氧化生成作为能源的二氧化碳/H2O;b)分泌到皮肤;c)转变成新陈代谢所必需的不饱度更高的长链PUFA,主要是DHA3和EPA3。
然而对于PUFA的平衡,过量的LA6控制着DHA3水平,而不是O6/O3脂肪酸比例。
饮食中LA6和ALA3的含量水平相互影响它们向HUFA转化的效率。人们常说,DHA3水平是由膳食中的O6/O3脂肪酸比例决定的,这在很大程度上说是不正确的。
诸多动物试验[9,20]和人类研究[21-22]表明,当LA6和ALA3是两个各自PUFA脂肪酸家族的唯一前体时,血液循环和组织中的DHA3不受饮食中 O6/O3脂肪酸比例的控制。假设 LA6/ALA3(O6/O3)为10,如果此O6/O3脂肪酸比例控制了DHA3的含量水平,那么,将饮食ALA3增加2倍或将LA6减少一半,即二者比例为5,会增加DHA3的水平。但实验结果表明,增加ALA3不会增加组织中的DHA3,而降低LA6会导致组织中DHA3增加。因此,饮食中过多的LA6,而非LA6与ALA3的比例或竞争,决定着DHA3含量水平。换言之,需要降低饮食中的LA6量以提高DHA3水平[13]。
5 O3脂肪酸和大脑发育的关系——近几十年来研究进展
DHA3在20世纪50年代被发现是大脑组织中的一种成分。当时,营养学研究的重点是想方设法发现更多的维生素。并且,在当时主要的生物活性脂肪酸被认为是LA6,因为这种营养物质的缺乏表型很明显:会导致皮肤的水屏障功能损伤[23],况且 O3脂肪酸并不能有效地修复这一缺陷。现在我们知道 O3脂肪酸影响大脑的高级功能,而这并不像皮肤损伤那么容易研究。因此O3脂肪酸对人类生活的重要性,直到20世纪80年代中期才得到以确定,这比 O6脂肪酸晚了数十年[24]。甚至是现在,在有些政策文件中,O3脂肪酸的重要性还没有被充分纠正和肯定。
大脑需要O3,并且DHA3可能是在某些生命阶段大脑发育所必需的营养物质。早在 20世纪70年代,人们就已经知道,DHA3是视网膜感光即视觉反应所必需的[25-28]。大约在那时,对北美的北极地区探险发现,从海洋食物中摄入大量O3脂肪酸与低心血管疾病发病率之间存在联系。这一发现虽然引起了人们主要对 EPA3作为预防或治疗心血管疾病的巨大兴趣(DHA3次之),但并没有解决 O3脂肪酸这一必要营养物质缺乏引起的相关问题[29-30]。
在此期间,O3脂肪酸缺乏症状首次出现——在怀孕动物的饮食中,用高含量O6脂肪酸(O3脂肪酸量低至可以忽略不计)的脂肪作为营养来源,会导致啮齿动物出现相应缺乏症状[31]。随之,这种特殊的O3脂肪酸缺乏膳食被用于研究O3脂肪酸的功能,并从国产期扩展到其他时期。
20世纪80年代,首次有临床研究表明O3脂肪酸是大脑发育的关键营养物质。一系列科学研究和有影响力论文的发表,表明缺乏 O3脂肪酸会导致恒河猴体内代谢产生类似于 O6脂肪酸的十二碳五烯酸(DPA6)取代DHA3[32-33]。这些结果与之前的啮齿动物研究结果类似,即 O3脂肪酸缺乏不改变身体生长发育或繁殖。几十年后,在所有野生动物中证明了DHA3会在大脑的神经组织中积累[3]。同时,Neuringer和Connor的研究表明,O3脂肪酸缺乏显著损害视网膜功能,当饮食中的O3脂肪酸恢复供给时,视网膜功能恢复。回顾这段历史,我们可以得到的一条重要经验是:研究结果的分析,必须与其引发因素对应起来才有意义,正如本例中的大脑和神经系统发育与O3脂肪酸[35]。
与此同时,首次对婴儿进行的研究表明,婴儿配方奶粉中不添加 DHA3,会导致血液中的DHA3减少,这与之前的动物试验结果一致[36]。同时,可准确分析母乳中脂肪酸浓度及 DHA含量的高分辨率方法也是在这个时候出现,并沿用至今[37]。20世纪80年代的临床研究同样关注早产儿,包括研究通过饮食补充DHA3程度以达到维持其机体内的DHA3状态[38-41]。
到20世纪90年代,对DHA3和O3脂肪酸缺乏动物模型的临床研究已有10年之久,得到的结果和早期的恒河猴研究类似(研究数量太多,不便在此回顾)。总的来说,临床研究令人信服地表明,不但对足月婴儿有意义,但对早产儿是必须要在膳食中添加预制的DHA3[42-43]。
O3脂肪酸缺乏动物研究模型对于评估人类的饮食具有重要的指导作用。到2011年,至少有60项关于O3缺乏脂肪酸的动物模型功能性研究结果出现[44]。这些研究显示,用高LA6/低ALA3油脂作为唯一的脂肪来源,进行怀孕动物(大鼠、小鼠、猪、灵长类动物)的喂养,会导致后代从受孕到断奶阶段的各种各样的神经功能异常,包括迷宫行为、视力、神经信号传递、平衡、焦虑、攻击性、情绪控制等,以及许多非神经缺陷,如儿茶酚胺循环异常。同样地,在摄入充足的 O6脂肪酸的情况下,这些模型动物的生长和繁殖并无明显异常,尽管一些研究表明,窝产仔数出现了微妙的异常和其它一些不明显的变化[45]。
这些实验结果得出了一个可能很简单,但很准确的普遍规则:Omega-6脂肪酸支撑身体发育,而Omega-3脂肪酸支撑大脑。
6 严重急性营养不良和多不饱和脂肪酸
全球每年约有2 000万儿童因缺乏食物而患有严重急性营养不良(Severe acute malnutrition,SAM)。SAM的康复治疗通常会使儿童的心智功能处于欠佳状态,可能表现为解决问题的能力下降或情绪受损。情绪受损包括抑郁、焦虑、易攻击性,以及由此带来的间接危害,如对疼痛更加敏感。
20世纪 90年代,以强化卡路里、蛋白质和微营养素的牛奶的形式,出现了帮助患有SAM的儿童康复的治疗性食品。用此强化牛奶食品帮助SAM患儿进行康复治疗,几个月后,存活率(恢复率)在50%左右,显示出了一定的疗效,但人们一直在追求更高疗效的治疗方法。
6.1 突破性进展:即食治疗食品(Ready-to-Use Therapeutic Foods,RUTF)
即食治疗食品(Ready-to-Use Therapeutic Foods,RUTF)是在 2000 年左右被开发出来的[46]。RUTF的基本构成是花生酱、脱脂奶粉、糖、维生素、矿物质和油脂。由于此,即食食品是密封在一个袋子里,室温下可以保存两年以上。到2007年,用此即食治疗食品治疗的 SAM 患儿,存活率提高到 90%以上。RUTF的研发成功是一项重大突破,为大多数营养不良儿童提供了合适的治疗方案。
6.2 从生存到繁荣
纵观人类的发展过程,当生命受到威胁的时候,首先要寻找生存的方法;生存的方法找到后,会谋求长期的发展。儿科疾病的治疗也是如此,一旦找到了治疗方法,儿科医生就会将注意力转向治疗方案的优化,寻求长期、稳定、坚实的疗效效果。
就早产儿而言,公认的多不饱和脂肪酸营养学并未被重视,确切地说,O3脂肪酸更应值得关注。因此,对于早产儿来说,如何在其饮食中人工加入 DHA3,以便尽可能地与母乳成分一致,至关重要。
在开发RUTF初期,一个关键的问题是使用了高含量LA6但DHA3缺乏的油脂为原料。这种疏忽至少部分是由于:(a)市场上供应的制作即食治疗食物成分的可用植物油本身成分决定;(b)饮食营养成分之间相互作用所产生的影响,在全球食品标准体系中缺乏重视。也就是说,一种营养物质的含量会影响机体对另一种营养物质的需求。对于RUTF来说,高含量水平的LA6会拮抗机体组织器官中O3脂肪酸的积累,导致O3脂肪酸无法满足组织的代谢需求。传统的花生,作为RUTF的主要成分,是高脂肪含量的,含有高LA6但不含 ALA3。因此,在开发RUTF时,要求添加的油脂成分在可以提供卡路里的同时,也能加入ALA3,但是添加的油脂成分中ALA3的含量增加同时LA6增加得更多(例如,大豆油)。
2010年,在加州召开了一次主题为“脂肪酸营养及营养不良”的会议,讨论了关于多不饱和脂肪酸营养的诸多方面。在那次会议上达成了一个共识:使用常规配方的RUTF甚至无法达到世界卫生组织建议的 LA6/ALA3 (O6/O3)<10的比例。但重要的是,当时开发RUTF使用的油脂成分中不含有 O3脂肪酸,而在动物模型研究中显示,饮食中O3脂肪酸缺乏可导致永久性神经损伤。
6.3 均衡膳食长期有益于健康
高油酸(high oleic,HO)花生的问世[47],为开发LA6含量较低、对O3脂肪酸拮抗作用较小的RUTF提供了可能。西方最常见的HO油是橄榄油,含有10%左右的LA6和80%以上的油酸,只有少量的ALA3,没有DHA3和EPA3。这种构成成分与中国的油茶籽油相似。早期研究表明,要避免缺乏症状,需要的膳食LA6水平很低[48],但超过了这个低含量水平,就会产生对DHA3的代谢需求[24]。大多数传统的食用油脂,如菜籽油、大豆油、芝麻油,都含有大量的LA6和低/零O3脂肪酸。HO花生运用传统的植物育种开发,没有人工基因改造,其油脂成分类似于橄榄油和茶油。HO花生的低LA6和高含量油酸特点,是一种解决高LA6/低O3油脂造成的DHA3代谢需求的方法。
现有的动物研究表明,与添加DHA3的饮食相比,在饮食中添加大量的 ALA3作为O3脂肪酸的唯一来源,其神经组织中DHA3的含量水平也相对较低[49]。即使使用HO油和较低LA6油脂为原料,机体组织中DHA3含量也达不到与饮食中添加DHA3相同的水平。因此,可以想象,在以HO花生(较低LA6)为原料开发的RUTF中强化适量的 DHA3,可以更好地提高机体组织中的DHA3水平。
我们团队在马拉维对81名平均年龄2岁、被诊断为 SAM 的儿童进行了研究测试。我们设定了对照组(control-RUTF,饮食脂肪酸质量百分比LA6为26%,ALA3<1%)和HO-RUTF组(饮食脂肪酸质量百分比LA6和ALA3均为13%),治疗4~12周,直至发现疗效。四周后发现,在对照组(control-RUTF)中,循环磷脂 DHA3的含量降低了25%,而在治疗组(HO-RUTF)中,DHA3含量水平稳定。这表明在饮食中LA6和ALA3含量均衡的情况下,接受治疗儿童的机体内,因为大量的卡路里和蛋白质可以从RUTF中获得,以产生足够的DHA3来满足代谢需求,从而促进大脑生长发育[50]。在肯尼亚的另一项类似研究中,饮食中 LA6脂肪酸比例同样为 13%,但增加了ALA3含量,血液循环中DHA3的含量水平并未显著降低[51],此项研究目的在于强调,在 RUTF的构成成分中,适度调控LA6含量水平的重要性。
我们最近做了一项研究,选取了2 800名SAM儿童作为研究对象,分别接受含不同PUFA成分的RUTF治疗,然后评估其中的1 000多名儿童的大脑功能[52]。儿童分三组,对应不同RUTF治疗方案,如表1所示,分别为:对照组(control)、HO 组(HO-低 LA6)、DHA-HO 组(添加了 DHA)。治疗结束后对臂围的评估显示,三组儿童的身体从营养不良中恢复的情况相似,之后让孩子们回家。6个月后,(在没有进一步干预的情况下)用“马拉维发展能力测试”测试他们的心智功能。结果发现,与对照组相比,HO组儿童的心智功能有明显的改善趋势(在“社会活动”中得分最高),而接受 DHA-HO治疗的儿童,心智功能明显更高(图1)。因此,在长期治疗后(严格的说,6个月后),DHA-HO RUTF促进大脑的高级功能恢复,帮助患儿在“运动”和“社会活动”中有良好的表现。
表1 RUTF中PUFA组成[50]
Table 1 RUTF PUFA composition
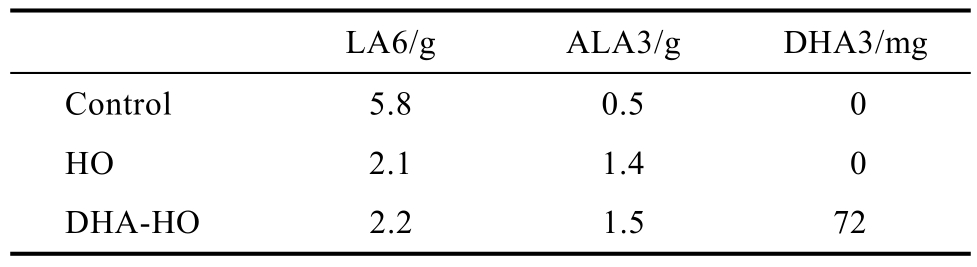
LA6/g ALA3/g DHA3/mg Control 5.8 0.5 0 HO 2.1 1.4 0 DHA-HO 2.2 1.5 72

图1 长期心智功能分析[52]
Fig.1 Long term mental function
注:从严重急性营养不良中恢复的儿童,在恢复6个月后的MDAT测试中总得分更高。
Note: Children recovered from severe acute malnutrition score higher on the global MDAT six months after recovery.
7 结论:世界卫生组织(WHO)的建议
世界卫生组织食品法典委员会于每年 11月召开会议,审议有关食品及其成分的建议。审议时,会邀请世界各国代表发表意见,体现了审议过程的高度组织化和公正性。2021年,食品法典委员会(在一定程度上)基于我们在马拉维的研究调查结果,作出了关于RUTF成分的相应调整,最终审议通过了关于 RUTF组成的建议——脂肪酸组成最大LA6量为780 mg/100 Kcal,最小ALA为110 mg/100 Kcal[52-53],这是对先前提出的高含量LA6/低含量ALA3水平的重大改进。另外,在RUTF中添加DHA3是允许的,正如一些生产制造商正在做的那样。
总之,世界卫生组织食品法典委员会一致认同要对大脑发育的重视,其反映了目前普遍注重脑与精神健康的态度。营养不良的儿童属于弱势群体,但是这些研究结果可以扩展到所有人群和各个生命时期,其中也包括可能受影响较小的、卡路里/蛋白质充足的儿童、成人和老人。作者认为,研究应更强调大脑的发育,因为大脑发育好了,身体的健康自然会跟进。
致谢:2021年在马拉维进行的研究得到了美国 Unorthodox慈善机构、Open慈善机构、希基家庭基金会和儿童研究所的慷慨资助,威利公司也通过捐赠用于研究的食品原料来支持这项工作。同时,感谢我的合作者:Mark Manary和他在圣路易斯华盛顿大学(WashU)的研究团队,以及Andre Briend。
[1] BRENNA J T, CARLSON S E. Docosahexaenoic acid and human brain development: Evidence that a dietary supply is needed for optimal development[J]. J Hum Evol, 2014.
[2] BRENNA J T. Metabolic and molecular aspects of the critical role of docosahexaenoic acid in human brain function, Chapter 4. In: CUNNANE S C, STEWART K M, editors. Human brain evolution: The influence of freshwater and marine food resources[M]. New York: John Wiley & Sons, Inc, 2010.
[3] CRAWFORD M A, CASPERD N M, SINCLAIR A J. The long chain metabolites of linoleic and linolenic acids in liver and brain in herbivores and carnivores[J]. Comp Biochem Physiol B,1976, 54(3): 395-401.
[4] KOTHAPALLI K S D, PARK H G, BRENNA J T.Polyunsaturated fatty acid biosynthesis pathway and genetics.implications for interindividual variability in prothrombotic,inflammatory conditions such as COVID-19[J]. Prostaglandins Leukot Essent Fatty Acids, 2020, 162: 102183.
[5] BRENNA J T, KOTHAPALLI K S D. New understandings of the pathway of long-chain polyunsaturated fatty acid biosynthesis[J].Curr Opin Clin Nutr Metab Care, 2021.
[6] KOTHAPALLI K S D, PARK H G, GUO X, et al. A novel FADS2 isoform identified in human milk fat globule suppresses FADS2 mediated Delta6-desaturation of omega-3 fatty acids[J].Prostaglandins Leukot Essent Fatty Acids, 2018, 138: 52-9.
[7] WANG Z, PARK H G, WANG D H, et al. Fatty acid desaturase 2(FADS2) but not FADS1 desaturates branched chain and odd chain saturated fatty acids[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2020, 1865(3): 158572.
[8] BRENNA J T. Arachidonic acid needed in infant formula when docosahexaenoic acid is present[J]. Nutr Rev, 2016, 74(5): 329-36.
[9] GIBSON R A, NEUMANN M A, LIEN E L, et al.Docosahexaenoic acid synthesis from alpha-linolenic acid is inhibited by diets high in polyunsaturated fatty acids[J].Prostaglandins Leukot Essent Fatty Acids, 2013, 88(1): 139-46.
[10] HOLMAN R T, MOHRHAUER H. A hypothesis involving competitive inhibitions in the metabolism of polyunsaturated fatty acids[J]. Acta Chemica Scandivanica, 1963, 17: S84-S90.
[11] MOHRHAUER H, HOLMAN R T. Alteration of the fatty acid composition of brain lipids by varying levels of dietary essential fatty acids[J]. J Neurochem, 1963, 10: 523-30.
[12] MOHRHAUER H, HOLMAN R T. The effect of dose level of essential fatty acids upon fatty acid composition of the rat liver[J]. J Lipid Res, 1963, 4: 151-9.
[13] BIBUS D, LANDS B. Balancing proportions of competing omega-3 and omega-6 highly unsaturated fatty acids (HUFA) in tissue lipids[J]. Prostaglandins Leukot Essent Fatty Acids, 2015,99: 19-23.
[14] LANDS W E, LIBELT B, MORRIS A, et al. Maintenance of lower proportions of (n-6) eicosanoid precursors in phospholipids of human plasma in response to added dietary (n-3) fatty acids[J]. Biochim Biophys Acta, 1992, 1180(2): 147-62.
[15] LANDS W E, MORRIS A, LIBELT B. Quantitative effects of dietary polyunsaturated fats on the composition of fatty acids in rat tissues[J]. Lipids, 1990, 25(9): 505-16.
[16] ASTRUP A, MAGKOS F, BIER D M, et al. Saturated fats and health: a reassessment and proposal for food-based recommendations: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2020, 76(7): 844-57.
[17] HAMAZAKI T, OKUYAMA H, OGUSHI Y, et al. Towards a paradigm shift in cholesterol treatment. a re-examination of the cholesterol issue in Japan[J]. Ann Nutr Metab, 2015, 66 Suppl 4:1-116.
[18] HARRIS W S. Omega-3 fatty acids and cardiovascular disease: a case for omega-3 index as a new risk factor[J]. Pharmacol Res,2007, 55(3): 217-23.
[19] METHEREL A H, BUZIKIEVICH L M, CHARKHZARIN P, et al. Omega-3 polyunsaturated fatty acid profiling using fingertipprick whole blood does not require overnight fasting before blood collection[J]. Nutrition Research, 2012, 32(8): 547-56.
[20] TU W C, MUHLHAUSLER B S, YELLAND L N, et al.Correlations between blood and tissue omega-3 LCPUFA status following dietary ALA intervention in rats[J]. Prostaglandins Leukot Essent Fatty Acids, 2013, 88(1): 53-60.
[21] STRANDJORD S E, LANDS B, HIBBELN J R. Validation of an equation predicting highly unsaturated fatty acid (HUFA)compositions of human blood fractions from dietary intakes of both HUFAs and their precursors[J]. Prostaglandins Leukot Essent Fatty Acids, 2018, 136: 171-6.
[22] BRENNA J T, SALEM N, Jr. SINCLAIR A J, et al. alpha-Linolenic acid supplementation and conversion to n-3 long-chain polyunsaturated fatty acids in humans[J]. Prostaglandins Leukot Essent Fatty Acids, 2009, 80(2-3): 85-91.
[23] THOMASSON H J. A biological method for the assay of essential fatty acids (vitamin F)[J]. Acta Physiol Pharmacol Neerl, 1955, 4(1): 114.
[24] HOLMAN R T. The slow discovery of the importance of omega 3 essential fatty acids in human health[J]. J Nutr, 1998, 128(2 Suppl): 427S-33S.
[25] ANDERSON R E, BENOLKEN R M, DUDLEY P A, et al.Proceedings: polyunsaturated fatty acids of photoreceptor membranes[J]. Exp Eye Res, 1974, 18(3): 205-13.
[26] BENOLKEN R M, ANDERSON R E, WHEELER T G.Membrane fatty acids associated with the electrical response in visual excitation[J]. Science, 1973, 182(118): 1253-4.
[27] WHEELER T G, BENOLKEN R M, ANDERSON R E. Visual membranes: specificity of fatty acid precursors for the electrical response to illumination[J]. Science, 1975, 188(4195): 1312-4.
[28] ANDERSON R E, BENOLKEN R M, JACKSON M B, et al.The relationship between membrane fatty acids and the development of the rat retina[J]. Adv Exp Med Biol, 1977, 83:547-59.
[29] DYERBERG J, BANG H O, STOFFERSEN E, et al.Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis?[J]. Lancet, 1978, 2(8081): 117-9.
[30] HARRIS W S, CALDER P C, MOZAFFARIAN D, C. N. S.Bang and Dyerberg's omega-3 discovery turns fifty[J]. Nat Food,2021, 2: 303-5.
[31] CRAWFORD M A, SINCLAIR A J. Nutritional influences in the evolution of the mammalian brain. In: ELLIOTT K, KNIGHT J,editors. Ciba foundation symposium 3 lipids, malnutrition & the developing brain[M]. 3: Wiley Interscience Online publishing,1972, 267-92.
[32] NEURINGER M, CONNOR W E, LIN D S, et al. Biochemical and functional effects of prenatal and postnatal omega 3 fatty acid deficiency on retina and brain in rhesus monkeys[J]. Proc Natl Acad Sci U S A, 1986, 83(11): 4021-5.
[33] NEURINGER M, CONNOR W E, VAN PETTEN C, et al.Dietary omega-3 fatty acid deficiency and visual loss in infant rhesus monkeys[J]. J Clin Invest, 1984, 73(1): 272-6.
[34] TINOCO J, WILLIAMS M A, HINCENBERGS I, et al.Evidence for nonessentiality of linolenic acid in the diet of the rat[J]. J Nutr, 1971, 101(7): 937-45.
[35] DOBBING J, SANDS J. Comparative aspects of the brain growth spurt[J]. Early Hum Dev, 1979, 3(1): 79-83.
[36] CARLSON S E, RHODES P G, FERGUSON M G.Docosahexaenoic acid status of preterm infants at birth and following feeding with human milk or formula[J]. Am J Clin Nutr, 1986, 44(6): 798-804.
[37] BRENNA J T, VARAMINI B, JENSEN R G, et al. Docosahexaenoic and arachidonic acid concentrations in human breast milk worldwide[J]. Am J Clin Nutr, 2007, 85(6): 1457-64.
[38] CARLSON S E, RHODES P G, RAO V S, et al. Effect of fish oil supplementation on the n-3 fatty acid content of red blood cell membranes in preterm infants[J]. Pediatr Res, 1987, 21(5):507-10.
[39] KOLETZKO B, SCHMIDT E, BREMER H J, et al. Effects of dietary long-chain polyunsaturated fatty acids on the essential fatty acid status of premature infants[J]. Eur J Pediatr, 1989,148(7): 669-75.
[40] PITA M L, FERNANDEZ M R, DE-LUCCHI C, et al. Changes in the fatty acids pattern of red blood cell phospholipids induced by type of milk, dietary nucleotide supplementation, and postnatal age in preterm infants[J]. J Pediatr Gastroenterol Nutr,1988, 7(5): 740-7.
[41] CRAWFORD M A, DOYLE W, DRURY P, et al. n-6 and n-3 fatty acids during early human development[J]. J Intern Med Suppl, 1989, 731: 159-69.
[42] UAUY R, HOFFMAN D R, MENA P, et al. Term infant studies of DHA and ARA supplementation on neurodevelopment: results of randomized controlled trials[J]. J Pediatr, 2003, 143(4 Suppl):S17-25.
[43] GIBSON R A, MAKRIDES M. Long-chain polyunsaturated fatty acids in breast milk: are they essential?[J]. Adv Exp Med Biol, 2001, 501: 375-83.
[44] BRENNA J T. Animal studies of the functional consequences of suboptimal polyunsaturated fatty acid status during pregnancy,lactation and early post-natal life[J]. Matern Child Nutr, 2011, 7 Suppl 2: 59-79.
[45] GUESNET P, PASCAL G, DURAND G. Dietary alpha-linolenic acid deficiency in the rat. I. Effects on reproduction and postnatal growth[J]. Reprod Nutr Dev, 1986, 26(4): 969-85.
[46] BRIEND A. Highly nutrient-dense spreads: a new approach to delivering multiple micronutrients to high-risk groups[J]. Br J Nutr, 2001, 85 Suppl 2: S175-9.
[47] JUNG S, SWIFT D, SENGOKU E, et al. The high oleate trait in the cultivated peanut[Arachis hypogaea L.]. I. Isolation and characterization of two genes encoding microsomal oleoyl-PC desaturases[J]. Mol Gen Genet, 2000, 263(5): 796-805.
[48] HANSEN A E, WIESE H F, BOELSCHE A N, et al. Role of linoleic acid in infant nutrition: clinical and chemical study of 428 infants fed on milk mixtures varying in kind and amount of fat[J]. Pediatrics, 1963, 31(1): 171-92.
[49] WOODS J, WARD G, SALEM N Jr. Is docosahexaenoic acid necessary in infant formula? Evaluation of high linolenate diets in the neonatal rat[J]. Pediatr Res, 1996, 40(5): 687-94.
[50] HSIEH J C, LIU L, ZEILANI M, et al. High-oleic ready-to-use therapeutic food maintains docosahexaenoic acid status in severe malnutrition[J]. J Pediatr Gastroenterol Nutr, 2015,61(1): 138-43.
[51] BRENNA J T, AKOMO P, BAHWERE P, et al. Balancing omega-6 and omega-3 fatty acids in ready-to-use therapeutic foods (RUTF)[J]. BMC Med, 2015, 13: 117.
[52] STEPHENSON K, CALLAGHAN-GILLESPIE M, MALETA K, et al. Low linoleic acid foods with added DHA given to Malawian children with severe acute malnutrition improve cognition: a randomized, triple blinded, controlled clinical trial[J]. Am J Clin Nutr, 2021.
[53] RUTF/New Codex guideline will protect vulnerable children 2021[R]. [Available from: https://www.fao.org/fao-who-codexalimentarius/news-and-events/news-details/en/c/1458680/.]