禾谷镰刀菌是小麦赤霉病的主要病原真菌之一,感染后不但会导致小麦种植减产,禾谷镰刀菌还会在小麦籽粒中持续繁殖生长,产生次级代谢产物脱氧雪腐镰刀菌烯醇(DON)毒素,直接影响粮食安全[1-2]。寻求恰当的方法抑制感染小麦中的禾谷镰刀菌生长,能有效减少DON的产生,降低其对粮食安全的影响。
二氧化氯(ClO2)作为一种公认的高效杀菌剂,可以抑制和杀死多种微生物,但在粮食上的应用较少。植物精油用于真菌灭菌较多,丁香精油和肉桂精油对禾谷镰刀菌抑制效果的优劣有不同的结论,袁媛[3]等研究了 8种植物精油对禾谷镰刀菌和黄曲霉生长抑制作用,结果表明丁香酚能显著抑制禾谷镰刀菌的生长,应用到染菌玉米上时,DON毒素被有效抑制,而肉桂精油在16 d后对禾谷镰刀菌无抑制作用。冯文旭[4]研究了 7种植物精油对3株镰刀菌的抑制效果,发现丁香精油、牛至油、肉桂油和山苍子油具有较好的抑制效果,其中肉桂精油效果最好。
本试验通过考察菌落直径、菌丝生长及孢子萌发情况,研究ClO2水溶液对禾谷镰刀菌的抑制作用,对比丁香精油和肉桂精油对禾谷镰刀菌的熏蒸抑制效果,为抑制感染粮食中禾谷镰刀菌的生长,降低感染粮食中的 DON含量、提高粮食质量安全水平提供依据。
1 材料与方法
1.1 试验材料
受试菌株禾谷镰刀菌(Gibberella zeae(Schwein.) Petch)编号:BNCC342051:北京北纳创联生物技术研究院;ClO2:华夏化学试剂有限公司;丁香精油、肉桂精油:源叶生物;葡萄糖、KH2PO4、MgSO4·7H2O、CMC-Na、NH4NO3、酵母膏、琼脂、氢氧化钾、正庚烷、磷酸、无水乙醇:科龙试剂有限公司,均为分析纯。
1.2 仪器与设备
恒温培养箱HNY-2102C:欧诺仪器仪表有限公司;冻干机FDU-1200:上海爱郎仪器有限公司;扫描电子显微镜CFXB50-5M:广东维锐电器有限公司;普通光学显微镜E200:尼康仪器有限公司;全自动高压力灭菌锅GI54DWS:致微(厦门)仪器有限公司;紫外可见光光度计Cary 100 Conc:VARIN;傅里叶变换红外光谱仪:珀金埃尔默企业管理有限公司。
1.3 试验方法
1.3.1 培养基制备
PDA培养基:200 g去皮马铃薯煮沸30 min后取滤液,葡萄糖20 g,琼脂15 g,加蒸馏水定容至1 000 mL,121 ℃灭菌20 min;
PDB培养基:200 g去皮马铃薯煮沸30 min后取滤液,葡萄糖20 g,加蒸馏水定容至1 000 mL,121 ℃灭菌20 min;
CMC培养基:7.5 g硝酸纤维素钠、0.5 g NH4NO3、0.5 g KH2PO4、0.5 g MgSO4·7H2O、0.5 g酵母提取物,加蒸馏水定容至1 000 mL,121 ℃灭菌20 min。
1.3.2 菌悬液和孢子菌悬液的制备
将禾谷镰刀菌接种到无菌生理盐水中,于28 ℃、120 r/min,孵化24 h后,再接种到含有PDB培养基的三角瓶中,置于恒温震荡器中,28 ℃、120 r/min,培养24 h。孢子菌悬液的制备:取部分活化后的菌丝,放入装有 CMC液体培养基的三角瓶中,于28 ℃、150 r/min培养5 d后,经无菌纱布滤去菌丝,用血球计数板计数,将分生孢子的浓度调为5×105 个/mL左右,置于-18 ℃冰箱中保存[5]。后续试验中,需提前转移至 4 ℃冰箱中解冻。
1.3.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
采用二倍稀释法[6-7]测定MIC、MBC。配置浓度为100 mg/L ClO2水溶液,二倍稀释获得100、50、25、12.5、6.25、3.75 mg/L ClO2水溶液,进行涂布抑菌试验;将丁香精油和肉桂精油(浓度为0.850 g/mL)用吐温80二倍稀释,获得90%、45%、22.5%、11.25%、5.62%和2.81%6个浓度梯度,进行涂布抑菌试验,通过不同稀释浓度的平皿中菌落生长情况确定MIC、MBC。
1.3.4 ClO2对禾谷镰刀菌生长繁殖的影响
1.3.4.1 对菌落生长的抑制 取在PDA培养基上生长7 d的菌落,在其边缘用打孔器取直径5 mm的禾谷镰刀菌菌饼,接种于新配制的PDA培养基中心,28 ℃恒温培养 2 d。将灭菌后的牛津杯在不同浓度的ClO2水溶液中浸泡10 min,自然干燥后垂直摆放在镰刀菌菌落一侧,另一侧放未经ClO2水溶液处理的牛津杯作为空白对照组。继续培养1~2 d,观察菌落形态变化[8]。
1.3.4.2 对菌丝生长的抑制 将 100 mL菌悬液置于250 mL锥形瓶中,加入不同浓度的ClO2水溶液,使孢子浓度为5×105 CFU/mL,对照组添加同体积的无菌蒸馏水。28 ℃恒温培养4 d后收集菌丝体,在60 ℃下干燥24 h,称重,计算菌丝生长的抑制率[9]。
式中:WC指对照组中的平均菌丝体重;WS指试验组的平均菌丝体重。
1.3.4.3 对孢子萌发的影响 移取 1 mL孢子悬液,9 mL不同浓度的ClO2水溶液置于20 mL离心管中,28 ℃,150 r/min,振荡培养20 min。吸取1 mL处理后的菌液,加入9 mL灭菌蒸馏水中,再经稀释后,取10 μL于PDA平板上涂布均匀,做3次重复。28 ℃恒温黑暗培养2 d后,对平板菌落计数[8]。
1.3.5 两种植物精油对禾谷镰刀菌生长繁殖的影响
1.3.5.1 对菌落生长的抑制 将直径 5 mm的禾谷镰刀菌菌饼置于PDA培养基平板中央,把3片直径为5 mm,均匀吸附有植物精油的灭菌滤纸均匀放置于皿盖边缘位置[3],使培养皿中浓度为20、40、60、80、100 μL/L air[10],空白组不添加精油。培养皿用封口膜密封,放入自封袋,置于密封盒中,在28 ℃下培养20 d。每天用十字交叉法测定菌落直径2次。每个处理做3次重复。精油浓度按下公式计算表征:

1.3.5.2 对菌丝生长的抑制 将丁香精油和肉桂精油分别加入含有100 mL PDB培养基的250 mL锥形瓶中,使得瓶中精油浓度为20、40、60、80、100 μL/L air,空白组不添加精油,并使孢子浓度为5×105 CFU/mL。28 ℃培养4 d后收集菌丝体,于60 ℃干燥24 h,称重,计算菌丝生长的抑制率。
1.3.5.3 对孢子萌发的影响 取10 μL孢子悬液,均匀涂布于PDA平板,把3片直径为5 mm,均匀吸附有植物精油的灭菌滤纸均匀放置在皿盖的边缘位置,使培养皿中精油浓度为20、40、60、80、100 μL/L air,空白组不添加精油[11]。培养皿用封口膜密封,放入自封袋,置于密封盒中,在28 ℃下培养 5 d。每天对平板菌落计数。每个处理做3次重复。
1.3.6 麦角固醇含量的测定
将孢子悬浮液按5×105 CFU/mL接种于PDB培养基,分别加入ClO2溶液和精油溶液,得到不同浓度的ClO2水溶液试验组和精油试验组。28 ℃培养6 d,收集菌丝体,蒸馏水洗涤2次。向每组样品中加入5 mL的25% KOH溶液,涡旋混合5 min,85 ℃孵育4 h。加入2 mL无菌蒸馏水和5 mL正庚烷,涡旋2 min。静置收集正庚烷层,用紫外分光光度计在230~300 nm处扫描。以未经处理的样品为对照[12]。

1.3.7 扫描电子显微镜观察超微结构
将禾谷镰刀菌孢子液置于 PDB中培养 12 d后,4 000 r/min离心10 min,吸去上清液,磷酸缓冲液(PBS)反复冲洗除去培养基,收集菌丝体。将菌丝体分别用浓度为0、20、100 mg/L的ClO2溶液和20、100 μL/L air丁香精油和肉桂精油,处理24 h后,用PBS反复冲洗。将菌丝体冻干,喷金,镜检拍照[13]。
1.3.8 傅里叶红外光谱测定菌丝体
将上述方法所得的冻干菌丝体研钵磨粉,其中ClO2为100 mg/L,丁香精油和肉桂精油分别为100 μL/L air。用傅里叶红外光谱仪检测菌丝粉,测试范围为400~4 000 cm-1[14-15]。
1.4 数据分析
采用 IBM SPSS Statistics 25.0分析数据,EXCEL 2016处理数据并作图。
2 结果与分析
2.1 菌落形态
禾谷镰刀菌在 PDA培养基上不同时间的生长形态如图1所示。将活化后的禾谷镰刀菌接种于PDA平板中心,12 h后,培养基表面已有白色菌落生成。生长初期,菌落中央产生黄褐色气生菌丝,反面部分呈砖红色,菌落棉絮状,生长茂盛。7 d后,菌落长至成熟期,菌落菌丝不断蔓延伸展,呈絮状,反面全板为砖红色。10 d后,菌落部分塌陷,不再仰展或蔓延。
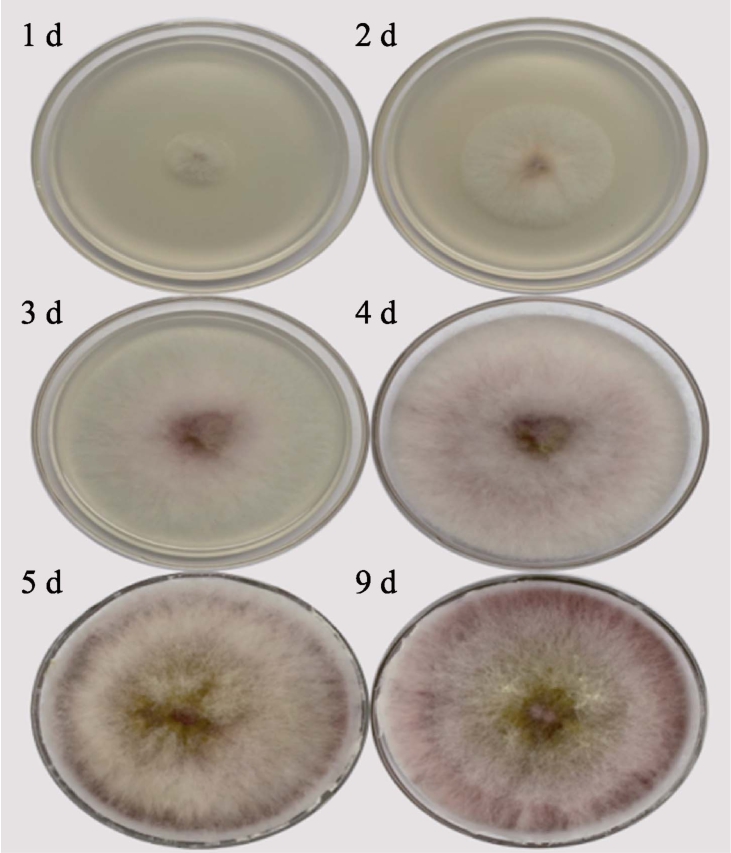
图1 禾谷镰刀菌菌落形态特征
Fig.1 Morphological characteristics of Fusarium graminearum colony
2.2 生长速度
禾谷镰刀菌生长过程中的菌落直径变化如表1所示。菌落生长初期的扩张速度稍慢于中后期,2 d后扩张速度达到最大,5 d后菌落已长满整个平板培养基。禾谷镰刀菌在中期的生长速率较快。
表1 禾谷镰刀菌生长速率情况
Table 1 Growth rate of Fusarium graminearum
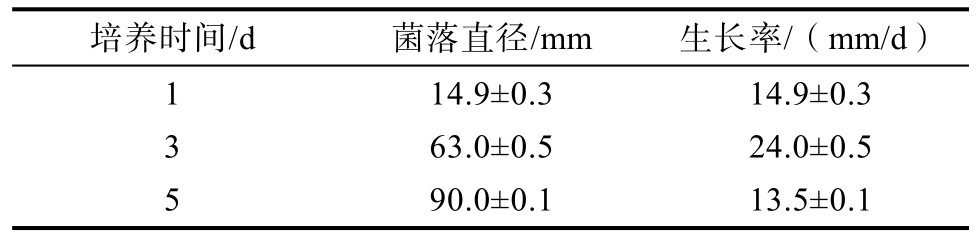
培养时间/d 菌落直径/mm 生长率/(mm/d)1 14.9±0.3 14.9±0.3 3 63.0±0.5 24.0±0.5 5 90.0±0.1 13.5±0.1
2.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)
28 ℃恒温培养24 h后,观察菌落的生长情况,细菌生长完全被抑制时所对应最低药物浓度试验孔即为ClO2水溶液、丁香精油和肉桂精油的MIC。继续培养24 h,无菌生长的最低样品浓度即为MBC值[6]。试验结果表明:ClO2水溶液MIC为6.25 mg/L,MBC为50 mg/L;丁香精油MIC为 0.096 g/mL,MBC为 0.382 g/mL;肉桂精油MIC为0.024 g/mL,MBC为0.765 g/mL。
2.4 ClO2对禾谷镰刀菌生长的影响
2.4.1 对菌落生长的影响
在培养禾谷镰刀菌菌落时发现其生长周期为10 d左右,接种2 d后,菌落已具初步形态,因此试验采用培养2 d的禾谷镰刀菌菌落进行试验处理。
不同浓度 ClO2水溶液对禾谷镰刀菌菌落生长抑制情况如图2所示。在正常生长情况下,禾谷镰刀菌生长呈朝四周扩散趋势,菌落直径增长快,菌落边缘较薄,整个菌落呈规则圆形。菌落中心由淡黄色变成红棕色,且颜色由外向内逐渐加深;ClO2水溶液试验组中的禾谷镰刀菌菌落中间菌丝生长茂盛,向四周生长较慢。
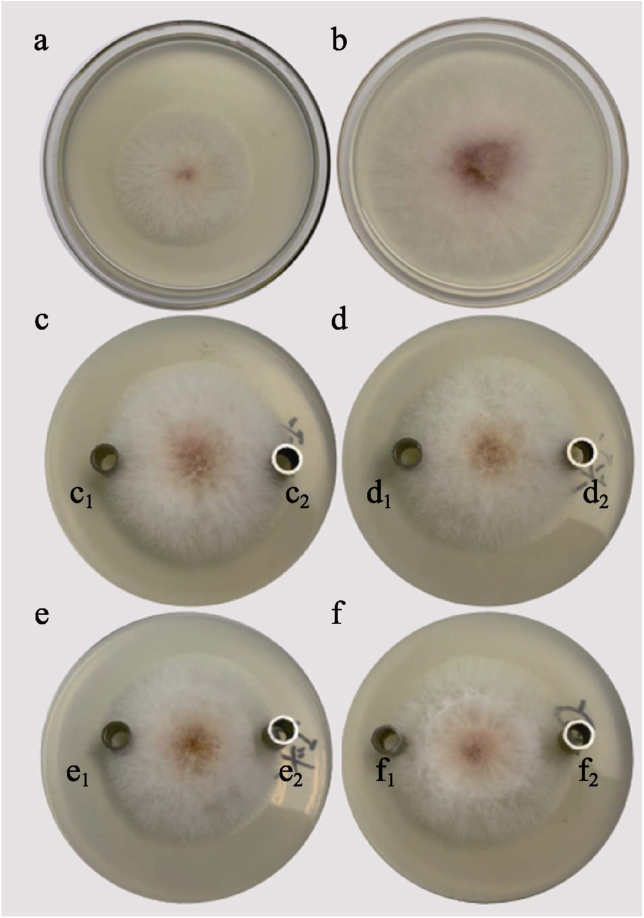
图2 ClO2水溶液对禾谷镰刀菌菌落的影响
Fig.2 Inhibitory effect of ClO2 aqueous solution on the Fusarium graminearum colony
a:48 h空白组;b:72 h空白组;c:10 mg/L ClO2组(c1:10 mg/L ClO2对照组;c2:10 mg/L ClO2实验组);d:20 mg/L ClO2组(d1:20 mg/L ClO2对照组;d2:20 mg/L ClO2实验组);e:30 mg/L ClO2组(e1:30 mg/L ClO2对照组;e2:30 mg/L ClO2实验组);f:40 mg/L ClO2组(f1:40 mg/L ClO2对照组;f2:40 mg/L ClO2实验组)
a: 48 h blank group; b: 72 h blank group; c: 10 mg/L ClO2(c1: 10 mg/L ClO2 Control group; c2: 10 mg/L ClO2 Experimental group); d:20 mg/L ClO2(d1: 20 mg/L ClO2 Control group; d2: 20 mg/L ClO2 Experimental group); e: 30 mg/L ClO2(e1: 30 mg/L ClO2 Control group; e2: 30 mg/L ClO2 Experimental group); f: 40 mg/L ClO2(f1:40 mg/L ClO2 Control group; f2: 40 mg/L ClO2 Experimental group)
低浓度(10、20 mg/L)处理组中c1、d1侧菌丝均延伸到牛津杯表面及内部,c2、d2侧的底部菌丝向上生长状况不如c1、d1,说明低浓度的ClO2影响禾谷镰刀菌生长,但抑制作用不显著;高浓度(30、40 mg/L)处理组中,试验组与对照组两侧的菌丝生长差别明显,e2、f2牛津杯不仅影响周围菌丝生长,还能观察到,e、f的菌落中心菌丝茂盛,但外侧菌丝不再往 e2、f2侧延伸,呈逆向生长,菌落边缘变薄,影响范围随浓度增加而变大。同时发现ClO2水溶液浓度为40 mg/L时,抑制效果最为显著,菌丝不能向四周和空气蔓延,菌落整体生长较为缓慢。ClO2水溶液能抑制禾谷镰刀菌菌落的生长,且随着 ClO2水溶液浓度升高,抑制禾谷镰刀菌菌落的生长越有效。
2.4.2 对菌丝生长的影响
不同浓度的 ClO2水溶液处理禾谷镰刀菌得到的菌丝干重如图3所示。随着ClO2浓度增大,菌丝体干重减少,ClO2浓度与菌丝体干重呈负相关。在20~40 mg/L ClO2溶液浓度下,其对菌丝生长的抑制率为25.97%~80.53%,由此可知ClO2溶液可以有效抑制禾谷镰刀菌菌丝体生长。以ClO2浓度对禾谷镰刀菌生长抑制率作图,得到标准曲线方程:y=0.026 7x-0.229 4,R2=0.949 7,计算得到 IC50为 27 mg/L。
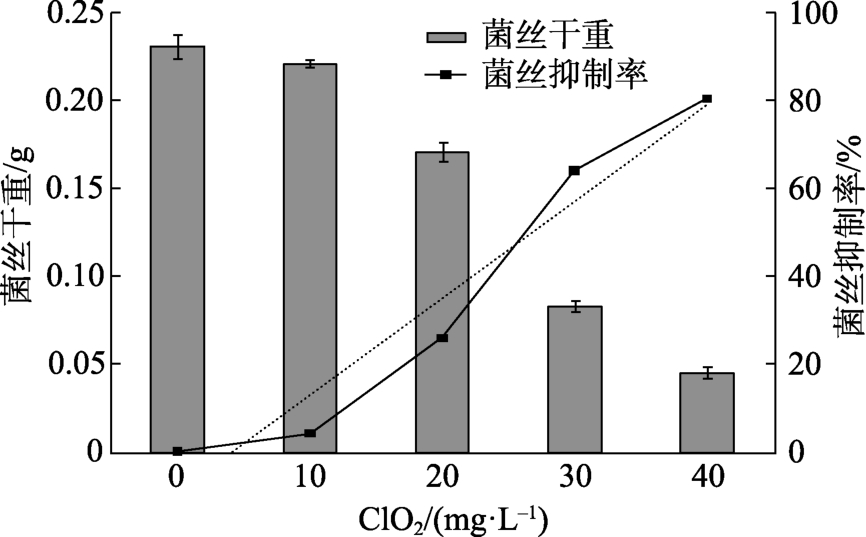
图3 不同浓度ClO2处理禾谷镰刀菌的菌丝干重
Fig.3 Dry weight of mycelium of Fusarium graminearum treated with different densities of ClO2
2.4.3 对孢子萌发的影响
禾谷镰刀菌的孢子形态及萌发情况如图4所示禾谷镰刀菌的大型分生孢子为镰刀形,稍弯曲,两端较为细窄,顶细胞末端稍尖。活化后的菌丝在CMC培养基中培养4 d,检测到的孢子浓度为2.05×106 个/mL。b为禾谷镰刀菌孢子悬液涂布平板后的萌发情况。
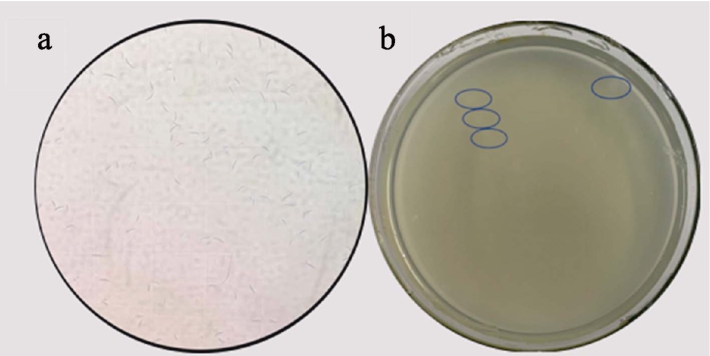
图4 禾谷镰刀菌的孢子形态及萌发情况
Fig.4 Spore morphology and Spore germination condition of Fusarium graminearum
a:普通光学显微镜下的孢子形态;b:孢子在平板上的萌发情况
a: Spore morphology under ordinary light microscope; b: Condition of spore germination on the plate
ClO2水溶液处理孢子悬液孢子萌发率变化情况如图5所示,随着ClO2水溶液浓度的升高,孢子的萌发率显著降低,当 ClO2水溶液浓度为40 mg/L时,孢子萌发率降低了93.67%。试验时还发现,低浓度(10、20 mg/L)处理组培养1 d后才有孢子萌发,高浓度(30、40 mg/L)处理组2 d后孢子才萌发。
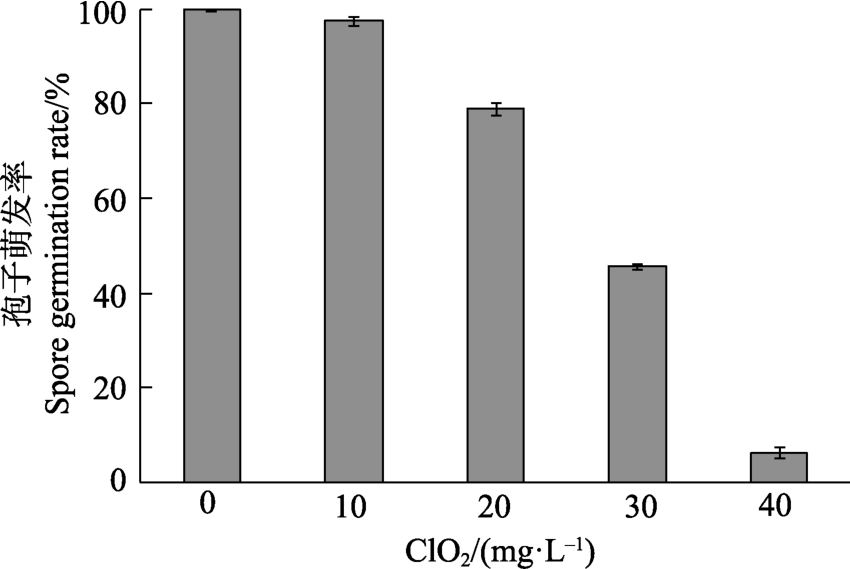
图5 不同浓度ClO2处理后孢子萌发率
Fig.5 Spore germination rate treated with different densities of ClO2
2.5 丁香精油和肉桂精油对禾谷镰刀菌生长的影响
2.5.1 对菌落生长的影响
不同浓度丁香精油熏蒸作用下,禾谷镰刀菌生长随培养时间的变化情况如图6所示。由图可知,培养前期,各浓度组菌落直径均随着培养时间延长有所增加,在相同培养时间下丁香精油浓度越高菌落直径越小。浓度相对较高的60、80、100 μL/L air三组,菌落直径随培养时间延长增加十分缓慢,与未处理的空白组差异十分明显,培养到5 d时,80和100 μL/Lair两浓度组菌落直径分别为对照组的55.29%和29.8%,5 d后增加更加缓慢,高浓度的丁香精油对禾谷镰刀菌菌落生长有明显的抑制作用。而低浓度20、40 μL/L air两组则与空白组比较相近,仅在培养前期(10 d前)表现出一定差异,抑制效果相对不明显。
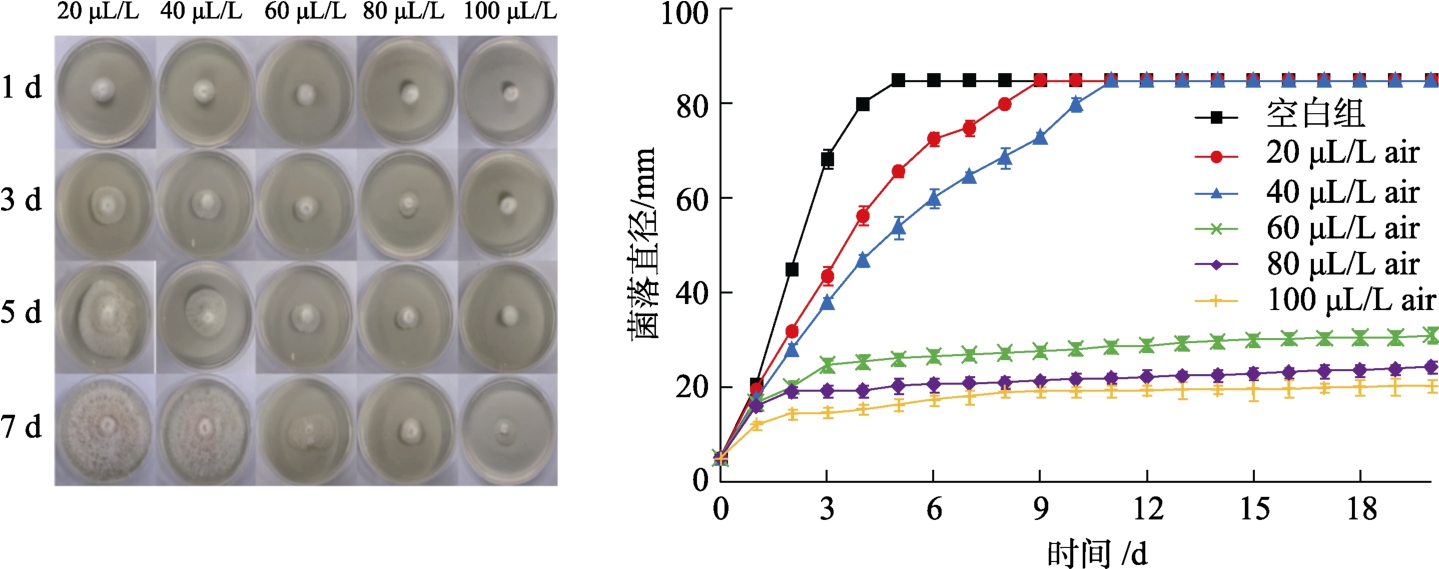
图6 不同浓度的丁香精油对禾谷镰刀菌菌落生长的影响
Fig.6 Effect of clove essential oil at different densities on the growth of Fusarium graminearum colony
反应不同肉桂精油浓度作用下,菌落生长随培养时间的变化情况如图7所示。由图可知,各浓度组菌落直径均随着培养时间延长增加,并表现出相似的增长趋势,前期增加相对更快。在相同培养时间下肉桂精油浓度越高菌落直径越小,培养至5 d时,在80和100 μL/L air剂量下菌落直径分别为对照组的 66.47%和 48.82%。与空白组对比发现,各处理组菌落整体厚度变薄,菌落中心几乎没有白色丝状菌丝,整个菌落呈淡桔色,菌落边缘新长出的白色菌丝变黄,菌丝长势萎靡,紧贴培养基生长,说明各浓度组肉桂精油对禾谷镰刀菌的生长均有不同程度的抑制作用。

图7 不同浓度的肉桂精油对禾谷镰刀菌菌落生长的影响
Fig.7 Effect of different densities of cinnamon essential oil on the growth of Fusarium graminearum colony
经培养7 d(其中空白组为5 d)不同浓度下两种精油熏蒸禾谷镰刀菌菌落平均生长速率如表2所示。由表可知,相同浓度下,丁香精油处理组菌落生长速度均小于肉桂精油组。与空白组比,在20 μL/L air浓度时丁香精油组生长速度降低了40.47%,肉桂精油组降低了27.06%,在100 μL/L air浓度时丁香精油组生长速度降低了 88.9%,肉桂精油组降低了59.53%,丁香精油对菌落生长的抑制作用随着剂量的增加比肉桂精油相对更显著。
表2 禾谷镰刀菌菌落生长速率
Table 2 Colony growth rate of Fusarium graminearum mm/d

生长速率浓度/(μL/L air) 丁香精油 肉桂精油0 17.00±0.3 17.00±0.3 20 10.12±0.2 12.40±0.4 40 8.12±0.5 10.33±0.2 60 3.50±0.1 10.25±0.1 80 2.56±0.1 9.67±0.2 100 1.89±0.1 6.88±0.1
观察菌落外观形态,在低浓度(20、40 μL/L air)条件下,丁香精油处理组菌落形态与对空白组比变化不明显(只影响菌落生长速率),肉桂精油处理组新长出来的菌丝颜色改变,菌丝紧缩,说明低浓度的肉桂精油虽然抑制菌落生产速度(直径)不如丁香精油,但会影响菌落生长形态。高浓度(60~100 μL/L air)条件下,两种精油处理菌丝颜色和菌丝形态均明显改变,丁香精油处理组变形更显著。
2.5.2 对菌丝生长的影响
丁香精油及肉桂精油对禾谷镰刀菌菌丝干重的影响如图8所示。与对照组相比,随着丁香精油和肉桂精油浓度增大,禾谷镰刀菌菌丝的干重均逐渐减小。在低浓度下(20、40 μL/L air)丁香精油和肉桂精油对菌丝干重影响差异不大,但在高浓度下(60、80、100 μL/L air)丁香精油对菌丝干重的影响较肉桂精油显著。
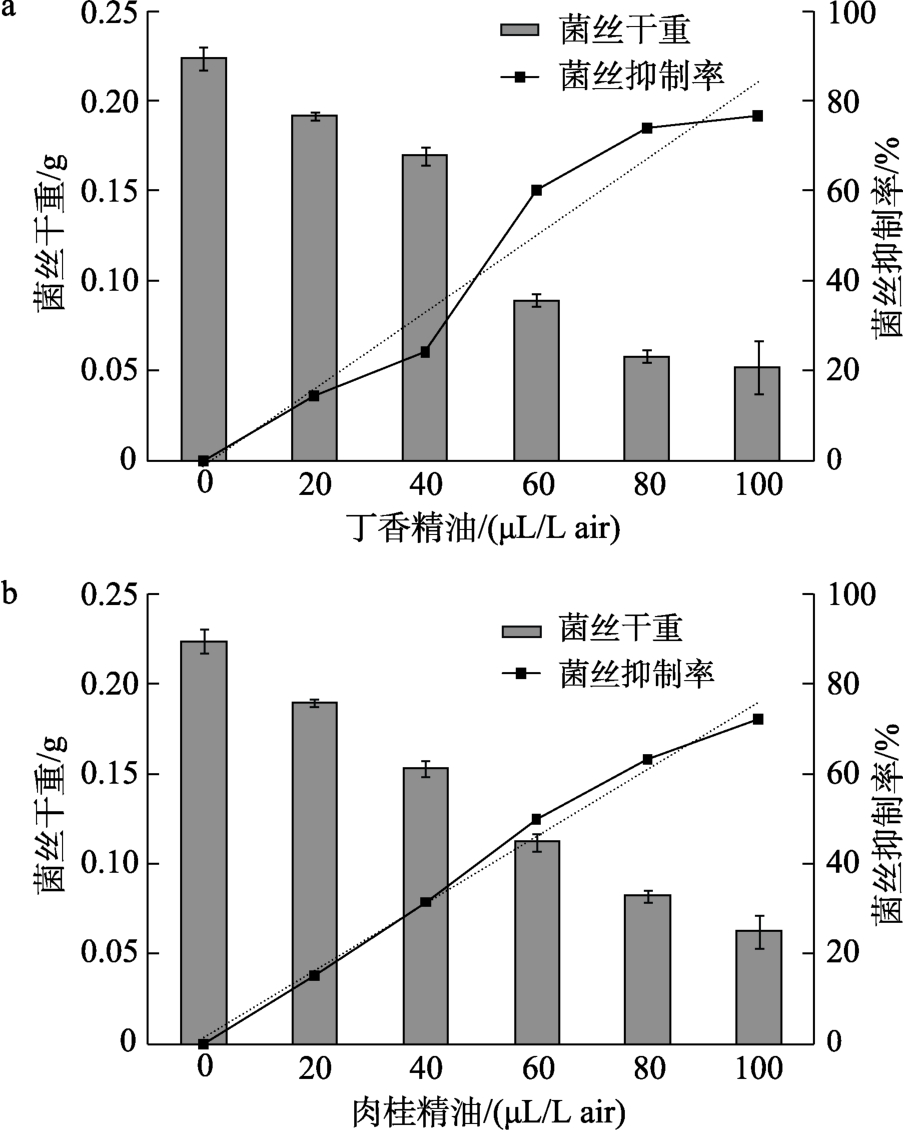
图8 不同浓度精油处理禾谷镰刀菌的菌丝干重及菌丝抑制率
Fig.8 Mycelial dry weight and mycelial inhibition rate of Fusarium graminearum treated with different densities of essential oil
根据丁香精油浓度和镰刀菌生长抑制率关系作图,得到拟合方程为 y=0.009 1x-0.026 5,R2=0.967 5,IC50=58 μL/L air;根据肉桂精油浓度和镰刀菌生长抑制率关系作图,得到线性拟合方程为 y=0.007 5x+0.001 29,R2=0.990 7,IC50=66 μL/L air。
2.5.3 对孢子萌发的影响
不同浓度的肉桂精油和丁香精油对禾谷镰刀菌孢子萌发的影响如图9所示。随着肉桂精油和丁香精油浓度的增加,孢子萌发率均呈降低趋势,丁香精油降低更为显著。在低浓度(20~40 μL/L air)时,肉桂精油对孢子萌发的抑制强于丁香精油,而在相对高浓度(60~100 μL/L air)时,丁香精油对孢子萌发的抑制强于肉桂精油。在100 μL/L air时,肉桂精油和丁香精油对孢子萌发抑制率分别为77.01%和99.21%,即丁香精油在100 μL/L air浓度下孢子几乎不萌发,抑制效果非常显著。
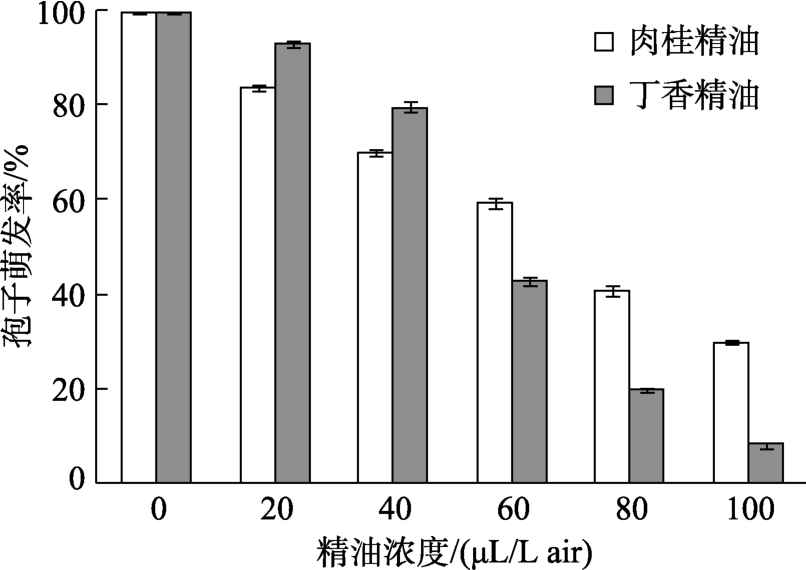
图9 不同浓度精油处理后孢子萌发率
Fig.9 Spore germination rate treated with essential oil of different densities
2.6 对麦角固醇含量的影响
麦角固醇是丝状真菌细胞膜的重要组成成分,通常用麦角固醇来表征真菌的生物量和维持膜完整性的标准,对维持膜结构的完整性、与膜结合酶的活性、膜的流动性、细胞活力以及物质运输非常重要[16]。
不同浓度 ClO2水溶液和精油处理后麦角固醇含量结果如图10所示。由图10a可知,随着ClO2浓度升高,麦角固醇含量逐渐减少,在40 mg/L时,麦角固醇含量只有 9.5%,比空白组减少了89.33%。说明ClO2可能会影响禾谷镰刀菌细胞膜的完整性,导致细胞膜渗透性增强,从而抑制菌丝的生长。图10b结果显示,两种精油处理都能降低菌体麦角固醇含量,在20~60 μL/L air相对低浓度下,肉桂精油对麦角固醇含量影响强于丁香精油,而在80、100 μL/L air相对高浓度时,丁香精油对麦角固醇含量影响强于肉桂精油。
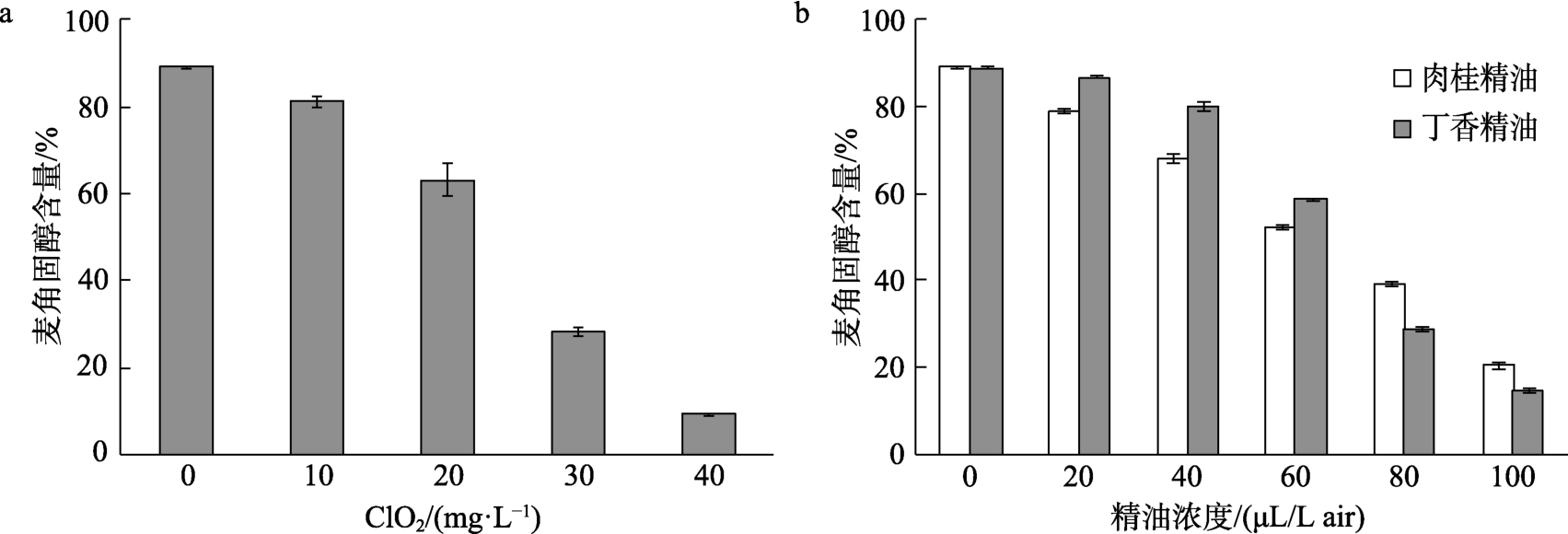
图10 不同浓度ClO2水溶液和精油处理后麦角固醇含量
Fig.10 Ergosterol content of Fusarium graminearum treated with ClO2 and essential oil of different densities
a:ClO2;b:丁香精油及肉桂精油
a: ClO2; b: Clove essential oil and cinnamon essential oil
2.7 禾谷镰刀菌菌丝的超微结构观察
2.7.1 ClO2对菌丝形态结构的影响
扫描电镜观察被 ClO2水溶液处理后的禾谷镰刀菌细胞结构如图11所示。正常条件下生长的菌丝体表面光滑,饱满粗壮,菌丝呈发散型扩展和分支排布,形成密集的立体空间网络。经ClO2处理后的菌丝整体结构呈收缩状,菌丝明显变细,菌丝表面变得凹凸不平。100 mg/L ClO2处理后的菌丝表面多处出现裂痕,细胞膜被破坏。不同浓度的ClO2水溶液处理均会造成菌丝细胞结构不同程度的破坏,菌体在高浓度ClO2条件下还会使其失活。

图11 ClO2水溶液处理后禾谷镰刀菌菌丝扫描电镜照片
Fig.11 SEM images of Fusarium graminearum treated with ClO2
a1:未处理组(10 000×);a2:未处理组(5 000×);b1:20 mg CIO2/L (10 000×);b2:20 mg CIO2/L(5 000×);c1:100 mg CIO2/L(10 000×);c2:100 mg CIO2/L(5 000×)
a1: Untreated group(10 000×); a2: Untreated group(5 000×); b1: 20 mg/L(10 000×); b2: 20 mg/L(5 000×); c1: 100 mg/L(10 000×); c2: 100 mg/L(5 000×)
2.7.2 两种植物精油对禾谷镰刀菌菌丝形态结构的影响
扫描电镜观察植物精油对禾谷镰刀菌菌丝结构的影响如图12所示。被精油处理过的菌丝表面均出现褶皱,菌丝体变细。高浓度丁香精油处理,使菌丝表面出现更多褶皱,菌丝的空间结构更加密集,菌丝体相互交错,菌丝变细;随着肉桂精油浓度的升高,菌丝破坏程度加重,菌丝体变得更加扁平,但即便在高浓度条件下,菌丝形态结构变化不如同等浓度的丁香精油。两种精油均能影响禾谷镰刀菌的菌丝体结构,对菌丝细胞造成不同程度的破坏。

图12 两种植物精油处理后禾谷镰刀菌菌丝扫描电镜照片
Fig.12 SEM images of Fusarium graminearum treated with essential oils
a1:未处理组(10 000×);a2:未处理组(5 000×);b1:40 μL/L air丁香精油(10 000×);b2:40 μL/L air丁香精油(5 000×);c1:100 μL/L air丁香精油(10 000×);c2:100 μL/L air丁香精油(5 000×);d1:40 μL/L air肉桂精油(10 000×);d2:40 μL/L air肉桂精油(5 000×);e1:100 μL/L air肉桂精油(10 000×);e2:100 μL/L air肉桂精油(5 000×)
a1: Untreated group (10 000×); a2: Untreated group (5 000×); b1: 40 μL/L air clove essential oil (10 000×); b2: 40 μL/L air clove essential oil(5 000×); c1: 100 μL/L air clove essential oil (10 000×); c2: 100 μL/L air clove essential oil (5 000×); d1: 40 μL/L air cinnamon essential oil(10 000×); d2: 40 μL/L air cinnamon essential oil (5 000×); e1: 100 μL/L air cinnamon essential oil (10 000×); e2: 100 μL/L air cinnamon essential oil (5 000×)
2.8 菌丝体的傅里叶红外光谱分析
物质的红外光谱具有特征性,可用于定性定量和结构分析,不同化合物的谱带位置、形状、数目和强度各异[17]。不同处理禾谷镰刀菌丝冻干粉的傅里叶红外光谱扫描结果如图13所示,由图可看出,ClO2和两种精油处理后,菌丝红外光谱扫描均表现差异,说明处理后会影响禾谷镰刀菌丝体含有的化合物,如脂质、蛋白质和碳水化合物等,其中丁香精油、ClO2影响相对更大,相关具体变化情况还有待进一步研究。
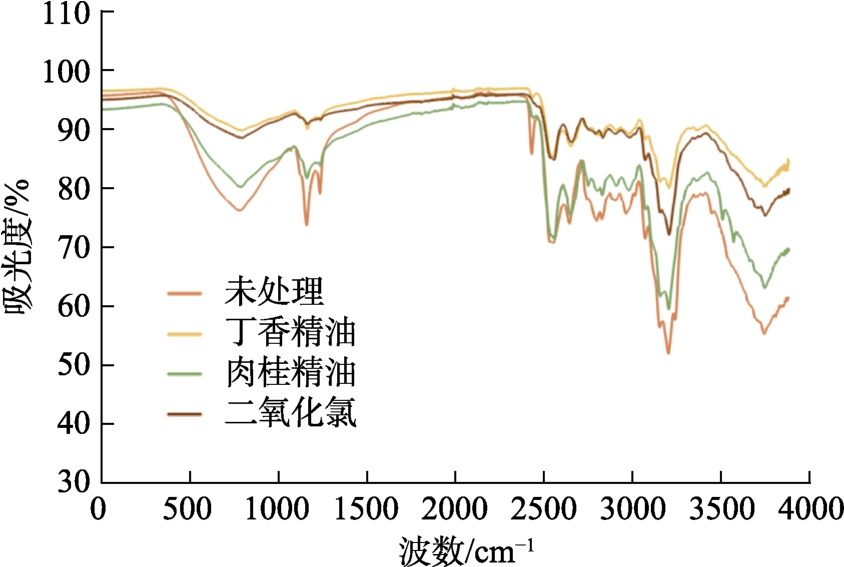
图13 ClO2、肉桂精油和丁香精油处理禾谷镰刀菌的ATR-FTIR光谱图
Fig.13 ATR-FTIR spectra of Fusarium graminearum treated with ClO2, cinnamon essential oil and clove essential oil
3 结论
ClO2和丁香精油、肉桂精油均对禾谷镰刀菌有抑制效果,且其浓度都与抑制作用呈正相关。ClO2水溶液MIC和MBC分别为6.25、50 mg/L;丁香精油MIC和MBC分别为0.096、0.382 g/mL;肉桂精油MIC和MBC分别为0.024、0.765 g/mL。通过菌丝生长的抑制实验得到 ClO2水溶液半抑制浓度IC50为27 mg/L,丁香精油和肉桂精油IC50分别为 58、66 μL/L air。
肉桂精油随着浓度的增加,菌丝体生长越来越慢,通过扫描电镜观察可以发现菌丝变得紧缩。丁香精油在低浓度(20~40 μL/L air)条件下抑制效果不如肉桂精油,但随着浓度的增加,其抑制效果显著增加,在80 μL/L air时,表现出对禾谷镰刀菌的持续性抑制作用,菌丝基本停止生长。丁香精油在高浓度(80~100 μL/L air)下对禾谷镰刀菌的抑制作用优于肉桂精油。ClO2和丁香、肉桂两种植物精油对禾谷镰刀菌菌丝细胞结构均会造成不同程度的破坏。ClO2水溶液破坏禾谷镰刀菌菌丝细胞膜,导致内容物渗出;高浓度丁香精油使禾谷镰刀菌菌丝结构变形较大,肉桂精油则使菌体发育不良。
[1]范江龙, 李欣蕊, 席雪冬. 小麦赤霉病生物防治研究进展[J].生物加工过程, 2021, 19(4): 420-431.FAN J L, LI X R, XI X D. Progresses in biological control of fusarium head blight[J]. Chinese Journal of Bioprocess Engineering, 2021, 19(4): 420-431.
[2]QINGSONG Y, PENG Y, AIBO W, et al. Variation in the microbiome, trichothecenes, and aflatoxins in stored wheat grains in Wuhan, China[J]. Toxins, 2018, 10(5): 171-171.
[3]袁媛, 邢福国, 刘阳. 植物精油抑制真菌生长及毒素积累的研究[J]. 核农学报, 2013, 27(8): 1168-1172.YUAN Y, XING F G, LIU Y. Role of essential oils in the inhibition of fungal growth and mycotoxin accumulation[J].Journal of Nuclear Agricultural Sciences, 2013, 27(8): 1168-1172.
[4]冯文旭. 精油乳液的制备及其减少制麦过程中呕吐毒素积累的研究[D]. 无锡市: 江南大学, 2020.FENG W X. Preparation of essential oil emulsions and its reduction of deoxynivalenol accumulation during malting process[D]. Wuxi: Jiangnan University, 2020.
[5]靳梦曈, 王建华, 林善海, 等. 室温下麦粒中脱氧雪腐镰刀菌烯醇(DON)及其隐蔽型(D3G)毒素累积分析[J]. 食品工业科技, 2015, 36(17): 132-136+141.JIN M T, WANG J H, LIN S H, et al. Analysis of deoxynivaleno(DON) and masked deoxynivalenol(D3G) accumulation in different treatment wheat grains at room temperature[J]. Science and Technology of Food Industry, 2015, 36(17): 132-136+141.
[6]曾荣, 陈金印, 林丽超. 丁香精油及丁香酚对食品腐败菌的抑菌活性研究[J]. 江西农业大学学报, 2013, 35(4): 852-857.ZENG R, CHEN J Y, LIN L C. Antimicrobial activity of clove essential oils and eugenol against food-borne bacteria[J]. Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(4): 852-857.
[7]孙长花, 于智勇, 丁娟芳, 等. 丁香提取物抑菌作用及稳定性研究[J]. 生物学杂志, 2021, 38(1): 61-65.SUN C H, YU Z Y, DING J F, et al. Study on bacteriostasis and stability of clove extract[J]. Journal of Biology, 2021, 38(1): 61-65.
[8]孙超. 二氧化氯和臭氧对污染粮食中呕吐毒素DON产生的影响及消减控制研究[D]. 无锡市: 江南大学, 2017.SUN C. The effect and detoxification control of vomitoxin DON in contaminated grains by chlorine dioxide and ozone[D]. Wuxi:Jiangnan University, 2017.
[9]JUN T, XIAOBIN Z, HONG Z. Investigations on the antifungal effect of nerol against Aspergillus flavus causing food spoilage[J].The Scientific World Journal, 2013.
[10]周丹丹, 王卓, 邢梦珂, 等. 植物精油抑制炭疽菌及对枇杷采后炭疽病与品质的影响[J]. 食品科学, 2017, 38(19): 212-217.ZHOU D D, WANG Z, XING M K, et al. Inhibitory effect of plant essential oils on collectorichum acutatum and postharvest anthracnose and quality of loquat fruits[J]. Food Science, 2017,38(19): 212-217.
[11]MARJANA R, TAIANE M C, DOS S H H C. Chemical composition and in vitro antioxidant and antihyperglycemic activities of clove, thyme, oregano, and sweet orange essential oils[J]. LWT, 2021, 138.
[12]TIAN J, BAN X, ZENG H. The mechanism of antifungal action of essential oil from dill (Anethum graveolens L.) on Aspergillus flavus[J]. Inventi Impact Pharmacokinetics & Pharmacodynamics,2012.
[13]谢强, 林玉桓, 苗淑萍, 等. 香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响[J]. 食品工业科技, 2014, 35(23): 54-58+62.XIE Q, LIN Y H, MIAO S P, et al. Effects of carvacrol on escherichia coli and staphylococcus aureus membrane[J]. Science and Technology of Food Industry, 2014, 35(23): 54-58+62.
[14]袁康, 胡振阳, 陈可欣, 等. 紫苏精油抑制灰绿曲霉的活性与机理[J]. 食品科学, 2020, 41(23): 63-69.YUAN K, HU Z Y, CHEN K X, et al. Activity and mechanism of perilla essential oil in inhibiting aspergillus glaucus[J]. Food Science, 2020, 41(23): 63-69.
[15]陈可欣, 骆郑航, 李玲, 等. 香樟精油抑制灰绿曲霉的活性与机理研究[J]. 中国粮油学报, 2021, 36(3): 71-78.CHEN K X, LUO Z H, LI L, et al. Antimicrobial effect and mechanism of cinnamomum camphora essential oil on aspergillus glaucus[J]. Journal of the Chinese Cereals and Oils Association,2021, 36(3): 71-78.
[16]习兴梅, 曾光明, 郁红艳, 等. 真菌生物量指示剂麦角固醇的分离及测定方法[J]. 微生物学通报, 2006, 33(3): 128-132.XI X M, ZENG G M, YU H Y, et al. The techniques of isolation and determination of ergosterol as the indicator of fungal biomass[J]. Microbiology China, 2006, 33(3): 128-132.
[17]范宇. 银杏黄酮对苹果扩展青霉的抑制机理[D].大连工业大学, 2017.FAN Y. Mechanism of flavonoid to penicillium expansum on antibacterial ability[D]. Dalian Polytechnic University, 2017.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。