玉米蛋白粉是玉米加工的主要副产物,产量巨大[1-3]。但由于其醇溶蛋白含量较高及氨基酸组成不平衡,严重制约其应用,大多被当作饲料原料[3-5]。微生物分泌的蛋白酶能将蛋白粉中难溶的植物蛋白质降解并产生具有多种生理活性的肽类,因此,利用微生物发酵过程加工玉米蛋白粉具有广阔应用发展前景[3-7]。张智等[8]确定了枯草芽孢杆菌ls-45制备玉米肽的最佳发酵条件;徐艳阳[7]等对纳豆芽孢杆菌水解玉米蛋白粉产玉米肽的工艺进行了优化;文超婷等[9]优化了羊肚菌发酵玉米蛋白液体发酵培养条件。但是,目前面临适宜发酵微生物资源认识和开发不足以及相应发酵工艺建立等问题[3-4],尤其是筛选获得高效蛋白酶活性的菌株及相应发酵工艺条件优化成为当前研究的重点。
本研究从传统自然发酵豆酱样品中,通过玉米蛋白粉固体筛培法和福林酚法等分离筛选到高效降解玉米蛋白粉的益生菌,并通过单因素发酵实验和正交实验对单菌株及其菌株组合发酵玉米蛋白粉的条件进行了优化。研究为提升优化微生物发酵玉米蛋白粉的条件工艺及其应用奠定基础。
1 材料方法
1.1 实验材料
自然发酵豆酱样品:市购;可溶蛋白含量测定试剂盒、DPPH自由基清除能力试剂盒:苏州格锐思生物科技公司;TIANamp Bacteria DNA Kit:北京天根生化科技有限公司;无水碳酸钠溶液、三氯乙酸溶液、磷酸缓冲液(pH分别为4.5、7.2、9.3):上海麦克林生化科技有限公司;酪蛋白、福林酚:北京索莱宝科技有限公司;配制培养基的各种样品、试剂,均为国产分析纯:国药集团化学试剂有限公司。
1.2 仪器与设备
冷冻干燥仪(ALPHA2-4):德国Chris Marin公司;pH计(FE20K):瑞士METTLER TOLEDO公司;振荡培养箱(SHK-99-II):北京北方同正生物技术发展有限公司;微型旋涡仪(V2S02S):德国 IKA公司;酶标仪(SynergvHT):美国BIOTEK 公司;台式高速冷冻离心机(EPPENDORF 5810R):德国EPPENDORF公司;PCR仪(C1000 Touch):美国BIORAD公司。
1.3 实验方法
1.3.1 菌株筛选、蛋白酶活性测定及菌种鉴定
研究中所用玉米蛋白粉平板筛选培养基,玉米蛋白粉基础发酵培养基及玉米蛋白粉优化发酵培养基参考文献王雨婷等[3],参照相关文献[3-4],菌株筛选采用玉米蛋白粉平板筛选培养基观察并测定菌落周围透明圈的大小;蛋白酶活性测定按照国标福林酚试剂法测定发酵液中上清液的蛋白酶活性;菌株鉴定,提取目标菌株基因组DNA,PCR扩增其16S rDNA,PCR产物由上海生工生物科技有限公司测序,测序结果采用 DNAMAN软件序列图谱校对拼接,并在 NCBI数据库中进行同源序列比对鉴定。
1.3.2 菌株玉米蛋白粉发酵实验
平板活化菌株HDJ1和HDJ2后接种于LB培养基中培养,再将此种子液接种于玉米蛋白粉基础发酵培养基中,以初始pH 8.0、接种量5%、摇床转速150 r/min、温度30 ℃、培养时间48 h为基础初始发酵条件,采用单因素及正交实验对培养基玉米蛋白粉含量、培养基初始pH、接种量、发酵温度、摇床转速、发酵时间及装液量等工艺参数进行优化。可溶蛋白含量测定采用可溶蛋白含量测定试剂盒。
1.3.3 菌株玉米蛋白粉发酵液冷冻干燥及冻干粉生理生化性质测定
对玉米蛋白粉发酵液进行冷冻干燥,先-80 ℃冷冻,经过降温,抽真空和主干燥,温度控制在-75~85 ℃之间,压强0.08 Mpa。
活菌数的测定。平板计数法,取10 g样品于装有90 mL无菌水的三角瓶中,振荡20 min,摇匀,稀释到一定的梯度,取三个梯度进行涂布,每个梯度设置 3组平行,倒置于 37 ℃恒温培养箱中培养,待计数。蛋白酶活的测定采用国标同1.3.1. DPPH自由基清除能力通过DPPH自由基清除能力试剂盒测定。
1.4 数据分析
本文中相关数据计算、处理及作图都利用软件Microsoft Excel 2019进行。
2 结果与讨论
2.1 菌株筛选、鉴定及蛋白酶活性测定
从自然发酵豆酱样品中分离筛选到两株出现明显透明水解圈菌株,菌株号分别为 HDJ1和HDJ2,其透明水解圈图片见图1,透明圈(H/C)值分别为2.2和2.4。
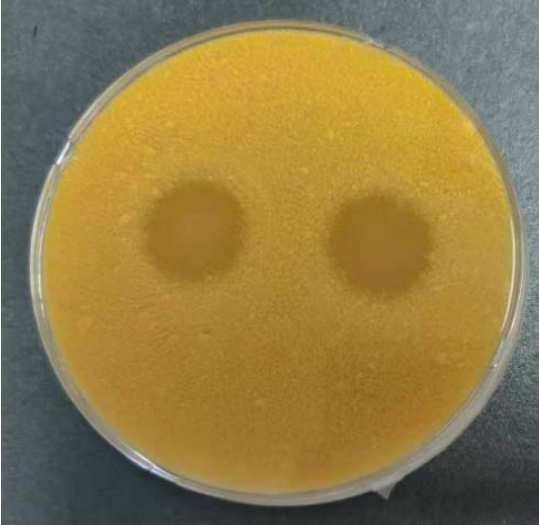
图1 菌株在玉米蛋白粉固体筛选培养基上水解透明圈图
Fig.1 Hydrolytic transparent circles of microbial strains of corn gluten meal screening medium
左为菌株HDJ1,右为菌株HDJ2。
left: HDJ1, right: HDJ2.
基于 16S rDNA序列的分子鉴定通过 NCBI BLAST比对确定菌株分类地位。结果显示,筛选获得的细菌菌株 HDJ1为枯草芽胞杆菌 Bacillus subtilis,另一株HDJ2为贝莱斯芽胞杆菌Bacillus velezensis(表1)。
表1 菌株筛选鉴定结果及菌株蛋白酶活性
Table 1 Identification of two stains and the protease activity U/mL
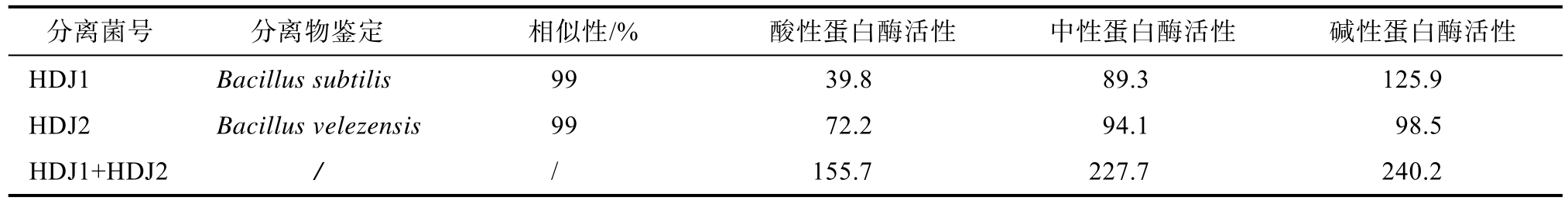
分离菌号 分离物鉴定 相似性/% 酸性蛋白酶活性 中性蛋白酶活性 碱性蛋白酶活性HDJ1 Bacillus subtilis 99 39.8 89.3 125.9 HDJ2 Bacillus velezensis 99 72.2 94.1 98.5 HDJ1+HDJ2 / / 155.7 227.7 240.2
依据国标福林酚试剂法测定了菌株蛋白酶活性(表1)。从研究结果可看出,菌株具有较高的蛋白酶活性。两菌株间蛋白酶活性比较显示,HDJ1酸性蛋白酶和中性蛋白酶活性低于HDJ2,而碱性蛋白酶活性高于HDJ2,说明HDJ1和HDJ2有各自更适合分解的蛋白种类。研究还表明两菌株共培养可极大地提升蛋白酶的活性,酸性、中性和碱性蛋白酶活性都有增加,比单菌株蛋白酶活大多提高1倍以上。说明菌株组合能改善和提高蛋白分解效率。
芽孢杆菌是国际上普遍应用的生防细菌,是食品生产加工菌,也是微生物饲料和微生物生态制剂的研究热点之一[10-11]。枯草芽孢杆菌分布广泛,能够帮助生物防治马铃薯黄疫病等多种病害[10-11],还能够合成分泌蛋白酶、脂肪酶等多种酶类,也是发酵玉米蛋白粉的重要菌株资源[10-12]。贝莱斯芽孢杆菌能分泌多种生物活性物质,抑制包括稻瘟病病原菌、梨灰霉在内等多种病原菌,并且促进植物生长;添加于饲料中还可促进动物生长[13-15]。本研究中的菌株均有酸性蛋白酶、中性蛋白酶及碱性蛋白酶活性,并且具有显著的组合培养协同提效分解蛋白的作用,应用潜力巨大。
2.2 菌株发酵玉米蛋白粉单因素发酵工艺优化
对菌株进行了发酵温度、发酵初始pH、底物玉米蛋白粉含量、摇瓶转速、菌株接种量及装液量加液体积的发酵玉米蛋白粉单因素发酵条件的优化。HDJ1和HDJ2单菌株在40 ℃发酵液可溶蛋白含量最高,而组合(HDJ1+HDJ2,等量)发酵液可溶蛋白含量在30 ℃最高(图2);50 ℃时,可溶性蛋白含量仍较高。pH 8时,HDJ1、HDJ1和HDJ2组合发酵液可溶蛋白含量最高,HDJ2则在pH 6时最高(图2)。HDJ1在接种量6%,底物浓度8%,转速200 r/min,加液体积40 mL,发酵时间72 h可溶蛋白含量最高;HDJ2在接种量9%,底物浓度8%,转速150 r/min,加液体积120 mL,发酵时间 72 h可溶蛋白含量最高;而 HDJ1和HDJ2等量组合在接种量6%,底物浓度8%,转速250 r/min,加液体积40 mL,发酵时间96 h下可溶蛋白含量最高(图2和表2)。而装液量即加液体积变化不明显,以下选择80 mL/300 mL装瓶液量。

图2 单因素对可溶蛋白含量的影响
Fig.2 Effect of single factor on soluble protein content
a. 温度; b. pH; c. 底物浓度(玉米蛋白粉含量); d. 转速; e. 接种量; f. 装液量(加液体积)。
a. temperature; b. pH; c. substrate concentration (content of corn gluten meal); d. rotation speed; e. amount of inoculation; f. liquid loading volume (volume of added liquid).
表2 发酵时间单因素表
Table 2 Fermentation time factor
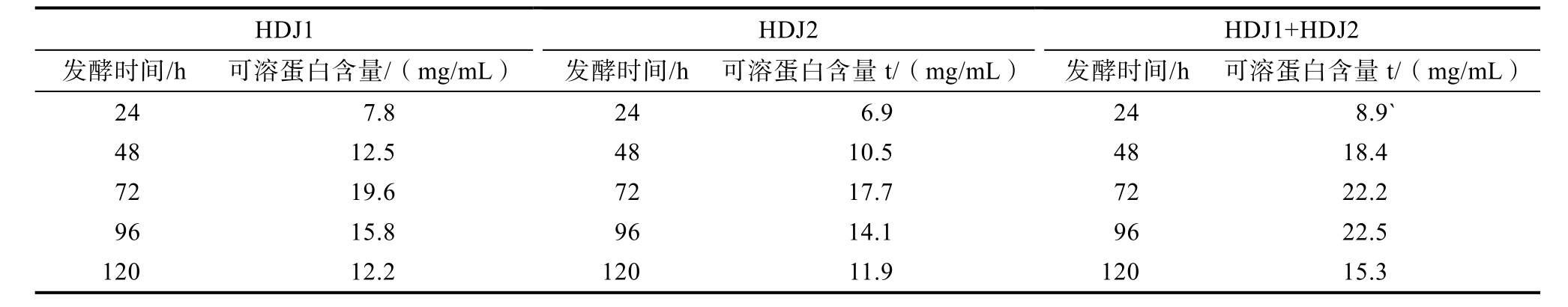
HDJ1HDJ2HDJ1+HDJ2发酵时间/h 可溶蛋白含量/(mg/mL) 发酵时间/h 可溶蛋白含量t/(mg/mL) 发酵时间/h 可溶蛋白含量t/(mg/mL)247.8246.9248.9`4812.54810.54818.4 7219.67217.77222.2 9615.89614.19622.5 12012.212011.912015.3
2.3 菌株发酵玉米蛋白粉发酵正交实验
在单因素实验的基础上,选定底物浓度、种子液的接种量、初始pH、摇床转速、发酵温度、发酵时间6个因素,采用L18(36)正交实验设计进行研究(表3)。各组正交实验设计和实验数据见表4(HDJ1)、表5(HDJ2)及表6(HDJ1+HDJ2)。由正交实验分析表比较各因素对可溶性蛋白含量的极差大小及平均值可看出,不同因素对可溶蛋白含量影响由大到小HDJ1为RA>RE>RD>RF>RB>RC,HDJ2 为 RA> RB> RE>RC>RD>RF。HDJ1+HDJ2为 RA>RE>RD>RF>RC>RB。正交实验结果显示HDJ1、HDJ2、HDJ1和 HDJ2组合在发酵温度30 ℃,发酵pH 8,接种量3%,底物浓度8%,转速200 r/min,发酵时间96 h条件下发酵液可溶蛋白含量最高。
表3 L18(36)正交实验设计
Table 3 L18(36) Orthogonal experimental design
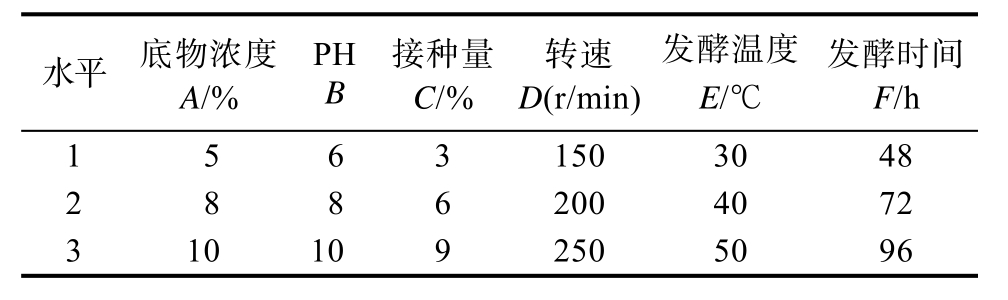
水平 底物浓度A/%PH B接种量C/%转速D(r/min)发酵温度E/℃发酵时间F/h 15631503048 28862004072 3101092505096
表4 HDJ1正交实验分析表
Table 4 HDJ1 Orthogonal test analysis table
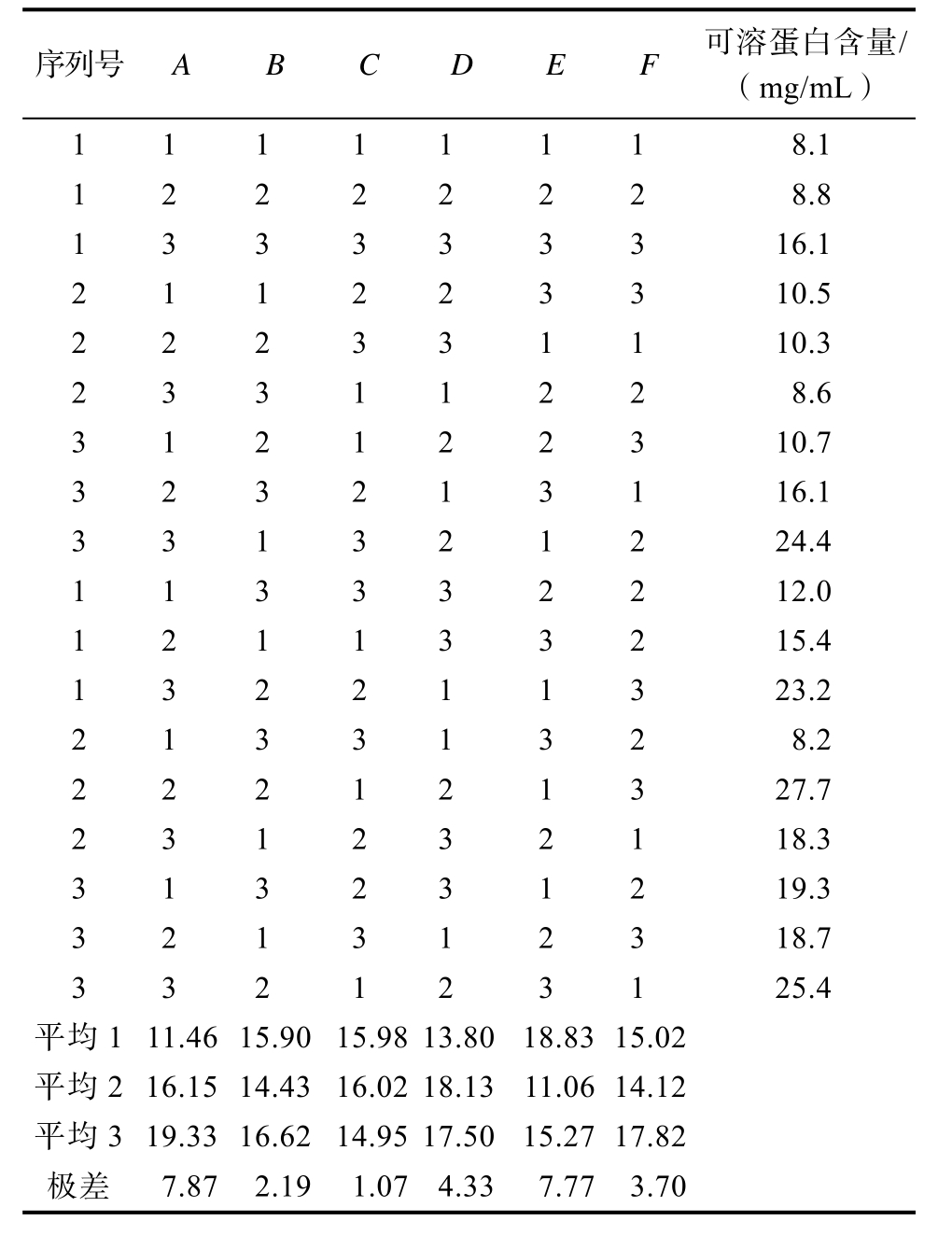
序列号A B C D E F 可溶蛋白含量/(mg/mL)11111118.1 12222228.8 133333316.1 211223310.5 222331110.3 23311228.6 312122310.7 323213116.1 331321224.4 113332212.0 121133215.4 132211323.2 21331328.2 222121327.7 231232118.3 313231219.3 321312318.7 332123125.4平均111.4615.9015.9813.8018.8315.02平均216.1514.4316.0218.1311.0614.12平均319.3316.6214.9517.5015.2717.82极差7.872.191.074.337.773.70
表5 HDJ2正交实验分析表
Table 5 HDJ2 Orthogonal test analysis table
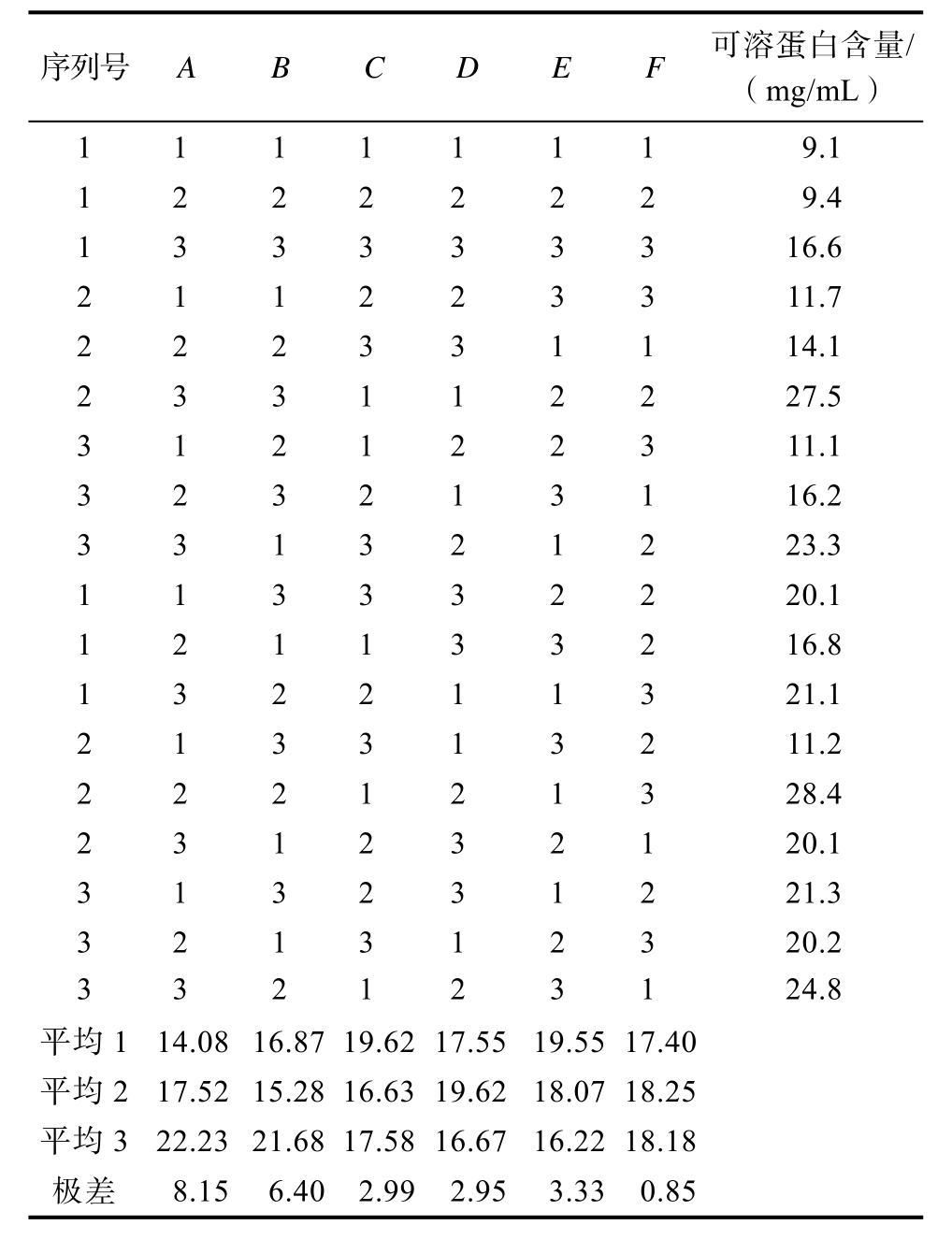
序列号A B C D E F 可溶蛋白含量/(mg/mL)1 1 1 1 1 1 19.1 1 2 2 2 2 2 29.4 1 3 3 3 3 3 316.6 2 1 1 2 2 3 311.7 2 2 2 3 3 1 114.1 2 3 3 1 1 2 227.5 3 1 2 1 2 2 311.1 3 2 3 2 1 3 116.2 3 3 1 3 2 1 223.3 1 1 3 3 3 2 220.1 1 2 1 1 3 3 216.8 1 3 2 2 1 1 321.1 2 1 3 3 1 3 211.2 2 2 2 1 2 1 328.4 2 3 1 2 3 2 120.1 3 1 3 2 3 1 221.3 3 2 1 3 1 2 320.2 3 3 2 1 2 3 124.8平均1 14.08 16.87 19.62 17.55 19.55 17.40平均217.52 15.28 16.63 19.62 18.07 18.25平均322.23 21.68 17.58 16.67 16.22 18.18极差8.15 6.40 2.99 2.95 3.33 0.85
表6 HDJ1+HDJ2正交实验分析表
Table 6 HDJ1+HDJ2 Orthogonal test analysis table
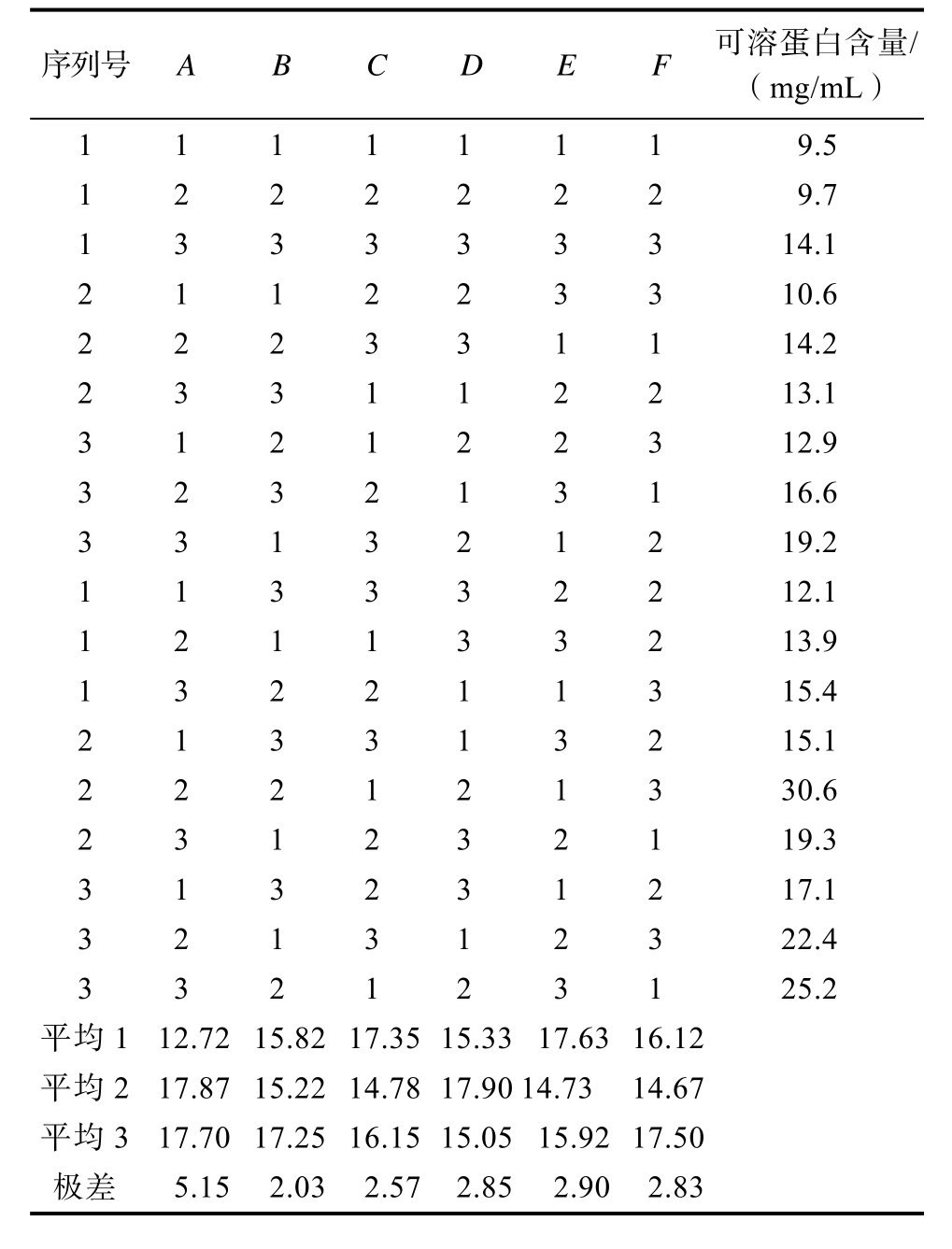
序列号A B C D E F 可溶蛋白含量/(mg/mL)1 1 1 1 1 1 19.5 1 2 2 2 2 2 29.7 1 3 3 3 3 3 314.1 2 1 1 2 2 3 310.6 2 2 2 3 3 1 114.2 2 3 3 1 1 2 213.1 3 1 2 1 2 2 312.9 3 2 3 2 1 3 116.6 3 3 1 3 2 1 219.2 1 1 3 3 3 2 212.1 1 2 1 1 3 3 213.9 1 3 2 2 1 1 315.4 2 1 3 3 1 3 215.1 2 2 2 1 2 1 330.6 2 3 1 2 3 2 119.3 3 1 3 2 3 1 217.1 3 2 1 3 1 2 322.4 3 3 2 1 2 3 125.2平均1 12.7215.8217.35 15.33 17.63 16.12平均217.8715.2214.78 17.90 14.73 14.67平均317.7017.2516.15 15.05 15.92 17.50极差5.152.032.57 2.85 2.90 2.83
2.4 玉米蛋白粉发酵后发酵液生理化生化指标的测定结果
玉米蛋白粉微生物发酵后发酵液进行了冷冻干燥,制成发酵玉米蛋白肽粉。发酵后样品可溶蛋白含量、DPPH清除率等显著提高,特别是可溶蛋白含量增加明显(表7),其中 HDJ1+HDJ2发酵液干燥粉可溶蛋白含量为231.2 mg/g。水溶性显著提高正是由于发酵过程中微生物分泌的各种蛋白酶类将玉米蛋白粉中难溶的大分子蛋白质降解为分子量较小的多肽,增加了可溶性。
表7 玉米蛋白粉发酵前后生化指标对比
Table 7 Comparison of biochemical indexes of corn gluten meal before and after fermentation

水平 益生菌/(cfu/g)蛋白酶活性/(U/g)可溶蛋白含量/(mg/g)氨基酸含量/(μg/g)DPPH清除率(0.01g/mL)/%玉米蛋白粉原料006.3216.132 HDJ1发酵液干燥粉1.5*1083 380.5195.82 107.184 HDJ2发酵液干燥粉5*1082 579.2207.42 212.281 HDJ1+HDJ2发酵液干燥粉1.2*1093 776.3231.23 298.790
已报道常用于玉米蛋白粉发酵的微生物有芽孢杆菌、米曲霉、黑曲霉等[1-9]。王雨婷等[3]报道枯草芽孢杆菌菌株X1-1在接种量6%,发酵温度36 ℃,转速180 r/min,发酵时间72 h为其液态发酵玉米蛋白粉的最佳条件。其发酵液经喷雾干燥得到样品的蛋白酶活为2 217 U/g,粗蛋白以及小肽含量提高了1.81倍和5.35倍。并提出底物浓度限值可能与发酵底物中含有较高浓度的硫化物从而对微生物的发酵产生抑制作用有关[3]。关于硫化物对菌株发酵的抑制作用我们在今后的实验也将进一步研究。向丽蓉等[16]通过单因素和正交实验,发现黑曲霉 L289在培养时间 5 d,温度34 ℃,装液量40 mL,底物浓度5%下发酵最佳,发酵液中氨基酸含量达2 718.05 μg/mL。另有研究对纳豆芽孢杆菌及羊肚菌等单菌株发酵条件进行了优化[7,9]。关于复合菌发酵玉米蛋白粉研究,魏炳栋等[17]对复合菌(黑曲霉、乳酸菌、酵母菌和地衣芽孢杆菌)发酵玉米蛋白粉的条件进行优化,通过正交实验研究发现最优接种比例为地衣芽孢杆菌 4%、乳酸菌 4%、酵母菌 6%、黑曲霉6%,发酵温度35 ℃、发酵时间84 h、含水量45%、初始pH为6为最佳发酵条件,在此条件下多肽得率可达44.03%。筛选获得高蛋白酶活性的菌株资源及相应发酵工艺条件优化是微生物发酵玉米蛋白粉研究的重点,是后续菌株改造和投入应用的基础,还需加强相关研究。而本研究中两菌株发酵效果优于单株菌也提示我们今后进一步对菌株间相互作用关系和作用机理进行探究。
3 结论
筛选玉米蛋白粉高效降解益生菌,利用益生菌发酵玉米蛋白粉产肽的研究和其发酵工艺条件的优化具有重要的意义。本研究通过固体筛培法筛选到两株玉米蛋白粉高效降解菌株 HDJ1和HDJ2。通过单因素发酵实验优化 HDJ1菌株、HDJ2菌株、及HDJ1和HDJ2等量组合液态发酵玉米蛋白粉的最佳条件(可溶蛋白含量最高条件)。正交实验结果显示 HDJ1、HDJ2、HDJ1和HDJ2等量组合在发酵温度30 ℃,发酵pH 8,接种量3%,底物浓度8%,转速200 r/min,发酵时间96 h条件下发酵液可溶蛋白含量最高。经益生菌菌株发酵后发酵液冷冻干燥后样品蛋白酶活、可溶蛋白含量、DPPH清除率等显著提高,并且两菌株组合后的发酵效果优于单株菌。通过本研究也证实了微生物发酵的确能提高可溶蛋白含量。后续将进一步进行玉米蛋白粉益生菌发酵产玉米肽的研究和优化发酵工艺的探索,以期将为玉米加工副产物蛋白粉的增值利用奠定基础。
[1]ZHU B, HE H, HOU T. A comprehensive review of corn protein-derived bioactive peptides: production, characterization,bioactivities, and transport pathways[J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18: 329-345.
[2]LI G, LIU W, WANG Y, et al. Functions and applications of bioactive peptides from corn gluten meal[M]. Advances in food and nutrition research. Academic Press, 2019, 87: 1-41.
[3]王雨婷, 缪礼鸿, 周风鸣,等. 一株高效降解玉米蛋白粉枯草芽孢杆菌的筛选及其发酵特性研究[J]. 饲料工业, 2017,38(21): 49-56.WANG Y T, MIAO L H, ZHOU F M, et al. An efficient degradation of corn gluten meal Bacillus subtilis screening and fermentation characteristics research[J]. Feed Industry, 2017,38(21): 49-56.
[4]任菲, 刘玉春, 王超, 等. 高效降解玉米蛋白粉益生菌筛选及生长特性研究[J]. 粮油食品科技, 2021, 29(3): 183-191.REN F, LIU Y C, WANG C, et al. Screening and growth characteristics of probiotics for high efficient degradation of corn gluten meal[J]. Science and Technology of Cereals, Oils and Foods, 2021, 29(3): 183-191.
[5]李艳娟, 李书国. 玉米生物活性肽的制备及功能和食品的研究进展[J]. 粮食与饲料工业, 2014, 12(6): 41-44.LI Y J, LI S G. Research progress on preparation and biological activity of bioactive peptides derived from corn gluten and its functional foods[J]. Cereal & Feed Industry, 2014, 12(6): 41-44.
[6]曹慧英, 柴媛, 肖志刚, 等. 玉米活性肽的研究进展[J]. 食品安全质量检测学报, 2019, 10(19): 6587-6591.CAO H Y, CHAI Y, XIAO Z G, et al. Research progress of corn active peptide[J]. Journal of Food Safety & Quality, 2019,10(19): 6587-6591.
[7]徐艳阳, 朱志红, 李晴, 等. 纳豆菌发酵玉米蛋白粉制备玉米肽工艺优化[J]. 食品研究与开发, 2014, (19): 75-79.XU Y Y, ZHU Z H, LI Q, et al. Optimization of fermentation process for polypeptide from corn protein powder via Bacillus Natto[J]. Food Research and Development, 2014, (19): 75-79.
[8]张智, 黄放, 朱宏亮, 等. 枯草芽孢杆菌 ls-45发酵法制取玉米肽的研究[J]. 中国粮油学报, 2009, 24(12): 36-41.ZHANG Z, HUANG F, ZHU H L, et al. Production of corn peptide by fermentation with Bacillus subtilis ls-45[J]. Journal of the Chinese Cereal and oils Association, 2009, 24(12): 36-41.
[9]文超婷, 郑明珠, 修琳, 等. 羊肚菌生物转化玉米醇溶蛋白液体发酵工艺优化[J]. 中国粮油学报, 2016, 31(2): 103-108.WEN C T, ZHENG M Z, XIU L, et al. Optimization of liquid fermentation technology for zein bioconverted by Morchella Esculenta[J]. Journal of the Chinese Cereal and oils Association,2016, 31(2): 103-108.
[10]马佳, 李颖, 胡栋, 等. 芽胞杆菌生物防治作用机理与应用研究进展[J]. 中国生物防治学报, 2018, 34(4): 639-648.MA J, LI Y, HU D, et al. Progress on mechanism and applications of Bacillus as a biocontrol microbe[J]. Chinese Journal of Biological Control, 2018, 34(4): 639-648.
[11]程洪斌, 刘晓桥, 陈红漫. 枯草芽孢杆菌防治植物真菌病害研究进展[J]. 上海农业学报, 2006, 22(1): 109-112.CHENG H B, LIU X Q, CHEN H M. Research advance in controlling plant fungous diseases by Bacillus subtilis[J]. Acta Agriculturae Shanghai, 2006, 22(1): 109-112.
[12]JIANG X, CUI Z C, WANG L H, et al. Production of bioactive peptides from corn gluten meal by solid-state fermentation with Bacillus subtilis MTCC5480 and evaluation of its antioxidant capacity in vivo[J]. LWT-Food science and technology, 2020,doi: 10.1016/j.lwt.2020.109767.
[13]RABBEE M, ALI M, CHOI J, et al. Bacillus velezensis: A valuable member of bioactive molecules within plant microbiomes[J]. Molecules, 2019, 24, doi: 10.3390/molecules 24061046.
[14]沙月霞, 隋书婷, 曾庆超, 等. 贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力[J]. 中国农业科学, 2019, 52(11):1908-1917.SHA Y X, SUI S T, ZENG Q C, et al. Biocontrol potential of Bacillus velezensis strain E69 against rice blast and other fungal diseases[J]. Scientia Agricultura Sinica, 2019, 52(11): 1908-1917.
[15]刘韶娜, 张斌, 相德才, 等. 贝莱斯芽孢杆菌对猪生长性能,微生物群落和代谢产物的影响[J]. 动物营养学报, 2020,32(12): 139-152.LIU S N, ZHANG B, XIANG D C, et al. Effects of Bacillus velezensis on growth performance, fecal microbiota and metabolites in pigs[J]. Chinese Journal of Animal Nutrition,2020, 32(12): 139-152.
[16]向丽蓉, 刘博伦, 田云, 等. 微生物法水解玉米蛋白粉的工艺研究[J]. 湖南农业科学, 2019, (9): 71-74.XIANG L R, LIU B L, TIAN Y, et al. Study on the technology of hydrolyzing corn protein powder by microbial method[J]. Hunan Agricultural Sciences, 2019, (9): 71-74.
[17]魏炳栋, 苗国伟, 陈群, 等. 复合菌发酵玉米蛋白粉的条件优化[J]. 中国畜牧兽医, 2017, 44(10): 2944-2950.WEI B D, MIAO G W, CHEN Q, et al. Optimization of fermentation conditions for corn gluten meal by mixed strains[J].China Animal Husbandry&Veterinary Medicine, 2017, 44(10):2944-2950.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。