α-半乳糖苷酶(α-Gal, EC 3.2.1.22)广泛存在于植物、微生物和动物中,是能催化水解α-半乳糖苷键的酶类。由于豆类中含有无法被人类及其他单胃动物消化的半乳糖苷类低聚糖如水苏糖、棉子糖、蜜二糖和毛蕊花糖等[1-2],所以食用后会在体内经厌氧发酵形成肠胃胀气[3],导致豆制品的吸收率无法达到最大。α-半乳糖苷酶通过消除α-D-半乳糖,提高单胃动物的消化率,抑制肠胃气胀[4]。此外,α-半乳糖苷酶通过切断甘露聚糖主链上的半乳糖侧链来修饰天然半乳甘露聚糖,以改善其溶解度和凝胶性能[5]。在纸浆和造纸工业中,α-半乳糖苷酶与内切β-1,4-甘露聚糖酶一起用于增强软木牛皮纸浆的漂白效果[6]。α-半乳糖苷酶与环糊精一起使用,可用于递送一些重要的健康化合物[7]。还有一些 α-半乳糖苷酶可以清除B血型细胞表面糖蛋白上的α-半乳糖残留物,引起B→O血型转换[8]。
大型真菌中的 α-半乳糖苷酶因其来源安全、产量高而备受关注。食用菌成为富含α-半乳糖苷酶的食物来源具有很大的优势。鳞杯伞(Clitocybe squamulosa)隶属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes),伞菌目(Agaricales),未定科;鳞杯伞是野生台蘑中的营养价值极高的一种,其质地柔嫩、风味独特,并含有活性较高的α-半乳糖苷酶。但是该酶存在耐热性不好、成本较高等缺点,不能满足工业生产的要求,而固定化酶通常可以改善游离酶稳定性,使其可重复使用,减少生产成本[9-10]。然而不同的固定化载体和固定化方法均会影响酶的固定化效率,因此选择合适的固定化载体和固定化方法就显得尤为重要[11]。所以开发固定化鳞杯伞α-半乳糖苷酶用于工业化生产具有重要的意义[12]。
本文以海藻酸钠和壳聚糖作为固定化载体,比较了游离酶和两种固定化酶的理化特性;并且以大豆低聚糖为水解底物,研究了两种固定化酶的添加量、保存时间、操作稳定性对水解率的影响,筛选出较为适合鳞杯伞α-半乳糖苷酶的固定化载体,为提高其使用价值提供资料。
1 材料与方法
1.1 实验材料
鳞杯伞干子实体:山西农业大学食用菌中心;大豆:市售;海藻酸钠、壳聚糖(分析纯):上海阿拉丁生化科技有限公司;4-硝基苯基-α-D-半乳吡喃糖苷(pNPG)、二硝基水杨酸(DNS):北京索莱宝生物科技有限公司;氢氧化钠、冰乙酸、氯化钙、戊二醇(50%)、柠檬酸、磷酸氢二钠、甘氨酸、无水乙酸钠等均分析纯:天津市致远化学试剂有限公司。
1.2 仪器设备
KQ5200 DE数控超声波清洗机:昆山市超声仪器有限公司;Multifuge XIR高速冷冻心离心机:美国Thermo Fisher公司;ZQPW-250恒温振荡培养箱:天津市莱玻特瑞仪器设备有限公司;UV-2550紫外分光光度计:上海美普达仪器有限公司;DF-101S磁力搅拌器:北京中兴伟业仪器有限公司。
1.3 实验方法
1.3.1 鳞杯伞α-半乳糖苷酶游离酶的提取
在室温条件下,将鳞杯伞干子实体粉碎成粉末状。粉末和去离子水以1∶10(w/v)的比例均匀混合。为获得更高的提取率,将浸提物在4 ℃下浸泡保存过夜,然后在4 ℃下6 000 r/min离心15 min。取上清液分别加入20%、40%、60%、80%、100%的硫酸铵进行蛋白质盐析确定最佳硫酸铵添加量,4 ℃下静置过夜,然后在4 ℃下6 000 r/min离心15 min,取沉淀透析后作为游离酶。
1.3.2 固定化酶的制备
1.3.2.1 海藻酸钠固定化酶的制备 取 49.5 mL游离酶加入0.5 mL pH4.6 1 mol/L NaAc-HAc缓冲溶液,配制成0.01 mol/L pH4.6游离酶溶液,加入1.25 g海藻酸钠,混匀。用针管吸取滴入0.2 mol/L CaCl2溶液中,室温静置2 h。抽滤并用去离子水和缓冲液洗净,放置于缓冲溶液中4 ℃备用。
1.3.2.2 壳聚糖固定化酶的制备 称取1.0 g壳聚糖加入2%醋酸溶液中,60 ℃超声辅助水浴搅拌至壳聚糖完全溶解。用针管吸取滴入1 mol/L氢氧化钠溶液中,放置1 h,抽滤并用去离子水洗涤至中性,放入2%戊二醇中静置3 h进行交联,抽滤并用缓冲液洗净。
取49.5 mL游离酶加入0.5 mL pH4.6 1 mol/L NaAc-HAc缓冲溶液,配制成0.01 mol/L pH4.6游离酶溶液,称取10 g微球加入游离酶溶液中,放入摇床中10 ℃ 200 r/min 震荡16 h。抽滤并用缓冲液洗涤,放置于缓冲溶液中4 ℃备用。
1.3.3 酶活力的测定
α-半乳糖苷酶活性测定方法是按照胡玉静[13]描述的方法用pNPG法,稍作修改进行测定的。反应体系由 0.1 mL酶液或 0.1 g固定化酶和0.01 mol/L 0.1 mL pNPG(pH4.6)组成,反应温度40 ℃,反应时间10 min,加入0.5 mol/L Na2CO3 0.8 mL终止反应。在405 nm波长处测定溶液的吸光度。在分析条件下,每分钟释放 1 μmol/mL对硝基苯酚所需的酶量定义为α-半乳糖苷酶活性单位。重复检测3次。
1.3.4 固定化后剩余酶活
按照1.3.3的方法测定酶活,以游离酶活性定义为100%,计算固定化后的剩余酶活。
1.3.5 pH对酶活力的影响
最适pH的测定:将游离酶或固定化酶与0.1 mol/L不同pH的缓冲溶液(pH2.2、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)等体积混合,以去离子水配制的0.01 mol/L pNPG(pH7.0)为底物,按照1.3.3的方法测定酶活。定义酶活力最高值为100%,计算相对酶活力。缓冲液的选择为:柠檬酸-磷酸氢二钠缓冲溶液(pH2.2~8.0),甘氨酸-氢氧化钠缓冲液(pH9.0~10.0)。
pH稳定性的测定:将游离酶或固定化酶与0.1 mol/L不同pH的缓冲溶液等体积混合,常温下孵育2 h, 按照1.2.3的方法测定酶活。所有底物为 pH4.6 NaAc-HAc配制而成的 0.01 mol/L pNPG,目的为遮蔽掉缓冲溶液的pH造成的影响,使酶活测定条件统一。
1.3.6 温度对酶活力的影响
最适温度的测定:分别在 4、10、20、30、40、50、60、70、80 ℃条件下按照1.3.3的方法测定酶活。定义酶活力最高值为100%,计算相对酶活力。
温度稳定性的测定:将游离酶或固定化酶分别在以上温度下保温2 h后按照1.3.3的方法测定酶活。定义4 ℃酶活力为100%,计算相对酶活力。
1.3.7 保存时间对酶活力的影响
将游离酶和固定化酶置于 4 ℃和常温(约15~29 ℃)下保存,每隔三天按 1.3.3的方法测定酶活。定义第一天的酶活力为100%,计算相对活力。
1.3.8 豆浆的制备
将大豆洗净浸泡一晚,大豆和水按照 1∶10(w/v)的比例将大豆打浆过滤,4 000 r/min离心10 min,4 ℃保存备用。
1.3.9 酶添加量对豆浆中低聚糖水解率的影响
以 2.5、5、7.5、10、12.5 U/μL 固定化酶或游离酶进行实验,利用DNS法测定对豆浆中低聚糖水解的影响。酶和底物混合反应后,取0.1 mL混合物加入0.3 mL DNS溶液,沸水浴5 min加入0.8 mL去离子水,540 nm下测吸光度值[14]。
1.3.10 水解时间对豆浆中低聚糖的影响
以最佳酶添加量进行实验,分别在反应2、4、6、8、10、12 h后利用DNS法测定对豆浆中低聚糖水解的影响。
1.3.11 固定化酶的操作稳定性
以豆浆为底物,以最佳酶添加量以及反应时间进行实验,每次反应完成后,将固定化酶用去离子水冲洗干净,再次重复以上方法,共反应5次。
1.4 数据分析
所有数据均为 3个重复样品的平均值,采用Excel 2016软件对实验数据进行统计分析。
2 结果与分析
2.1 硫酸铵添加量对鳞杯伞 α-半乳糖苷酶游离酶提取率的影响
硫酸铵添加量对鳞杯伞 α-半乳糖苷酶游离酶提取率的影响如图1所示,当硫酸铵饱和度为20%时,鳞杯伞α-半乳糖苷酶提取率低于10%,随着硫酸铵饱和度的增大,鳞杯伞α-半乳糖苷酶的相对活性增加,当硫酸铵饱和度为80%时,酶的提取率达到最大。
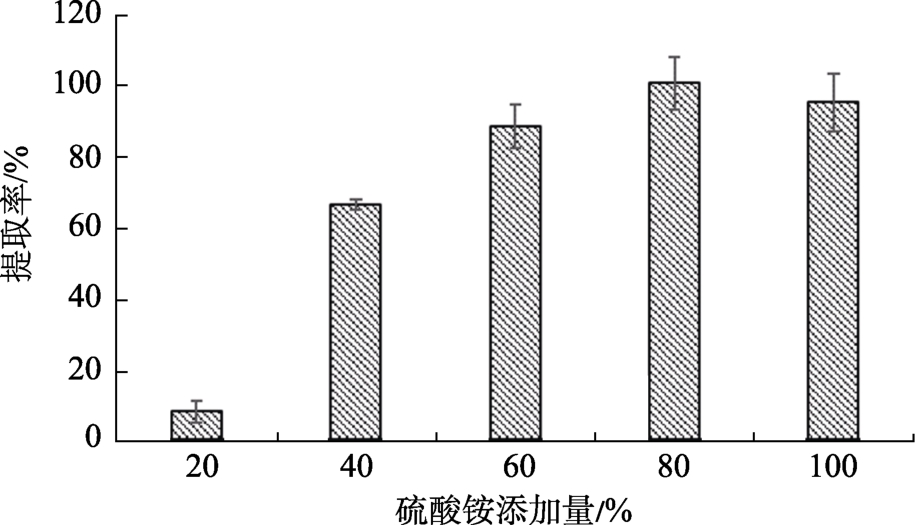
图1 硫酸铵添加量对鳞杯伞α-半乳糖苷酶游离酶提取率的影响
Fig.1 Effects of ammonium sulfate supplementation on extraction rate of α-galactosidase from Clitocybe squamulosa
α-半乳糖苷酶作为一种蛋白质,可以利用常规提取蛋白质的方法将其提取[13]。硫酸铵盐析是蛋白质提取的常用方法之一,鳞杯伞α-半乳糖苷酶在80%的饱和度下提取率最高。
2.2 不同固定化方法对鳞杯伞 α-半乳糖苷酶固定化效果的影响
不同固定化方法对鳞杯伞 α-半乳糖苷酶固定化效果的影响如表1所示,海藻酸钠固定化酶的固定化率和酶活力回收率分别为 80.27%和64.30%,壳聚糖固定化酶的固定化率和酶活力回收率分别为 74.99%和 58.34%,前者的固定化率和酶活力回收率均大于后者,但相差不大。
表1 不同固定化方法对鳞杯伞α-半乳糖苷酶固定化效果的影响
Table 1 Effect of different immobilization methods on the immobilization of α-galactosidase %
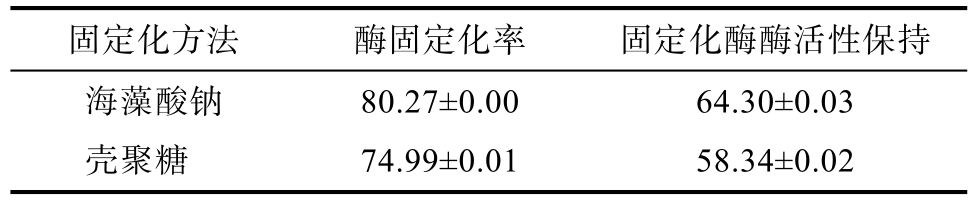
固定化方法 酶固定化率 固定化酶酶活性保持海藻酸钠 80.27±0.00 64.30±0.03壳聚糖 74.99±0.01 58.34±0.02
由于载体与酶分子之间的结合位点有限,因此在固定过程中会损失掉一部分酶分子[13]。两种固定化酶对鳞杯伞 α-半乳糖苷酶的回收率都在60%左右,高于其它报道的固定化酶回收率[16]。
2.3 pH对酶活力的影响
2.3.1 最适pH
pH对固定化酶活力的影响如图2所示,游离酶的最适pH是3.0,且pH2.2~5.0条件下酶活力在50%以上,但在pH7.0时已经检测不到酶活;海藻酸钠固定化酶的最适pH是5,与游离酶相比活性范围由pH7增加到了pH9.0,且在pH4.0~7.0条件下酶活力在50%以上;壳聚糖固定化酶的最适pH与游离酶一样,在pH3.0时催化性能最好,在pH9.0时仍有些许酶活。研究结果表明,经固定化后,酶对碱性条件的耐受力得到了提升,使其在碱性条件下也能发挥作用。
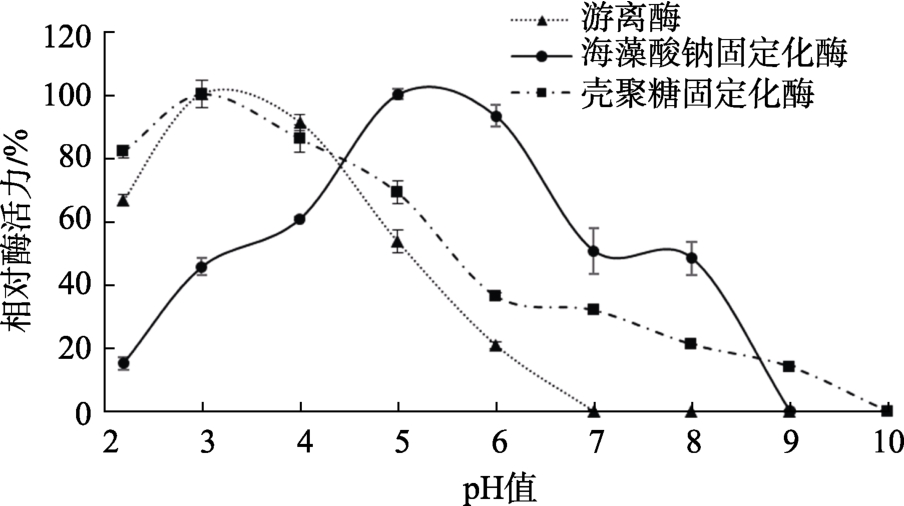
图2 pH对固定化酶活力的影响
Fig.2 Effect of pH on immobilized enzyme activity
2.3.2 pH稳定性
固定化酶的 pH稳定性如图3所示,游离酶在pH3.0时稳定性最好,且在酸性条件下酶活性比较稳定,在 pH2.2~6.0范围内酶活力可以达到80%以上;海藻酸钠固定化酶的 pH5.0时酶活力最高,与最适pH相同,且在pH3.0~7.0范围内酶活力在40%以上,但在pH4.0及以下条件下酶活力没有游离酶高;壳聚糖固定化酶的pH3.0时酶活力最高,活性范围最大,且在 pH2.2~8.0范围内酶活力在40%以上。在pH介于2.2~4.0时,壳聚糖固定化酶的稳定性要高于海藻酸钠固定化酶。研究结果表明,壳聚糖固定化拓宽了鳞杯伞α-半乳糖苷酶的pH稳定性。
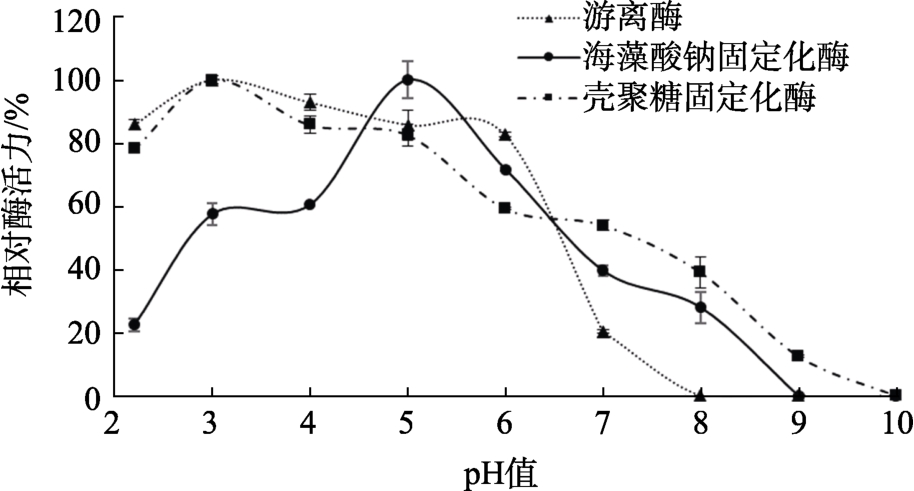
图3 固定化酶的pH稳定性
Fig.3 pH stability of immobilized enzyme
pH在酶促反应中是重要因素之一[17],对于任意一种酶都有其最适反应pH及稳定性,pH过高或过低可能会影响酶的空间结构或与底物的结合,从而影响酶的反应速率,因此只有在酶的最适条件下才能表现最大反应速率。游离酶的最适pH是 3.0,随着 pH的不断增大,游离酶和固定化酶的活性损失也在增加,但是无论是海藻酸钠固定化酶还是壳聚糖固定化酶,其最适 pH和稳定性范围和都比游离酶的范围大。这表明经过固定后,酶分子稳定性得到了提高[18]。这是由于酶在固定过程中与载体多位点结合[19],构象更加稳定,减弱了外部溶液变化对酶分子构象的影响。
2.4 温度对酶活力的影响
2.4.1 最适温度
温度对固定化酶活力的影响如图4所示,游离酶的最适温度为 50 ℃,60 ℃时未检测到活性,说明其已失活;海藻酸钠固定化酶的最适温度与游离酶相同,也是50 ℃,在60 ℃时比游离酶活性高20%左右,70 ℃时失活;壳聚糖固定化酶的最适温度为60 ℃,在60 ℃时比海藻酸钠固定化酶和活性游离酶都高,70 ℃时失活。研究结果表明,海藻酸钠固定化酶比壳聚糖固定化更易达到最适温度。
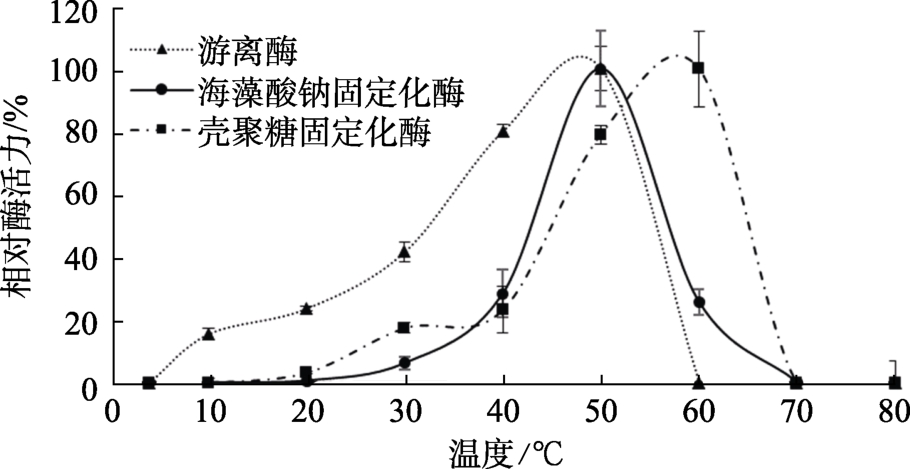
图4 温度对固定化酶活力的影响
Fig.4 Effect of temperature on immobilized enzyme activity
2.4.2 温度稳定性
固定化酶的温度稳定性如图5所示,游离酶在 20 ℃以下比较稳定,在 30 ℃时相对活性为65.8%,但在40 ℃时已检测不到活性,海藻酸钠固定化酶和壳聚糖固定化酶都是在 40 ℃下比较稳定,海藻酸钠固定化酶在 50 ℃时失活,壳聚糖固定化酶在50 ℃下仍能保持40%以上的活性,在 60 ℃时失活。研究表明两种固定化酶的温度稳定性要优于游离酶,且相比于海藻酸钠固定化酶,壳聚糖固定化酶稳定性更好。
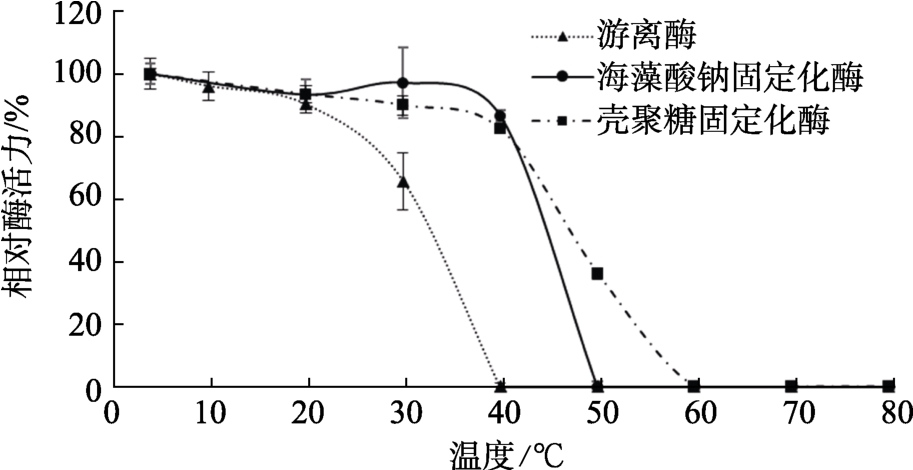
图5 固定化酶的温度稳定性
Fig.5 Temperature stability of immobilized enzyme
温度对酶的催化作用有很大的影响[20],酶的化学本质是蛋白质,温度过高会使酶的蛋白结构发生变化,导致酶变性;过低会抑制酶的活性。游离酶的最适温度为50 ℃,这与 S. J. Prashanth[21]等的报道一致,许多从真菌中提纯的α-半乳糖苷酶热稳定性都较差[22-24]。鳞杯伞α-半乳糖苷酶也和它们一样,表现出较差的热稳定性。但两种固定方法都使酶的温度稳定性范围有所扩大,符合更多工业化应用的需求。当温度大于 50 ℃时,酶活力损失较大,可能是因为长时间温度过高使酶变性,也可能是由于固定化后的扩散限制[25]导致的。
2.5 保存时间对酶活力的影响
保存时间对酶活力的影响如图6A~B所示,在4 ℃下游离酶保存15 d后相对酶活力降到60%左右;海藻酸钠固定化酶15 d后相对活力最高,可以保持在90%以上;壳聚糖固定化酶15 d后相对活力稍差,但仍保持在80%以上。在常温下游离酶保存15 d后相对酶活力降到40%以下;海藻酸钠固定化酶常温下15 d后仍可以保持在75%以上;壳聚糖固定化酶15 d后相对活力保持在70%以上。研究结果表明,固定化酶可以有效地减少酶的损失,延长鳞杯伞 α-半乳糖苷酶的保存时间。
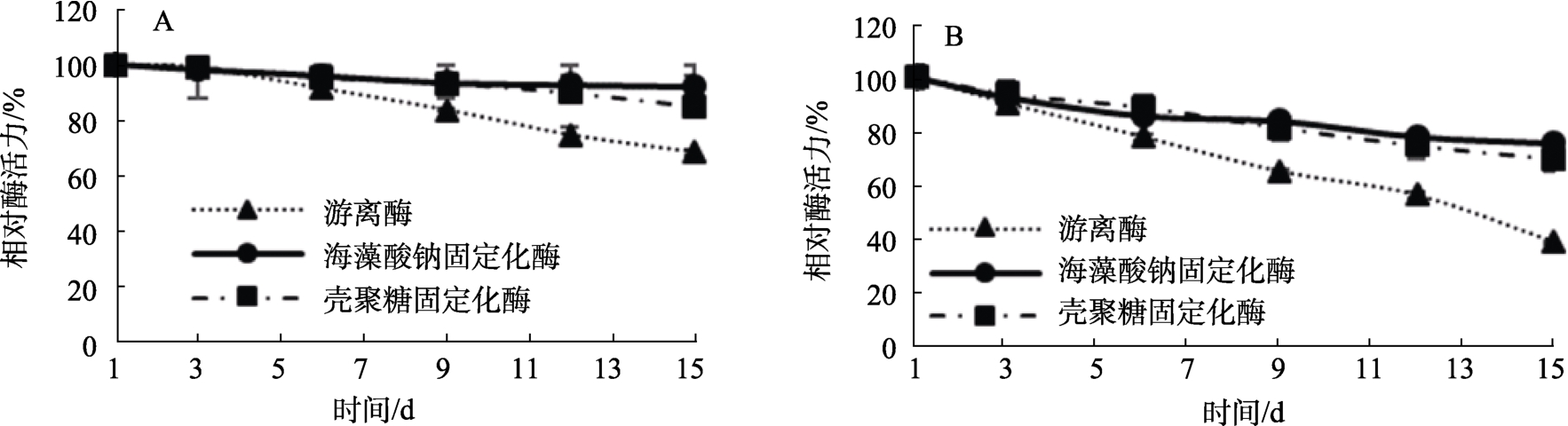
图6 保存时间对酶活力的影响
Fig.6 Effect of storage time on enzyme activity
A:4 ℃保存对酶活力的影响;B:常温保存对酶活力的影响
A: Effect of 4 ℃ storage on enzyme activity. B: Effect of storage at room temperature on enzyme activity
酶制剂中的酶活会随着保存时间的延长而逐渐损失。在常温下保存的酶无论是游离酶还是固定化酶,酶活损失都比4 ℃下严重,但固定化后的酶活性明显比游离酶损失的少,说明两种固定方法均可以减少酶的流失,延长鳞杯伞α-半乳糖苷酶的保存时间。
2.6 酶添加量对豆浆中低聚糖水解的影响
酶添加量对豆浆中低聚糖水解的影响如图7所示,随着游离酶浓度的增加,大豆低聚糖的水解率提高,当游离酶添加量到2.5 U/μL后,继续添加游离酶对大豆低聚糖的水解率不再有影响,说明7.5 U/μL已经达到了游离酶的足够量;当海藻酸钠固定化酶的添加量为2.5 U/μL时,大豆低聚糖的水解率可以达到85%,增加到5 U/μL后可以达到95%以上,7.5 U/μL时大豆低聚糖水解率达到最大,继续添加海藻酸钠固定化酶大豆低聚糖水解率不再增加;当壳聚糖固定化酶的添加量为 2.5 U/μL时,大豆低聚糖的水解率已经达到98.17%±0.03%,继续增加壳聚糖固定化酶的添加量对大豆低聚糖的水解率影响不大。研究结果表明,相同添加量时固定化酶对豆浆中低聚糖水解效果优于游离酶,添加量为2.5 U/μL时,海藻酸钠固定化酶更优一些。
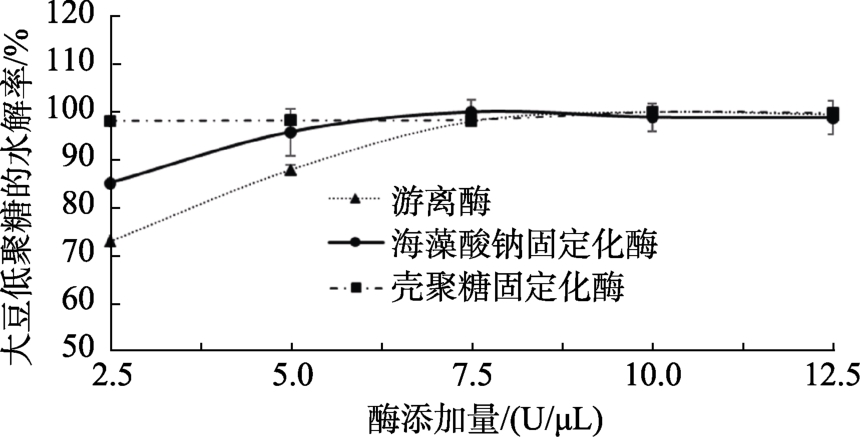
图7 酶添加量对豆浆中低聚糖水解的影响
Fig.7 Effect of enzyme dosage on hydrolysis of oligosaccharides in soybean milk
酶浓度和底物浓度对酶促反应也有很大的影响[26],随着游离酶添加量增多,大豆低聚糖水解率增大,当到达7.5 U/μL时,再添加游离酶水解率也没有升高,说明7.5 U/μL已到达足够的游离酶用量;可能是由于酶固定化后将游离酶富集,使单位体积下的酶浓度比游离酶高,增加了酶与底物的结合概率,所以当固定化酶的添加量加大时,大豆低聚糖的水解率并不像游离酶那样有明显的增大。
2.7 水解时间对豆浆中低聚糖的影响
水解时间对豆浆中低聚糖的影响如图8所示,在 2 h时游离酶降解低聚糖的水解率为 56.77%±0.88%,4~6 h内水解率上升速度较快,6 h时水解率达到最大;海藻酸钠固定化酶在2 h时水解率就达到了98.93%±0.02%,4 h时达到最大值;壳聚糖固定化酶在2 h时水解率为83.33%±0.36%,4 h时达到最大值。研究结果表明,固定化酶催化反应所需时间少于游离酶。
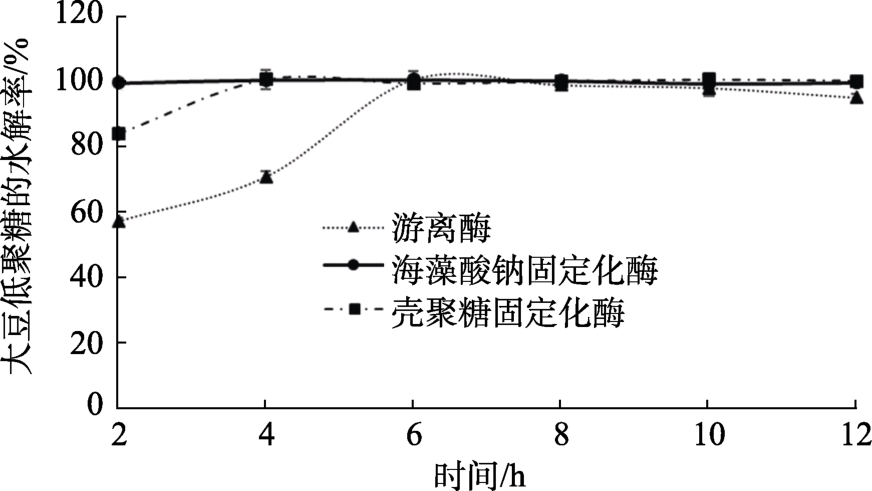
图8 水解时间对豆浆中低聚糖的影响
Fig.8 Effect of hydrolysis time on oligosaccharides in soybean milk
在酶促反应中,反应时间的延长可以使酶与更多的底物结合,使酶促反应更加彻底。两种固定方法使鳞杯伞α-半乳糖苷酶在2 h时对低聚糖的水解率达到80%以上,比游离酶所需催化时间少,可能由于相同时间内固定化后的鳞杯伞α-半乳糖苷酶与底物结合概率更大,催化反应快速地发生。
2.8 固定化酶的操作稳定性
固定化酶的操作稳定性如图9所示,以豆浆为底物时,海藻酸钠固定化酶在重复两次后的低聚糖水解率为97.51%±0.85%,重复三次后水解率为84.83%±0.16%,重复第五次时低聚糖水解率降为29.27%±1.41%;壳聚糖固定化酶在重复两次后的活性为98.38%±0.38%,重复第五次时低聚糖水解率仍在60%以上。研究结果表明,壳聚糖固定化酶的操作稳定性优于海藻酸钠固定化酶,说明这种固定方法使壳聚糖与鳞杯伞α-半乳糖苷酶的结合更加牢固。
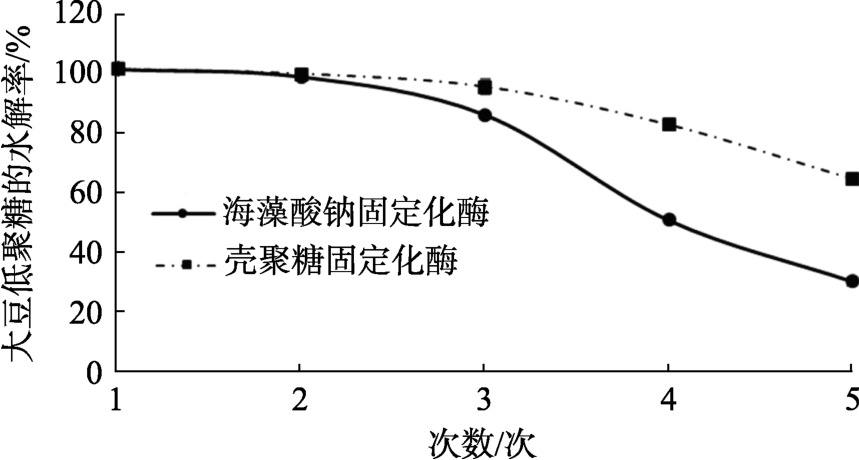
图9 固定化酶的操作稳定性
Fig.9 Operational stability of immobilized enzyme
游离酶与底物反应后不能重复利用,而固定化酶能够取出重复利用,可以节省成本。海藻酸钠固定化酶重复4次时低聚糖水解率接近50%,壳聚糖固定化酶在重复5次后,水解率在60%以上。可能由于海藻酸钠固定化酶多次重复后,包埋不牢固,保护作用变差,而壳聚糖经过戊二醇的交联反应,与鳞杯伞α-半乳糖苷酶的结合更加牢固,酶活损失比海藻酸钠少。但与其它固定化酶相比[27],固定化鳞杯伞α-半乳糖苷酶的操作稳定性较差,还需进一步研究。
3 结论
本实验以鳞杯伞为原料提取α-半乳糖苷酶,确定了最佳硫酸铵饱和度为80%,并以两种固定化方式对其进行固定,海藻酸钠固定化率和固定化酶酶活性保持率均优于壳聚糖。两种固定化酶的温度稳定性要优于游离酶,且相比于海藻酸钠固定化酶,壳聚糖固定化酶稳定性更好;4 ℃和常温下保存15 d后海藻酸钠固定化酶相对酶活最高,约提高30%;水解4.0 h时的两种固定化酶大豆低聚糖水解率均达到100%;添加量为2.5 U/μL时,壳聚糖固定化酶大豆低聚糖的水解率最高;重复使用3次后,壳聚糖固定化酶大豆低聚糖的水解率高于海藻酸钠固定化酶。与游离酶相比,固定化酶能够有效改善鳞杯伞α-半乳糖苷酶的稳定性,缩短水解时间,并且能够重复使用,且相比于海藻酸钠,壳聚糖更适宜作为鳞杯伞α-半乳糖苷酶的固定化载体,为鳞杯伞α-半乳糖苷酶工业化应用提供思路。
[1]KOTIGUDA G, KAPNOOR S S, KULKARNI D, et al.Degradation of raffinose oligosaccharides in soymilk by immobilized alpha-galactosidase of Aspergillus oryzae[J]. Journal of Microbiology & Biotechnology, 2007, 17(9): 1430-1436.
[2]LESKE K L, JEVNE C J, COON C N. Effect of oligosaccharide additions on nitrogen-corrected true metabolizable energy of soy protein concentrate-sciencedirect[J]. Poultry Science, 1993,72(4): 664-668.
[3]杜芳. 鸡枞菌和云芝中 α-半乳糖苷酶的研究[D]. 中国农业大学, 2014.DU F. The study on α-galactosidase from Termitomyces albuminosus and Trametes versicolor[D]. China Agricultural University, 2014.
[4]HU Y J, TIAN G T, GENG X R, et al. A protease-resistant α-galactosidase from Pleurotus citrinopileatus with broad substrate specificity and good hydrolytic activity on raffinose family oligosaccharides[J]. Process Biochemistry, 2016, 51(4):491-499.
[5]PUCHART V, VRSANSKA M, BHAT M K, et al. Purification and characterization of α-galactosidase from a thermophilic fungus Thermomyces lanuginosus[J]. Biochimica Et Biophysica Acta General Subjects, 2000, 1524(1): 27-37.
[6]LI S, LI T, KIM W D, et al. Characterization of raffinose synthase from rice (Oryza sativa L. var. Nipponbare) [J].Biotechnology Letters, 2007, 29(4): 635-640.
[7]DI Y, ZHU Z Z, CAI H Y, et al. Inhibition of cyclodextrins on α-galactosidase[J]. Food Chemistry, 2017, 217: 59-64.
[8]TSUBOI K. Enzyme replacement therapy in patients with Fabry’s disease[J]. Journal of International Medical Research,2007, 35(4): 574-581.
[9]罗贵民. 酶工程[M]. 北京: 化学工业出版社, 2003, 251-253.LUO G M. Enzyme engineering [M]. Beijing: Chemical Industry Press, 2003, 251-253.
[10]王君虹, 陈新峰, 周利亘. 乳酪蛋白肽的固定化酶法制备工艺研究[J]. 保鲜与加工, 2008(4): 41-44.WANG J H, CHEN X F, ZHOU L G. Preparation of casein peptide by immobilized enzyme [J]. Preservation and Processing,2008(4): 41-44.
[11]ZHOU L Y, JIANG Y J, GAO J, et al. Oriented immobilization of glucose oxidase on graphene oxide[J]. Biochemical Engineering Journal, 2012, 69: 28-31.
[12]邓春, 易弋, 李平, 等. α-半乳糖苷酶的研究进展[J]. 食品工业, 2016, 37(2): 255-260.DENG C, YI Y, LI P, et al. Research progress of α-galactosidase[J].Food Industry, 2016, 37(2): 255-260.
[13]胡玉净. 榆黄蘑、红平菇和双孢菇子实体中 α-半乳糖苷酶理化性质的研究[D]. 中国农业大学, 2016.HU Y J. The physicochemical properties of α-galactosidase from Pleurotus citrinopileatus, Pleurotus djamor and Agaricus bisporus[D]. China Agricultural University, 2016.
[14]GENG X R, YANG D X, ZHANG Q Y, et al. Good hydrolysis activity on raffinose family oligosaccharides by a novel α-galactosidase from Tremella aurantialba[J]. International Journal of Biological Macromolecules, 2020, 150: 1249-1257.
[15]雷生姣, 潘思轶. 交联海藻酸钠固定化柚(皮)苷酶[J]. 食品工业科技, 2014, 35(1): 232-236.LEI S J, PAN S Y. Immobilized naringinase by crosslinked sodium alginate[J]. Science and Technology of Food Industry,2014, 35(1): 232-236.
[16]KUBITZKI T, NOLL T, LUETZ S. Immobilisation of bovine enterokinase and application of the immobilised enzyme in fusion protein cleavage[J]. Bioprocess & Biosystems Engineering,2008, 31(3): 173-182.
[17]孙科, 李根亮, 李朝敢, 等. 关于温度、pH对酶促反应速度影响的实验方法改进[J]. 临床医学研究与实践, 2021, 6(18): 13-15.SUN K, LI G L, LI C G, et al. Effects of temperature and pH on enzymatic reaction rate [J]. Clinical Medical Research &Practice, 2021, 6(18): 13-15.
[18]JOCHEMS P, SATYAWALI Y, ROY S V, et al. Characterization and optimization of β-galactosidase immobilization process on a mixed-matrix membrane[J]. Enzyme & Microbial Technology,2011, 49(6-7): 580-588.
[19]SONG Y S, LEE J H, KANG S W, et al. Performance of β-galactosidase pretreated with lactose to prevent activity loss during the enzyme immobilisation process[J]. Food Chemistry,2010, 123(1): 1-5.
[20]吴文婵. “影响酶促反应速度的因素”教学设计与反思[J]. 广东职业技术教育与研究, 2019(1): 82-84.WU W C. Teaching design and reflection of “factors affecting enzymatic reaction speed”[J]. Guangdong Vocational and Technical Education and Research, 2019(1): 82-84.
[21]PRASHANTH S J, MULIMANI V H. Soymilk oligosaccharide hydrolysis by Aspergillus oryzae α-galactosidase immobilized in calcium alginate[J]. Process Biochemistry, 2005, 40(3-4):1199-1205.
[22]陈俊亮, 田芬, 霍贵成, 等. 长双歧杆菌α-半乳糖苷酶的分离纯化及酶学性质[J]. 食品科学, 2014, 35(7): 118-122.CHEN J L, TIAN F, HUO G C, et al. Isolation, purification and enzymatic properties of α-galactosidase from bifidobacterium longum[J]. Food Science, 2014, 35(7): 118-122.
[23]GENG X R, TIAN G T, ZHAO Y C, et al. A fungal α-galactosidase from Tricholoma matsutake with broad substrate specificity and good hydrolytic activity on raffinose family oligosaccharides[J]. Molecules, 2015, 20(8): 13550-62.
[24]HU Y J, ZHU M J, TIAN G T, et al. Isolation of a protease-resistant and pH-stable α-galactosidase displaying hydrolytic efficacy toward raffinose family oligosaccharides from the button mushroom Agaricus bisporus[J]. International Journal of Biological Macromolecules, 2017, 104: 576-583.
[25]ABDEL-NABY M A, SHERIF A A, AB El-TANASH, et al.Immobilization of Aspergillus oryzae tannase and properties of the immobilized enzyme[J]. Journal of Applied Microbiology,2010, 87(1): 108-114.
[26]陈加敏. 酶浓度和底物浓度对酶活性影响因素的教学探讨[J].生物学教学, 2020, 45(9): 78-80.CHEN J M. Study on the influencing factors of enzyme concentration and substrate concentration on enzyme activity in teaching[J]. Biology Teaching, 2020, 45(9): 78-80.
[27]解婉莹, 董墨思, 李苏红. α-半乳糖苷酶固定化的研究进展[J].粮油食品科技, 2016, 24(3): 92-97.XIE W Y, DONG M S, LI S H. Research progress of αgalactosidase immobilization[J]. Science and Technology of Cereals, Oils and Foods, 2016, 24(3): 92-97.