营养物质是一切生命的物质基础,营养支持对于临床治疗具有重要意义,能够帮助患者改善营养状态、纠正代谢失衡[1]、减少感染等并发症[2-4]、促进康复,同时能够缩短住院时间、降低再住院率[5]和死亡风险[6],从而减少医疗费用等[7-8]。特殊医学用途配方食品(Food for Special Medical Purpose,简称 FSMP)是临床病人营养支持的重要工具之一[9],它是为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品,必须在医生或临床营养师的指导下单独食用或与普通食品及其它特殊膳食食品共同使用,包括全营养配方食品、特定全营养配方食品和非全营养配方食品三大类,非全营养配方食品主要有脂肪、蛋白质及碳水化合物等营养素组件以及电解质、流质配方等[10]。目前市售特医脂肪组件产品以红花油、菜籽油等为原料制备,在脂肪酸均衡组成方面还有待进一步优化。
中链甘油三酯(Medium chain triglycerides,MCTs)是指含8~12个碳原子的中链脂肪[11],天然存在于棕榈仁油、椰子油等食物和母乳中[12],是膳食脂肪的来源之一,与长链脂肪酸甘油酯相比,MCTs分子量小,水解速度快,更易被人体消化、吸收和代谢[13]。棕榈仁油(Palm kernel oil,PKO),由棕榈仁经压榨提炼而成,富含中碳链月桂酸和肉豆蔻酸,其中月桂脂肪酸(C12∶0)占棕榈仁油脂肪酸组成的44%[14],是中链甘油三酯的天然食物来源,化学性质稳定,不易发生过氧化反应。目前有关棕榈仁油在特医食品中的应用研究较少,因此,具有一定的研究意义及开发潜力。
目前,FSMP产品形态以粉剂和液体为主,粉剂产品约占 40.4%,液体产品约占 49.6%[15]。液体FSMP产品使用前无需进行复水操作,较粉剂使用更方便,是FSMP的常用剂型[16]。本文参照《特殊医学用途配方食品通则》、FSMP研发要求以及特医乳液产品质量标准等相关要求[17],开发基于棕榈仁油的特医脂肪乳液产品,进行稳定性评价,并通过动物试验评价其对血清血脂的影响。
1 材料与方法
1.1 试验材料
棕榈仁油、红花籽油、亚麻籽油、葵花籽油、低芥酸菜籽油:市售;中链甘油三酯(MCTs oil)(药品级)、总胆固醇(TC)检测试剂盒:上海源叶生物科技有限公司;大豆卵磷脂、黄原胶(药品级):国药试剂(上海)有限公司;Microlipid脂肪乳液:美国雀巢公司;脂肪酸甲酯标准品:上海安谱实验科技股份有限公司;甘油三酯(TG)测定试剂盒:南京建成生物工程研究所;小鼠低密度脂蛋白(LDL)ELISA试剂盒、小鼠高密度脂蛋白(HDL)ELISA试剂盒:上海酶联生物科技有限公司。
健康SPF级昆明小鼠(26±2)g 40只,雄性:北京维通利华实验动物技术有限公司;动物维持饲料及低脂饲料:江苏省协同医药生物工程有限责任公司,饲料生产许可证:苏饲证2019(01008)。
1.2 仪器与设备
FE28 pH计、HE53/02 卤素水分测定仪、AB135-S电子分析天平:梅特勒-托利多仪器(上海)有限公司;NanoZS90马尔文纳米粒度分析仪:英国马尔文公司;Multiskan Spextrum酶标仪、Multifuge XR 1高速冷冻离心机:赛默飞世尔科技(中国)有限公司;Eurostar 40 digital 数显型悬臂搅拌器、T18高速匀浆机:德国IKA公司;高压均质机:上海申鹿均质机有限公司;DV1粘度计:美国博勒飞公司;Agilent 7890B气相色谱仪系统:安捷伦(美国)有限公司;Direct-Pure Genie10纯水仪:上海乐枫生物科技有限公司。
1.3 试验方法
1.3.1 油相的制备
按照设计配方比例将棕榈仁油、红花籽油、亚麻籽油、葵花籽油、低芥酸菜籽油等各种植物油与MCTs oil混合均匀作为油相。
1.3.2 特医脂肪乳液制备工艺
由于卵磷脂分散在油相中的乳化效果优于其分散于水相中的乳化效果[18],因此将大豆卵磷脂按比例添加至油相中,先用悬臂搅拌器在2 000 r/min条件下搅拌1 min中,让乳化剂充分溶解在油相中,继而逐渐加入水相进行乳化,最后将溶解在少量水中的黄原胶稳定剂添加至乳化体系中,充分混匀后置于高速匀浆机中在一定乳化速度、乳化温度、乳化时间条件下进一步乳化得到初乳液。
初乳液经高压均质机在一定压力下均质数次,灌装后再经高压灭菌得到特医脂肪乳液样品,进行相关指标检测及稳定性实验。
1.3.3 乳化工艺条件优化
1.3.3.1 乳化速度 设置高速匀浆机乳化温度30 ℃、乳化时间30 min,分别在乳化速度6 000、8 000、10 000、12 000及14 000 r/min的条件下进行乳化,考察不同乳化速度对脂肪乳液Zeta电位的影响。
1.3.3.2 乳化时间 设置高速匀浆机乳化速度10 000 r/min、乳化温度30 ℃,分别在乳化时间10、20、30、40及50 min的条件下对进行乳化,考察不同乳化时间对脂肪乳液Zeta电位的影响。
1.3.3.3 乳化温度 设置高速匀浆机乳化速度10 000 r/min、乳化时间30 min,分别在乳化温度20、30、40、50、60及70 ℃的条件下进行乳化,考察不同乳化温度对脂肪乳液Zeta电位的影响。
1.3.3.4 乳化工艺正交试验 在单因素试验结果的基础上进行正交试验,优化乳化工艺条件,正交因素水平表设计如表1所示。
表1 正交试验因素水平表
Table 1 Factors and coding level of experimental design
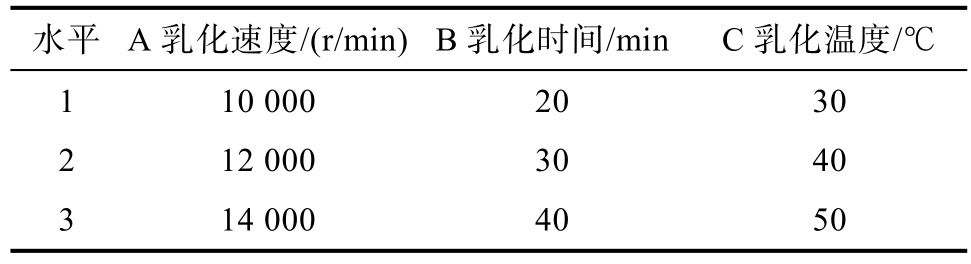
水平 A乳化速度/(r/min)B乳化时间/min C乳化温度/℃1 10 000 20 30 2 12 000 30 40 3 14 000 40 50
1.3.4 高压均质条件确定
参考相关文献[19-20],使用高压均质机分别在25 MPa和50 MPa条件下对前期乳化后的初乳液均质数次,根据测定的粒径指标确定该特医脂肪乳液的高压均质条件。
1.3.5 高压灭菌条件确定
参考相关文献[16-18],采用高压灭菌方式对特医脂肪乳液进行灭菌处理,考察温度在121 ℃,时间分别为5、10、15、20 min条件下的灭菌效果。
1.3.6 稳定性试验
按照优化工艺条件制备特医脂肪乳液样品,分别在温度(4.0±2.0) ℃、(25.0±2.0) ℃、(40.0±2.0) ℃,湿度 RH 均为 60%±10%条件下放置一定时间后,考察产品的稳定性[21]。
1.3.7 脂肪酸组成的测定
采用GB5009.168—2016 对油相及特医脂肪乳液样品进行脂肪酸组成分析[22]。
1.3.8 粒径测定
采用马尔文纳米粒度分析仪对脂肪乳液样品进行粒径测定,用去离子水作为分散介质将样品稀释100倍,混匀后取样进行测定[23],每个样品平行测定3次。
1.3.9 Zeta电位测定
将脂肪乳液用去离子水稀释100倍,采用马尔文纳米粒度分析仪测定乳液Zeta电位[24],每个样品测定重复3次。
1.3.10 动物试验设计
选用8周龄SPF级雄性昆明小鼠40只,适应性喂养7 d后,标记并称重,随机分为五组,每组8只,依据中国营养学会发布的《中国居民膳食指南》(2016),成人油脂推荐摄入量为25~30 g/d,同时参考中国居民实际油脂摄入量42 g/d[25],运用营养代谢换算公式换算成小鼠的每日脂肪摄入量,设置低剂量组、中剂量组、高剂量组及商业样品(Microlipid 脂肪乳液)对照组,同时设置空白对照组(普通维持饲料),如表2所示。试验喂养30 d后称重,眼球取血,采用试剂盒法进行血清总甘油三酯(TG)、总胆固醇(TC)以及低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)指标的测定。
表2 实验动物每日脂肪摄入量及与成人每日脂肪摄入量对照
Table 2 The daily fat intake of experimental animals compared with that of adults
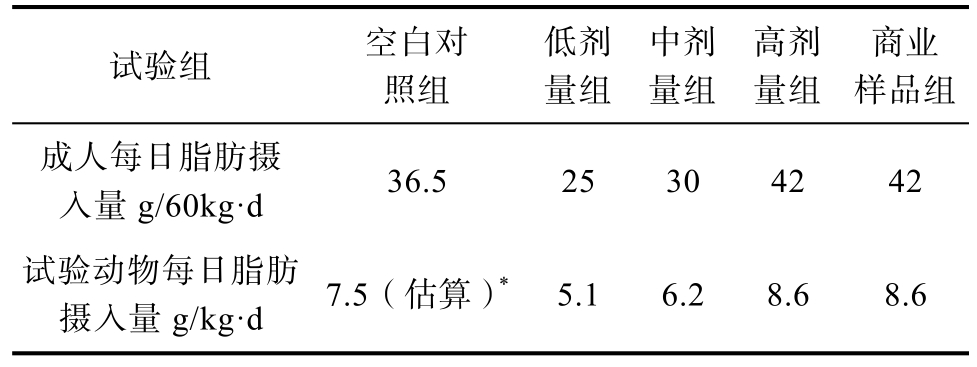
*估算依据:普通维持饲料脂肪含量为 5%,空白对照组小鼠日均摄食量约为6.2 g。
* Basis for estimation: The fat content of normal maintenance diet was 5%, and the average daily intake of mice in blank control group was about 6.2 g.
试验组 空白对照组低剂量组中剂量组高剂量组商业样品组成人每日脂肪摄入量 g/60kg·d 36.5 25 30 42 42试验动物每日脂肪摄入量 g/kg·d 7.5(估算)* 5.1 6.2 8.6 8.6
1.4 数据分析
采用Excel 2010和GraphPad Prism 8.0软件进行数据统计分析,所有试验数据均采用平均值±标准偏差(SD)表示。
2 结果与分析
2.1 油相脂肪酸组成
以《特殊医学用途配方食品通则》《中国居民膳食营养素参考摄入量》及相关医学、营养学的研究结果为依据进行脂肪酸均衡型棕榈仁油基脂肪乳液(PKO based fat emulsion for special medical purposes PKO-FESMP)产品配方设计。《中国居民膳食营养素参考摄入量》中建议[26],居民每日膳食脂肪酸摄入推荐比例饱和脂肪酸(SFA)∶单不饱和脂肪酸(MUFA)∶多不饱和脂肪酸(PUFA)=1∶1∶1,PUFA 中,C18∶2(n-6)与C18∶3(n-3)的比值为(4~6)∶1。
特殊医学用途配方食品的脂肪来源通常为混合精炼植物油,本文选择棕榈仁油、红花籽油、亚麻籽油、葵花籽油、低芥酸菜籽油等各种精炼植物油以及MCTs oil,测定各原料脂肪酸组成,进行油相配方比例的设计,并通过测定油相脂肪酸组成进行验证,结果如表3所示。
表3 棕榈仁油基脂肪乳液油相脂肪酸组成
Table 3 Fatty acid composition in formulated PKO-FSMP samples
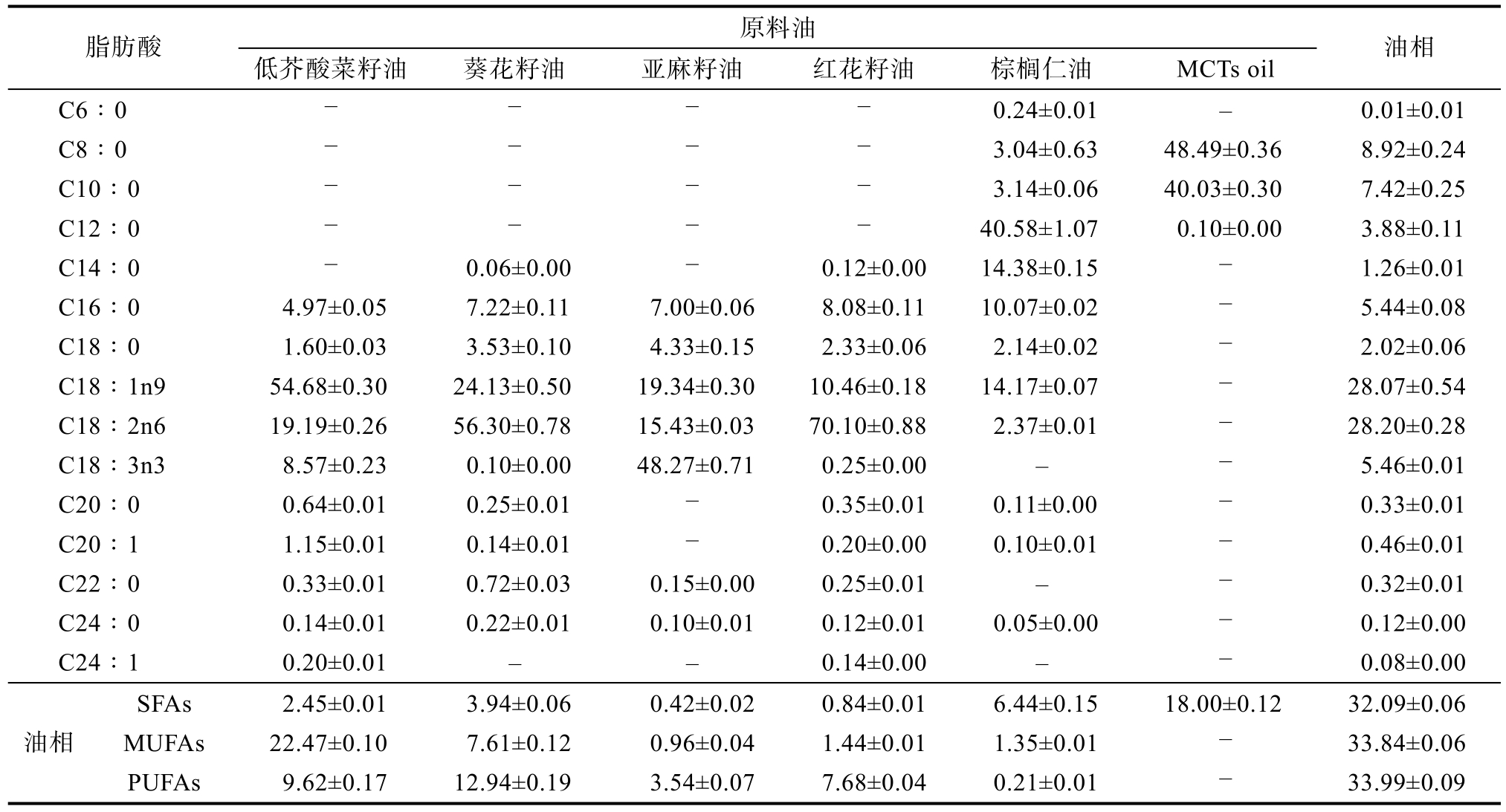
注:- 表示低于检测限,未检出。
Note: - means below the detection limit, not detected.
原料油脂肪酸 低芥酸菜籽油 葵花籽油 亚麻籽油 红花籽油 棕榈仁油 MCTs oil 油相C6∶0 - - - - 0.24±0.01 - 0.01±0.01 C8∶0 - - - - 3.04±0.63 48.49±0.36 8.92±0.24 C10∶0 - - - - 3.14±0.06 40.03±0.30 7.42±0.25 C12∶0 - - - - 40.58±1.07 0.10±0.00 3.88±0.11 C14∶0 - 0.06±0.00 - 0.12±0.00 14.38±0.15 - 1.26±0.01 C16∶0 4.97±0.05 7.22±0.11 7.00±0.06 8.08±0.11 10.07±0.02 - 5.44±0.08 C18∶0 1.60±0.03 3.53±0.10 4.33±0.15 2.33±0.06 2.14±0.02 - 2.02±0.06 C18∶1n9 54.68±0.30 24.13±0.50 19.34±0.30 10.46±0.18 14.17±0.07 - 28.07±0.54 C18∶2n6 19.19±0.26 56.30±0.78 15.43±0.03 70.10±0.88 2.37±0.01 - 28.20±0.28 C18∶3n3 8.57±0.23 0.10±0.00 48.27±0.71 0.25±0.00 - - 5.46±0.01 C20∶0 0.64±0.01 0.25±0.01 - 0.35±0.01 0.11±0.00 - 0.33±0.01 C20∶1 1.15±0.01 0.14±0.01 - 0.20±0.00 0.10±0.01 - 0.46±0.01 C22∶0 0.33±0.01 0.72±0.03 0.15±0.00 0.25±0.01 - - 0.32±0.01 C24∶0 0.14±0.01 0.22±0.01 0.10±0.01 0.12±0.01 0.05±0.00 - 0.12±0.00 C24∶1 0.20±0.01 - - 0.14±0.00 - - 0.08±0.00 SFAs 2.45±0.01 3.94±0.06 0.42±0.02 0.84±0.01 6.44±0.15 18.00±0.12 32.09±0.06 MUFAs 22.47±0.10 7.61±0.12 0.96±0.04 1.44±0.01 1.35±0.01 - 33.84±0.06油相PUFAs 9.62±0.17 12.94±0.19 3.54±0.07 7.68±0.04 0.21±0.01 - 33.99±0.09
试验结果表明,该配方中油相SFA、MUFA、PUFA占比分别为32.09%±0.06%,33.84%±0.06%,33.99±0.09%,PUFA中 n-6与 n-3的比值约为5.16%±0.05,符合上述营养素参考摄入量推荐要求。
2.2 乳化工艺优化
特医脂肪乳液通常为水包油型乳状液[27],乳化工艺是油脂乳状液加工的关键技术。Zeta电位值的大小表示体系中相邻带电粒子之间的静电斥力,从而抵抗粒子间相互吸引发生聚集,静电稳定机制和空间位阻共同作用防止乳液体系中乳滴合并,因此是评价乳液稳定性的关键指标[28]。通常认为Zeta电位绝对值越高乳液越稳定,研究表明乳液的净电位值大于 30 mV(即Zeta电位> ±30 mV)时能够提供足够的静电斥力防止乳滴絮凝[29],具有较好的物理稳定性[30]。本试验以为高速匀浆机为乳化设备,纳米粒度分析仪为检测仪器,研究了乳化速率、乳化时间、乳化温度等条件对乳化过程中Zeta电位值的影响,在单因素试验基础上开展正交试验优化乳化工艺。
2.2.1 乳化速度对Zeta电位绝对值的影响
乳化速度对Zeta电位绝对值的影响如图1所示,乳化速度从6 000 r/min增加到10 000 r/min, Zeta电位绝对值明显增加。当乳化速度达到12 000 r/min时,Zeta电位绝对值达到最大值(35.50±1.77)mV,乳化速度继续增大,Zeta电位绝对值略有下降。乳化速度为6 000 r/min和8 000 r/min时形成的Zeta电位绝对值均低于30 mV,表明脂肪乳粒径较大,且乳化不均匀。乳化速度达到10 000 r/min以上时,Zeta电位绝对值均大于30 mV,表明乳化体系均匀、稳定性好,因此,确定乳化速度范围为 10 000~14 000 r/min。
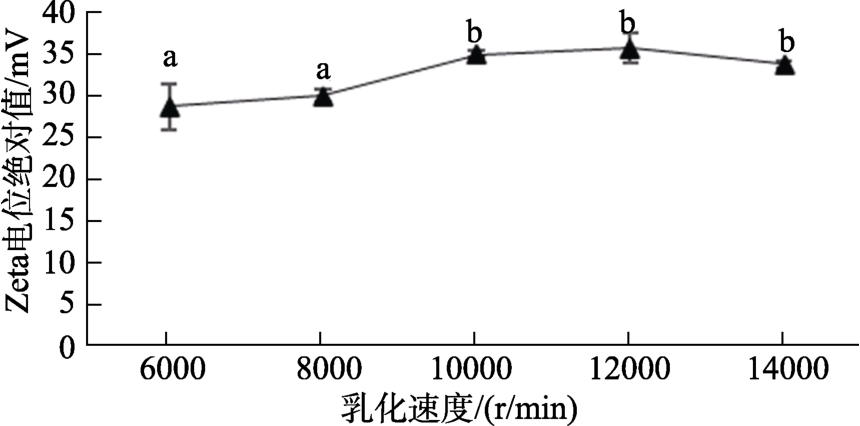
图1 乳化速度对Zeta电位绝对值的影响
Fig.1 Effect of emulsification speed on the absolute value of Zeta potential
注:不同字母的数据表示差异显著(P<0.05)。
Note: The data with different letters show significant differences (P< 0.05).
2.2.2 乳化时间对Zeta电位绝对值的影响
乳化时间对Zeta电位绝对值的影响如图2所示,除乳化时间10 min外,其他乳化时间的Zeta电位绝对值均高于30 mV。当乳化时间从10 min增加到30 min时,Zeta电位绝对值明显增加,乳化时间达到30 min时,Zeta电位绝对值达到最大值(34.70±0.75) mV,乳化时间继续增加,Zeta电位绝对值呈现下降趋势,乳化时间从40 min增加到50 min,Zeta电位绝对值变化不大。因此,将乳化时间范围确定为20~40 min。

图2 乳化时间对Zeta电位绝对值的影响
Fig.2 Effect of emulsification time on the absolute value of Zeta potential
注:不同字母的数据表示差异显著(P<0.05)。
Note: The data with different letters show significant differences (P< 0.05).
2.2.3 乳化温度对Zeta电位绝对值的影响
乳化温度对Zeta电位绝对值的影响如图3所示,在试验乳化温度条件下,Zeta电位绝对值呈现先升高后下降的趋势。乳化温度从 20 ℃上升到 40 ℃,Zeta电位绝对值明显增加,乳化温度为40 ℃时,Zeta电位绝对值达到最大值(36.63±1.49) mV,乳化温度继续升高,Zeta电位绝对值则开始降低,出现这一变化的原因可能是由于随着乳化温度的升高,乳化剂分子快速扩散到液滴界面,增加了液滴间的静电排斥作用,Zeta电位绝对值增大;而随着温度继续升高,一方面水相的粘度降低,布朗运动加剧,使液滴间碰撞合并的机率增大,同时由于乳化剂分子的热运动增强,其从液滴界面逃离趋势增加,导致液滴界面相同电荷减少,静电斥力减弱,液滴间聚结增多,稳定性降低[31]。除了在乳化温度20 ℃时Zeta电位绝对值为29.2 mV,其余乳化温度下的Zeta电位绝对值均高于30 mV。因此,将乳化温度范围确定为30~50 ℃。
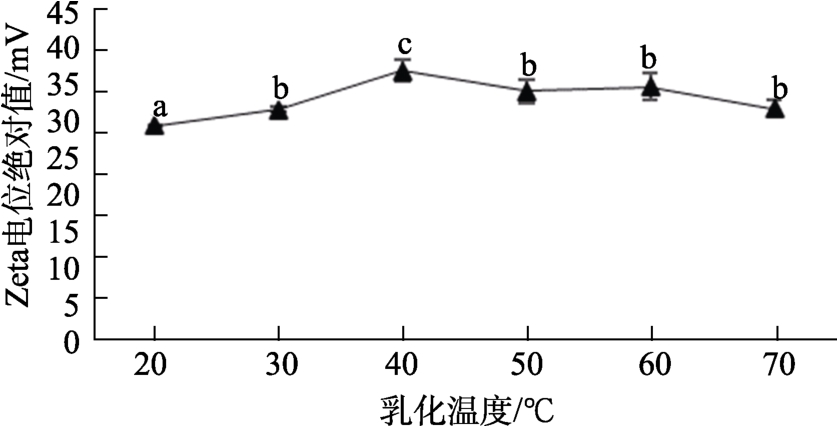
图3 乳化温度对Zeta电位绝对值的影响
Fig.3 Effect of emulsification temperature on the absolute value of Zeta potential
注:不同字母的数据表示差异显著(P<0.05)。
Note: The data with different letters show significant differences (P< 0.05).
2.2.4 正交试验
由表4的因素极差值大小可以看出,以Zeta电位绝对值为评价指标,影响脂肪乳液乳化工艺因素的主次顺序为:B>C>A,最优条件组合是B1C3A1,即乳化速度10 000 r/min,乳化时间20 min,乳化温度50 ℃。在此条件下制备脂肪乳液样品,经过三次试验得出 Zeta电位绝对值平均值为(38.72±0.20) mV,略高于正交试验中最佳组合B1C3A3,因此确定B1C3A1组合为最优乳化工艺。
表4 乳化工艺正交试验
Table 4 Orthogonal design for optimization of emulsification process
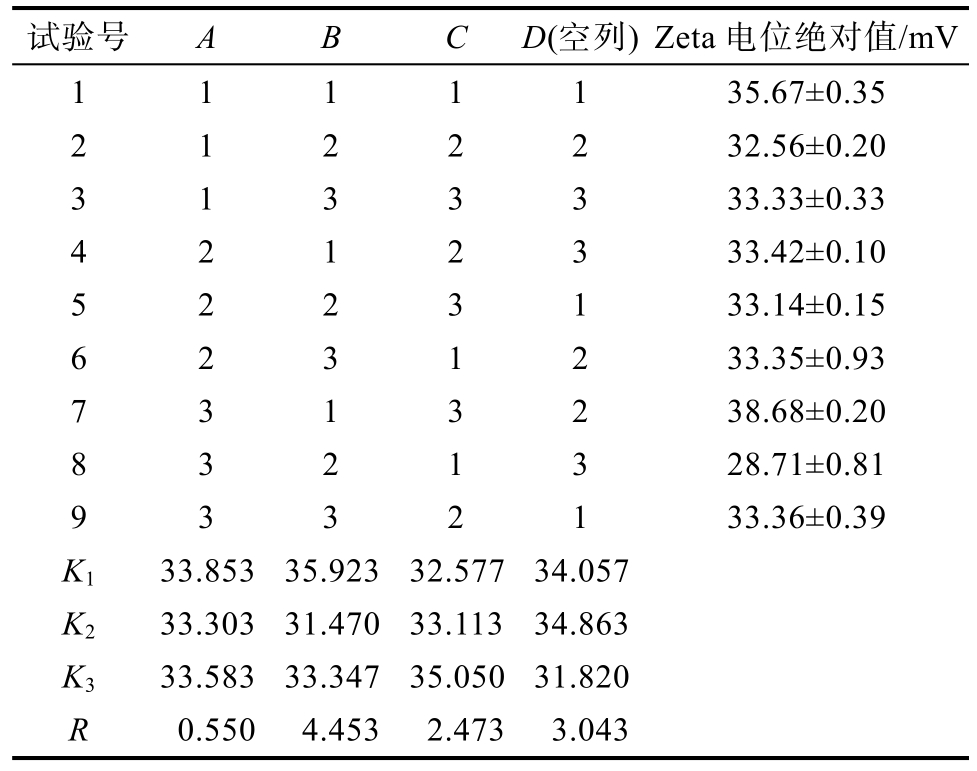
试验号 A B C D(空列) Zeta电位绝对值/mV 1 1 1 1 1 35.67±0.35 2 1 2 2 2 32.56±0.20 3 1 3 3 3 33.33±0.33 4 2 1 2 3 33.42±0.10 5 2 2 3 1 33.14±0.15 6 2 3 1 2 33.35±0.93 7 3 1 3 2 38.68±0.20 8 3 2 1 3 28.71±0.81 9 3 3 2 1 33.36±0.39 K1 33.853 35.923 32.577 34.057 K2 33.303 31.470 33.113 34.863 K3 33.583 33.347 35.050 31.820 R 0.550 4.453 2.473 3.043
脂肪乳液乳化工艺正交试验方差分析如表5所示,结果表明乳化时间和乳化温度的差异在α=0.05水平上都是显著的。
表5 方差分析(α=0.05)
Table 5 Analysis of variance for orthogonal experiment
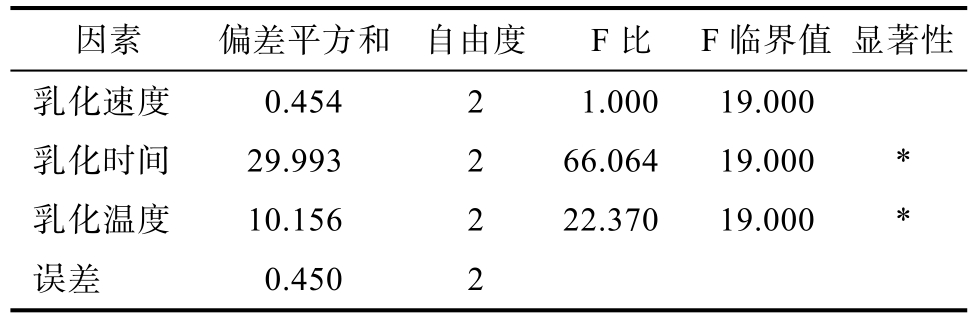
因素 偏差平方和 自由度 F比 F临界值 显著性乳化速度 0.454 2 1.000 19.000乳化时间 29.993 2 66.064 19.000 *乳化温度 10.156 2 22.370 19.000 *误差 0.450 2
2.3 高压均质及高压灭菌条件确定
脂肪乳液属于热力学不稳定的乳状分散体系,粒径大小和粒径分布反映了乳液体系的稳定性,乳滴粒径越小,分布越窄,越有利于体系的稳定[31]。同时,粒径还影响乳液的口感以及在胃肠道中的脂肪消化与吸收[32]。而乳液粒径大小则取决于油相类型和乳化剂类型,以及乳化、高压均质及灭菌工艺等[33]。因此,以粒径为评价指标,优化脂肪乳液的均质及灭菌条件。
高压均质压力及均质次数对乳液粒径的影响如表6所示,通过比较脂肪初乳液在 25 MPa、50 MPa压力下不同均质次数后的粒径可以看出,乳液粒径随着均质次数增加粒径逐渐减少,25 MPa下均质次数从1次增加到3次,乳液粒径由(1 177.00±9.06) nm降低至(979.40±8.76) nm;均质压力为50 MPa时,均质次数从1次增加到3次,乳液粒径由(921.73±4.73) nm 降低至(692.20±1.18) nm,与25 MPa压力相比,50 MPa均质压力下均质后的乳液粒径明显降低,而在此压力下均质次数增加至4次后粒径变化不大,因此,将脂肪乳液均质条件确定为50 MPa压力下均质3次。
表6 高压均质条件对乳液粒径的影响
Table 6 Effect of high-pressure homogenous parameters on the size of emulsion
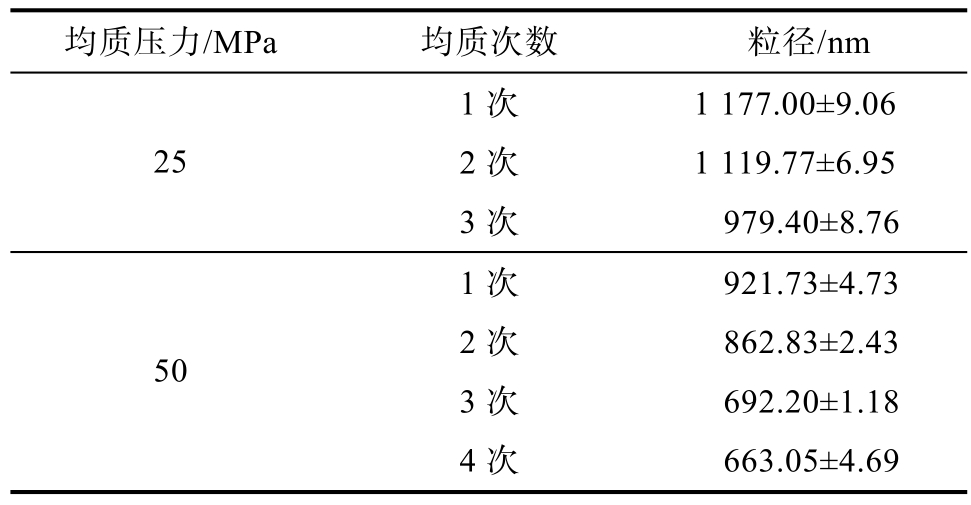
均质压力/MPa 均质次数 粒径/nm 1次 1 177.00±9.06 252次 1 119.77±6.95 3次 979.40±8.76 1次 921.73±4.73 502次 862.83±2.43 3次 692.20±1.18 4次 663.05±4.69
由于脂肪乳液体系不稳定,灭菌温度过高或时间过长将影响脂肪乳液的粒径,同时可能加速卵磷脂的降解,降低体系稳定性[18]。因此,选择适宜的灭菌条件对于脂肪乳液的质量具有重要影响。为此采用压力蒸汽灭菌法,考察在121 ℃条件下灭菌5、10、15、20 min时的灭菌效果,结果如表7所示,可以看出随着灭菌时间的增加,脂肪乳液粒径略有增加;灭菌时间在5 min和10 min时,灭菌后乳化体系外观呈乳白色,状态均匀,未见油水分离现象,室温静置30 d产品稳定;而当灭菌时间增加到15 min后,乳液液面有轻微漂油现象,表明此时乳化体系已处于不稳定状态,少量油脂析出。因此,将脂肪乳液灭菌条件确定为121 ℃条件下灭菌10 min。
表7 高压灭菌条件对脂肪乳液的影响
Table 7 Effect of sterilization parameters on the size and state of the emulsion
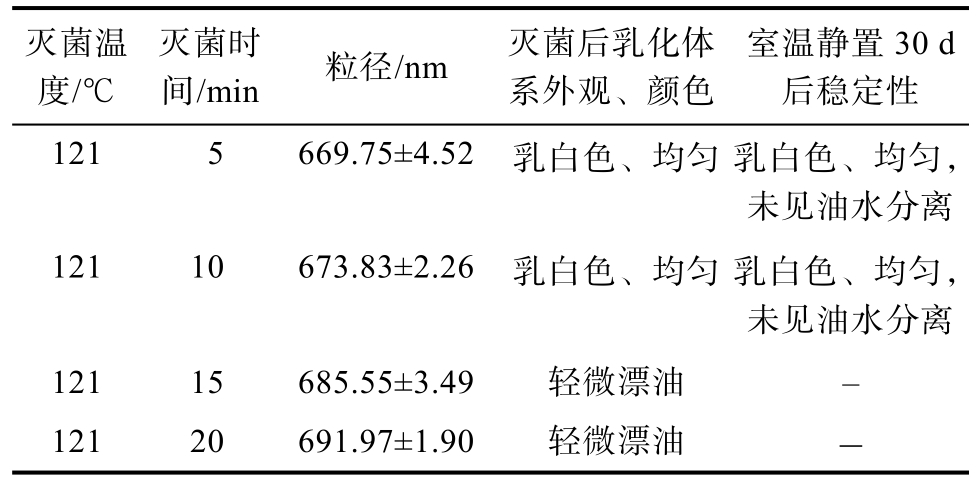
灭菌温度/℃灭菌时间/min 粒径/nm 灭菌后乳化体系外观、颜色室温静置30 d后稳定性121 5 669.75±4.52 乳白色、均匀 乳白色、均匀,未见油水分离121 10 673.83±2.26 乳白色、均匀 乳白色、均匀,未见油水分离121 15 685.55±3.49 轻微漂油 -121 20 691.97±1.90 轻微漂油 -
2.4 产品稳定性评价
将制备的PKO-FESMP样品分别在4、25及40 ℃条件下放置30、60及90 d后考察产品的稳定性,试验结果如表8所示,可以看出在三个不同温度下存放一定时间后乳液粒径变化不大,不同存放条件下的脂肪乳液样品在考察时间内保持均匀乳白色,未见油水分离,产品稳定性良好。
表8 棕榈仁油基特医脂肪乳液产品稳定性试验
Table 8 Stability experiment of PKO-FESMP
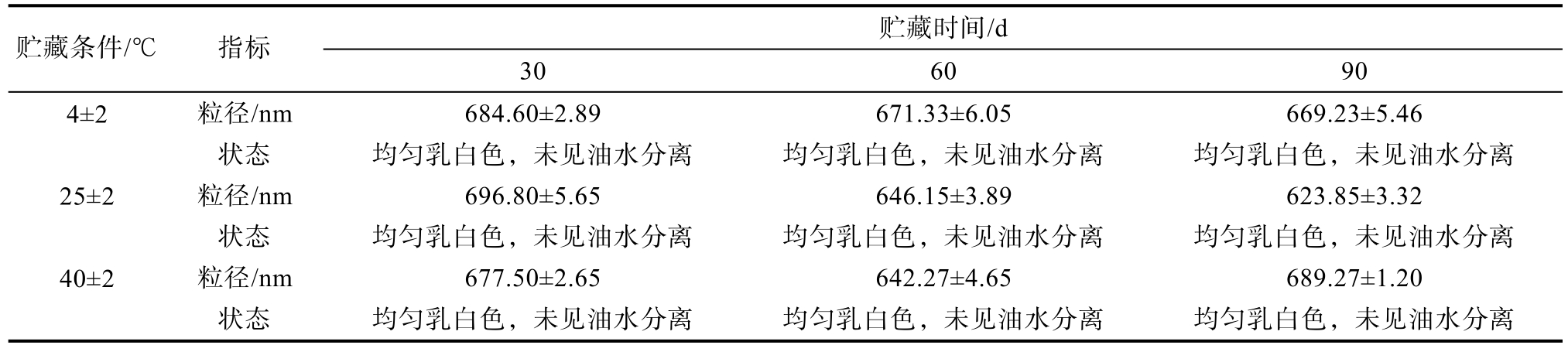
贮藏时间/d贮藏条件/℃ 指标 30 60 90粒径/nm 684.60±2.89 671.33±6.05 669.23±5.46 4±2状态 均匀乳白色,未见油水分离 均匀乳白色,未见油水分离 均匀乳白色,未见油水分离粒径/nm 696.80±5.65 646.15±3.89 623.85±3.32 25±2状态 均匀乳白色,未见油水分离 均匀乳白色,未见油水分离 均匀乳白色,未见油水分离粒径/nm 677.50±2.65 642.27±4.65 689.27±1.20 40±2状态 均匀乳白色,未见油水分离 均匀乳白色,未见油水分离 均匀乳白色,未见油水分离
2.5 PKO-FESMP对小鼠血清血脂的影响
2.5.1 PKO-FESMP对试验小鼠体重的影响
PKO-FESMP对试验小鼠体重的影响试验结果如表9所示,与对照组相比,各剂量组小鼠体重在试验初始(0 d)、中期(15 d)和后期(30 d)未出现明显差异(P>0. 05)。
表9 PKO-FESMP对实验小鼠体重的影响( ±s)
±s)
Table 9 Effect of PKO-FESMP on body weight of experimental mice
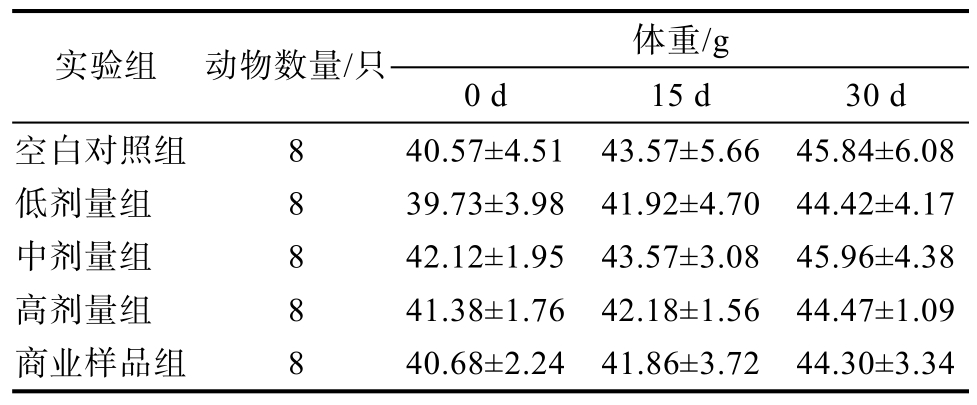
体重/g实验组 动物数量/只 0 d 15 d 30 d空白对照组 8 40.57±4.51 43.57±5.66 45.84±6.08低剂量组 8 39.73±3.98 41.92±4.70 44.42±4.17中剂量组 8 42.12±1.95 43.57±3.08 45.96±4.38高剂量组 8 41.38±1.76 42.18±1.56 44.47±1.09商业样品组 8 40.68±2.24 41.86±3.72 44.30±3.34
2.5.2 试验小鼠摄食量比较
试验各组小鼠日平均摄食量情况如图4所示,可以看出,空白对照组小鼠日均摄食量明显高于其他试验组,其中低剂量组、中剂量组与空白对照组比较日均摄食量差异显著(P<0.05),高剂量组、商业样品组与空白对照组比较日均摄食量差异极显著(P<0.01),原因是由于空白对照组食用的饲料为日粮型饲料,适口性好,小鼠比较爱吃;其他各剂量组与商业样品组食用的是纯化型低脂饲料,适口性较日粮型差,一定程度上影响动物食欲,从而影响摄食量;同时,与商业样品组比较,高、中、低各剂量组日均摄食量无显著性差异(P>0.05)。
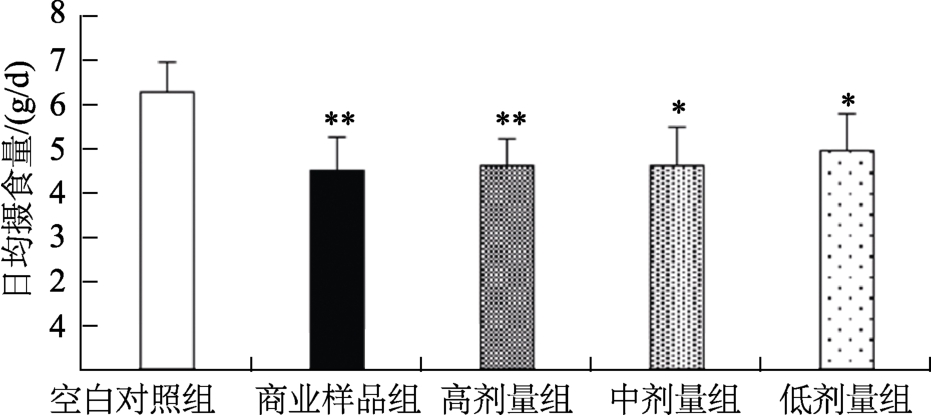
图4 实验各组小鼠日平均摄食量比较
Fig.4 Comparison of average daily food intake of experimental groups
(*P<0.05,**P<0.01,与空白对照组比较)
2.5.3 PKO-FESMP对试验小鼠血清血脂含量的影响
PKO-FESMP对试验小鼠血清血脂含量的影响结果如表10所示。
表10 PKO-FESMP对实验小鼠血清血脂含量的影响
Table 10 Effect of PKO-FESMP on serum lipid content of experimental mice

#P<0.05,##P<0.01,与空白对照组比较;*P<0.05,**P<0.01,与商业样品组比较
#P<0.05, ##P<0.01, compared with control group; * P<0.05,** P <0.01, compared with the commercial sample.
实验组 动物数量/只 T G/(m m o l/L) T C/(m m o l/L)空白对照组 8 1.6 1±0.0 1 2.9 6±0.3 7 1.3 4±0.1 2 0.5 5±0.1 2 L D L-C/(m m o l/L) H D L-C/(m m o l/L)低剂量组 8 1.4 3±0.4 1##* 2.8 6±0.3 0 1.3 5±0.0 7 0.7 5±0.1 1##**中剂量组 8 1.4 8±0.2 3#** 2.9 3±0.8 8 1.4 7±0.1 1# 0.7 0±0.0 4##**高剂量组 8 1.3 8±0.3 1#* 2.0 2±0.0 8#** 1.2 7±0.0 2* 0.5 8±0.0 4**商业样品组 8 2.2 4±0.1 9# 2.9 7±0.1 4 1.4 6±0.1 3 0.6 5±0.0 4#
试验结果表明:(1)对甘油三酯(TG)含量的影响与空白对照组相比,高剂量组、中剂量组小鼠 TG含量显著降低(P<0.05),低剂量组 TG含量降低极显著(P<0.01),而商业样品组(Microlipid)TG含量却显著升高(P<0.05);同时与商业样品组比较,高剂量组、低剂量组 TG含量显著降低(P<0.05),中剂量组 TG 含量降低极为显著(P<0.01);(2)对总胆固醇(TC)含量的影响与空白对照组相比,高剂量组 TC含量显著降低(P<0.05);与商业样品组比较,高剂量组TC含量降低极为显著(P<0.01);(3)对低密度脂蛋白胆固醇(LDL-C)含量的影响中剂量组LDL-C含量较空白对照组升高明显(P<0.05),然而高剂量组LDL-C含量较商业样品组显著降低(P<0.05);(4)对高密度脂蛋白胆固醇(HDL-C)含量的影响与空白对照组比较,低剂量组与中剂量组HDL-C升高极为显著(P<0.01),商业样品组 HDL-C升高显著(P<0.05);同时与商业样品组比较,低剂量组、中剂量组及高剂量组HDL-C升高差异极为显著(P<0.01)。
表3中PKO-FESMP油相脂肪酸组成结果显示其不饱和脂肪酸含量接近60%,其中单不饱和脂肪酸MUFA(如C18∶1)约为29.88%±0.59%,多不饱和脂肪酸PUFA(如C18∶2、C18∶3)占比约31.12%±0.27%;PKO-FESMP具有显著降低小鼠血清 TG(P<0.01)、TC(P<0.01),以及 LDL-C含量(P<0.05)和升高HDL-C含量(P<0.01)的能力,分析原因主要是由于其中的不饱和脂肪酸的作用。已有研究表明单不饱和脂肪酸可以降低血清TC和LDL-C的水平,同时可升高血清HDL-C[34];多不饱和脂肪酸如亚油酸能提高 LDL-C受体活性,降低血清中LDL-C,从而降低血清TC含量[35-36];另一方面,多不饱和脂肪酸中的α-亚麻酸能够抑制肝内脂质及脂蛋白合成,降低血 TC、TG、LDL-C,并增加HDL-C[37]。
3 结论
本研究在设计脂肪酸均衡型油相配方基础上,对脂肪乳液乳化、均质、灭菌等加工工艺进行优化。乳化工艺通常受乳化速度、时间、温度等多个因素影响,因此选择与乳化稳定性呈正相关的Zeta电位绝对值作为评价指标确定乳化工艺条件为乳化速度10 000 r/min,乳化时间20 min,乳化温度 50 ℃;均质和灭菌工艺影响参数通常为两个,分别为均质压力与均质次数、灭菌压力与灭菌时间。因此,以粒径为评价指标可以较为直观的进行判断,根据试验结果确定均质工艺为50 MPa压力下均质三次,灭菌条件为 121 ℃灭菌 10 min。稳定性实验结果显示,PKO-FESMP在4、25及40 ℃条件下存放90 d稳定性良好。动物实验结果表明,PKO-FESMP具有显著降低血清TG含量(P<0.01)、高剂量脂肪乳液具有降低血清TC含量(P<0.01),以及降低LDL-C含量(P<0.05)和升高HDL-C含量(P<0.01)的作用,对于调节血脂水平具有一定意义。
[1]谈善军, 虞文魁, 林志亮, 等. 早期肠内营养对胰十二指肠切除术后病人预后影响的Meta分析[J]. 肠外与肠内营养, 2016,23(1): 12-17+20.TAN S J, YU W K, LIN Z L, et al. Effect of early enteral nutrition on prognosis of patients after pancreaticoduodenectomy:a meta-analysis[J]. Parenter Enter Nutr, 2016, 23(1): 12-20.
[2]MILNE A C, POTTER J, VIVANTI A, et al. Protein and energy supplementation in elderly people at risk from malnutrition[J].The Cochrane database of systematic reviews, 2010, 29(3): 144.
[3]AVENELL A, SMITH T O, CURTAIN J P, et al. Nutritional supplementation for hip fracture aftercare in older people[J].The Cochrane database of systematic reviews, 2016, (11):1-58.
[4]REBECCA J S, ANNA C E, MEIKE E, et al. Enteral nutritional support in prevention and treatment of pressure ulcers: A systematic review and meta-analysis[J]. Ageing Research Reviews, 2005, 4(3): 422-450.
[5]A L CAWOOD, M ELIA, R J STRATTON. Systematic review and meta-analysis of the effects of high protein oral nutritional supplements[J]. Ageing Research Reviews, 2012, 11(2): 278-296.
[6]STRATTON R J, GREEN C J, ELIA M. Disease-related malnutrition: an evidence-based approach to treatment[M].Wallingford: CABI Publishing, 2003: 1123-1126.
[7]SCHUETZ P, FEHR R, BAECHLI V, et al. Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial[J]. Lancet (London, England), 2019,393(10188): 2312-2321.
[8]JOHN F K, JEREMY M D. Nightingale. Cost savings of an adult hospital nutrition support team[J]. Nutrition, 2005, 21(11):1127-1133.
[9]韩军花. 中国特殊医学用途配方食品标准法规-现状及展望[J]. 营养学报, 2017, 39(6): 543-548.HAN J H. Standards and regulations on foods for special medical purposes China: current situations and prospects [J].Acta Nutrimenta Sinica, 2017, 39(6): 543-548.
[10]中华人民共和国国家卫生和计划生育委员会. 特殊医学用途配方食品通则: GB 29922—2013[S]. 北京: 中国标准出版社, 2013.China National Standardization Administration Committee.National food safety standard-general principles for formulated foods for special medical purposes: GB 29922—2013[S].Beijing: China Standards Press, 2013.
[11]BACH A C, BABAYAN V K. Medium-chain triglycerides: an update[J]. The American journal of clinical nutrition, 1982,36(5): 950-962.
[12]SHAH N D, LIMKETKAI B N. The use of medium-chain triglycerides in gastrointestinal disorders[J]. Pract.Gastroenterol,2017, 41: 20-28.
[13]TAYLOR M K, SWERDLOW R H, SULLIVAN D K. Dietary neuroketotherapeutics for Alzheimer's Disease:an evidence update and the potential role for diet quality[J]. Nutrients, 2019,11(8): 1-24.
[14]MAHDI E S, SAKEENA M H F, ABDULKARIM M F, et al.Effect of surfactant and surfactant blends on pseudoternary phase diagram behavior of newly synthesized palm kernel oil esters[J].Drug Des Devel Ther, 2011, (5): 311-323.
[15]沈敏跃, 陈军. 中国肠内营养制剂分类研究[J].中华普通外科学文献(电子版), 2010, 4(2): 144-146.SHEN M Y, CHEN J. Clinical research of classification of enteral nutrition products in China[J]. Chinese Archives of General Surgery (Electronic Edition), 2010, 4(2): 144-146.
[16]杨佩佩, 吉娟, 樊衍良, 等. 以双蛋白为乳化剂的肠内营养乳的制备与评价[J]. 今日药学, 2017, 27(3): 176-180.YANG P P, JI J, FAN Y L, et al. Preparation and evaluation of lipid emulsion with double proteins as emulsifiers for enteral nutrition[J]. Pharmacy Today, 2017, 27(3): 176-180.
[17]彭艳梅, 覃元清, 龚年春, 等. 糖尿病专用型特殊医学用途配方食品的研制[J].食品科学技术学报, 2017, 35(1): 17-20.PENG Y M, QIN Y Q, GONG N C. Research of foods for special medical purposes to diabetic patients[J]. Journal of Food Science and Technology, 2017, 35(1): 17-20.
[18]刘芙蓉, 王银, 杨雅静, 等. 多种油脂肪乳注射液制备工艺与质量评价的初步研究[J]. 华西药学杂志, 2017, 32(3): 234-237.LIU F R, WANG Y, YANG Y J, et al. The pilot study of preparation and quality evaluation of muti-oil fat emulsion injection[J]. West China Journal of Pharmaceutical Sciences.2017, 32(3): 234-237.
[19]刘媛, 叶盛英, 魏振承, 等. 宏量营养素和 pH 值对乳液型特医食品基质品质的影响[J]. 食品科学, 2020, 41(4): 23-31.LIU Y, YE S Y, WEI Z C, et al. Effects of macronutrients and pH on matrix quality of emulsion-type foods for special medical purposes[J]. Food Science, 2020, 41(4): 23-31.
[20]魏振承, 徐志宏, 池建伟, 等. 短肽免疫增强型临床营养乳液的配方和制备工艺研究[J]. 中国粮油学报, 2009, 24(7):120-123.WEI Z C, XU Z H, CHI J W, et al. Formulation and manufacturing technology for immunity enhancing peptide emulsion[J]. Journal of the Chinese Cereals and Oils Association, 2009, 24(7): 120-123.
[21]国家市场监督管理总局. 特殊医学用途配方食品稳定性研究要求(试行)(2017修订版), 2017年第108号.http://gkml.samr.gov.cn/nsjg/tssps/202011/t20201109_323191.html#
[22]国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品中脂肪酸的测定: GB 5009. 168—2016[S]. 食品安全国家标准 北京: 中国标准出版社, 2016.China National Standardization Administration Committee.China Standard Book National food safety standard-determination of fatty acids in foods: GB5009.168—2016[S]. Beijing: China Standards Press, 2016.
[23]LUCAS O B, JUAN M C, CRISTINA M, et al. Development of oil-in-water emulsions based on rice bran oil and soybean meal as the basis of food products able to be included in ketogenic diets[J]. LWT, 2020, 118(1): 1-8.
[24]KAZUNORI I, YOICHI H, MAKOTO M, et al. Enhancing mechanism of intestinal absorption of highly lipophilic compounds using microemulsion-quantitative analysis of the partitioning to the mesenteric lymph in intestinal cells[J]. Asian Journal of Pharmaceutical Sciences, 2015, 10(3): 186-193.
[25]王吉, 谢文, 严思思, 等. 植物油与猪油的 1∶1调和油对小鼠血脂及肝脏脂质代谢的影响[J]. 中国油脂, 2016, 41(9): 59-64.WANG J, XIE W, YAN S S, et al. Effects of vegetable oils blended with lard in mass ratios of 1:1 on blood lipid and hepatic lipid metabolism of mice [J]. China Oils and Fats, 2016, 41(9):59-64.
[26]中国营养学会.中国居民膳食营养素参考摄入量[M]. 北京:科学出版社, 2009: 101-102.Chinese Nutrition Society. Chinese dietary reference intakes[J].Beijing: Science Press, 2009: 101-102.
[27]董武军, 叶军, 吴朝阳. 载药脂肪乳的质量控制进展[J]. 中国食品药品监管, 2019(10): 34-40.DONG W J, YE J, WU C Y. Progress in quality control of drug-loaded fat emulsion[J]. China Food Drug Administration,2019(10): 34-40.
[28]王怡. 基于QbD制备肠内全营养乳液及用近红外光谱测定多组分含量[D]. 福建医科大学, 2019.WANG Y. Preparation of enteral nutritional emulsion using quality by design and determination of components by NIR[D].Fujian Medical University, 2019.
[29]MITRI K, SHEGOKAR R, GOHLA S, et al. Lipid nanocarriers for dermal delivery of lutein: preparation, characterization, stability and performance[J]. International Journal of Pharmaceutics,2011, 414(1-2): 267-275.
[30]ILLUM L. Chitosan and its use as a pharmaceutical excipient [J].Pharm Res, 1998, 15, 1326-1331.
[31]冯建国, 张小军, 范腾飞, 等. 体系 pH值、乳化温度和电解质离子对异丙甲草胺水乳剂稳定性的影响[J]. 高等学校化学学报, 2012, 33(11): 2521-2525.FENG J G, ZHANG X J, FAN T F, et al. Effects of pH value,emulsification temperature and electrolytical ions on the stability of metolachlor emulsion in water[J]. Chemical Journal of Chinese Universities, 2012, 33(11): 2521-2525.
[32]SUN J H, SEON T J, BEONG O L, et al. Impact of salt and lipid type on in vitro digestion of emulsified lipids[J]. Food Chemistry,2011, 126(4): 1559-1564.
[33]侯丹平, 温敏, 邢杨杨, 等. 创新组方肠内营养乳液制备的工艺参数研究[J]. 中国食物与营养, 2018, 24(8): 25-28.HOU D P, WEN M, XING Y Y, et al. Process parameter of enteral fat emulsion with perilla oil[J]. Food and Nutrition in China, 2018, 24(8): 25-28.
[34]GARDNER C D, KRAEMER H C. Monounsaturated versus polyunsaturated dietary fat and serum lipids. A meta-analysis.[J].Arteriosclerosis, thrombosis, and vascular biology, 1995, 15(11).
[35]LAVEDRINE F, ZMIROU D, RAVEL A, et al. Blood cholesterol and walnut consumption: a cross-sectional survey in France[J].Prev Med, 1999, 28(4): 333-9.
[36]YU S, DERR J, ETHERTON T D, et al. Plasma cholesterolpredictive equations demonstrate that stearic acid is neutral and monounsaturated fatty acids are hypocholesterolemic[J]. Am J Clin Nutr, 1995, 61(5): 1129-39.
[37]孙长颢. 营养与食品卫生学[M]. 北京: 人民卫生出版社,2019, 255-256.SUN C H. Nutrition and food Hygiene[M]. Beijing: People's Medical Publishing House, 2019, 255-256.