燕麦中膳食纤维的主要成分是 β-葡聚糖[1],含量约为2%~8%。在过去几十年中,因其出色的功能特性和营养特性而受到了广泛关注,研究表明,它可以通过调节肠道菌群而发挥其有益作用[2]。β-葡聚糖对益生菌如双歧杆菌和乳杆菌的生长促进作用已通过体内和体外研究证明,它是菌群发酵的良好底物,促进了短链脂肪酸的生成[1],具有维持或降低胆固醇和脂质水平[3]、预防动脉粥样硬化、抗消化、调节血糖[2]、改善胃肠功能、免疫调节、抗肿瘤作用以及预防Ⅱ型糖尿病和心血管疾病的作用[4]。燕麦富含蛋白质、矿物质、脂类、β-葡聚糖和其它营养因子,它在制备功能性食品方面具有广阔的应用前景,Fras等[5]在小黑麦粉中添加5%的高膳食纤维浓缩燕麦粉,丰富并优化了面包中氨基酸的组成,尤其是赖氨酸的增加,提高了人体对蛋白质的利用效率,同时增加了膳食纤维和不饱和脂肪酸,使面包的营养价值得到提升。
因为燕麦含有少量或不含面筋蛋白,因此,用燕麦粉制得的面团通常表现出高弹性模量和粘性模量[6]。而适合于焙烤制作的面团必须能够响应气体膨胀而伸展,为了获得具有良好结构和体积的产品,面团强度必须足以防止塌陷,同时还能够伸展而不会过早断裂[7]。面团的延展性主要受到面团中蛋白质和淀粉网络以及分子链段间或分子内相互作用力的影响。增加燕麦粉在小麦面粉中的含量,会导致面团具有较高弹性模量、粘性模量和屈服应力并且会降低混粉的峰值黏度、糊化温度、凝胶硬度、溶胀体积和稠度系数[8]。而较小的粘性和弹性模量,对面包体积的发展是有利的[9]。燕麦粉面团的流变学特性与 β-葡聚糖的含量和分子量有直接的关系,β-葡聚糖含量的增加会使面团表观黏度上升,导致面团延展性降低,硬度增大,无法直接应用于焙烤食品[10]。
膳食纤维与麸质的相互作用是一个复杂的现象,这些相互作用与蛋白质二级和三级结构,二硫键和氢键结合模式的改变有关[11]。目前的结果一致认为,大多数可溶性纤维通过氢键和疏水性相互作用与面筋发生非共价相互作用。在存在不溶性多糖纤维的情况下,相互作用由纤维的溶胀和水合程度决定,它在与面筋蛋白竞争性吸水和物理位阻效应中起着重要的作用[12]。面筋蛋白与膳食纤维之间竞争性的结合水,会导致面筋蛋白的构象变化以及面筋蛋白聚集体网络结构位置的塌陷[13]。同时膳食纤维对面筋蛋白的稀释作用,会在物理上破坏面筋网络[14]。因此,在开发含有高燕麦粉含量面包时,高含量的β-葡聚糖会导致面包体积显著减少和面包芯硬度增加。原因可能是因为高水平的β-葡聚糖与面筋竞争水分,从而阻碍了面团中面筋网络的正常发展,物理上稀释了面筋,并改变了面筋网络的连续性,面筋网络薄弱,从而导致发酵过程中气室的早期破裂以及面团的低膨胀。
本文旨在探究β-葡聚糖酶对燕麦面包预拌粉面团加工特性以及面筋蛋白理化特性及面筋形成变化规律的影响,探讨β-葡聚糖酶在高燕麦粉含量面团中的应用潜力。
1 材料与方法
1.1 实验材料
裸燕麦(蛋白质 11.9%、脂肪 6.2%、淀粉58.0%、膳食纤维11.92%):黑龙江五常市彩桥米业有限公司;β-葡聚糖酶(酶活20 000 U/g,粉状):广西庞博生物工程有限公司;谷朊粉(蛋白质82.5%、脂肪 0.7%、淀粉 6.8%):安徽安特食品股份有限公司;高筋小麦粉(蛋白质 12.8%、脂肪 1.6%、淀粉 72.0%):东莞益海嘉里粮油食品工业有限公司;盐:市售;黄油:新西兰恒天然集团;高糖酵母:安琪酵母股份有限公司。
1.2 仪器与设备
HC-800Y型高速多功能粉碎机:武汉海纳电器有限公司;WTN-25型和面机:无锡联合纬创机械有限公司;Nicolet IS10型傅立叶红外光谱仪:美国赛默飞世尔科技公司;F-7000型荧光光谱仪、CR-21GIII型高速离心机:日本日立公司;HZ-9212SB型水浴振荡器:太仓市华利达实验设备有限公司;L550型离心机:湖南湘仪实验室仪器开发有限公司;HWS-24型电热恒温水浴锅:上海一恒科学仪器有限公司;DHR-3型动态流变仪:美国沃特世公司;T9型紫外分光光度计:北京普析通用仪器有限公司;ChemiDoc XRS+型化学发光凝胶成像系统:美国伯乐公司;DAWN HELEOS Ⅱ型多角度激光光散射凝胶色谱系统检测:美国怀雅特技术公司。
1.3 实验方法
1.3.1 燕麦面团制作
将裸燕麦籽粒经粉碎机粉碎后,通过80目筛制得燕麦粉,通过率在95%以上。燕麦面包预拌粉由50%的燕麦粉、37.5%的小麦粉和12.5%的谷朊粉组成,燕麦面包配方包括以500 g谷物粉为基础的燕麦面包预拌粉(含50%的燕麦粉、37.5%的小麦粉和 12.5%的谷朊粉组成的谷物粉,以及基于谷物粉质量8.0%的蔗糖,1.6%的食用盐和不同用量的 β-葡聚糖酶)、1.5%的干酵母、8.0%的黄油和最佳的水量(由燕麦面团在粉质仪测试中最大稠度在(500±20) FU时加水数据获得),干酵母和黄油的添加比例都基于谷物粉质量。将燕麦面包预拌粉和干酵母倒入和面机中,在低速档位下,缓慢加入20 ℃的水后连续搅拌3 min,然后在高速档位下搅拌2 min至面团基本成型,然后加入黄油并在低速档位下揉至面筋完全发展,得到燕麦面团,生面团在(25±1) ℃延展30 min后进行相关面团性质测试,并将其进行冷冻干燥后获得冻干粉进行蛋白质和葡聚糖相关分析测试。
1.3.2 面包粉粉质特性的测定
面包粉粉质特性的测定参照 GB/T 14614—2019《粮油检验小麦粉面团流变学特性测试粉质仪法》。称取质量相当于300 g水分含量为14%的混合粉,25 s内加入定量水在粉质仪混揉,使面团的稠度达到(500±20) FU,记录吸水率(%)、面团形成时间(min)、稳定性(min)、弱化度(BU)。
1.3.3 燕麦面团动态流变学特性的测定
燕麦面团动态流变学特性通过使用配备有直径40 mm平板的DHR-3动态流变仪测定得到。测定模式为振荡模式,夹缝间距为2 mm,压力松弛时间为 5 min,温度为25 ℃,应力为0.1%,扫描频率范围为0.1~100 Hz,试参数包括弹性模量(G′),粘性模量(G″)和损耗角 tan(G′/G″)。1.3.4 β-葡聚糖含量和分子量的测定
燕麦面团和面包中的 β-葡聚糖含量测定参照NY/T 2006—2011《谷物及其制品中β-葡聚糖含量的测定》。利用地衣聚糖酶专一性地水解β-葡聚糖成寡糖,再用β-葡聚糖苷酶将寡糖水解成葡萄糖,葡萄糖在葡萄糖氧化酶作用下生成葡萄糖酸和过氧化氢,过氧化氢在过氧化物酶作用下,与 4-氨基安替比林氧化缩合生成红色醌类化合物,此化合物在510 nm处的吸光度值与葡萄糖含量成正比。
燕麦面团中 β-葡聚糖的平均分子量测定参照Suortti的方法[15],将2 g冻干粉分散在12 mL含0.1% NaBH4的0.1 mol/L NaOH溶液中,搅拌10 h,离心收集上清液,用淀粉酶去淀粉,并用等电点法除去蛋白,离心收集上清液,加入95%乙醇沉淀,离心收集沉淀,冻干后得到β-葡聚糖粗提物,使用多角度激光光散射凝胶色谱系统检测分子量。
1.3.5 蛋白质游离巯基的测定
将10 mg的粉末样品分散在4.0 mL缓冲液[2.0%十二烷基硫酸钠(SDS),3.0 μmol/L尿素和1.0 μmol/L乙二胺四乙酸四钠和0.05 μmol/L磷酸钠,pH 6.5]中。将悬浮液充分振摇后,添加50 μL的 0.1%(w/v缓冲液)5, 5′-二硫-2-硝基苯甲酸(DTNB)试剂,将该混合物在黑暗中反应30 min,然后以8 000 g离心10 min,并在412 nm处测量上清液的吸光度。空白样品是50 μLDTNB和4.0 mL缓冲液的混合物。
计算公式如下:
式中:
73.53——DTNB的摩尔吸光系数
A412——样品在412 nm处吸光度
D——样品稀释倍数
C——样品浓度(mg/mL)
1.3.6 SDS可萃取蛋白的测定
将 150 mg粉末状样品分散在20 mL的 2%(w/v)十二烷基硫酸钠(SDS)中。将悬浮液通过磁力搅拌器混合5 h,并以8 000 g离心20 min。通过使用缩二脲试剂确定上清液的蛋白质含量。
1.3.7 蛋白质二级结构的测定
使用 Nicolet IS10型傅立叶红外光谱仪测定蛋白质的二级结构。红外光谱采集范围是400~4 000 cm-1,以空气背景下,在4 cm-1的分辨率下扫描32次获得样品的二级结构光谱图。通过使用OMNIC v8.0和PeakFit v4.12分析酰胺I区(1 600~1 700 cm-1)的光谱信息。
1.3.8 SDS-聚丙烯酰胺凝胶电泳
参考Zhou的方法[16],采用5%浓缩胶和10%分离胶配制凝胶,将100 mg的样品分散在20 mL 1.5% SDS溶液中。以10 000 g离心15 min,将上清液和还原型上样缓冲液以4∶1的体积比混合,并在100 ℃下加热10 min,取15 μL上样,运行电压为100 V。凝胶用0.1%的考马斯亮蓝R-250染色,并用10%的甲醇和10%的乙酸溶液脱色。非还原型SDS-PAGE的实验方法同上,但是上样缓冲液为非还原型。
1.3.9 蛋白质表面疏水性的测定
将约100 mg粉末状样品分散在20 mL 50 mmol/L的乙酸溶液中。磁力搅拌2 h,并以10 000 g离心20 min。将上清液稀释至五种不同浓度,并与20 μL 8 mmol/L ANS(8-苯胺-1-萘磺酸)试剂在黑暗中反应15 min,通过F-7000荧光光谱仪,在390 nm的激发波长,470 nm的发射波长和5 nm的狭缝宽度下测量荧光强度。
1.4 数据分析
所有实验至少进行三次,用 SPSS 20.0和EXCEL 2011对数据进行统计和分析,运用方差分析法(ANOVA)对数据进行显著性分析。
2 结果与讨论
2.1 燕麦面包预拌粉粉质特性
表1显示了不同β-葡聚糖酶含量对燕麦面团的粉质特性的影响。通过添加β-葡聚糖酶,燕麦面团的吸水率和形成时间显著降低。燕麦β-葡聚糖的黏度与分子量和浓度有关。分子量和浓度越低,燕麦β-葡聚糖的黏度越低,持水能力越弱。由于β-葡聚糖酶的影响,燕麦面团中的β-葡聚糖含量和聚合度降低,导致混合粉在面团形成过程中对在水的吸收能力降低,吸水率降低。同时,由于β-葡聚糖持水能力减弱,面团中水分子的流动性可能会增强,蛋白质的水合速率会加快,面团形成时间降低。此外,β-葡聚糖酶的添加量从3 U/g增加到9 U/g对面团吸水率和形成时间几乎没有影响。这可能与β-葡聚糖酶的酶促水解特性有关。β-葡聚糖酶可以快速水解高分子量大麦 β-葡聚糖,而当底物是低分子量 β-葡聚糖时,β-葡聚糖酶的水解能力受到限制。
表1 不同β-葡聚糖酶含量燕麦面包预拌粉的粉质特性
Table 1 The farinographic properties of pre-mixed oat bread flour with different β-glucanase content
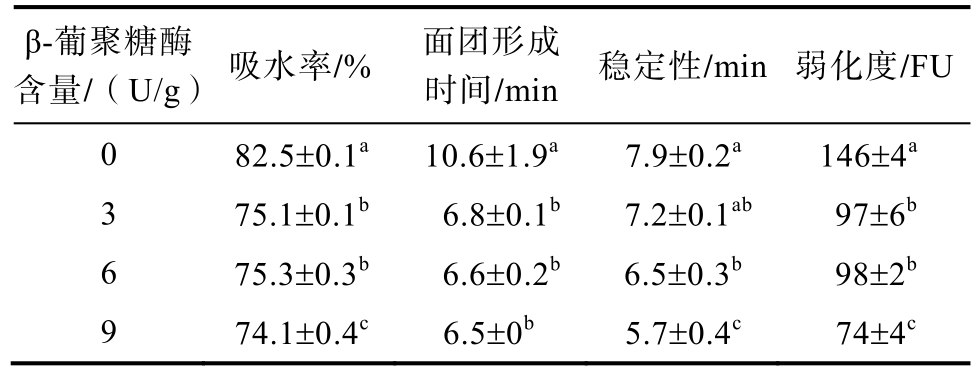
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),a代表最大值,测试取3次平均值。
Note: The values in the table are the means ± standard deviation. Different letters in the same column indicate significant differences (P<0.05). Letter a represents the maximum value. All tests were performed at three replicates.
β-葡聚糖酶含量/(U/g) 吸水率/% 面团形成时间/min 稳定性/min 弱化度/FU 0 82.5±0.1a 10.6±1.9a 7.9±0.2a 146±4a 3 75.1±0.1b 6.8±0.1b 7.2±0.1ab 97±6b 6 75.3±0.3b 6.6±0.2b 6.5±0.3b 98±2b 9 74.1±0.4c 6.5±0b 5.7±0.4c 74±4c
随着 β-葡聚糖酶添加量的增加,面团的稳定性和弱化度也显著降低。面团稳定性表明的是面团的强度和抵抗连续混合的能力[17]。据报道,由于多糖亲水胶体的高黏度和多糖链之间的自缔合[18],因此添加多糖亲水胶体可以提高面团稳定性。因此,可以推测,由于β-葡聚糖被β-葡聚糖酶水解后黏度降低可能会降低面团抵抗连续混合的稳定性。面团弱化度的值降低表明添加了β-葡聚糖酶后,燕麦面团的面筋网络强度提高。该结果可以推测为是大分子β-葡聚糖经β-葡聚糖酶作用后对面筋网络的物理剪切破坏能力减弱的结果,这有助于提高燕麦面团后续的醒发高度,以及燕麦面包的比容。
2.2 面团动态流变学特性
图1显示了β-葡聚糖酶含量对燕麦面团动态流变性能的影响。扫描频率从0.1 Hz增加到100 Hz,所有燕麦面团样品的弹性模量(G′)和粘性模量(G″)都随着频率增大而增大。在给定的频率下,G′值始终高于G″值,tan δ小于1。在低频模式下,tan δ随着频率的升高而减小,而在高频模型下,tan δ随着频率的升高而增大。该现象表明所有燕麦面团样品表现的更像固体[30]。
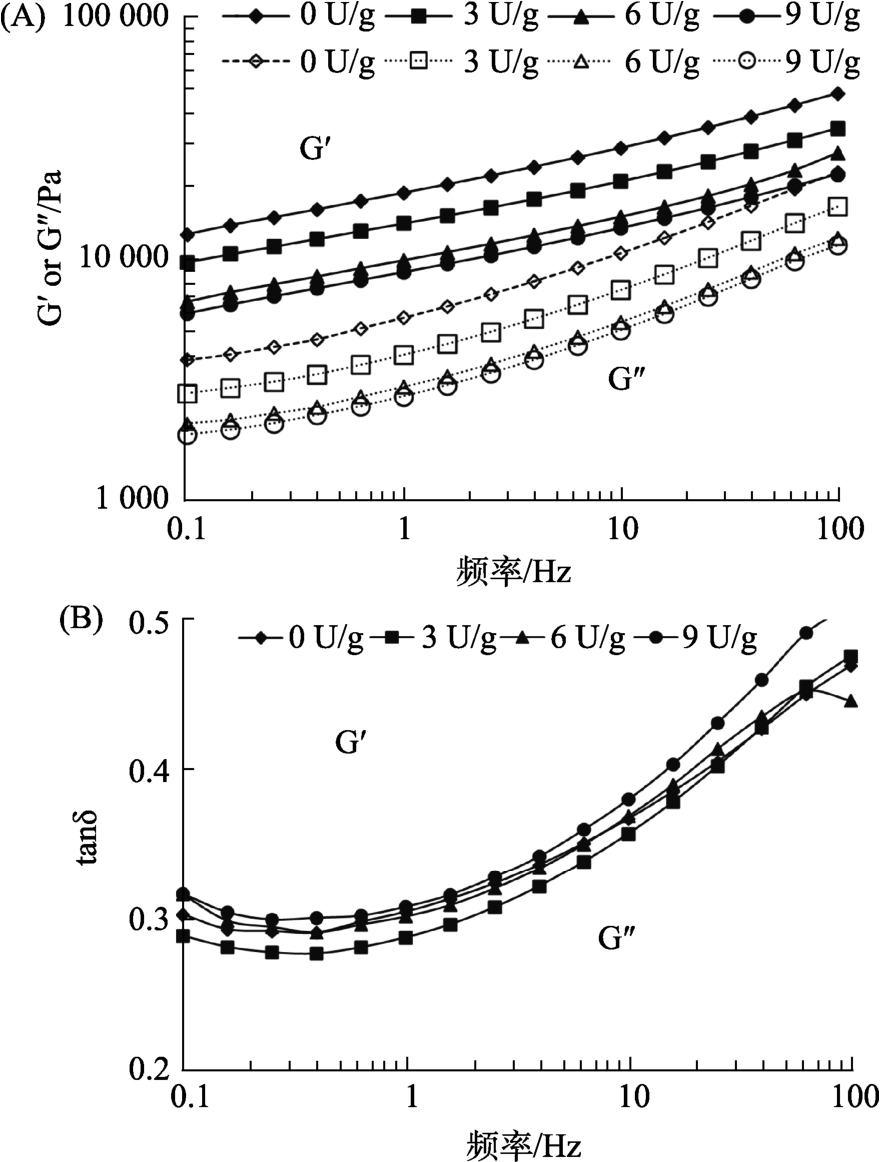
图1 不同β-葡聚糖酶含量燕麦面团的动态流变学特性
Fig.1 The dynamic rheological properties of oat dough with different β-glucanase content
弹性模量反映了面团系统的刚度和强度。降低的G′值表明面团对抵抗变形的能力减弱。粘性模量反映了面团的黏度和流动性。减小的G″值表明面团的流动性增加。在给定的频率下,燕麦面团样品的 G′和 G″随着 β-葡聚糖酶含量的增加而明显降低。据报道,高黏度的β-葡聚糖分子与淀粉颗粒之间对游离水的竞争限制了淀粉颗粒的溶胀,从而导致了较大的 G′和 G″值[19]。因此,添加β-葡聚糖酶减弱了β-葡聚糖的成胶性并改善了面团的可变形性和流动性。tan δ值反映了面团的粘性和弹性成分之间的竞争关系,各燕麦面团样品之间没有显著差异。
2.3 燕麦面团中β-葡聚糖含量和平均相对分子量
表2显示了添加不同含量的β-葡聚糖酶对燕麦面团中β-葡聚糖的含量和平均相对分子量的影响。分别添加3、6和9 U/g β-葡聚糖酶来处理燕麦面团中β-葡聚糖。β-葡聚糖被β-葡聚糖酶水解后,面团的 β-葡聚糖含量分别降低了 0.14、0.27和0.78 g/100 g DW,燕麦面团中β-葡聚糖的平均相对分子量从350 KDa降至62 kDa。多糖的性质通常与其分子量密切相关。β-葡聚糖黏度和平均分子量的降低导致其在燕麦面团中的黏度、持水能力和成胶性能降低[20],这会影响燕麦面团的流变学特性性,面筋网络结构的形成以及最终燕麦面包的品质。
表2 燕麦面团中β-葡聚糖的含量和平均相对分子量
Table 2 The contet and average molecular weight of β-glucan of oat dough
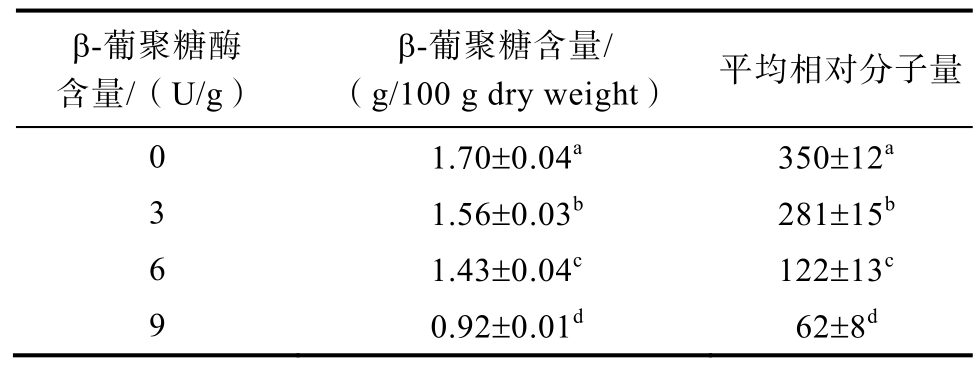
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),a代表最大值,测试取3次平均值。
Note: The values in the table are the means ± standard deviation. Different letters in the same column indicate significant differences (P<0.05). Letter a represents the maximum value. All tests were performed at three replicates.
β-葡聚糖酶含量/(U/g)β-葡聚糖含量/(g/100 g dry weight) 平均相对分子量0 1.70±0.04a 350±12a 3 1.56±0.03b 281±15b 6 1.43±0.04c 122±13c 9 0.92±0.01d 62±8d
2.4 蛋白质游离巯基和SDS可萃取蛋白含量
图2(A)显示了β-葡聚糖酶含量对燕麦面团样品中游离巯基含量的影响。加入β-葡聚糖酶后,面团中游离巯基含量显著增加。该现象与在全麦面团系统中,通过添加戊聚糖酶来消除水不溶性阿拉伯木聚糖对面筋蛋白结构不利影响的结果一致[22]。随着阿拉伯木聚糖平均分子量的减小,木聚糖与蛋白质分子之间的非共价相互作用增强,这阻止了麦谷蛋白中蛋白质间二硫键的形成[21]。因此,该实验的结果也可以推测是面筋蛋白与经β-葡聚糖酶作用产生的小分子 β-葡聚糖寡糖之间非共价相互作用的结果,同时,随着小分子β-葡聚糖寡糖的增多,其阻碍巯基间相互接触的作用位点变多。通常,游离巯基的增加代表了蛋白中二硫键的减少,说明蛋白分子间的共价交作用联减弱。
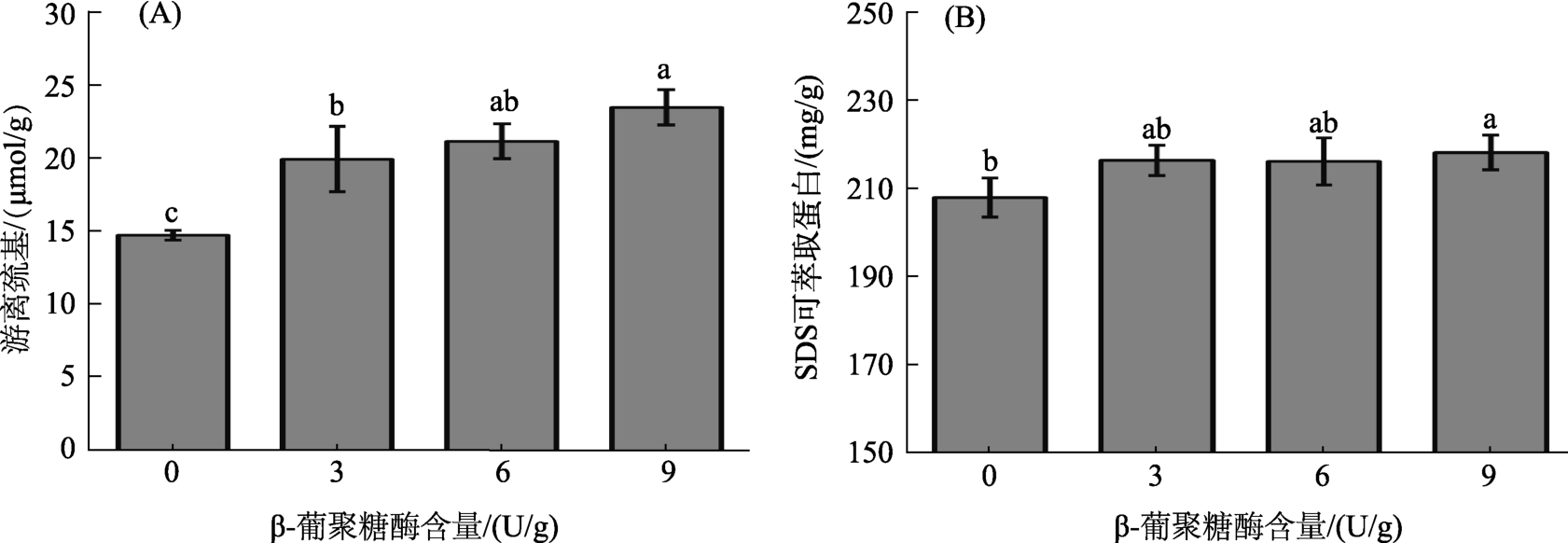
图2 不同β-葡聚糖酶含量燕麦面团游离巯基和SDS可萃取蛋白含量
Fig.2 The free sulfhydryl content and proteins extractability in SDS solution of oat dough with different β-glucanase content
图2(B)显示了β-葡聚糖酶含量对燕麦面团样品在SDS溶液中可萃取蛋白含量的影响。通过添加β-葡聚糖酶,燕麦面团在SDS溶液中可萃取蛋白含量显著上升,表明面团中的蛋白质结构发生了变化。该结果与戊聚糖酶处理全麦面团系统的结果一致,与水不溶性阿拉伯木聚糖的空间位阻效应减弱,蛋白分子之间相互作用加强有关。此外,据报道,瓜尔豆胶和魔芋葡甘露聚糖等线性非离子型亲水胶体存在大量羟基,可通过氢键与面筋蛋白反应,这在与面筋蛋白的相互作用中起关键作用[23]。因此,由实验结果可推测,高分子量β-葡聚糖被β-葡聚糖酶降解后,其对蛋白质分子之间空间位阻效应减弱,而生成的低分子量β-葡聚糖可以进入蛋白质聚集体并通过氢键作用提高了蛋白质分子的水合程度,蛋白质聚集体的结构得以扩展,更多的蛋白质能溶解在 SDS溶液中。
2.5 蛋白质二级结构
表3显示了β-葡聚糖酶含量对燕麦面团样品中蛋白质二级结构的影响。结果表明,添加β-葡聚糖酶处理后,二级结构中的β-折叠含量显著增加,而无规则卷曲和 β-转角的含量显著降低。β-折叠是蛋白质二级结构中最稳定的构象。β-折叠含量的增加表明蛋白质结构变得更加有序,蛋白质分子之间的聚合程度增加,面筋网络结果变得更加坚固,且更具有弹性[24]。
表3 不同β-葡聚糖酶含量燕麦面团蛋白二级结构
Table 3 The secondary structure of proteins of oat dough with different β-glucanase content
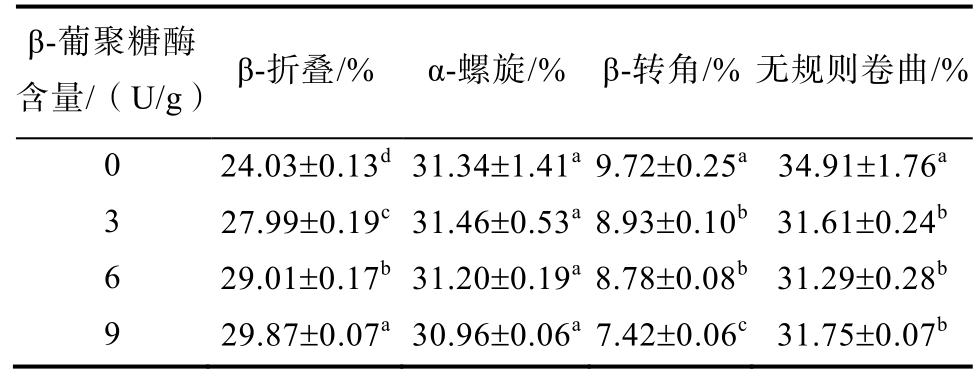
注:表中数值为平均值±标准偏差,同一列中不同字母表示显著性差异(P<0.05),a代表最大值,测试取3次平均值。
Note: The values in the table are the means ± standard deviation. Different letters in the same column indicate significant differences (P<0.05). Letter a represents the maximum value. All tests were performed at three replicates.
β-葡聚糖酶含量/(U/g) β-折叠/% α-螺旋/% β-转角/% 无规则卷曲/%0 24.03±0.13d31.34±1.41a 9.72±0.25a 34.91±1.76a 3 27.99±0.19c31.46±0.53a 8.93±0.10b 31.61±0.24b 6 29.01±0.17b31.20±0.19a 8.78±0.08b 31.29±0.28b 9 29.87±0.07a30.96±0.06a 7.42±0.06c 31.75±0.07b
有研究中表明,面筋蛋白分子之间的氢键在β-折叠结构中起着重要作用[25]。而高分子量β-葡聚糖会对面筋蛋白的二级结构产生不利影响,这是因为高分子量β-葡聚糖能够吸收水分并形成高粘性凝胶附着在面筋表面时,会阻碍面筋网络结构的形成。因此,β-葡聚糖在 β-葡聚糖酶作用下持水能力和成胶性减弱,面筋蛋白周围的自由水含量增加并促进了蛋白质分子的聚集,从而增加了 β-折叠的含量[26]。
2.6 SDS-PAGE凝胶电泳
β-葡聚糖酶含量对燕麦面团样品的 SDS-PAGE蛋白图谱的影响如图3所示。从图3(A)显示了β-葡聚糖酶含量从0增加至9 U/g时,对燕麦面团样品的还原型SDS-PAGE蛋白图谱的影响。未还原型SDS-PAGE蛋白图谱的结果来看,蛋白条带的数量或位置没有变化。这表明添加β-葡聚糖酶不能加强蛋白质分子之间的共价交联作用。但是,添加 β-葡聚糖酶后,A1部分的条带强度显著降低。该部分蛋白主要由α, β-麦醇溶蛋白组成,麦醇溶蛋白不能通过二硫键与其他蛋白质聚合[27]。这表明 A1部分的蛋白质分子可能与其他大分子量蛋白质纠缠在一起,并被截留在上层的浓缩胶中。

图3 不同β-葡聚糖酶含量燕麦面团的蛋白SDS-PAGE电泳图
Fig.3 The SDS-PAGE pattern of protein in oat dough with different β-glucanase content
图3(B)显示了β-葡聚糖酶含量从0增加至9 U/g时,对燕麦面团样品的还原型 SDS-PAGE蛋白图谱的影响。相比于0 U/g和3 U/g的条带,6 U/g和9 U/g的条带在B1、B2和B3部分的条带强度显著增加。B1和 B2部分蛋白主要由 β-麦醇溶蛋白组成。B3部分蛋白主要由γ-麦醇溶蛋白和LMW-GS组成。因此,可以推测,在用β-葡聚糖酶处理燕麦面团可以促进面筋蛋白分子以非共价相互作用的方式聚集。
2.7 蛋白质表面疏水性
β-葡聚糖酶含量对燕麦面团样品表面疏水性的影响如图4所示。当添加β-葡聚糖酶时,面筋蛋白的表面疏水性降低。这可能是高分子量β-葡聚糖经β-葡聚糖酶作用产生的可溶性β-葡聚糖寡糖与面筋蛋白分子中的疏水位点直接结合并屏蔽所致[28]。此外,据研究表明面筋蛋白的表面疏水性降低还可能是蛋白质分子之间通过疏水相互作用形成蛋白质-蛋白质复合物的结果[29]。总之,用β-葡聚糖酶处理燕麦面团促进了蛋白质分子之间的聚集。
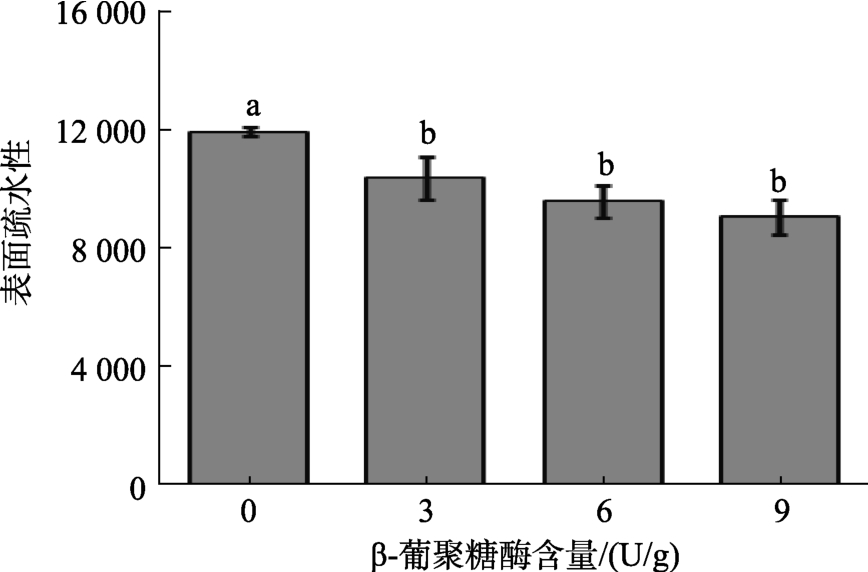
图4 不同β-葡聚糖酶含量燕麦面团中蛋白的表面疏水性
Fig.4 The surface hydrophobicity of protein of oat dough with different β-glucanase content
3 结论
加入β-葡聚糖酶后,面团的吸水率、弱化度、弹性模量(G′)和粘性模量(G″)显著降低,高燕麦含量面团的加工性能得到显著改善,在β-葡聚糖酶的作用下,面筋蛋白的SDS可萃取蛋白含量增加,表面疏水性降低,蛋白的二级结构由无规则卷曲和β-转角转变为β-折叠,面筋蛋白的水合和聚集程度增加。这与β-葡聚糖的含量和聚合度降低,β-葡聚糖的持水能力减弱有关。研究结果表明,β-葡聚糖酶对减弱大分子量 β-葡聚糖对面筋蛋白结构的劣化作用具有积极作用,促进了面团蛋白质之间的聚集。β-葡聚糖酶能造成面团β-葡聚糖平均分子量的下降,6 u/g的酶量能保留原始面团84%的β-葡聚糖,显示其有在高燕麦含量面团加工和烘焙过程中的应用前景。
[1]MARTINEZ-VILLALUENGA C, PENAS E. Health benefits of oat: current evidence and molecular mechanisms[J]. Current Opinion in Food Science, 2017, 14: 26-31.
[2]ZAREMBA S M M, GOW L F, DRUMMOND S, et al. Effects of oat beta-glucan consumption at breakfast on ad libitum eating,appetite, glycemia, insulinemia and GLP-1 concentrations in healthy subjects[J]. Appetite, 2018, 128: 197-204.
[3]LIU B, YANG T, LUO Y, et al. Oat beta-glucan inhibits adipogenesis and hepatic steatosis in high fat diet-induced hyperlipidemic mice via AMPK signaling[J]. Journal of Functional Foods, 2018, 41: 72-82.
[4]RASANE P, JHA A, SABIKHI L, et al. Nutritional advantages of oats and opportunities for its processing as value added foods - a review[J]. Journal of Food Science and Technology-Mysore,2015, 52(2): 662-675.
[5]FRAS A, GOLEBIEWSKI D, GOIEBIEWSKA K, et al. Triticaleoat bread as a new product rich in bioactive and nutrient components[J]. Journal of Cereal Science, 2018, 82: 146-154.
[6]BURESOVA I, KRACMAR S, DVORAKOVA P, et al. The relationship between rheological characteristics of gluten-free dough and the quality of biologically leavened bread[J]. Journal of Cereal Science, 2014, 60(2): 271-275.
[7]BURESOVA I, TOKAR M,MARECEK J, et al. The comparison of the effect of added amaranth, buckwheat, chickpea, corn,millet and quinoa flour on rice dough rheological characteristics,textural and sensory quality of bread[J]. Journal of Cereal Science, 2017, 75: 158-164.
[8]WU K, GAN R Y, DAI S H, et al. Buckwheat and millet affect thermal, rheological, and gelling properties of wheat flour[J].Journal of Food Science, 2016, 81(3): E627-E636.
[9]PARRA A F R, RIBOTTA P D, FERRERO C. Apple pomace in gluten-free formulations: effect on rheology and product quality[J].International Journal of Food Science and Technology, 2015,50(3): 682-690.
[10]LONDONO D M, GILISSEN L, VISSER R G F, et al. Understanding the role of oat beta-glucan in oat-based dough systems[J].Journal of Cereal Science, 2015, 62: 1-7.
[11]ZHU Y, WANG Y, LI J, et al. Effects of water-extractable arabinoxylan on the physicochemical properties and structure of wheat gluten by Thermal Treatment[J]. Journal of Agricultural and Food Chemistry, 2017, 65(23): 4728-4735.
[12]LIU S, SUN Y, OBADI M, et al. Effects of vacuum mixing and mixing time on the processing quality of noodle dough with high oat flour content[J]. Journal of Cereal Science, 2020, 91: 106050.
[13]XIONG L, ZHANG B, NIU M, et al. Protein polymerization and water mobility in whole-wheat dough influenced by bran particle size distribution[J]. Lwt-Food Science and Technology, 2017,82: 396-403.
[14]HAN W, MA S, LI L, et al. Gluten aggregation behavior in gluten and gluten-starch doughs after wheat bran dietary fiber addition[J]. Lwt-Food Science and Technology, 2019, 106: 1-6.
[15]FORREST I S, WAINWRIGHT T. The mode of binding of beta-glucans and pentosans in barley endosperm cell walls[J].Journal of the Institute of Brewing, 1977, 83(5): 279-286.
[16]ZHOU R X, SUN J, QIAN H F, et al. Effect of the frying process on the properties of gluten protein of you-tiao[J]. Food Chemistry,2020, 310: 125973.
[17]YU W J, XU D, ZHANG H, et al. Effect of pigskin gelatin on baking,structural and thermal properties of frozen dough:Comprehensive studies on alteration of gluten network[J]. Food Hydrocolloids, 2020, 102: 105591.
[18]LI J, ZHU Y, YADAV M P, et al. Effect of various hydrocolloids on the physical and fermentation properties of dough[J]. Food Chemistry, 2019, 271: 165-173.
[19]SKENDI A, PAPAGEORGIOU M, BILIADERIS C G. Effect of barley beta-glucan molecular size and level on wheat dough rheological properties[J]. Journal of Food Engineering, 2009,91(4): 594-601.
[20]LIU X, JIANG Z, MA S,et al. High-level production and characterization of a novel beta-1, 3-1, 4-glucanase from Aspergillus awamori and its potential application in the brewing industry[J]. Process Biochemistry, 2020, 92: 252-260.
[21]EUGENIA STEFFOLANI M, RIBOTTA P D, PEREZ G T, et al.Effect of glucose oxidase, transglutaminase, and pentosanase on wheat proteins: Relationship with dough properties and breadmaking quality[J]. Journal of Cereal Science, 2010, 51(3): 366-373.
[22]LIU L, YANG W, CUI S W, et al. Effects of pentosanase and glucose oxidase on the composition, rheology and microstructure of whole wheat dough[J]. Food Hydrocolloids, 2018, 84:545-551.
[23]RIBOTTA P D, AUSAR S F, BELTRAMO D M, et al.Interactions of hydrocolloids and sonicated-gluten proteins[J].Food Hydrocolloids, 2005, 19(1): 93-99.
[24]FERRER E G, BOSCH A, YANTORNO O, et al. A spectroscopy approach for the study of the interactions of bioactive vanadium species with bovine serum albumin[J]. Bioorganic & Medicinal Chemistry, 2008, 16(7): 3878-3886.
[25]TUHUMURY H C D, SMALL D M, DAY L. The effect of sodium chloride on gluten network formation and rheology[J].Journal of Cereal Science, 2014, 60(1): 229-237.
[26]ZHU Y, WANG Y, LI J, et al. Effects of water-extractable arabinoxylan on the physicochemical properties and structure of wheat gluten by Thermal Treatment[J]. Journal of Agricultural and Food Chemistry, 2017, 65(23): 4728-4735.
[27]WANG P, CHEN H Y, MOHANAD B, et al. Effect of frozen storage on physico-chemistry of wheat gluten proteins: Studies on gluten-, glutenin- and gliadin-rich fractions[J]. Food Hydrocolloids, 2014, 39: 187-194.
[28]ORTIZ S E M, PUPPO M C, WAGNER J R. Relationship between structural changes and functional properties of soy protein isolates-carrageenan systems[J]. Food Hydrocolloids,2004, 18(6): 1045-1053.
[29]TOLSTOGUZOV V. Some thermodynamic considerations in food formulation[J]. Food Hydrocolloids, 2003, 17(1): 1-23.
[30]TANG Y, YANG Y, WANG Q, et al. Combined effect of carboxymethylcellulose and salt on structural properties of wheat gluten proteins[J]. Food Hydrocolloids, 2019, 97: 105189.