类胡萝卜素(Carotenoid)是一类呈黄色、橙红色或红色的多烯类化合物,主要包括β-类胡萝卜素、虾青素、叶黄素和蕃茄红素等[1-3],除具有转化为 VA的生物活性外,还具有预防癌症和心血管疾病等多种生理功能,因此多被应用于功能营养品、化妆品、食品添加剂、动物饲料等领域[4-6]。类胡萝卜素的生产方法主要有动植物材料提取法、化学合成法以及微生物发酵法。动植物材料提取法受到季节、材料品种、生长环境等因素影响很大,而且工艺复杂,成本较高;由于易产生多种副产物,导致化学合成法的安全性受到质疑;微生物发酵法由于成本低,而且合成的类胡萝卜素在构型、活性等方面同天然的类胡萝卜素相一致,因而越来越受到大家的关注[7-13]。随着微生物代谢工程领域及合成生物学的迅速发展,微生物法制造类胡萝卜素的发展及普及将如虎添翼[8-11]。
利用工、农业副产物进行发酵可以降低成本、促进产量提高[14-19],蚕蛹是蚕茧抽丝后的副产物,我国的蚕蛹年产量超过30万t,约占世界总产量的80%[20]。蚕蛹中富含油脂、蛋白质、甲壳素、糖类、维生素、嘌呤以及丰富的微量元素,具有较高的营养保健价值,但由于致敏性以及食用后会引起部分人头晕、恶心、呕吐等不良反应,因而目前食品领域内未见到成熟且商业化的蚕蛹相关产品[21]。蚕蛹粉在作为动物饲料原料时易发生腐败和恶臭,添加剂量不当时,还易使鸡蛋、猪肉和鸡肉带有不良气味,猪肉脂肪变黄;所以长期以来蚕蛹利用率较低,资源浪费较多[22]。
研究表明:细胞积累脂质是提高类胡萝卜素产量的方法之一[12],但类胡萝卜素含量过高会影响细胞生长,所以提高酵母中油脂含量,不仅可以降低产物对细胞生长的影响,同时还可以为类胡萝卜素的合成提供更多的前体[8];酵母如果将过多的葡萄糖用于油脂的合成以提高类胡萝卜素产量,将使原料转化率减低,所以适当添加有机氮源,有利于葡萄糖的充分利用和类胡萝卜素产量的提高[23]。基于以上原因,探索在培养基中添加蚕蛹粉,促进红酵母类胡萝卜素产量的提高,为桑蚕副产物的综合利用和类胡萝卜素的发酵生产工艺优化提供实验依据。
1 材料与方法
1.1 实验材料
红酵母(Rhodotorula sp.):江苏科技大学生物工程实验室保存;蚕蛹,粉碎备用:中国农科院蚕业研究所提供;葡萄糖、蛋白胨、酵母膏,分析纯:国药集团化学试剂有限公司。
1.2 仪器与设备
超净工作台(SW-C-J-1F);苏州安泰空气技术有限公司;精密台式pH计(310P-03):上海杰晟科学仪器有限公司;摇摆粉碎机(HK-20B):杭州旭朗机电有限公司;立式压力蒸汽灭菌器(LDZX-40BI):上海申安医疗器械厂;紫外/可见光分光光度计(UV-9100):北京瑞利分析仪器公司;高速台式离心机(TGL-16G):上海安亭科学仪器厂;恒温摇瓶柜(HYG-A):金坛市精达仪器制造有限公司。
1.3 实验方法
1.3.1 培养基制备
斜面活化及发酵培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L;若配置固体培养基,加入2%(w/v)琼脂粉;121 ℃,15 min灭菌。
1.3.2 单因素实验
在 250 mL的三角瓶中配制发酵培养基50 mL,分别添加不同浓度蚕蛹粉 0、2.5、5.0、7.5、10.0、12.5 g/L(其它单因素实验选择7.5 g/L),不同葡萄糖浓度15、20,25、30、35 g/L(其它单因素实验选择30 g/L),不同培养时间2、2.5、3、3.5、4、4.5 d(其它单因素实验选择4.0 d),发酵液不同初始pH 5.0、6.0、7.0、8.0、9.0(其它单因素实验pH 7.0),接入活化的红酵母1环,200 r/min振荡培养,各3个平行,检测生物量及类胡萝卜素产量,结果取平均值。
1.3.3 正交实验
选择蚕蛹粉浓度、葡萄糖浓度、发酵时间、培养基初始 pH四个因素,每个因素选择三个水平进行正交实验(见表1),各3个平行,检测生物量及类胡萝卜素含量,结果取平均值。
表1 正交实验设计
Table 1 Orthogonal test design
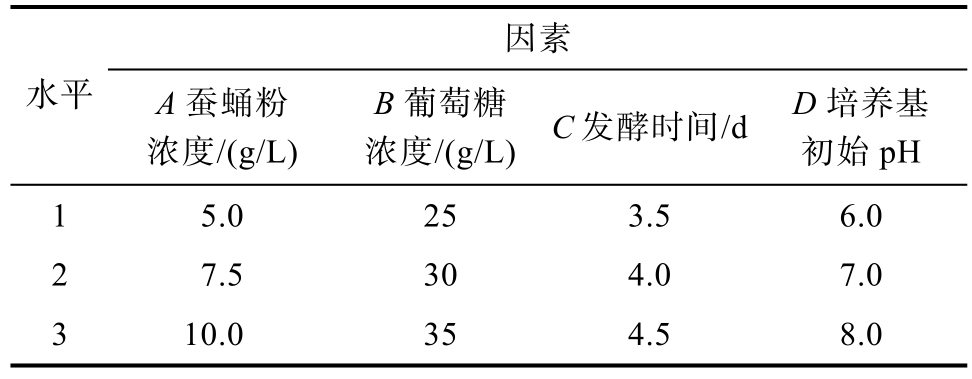
因素水平 A蚕蛹粉浓度/(g/L)浓度/(g/L) C发酵时间/d D培养基初始pH B葡萄糖1 5.0 25 3.5 6.0 2 7.5 30 4.0 7.0 3 10.0 35 4.5 8.0
1.3.4 细胞生物量(Biomass)的测定
将发酵液转入离心管中,8 000 r/min离心3 min,弃上清液,菌体用无菌水洗后再离心,50 ℃左右烘干称重。
1.3.5 类胡萝卜素含量及产量的测定
类胡萝卜素含量参照文献[24]的方法测定,计算公式如下:

式中:Aλmax为类胡萝卜素最大波长处的吸光度;D为色素浸提液稀释倍数;V为浸提所用丙酮的总体积,mL;W为提取所用的发酵培养物重量,g;0.16为胡萝卜素的摩尔消光系数。
类胡萝卜素产量计算方法参照公式:
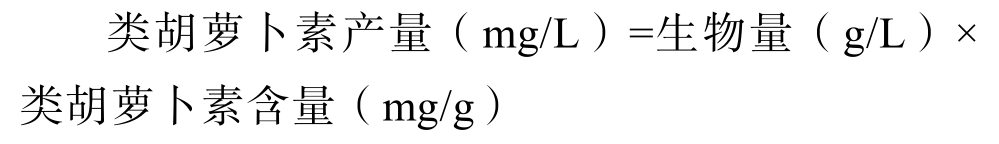
1.4 数据分析
采用Microsoft Excel软件对实验数据进行分析及绘图,每组实验重复3次,结果以(平均值±标准差)表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 蚕蛹粉浓度对类胡萝卜素产量的影响
蚕蛹粉浓度对类胡萝卜素发酵影响的结果见图1,从图1可以看出随着蚕蛹粉浓度的上升,生物量和类胡萝卜素呈先升高后降低的趋势。在蚕蛹粉浓度从0 g/L提高到7.5 g/L时,生物量和类胡萝卜素含量分别从19.23 g/L和513.62 μg/g升高至最大值22.54 g/L和643.67 μg/g,类胡萝卜素产量达到 14.51 mg/L,比蚕蛹粉浓度为 0 g/L时提高了 46.9%。从蚕蛹粉浓度对类胡萝卜素发酵影响的结果看出,不同蚕蛹粉浓度条件下生物量的差异不明显,但是对类胡萝卜素的生产有一定的促进作用。当蚕蛹粉浓度超过7.5 g/L时,生物量和葡糖胺均略有下降,这可能是因为蚕蛹粉浓度过高,对细胞产生一定的抑制作用,所以添加 7.5 g/L的蚕蛹粉对类胡萝卜素的合成促进作用最大。
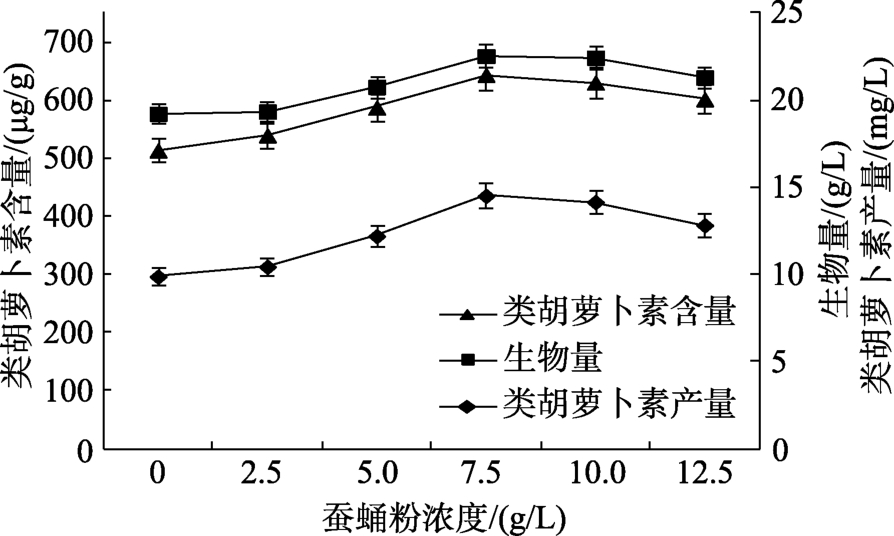
图1 蚕蛹粉对类胡萝卜素发酵的影响
Fig.1 Effects of silkworm pupae powder on carotenoid production
2.1.2 葡萄糖浓度对类胡萝卜素产量的影响
葡萄糖浓度对类胡萝卜素发酵影响的结果见图2,从图2可以看出随着葡萄糖浓度的上升,生物量和类胡萝卜素呈先升高后降低的趋势。在葡萄糖浓度从15 g/L提高到30 g/L时,生物量和类胡萝卜素含量分别从13.50 g/L和537.80 μg/g升高至最大值21.58 g/L和654.12 μg/g,类胡萝卜素产量达到14.12 mg/L,是葡萄糖浓度为15 g/L时产量的1.94倍,且生物量和类胡萝卜素含量差异明显。葡萄糖对生物量和类胡萝卜素的生产均有一定的影响,当葡萄糖浓度超过30 g/L时,由于生物量出现下降趋势从而导致了类胡萝卜素产量的下降,这是因为葡萄糖浓度过高,对细胞生长产生一定的影响,所以添加30 g/L的葡萄糖对类胡萝卜素的生产较为合适。由于红酵母对纤维素的利用能力有限[25],所以添加还原糖对促进红酵母生物量的提高作用明显,在生物量提高的基础上,通过添加富含蛋白和脂肪的蚕蛹粉将有利于提高红酵母细胞中油脂的含量,而较高的油脂含量将为类胡萝卜素的合成提供更多的前体乙酰辅酶 A,因此促进了胡萝卜素的合成,说明葡萄糖和蚕蛹粉是红酵母发酵生产类胡萝卜素的良好的碳源和氮源。
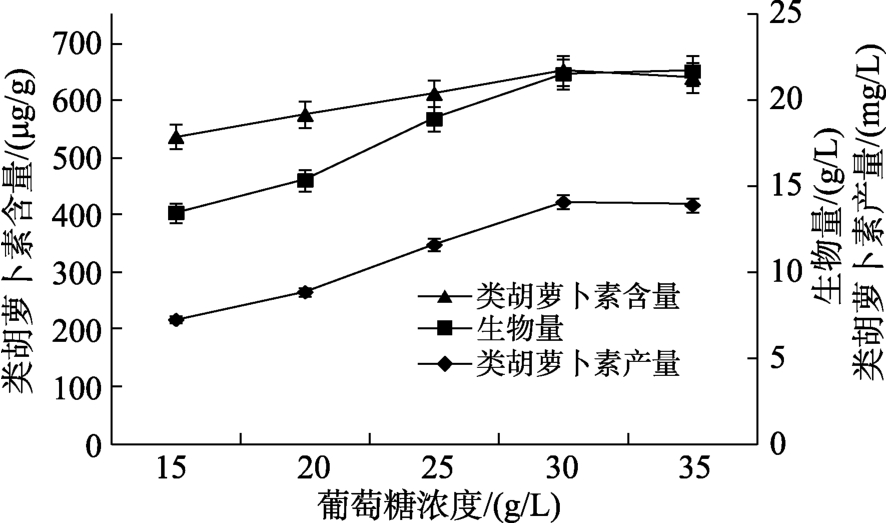
图2 葡萄糖浓度对类胡萝卜素发酵的影响
Fig.2 Effects of glucose concentration on carotenoid production
2.1.3 培养时间对类胡萝卜素产量的影响
培养时间对类胡萝卜素发酵影响的结果见图3,从图3可以看出随着培养时间的延长,生物量和类胡萝卜素呈先升高后降低的趋势。培养时间从2延长到4 d时,生物量和类胡萝卜素含量分别从 5.70 g/L和 303.09 μg/g提高至最大值20.33 g/L和 632.45 μg/g,类胡萝卜素产量达到12.86 mg/L,是培养时间2 d时的7.43倍。生物量和类胡萝卜素含量随着培养时间的延长增加较为明显,说明培养时间对生物量和类胡萝卜素的生产均有较大的影响。这是由于类胡萝卜素是次生代谢产物,培养时间太短不利于生物量的提高和类胡萝卜素的积累。当培养时间继续延长,生物量和类胡萝卜素含量略有下降,所以培养时间为4 d时对类胡萝卜素的生产较为合适。
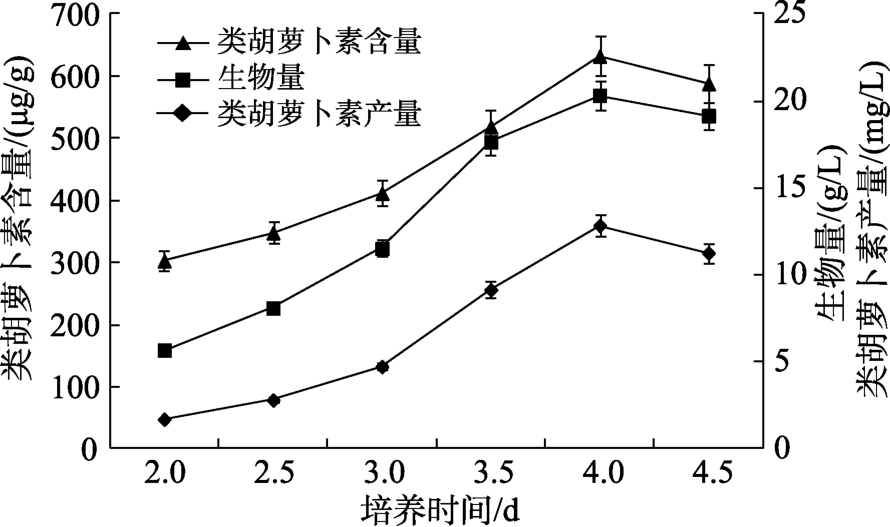
图3 培养时间对类胡萝卜素发酵的影响
Fig.3 Effects of cultural time on carotenoid production
2.1.4 培养基初始pH对类胡萝卜素产量的影响
培养基初始 pH对类胡萝卜素发酵影响的结果见图4,从图4可以看出随着培养基初始pH从5.0升高至9.0,生物量和类胡萝卜素含量呈先增加后降低的趋势。培养基初始 pH从 5.0升高至7.0时,生物量和类胡萝卜素含量分别从9.77 g/L和 379.02 μg/g提高至最大值 19.69 g/L和614.27 μg/g,类胡萝卜素产量达到 12.09 mg/L,是培养基初始pH5.0时的3.27倍。生物量和类胡萝卜素的产量受培养基初始 pH的影响也较大。这一方面是由于培养基初始 pH影响菌体生长,另一方面,pH也可能影响菌体对蚕蛹粉的利用,结果表明中性略偏酸有利于红酵母生物量和类胡萝卜素产量的提高,培养基初始pH7.0时对类胡萝卜素的生产较为合适。
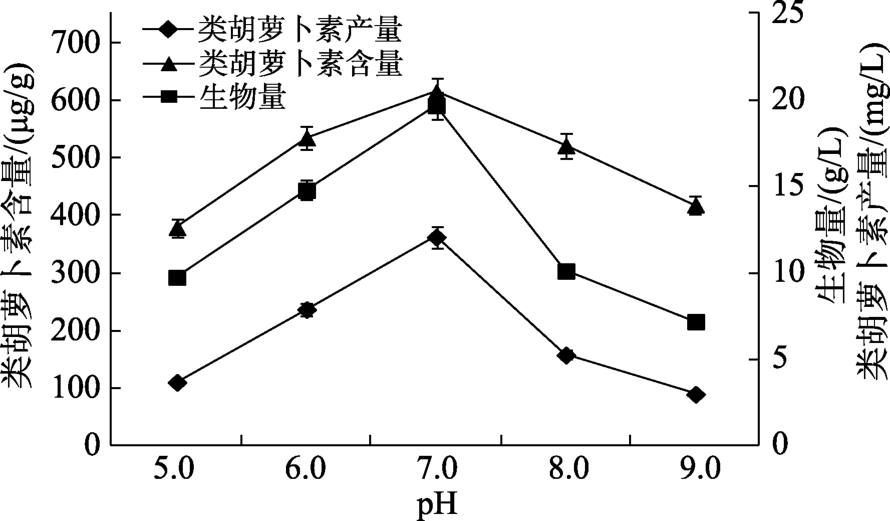
图4 培养基初始pH对类胡萝卜素发酵的影响
Fig.4 Effects of initial pH of fermentation medium on carotenoid production
2.2 正交实验结果
正交实验结果见表2,从表2可以看出培养时间对类胡萝卜素的产量影响最大,蚕蛹粉浓度次之,而培养基初始 pH对类胡萝卜素的产量影响最小,即各因素对类胡萝卜素发酵产量的影响大小顺序为:培养时间>蚕蛹粉浓度>葡萄糖浓度>培养基初始pH。从极差R可知,最佳提取条件组合为A2B2C2D1,即蚕蛹粉浓度0.75%、葡萄糖浓度30 g/L、培养时间4.0 d、培养基初始pH 6.0时,类胡萝卜素产量最大达到14.70 mg/L。在此条件下进行发酵实验验证,类胡萝卜素产量为14.88 mg/L,较单因素实验最高产量提高0.37 mg/L。
表2 正交实验结果
Table 2 Results of orthogonal experiments

注:R以类胡萝卜素产量为指标进行计算。
Note: The R-value is calculated with the yield of carotenoid.
试验号 A蚕蛹粉浓度/% B葡萄糖浓度/(g/L) C培养时间/d D培养基初始pH 生物量/(g/L)1 0.5 25 3.5 6.0 18.77 2 0.5 30 4.0 7.0 21.37 3 0.5 35 4.5 8.0 19.64 4 0.75 25 4.0 8.0 20.61 5 0.75 30 4.5 6.0 22.57 6 0.75 35 3.5 7.0 18.97 7 1.00 25 4.5 7.0 18.47 8 1.00 30 3.5 8.0 17.5 9 1.00 35 4.0 6.0 20.45 K1 34.90 33.68 32.14 37.54 K2 38.83 38.14 38.29 36.04 K3 33.74 35.65 37.05 33.88 k1 11.63 11.23 10.71 12.51 k2 12.94 12.71 12.76 12.01 k3 11.25 11.88 12.35 11.29极差R 1.70 1.49 2.05 1.22类胡萝卜素含量/(μg/g) 类胡萝卜素产量/(mg/L)546.9 10.27 622.45 13.30 577.21 11.34 601.78 12.40 651.19 14.70 618.29 11.73 596.22 11.01 579.61 10.14 615.19 12.58
3 结论
(1)单因素实验结果表明:葡萄糖和蚕蛹粉是红酵母发酵生产类胡萝卜素的良好碳源和氮源,添加7.5 g/L的蚕蛹粉和30 g/L的葡萄糖时,类胡萝卜素产量最高;培养时间太短不利于生物量的提高和类胡萝卜素的积累,当培养时间达到4 d时,类胡萝卜素的产量最高;菌体生长受培养基初始 pH影响较大,中性略偏酸有利于红酵母生物量和类胡萝卜素产量的提高。
(2)正交实验结果显示:各因素对类胡萝卜素发酵产量的影响大小顺序为:培养时间>蚕蛹粉浓度>葡萄糖浓度>培养基初始 pH。从极差 R可知,最佳提取条件组合为A2B2C2D1,即蚕蛹粉浓度7.5 g/L、葡萄糖浓度30 g/L、培养时间4.0 d、培养基初始pH6.0时,类胡萝卜素产量最大达到14.70 mg/L。
(3)在正交实验结果的条件下进行实验验证,类胡萝卜素产量为14.88 mg/L,较单因素实验最高产量提高0.37 mg/L,实验结果为桑蚕副产物的综合利用和类胡萝卜素的发酵生产工艺优化提供实验依据。
[1]NIU F X, LU Q, BU Y F, et al. Metabolic engineering for the microbial production of isoprenoids: Carotenoids and isoprenoidbased biofuels[J]. Synthetic and Systems Biotechnology, 2017,2(3): 167-175.
[2]LI C, SWOFFORD C A, SINSKEY A J. Modular engineering for microbial production of carotenoids[J]. Metabolic Engineering Communications, 2020, 10: e00118.
[3]LOPEZ-ROMERO J, SALGADO-MANJARREZ E, TORRES L, et al. Enhanced carotenoid production by Rhodopseudomonas palustris ATCC 17001 under low light conditions[J]. Journal of Biotechnology, 2020, 323: 159-165.
[4]CARDOSO L A C, JAKEL S, KARP S G, et al. Improvement of sporobolomyces ruberrimus carotenoids production by the use of raw glycerol[J]. Bioresource Technology, 2016, 200: 374-379.
[5]BONADIO M P, FREITA L A, MUTTON M J R. Carotenoid production in sugarcane juice and synthetic media supplemented with nutrients by rhodotorula rubra l02[J]. Brazilian Journal of Microbiology, 2018, 49(4): 872-878.
[6]REHMAN A, TONG Q, JAFARI S M, et al. Carotenoidloaded nanocarriers: a comprehensive review[J]. Advances in Colloid and Interface Science, 2020, 275:102048.
[7]SILVA P G P, JUNIOR D P, SALA L, et al. Magnetic field as a trigger of carotenoid production by Phaffia rhodozyma[J].Process Biochemistry, 2020, 98: 131-138.
[8]马田,陈智莉,黄敏坚. 合成微生物技术促进类胡萝卜素产品的高效合成[J]. 生物产业技术, 2019, 1: 27-33 MA T,CHEN Z L, HUANG M J, et al. Promotion of synthetic microbial technology in carotenoids overproduction[J]. Biotechnology& Business, 2019, 1: 27-33.
[9]KRISTIANSDOTTIR T, RON E Y C, MOLINS-DELGADO D,et al. Engineering the carotenoid biosynthetic pathway in Rhodothermus marinus for lycopene production[J]. Metabolic Engineering Communications. 2020, 11: e00140
[10]RAM S, MITRA M, SHAH F, et al. Bacteria as an alternate biofactory for carotenoid production: a review of its applications,opportunities and challenges[J]. Journal of Functional Foods.2020, 67: 103867
[11]YAMAD R, YAMAUCHI A, ANDO Y, et al. Modulation of gene expression by cocktail δ-integration to improve carotenoid production in Saccharomyces cerevisiae[J]. Bioresource Technology. 2018, 268: 616-621.
[12]王颖,曲俊泽,梁楠等. 合成类胡萝卜素细胞工厂的快速构建和定向进化[J]. 化工进展, 2021, 40(3): 1187-1201.WANG Y,QU J Z,LIANG N, et al. Rapid construction and directed evolution of cell factories for carotenoid biosynthesis[J].Chemical Industry and Engineering Progress, 2021, 40(3): 1187-1201.
[13]SUN D Z, ZHANG Z, ZHANG Y, et al. Light induces carotenoids accumulation in a heterotrophic docosahexaenoic acid producing microalga, Crypthecodinium sp. SUN[J].Bioresource Technology. 2019, 276:177-182
[14]KALRA R, GAUR S, GOEL M. Microalgae bioremediation: a perspective towards wastewater treatment along with industrial carotenoids production[J]. Journal of Water Process Engineering.2021, 40: 101794
[15]SHARMA R, GHOSHAL G. Optimization of carotenoids production by Rhodotorula mucilaginosa (MTCC-1403) using agro-industrial waste in bioreactor: a statistical approach[J].Biotechnology Reports. 2020, 25: e00407
[16]KOT A M, BLAZEIAKA S, KIELISZEK M, et al. Production of lipids and carotenoids by Rhodotorula gracilis ATCC 10788 yeast in a bioreactor using low-cost wastes[J]. Biocatalysis and Agricultural Biotechnology. 2020, 26: 101634
[17]WANG X, ZHANG M M, LIU S F, et al. Synergistic bioconversion of lipids and carotenoids from food waste by Dunaliella salina with fulvic acid via a two-stage cultivation strategy[J]. Energy Conversion and Management. 2021, 234(15):113908
[18]MOREIRA M D, MELO M M, COIMBRA J M, et al. Solid coffee waste as alternative to produce carotenoids with antioxidant and antimicrobial activities[J]. Waste Management .2018, 82: 93-99
[19]VILLEGAS-MENDEZ M Á, AGUILAR-MACHADO D E,BALAGURUSAMY N, et al. Agro-industrial wastes for the synthesis of carotenoids by Xanthophyllomyces dendrorhous:mesquite pods-based medium design and optimization[J]. Waste Management. 2019, 150(15): 107260
[20]吴钊龙,林芳,陈振林,等. 蚕蛹变温压差膨化干燥工艺优化[J]. 食品研究与开发,2021,42(5): 153-158.WU Z L, LIN F, CHEN Z L, et al. Optimization of explosion puffing drying process for silkworm pupa at variable temperatures and pressure difference[J]. Food Research and Development, 2021, 42(5): 153-158.
[21]谢盛莉,张宇昊,马良, 等. 蚕蛹油和蚕蛹蛋白组成及潜在过敏原分布研究 [J]. 中国油脂,2020, 45(1): 31-37.XIE S L, ZHANG Y H, MA L, et al. Compositions of silkworm pupa oil and protein and potential allergen distribution[J]. China Oils and Fats. 2020, 45, 1: 31-37.
[22]王水军, 贾晓虎, 胡丹. 蚕蛹在鱼类饲料中的应用进展[J]. 四川蚕业, 2019, 47(4): 42-44.WANG S J, JIA X H, HU D. Progress on the application of silkworm pupae in fish feed[J]. Sichuan Canye. 2019, 47(4):42-44.
[23]王蓉,曹海宁,李娟. 不同碳氮比对黏性红酵母WP3生长及类胡萝卜素合成的影响[J]. 科技创新与生产力, 2020, 315:64-68.WANG R, CAO H N, LI J. Effects of different C/N ratios on Rhodotorula Mucilaginosa WP3 biomass and carotenoids accumulation[J]. Sci-tech Innovation and Productivity, 2020,315: 64-68.
[24]ZHU Y Q, LU W Q, YE L D, et al. Enhanced synthesis of coenzyme Q10 by reducing the competitive production of carotenoids in Rhodobacter sphaeroides[J]. Biochemical Engineering Journal. 2017: 125: 50-55.
[25]王宁, 杨继业, 陈书明, 等. 红酵母发酵豆腐渣产类胡萝卜素工艺优化[J]. 农业工程学报, 2020, 36(9): 323-330.WANG N, YANG J Y, CHEN S M, et al. Optimization of the process for carotenoid production from bean curd residue fermented by Rhodotorula[J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(9): 323-330.