储粮害虫为害是威胁我国粮食安全的因素之一,害虫的爆发不仅会造成粮食损失,它们的排泄物、尸体等还会使粮食发霉变质,甚至产生人体有害的物质。因此我国储粮防治迫切需要新型、绿色、安全和高效的防治技术。
丁烯基多杀菌素(butenyl-spinosyns)是好氧型菌须糖多孢菌(Saccharopolyspora pogona)的次级代谢产物,由糖苷配基和两侧糖基(侧链糖基一般为鼠李糖基团和福乐糖胺基团)构成的一种大环内酯类抗生素。其与美国陶氏益农公司上市的多杀菌素(spinosyns)结构相似且杀虫机制相同,对多杀菌素难以控制的鳞翅目中烟青虫、苹果小卷叶蛾等,鞘翅目中的马铃薯甲虫及半翅目中的苹果蠹蛾能有效毒杀,是一种具有潜在应用价值的新一代多杀菌素类生物杀虫剂。
郭超[1]等从 162份土壤样品中,分离得到15 000余株放线菌建立放线菌库,利用蚊子幼虫生物测定法筛选产多杀菌素及其结构类似物,获得1株产丁烯基多杀菌素的菌株,并完成了16 s RNA鉴定、全基因组序列测定、理化诱变等研究工作。但从环境中筛选得到的野生型菌株存在着生长缓慢、生物量较低、发酵过程调控难等缺点,导致菌株性能达不到工业化生产和应用需求。因此采用适当的选育手段筛选高产突变株并对其发酵工艺进行优化,提高其发酵能力成为目前研究的重点。
常压室温等离子体(Atmospheric and room temperature plasma,ARTP)诱变育种仪以氦气作为工作气体,在大气压的作用下产生高浓度活性粒子的等离子体射流[2],使DNA单链或者双链发生断裂,造成 DNA损伤,进而诱发细胞启动应急修复机制,引起微生物突变[3]。ARTP诱变技术极大程度地加快了微生物诱变育种的进程,在菌种改良及微生物合成能力等方面有广泛应用。田萍萍等[4]对阿维菌素进行 ARTP诱变筛选,结果证实ARTP技术能显著提高代谢产物产量。
由于培养基中的碳源对菌丝体生长及次生代谢产物合成有着重要作用。对发酵培养基的碳、氮源进行优化,是提高丁烯基多杀菌素产量最行之有效的方法。借助响应曲面分析方法可通过较少的实验次数获得最优工艺参数,从而有效的确定最优培养基配方。陈爽[5]对发酵培养基中葡萄糖、可溶性淀粉、糊精和甘露醇复合搭配后,优化后使丁烯基多杀菌素产量提高 52.1%。夏立秋团队[6]对11种常见碳源进行代谢途径分析,以5 g/L的甘露糖作为单一碳源添加时,显著提高了丁烯基多杀菌素产量1.78倍。这可能是因为甘露糖除能产生乙酰-CoA外,还能转化 GDP-D-rhamnose,而鼠李糖正是形成细胞壁和丁烯基多杀菌素的重要前体。
目前国内外对于丁烯基多杀菌素高产菌株选育和发酵调控方面的研究较少,但其结构类似物多杀菌素在菌株诱变选育[7-9]、分子生物学改造[10-12]、发酵培养基优化[13-15]等方面的研究较为深入,相信借鉴其研究经验对于丁烯基多杀菌素的提产具有重要意义。本文以ASAGF 2-G4作为研究对象,对该菌株进行ARTP和NTG复合理化诱变选育,筛选出稳定遗传且高产的突变菌株,对其发酵培养基配方优化,以期进一步提高丁烯基多杀菌素产量。
1 材料与方法
1.1 实验材料
1.1.1 出发菌株
ASAGF 2-G4由国家粮食和物资储备局科学研究院筛选和保藏。
1.1.2 培养基的配制和培养方法
(1)固体产孢培养基(g/L):葡萄糖4.0,酵母提取物4.0,麦芽提取物10.0,CaCO3 2.0,琼脂20.0,pH7.2。(2)摇瓶培养基S2及96孔板种子培养基(g/L):葡萄糖10.0,FM888 30.0,胨化牛奶 5.0,MgSO4·7H2O 2.0,KH2PO4 0.5,pH7.2。(3)摇瓶及 96孔板发酵培养基(g/L):葡萄糖10.0,糊精 20.0,玉米浆干粉 10.0,MgSO4·7H2O 1.0,胨化牛奶10.0,棉籽蛋白20.0,CaCO3 5.0,NaCl 2.0,pH7.2。以上培养基均在115 ℃,灭菌20 min。
1.1.3 主要试剂和仪器
棉籽蛋白、玉米浆干粉:西格玛奥德里奇(上海)贸易有限公司;FM888:安琪酵母股份有限公司;其他试剂:国药集团化学试剂北京有限公司。
1.2 实验方法
1.2.1 制备孢子悬液
取培养成熟的新鲜菌种斜面,加入 20 mL 0.02%无菌葡萄糖溶液冲洗斜面,将表面的孢子刮下后置于含15~20颗玻璃珠的无菌三角瓶中,置于恒温恒湿摇床,设置摇床转速为160 r/min,温度为28 ℃培养8~12 h,孢子悬液浓度一般控制在约108个/mL。
1.2.2 ARTP诱变
实验前预先将一定数量载片灭菌,置于酒精灯外焰灼烧30 s,冷却后取10 μL孢子液均匀涂于载片。以氦气作为等离子体的工作气体,以ASAGF 2-G4为出发菌株,在电源功率100 W,照射距离 2 mm,等离子体温度<30 ℃,气流量10 L/min的条件下,分别将孢子悬液处理进行等离子体照射 0、30、60、90、120、150、180、210、240、270、300 s。
1.2.3 NTG诱变
配制10 mg/mL的NTG母液。取萌发好的孢子悬浮液于离心管中,使诱变终浓度为2 mg/mL。将孢子悬液分别处理 10、20、30、40、50、60 min,14 000 r/min离心10 min收集孢子,无菌水重复洗涤三次。处理后的溶液移入饱和硫代硫酸钠溶液中。
1.2.4 稀释涂布
将经诱变处理的孢子悬液进行 10-2~10-6稀释,取100 μL稀释液涂布于预先倒置好的平面培养基上,于 30 ℃培养,每日观察菌落的生长速度和菌落形态,并拍摄特殊形态的菌落。
1.2.5 96 孔板高通量发酵培养
将 96孔板的种子培养基和发酵培养基在无菌条件下,使用美国RAININ BenchSmart 96半自动移液系统分装至96深孔板中,装液量600 μL。用无菌牙签挑取生长速度快、形态特殊的单菌落于96孔板中,盖上配套的三明治盖,在恒温恒湿摇床上设置240 r/min,30 ℃进行96孔板种子培养,培养65 h后转接二级种子液,培养48 h后转接发酵摇瓶培养9~10 d。
1.2.6 丁烯基多杀菌素测定法
向96孔板发酵液中,加入2倍体积甲醇浸提丁烯基多杀菌素,充分振荡后,4 ℃静置过夜。以4 000 r/min离心10 min,取上清液1 mL至新的离心管管内,以10 000 r/min,离心10 min后进行 HPLC检测。分析条件为:安捷伦 C18反相柱;流动相为 V 乙腈∶V 甲醇∶V 水=45∶45∶10(含0.05%乙酸铵);进样量设置10 μL;流速设置1.0 mL/min;检测波长为244 nm。根据积分面积,计算产量。
1.2.7 丁烯基多杀菌素产量性状遗传稳定性实验
将获得的高产菌株连续划斜面试管进行摇瓶验证,转接3~4次,利用HPLC测丁烯基多杀菌素发酵产量,转接几代后产量变化幅度不大的则认为遗传稳定性较好。
1.2.8 Plackett-Burman实验设计
设计 PB实验,从发酵培养基中快速筛选出显著因素,筛选设计了影响因素主要是葡萄糖、糊精、棉籽蛋白、玉米浆干粉、MgSO4、胨化牛奶、NaCl和CaCO3,考察影响丁烯基多杀菌素含量的主导因素及交互作用,筛选出主要因素。Plackett-Burman实验各因素水平见表1。
表1 Plackett-Burman实验因素水平
Table 1 The factors and level of the Plackett-Burman design g/L
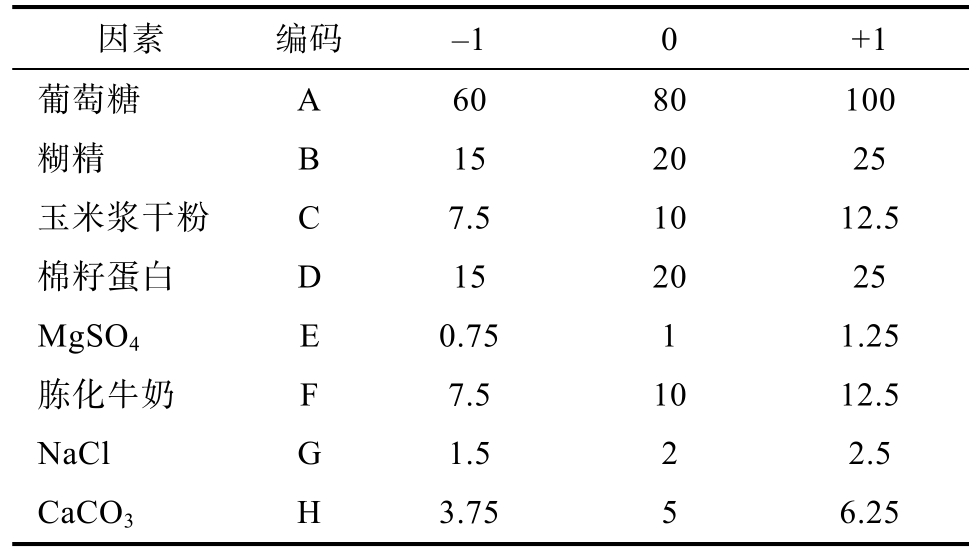
因素 编码 -1 0 +1葡萄糖 A 60 80 100糊精 B 15 20 25玉米浆干粉 C 7.5 10 12.5棉籽蛋白 D 15 20 25 MgSO4 E 0.75 1 1.25胨化牛奶 F 7.5 10 12.5 NaCl G 1.5 2 2.5 CaCO3 H 3.75 5 6.25
1.2.9 Box-Behnken响应面设计优化
根据Plackett-Burman实验所得的回归方程系数与筛选到的影响显著因素,确定响应面设计的考察因素与中心点。
1.3 数据分析
数据处理采用Origin 8.0、SPSS 22.0、Excel等软件进行分析。在系统误差允许存在的情况下,当突变菌株丁烯基多杀菌素产量与出发菌株产量的比值不低于110%时,则菌株表现为正突变;当比值不高于90%时,则菌株表现为负突变;当比值介于两者之间时,则表示菌株未突变。
突变率=正突变率+负突变率;致死率(%)=(未经诱变的总单菌落数-诱变后的总单菌落数)/未经诱变的总菌落数×100%;丁烯基多杀菌素产量(μg/mL)=(组分 A+组分 D)/8065.4032×稀释倍数;丁烯基多杀菌素相对产量=平均值±标准偏差。
2 结果与分析
2.1 ARTP与NTG复合诱变对ASAGF 2-G4的作用
2.1.1 ARTP诱变时间对ASAGF 2-G4的影响
由图1可知,随着等离子体照射时间的不断延长,致死率逐渐增加,且致死效果非常显著,ARTP处理90 s时,致死率已达到98%以上。对2-G4的突变率进行分析发现(如图2),整体的正突变率趋势为逐渐升高,而负突变率则是随着诱变时间的延长不断减小,在 300 s等离子体照射剂量下,筛选到的正突变菌株最多,当诱变时间高于20 min时没有正突变菌株出现。
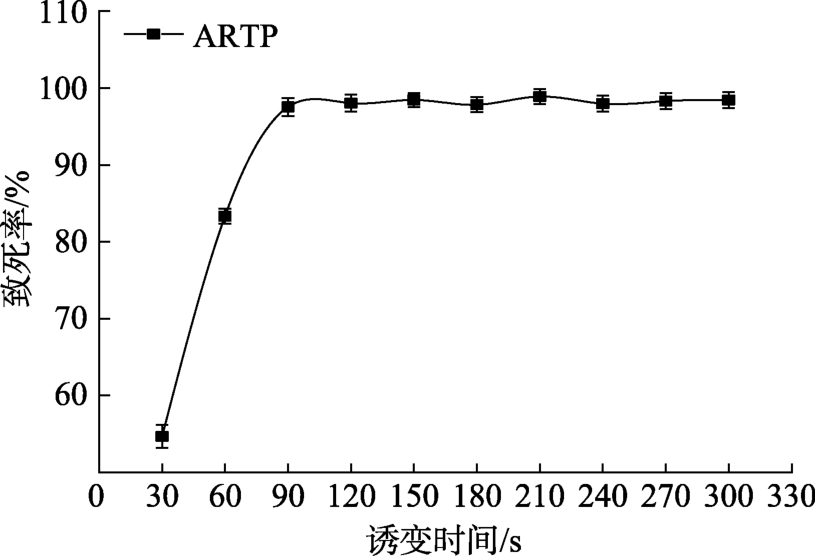
图1 ARTP对菌株2-G4诱变的致死率曲线
Fig. 1 The lethal rate of different time by ARTP on strain 2-G4
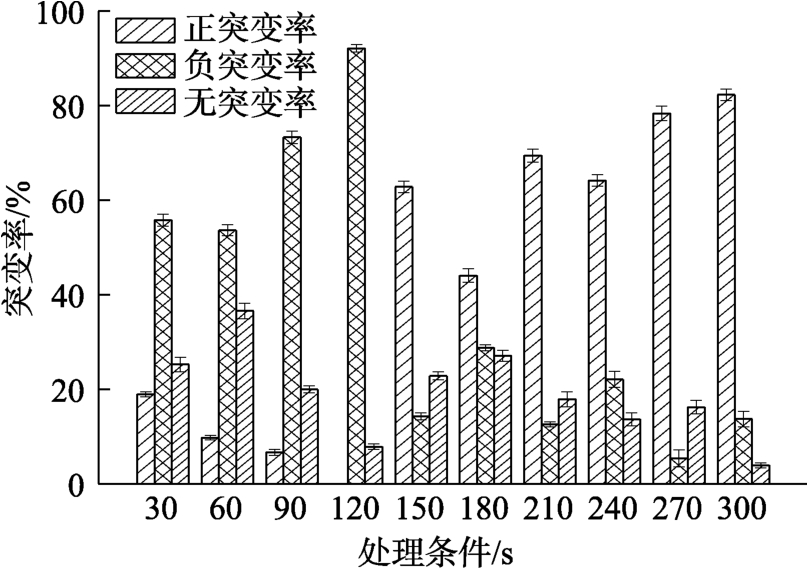
图2 不同剂量ARTP对2-G4突变率的影响
Fig. 2 Mutation rate of 2-G4 when the strain was treated by ARTP radiation in different time
2.1.2 ARTP与NTG复合诱变对2-G4的影响
由图3可知,ARTP和NTG复合诱变对2-G4的致死效应明显,当2 mg/mL的NTG处理10 min时2-G4的致死率已高达98%。对2-G4的突变率进行分析发现(如图4),在10 min和20 min诱变时间下,筛选到的正突变菌株较多。
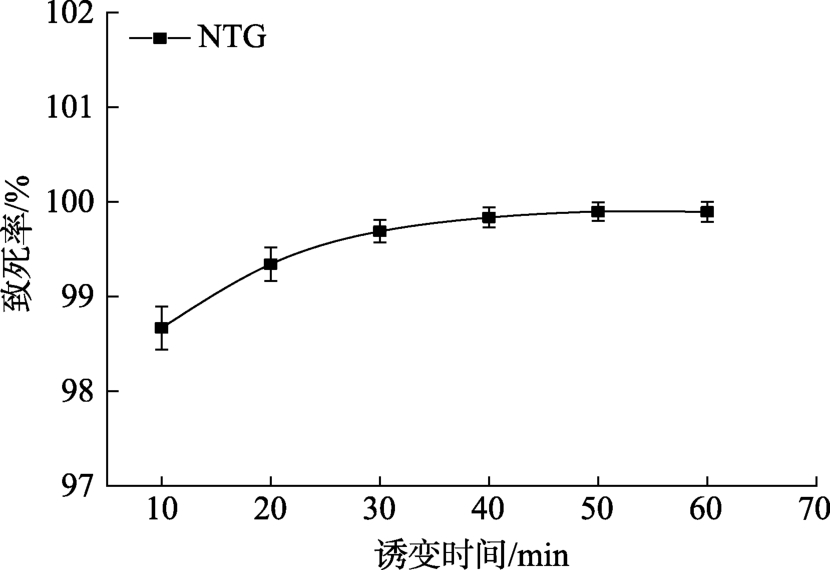
图3 ARTP与NTG复合诱变对菌株2-G4的致死率曲线
Fig. 3 The lethal rate of different time by ARTP and NTG compound on strain 2-G4
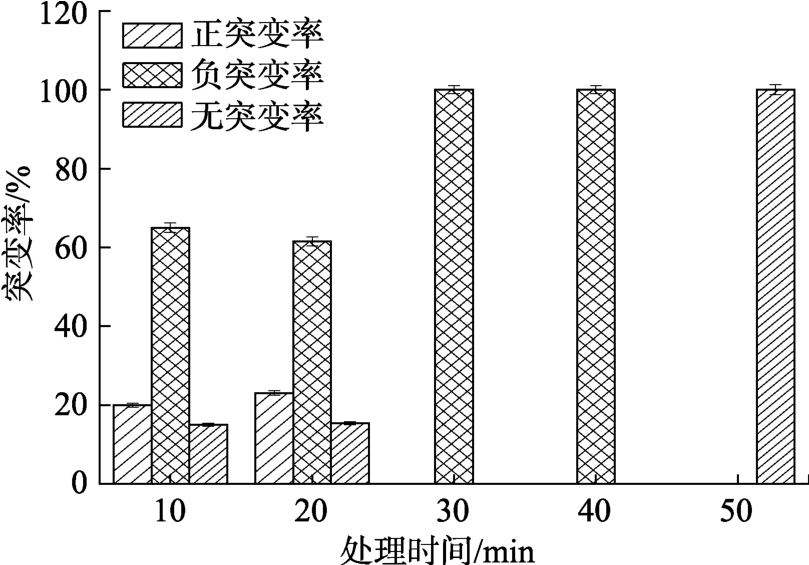
图4 不同时间ARTP对2-G4突变率的影响
Fig. 4 Mutation rate of 2-G4 when the strain was treated by ARTP and NTG compound radiation in different time
2.1.3 高产突变株代谢曲线的考察
本研究以2-G4为出发菌株进行ARTP和NTG复合诱变,挑取870余单菌落进行发酵培养,经过摇瓶初筛和复筛,丁烯基多杀菌素高产菌株编号及产量如表2所示。突变株在传代中可能出现表型延迟现象,因此,对5株高产菌株进行了遗传稳定性验证,如图5所示。突变菌株2-A9经过3次转接传代后,丁烯基多杀菌素相对产量分别降低了 10.03%、8.05%,第 4次转接产量较第 3次提高了0.68%;与转接1次相比,突变株5-H12转接 2、3、4次分别降低了 35.29%、30.43%、12.51%,产量变化幅度较大,表明其遗传稳定性较差。其余菌株与 2-A9菌株相比产量较低。ASAGF 2-G4菌株经ARTP诱变处理60 s后筛选出 1株发酵产量较高,且稳定遗传的突变菌株2-A9,比出发菌株提高30.92%。

图5 突变株的遗传稳定性验证
Fig. 5 The genetic stability of mutants
表2 高产突变株的丁烯基多杀菌素产量
Table 2 The butenyl-spinosyns production of the high yield mutant strain by shake flask culture %

菌株 复筛后丁烯基多杀菌素相对产量2-A9 130.64±1.09 3-D10 116.65±1.82 5-H2 127.56±6.06 5-H12 141.04±0.86 7-A9 126.40±1.16
2.2 发酵培养基优化对ASAGF 2-G4的作用
2.2.1 Plackett-Burman实验设计
利用Design-Expert软件进行优化处理,结果如表3和表4所示。模型F值为12.608 8,模型极显著(P<0.01)表明该模型具有重要意义,R2Adj=0.885 573,说明该实验数据较好的用于模型解释。产量影响因素依次为 A>D>C>B>F>E>H>G,其中A、D对产量影响极显著(P<0.01),B、C对产量影响显著(P<0.05),胨化牛奶对产量的影响接近显著水平。获得一次多元线性编码方程:21.35-1.65A+0.75B+1.04C+1.20D-0.40E-0.63F-0.07G-0.32H。
表3 Plackett Burman实验设计结果
Table 3 Plackett-Burman experiment design and response values
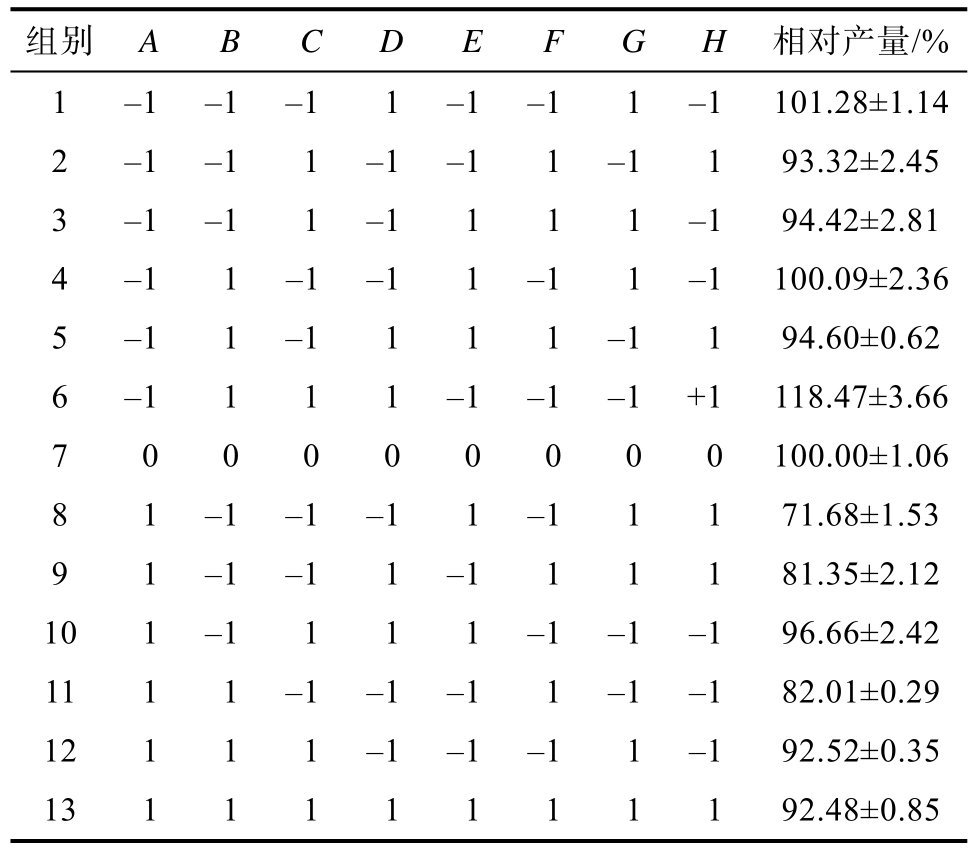
组别 A B C D E F G H 相对产量/%1 -1 -1 -1 1 -1 -1 1 -1 101.28±1.14 2 -1 -1 1 -1 -1 1 -1 1 93.32±2.45 3 -1 -1 1 -1 1 1 1 -1 94.42±2.81 4 -1 1 -1 -1 1 -1 1 -1 100.09±2.36 5 -1 1 -1 1 1 1 -1 1 94.60±0.62 6 -1 1 1 1 -1 -1 -1 +1 118.47±3.66 7 0 0 0 0 0 0 0 0 100.00±1.06 8 1 -1 -1 -1 1 -1 1 1 71.68±1.53 9 1 -1 -1 1 -1 1 1 1 81.35±2.12 10 1 -1 1 1 1 -1 -1 -1 96.66±2.42 11 1 1 -1 -1 -1 1 -1 -1 82.01±0.29 12 1 1 1 -1 -1 -1 1 -1 92.52±0.35 13 1 1 1 1 1 1 1 1 92.48±0.85
表4 Plackett-Burman实验设计方差分析
Table 4 Analysis of variance of Plackett-Burman design
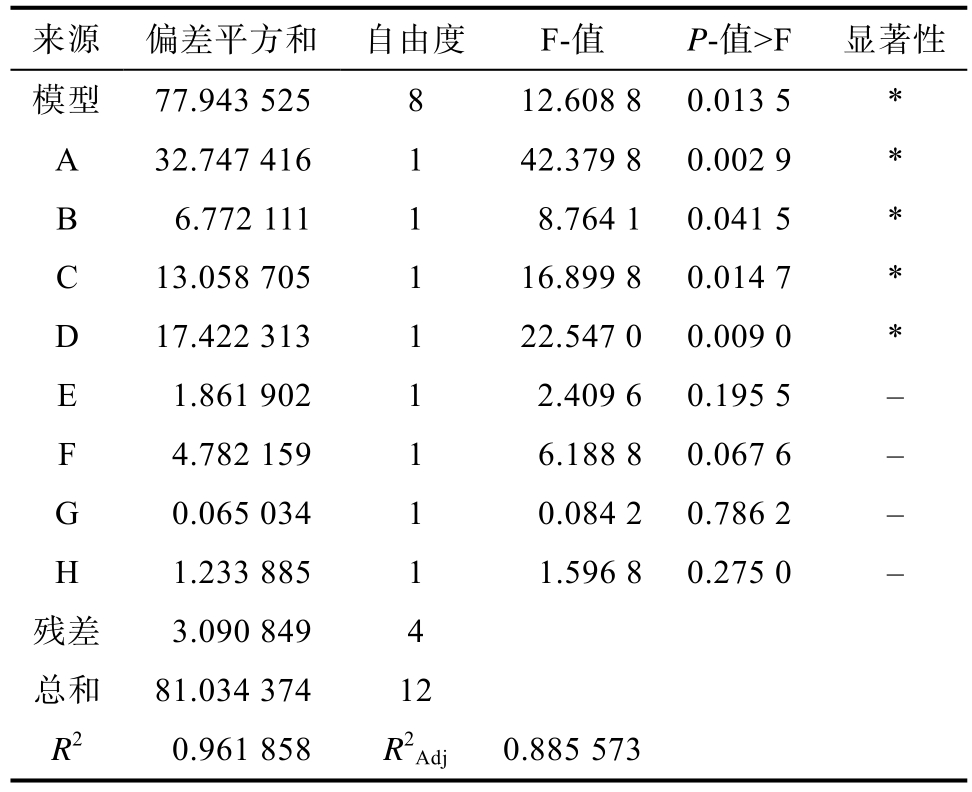
注:*表示P<0.05,显著。
Note: * indicates P<0.05, significant.
来源 偏差平方和 自由度 F-值 P-值>F 显著性模型 77.943 525 8 12.608 8 0.013 5 *A 32.747 416 1 42.379 8 0.002 9 *B 6.772 111 1 8.764 1 0.041 5 *C 13.058 705 1 16.899 8 0.014 7 *D 17.422 313 1 22.547 0 0.009 0 *E 1.861 902 1 2.409 6 0.195 5 -F 4.782 159 1 6.188 8 0.067 6 -G 0.065 034 1 0.084 2 0.786 2 -H 1.233 885 1 1.596 8 0.275 0 -残差 3.090 849 4总和 81.034 374 12 R2 0.961 858 R2Adj 0.885 573
因此,选取葡萄糖、糊精、棉籽蛋白和玉米浆干粉4个因素进行响应面设计。
2.2.2 响应面法优化发酵培养基
2.2.2.1 响应面优化及分析 根据生成的3D图,如图6所示,其最佳浓度分别为:葡萄糖60 g/L、糊精 25 g/L、棉籽蛋白 25 g/L和玉米浆干粉12.5 g/L,预测得到丁烯基多杀菌素达最高值。

图6 葡萄糖、糊精、玉米浆干粉、棉籽蛋白浓度交互作用对丁烯基多杀菌素产量影响的响应面
Fig. 6 Response surface plots of effects of interaction between of glucose、dextrin、corn steed solids and cottonseed protein content on the yield of butenyl-spinosyns
表5 回归模型方差分析
Table 5 Variance analysis of regression model
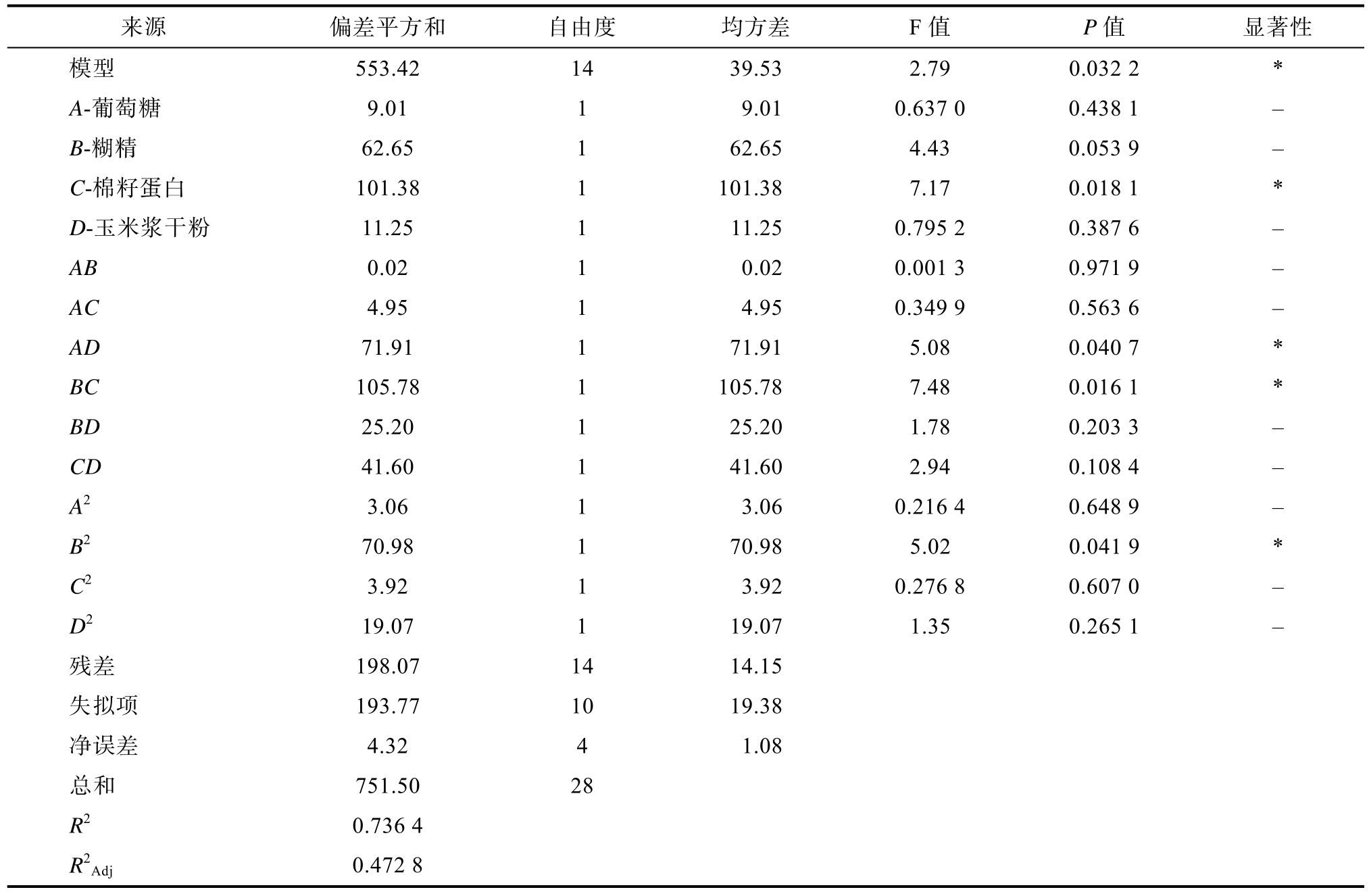
注:*表示p<0.05,显著。
Note: * indicates p<0.05, significant.
来源 偏差平方和 自由度 均方差 F值 P值 显著性模型 553.42 14 39.53 2.79 0.032 2 *A-葡萄糖 9.01 1 9.01 0.637 0 0.438 1 -B-糊精 62.65 1 62.65 4.43 0.053 9 -C-棉籽蛋白 101.38 1 101.38 7.17 0.018 1 *D-玉米浆干粉 11.25 1 11.25 0.795 2 0.387 6 -AB 0.02 1 0.02 0.001 3 0.971 9 -AC 4.95 1 4.95 0.349 9 0.563 6 -AD 71.91 1 71.91 5.08 0.040 7 *BC 105.78 1 105.78 7.48 0.016 1 *BD 25.20 1 25.20 1.78 0.203 3 -CD 41.60 1 41.60 2.94 0.108 4 -A2 3.06 1 3.06 0.216 4 0.648 9 -B2 70.98 1 70.98 5.02 0.041 9 *C2 3.92 1 3.92 0.276 8 0.607 0 -D2 19.07 1 19.07 1.35 0.265 1 -残差 198.07 14 14.15失拟项 193.77 10 19.38净误差 4.32 4 1.08总和 751.50 28 R2 0.736 4 R2Adj 0.472 8
2.2.2.2 优化培养基的验证 为了确定实验结果的可靠性,对上述优化培养基进行重复实验验证,最终丁烯基多杀菌素平均产量与预测值接近,表明模型是可行有效的。
3 讨论
从环境中筛选得到的野生型菌株因目标物合成能力较差,达不到工业化生产需求。虽然有关须糖多孢菌的全基因组序列已完成解析,但丁烯基多杀菌素生物合成途径复杂且调控机制的研究较少,使得工程菌株的改造困难。通过常规诱变技术包括紫外(UV)诱变、NTG诱变、60Co-γ诱变、ARTP诱变等能够获得性能大幅提高的突变菌株。因此本研究采用ARTP和NTG复合诱变,并结合96孔板培养进行了初筛和摇瓶复筛,获得了产量较高且遗传稳定的 1株突变菌株 2-A9(ARTP诱变时间60 s),较出发菌株提高30.92%。但常规的理化诱变技术存在着工作量大、筛选周期长等缺点,限制了其的应用。
种子是微生物发酵生产至关重要的一步,良好的培养条件是获得高产种子的关键。目前对于发酵条件优化最好的方式就是采用数理统计法,对发酵过程建立数学模型,通过适时调节发酵参数,实现对发酵过程的优化控制。目前常用方法包括:单因素实验法、响应面分析法、人工神经网络建模法等,徐瑶[16]在单因素实验的基础上进行了Plackett-Burman,利用最陡爬坡及中心响应面方法最终确定了各个组分的最佳浓度,使得较原始培养基产量提高了17.44%。本研究首先通过Plackett-Burman实验设计,分析了发酵培养基中影响显著的因素,结果表明葡萄糖、糊精、棉籽蛋白和玉米浆干粉为影响丁烯基多杀菌素发酵的显著因素,并利用响应面实验设计,以较少实验次数的 3D图形更直观清楚地获得发酵培养基的最佳配比为(g/L):葡萄糖 60.0、糊精 25.0、棉籽蛋白25.0、玉米浆干粉12.5、胨化牛奶10.0、MgSO4 1.0、NaCl 2.0和CaCO3 5.0。使得丁烯基多杀菌素产量得到提升。
碳源是培养基的重要组成部分,对菌丝体生长及次生代谢产物的生物合成有着重要作用,并且碳源是构成菌体碳架材料与形成含氮产物的重要来源,发酵过程中对碳源的利用也会影响菌株对氮源的消耗。对发酵培养基的碳、氮源进行优化,是提高丁烯基多杀菌素产量最行之有效的方法。此外,适宜的外界环境也在一定程度上帮助次级代谢产物合成的提高。余龙江等[17]将 10天的发酵培养期按发酵特点不同分为四个阶段,分别采用不同浓度的溶氧量,使得同为好氧菌的刺糖多孢菌的代谢产物产量达180 mg/L。发酵液的pH也在一定程度上影响微生物的生长与代谢。因此,陈纪龙[18]和Li[19]等提出两阶段pH调控手段,使得发酵体系中的葡萄糖利用率增加且达到提产目的。植物油水解后会生成甘油以及短链脂肪酸,添加入培养基后不但可以缓解葡萄糖阻遏,还能够补充抗生素合成的前体物质,也可作为消泡剂。Huang等[20]在摇瓶中加入草莓籽油和山茶油,使多杀菌素产量提高了80%以上。张瀚等[21]在发酵0 h添加15 g/L的山茶油使菌株多杀菌素产量显著提升。
丁烯基多杀菌素生物合成受到多种因素影响,相信随着未来研究者们的深入研究,丁烯基多杀菌素产生菌的合成能力可进一步提高。
[1]郭超, 赵晨, 黎琪, 等. 产丁烯基多杀菌素菌株的筛选及鉴定[J]. 粮油食品科技, 2019, 27(2): 55-60.GUO C, ZHAO C, LI Q, et al. Screening and identification of the strain producing butenyl-spinosyns[J]. Science and Technology of Cereals, Oils and Foods, 2019, 27(2): 55-60.
[2]LU Y, WANG L, MA K, et al. Characteristics of hydrogen production of an enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma (artp)[J].Biochemical Engineering Journal, 2011, 55(1): 17-22.
[3]张雪, 吴亦楠, 马飞, 等. ARTP诱变技术在食品和饲料加工生物催化剂改造中的应用进展[J]. 生物产业技术, 2019,71(3): 13-24.ZHANG X, WU Y N, MA F, et al. Application of ARTP mutagenesis in breeding of microbial biocatalysts for food and feed processing industry[J]. Biotechnology & Business, 2019, 71(3): 13-24.
[4]田萍萍, 曹鹏, 常传友, 等. 阿维菌素生产菌的常压室温等离子体诱变育种及培养基优化[J]. 微生物学通报, 2017, 44(1):150-160.TIAN P P, CAO P, CHANG C Y, et al. Atmospheric and room temperature plamsma breeding and medium optimization of avermectin producing strains[J]. Microbiology China, 2017,44(1): 150-160.
[5]陈爽, 赵晨, 黎琪, 等. 丁烯基多杀菌素高产菌株的诱变选育及培养基优化[J]. 江苏农业科学, 2018, 46(9): 108-111.CHEN S, ZHAO C, LI Q, et al. Mutation breeding and medium optimization of butenyl-spinosad producing strain[J]. Jiangsu Agricultural Sciences, 2018, 46(9): 108-111.
[6]何思颖, 柏丹, 夏伦, 等. 不同碳源对须糖多孢菌生长发育及丁烯基多杀菌素生物合成的影响[J]. 激光生物学报, 2019,28(2): 136-143.HE S Y, BAI D, XIA L, et al. Effects of different carbon sources on the growth development and butenyl-spinosyn biosynthesis of saccharopolyspora pogona[J]. Acta Laser Biology Sinica, 2019,28(2): 136-143.
[7]陈园. 多杀菌素高产菌株的诱变选育及快速筛选方法的研究[D]. 华南理工大学, 2013.CHEN Y. Mutation breeding of spinosad high-producing strain and study of rapid screening method[D]. South China University of Technology, 2013.
[8]郭伟群, 邹球龙, 陈园, 等. 多杀菌素高产菌株的诱变选育及代谢曲线初步研究[J]. 中国抗生素杂志, 2014, 39(4): 245-248.GUO W Q, ZUO Q L, CHEN Y, et al. Screenig and breeding of high Spinosad producing strains and preliminary study on metabolism curve of mutation[J]. Chinese Journal of Antibiotics,2014, 39(4): 245-248.
[9]王海霞, 陈园, 王超, 等. MPMS诱变结合抗生素抗性选育多杀菌素高产菌株[J]. 粮油食品科技, 2017, 25(3): 82-86.WANG H X, CHEN Y, WANG C, et al. Breeding of Spinosad high-producing strains through MPMS mutagenesis combined with antibiotics[J]. Science and Technology of Cereals, Oils and Foods, 2017, 25(3): 82-86.
[10]KUMAR J A, RAJ P A, KUMAR C A, et al. Metabolic engineering of rational screened saccharopolyspora spinosa for the enhancement of spinosyns A and D production[J]. Molecules and Cells, 2014, 37(10): 727-733.
[11]黄颖, 赵晨, 杨博磊, 等. 刺糖多孢菌高产菌株和野生型菌株多杀菌素生物合成基因簇(spn)在发酵过程中的表达分析[J].农业生物技术学报, 2014, 22(11): 1337-1346.HUANG Y, ZHAO C, YANG B L, et al. Expression analysis of spinosad biosynthetic gene cluster (spn) in hyperproducing and wild-type saccharopolyspora spinosa strains during fermentation[J]. Chinese journal of agricultural biotechnology, 2014, 22(11):1337-1346.
[12]WANG X Y, ZHANG C B, WANG M L, et al. Genome-scale metabolic network reconstruction of saccharopolyspora spinosa for spinosad production improvement[J]. Microbial Cell Factories,2014, 13(1): 41.
[13]YANG G, HE Y, JIANG Y, et al. A new medium for improving spinosad production by saccharopolyspora spinosa[J]. Jundishapur Journal of Microbiology, 2016, 9(6): e16765.
[14]彭上. 刺糖多孢菌培养基成分优化和发酵条件研究[D]. 湖南师范大学, 2012.PENG S. The optimization of fermentation medium and process of spinosad by saccharopolyspora spinosa[D]. Hunan Normal University, 2012.
[15]邹球龙, 郭伟群, 王超, 等. 多杀菌素补料发酵工艺的研究[J]. 粮油食品科技, 2014, 22(3): 86-88.ZUO Q L, GUO W Q, WANG C, et al. Study on the fed-batch fermentation process of spinosad[J]. Science and Technology of Cereals, Oils and Foods, 2014, 22(3): 86-88.
[16]徐瑶. 基于常温常压等离子体(ARTP)诱变的阿维链霉菌工业菌株选育及发酵工艺优化[D]. 华东理工大学, 2019.XU Y. Breeding of streptomyces avermitilis based on artp mutagenesis and optimization of avermectins fermentation processes[D]. East China University of Science and Technology,2019.
[17]BAI Y, ZHOU P P, FAN P, et al. Four-stage dissolved oxygen strategy based on multi-scale analysis for improving Spinosad yield by Saccharopolyspora spinosa ATCC49460[J]. Microbial Biotechnology, 2015, 8(3): 561-568.
[18]陈纪龙, 朱莉, 高敏杰, 等. 一株耐受低pH、高浓度硒菌株的筛选鉴定及两阶段 pH调控高效除硒的研究[J]. 工业微生物,2017, 47(3): 14-21.CHEN J L, ZHU L, GAO M J, et al. Isolation and identification of a low-pH and selenium tolerant strain and research on efficient removal of selenium using two-stage pH control strategy[J].Industrial Microbiology, 2017, 47(3): 14-21.
[19]XIANG Y L, YE L, MING C, et al. Efficient production of arachidonic acid by mortierella alpina through integrating fedbatch culture with a two-stage ph control strategy[J]. Bioresource Technology, 2015, 181(4): 275-282.
[20]YING H, XIAO L Z, CHEN Z, et al. Improvement of spinosad production upon utilization of oils and manipulation of β-oxidation in a high-producing saccharopolyspora spinosa strain[J]. Journal of Molecular Microbiology and Biotechnology, 2018, 28(2):53-64.
[21]张瀚, 扶教龙, 张松, 等. 利用山茶油提高刺糖多孢菌 AEG3-1发酵多杀菌素生产[J]. 中国抗生素杂志, 2021, 46(1): 34-41.ZHANG H, FU J L, ZHANG S, et al. Enhancement of spinosad production by Saccharopolyspora spinosa AEG3-1 using camellia oil[J]. Chinese Journal of Antibiotics, 2021, 46(1): 34-41.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。