缓解视疲劳片为一款缓解视疲劳保健食品,配方为越橘提取物、叶黄素和菊花。菊花中含有多种黄酮类成分,能够清除自由基达到保护组织的功效[1-3]。叶黄素通过细胞体外实验、小鼠体内试验对氧自由基活性的抑制,来证实缓解视疲劳机理[4-6]。欧洲越橘提取物功效成分为花色苷,花色苷具有极强的抗氧化、清除自由基活性,能够改善血管微循环、提高毛细血管强度以及改善视力[7-9]。目前花色苷的检测方法参照 SW2—2013《国际商务标准 植物提取物 越橘提取物》,但此方法只适用于单一原料的含量检测,不适用于复方保健食品中花色苷的检测,本实验建立保健食品中花色苷的定性鉴别和含量测定的方法,适用于复方保健食品中花色苷的分析方法,为产品质量控制提供科学依据。
1 材料与方法
1.1 实验材料
缓解视疲劳片,以越橘提取物等为主要原料制成的缓解视疲劳保健食品:连云港康缘美域保健食品有限公司;花色苷单标对照品,矢车菊素-3-O-葡萄糖苷,批号为18040904,含量以98%计:成都普菲德生物技术有限公司;对照样品,越橘提取物:USP RockVILLE,MD;硅胶GF254层析板,批号:20180905:安徽良臣硅源材料有限公司;乙腈、甲醇为色谱纯;其它试剂均为国产分析纯;超纯水:自制。
1.2 仪器与设备
电子分析天平,BSA224S-CW:德国赛多利斯公司;KQ-500DE型超声波清洗器:昆山市超声仪器有限公司;高效液相色谱仪:戴安;Mili-Q超纯水仪:美国密理博公司;H1650-W型离心机:湖南湘仪实验室仪器开发有限公司。
1.3 实验方法
1.3.1 薄层鉴别供试品溶液的制备
取样品20片,研细,称取0.2 g粉末,于25 mL容量瓶中,用甲醇溶解,超声处理15 min,定容,离心,即得。
1.3.2 薄层鉴别标准品溶液的配制
称取矢车菊素-3-O-葡萄糖苷约2 mg,于10 mL容量瓶中,用甲醇溶解并定容至刻度,摇匀,即得单标标准溶液。
称取Powdered Bilberry Extract约5 mg,置于10 mL容量瓶中,加入甲醇溶解并定容至刻度,摇匀,即得混标标准溶液。
1.3.3 薄层鉴别阴性对照溶液的配制
取阴性对照(不含越橘提取物)0.2 g,按照供试品溶液的制备方法,同法制成阴性样品溶液。
1.3.4 高效液相色谱检测对照品溶液的制备
称取对照品(矢车菊素-3-O-葡萄糖苷)约4 mg,精密称定,置于25 mL的容量瓶中,加入2%盐酸-甲醇溶液(V/V)并稀释至刻度,摇匀,准确移取2 mL的上述溶液于10 mL的容量瓶中,用10%磷酸水溶液(V/V)定容,得到单标对照品溶液。
称取对照样品(Powdered Bilberry Extract)约125 mg,精密称定,置于25 mL的容量瓶中,加入2%盐酸-甲醇溶液(V/V)并稀释至刻度,摇匀,准确移取2 mL的上述溶液于50 mL的容量瓶中,用10%磷酸水溶液(V/V)定容,得到混标对照样品溶液。
1.3.5 高效液相色谱检测供试品溶液的制备
取样品20片,去包衣,研细,取0.4 g,置具塞锥形瓶中,精密称定,置于25 mL的容量瓶中,加入2%盐酸-甲醇溶液(V/V)并稀释至刻度,摇匀,超声处理(功率500 W,频率40 kHz)30 min,放冷,摇匀,准确移取2 mL的上述溶液于10 mL的容量瓶中,用10%磷酸水溶液(V/V)定容。高速离心(12 000 r/min),取上清液,即为待测样品。
1.3.6 高效液相色谱检测阴性对照溶液的制备
按照配方工艺,制备缺少越橘提取物的阴性样品,按照供试品溶液的制备方法制得阴性对照溶液。
1.3.7 高效液相色谱条件
参照国际商务标准,确定选用以十八烷基硅烷键合硅胶为填充剂,色谱柱为 Luna C18(250×4.6 mm,5 μm),柱温为 30 ℃,流速为 1 mL/min,检测波长535 nm。流动相∶A相∶甲酸-水溶液(8.5∶91.5,V/V);B 相∶乙腈-甲醇-甲酸-水溶液(22.5∶22.5∶8.5∶41.5,V/V/V/V),梯度条件见表1。
表1 洗脱梯度
Table 1 Elution gradient
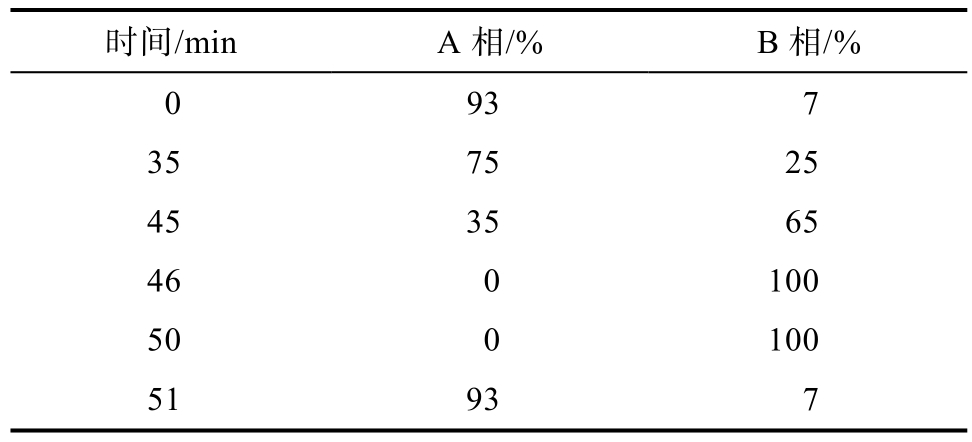
时间/min A相/% B相/%0 93 7 35 75 25 45 35 65 46 0 100 50 0 100 51 93 7
1.4 数据分析
以矢车菊素-3-O-葡萄糖苷对照品为参照,以其相应的峰为S峰,计算各花色苷组分的相对保留时间,并参照 SW2—2013《国际商务标准 植物提取物 越橘提取物》中花色苷各组分出峰顺序,采用外标一点法对各花色苷组分的质量分数进行定量,并计算相对标准偏差(RSD)。
2 结果与讨论
2.1 花色苷薄层鉴别方法
2.1.1 展开剂的选择
在硅胶 GF254层析板上,按照单标2 μL、混标4 μL、供试品溶液2 μL、阴性对照溶液4 μL分别进行点样。分别用V(甲酸)∶V(水)∶V(正丁醇)=9.1∶8.4∶32.5(展开剂 1)、V(乙酸)∶V(水)∶V(正丁醇)=9∶6∶32.5(展开剂 2)、V(甲酸)∶V(水)∶V(乙酸乙酯)=9∶8∶32(展开剂 3)进行展开。然后晾干,在日光灯下检视结果见图1。
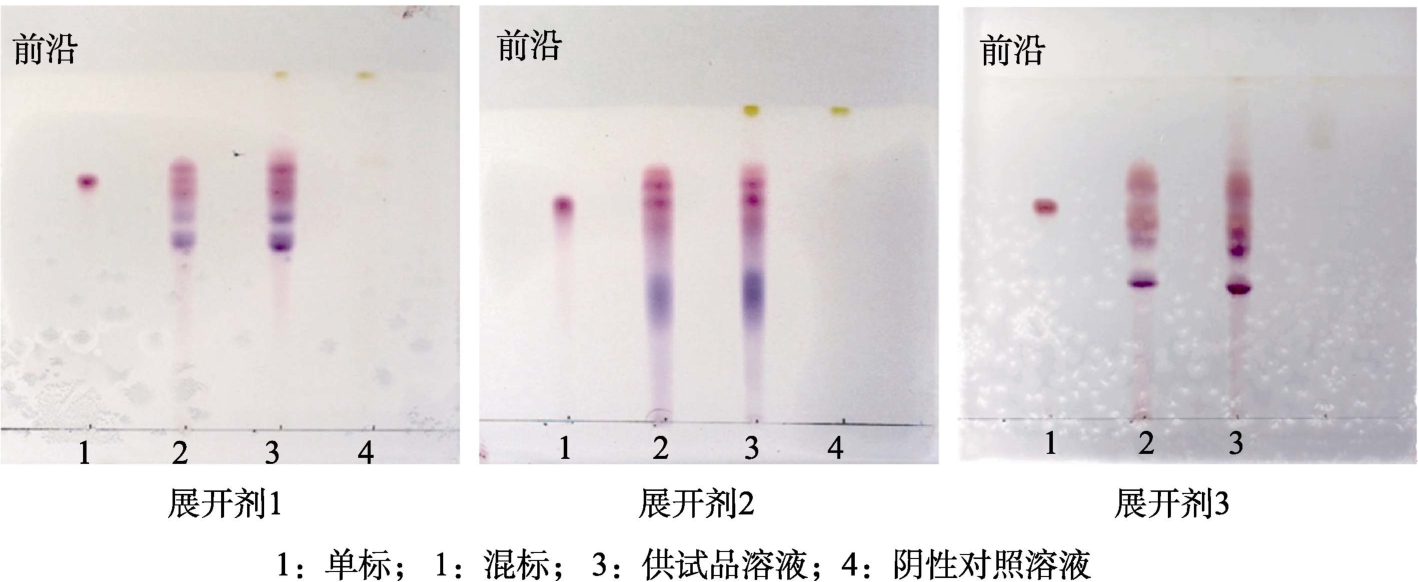
图1 花色苷薄层鉴别展开剂考察
Fig.1 Study on TLC identification unfolding agent of Anthocyanin
由图1可知,与展开剂 2、展开剂3相比,展开剂1的斑点分离度、清晰度均较好,故花色苷的薄层鉴别选择展开剂1作为展开系统。
2.1.2 点样量的确定
在硅胶 GF254层析板上,按照单标2 μL,混标 4 μL,供试品溶液1、2、4、6 μL,阴性对照溶液 4 μL 分别进行点样,V(甲酸)∶V(水)∶V(正丁醇)=9.1∶8.4∶32.5作为展开剂,展开后晾干,在日光灯下检视,结果见图2。
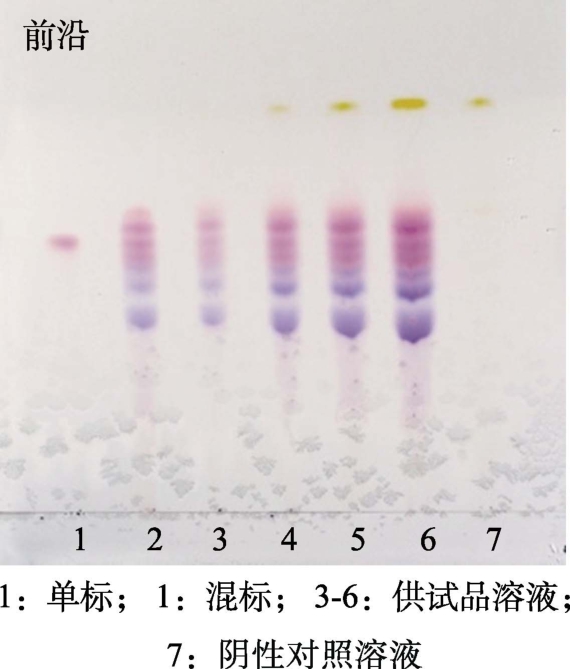
图2 花色苷薄层鉴别点样量考察
Fig.2 Study on the sample size of Anthocyanin TLC identification
由图2可知,通过考察不同点样量时样品的分离度和拖尾情况,结果表明点样量在1~6 μL之间,样品均能得到检视,供试品溶液点样量为2 μL时,已显示出较为清晰的主斑点,故供试品溶液点样量选择2 μL。
2.1.3 温度和湿度考察
设置点样量:单标2 μL,混标4 μL,供试品溶液 2 μL,阴性对照溶液 4 μL;展开剂∶V(甲酸)∶V(水)∶V(正丁醇)=9.1∶8.4∶32.5。在不同的温度(室温20 ℃和低温4 ℃)和不同的相对湿度(47%、65%、88%)条件下进行薄层层析,晾干后在日光灯下检视结果见图3。
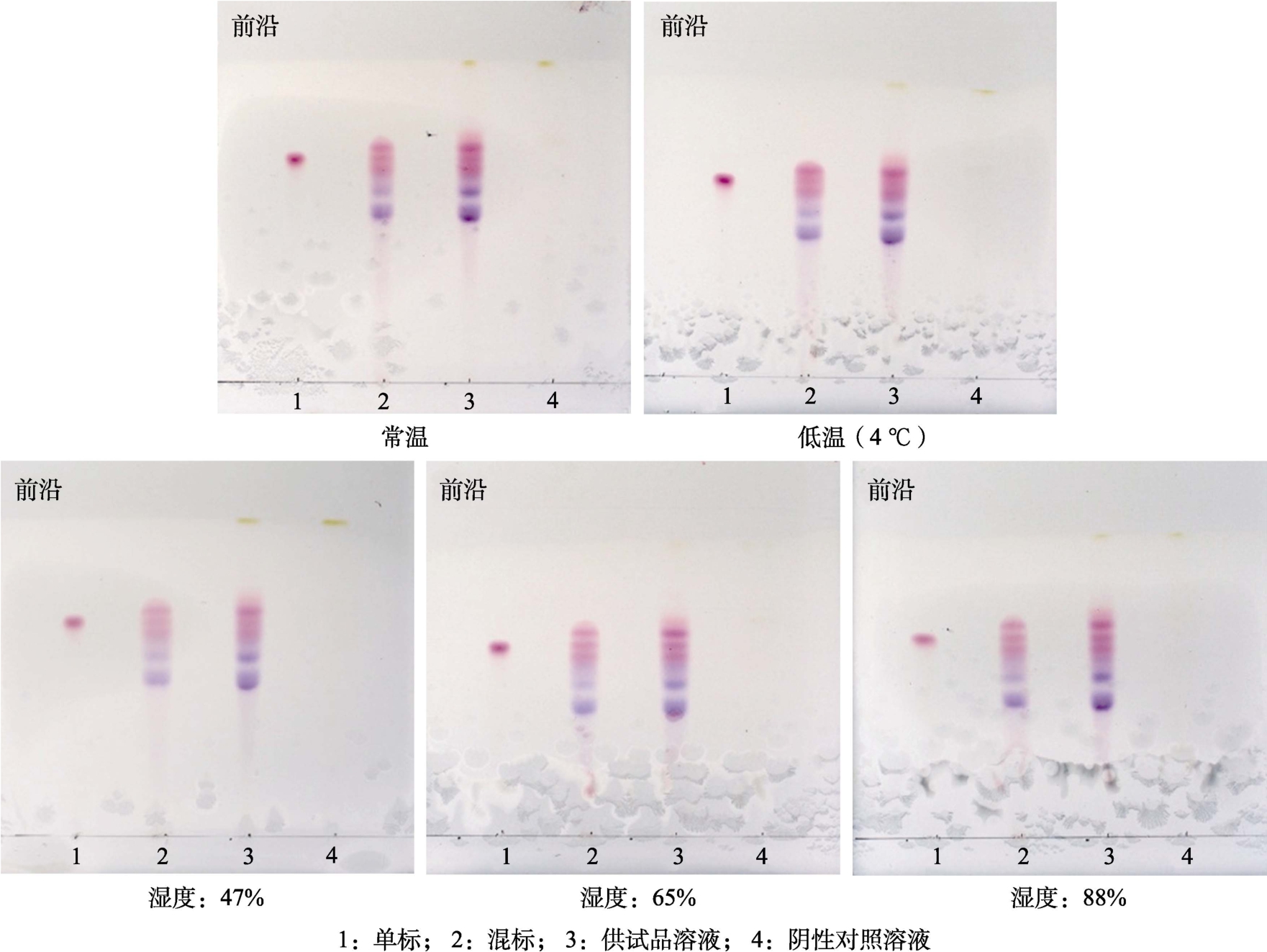
图3 花色苷薄层鉴别温度和湿度考察
Fig.3 Identification of Anthocyanins by TLC with temperature and humidity
由图3可知,在不同温度、不同的相对湿度条件下,分离效果均较好,表明温度和相对湿度对花色苷薄层鉴别基本无影响,说明温度耐用性考察结果和湿度耐用性考察结果均良好。
2.2 花色苷含量测定方法
2.2.1 高效液相色谱法测定花色苷的专属性
分别精密吸取对照品、供试品、阴性对照溶液各 10 μL,注入高效液相色谱仪,测定。结果见图4~7。
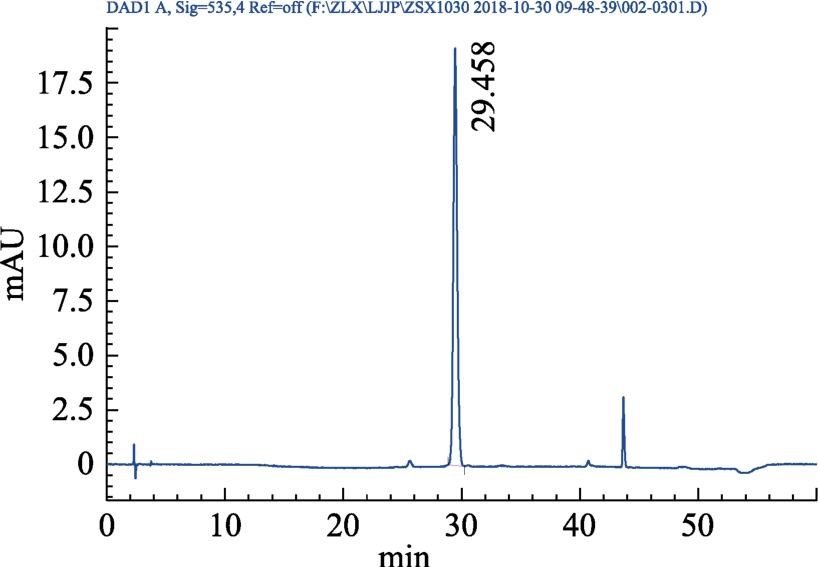
图4 矢车菊素-3-O-葡萄糖苷对照品(单标)HPLC色谱图
Fig.4 HPLC chromatogram of cyanidin-3-O-glucoside reference substance (single label)
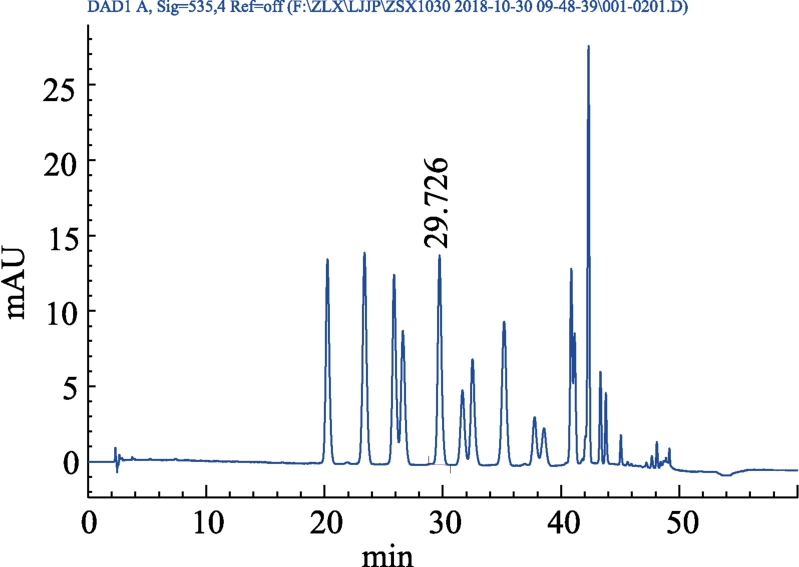
图5 Powdered Bilberry Extract对照品(混标)HPLC色谱图
Fig.5 Powder Bilberry Extract reference (mixed)HPLC chromatogram
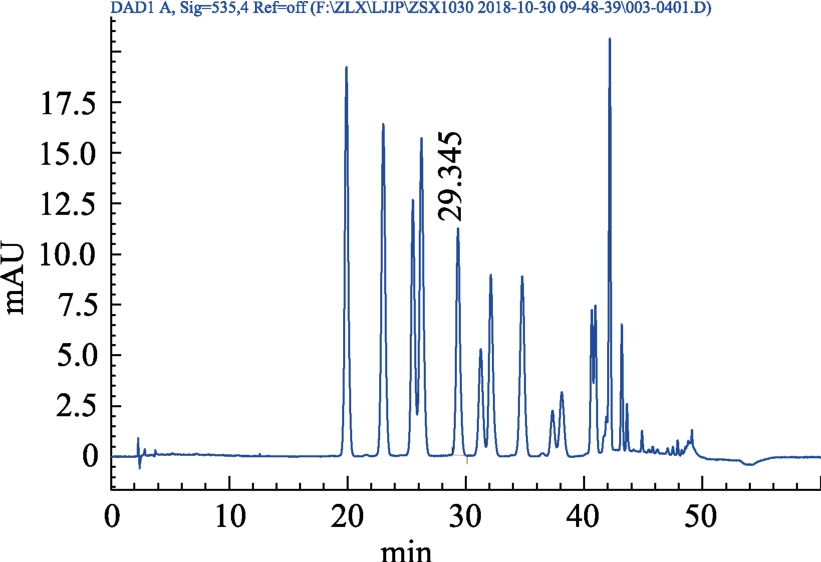
图6 缓解视疲劳片供试品溶液HPLC色谱图
Fig.6 HPLC chromatogram of sample solution for relieving Shilai tablets
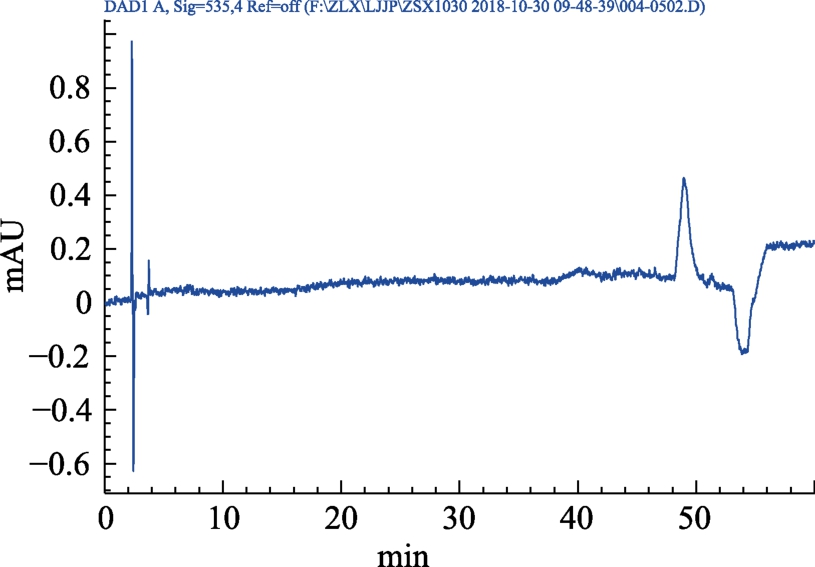
图7 缓解视疲劳片阴性对照HPLC色谱图
Fig.7 HPLC chromatogram of negative control for relieving asthenopia tablets
结果表明:供试品色谱图中呈现与对照品色谱保留时间一致(29 min)的色谱峰,为矢车菊素-3-O-葡萄糖苷目标峰,且阴性对照色谱图中在待测成分保留时间处无杂质峰干扰,表明本方法有良好的专属性。
2.2.2 高效液相色谱法测定花色苷的检测限与定量限
将对照品(矢车菊素-3-O-葡萄糖苷)溶液34.888 μg/mL用10%磷酸水溶液稀释,精密吸取对照品溶液各 10 μL,注入液相色谱仪,测定,以信噪比10∶1时的测定浓度作为定量限,以信噪比3∶1时的测定浓度作为检测限,得定量限为11.23 ng,检测限为4.16 ng。
2.2.3 高效液相色谱法测定花色苷线性关系
分别精密量取不同体积的矢车菊素-3-O-葡萄糖苷单标对照品储备液,置于10 mL的容量瓶中,用10%磷酸水溶液(V/V)定容,配制成系列浓度的标准溶液:4.361、8.722、17.444、26.166、34.888、52.322 μg/mL。精密吸取上述对照品溶液各 10 µL,注入液相色谱仪,按上述色谱条件测定峰面积,结果见表2。以进样浓度(μg/mL)为横坐标(x),峰面积为纵坐标(y),绘制标准曲线,计算回归方程。结果表明:矢车菊素-3-O-葡萄糖苷溶液在4.361~52.332 μg/mL范围内有良好的线性关系,回归方程为 y=0.236 4x+0.098 7,R2=0.999 5
表2 标准曲线的测定
Table 2 Determination of standard curve
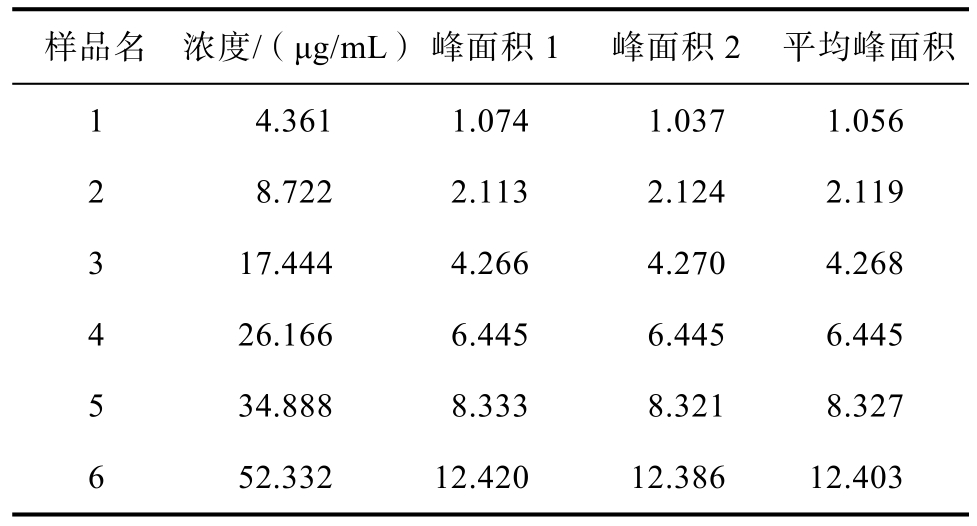
样品名 浓度/(μg/mL) 峰面积1 峰面积2 平均峰面积1 4.361 1.074 1.037 1.056 2 8.722 2.113 2.124 2.119 3 17.444 4.266 4.270 4.268 4 26.166 6.445 6.445 6.445 5 34.888 8.333 8.321 8.327 6 52.332 12.420 12.386 12.403
2.2.4 高效液相色谱法测定花色苷的精密度
精密吸取低中高三个浓度的对照品溶液,连续重复进样6次,测得矢车菊素-3-O-葡萄糖苷峰面积积分值,计算,结果见表3。RSD值均小于2%,结果表明仪器精密度良好。
表3 精密度测定结果(对照品)
Table 3 Precision measurement results (Reference substance)
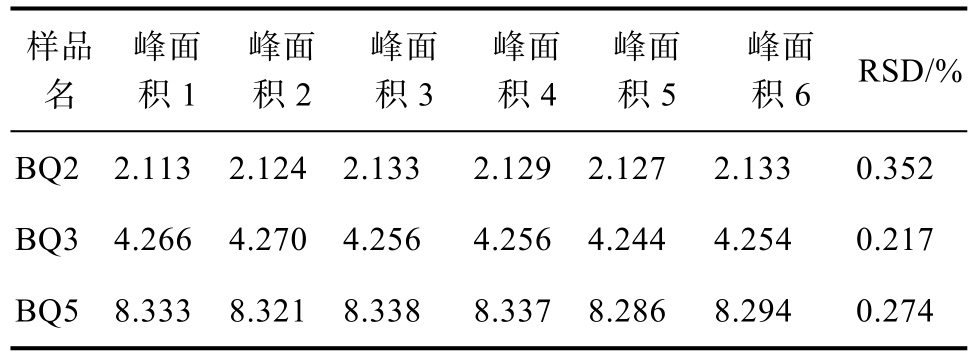
样品名峰面积1峰面积2峰面积3峰面积4峰面积5峰面积6 RSD/%BQ2 2.113 2.124 2.133 2.129 2.127 2.133 0.352 BQ3 4.266 4.270 4.256 4.256 4.244 4.254 0.217 BQ5 8.333 8.321 8.338 8.337 8.286 8.294 0.274
2.2.5 高效液相色谱法测定花色苷的的重复性
按照上述处理方法,平行制备6份供试品溶液,结果见表4。
表4 重复性测定结果
Table 4 Repeatability test
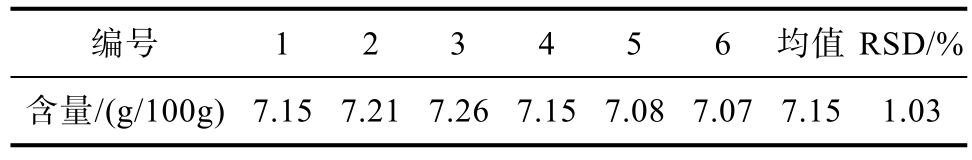
编号 1 2 3 4 5 6 均值RSD/%含量/(g/100g)7.15 7.21 7.26 7.15 7.08 7.07 7.15 1.03
结果表明总花色苷的平均含量为7.15 g/100g,RSD%=1.03(n=6)。说明此法重复性良好。
2.2.6 高效液相色谱法测定花色苷的稳定性
取线性项下的对照品溶液(浓度为17.444 μg/mL),分别于 0、2、4、6、10、16、20、24、28、32、36 h进样,检测样品在36 h内的稳定性,计算峰面积的RSD值,结果检表5和标6。结果表明,对照品和供试品的RSD值分别为0.31%、0.61%,说明在36小时内稳定性良好。
表5 稳定性测定结果(对照品)
Table 5 Stability results (Reference substance)

测定时间/h 0 2 4 6 10 16 20 24 28 32 36 RSD/%峰面积 4.104 4.070 4.147 4.037 4.052 4.026 4.045 4.017 4.042 4.013 4.024 1.01
表6 稳定性测定结果(供试品)
Table 6 Stability test result (test specimen)

序号 样品名 分子量 峰面积0 h 2 h 4 h 6 h 10 h 16 h 20 h 24 h 28 h 32 h 36 h RSD/% 平均RSD/%1 飞燕草素-3-O-半乳糖苷 500.84 7.537 7.464 7.442 7.232 7.454 7.431 7.426 7.397 7.389 7.372 7.415 1.01 2 飞燕草素-3-O-葡萄糖苷 500.84 6.994 6.926 6.906 6.718 6.927 6.918 6.909 6.843 6.859 6.847 6.865 1.02 3 矢车菊素-3-O-半乳糖苷 484.84 5.067 5.002 5.003 4.869 5.001 4.964 5.012 4.969 4.990 4.995 4.991 0.95 4 飞燕草素-3-O-阿拉伯糖苷 470.81 6.817 6.759 6.734 6.554 6.754 6.711 6.707 6.658 6.665 6.664 6.656 1.04 5 矢车菊素-3-O-葡萄糖苷 484.84 4.732 4.699 4.671 4.557 4.687 4.694 4.695 4.682 4.692 4.657 4.673 0.94 6 矮牵牛素-3-O-半乳糖苷 514.86 2.436 2.404 2.414 2.328 2.403 2.417 2.402 2.395 2.377 2.382 2.354 1.27 7 矢车菊素-3-O-阿拉伯糖苷 454.81 3.808 3.755 3.786 3.677 3.751 3.737 3.733 3.707 3.698 3.683 3.698 1.14 8 矮牵牛素-3-O-葡萄糖苷 514.86 4.325 4.216 4.271 4.125 4.228 4.213 4.230 4.187 4.161 4.186 4.167 1.31 9 芍药素-3-O-半乳糖苷 498.86 1.098 1.067 1.066 1.043 1.065 1.056 1.074 1.069 1.045 1.025 1.055 1.79 10 矮牵牛素-3-O-阿拉伯糖苷 484.85 1.556 1.546 1.532 1.484 1.519 1.518 1.498 1.501 1.481 1.485 1.484 1.76 11 芍药素-3-O-葡萄糖苷 498.86 1.760 1.742 1.724`.687 1.774 1.783 1.787 1.799 1.786 1.777 1.785 1.31 12 锦葵素3-O-半乳糖苷 528.89 1.728 1.699 1.708 1.646 1.710 1.720 1.712 1.727 1.714 1.703 1.727 1.34 13 芍药素-3-O-阿拉伯糖苷 468.84 0.311 0.317 0.307 0.310 0.314 0.321 0.319 0.331 0.326 0.322 0.332 2.61 14 锦葵素3-O-葡萄糖苷 528.89 3.961 3.923 3.906 3.792 3.924 3.911 3.905 3.888 3.873 3.857 3.880 1.13 15 锦葵素3-O-阿拉伯糖苷 498.86 1.470 1.452 1.442 1.405 1.457 1.447 1.442 1.469 1.463 1.468 1.449 1.28 16 飞燕草素-3-O-半乳糖苷 500.84 7.537 7.464 7.442 7.232 7.454 7.431 7.426 7.397 7.389 7.372 7.415 1.01 17 飞燕草素-3-O-葡萄糖苷 500.84 6.994 6.926 6.906 6.718 6.927 6.918 6.909 6.843 6.859 6.847 6.865 1.02 1.33
2.2.7 高效液相色谱法测定花色苷的加样回收率
取本品20片,去包衣,研细,取0.2 g,精密称定,置于25 mL容量瓶中,精密加入对照品溶液(1.186 mg/mL)1 mL,用2%盐酸-甲醇溶液(V/V)定容至刻度,超声处理(功率500 W,频率40 kHz)30 min,放冷,摇匀,准确移取2 mL的上述溶液于10 mL的容量瓶中,用10%磷酸水溶液(V/V)定容。高速离心(12 000 r/min),取上清液,即为待测样品。平行制备6份供试品溶液,测定,结果见表7。平均回收率在95%~105%之间,RSD小于2%,说明该方法的准确度良好。
表7 加样回收率实验
Table 7 Sample recovery test
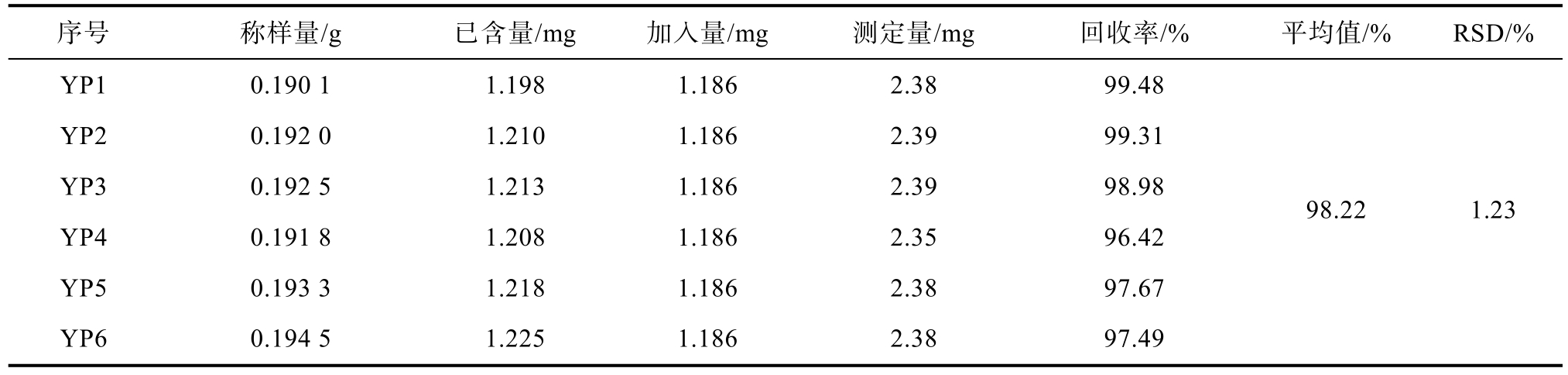
序号 称样量/g 已含量/mg 加入量/mg 测定量/mg 回收率/% 平均值/% RSD/%YP1 0.190 1 1.198 1.186 2.38 99.48 YP2 0.192 0 1.210 1.186 2.39 99.31 YP3 0.192 5 1.213 1.186 2.39 98.98 YP4 0.191 8 1.208 1.186 2.35 96.42 YP5 0.193 3 1.218 1.186 2.38 97.67 YP6 0.194 5 1.225 1.186 2.38 97.49 98.22 1.23
3 结论
薄层色谱法能够鉴别缓解视疲劳片中的花色苷成分,确定最佳鉴别条件为:展开剂为 V(甲酸)∶V(水)∶V(正丁醇)=9.1∶8.4∶32.5,点样量为2 µL,且不受温度和湿度的影响,对类似的保健食品中花色苷的薄层鉴别有一定借鉴意义。
参考 SW2—2013《国际商务标准 植物提取物 越橘提取物》中花色苷的含量测定方法,通过专属性、检测线、定量限、线性关系、精密度、重复性、稳定性和加样回收试验,优化并建立一种适用于保健食品中花色苷含量测定的方法,可作为缓解视疲劳片的质量控制方法。
[1]夏道宗, 吕圭源, 于新芬, 等. 杭白菊总黄酮对铅诱导小鼠氧化损伤的拮抗效应研究[J]. 中国中药杂志, 2008, 33(23):2803-2808.XIA D Z, LV G Y, YU X F, et al. Antagonistic effect of total flavone of chrysanthemum morifolium on oxidative damage induced by lead in mice[J]. Chinese Journal of Traditional Chinese medicine, 2008, 33(23): 2803-2808.
[2]于亚威, 徐广涛, 潘晓燕, 等. 杭白菊对衰老小鼠肝组织SOD、GSH-PX和 MDA表达的影响[J]. 温州医学院学报,2011, 41(1): 53-55.YU Y W, XU G T, PAN X Y, et al. Effect of chrysanthemum morifolium on the expression of SOD, GSH-PX and MDA in liver tissue of aging mice[J]. Journal of Ningbo University, 2011,41(1): 53-55.
[3]曹小燕, 杨海涛. 野菊花总黄酮清除自由基的活性[J]. 江苏农业科学, 2014, (10): 307-309.CAO X Y, YANG H T. Free radical scavenging activity of total flavonoids from Chrysanthemum Indicum[J]. Jiangsu Agricultural Sciences, 2014, (10): 307-309.
[4]苏卿, 李谦, 陈浩, 等. 叶黄素的抗氧化-促氧化作用研究[J].食品工业科技, 2014, 9(35): 68-70.SU Q, LI Q, CHEN H, et al. Study on antioxidation and prooxidation of Lutein [J]. Food Industry Technology, 2014,9(35): 68-70.
[5]张莉华, 葛文津, 夏立营, 等. 叶黄素对眼的保健作用和临床观察[J]. 中国食品添加剂, 2012, (5): 61-65.ZHANG L H, GE W J, XIA L Y, et al. The eye-care effect and clinical observation of Lutein[J]. Chinese food additives, 2012,(5): 61-65.
[6]夏立营, 刘维佳, 葛文津, 等. 叶黄素缓解视力疲劳临床观察[J]. 中国临床保健杂志, 2010, 13(4): 419-420.XIA L Y, LIU W J, GE W J, et al. Lutein relieves visual fatigue[J]. Chinese Journal of Clinical Health Care, 2010, 13(4): 419-420.
[7]宝丽. 欧洲越橘花色苷提取物抗氧化应激作用及其机制学研究[D]. 沈阳药科大学, 2008.Bao L. Studies on the anti-oxidative stress effect and mechanism of Bilberry Anthocyanin extract [D]. Shenyang Pharmaceutical University, 2008.
[8]姜艳霞, 沈楠, 孙鹏飞, 等. 越橘花色苷对被动吸烟大鼠SOD、GSH-Px、GH影响[J]. 中国公共卫生, 2012, 28(3): 345-346.JIANG Y X, SHEN N, SUN P F, et al. Effects of vaccinium anthocyanin on SOD, GSH-Px and GH of passive smoking rats[J]. Public Health in China, 2012, 28(3): 345-346.
[9]吴昱含, 张会图, 董淑珍, 等. 复合营养素缓解视疲劳作用研究[J]. 食品与药品, 2017, 19(5): 314-317.WU Y H, ZHANG H T, DONG S Z, et al. Effect of compound nutrients on relieving asthenopia[J]. Food and drugs, 2017,19(5): 314-317.
备注:本文的彩色图表可从本刊官网(http:// lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。