蛋白质缺乏是世界问题。FAO 2013年的报告指出,全球有10亿人口蛋白质摄入不充分,在非洲中部和南亚有 10%~30%的儿童蛋白质摄入缺乏[1]。而中国的蛋白质缺乏问题主要表现在蛋白饲料资源的缺乏上,我国每年进口约 9 000万 t大豆用以豆粕生产和榨油。蛋白质的科学评价和合理高效利用是缓解蛋白质缺乏的有效途径之一。同时,膳食营养与国民健康息息相关,膳食蛋白质是最重要的宏量营养素之一,蛋白质摄入数量不足或过多,氨基酸摄入不平衡等都会对身体健康造成极大的影响,粮食蛋白和动物蛋白是人们日常膳食中最主要的蛋白质来源,如何正确选择和搭配不同蛋白来源的食物是人们生活中经常遇到的问题,也是关系国民营养与健康水平的重要因素。动物蛋白长期以来一直都被认为是优质蛋白,而植物蛋白,尤其是粮食蛋白,由于氨基酸构成比例与人体或动物体的氨基酸构成比例相去甚远,转化效率较低,一直被认为是低质蛋白。
当前国际上评价食物蛋白质品质的理论体系一直是传统的氨基酸生物利用率方法,不管是以前的氨基酸评分(amino acid score,AAS)、蛋白质功效比值(protein efficiency ratio,PER)、蛋白质消化率校正氨基酸评分(protein digestibilitycorrected amino acid score,PDCAAS),还是近年来的可消化必需氨基酸评分(digestible indispensable amino acid score,DIAAS)都是基于氨基酸,尤其是必需氨基酸的消化吸收量与机体氨基酸的需求量匹配程度为基础的,对于单一氨基酸对健康的效应考虑的非常少。国内对于食品蛋白质的品质评价大多还停留在AAS阶段,仅有Han等[2-4]采用最新的 DIAAS方法评价了我国居民日常膳食中食用的谷物[2,4]和豆类[3-4]的蛋白质品质,但研究范围和程度还远远不够,急需开展更加深入系统的研究工作。
1 食物蛋白质品质评价研究进展
蛋白质、氨基酸和氮代谢共同决定了人体膳食蛋白质的代谢需求,氨基酸代谢除了需要维持组织蛋白在适度水平,还需满足氨基酸衍生代谢和生长、怀孕及泌乳时所需的额外需求。人体重要的功能,如免疫和宿主防御、线性生长和相关智力发育等都会受到蛋白质品质的影响,而蛋白质品质也会受加工和烹饪后蛋白质生物利用度的影响[5-6]。
由于蛋白质对机体生命维持及生长发育的重要影响,国际上对食物蛋白质品质评价的研究工作一直很重视。食物蛋白质品质评价方法包括非生物学和生物学评价法。非生物学方法包括氨基酸评分、必需氨基酸指数及氨基酸比值系数分等;生物学评价法包括蛋白质功效比值(PER)、蛋白质消化率校正氨基酸评分(PDCAAS)和可消化必需氨基酸评分(DIAAS)等。这些评价方法的发展经历了从化学分析到生物学分析、从表观到真实、从简单到复杂的评价过程。非生物学方法主要考察的是食物蛋白质必需氨基酸含量与推荐的参考蛋白必需氨基酸含量的比较,这些方法没有考虑食物蛋白质的消化利用率,不能真实地反映真正被动物消化利用的氨基酸数量[7];而生物学方法重点考虑的是机体摄食食物蛋白质后直观的体重增长或食物蛋白质(氨基酸)在机体中的消化率,生物学方法不是仅仅考虑食物蛋白质(氨基酸)的化学成分含量,而是考虑动物体对食物的消化利用情况,因此生物学方法比非生物学方法更接近人体对蛋白质(氨基酸)的真实需求,因而更科学。
生物学评价方法主要经历了PER到PDCAAS再到 DIAAS的发展过程。PER最早是由美国AOAC推荐的标准方法,1919年后在国际上被广泛采用[8]。PER的具体方法是:给10只试验断奶大鼠饲喂检测蛋白,另10只大鼠饲喂相同比例参比蛋白(酪蛋白),记录大鼠的采食量及体增重,4周后计算PER。PER的数值越高表明食物蛋白质的品质越好。计算公式为[8]:

PER在使用中存在如下的局限性[9]:(1)与人体试验结果相比,大鼠试验测得的PER值可能高估了一些动物蛋白的营养价值而低估了一些植物蛋白的营养价值;(2)大鼠和人类的必需氨基酸需要模式不同。虽然PER在应用上有其局限性,但由于其简便易测,目前仍是国际上一些国家用来评价食物蛋白质质量的标准方法之一。
由于 PER在使用过程中存在上述局限性,1991年 FAO提出了用蛋白质消化率校正氨基酸评分(PDCAAS)来评价食物蛋白质营养价值[10]。PDCAAS是以待测蛋白质的第一限制性氨基酸乘以待测蛋白质的真粪便消化率,再与参比蛋白质的相同氨基酸含量相比,所得到的比值作为评分数据,数据的上限为 1。PDCAAS数据越大表明蛋白质品质越好。其中,待测食物蛋白的真粪便消化率是以大鼠为模型动物测定的。具体计算公式为[10]:

PDCAAS在使用过程中也存在如下局限性[11]:(1)PDCAAS是基于真粪便氮消化率而不是个体回肠氨基酸消化率,因此不能反映个体氨基酸的消化率和可消化氨基酸含量;(2)由于后消化道微生物对蛋白质的合成作用,会在某种程度上高估蛋白质的真消化率,因此 PDCAAS值会被高估;(3)PDCAAS最大值是1,因此一些高质量的蛋白不能被突显出来;(4)由于大鼠不论是生长和维持对氨基酸的需求模式都与人不同,用大鼠模型测定真粪氮消化率存在弊端。目前PDCAAS仍是国际上被广泛采用的标准方法之一。
基于以上PDCAAS的局限性,2013年FAO提出用可消化必需氨基酸评分(DIAAS)替代PDCAAS评价食物蛋白质品质[5]。DIAAS是利用内源性氨基酸(endogenous amino acid,EAA)损失校正表观回肠氨基酸消化率(apparent ileal amino acid digestibility,AID)至真回肠氨基酸消化率(true ileal amino acid digestibility,TID),得出机体真正从食物中消化获得的可利用必需氨基酸的量,再与人体不同年龄阶段必需氨基酸的需求量比较得出评分数据。DIAAS的计算公式如下[5]:

DIAAS是基于回肠末端氨基酸消化率测定的。消化道和外分泌腺分泌大量氨基酸和其他含氮化合物进入肠腔并且只有部分物质被消化和吸收,回肠食糜中的非日粮成分校正表观消化率系数至真消化率系数,能更准确的描述饮食中的蛋白质消化率。必需氨基酸消化率应来自人体回肠必需氨基酸真消化率,在人体资料不易获得的情况下,可采取以生长期的猪为模型动物获得的回肠必需氨基酸消化率,其次采用生长期大鼠为模型动物。2013年FAO“人类营养中膳食蛋白质质量评估”专家咨询报告中针对不同人群提出的DIAAS的氨基酸评分模式见表1[5]。
表1 不同人群DIAAS的评分模式[5]
Table 1 Recommended amino acid acoring patterns for infants, children and older children, adolescents and adults[5](mg/g蛋白)
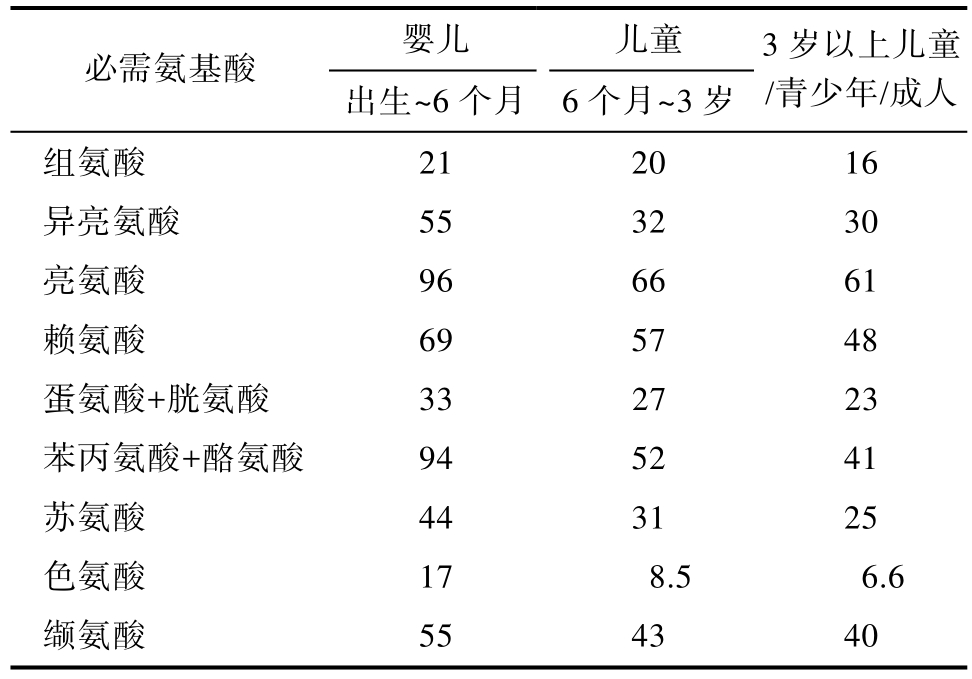
婴儿 儿童必需氨基酸 出生~6个月 6个月~3岁3岁以上儿童/青少年/成人组氨酸 21 20 16异亮氨酸 55 32 30亮氨酸 96 66 61赖氨酸 69 57 48蛋氨酸+胱氨酸 33 27 23苯丙氨酸+酪氨酸 94 52 41苏氨酸 44 31 25色氨酸 17 8.5 6.6缬氨酸 55 43 40
DIAAS能更真实地反映机体对氨基酸的消化利用程度以及食物中蛋白质对人体氨基酸和氮代谢的贡献[12]。从2013年FAO提出用DIAAS评价食品蛋白质品质以来,世界上许多国家都开展了一系列针对本国食品蛋白质品质评价的研究,尤其以新西兰、美国、加拿大、荷兰和印度的研究较多。国内仅有Han等[2-4]分别以大鼠和猪作为模型动物,对我国常见的谷物(糙米、精米、小麦粉、燕麦、甜荞、苦荞、小米、糜子、薏苡等 9种谷物)和杂豆(绿豆、小豆、芸豆、豌豆、蚕豆、鹰嘴豆等6种杂豆)煮熟后的DIAAS进行了系列研究。
当前对于食品蛋白质评价的 DIAAS研究发现,动物蛋白的DIAAS值一般均大于90[7,13-16],谷物蛋白的 DIAAS一般均小于 68[2,4,13-19],豆类蛋白的 DIAAS范围为 55~94[3,4,18-22]。根据 FAO专家委员会的评价标准[5],DIAAS大于75为优质蛋白,那么所有的谷物蛋白均为低质蛋白,动物蛋白均为优质蛋白,而一部分豆类蛋白为优质蛋白。
2 传统食物蛋白质评价体系面临的挑战
目前,常用蛋白质的评价体系是以氨基酸的生物利用率为参考指标。然而,膳食蛋白与营养相关慢性疾病的关系研究,尤其是蛋氨酸限制饮食(methionine-restricted diet,MRD)对健康的有益作用正对这一评价体系提出了严峻的挑战。一系列研究发现,当给啮齿类动物日粮中蛋氨酸摄入量限制为蛋氨酸需求量的20%时,可以显著减少机体脂肪的积累,增加能量支出和代谢的灵活性,增强胰岛素敏感性,改善脂类代谢,降低炎症反应,并且可以显著延长啮齿类动物的寿命。这些结果表明,仅仅通过评价蛋白质的氨基酸生物利用率,并与人体的氨基酸需要量进行匹配的蛋白质评价体系显然已不能全面反映蛋白质品质,尤其是蛋白质的健康品质。同时,一些粮食蛋白,如荞麦蛋白、杂豆类蛋白的第一限制性氨基酸均为蛋氨酸。近年来的研究发现,这类食物有很多有益于健康的功效,相关研究往往将其归因于富含膳食纤维、植物化学物等,并未充分考虑其作为天然的蛋氨酸限制食物这一因素。
2.1 蛋氨酸限制饮食(methionine-restricted diet,MRD)
蛋氨酸是一种人和动物的必需氨基酸,它在机体代谢过程中具有非常重要的生理作用,如蛋白质合成、参与一碳代谢、转硫途径等[23]。虽然蛋氨酸在膳食中是必需的,但是过多的蛋氨酸摄入会诱导贫血、氧化应激和多器官损伤(包括心脏、肝脏和肾脏等)、血脂异常和动脉粥样硬化等的发生[24-25]。近年来大量研究表明,MRD能够产生许多有益于机体健康的作用,包括延长酵母[26]、果蝇[27]、线虫[28]和啮齿动物[29-30]的寿命、减少机体脂肪积累[31-32]、降低体重[33-34]、改善胰岛素敏感性[34-36]、减少氧化应激和炎症反应[37]、抑制结直肠肿瘤和软组织肉瘤的生长[38]以及抑制年龄相关疾病的发生等[39]。其中,最突出的代谢益处是能量摄入和支出的协调性增加,其中能量支出的增加更为明显,机体通过增加维持现有组织(例如骨骼肌)所需的总能量的比例来限制持续的脂肪沉积[40-41]。近年来 MRD也有一些人群的临床研究,如用于高胱氨酸血症[42]、神经综合症[43]、转移性实体瘤[44]、甚至新冠肺炎(Covid-19)[45]的辅助治疗等;临床试验还发现,MRD干预可改善超重或肥胖女性的血浆生物标志物、血清成纤维细胞生长因子21(FGF21)以及脂肪组织基因表达等[46],可增加脂肪氧化,提高胰岛素敏感性,减轻肥胖症[47],可逆转衰老对体重、胰岛素抵抗和肥胖的负面影响[48]等,这些研究结果提示MRD干预可能是一种可行的治疗成年人因年龄引起的代谢综合征的有效方案。
2.2 蛋氨酸限制饮食的机理
由于大多数真核生物不能利用无机硫,所以含硫氨基酸(SAA)必须从饮食中摄入。SAA包括蛋氨酸(Met)和半胱氨酸(Cys)。由于 Cys可以通过转硫途径(TSP)由 Met从头合成,如果膳食中Met和Cys的摄入量都很低,那么Cys也将成为必需氨基酸。因此,更准确地 MRD应称为SAA限制饮食[49]。Met不仅是蛋白质合成的起始氨基酸,而且它的甲基(X-CH3)也是碳转移反应的来源。除了在蛋白质合成中的重要作用外,Cys还对谷胱甘肽的产生和氧化还原稳态起着关键作用。目前,独立于年龄或性别的SAA的人群推荐量为每日每公斤体重14~20 mg,Met的推荐摄入量为每日每公斤体重10~19 mg。由于缺乏年龄和/或健康相关试验数据,这些推荐摄入量并未得到普遍认同[50],因此,SAA的适宜推荐摄入量仍需进一步深入研究。已有的文献表明过早的 MRD干预会限制断奶后幼龄鼠的生长、发育及组织沉积[48,51-52],而 MRD干预成年鼠却能预防和减轻肥胖、提高胰岛素抵抗[51],增加脂质输出和逆转小鼠肝脏中的脂肪变性[53],预防肥胖小鼠 2型糖尿病的发作[54]等。因此,MRD极有可能不适合幼龄动物,却适宜肥胖或者代谢综合症的成年动物,以及进入或者正处在衰老状态的中老龄动物。
目前对于MRD机理的研究主要集中于MRD通过调节机体的能量代谢,进而影响机体健康效应。能量代谢减缓是慢性代谢性疾病与衰老的典型特征,而 MRD对机体作用的重要特征就是显著增强机体的能量消耗[55]。研究发现,限制蛋氨酸摄入能显著提高试验动物的采食量、能量支出和脂肪分解,降低血糖和血脂水平,促进机体供能水平[56]。由于蛋白质合成需要蛋氨酸作为底物,且高度耗能,因此推测,蛋氨酸限制后,机体可能通过增加采食量、消耗大量脂肪和碳水化合物的方式来提高机体供能水平,从而提高蛋白质合成效率,维持蛋白代谢的平衡[56]。
MRD增强能量代谢的可能机制如下:一是改善糖代谢,比如通过上调循环FGF21水平从而改善葡萄糖代谢[48,57];二是白色脂肪米色化,通过增加脂肪细胞解偶联蛋白 1(Ucp1)的表达和呼吸能力,从而导致能量消耗[58-59];三是通过调节肾上腺素的分泌从而调节总热量消耗[58];四是通过改善甲状腺稳态和减轻氧化应激,激活能量代谢,为蛋白质合成提供充足能量,从而在低蛋氨酸水平下满足机体蛋白质代谢基本需求[41,56,60]。
按照目前SAA推荐摄入量标准,当饮食蛋氨酸摄入量限制为蛋氨酸需求量的20%时,机体依然能保持正常生理功能,且并没有过多地降低蛋白质的合成[61]。研究发现,对一些物种,SAA限制和粗蛋白限制存在明显的表型重叠[62];最近的一些试验还表明,MRD可能与Met在机体代谢过程中产生的硫化氢(H2S)有关[41,63]。同时有研究发现,MRD通过改善不同能量日粮中老龄鼠的甲状腺功能,调节海马依赖的焦虑抑郁和学习记忆功能,增加肠道微生物的多样性和有益菌的丰度,改善中老龄鼠的肠道粘膜功能,从而改善中老龄鼠的健康状况[51,64]。
3 应对挑战的思考和建议
由于 MRD对成年啮齿类动物的健康作用已经非常明确,因此,食品中蛋氨酸的含量对食品蛋白质的品质评价有显著的影响。按照传统蛋白质评价体系认为的劣质蛋白,如荞麦蛋白、豆类蛋白,由于其是天然的蛋氨酸限制食品,从健康角度来说可能是优质蛋白,而且对不同的年龄或生理阶段的目标人群,相同的蛋白食品也有可能被定性为不同的优劣程度。为了客观表征这种优劣程度,最好能引入数字指标,因此,经过深入思考,笔者首次提出用蛋氨酸分数(methionine score,MS)来表征食品的这种蛋白质品质。
蛋氨酸分数(MS)被定义为,食物中可消化的蛋氨酸含量(包括胱氨酸含量)与目标人群蛋氨酸需求量(包括胱氨酸的需求量)的比值。用公式表述如下:

其中,参比蛋白中所含有的蛋氨酸加胱氨酸的数量参考 2007年世界卫生组织/联合国粮农组织/联合国大学(WHO/FAO/UNU)报告中不同年龄段人群每天每公斤体重氨基酸的需求量确定[5]。当然,这个公式的表述是否准确还需要进一步展开研究和讨论。在这里采用可消化蛋氨酸和胱氨酸数量,而不是直接采用蛋白质中的蛋氨酸和胱氨酸的含量,是基于可消化氨基酸的数量能更真实的反映机体真正能利用的氨基酸数量考虑的。蛋氨酸分数并不是越高越好,也不是越低越好,应是一个适宜的范围,这个范围需要开展进一步的深入研究来确定。
MRD可以通过类似不严格的素食来实现。2017年Ables和Johnson整理了不同食物中的蛋氨酸含量[65]。他们指出蛋氨酸在肉类中含量丰富,尤其是红肉;坚果、种子、豆类、谷类和面食含量低;蔬菜和水果几乎不存在[66]。蛋氨酸天然含量低的食物构成MRD,类似于素食饮食[66]。而至今国内外 MRD的实际应用十分少见,作为健康膳食的推广或者相关产品开发都未起步,MS的研究和应用会加速 MRD健康膳食的推广和相关产品的研发。
4 结论
传统的食物蛋白质品质评价体系经历了从PER到PDCAAS再到DIAAS的过程,以猪为模式动物测定食物氨基酸的消化率已经接近准确,进一步的工作是建立食物对模型动物猪的氨基酸回肠消化率和不同年龄段人的消化率的回归方程,进而利用已经比较成熟和广泛的猪的饲料标准回肠消化率数据,扩充人的DIAAS数据库;另一方面是发展和完善食物体外回肠氨基酸消化率测定标准方法,建立食物体外氨基酸消化率和不同年龄段人群的消化率回归方程,进而快速扩充人的DIAAS数据库。但是,这一系列工作都是以食物的氨基酸与人体氨基酸需要量的匹配程度为评价标准的,没有考虑氨基酸的健康效应,因此在进一步发展传统食物蛋白质评价体系的同时,应同时考虑蛋白质的健康品质,建立基于氨基酸健康效应的评分体系,如蛋氨酸分数(MS),用以补充和完善食物的蛋白质品质评价体系。
[1]United Nations Food and Agriculture Organization (FAO). The State of Food Insecurity in the World. 2013. Available online:http://www.fao.org/publications/2013/so fi/en (accessed on 31 August 2021).
[2]HAN F, HAN F, WANG Y, et al. Digestible indispensable amino acid scores (DIAAS) of nine cooked cereal grains[J]. British Journal of Nutrition, 2019, 121: 30-41.
[3]HAN F, MOUGHAN PJ, LI J, et al. Digestible indispensable amino acid scores (DIAAS) of six cooked Chinese pulses[J].Nutrients, 2020, 12, 3831.
[4]HAN F, MOUGHAN PJ, LI J, et al. The complementarity of amino acids in cooked pulse/cereal blends and effects on DIAAS[J]. Plants 2021, 10(10), 1999.
[5]FAO/WHO. Dietary protein quality evaluation in human nutrition report of an FAO expert consultation. Food and Nutrition: Rome (Italy), 2013, 92.
[6]BALL R O, ELANGO R, SARWAR G G, et al. Research approaches and methods for evaluating the protein quality of human foods[J]. Food and Agriculture Organization of the United Nations, 2015, 1-59.
[7]MILLWARD D J. Amino acid scoring patterns for protein quality assessment[J]. British Journal of Nutrition, 2012, 108(2):31-43.
[8]THE CANADIAN FOOD INSPECTION AGENCY. Food labeling for industry: elements within the nutrition facts tableprotein. 2016. http://www.inspection.gc.ca/food/blbelling/ foodlabelling=for-industry/nutrition-labelling/elements-within-the-nu trition-facts-table/eng/1389206763218/1389206811747?chap=7.Accessed July 26, 2016.
[9]G SARWAR GILANI. Background on international activities on protein quality assessment of foods[J]. British Journal of Nutrition,2012, 108(S2): S168-S182.
[10]FAO/WHO. Protein quality evaluation: report of the Joint FAO/WHO expert consultation. Food and Nutrition: Rome (Italy),1991, 51.
[11]WOLFE R R, RUTHERFURD S M, KIM I Y, et al. Protein quality as determined by the digestible indispensable amino acid score: evaluation of factors underlying the calculation[J].Nutrition Reviews, 2016,74: 584-599.
[12]FAO/WHO. Research approaches and methods for evaluating the protein quality of human foods: report of a FAO expert working group. Food and Nutrition: Rome (Italy), 2014.
[13]RUTHERFURD S M, CUI J, GORONCY A K, et al. Dietary protein structure affects endogenous ileal amino acids but not true ileal amino acid digestibility in growing male rats[J]. Journal of Nutrition, 2015, 145: 193-198.
[14]STEIN H H, SEVE B, FULLER M F, et al. Invited review:Amino acid bioavailability and digestibility in pig feed ingredients: terminology and application[J]. Journal of Animal Science, 2007, 85: 172-180.
[15]CHRISTOPHER P F, JAMES D H. Potential impact of the digestible indispensable amino acid score as a measure of protein quality on dietary regulations and health[J]. Nutrition Reviews,2017, 75(8): 658-667.
[16]MOUGHAN P J. Measuring protein’s punch: DIAAS is the new PDCAAS [J]. The World of Food Ingredients, 2019, 116–119.
[17]CERVANTES-PAHM S K, LIU Y, STEIN H H. Digestible indispensable amino acid score and digestible amino acids in eight cereal grains[J]. British Journal of Nutrition, 2014, 111:1663-1672.
[18]ABELILLA J J, LIU Y, STEIN H H. Digestible indispensable amino acid score (DIAAS) and protein digestibility corrected amino acid score (PDCAAS) in oat protein concentrate measured in 20 to 30 kilogram pigs[J]. Journal of the Science of Food and Agriculture, 2018, 98: 410-414.
[19]MARINANGELI P F, HOUSE J D. Potential impact of the digestible indispensable amino acid score as a measure of protein quality on dietary regulations and health[J]. Nutrition Reviews,2017, 75(8): 658-667.
[20]NOSWORTHY M G, MEDINA G, FRANCZYK A J, et al. Effect of processing on the in vitro and in vivo protein quality of beans(Phaseolus vulgaris and Vicia faba)[J]. Nutrients, 2018, 10: 671.
[21]NOSWORTHY M G, NEUFELD J, FROHLICH P, et al.Determination of the protein quality of cooked Canadian pulses[J].Food Science and Nutrition, 2017, 5: 896-903.
[22]NOSWORTHY M G, FRANCZYK A J, MEDINA G, et al. Effect of processing on the in vitro and in vivo protein quality of yellow and green split peas (Pisum sativum)[J]. Journal of Agricultural and Food Chemistry, 2017, 65: 7790-7796.
[23]ORGERON M L, STONE K P, WANDERS D, et al. The impact of dietary methionine restriction on biomarkers of metabolic health[J]. Progress in Molecular Biology and Translational Science, 2014, 121: 351-376. DOI: 10.1016/B978-0-12-800101-1.00011-9.
[24]KIM S Y, KIM H, MIN H. Effects of excessive dietary methionine on oxidative stress and dyslipidemia in chronic ethanol-treated rats[J]. Nutrition Research and Practice, 2015,9(2): 144-149.
[25]SELHUB J, TROEN A M. Sulfur amino acids and atherosclerosis:a role for excess dietary methionine[J]. Annals of the New York Academy of Sciences, 2016, 1363: 18-25.
[26]JOHNSON J E, JOHNSON F B. Methionine restriction activates the retrograde response and confers both stress tolerance and lifespan extension to yeast, mouse and human cells[J]. Plos One,2014, 9(5): e97729.
[27]LEE B C, KAYA A, MA S, et al. Methionine restriction extends lifespan of Drosophila melanogaster under conditions of low amino acid status[J]. Nature Communications, 2014, 5: 3592-3592.
[28]CABREIRO F, AU C, KIT-YI L, et al. Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism[J]. Cell, 2013, 153: 228-239.
[29]ORENTREICH N, MATIAS J R, DEFELICE A, et al. Low methionine ingestion by rats extends life span[J]. Journal of Nutrition, 1993, 123(2): 269-274.
[30]SUN L, SADIGHI-AKHA A A, MILLER R A, et al. Life-span extension in mice by preweaning food restriction and by methionine restriction in middle age[J]. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences,2009, 64(7): 711-722.
[31]ORGERON M L, STONE K P, WANDERS D, et al. The impact of dietary methionine restriction on biomarkers of metabolic health[J]. Progress in Molecular Biology and Translational Science,2014, 121: 351-376.
[32]PATIL Y N, DILLE K N, BURK D H, et al. Cellular and molecular remodeling of inguinal adipose tissue mitochondria by dietary methionine restriction[J]. Journal of Nutritional Biochemistry, 2015, 26(11): 1235-1247.
[33]ABLES G P, PERRONE C E, ORENTREICH D, et al.Methionine-restricted c57bl/6j mice are resistant to diet-induced obesity and insulin resistance but have low bone density[J]. Plos One, 2012, 7(12): 456-463.
[34]王雅楠, 张佳红, 郭海涛, 等. 蛋氨酸限制和胶原蛋白肽对高脂饮食小鼠脂代谢和氧化应激的联合作用[J]. 食品科学,2018, 39(9): 108-115.WANG Y, ZHANG J, GUO H, et al. Combined effect of methionine restriction and collagen peptides on lipid metabolism and oxidative stress in high-fat diet-fed mice[J]. Food Science,2018, 39(9): 108-115.
[35]YUNCONG X, YUHUI Y, JIN S, et al. Dietary methionine restriction ameliorates the impairment of learning and memory function induced by obesity in mice[J]. Food and Function,2019, 10: 1411-1425.
[36]TINGYU L, YUHUI Y, YUNCONG X, et al. Dietary methionine restriction improves glucose metabolism inskeletal muscle of obese mice[J]. Food and Function, 2019, 10: 2676-2690.
[37]YUHUI Y, YANAN W, JIN S, et al. Dietary methionine restriction reduces hepatic steatosis and oxidative stress in highfat-fed mice by promoting H2S production[J]. Food and Function,2019, 10: 61-77.
[38]GAO X, SANDERSON S M, DAI Z, et al. Dietary methionine influences therapy in mouse cancer models and alters human metabolism[J]. Nature, 2019, 572(7769): 397-401.
[39]ZHOU X, HE L, WAN D, et al. Methionine restriction on lipid metabolism and its possible mechanisms[J]. Amino Acids, 2016,48(7): 1533-1540.
[40]FONTENELLE L C, FEITOSA M M, SEVERO J S, et al.Thyroid function in human obesity: underlying mechanisms[J].Hormone and Metabolic Research, 2016, 48(12): 787-794.
[41]GUOQING W, YANAN W, YUHUI Y, et al. Dietary methionine restriction upregulates endogenous H2S via miR-328-3p: a potential mechanism to improve liver protein metabolism efficiency in a mouse model of high-fat-diet-induced obesity[J].Molecular Nutrition and Food Research, 2019, 63(5): e1800735.
[42]SCHIMKE R N. Low methionine diet treatment of homocystinuria[J]. Annals of Internal Medicine, 1969, 70(3):642-643.
[43]HIRABAYASHI K, SHIOHARA M, YAMADA K, et al.Neurologically normal development of a patient with severe methionine adenosyltransferase Ⅰ/Ⅲ deficiency after continuing dietary methionine restriction[J]. Gene, 2013, 530(1):104-108.
[44]PLAISANCE E P, GREENWAY F, BOUDREAU A, et al.Dietary methionine restriction increases fat oxidation in obese adults with metabolic syndrome[J]. Journal of Clinical Endocrinology and Metabolism, 2011, 96(5): e836-e840.
[45]HOFFMAN R M, HAN Q. Oral methioninase for covid-19 methionine-restriction therapy. In Vivo[J]. 2020, 34(3), 1593-1596.
[46]OLSEN T, ØVREBØ B, HAJ-YASEIN N, et al. Effects of dietary methionine and cysteine restriction on plasma biomarkers,serum fibroblast growth factor 21, and adipose tissue gene expression in women with overweight or obesity: A double-blind randomized controlled pilot study[J]. Journal of Translational Medicine, 2020, 18(1): 1095-1100.
[47]PLAISANCE E P, GREENWAY F L, BOUDREAU A, et al.Dietary methionine restriction increases fat oxidation in obese adults with metabolic syndrome[J]. The Journal of Clinical Endocrinology and Metabolism, 2011, 96(5): e836-840.
[48]LEES E K, KRÓL E, GRANT L, et al. Methionine restriction restores a younger metabolic phenotype in adult mice with alterations in fibroblast growth factor 21[J]. Aging cell, 2014,13(5): 817-827. DOI: 10.1111/acel.12238.
[49]HINE C, MITCHELL J R. Calorie restriction and methionine restriction in control of endogenous hydrogen sulfide production by the transsulfuration pathway[J]. 2015, 68: 26-32.
[50]NIMNI M E, HAN B, CORDOBA F. Are we getting enough sulfur in our diet[J]. Nutrition and Metabolism, 2007, 4:24.
[51]ABLES G P, PERRONE C E, DAVID O, et al. Methioninerestricted c57bl/6j mice are resistant to dietinduced obesity and insulin resistance but have low bone density[J]. Plos One, 2012,7(12): e51357.
[52]HASEK B E, STEWART L K, HENAGAN T M, et al. Dietary methionine restriction enhances metabolic flexibility and increases uncoupled respiration in both fed and fasted states[J].American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2010, 299(3): R728-739.
[53]MALLOY V L, PERRONE C E, MATTOCKS D A, et al.Methionine restriction prevents the progression of hepatic steatosis in leptin-deficient obese mice[J]. Metabolism, 2013,62(11): 1651-1661.
[54]CASTAÑO-MARTINEZ T, SCHUMACHER F, SCHUMACHER S, et al. Methionine restriction prevents onset of type 2 diabetes in nzo mice[J]. FASEB Journal, 2019, 33(6): 7092-7102.
[55]ORGERON M L, STONE K P, WANDERS D, et al. The impact of dietary methionine restriction on biomarkers of metabolic health[J]. Progress in Molecular Biology and Translational Science, 2014, 121: 351-376.
[56]张佳红. 蛋氨酸限制对髙脂饮食小鼠能量代谢和蛋白质代谢的影响[D]. 江南大学, 2017.ZHANG J. Effects of methionine restriction on energy metabolism and protein metabolism in high-fat diet-fed mice[D].Jiangnan university, 2017.
[57]STONE K P, DESIREE W, MANDA O, et al. Mechanisms of increased in vivo insulin sensitivity by dietary methionine restriction in mice[J]. Diabetes, 2014, 63(11): 3721-3733.
[58][58]PLAISANCE E P, HENAGAN T M, ECHLIN H, et al. Role of beta-adrenergic receptors in the hyperphagic and hypermetabolic responses to dietary methionine restriction[J].American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2010, 299(3): R740-750.
[59]WANDERS D, BURK D H, CORTEZ C C, et al. Ucp1 is an essential mediator of the effects of methionine restriction on energy balance but not insulin sensitivity[J]. FASEB Journal,2015, 29(6): 2603-2615.
[60]吴国卿. 蛋氨酸限制日粮改善甲状腺功能激活中老龄鼠代谢的研究[D]. 江南大学, 2020.WU G. Dietary methionine restriction activates metabolism by improving thyroid function[D]. Jiangnan university, 2020.
[61]ABLES G P, HENS J R, NICHENAMETLA S N. Methionine restriction beyond life-span extension[J]. Annals of the New York Academy of Sciences, 2016, 1363(1): 68-79.
[62]LOPEZ-TORRES M, BARJA G. Lowered methionine ingestion as responsible for the decrease in rodent mitochondrial oxidative stress in protein and dietary restriction possible implications for humans[J]. Biochimica et Biophysica Acta, 2008, 1780, 1337-1347.
[63]HINE C, HARPUTLUGIL E, ZHANG Y. et al. Endogenous hydrogen sul-fide production is essential for dietary restriction benefits[J]. Cell, 2015, 160(1-2): 132-144.
[64]GUOQING W, YONGHUI S, LE H, et al. Dietary methionine restriction ameliorated fat accumulation, systemic inflammation,and increased energy metabolism by altering gut microbiota in middle-aged mice administered different fat diets[J]. Journal of Agricultural and Food Chemistry, 2020, 68: 7745-7756.
[65]ABLES G P, JOHNSON J E. Pleiotropic responses to methionine restriction[J]. Experimental Gerontology, 2017, 94:83-88.
[66]MCCARTY M F, BARROSO-ARANDA J, CONTRERAS F.The low-methionine content of vegan diets may make methionine restriction feasible as a life extension strategy[J]. Medical Hypotheses, 2009, 72(2): 125-128.