辣木原产于热带和亚热带,属多年生木本植物[1]。广东、广西、海南,四川和云南省已从印度和缅甸引入种子和栽培技术,其种子富含油脂,蛋白质和矿物质[2]。辣木具有一系列的营养价值和健康功效,例如抗氧化、抗炎、抗溃疡、解热、降压、抗癫痫、抗糖尿病、降低胆固醇、保护肝脏、抗细菌和真菌等能力[3-5]。
环境压力(如过热或紫外线照射)增加机体内活性氧水平,导致细胞成分(如核酸、脂质、蛋白质)的损伤,因此,机体的抗氧化能力对于维持细胞正常运转有重要作用[6-7]。从动植物中寻找安全营养,并具有很好抗氧化性的功能成分用于食品、保健品等领域一直是研究的热点。辣木的种子和叶是抗氧化剂的良好来源[8],例如,辣木叶丙酮提取物[9],辣木叶甲醇提取物[10]、辣木多酚[11]、黄酮[12]和多糖[13] 等的体外抗氧化活性研究均有大量报道。
关于辣木籽蛋白抗氧化活性方面的研究较少,并且主要采用酶解法。Aderinola等研究显示,辣木籽蛋白具有抗氧化活性[14],尤其通过胰蛋白酶和碱性蛋白酶水解之后,水解产物显示了很好的体外抗高血压和抗氧化活性[15-16]。然而,采用干燥加热磷酸化法[17]研究辣木籽蛋白的体外抗氧化活性的文献尚未报道。干燥加热磷酸化法于1994年由Tarelli等[17]提出,是食品蛋白质改性的常用方法,与食品蛋白改性的其它方法[18]比较,具有副反应少,不易引起蛋白质变性,有望应用于食品工业[19]。有大量研究表明干燥加热磷酸化法能提高食品蛋白的体外抗氧化活性[20-22]。因此,本研究采用辣木籽为材料,通过干燥加热磷酸化法修饰辣木籽蛋白,旨在确定干燥加热磷酸化修饰对辣木籽蛋白结构和体外抗氧化活性的影响。
1 材料与方法
1.1 试验材料
辣木籽蛋白的制备参照孙坤来等 [23]的方法略作修改。具体为:成熟果夹在室温干燥去壳、皮,粉碎过筛,脱脂,过150目筛,往过筛后的粉末中加入三羟甲基氨基甲烷和蒸馏水,质量比为 1∶4∶20,室温搅拌 1 h,6 000 r/min 离心30 min,用盐酸调节pH至4.8,取上清在10 kDa的透析袋透析 2 d,再在 6 000 r/min 离心 30 min,取出上清冻干后获得辣木籽蛋白(N-MSP)样品。
亚铁嗪(Sigma)、2,2-二氮-双-(3-乙基苯并噻唑-6-磺酸)-二铵盐、乙二胺四乙酸二钠:上海伊卡生物科技有限公司;重硫酸钾:天津市风船化学试剂科技有限公司。
1.2 仪器和设备
PHS-25型pH计:上海仪电科学仪器股份有限公司;UV-1800 PC型紫外-可见分光光度计:上海美谱达仪器有限公司;FA 2004型电子天平:上海舜宇恒平科学仪器有限公司。
1.3 试验方法
1.3.1 干燥加热磷酸化辣木籽蛋白制备
PP-MSP的制备采用Li等[24]的方法。1 g N-MSP样品溶于焦磷酸钠溶液(100 mL, 0.1 mol/L),调节pH 为 4.0。冻干,然后干燥加热(85 ℃, 5 d)。用透析袋去除样品溶液中游离的焦磷酸钠,冷冻干燥得到干燥加热磷酸化辣木籽蛋白(PP-MSP)样品。干燥加热辣木籽蛋白(DH-MSP)样品的制备除不加入焦磷酸钠溶液外,同以上步骤。
1.3.2 磷含量测定
样品中磷含量采用 Chen等[25]的方法。用高氯酸分解磷酸化辣木籽蛋白 PP-DEWP样品,分解液中的磷作为总磷。为了测定无机磷含量,用5 mL10%TCA 溶解 20 mg PP-DEWP 样品,溶液离心 2 h(3 000 r/min),上清液中的磷作为无机磷。分别取2 mL不同浓度的磷标液和PP-DEWP样品稀释液,加入等体积的混合液,混匀后在50 ℃水浴中加热1 h,冷却后在820 nm处测定吸光度值。
有机磷含量(Po):Po = Pt- Pi 。Po代表磷酸化修饰后样品中的磷含量,Pt代表样品中总磷含量,Pi代表样品中无机磷含量。
1.3.3 溶解性测定
将辣木籽蛋白N-MSP、干燥加热辣木籽蛋白DH-MSP和干燥加热磷酸化辣木籽蛋白 PP-MSP样品分别溶解在 Tris-HCl(50 mmol/L,pH=7.0)的缓冲溶液中,调节浓度为 1 mg/mL。3 000 rpm离心30 min得上清。采用Lowry法[26]测定上清液中蛋白质浓度。
1.3.4 表面巯基含量测定
采用Ellman等[27]的方法测定。1.0 mL 0.1 mol/L Tris-甘氨酸(pH=8.0)缓冲液(含0.01 mol/L的乙二胺四乙酸二钠盐溶液)加入到1.0 mL 0.1%的样品溶液,在 40 ℃孵化 30 min,加入 50 µL 5,5′-二硫代双(二硝基苯甲酸)溶液(5,5′-二硫代双(二硝基苯甲酸)溶液浓度为1 mol/L),25 ℃孵化 10 min,在 412 nm 处测定其吸光度。计算公式:SH =A×1.9539。
1.3.5 浊度和吸光度测定
浊度测定采用 Li[28]等的方法。样品溶于50 mmol/L Tris-HCl 缓冲液(pH=7.0),浓度为2 mg/mL。
在595 nm处测定吸光度即为浊度。同理配制1 mg/mL的样品溶液,测定280 nm处的吸光度。
1.3.6 ABTS+自由基清除能力
根据 Zhang等[29]的方法测定。80 µL的样品溶液(浓度为 0.1~10.0 mg/mL)和 4.0 mL ABTS试剂(734 nm的吸收度为0.6)混合,37 ℃水浴放置 10 min,测定 734 nm 处的吸光度。平行 3次,空白不加样品,以等量的磷酸盐缓冲液代替,样品抗氧化率计算如下:
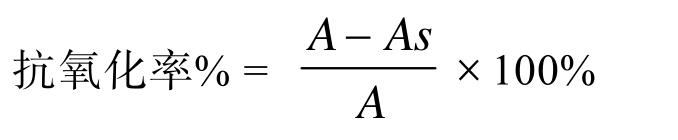
其中As代表样品的吸光度,A代表空白的吸光度。
1.3.7 超氧阴离子自由基清除能力
根据 Zhang等[30]的方法测定。用 50 mmol/L pH 8.2 Tris-盐酸溶液缓冲液溶解样品,使蛋白浓度为 1 mg/mL。25 ℃水浴中恒温的 0.14 mL 5 mmol/L 邻苯三酚溶液(用 10 mmol/L 盐酸溶液配制)中加入3 mL样品溶液,混匀,每30 s测定325 nm处的吸光度,测定时长为4 min。对照组中用 3 mL去离子水代替样品,空白组中用0.14 mL 10 mmol/L 盐酸代替邻苯三酚。以时间为横坐标,吸光度为纵坐标作曲线回归方程,斜率代表样品组对邻苯三酚的自氧化速率和邻苯三酚的自氧化速率。样品组对邻苯三酚的自氧化速率设为V样品,邻苯三酚的自氧化速率设为V对照。计算如下: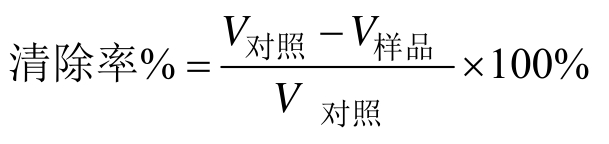
1.3.8 二价铁离子的螯合能力
采用Wu等[31]的方法测定。样品或EDTA溶液(1.0 mL, 0.1~10.0 mg/mL)和 0.1 mL 2 mmol/L的FeSO4·7H2O,加入3.7 mL去离子水,混匀,25 ℃下水浴 60 min。加入 0.2 mL 5 mmol/L 的亚铁嗪溶液,混匀,在25 ℃水浴中放置10 min,测定562 nm处的吸光度。3次平行实验,空白以等量的去离子水代替样品,蛋白对二价铁离子的螯合能力计算如下:
其中As代表样品的吸光度,A代表空白的吸光度。
1.3.9 色氨酸的荧光强度
采用 Li等[32]的方法测定。用磷酸盐缓冲液(50 mmol/L,pH=7.0)配置浓度为 1.5 mg/mL 的样品溶液。离心后取上清,用Lowry法准确测定上层液中样品的浓度,然后用磷酸盐缓冲液(50 mmol/L,pH 7.0)稀释为 0.1 g/L。在激发波长为 280 nm,测定波长为300~450 nm的条件下,用荧光光度计(F4500型)测定色氨酸的荧光强度。
1.3.10 圆二色谱测定
参照 Wu等[33]的方法。用磷酸盐缓冲液(50 mmol/L,pH=7.0)配制 1 mg/mL 的样品溶液,采用0.45 µm的滤头过滤,样品的准确浓度用Lowry法测定,最终调节为0.1 mg/mL。20 ℃下扫描,扫描的相关参数如下:波长范围:190 nm~250 nm;谱带宽度:1 nm。
1.3.11 红外光谱
参照Wu等[33]的方法。取适量样品粉末(加入一定量的KBr晶体以便充分研磨),然后压片,采用傅立叶红外光谱仪(Nicolet AVATAR 360 FT-IR)测定红外光谱。
1.4 数据分析
采用Excel和Origin 2018软件进行数据处理,采用单因素方差分析。实验结果以(平均值±标准差)表示,平行测定3次。
2 结果与分析
2.1 干燥加热磷酸化辣木籽蛋白的特性
2.1.1 磷酸化辣木籽蛋白中的磷含量
磷含量是干燥加热磷酸化后接在蛋白质上的有机磷含量,即有机磷含量=总磷含量-无机磷含量。磷含量与pH、干燥加热时间和温度等因素有关,本实验采用Li等的方法成功制备磷酸化辣木籽蛋白样品[24]。pH为4.0、85 ℃干燥加热5 d获得的样品有机磷含量达到 1.32%,磷酸化辣木籽蛋白中的磷含量见图1。
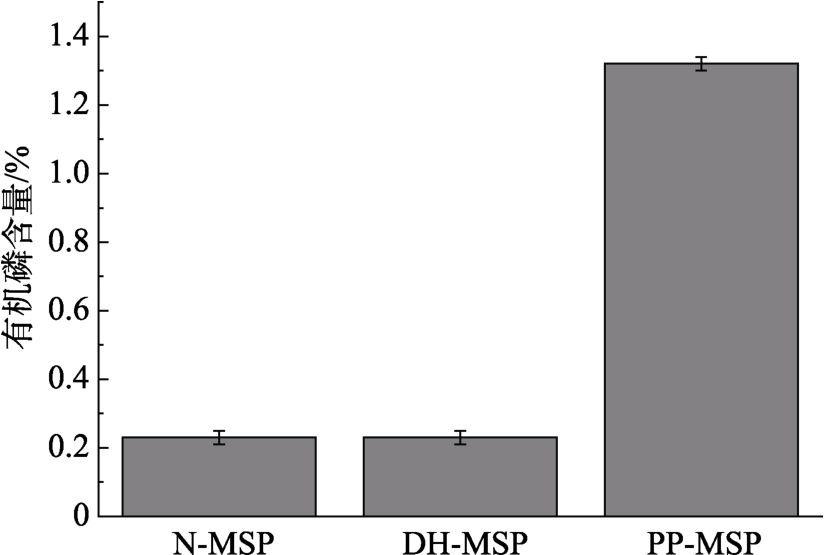
图1 磷酸化辣木籽蛋白中的磷含量
Fig.1 Effect of pH on the phosphorus content in MSP protein phosphorylated by dry-heating in the presence of pyrophosphate(PP-MSP)
2.1.2 磷酸化辣木籽蛋白溶解度测定
本实验采用Lowry法[26]测定样品溶解度。蛋白质的溶解度对食品的粘度、凝胶性、起泡性、乳化性等功能特性有直接影响,这些特性是创制新型食品的基础。如表1所示,与未经过任何处理的辣木籽蛋白(N-MSP)相比,未加入焦磷酸盐干燥加热的辣木籽蛋白(DH-MSP)溶解度有所下降。但在焦磷酸盐存在条件下干燥加热的辣木籽蛋白(PP-MSP)溶解度达到99.4%,与N-MSP溶解度相当。表明干燥加热磷酸化改善了辣木籽蛋白的溶解性。有研究表明干燥加热磷酸化修饰能改善蛋清蛋白[28],牛血清蛋白[34],卵转铁蛋白[35]的溶解性。另有研究表明a-乳白蛋白(a-la)、β-乳球蛋白(β-lg)、牛血清蛋白(BSA)[36],乳清分离蛋白(WPI)[37],乳清水解蛋白(WPA)[37]经过糖基化修饰,其溶解度提高,其原因可能是由于糖基化作用在蛋白质表面引入了羟基基团,致使蛋白质的等电点降低。本研究中干燥加热磷酸化修饰使辣木籽蛋白溶解度增高可能是由于引入的磷酸基团亲水作用的结果[22]。
表1 磷酸化辣木籽蛋白的特性
Table 1 Characteristics of MSPs

表面巯基含量/(mol/mol)溶解度/%浑浊度(595 nm)吸光度(280 nm)N-MSP 0.223 100 0.131 0.759 DH-MSP 0.329 98.8 1.050 0.831 PP-MSP 0.476 99.4 0.254 0.820
2.1.3 磷酸化辣木籽蛋白巯基含量测定
表面巯基含量的测定采用 Ellman等[27]的方法。如表1所示,未加入焦磷酸盐干燥加热能使辣木籽蛋白的表面巯基含量增加,在焦磷酸盐存在条件下干燥加热使辣木籽蛋白表面巯基含量进一步增加。这一结果与Li等用鸭蛋清蛋白[22]和鸡蛋清蛋白[27]研究的结果一致。研究表明干燥加热或磷酸化修饰能使蛋白质表面巯基含量增加可能与蛋白质结构展开有关[38-39] 。有趣的是,另有研究表明蛋白质表面巯基含量的增加能使其抗氧化性提高[40-41]。Žilić等[42]以玉米蛋白为样品确定了表面巯基的含量和抗氧化性存在正相关。
2.1.4 浑浊度和吸光度值
未经干燥加热或磷酸化修饰的辣木籽蛋白(浓度为 2 mg/mL)在 595 nm处的吸光度值为0.131,此时溶液为澄清透明。辣木籽蛋白经干燥加热后,其浑浊度明显升高。然而,在焦磷酸盐存在的情况下干燥加热的辣木籽蛋白,其溶液透明度与未经任何修饰的辣木籽蛋白溶液接近。表明磷酸化修饰能够抑制由于干燥加热引起的浑浊增加。有研究表明磷酸化修饰能使蛋白质溶解度增加,这可能与磷酸基团的引入增加了分子的静电排斥力有关[39]。同时,各样品溶液(蛋白浓度为1 mg/mL)在280 nm处的吸光度也证明了这一结论。
2.2 磷酸化对辣木籽蛋白结构的影响
2.2.1 色氨酸的荧光强度
蛋白质的荧光主要来源于色氨酸、酪氨酸和苯丙氨酸,其中色氨酸荧光最强。蛋白质与其它分子相互作用会引起荧光强度降低,称为荧光猝灭。本实验中,磷酸基团作为猝灭剂。如图2所示,辣木籽蛋白经过干燥加热磷酸化修饰之后,其色氨酸荧光强度有所降低,可能是由于磷酸基团在色氨酸残基附近形成结合位点,阻碍了色氨酸荧光的展现[43]。
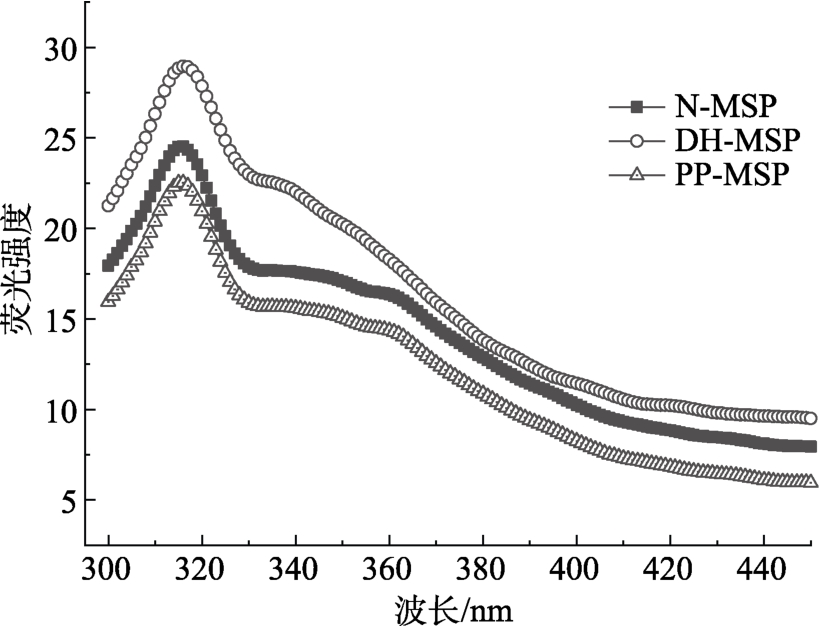
图2 N-MSP、DH-MSP和PP-MSP的色氨酸荧光光谱
Fig.2 Tryptophan (Trp) fluorescence spectra of N-MSP, DH-MSP and PP-MSP
2.2.2 圆二色谱(CD)测定
蛋白质α-螺旋结构在208 nm和222 nm处有两个特征性的肩峰,因此可以利用 CD图谱判断蛋白质的二级结构。如图3所示,经干燥加热或磷酸化修饰的辣木籽蛋白在 222 nm 处的特征值略微升高,表明辣木籽蛋白经干燥加热磷酸化修饰,其二级结构发生一定改变[39]。
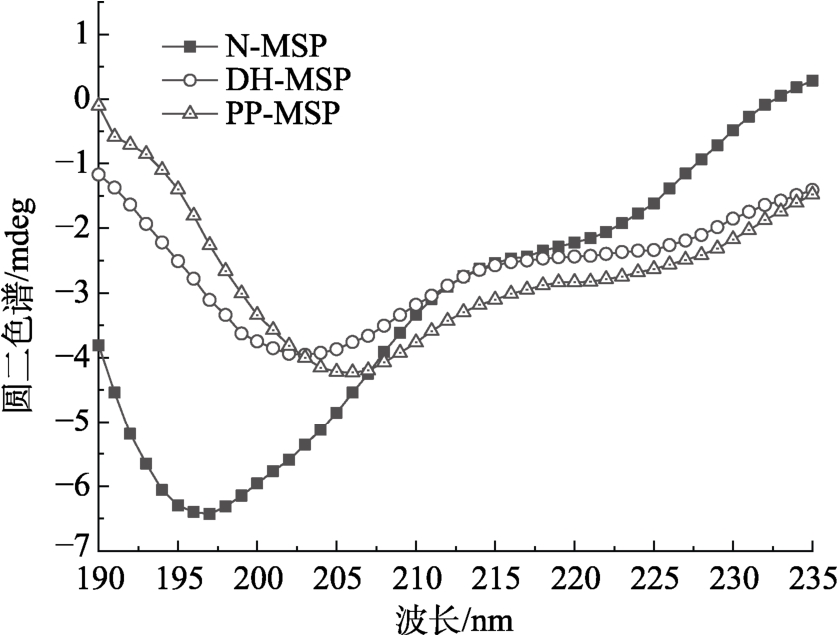
图3 干燥加热磷酸化修饰对N-MSP、DH-MSP和PP-MSP二级结构的影响
Fig.3 Effect of phosphorylation on the secondary structure of N-MSP, DH-MSP and PP-MSP
2.2.3 红外光谱
在蛋白质的红外光谱中有两个主要的特征吸收带,即酰胺Ⅰ带和酰胺Ⅱ带。酰胺Ⅰ带在1 600~1 700 cm-1处有吸收(主要是C=O的伸缩振动),酰胺Ⅱ带在1540 cm-1处有吸收,酰胺Ⅰ带对蛋白质二级结构的改变比酰胺Ⅱ带更敏感[33]。如图4所示,经干燥加热磷酸化修饰的辣木籽蛋白的酰胺Ⅰ带从 1 639.8 cm-1移动到 1 618.3 cm-1,酰胺Ⅱ带从 1 540.4 cm-1 移动到 1 539.7 cm-1,表明辣木籽蛋白经干燥加热磷酸化修饰,其二级结构发生了一定的改变。
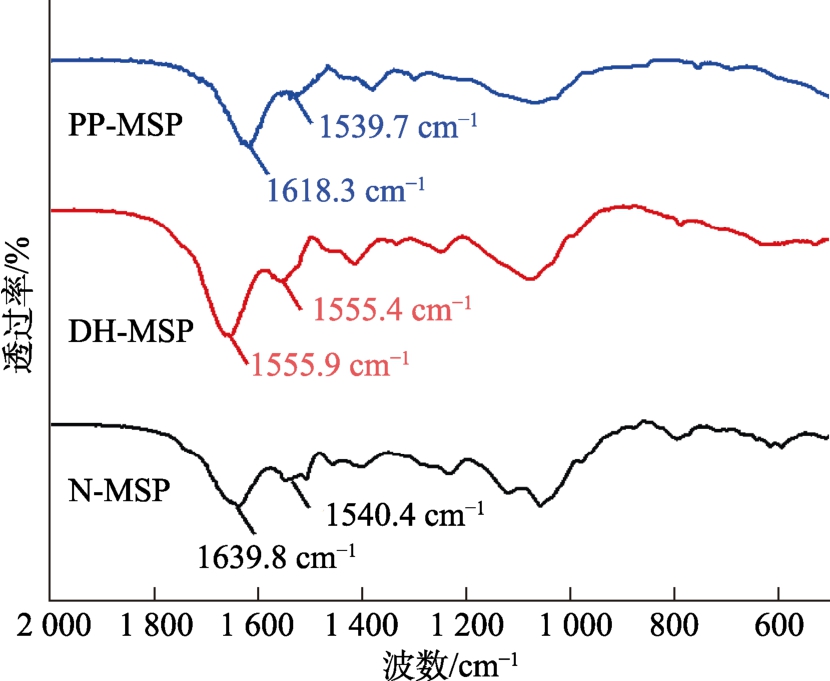
图4 N-MSP、DH-MSP和PP-MSP的红外光谱
Fig.4 FTIR spectra of N-MSP, DH-MSP and PP-MSP
2.3 磷酸化对辣木籽蛋白抗氧化活性的影响
2.3.1 ABTS+自由基清除能力
ABTS法最是一种用于体外测定物质总抗氧化能力的方法。ABTS(全名为 2,2-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐)经过氧化生成一种稳定的阳离子自由基ABTS+·,可以在734 nm的最大吸收峰处形成一个蓝绿的发色团。在该反应体系中,溶液退色程度越明显则表明所检测物质的总抗氧化能力越强[44]。如图5所示,在同一浓度下,PP-MSP对 ABTS自由基的清除能力显著高于N-MSP和DH-MSP。表明辣木籽蛋白经干燥加热磷酸化修饰,ABTS+自由基的清除能力显著提高。YIN等[20,22]利用ABTS法评价磷酸化修饰的鸡蛋清蛋白和鸭蛋清蛋白的抗氧化性也得到同样的结果。暗示蛋白质抗氧化能力的提高归因于磷酸基团的引入。
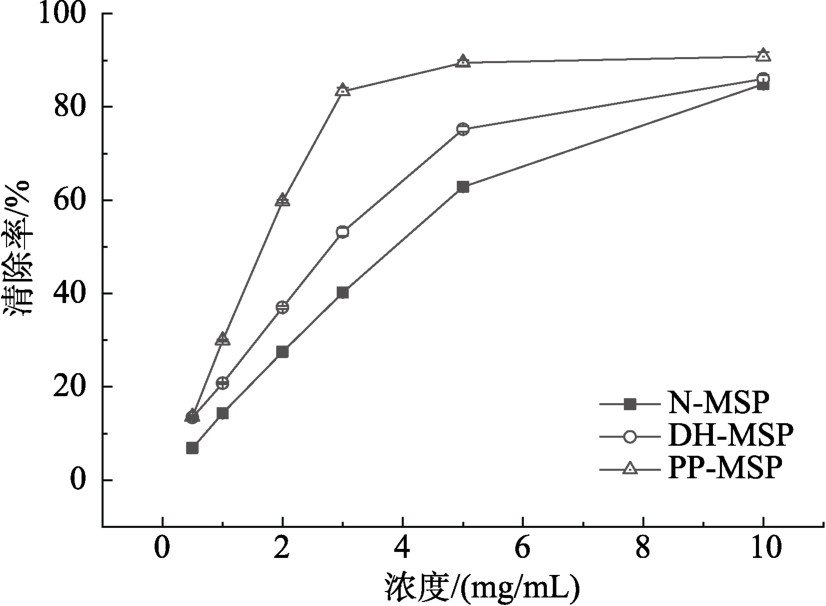
图5 N-MSP、DH-MSP和PP-MSP对ABTS+自由基的清除能力
Fig.5 ABTS+ free radical scavenging effects of N-MSP,DH-MSP, and PP-MSP at concentrations of 0.1-10.0 mg/mL
2.3.2 超氧阴离子自由基清除能力
超氧阴离子也是在正常生理情况下产生的一类具有高反应活性的自由基,它能氧化蛋白质、脂质等生物分子。如图6所示,PP-MSP的超氧阴离子自由基清除能力(20.15%)高于 N-MSP(11.02%)和DH-MSP(13.32%)。表明辣木籽蛋白经干燥加热后,对超氧阴离子自由基清除能力有所提高,辣木籽蛋白经干燥加热磷酸化修饰,对超氧阴离子自由基清除能力进一步提高。前期研究磷酸化修饰的鸡蛋清蛋白[20]和鸭蛋清蛋白[22]的抗氧化性也得到相似的结果。
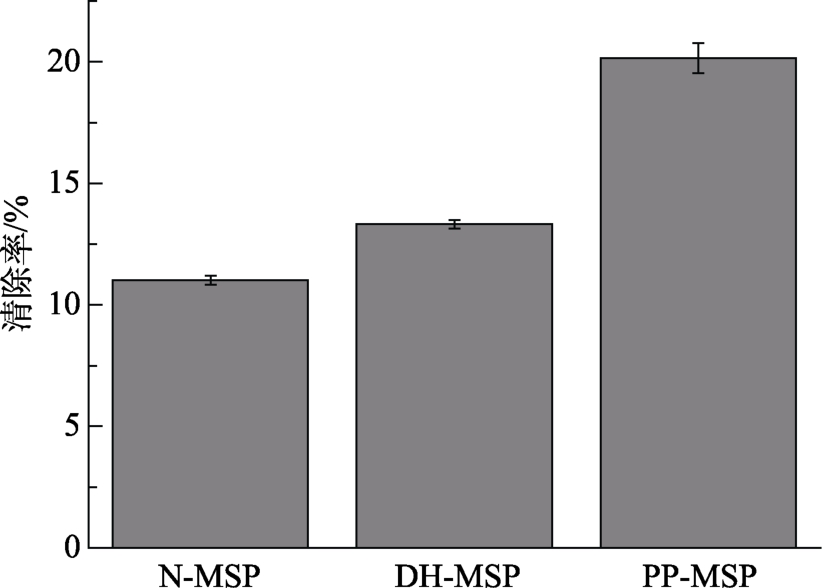
图6 N-MSP、DH-MSP和PP-MSP对超氧阴离子的清除能力
Fig.6 Superoxide anion scavenging activity of N-MSP,DH-MSP, and PP-MSP at concentrations of 1.0 mg/mL
2.3.3 二价铁离子的螯合能力
过渡金属(二价铁离子)能导致机体产生活性氧,某些蛋白质螯合剂可以通过改变过渡金属的物理位置形成不溶性金属配合物,降低过渡金属的化学反应活性[45]。如图7所示,辣木籽蛋白经过干燥加热磷酸化修饰,对二价铁离子螯合能力显著提高。众所周知,EDTA是很好的螯合剂,被广泛用于食品中。在本实验中,当PP-MSP的浓度大于1 mg/mL时,螯合能力与EDTA相当。表明经干燥加热磷酸化修饰的辣木籽蛋白是一种很好的抗氧化剂,有望应用于食品工业。
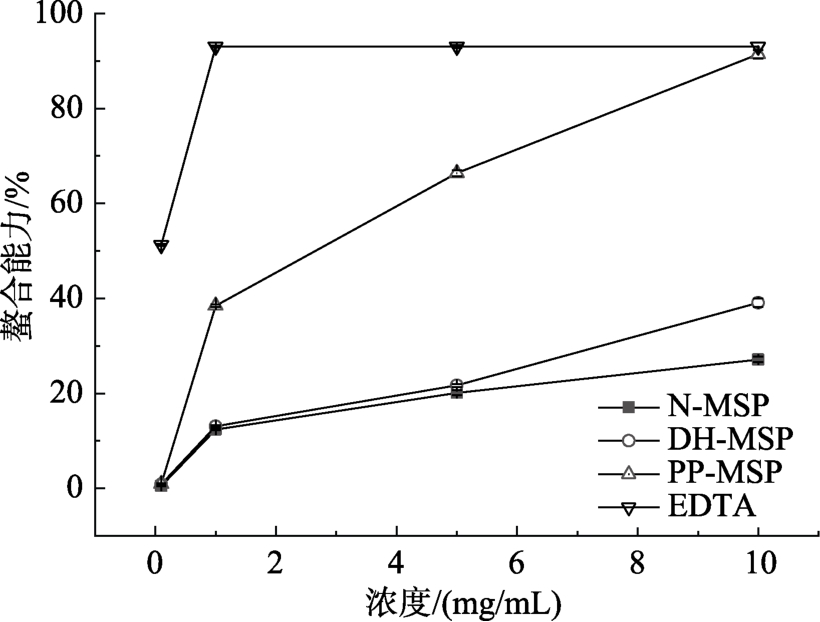
图7 N-MSP、DH-MSP和PP-MSP对二价铁离子的螯合能力
Fig.7 Chelating capacity of N-MSP, DH-MSP, and PP-MSP
3 结论
本文采用干燥加热磷酸化法成功制备干燥加热磷酸化辣木籽蛋白(PP-MSP),干燥加热磷酸化修饰使其抗氧化性显著提高,尤其是螯合能力与EDTA基本相等。通过磷酸化修饰,辣木籽蛋白二级结构发生一定改变,表面巯基含量增加且蛋白质的溶解性、浑浊度基本未受影响。抗氧化性显著提高可能是因为:①带负电荷的磷酸基团的引入使辣木籽蛋白的静电相互作用增强。②干燥加热磷酸化修饰增加了辣木籽蛋白的表面巯基含量。
综上所述,干燥加热磷酸化法可作为一种很好的提高蛋白质抗氧化特性的方法。此法能在温和条件下完成,副反应少,蛋白质变性程度小;同时,采用焦磷酸盐作为磷酸化试剂,反应试剂易于通过透析去除,这为食品添加剂中添加抗氧化剂的创制提供了可能。
[1]VAKNIN Y, MISHAL A. The potential of the tropical “miracle tree” Moringa Oleifera and its desert relative Moringa peregrina as edible seed-oil and protein crops under mediterranean conditions[J]. Scientia Horticulturae, 2017, 225: 431-437.
[2]盛军. 现代辣木生物学[M]. 云南出版集团公司, 云南科技出版社, 2015.SHENG J. Modern moringa oleifera lam biology [M]. Yunnan Publishing Group CO., LTD, Yunnan Science and Technology Press, 2015.
[3]HSU R. Moringa Oleifera: medicinal and socio-economic uses,international course on economic botany[J]. National Herbarium Leiden, Netherlands, 2006, 2-6.
[4]SILESHI T, MAKONNEN E, DEBELLA A, et al. Tesfaye,antihyperglycemic and sub-chronic toxicity study of Moringa stenopetala leaves in mice[J]. Journal of Coastal Life medicine,2014(3): 214-221.
[5]MEHTA L K, BALARAMAN R, AMIN A H, et al. Effects of fruits of M. Oleifera on the lipid profile of normal and hypercholesterolaemic rabbits[J]. Journal of Ethnopharmacology,2003, (86): 191-195.
[6]RANA J S, NIEUWDORP M, JUKEMA J W, et al.Cardiovascular metabolic syndromean interplay of obesity,inflammation, diabetes and coronary heart disease[J]. Diabetes Obesity and Metabolism, 2010, 9, 218-232.
[7]LIMÓN-PACHECO J, GONSEBATT M E. The role of antioxidants and antioxidant-related enzymes in protective responses to environmentally induced oxidative stress[J]. Mutation Research, 2009, 674(1-2): 137-147.
[8]CHUMARK P, KHUNAWAT P, SANVARINDA Y, et al. The in vitro and ex vivo antioxidant properties, hypolipidaemic and antiatherosclerotic activities of the water extract of Moringa Oleifera lam. leaves[J]. Journal of Ethnopharmacology, 2008,116(3): 439-446.
[9]MOYO B, OYEDEMI S , MASIKA P J , et al. Polyphenolic content and antioxidant properties of Moringa Oleifera leaf extracts and enzymatic activity of liver from goats supplemented with Moringa Oleifera leaves/sunflower seed cake[J]. Meat Science, 2012, 91(4): 441-447.
[10]SREELATHA S, PADMA P R. Antioxidant activity and total phenolic content of Moringa Oleifera leaves in two stages of maturity [J]. Plant Foods for Human Nutrition, 2009, 64(4): 303-311.
[11]裴斐, 陶虹伶, 蔡丽娟, 等. 辣木叶多酚超声辅助提取工艺响应面法优化及抗氧化活性研究[J]. 食品科学, 2016, 1-11.PEI F, TAO H L, CAI L J, et al. Optimization of polyphenols from Moringa oleifera Lam. leaves by uItrasound-assisted extraction using response surface methodology and their antioxidant activities[J]. Food Science, 2016, 1-11.
[12]吴迪, 赵贝贝, 耿曼璐, 等. 正交试验优化超声提取辣木叶总黄酮及其抗氧化活性研究[J]. 粮食与油脂, 2017, 30(8): 96-99.WU D, ZHAO B B, GENG M L, et al. Optimization of utrasonic extraction of total flavonoids from Moringa oleifera leaves and their antioxidant activities by orthogonal test[J]. Cereals and Oils, 2017, 30(8): 96-99.
[13]马波, 朱建国, 邵世光, 等. 乙酰化辣木多糖的制备及其抗氧化活性研究[J]. 食品工业科技, 2017(18): 207-210.MA B, ZHU J G, SHAO S G, et al. Preparation and antioxidant activity of acetylated polysaccharide from Moringa oleifera[J].Science and Technology of Food Industry, 2017(18): 207-210.
[14]ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, et al.Amino acid composition and antioxidant properties of Moringa Oleifera seed protein isolate and enzymatic hydrolysates[J].Heliyon, 2018, 4(10): e00877.
[15]ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, et al. In vitro antihypertensive and antioxidative properties of alcalasederived Moringa Oleifera seed globulin hydrolysate and its membrane fractions[J]. Journal of Food Processing and Preservation,2019, 43(2): e13862. 1-e13862. 8.
[16]ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, et al. In vitro antihypertensive and antioxidative properties of trypsinderived Moringa Oleifera seed globulin hydrolyzate and its membrane fractions[J]. Food Science & Nutrition, 2019, 7(1):132-138.
[17]TARELLI E, WHEELER S F. Drying from phosphate-buffered solutions can result in the phosphorylation of primary and secondary alcohol groups of saccharides, hydroxylated amino acids, proteins, and glycoproteins[J]. Analytical Biochemistry,1994, 222(1): 196-201.
[18]MATHEIS G, WHITAKER J R. Chemical phosphorylation of food proteins:an overview and a prospectus[J].Journal of Agricultural and Food Chemistry, 1984, 32: 699-705.
[19]李灿鹏, 陈德义, 赵逸云, 等. 食品蛋白质磷酸化改性的研究进展[J]. 食品科学, 2009(11): 252-255.LI C P, CHEN D Y, ZHAO Y Y, et al. Research progress on phosphorylation modification of food protein[J]. Food Science,2009(11): 252-255.
[20]YIN C Y, YANG L, ZHAO H, et al. Improvement of antioxidant properties of egg white protein by phosphorylation and conjugation of epigallocatechin gallate[J]. Food Research Internationnal. 2014, 64: 855-863.
[21]LI C P, ENOMOTO H, HAYASHI Y, et al. Recent advances in phosphorylation of food protein: A review [J]. LWT-Food Science and Technology. 2010, 43, 1295-1300.
[22]刘自单, 殷春雁, 李灿鹏. 干燥加热磷酸化修饰对鸭蛋清蛋白结构和抗氧化活性影响的研究[J]. 食品研究与开发, 2020,41(24): 31-38.LIU Z D, YIN C Y, LI C P. Phosphorylation of duck egg white protein by dry-heating in the presence of pyrophosphate: effect on protein structure and antioxidant activity[J]. Food Research and development, 2020, 41(24): 31-38.
[23]孙坤来, 陈子阳, 陈常健, 等. 一种从印度辣木籽中活性蛋白提取方法[P]. 2017, 申请(专利)号: CN106701873 A.SUN K L, CHEN Z Y, CHEN C J, et al. A method for extracting active protein from moringa oleifera seed[P]. 2017, CN106701873 A.
[24]LI C P, SALVADOR A S, IBRAHIM H R, et al. Phosphorylation of egg white proteins by dry-heating in the presence of phosphate[J]. Journal of Agricultural and Food Chemistry, 2003,51(23): 6808-6815.
[25]CHEN P S, TORIBARA T Y, WARNER H. Microdetermination of phosphorus[J]. Analytical Chemistry, 1956, 28(11): 1756-1758.
[26]LOWERY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Biochemistry,1951, 193: 265-267.
[27]ELLMAN G T. Tissue sulphydryl groups. Arch[J]. Biochemistry and Biophysics, 1959, 82: 70-75.
[28]LI C P, IBRAHIM H R, SUGIMOTO Y, et al. Improvement of functional properties of egg white protein through phosphorylation by dry-heating in the presence of pyrophosphate[J]. Journal of Agricultural and Food Chemistry, 2004, 52(18): 5752-5758.
[29]ZHANG H B, CHEN T F, JIANG J, et al. Selenium-containing allophycocyanin purified from selenium-enriched spirulina platensis attenuates AAPH-induced oxidative stress in human erythrocytes through inhibition of ROS generation[J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8683-8690.
[30]ZHANG T, LI Y H, MIAO M, et al. Purification and characterization of a new antioxidant peptide from chickpea(cicer arietium L.) protein hydrolysates[J]. Food Chemistry,2011, 128(1): 28-33.
[31]WU H C, SUN B, CHANG C L, et al. Low-molecular-weight peptides as related to antioxidant properties of chicken essence[J].Journal of Food and Drug Analysis, 2005, 13(2): 176-183.
[32]LI C P, HE Z K, WANG X Y, et al. Selenization of ovalbumin by dry-heating in the presence of selenite: effect on protein structure and antioxidant activity[J]. Food Chemistry, 2014, 148: 209-217.
[33]WU X L, WU H, LIU M X, et al. Analysis of binding interaction between (-)-epigallocatechin (EGC) and β-Lactoglobulin by multi-spectroscopic method[J]. Spectrochimica Acta Part A, 2011,82(1): 164-168.
[34]HAYASHI Y , LI C P, ENOMOTO H, et al. Improvement of functional properties of ovotransferrin by phosphorylation through dry-heating in the presence of pyrophosphate[J]. Asian Australasian Journal of Animal Sciences, 2008, 21(4): 596-602.
[35]JIMÉNEZ-CASTAÑO L, VILLAMIEL M, LÓPEZ-FANDIÑO R. Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J]. Food Hydrocolloids,2007, 21(3): 433-443.
[36]MARTINEZ-ALVARENGA M S, MARTINEZ-RODRIGUEZ E Y, GARCIA-AMMMEZQUITA L E, et al. Effect of Maillard reaction conditions on the degree of glycation and functional properties of whey protein isolate-maltodextrin conjugates[J].Food Hydrocolloids, 2014, 38: 110-118.
[37]NOOSHKAM M, MADADLOU A. Microwave-assisted isomerisation of lactose to lactulose and Maillard conjugation of lactulose and lactose with whey proteins and peptides [J]. Food Chemistry, 2016, 200: 1-9.
[38]GUO H, KOUZUMA Y, YONEKURA M. Structures and properties of antioxidative peptides serived from royal jelly protein[J]. Food Chemistry, 2009, 113(1): 238-245.
[39]LI C P, ENOMOTO H, OHKI S, et al. Improvement of functional properties of whey protein isolate through glycation and phosphorylation by dry-heating [J]. Journal of Dairy Science,2005, 88(12): 4137-4145.
[40]TAYLOR M J, RICHARDSON T. Antioxidant activity of skim milk: effect of heat and resultant sulfhydryl groups[J]. Journal of Dairy Science, 1980, 63(11): 1783-1795.
[41]ELIAS R J, KELLERBY S S, DECKER E A. Antioxidant activity of proteins and peptides. critical review in food [J].Science and Nutrition, 2008, 48(5): 430-441.
[42] ILI
ILI S, AK ll o
S, AK ll o LU G, SERPEN A, et al. Effects of isolation, enzymatic hydrolysis, heating, hydratation and Maillard reaction on the antioxidant capacity of cereal and legume proteins[J]. Food Research International, 2012, 49: 1-6.
LU G, SERPEN A, et al. Effects of isolation, enzymatic hydrolysis, heating, hydratation and Maillard reaction on the antioxidant capacity of cereal and legume proteins[J]. Food Research International, 2012, 49: 1-6.
[43]WU X, HE W, WANG W, et al. Investigation of the interaction between (-)-epigallocatechin- 3-gallate with trypsin and α-chymotrypsin[J]. International Journal of Food Science &Technology, 2013, 8(11): 2340-2347.
[44]朱玉昌, 焦必宁. ABTS法体外测定果蔬类总抗氧化能力的研究进展[J]. 食品与发酵工业, 2005, 31(8): 77-80.ZHU Y C, JIAO B N. Research progress on ABTS assay in determination of TAA in fruits and vegetables invitro[J]. Food and Fermentation Industries, 2005, 31(8): 77-80.
[45]DIAZ M, DUNN C M, MCCLEMENTS D J, et al. Use of casein-phosphopeptides as natural antioxidants in oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2003,51(8): 2365-2370.
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。