卷烟烟气是一种复杂的混合物,化学物质种类繁多,其中大部分具有毒性作用,本实验室利用活体小鼠探索建立了体内安全评价方法[1],获得了很好的实验效果。后续的研究中发现这些烟气成分中一部分具有氧化性,当组织或细胞受到全烟气暴露时,机体内的氧化-抗氧化平衡被破坏,细胞会表现出氧化应激与炎症反应,并且引发机理性损伤。研究发现,当细胞出现氧化应激反应时,胞内的活性氧族(ROS)以及活性氮族(RON)的活性增加,对脂质、蛋白质和遗传物质等造成不同程度的氧化损伤[2]。活性氧是指机体内或大自然中由氧组成,含氧并且性质活泼的物质的总称,在正常的生命过程中,活性氧维持在一个正常水平,具有一定的免疫和信号转导功能,是机体的有效防御系统,但是在一定条件下,由于产生和清除的活性氧失去了正常平衡,通常会导致活性氧对机体的损伤。细胞遭受到氧化损伤后,会激活胞内的抗氧化防御系统[3]。机体存在的抗自由基抗氧化两大防御体系:一类是酶性防御体系,包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)等。另一类是非酶性防御体系,包括谷胱甘肽(GSH)、维生素E、维生素C等[4-5]。本文选取暴露时长1 h组,以SOD、活性氧(ROS)、CAT、GSH-Px、总抗氧化能力(T-AOC)为指标,通过对细胞进行卷烟全烟气暴露处理,研究全烟气对细胞抗氧化能力的影响。
1 材料与方法
1.1 试验材料
V79细胞株:中科院上海细胞资源中心;GSH-PX测试试剂、总超氧化物歧化酶(T-SOD)测试试剂盒、CAT测试试剂盒、蛋白定量测试试剂盒、T-AOC检测试剂盒、ROS测定试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
Heraeus Pico 17 高速常温离心机、NanoDrop2000微量紫外分光光度计:Thermo Scientific;QL-902漩涡混合器:江苏海门其林贝尔仪器制造有限公司;JS-680B水浴锅:上海培清科技有限公司;F-7000荧光分光光度计:日立公司。
1.3 试验方法
1.3.1 细胞培养技术
将V79细胞接种于含有10%胎牛血清(FBS)的高糖培养基DMEM中,在25 cm2的一次性培养瓶中培养,培养箱设置的环境为温度37 ℃、二氧化碳浓度为 5%、湿度为 95%。生长良好的细胞呈单层贴壁生长,每2~3 d需要传代一次,细胞生长到占瓶底约90%时进行传代,一般选取对数生长期的细胞用于实验将细胞悬液用细胞计数仪测定浓度,加培养基调整至实验需要的浓度,设置空白组、实验组和对照组,每组6个重复,每孔 100 uL。需要在接种细胞的孔周围加注100 uLPBS缓冲液,以防边缘实验孔的培养基在培养箱中蒸发,影响实验结果。
1.3.2 细胞全烟气暴露
1.3.2.1 将细胞接种至微孔膜 取微孔膜一张,光滑面朝上放入培养皿中,加入 1 mLDMEM 培养基,浸润20 min;将传代后的细胞在37 ℃,二氧化碳浓度5%,95%湿度的环境下培养48 h。倒出培养基,用 2 mL PBS清洗两次,用含0.02%EDTA的0.25%胰蛋白酶消化后,向培养瓶中加入 3 mLDMEM培养基吹散,向放有微孔膜的培养皿中加入1 mL细胞悬液,静置10~20 min,小心转移至二氧化碳培养箱中培养。24 h后换液,换液时,将培养皿倾斜,用移液枪缓慢吸出旧培养基,再缓慢加入 2 mL新培养基,然后放入二氧化碳培养箱,再培养24 h待用。
1.3.2.2 细胞全烟气暴露处理 将接种有细胞的微孔膜放入全烟气暴露模型中,实验组通入烟气,对照组通入纯净空气,对细胞进行暴露处理。其中,实验组设置0.5、1、1.5 h三个时间组,每个时间组设置3个浓度组,分别为4支烟/h、6支烟/h、8支烟/h,每支烟的整个燃吸过程大约持续5 min,均匀的分布于整个暴露过程,其余的时间通如等流量的纯净空气。稀释程度按烟气 60%,空气 40%。每个时间组设置一个对照,对细胞进行同时长同流量的暴露处理。
1.3.3 细胞ROS含量检测
采用DCF法检测全烟气暴露后,用试剂盒检测细胞内的ROS水平[6-7]。
将DCFH-DA配制成浓度为20 μM的溶液,避光放置。取新的培养皿,将全烟气暴露处理后细胞连同微孔膜一起放置于培养皿中,将 1 mL DCFH-DA的培养基溶液加入培养皿,放入二氧化碳培养基孵育1 h。
将培养基小心吸弃,加入1 mL的0.25%胰酶消化 2 min 后,再直接加入 1 mL PBS,轻轻吹打,使微孔膜上的细胞脱落下来,收集细胞悬液转移至 2 mL 离心管,1 000 r/min 离心 7 min。
将上清吸弃,用2 mL PBS清洗2次,离心收集细胞沉淀。
用PBS将细胞沉淀重悬,调整至1×106个/mL,上荧光分光光度计,激发波长490 nm,发射波长530 nm测吸光度。
1.3.4 细胞破碎
首先将细胞用胰酶消化下来,接着收集细胞悬液,然后 1 000 G 离心 7 min,弃上清。用 PBS小心清洗两次,再次离心,用PBS重悬。本实验中,把PBS重悬后细胞悬液浓度全部调整为1×105个/mL。取0.7 mL细胞悬液转移至2 mL的离心管中,将离心管放入液氮中冷冻30 s,取出后放入冰水混合物中解冻10 min,如此反复冻融3次,所得细胞破碎液可直接用于检测。
1.3.5 全烟气暴露后细胞的蛋白浓度测定
使用蛋白定量测试盒测定待测细胞的蛋白浓度。
1.3.6 全烟气暴露后细胞的T-AOC、SOD、CAT、GSH-Px活性检测
使用南京建成生物工程研究所的试剂盒,检测待测细胞的 SOD、GSH-Px、CAT、T-AOC活性,并根据说明所给的公式计算结果。实验进行三次重复,取平均值,并计算偏差。
1.4 数据分析
试验数据均采用平行试验的平均值,试验结果用 Microsoft Office Excel 2016 对其进行分析。
2 结果与分析
2.1 全烟气暴露处理对V79细胞内ROS水平的影响
在真核细胞的有氧呼吸过程中,有一部分氧没有被完全还原,生成具有较强氧化作用的ROS,包括羟自由基过氧化氢(H2O2)、超氧阴离子![]() 、(HO-)等[8]。正常条件下,生命过程中所产生的活性氧会维持在一个正常的水平,本身具有一定的免疫以及信号转导功能,属于机体有效防御系统的一部分,但是过多的活性氧会对细胞和机体造成损伤,由于性质活泼,它会与蛋白质、核酸和脂肪发生反应,破坏这些物质的结构,扰乱细胞的正常功能[9-10]。
、(HO-)等[8]。正常条件下,生命过程中所产生的活性氧会维持在一个正常的水平,本身具有一定的免疫以及信号转导功能,属于机体有效防御系统的一部分,但是过多的活性氧会对细胞和机体造成损伤,由于性质活泼,它会与蛋白质、核酸和脂肪发生反应,破坏这些物质的结构,扰乱细胞的正常功能[9-10]。
实验分别对各组细胞进行一小时的空气暴露和4、6、8支烟/h浓度的烟气暴露处理,然后用荧光分光光度计分别检测各组的吸光度。结果显示,同时长条件下,V79细胞内的ROS水平随着烟气浓度的提高而上升,各浓度组与对照组比较皆有显著性差异(P<0.05)。当全烟气浓度为8支烟/h,细胞内的ROS水平为对照组的近2.5倍,说明全烟气对V79细胞内的ROS水平影响很大,V79细胞内的ROS水平迅速升高,是细胞大量死亡的原因之一。结果见图1。
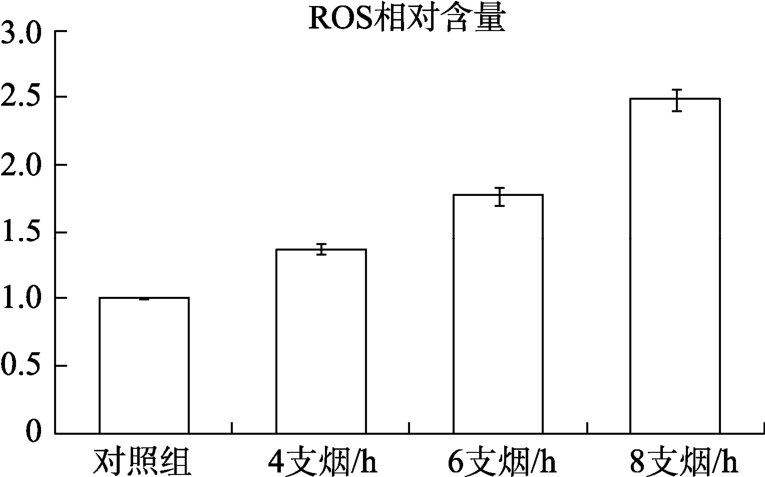
图1 全烟气暴露处理后细胞内ROS相对含量
Fig.1 Relative content of ROS in cells after whole smoke exposure treatment
2.2 全烟气暴露处理对V79细胞内SOD活力的影响
SOD是机体对抗氧自由基的酶促防御体系中重要的组成部分。SOD能催化机体内的超氧化物歧化反应,在抗氧化酶中处于至关重要的地位。在活性氧清除系统里,它是抗氧化酶中第一个发挥作用的[11]。SOD对机体的氧化与抗氧化平衡起着至关重要的作用,它能清除超氧阴离子自由基(O2-)保护细胞免受损伤[12]。因此,细胞内的SOD的含量能够反映细胞的抗氧化能力。本试验中,对V79细胞进行全烟气暴露后,4支烟/h浓度下,细胞内的SOD活性较对照组略有提升,而随着烟气浓度的增加,细胞内的 SOD活性明显降低,详见表1,图2。SOD是已知的机体中,目前惟一能够特异性地清除体内超氧自由基的抗氧化酶,SOD可以把机体内过量的超氧自由基歧化成过氧化氢,然后在过氧化氢酶和谷胱甘肽过氧化物酶的催化作用下转化为水,防止细胞被自由基伤害[13]。实验结果表明,低剂量的烟气刺激下,SOD活性出现了短暂的提升,来消除细胞因烟气刺激产生的过量活性氧。而随着烟气剂量的增高,SOD会因消除自由基造成自身的损耗,这直接反映于细胞内SOD活性的降低,细胞对超氧化物的还原能力也随之弱化,无法抵御烟气刺激对细胞的损伤。
表1 全烟气对V79细胞SOD活性的影响
Table 1 Effect of whole smoke on SOD activity of V79 cells
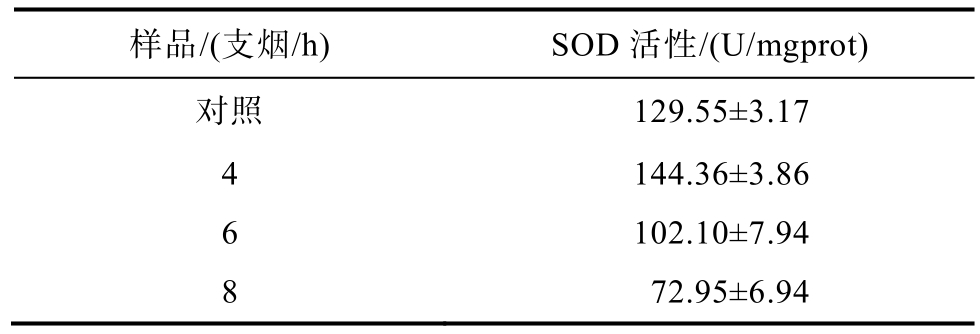
样品/(支烟/h) SOD 活性/(U/mgprot)对照 129.55±3.17 4 144.36±3.86 6 102.10±7.94 8 72.95±6.94
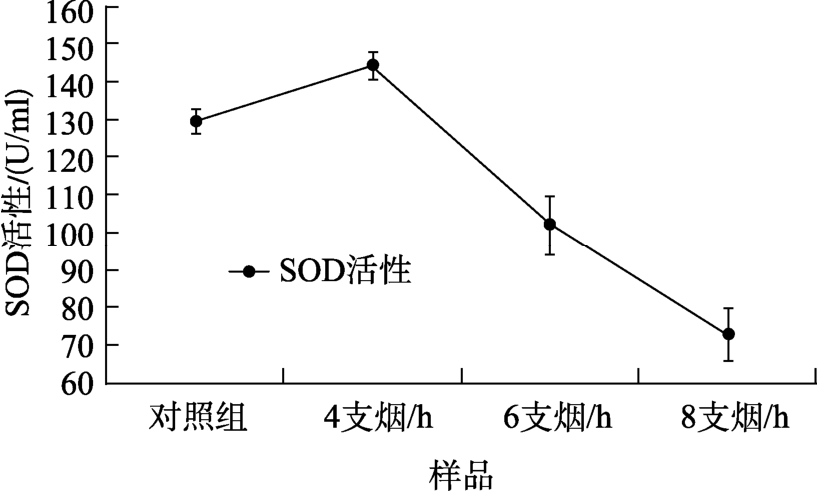
图2 全烟气对V79细胞SOD的影响结果图
Fig.2 Results of the effect of whole smoke on V79 cell SOD
2.3 全烟气暴露处理对 V79细胞内GSH-PX活力的影响
谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)广泛存在于机体内的一种重要的催化过氧化氢分解的酶。对于单个细胞,细胞膜的完整性是保持细胞内环境稳定,保障各项生理活动有序进行的重要基础[14]。每当细胞受到外援化合物的攻击时,细胞膜是最先受到损伤的,而细胞膜损伤会导致膜内物质的外逸,致使细胞死亡。在细胞的生命活动中,当机体出现过量的自由基时,超氧自由基被SOD歧化成H2O2,然后在GSH-PX和过氧化氢酶的催化作用下,将其转化为水,从而达到保护机体的目的。对于经烟气暴露的 V79细胞,同时间下,GSH-PX的活力随着烟气浓度的升高而降低,结果具有显著性(P<0.05),详见表2,图3。结果说明,全烟气可能会抑制细胞内GSH-PX的活性,同时,为了清除细胞内由烟气刺激产生的过量自由基,也消耗了不少GSH-PX,造成机体内抗氧化能力的降低。
表2 全烟气对V79细胞GSH-PX活性的影响
Table 2 Effect of whole smoke on GSH-PX activity of V79 cells

样品/(支烟/h) GSH-PX 活性(U/mgprot)对照 343.77±6.24 4 267.95±13.16 6 206.48±9.17 8 368.04±9.68
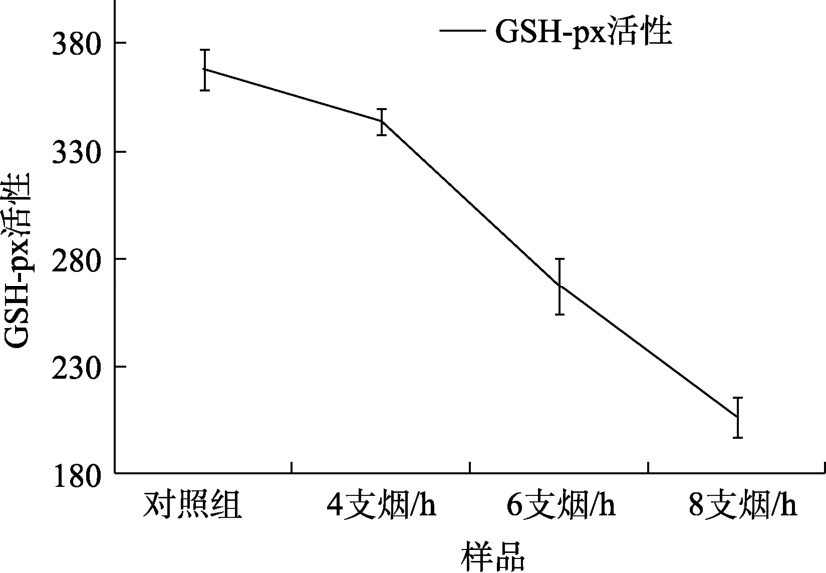
图3 全烟气对V79细胞GSH-PX活力的影响结果图
Fig.3 Effect of whole smoke on the vitality of GSH-PX in V79 cells
2.4 全烟气暴露处理对V79细胞内CAT活力的影响
CAT是一类末端氧化酶,是生物防御系统中的关键酶之一[15]。CAT在细胞中与GSH-PX一起清除代谢产生的过氧化氢,使细胞免受过氧化物的毒害[16]。本实验中,经烟气暴露处理的V79细胞中,CAT的活力值随着烟气浓度的升高而降低。实验进行3次重复,结果具有显著性(P<0.05),详见表3,图4。
表3 全烟气对V79细胞CAT活性的影响
Table 3 Effect of whole smoke on the activity of V79 cell CAT

样品/(支烟/h) CAT 活性(U/mgprot)对照 42.92±1.45 4 39.20±0.82 6 34.37±0.74 8 27.28±0.92
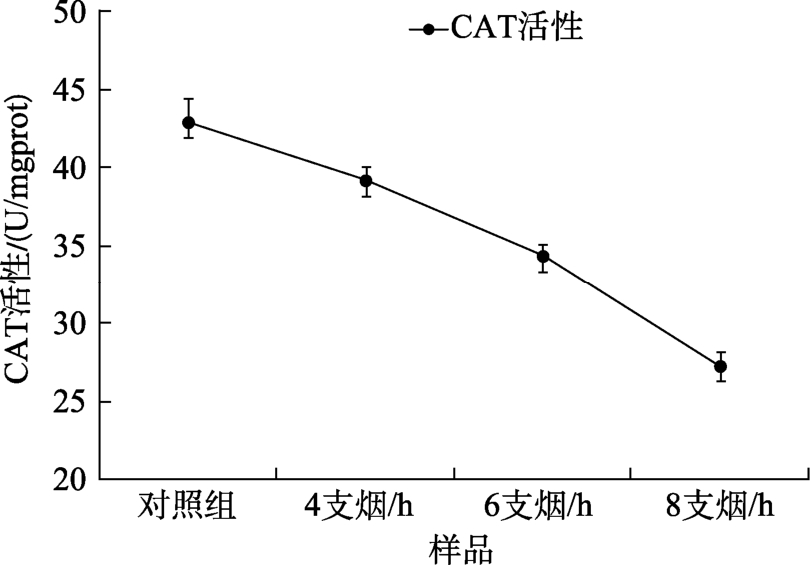
图4 全烟气对V79细胞CAT活力的影响结果图
Fig.4 The effect of whole smoke on the vitality of V79 cell CAT
2.5 全烟气暴露处理对V79细胞内T-AOC活力的影响
目前的研究中,T-AOC是常用来反映机体抗氧化功能情况的一个重要的综合性指标,它可以显示机体中非酶促系统以及抗氧化酶系统应对外来刺激的代偿能力和机体内自由基的代谢情况[17]。T-AOC衡量机体具有的总的抗氧化能力,当检测到机体T-AOC活力显著降低时,说明机体内的抗氧化系统受到了大量消耗,间接反映了机体内有过量的自由基产生,这在研究机体是否受到氧化损伤时,是某些特定的单项抗氧化剂指标所无法替代的[18-19]。本实验中,当V79细胞受到1 h不同浓度的烟气暴露后,T-AOC活力较对照组显著下降(P<0.05),详见表4,图5。而且随着浓度的增加,T-AOC的活性下降的更快,这说明烟气使得细胞整体的抗氧化能力下降,细胞内的自由基无法及时被清除,对细胞造成了一定的氧化损伤。
表4 全烟气对V79细胞T-AOC活性的影响
Table 4 Effect of whole smoke on the activity of T-AOC in V79 cells

样品/(支烟/h) T-AOC 活性(U/mgprot)对照 54.18±1.05 4 49.36±0.77 6 41.22±1.15 8 27.08±1.46
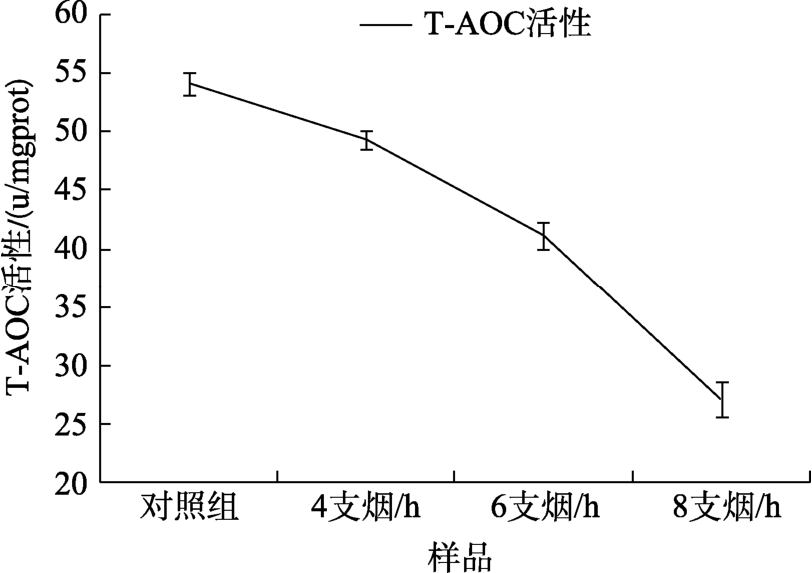
图5 全烟气对V79细胞T-AOC活力的影响结果图
Fig.5 The effect of whole smoke on the vitality of V79 cell T-AOC
3 结论
通过对 V79细胞进行1 h不同浓度4、6、8支烟/h的全烟气暴露,选取 ROS、SOD、GSH-Px、CAT、T-AOC为指标,研究全烟气对细胞抗氧化能力的影响。结果表明,全烟气会对细胞内的抗氧化物质产生消耗和抑制,导致胞内的活性氧自由基含量增加,抑制的效果随烟气浓度的增加而愈加显著。过量的活性氧会导致细胞的氧化损伤,导致细胞死亡。
[1]宁维, 陈利平, 李瑜, 等. 卷烟烟气体内安全评价方法研究[J]. 河南农业科学, 2013, 42(9): 152-156.NING W, CHEN L P, LI Y, et al. Study on the safety evaluation methods of cigarette smoke in vivo[J]. Agricultural science in Henan, 2013, 42(9): 152-156.
[2]李美娟, 劳乔聪, 姜永新, 等. 几种植物原花青素及其片段化产物的抗 ROS 活性评价[J]. 西部林业科学, 2014(1): 99-103.LI M J, LAO Q C, JIANG Y X, et al. In Vivo Anti-ROS activities of the fragmentive products of several proanthocyanidins[J].Western Forestry Science, 2014(1): 99-103.
[3]李霏, 黄金兰, 崔雯, 等. 积雪草乙酸乙酯提取物对 Aβ25-35片段所致的 PC12细胞损伤模型及 SAMP8小鼠脑内 SOD,GSH-Px 的影响[J]. 中国实验方剂学杂志, 2014, 20(4): 111-114.LI F, HUANG J L, CUI W, et al. Effects of ethyl acetate extract on PC12 cell damage models and SOD, GSH-Px in SAMP8 mice in A beta 25-35 fragments[J]. Chinese Journal of Experimental Pharmacology, 2014, 20(4): 111-114.
[4]邓洋, 许秀举, 于海平. 啤酒对大鼠血清的LDH和T-AOC的影响[J]. 食品科技, 2009, 34(5): 120-122.DENG Y, XU X J, YU H P. Influence of beer on LDH and T-AOC of rats[J]. Food technology, 2009, 34(5): 120-122.
[5]窦传字, 吴焕淦, 王硕硕, 等. 艾烟溶液干预人肺腺癌细胞活性氧和超氧化物歧化酶的活性[J]. 中国组织工程研究, 2015,19(7): 1057-1062.DOU C Z, WU H G, WANG S S, et al. Activities of reactive oxygen species and superoxide dismutase in human lung adenocarcinoma cells impacted by moxa smoke solution[J].Organizational engineering research in China, 2015, 19(7):1057-1062.
[6]丁黎敏, 黄小民, 张卓一, 等. 原花青素对过氧化氢损伤内皮细胞 SOD、GSH-PX 活性的影响[J]. 中国中医急症, 2013,22(5): 714-716.DING L M, HUANG X M, ZHANG Y Z, et al. Effect of procyanidins on the activities of SOD, GSH -PX in endothelial cell injured by hydrogen perdxide[J]. Chinese traditional medicine emergency, 2013, 22(5): 714-716.
[7]纪元, 龙建纲, 刘健康. 自噬发生中的 ROS 调节机制[J]. 中国生物化学与分子生物学报, 2014, 30(4): 321-327.JI Y, LONG J G, LIU J K. The role of reactive oxygen species in autophagy[J]. China Journal of Biochemistry and Molecular Biology, 2014, 30(4): 321-327.
[8]杨硕, 苏畅, 张永亮, 等. 急性低压缺氧大鼠脑组织中细胞红蛋白 MDA SOD CAT 的表达变化[J]. 山东医药, 2016(13):30-32.YANG S, SU C, ZHANG Y L, et al. Changes in the expression of cell hemoglobin MDA SOD CAT in brain tissue of acute low-pressure hypoxia rats[J]. Shandong Medicine, 2016(13):30-32.
[9]蒋玉清, 金哲雄. 香烟烟气对小鼠血清SOD及MDA的影响[J]. 黑龙江医药, 2009(1): 77-78.JIANG Y Q, JIN Z X. Effects of cigarette smoke on serum SOD and MDA in mice[J]. Heilongjiang Medicine, 2009(1): 77-78.
[10]于昱, 吕林, 张亿一, 等. 硒对硒蛋白-谷胱甘肽过氧化物酶基因表达及其酶活性的调节[J]. 动物营养学报, 2007, 19(sl):469-474.YU Y, LV L, ZHANG Y Y, et al. Selenium regulates the gene expression of selenium protein-glutathione peroxidase and its enzyme activity[J]. Journal of Animal Nutrition, 2007, 19(sl):469-474.
[11]王秀娜, 耿忠诚, 王燕, 等. 饲粮硒来源及添加水平对仔猪组织中细胞内谷胱甘肽过氧化物酶基因 mRNA表达的影响[J].动物营养学报, 2010, 22(6): 1630-1635.WANG X N, GENG Z C, WANG Y, et al. Effects of sources and levels of dietary selenium on the expression level of mRNA of celluar glutathione peroxidase gene in piglets[J]. Journal of Animal Nutrition, 2010, 22(6): 1630-1635.
[12]李仕飞, 刘世同, 周建平, 等. 分光光度法测定植物过氧化氢酶活性的研究[J]. 安徽农学通报, 2007, 13(2): 72-73.LI S F, LIU S T, ZHOU J P, et al. Mensuration of catalase vigor in plants with spectrophotometry[J]. Anhui Agricultural Bulletin,2007, 13(2): 72-73.
[13]张哲, 陈欢欢, 杨婵丽, 等. 胞内SOD1活性的ATSM抑制对ERK 信号通路的影响[J]. 中国科学: 化学, 2015, 45(8): 829-835.ZHANG Z, CHEN H H, YANG C L, et al, ATSM inhibition of intracellular SOD1 activity and its effect on ERK signaling pathway[J]. Chinese Science: Chemistry, 2015, 45(8): 829-835.
[14]覃鹏, 刘飞虎, 梁雪妮. 超氧化物歧化酶与植物抗逆性[J]. 黑龙江农业科学, 2002(1): 31-34.TAN P, LIU F H, LIANG X N. Superoxide dismutase and plant resistance to the environmental stress[J]. Heilongjiang Agricultural Science, 2002(1): 31-34.
[15]卢彦珍, 张友云, 李应续, 等. 缺氧对小鼠心 Ca~(2+)-Mg~(2+)-ATPase及 CAT 的影响[J]. 长治医学院学报, 1996(4):325-327.LU Y Z, ZHANG Y Y, LI Y X, et al. Effect of hypoxia on mouse heart Ca-(2 plus) -Mg-(2 plus)-ATPase and CAT[J]. Journal of Changzhi Medical College, 1996(4): 325-327.
[16]邱钰超, 谢丽霞, 黄玲萍, 等. GPx1 对肺癌 A549 微球体细胞增殖 、 凋亡的调控作用及可能的作用机制[J]. 肿瘤, 2017,37(3): 225-236.QIU Y C, XIE L X, HUANG L P, et al. The role of GPx1 in proliferation and apoptosis of lung cancer A549 spheres and its possible mechanism[J]. Tumor, 2017, 37(3): 225-236.
[17]李欣芮, 王江薇, 孙明江. 宣木瓜对烟气致小鼠肺损伤的干预研究[J]. 中医药导报, 2016(8): 23-25.LI X R, WANG J W, SUN M J. Intervention study on xuanmugua (Chaenomeles Speciosa S. Nakai) for smoke-caused pulmonary injury in mice[J]. Introduction to Chinese medicine,2016(8): 23-25.
[18]于扬, 魏景艳. 谷胱甘肽过氧化物酶及其合成机制[J]. 生物物理学报, 2013, 29(10): 724-737.YU Y, WEI J Y. Glutathione peroxidase and its synthesis mechanism[J]. Journal of Biophysics, 2013, 29(10): 724-737.
[19]刘灵芝, 钟广蓉, 熊莲, 等. 过氧化氢酶的研究与应用新进展[J]. 化学与生物工程, 2009, 26(3): 15-18.LIU L Z, ZHONG G R XIONG L, et al. Research and application progress of catalase[J]. Chemical and biological engineering,2009, 26(3): 15-18.