酸值是指中和 1 g油脂中游离脂肪酸(free fatty acid,FFA)所需要的氢氧化钾毫克数,也是油脂精炼程度和新鲜度的重要标志之一[1]。食用植物油作为人们日常膳食中不可缺少的一部分,除了可以改善和提高食品口感、风味和物性外,还可提供人体脂溶性维生素和磷、铁、钙、钾等矿物质,为人体提供能量,具有很高的营养价值[2-3]。然而,在植物油加工和储藏过程中,水分、光、氧、酶、热等因素会引起油脂的酸败变质,油脂会发生水解,产生FFA。FFA中不饱和脂肪酸不稳定,容易导致油脂的氧化和酸败,产生醛、酮、酸等低分子有异味物质,最终会降低油脂的品质甚至对人体健康产生不利影响[4]。因此,食用植物油FFA含量的测定对保障其品质和安全十分重要。此外,在油料种子的形成过程中,脂肪酸和甘油经酯化形成脂肪的反应不彻底,导致植物油料中残留 FFA[5],油脂碱炼脱酸过程可除去残留的FFA和油料加工储藏过程中产生的FFA,酸值是油脂碱炼脱酸过程中计算用碱量的依据,可以指导食用油生产,也是评价油脂精炼程度的重要指标[6]。
目前,食用油酸值常用分析方法为滴定法。滴定法操作简便、易行,对大多数种类食用油的检测是有效的,但该法对于少部分油脂的检测存在局限性:对于颜色较深的油脂如四级菜籽油,其背景颜色会干扰对滴定终点指示剂颜色变化的判断[1];对于含有除FFA外其它酸性物质的油脂,如含有高含量谷维素的米糠油,谷维素会干扰滴定终点指示剂的颜色变化,从而影响滴定终点的判定[7];对于低FFA含量的油脂,滴定法的精确度和灵敏度较低;在测定数量较大的油脂样品时,需要大量化学试剂,检测耗时长,无法满足酸值现场快速检测的要求[1]。为了克服滴定法存在的问题,现已开发了许多仪器分析方法包括光谱法、电化学法、比色法和色谱法等作为滴定法的潜在替代方法,这些方法可能需要各种复杂的仪器,在分析速度、自动化适应性和减少有害溶剂方面都有较好的表现,有良好的灵敏度和准确性[2]。本综述对食用植物油FFA产生途径、酸值测定方法的特点和现状进行了探讨,以期为食用植物油酸值检测方法的应用和创新提供参考,实现各种植物油酸值的快速准确检测。
1 FFA产生途径
FFA是指一端含有一个活泼羧基的脂肪酸碳氢链,其化学通式为 RCOOH,食用油中存在的FFA,一部分是油籽中脂肪酸酯化不彻底经精炼后仍残留的;另一部分是甘油三酯的水解产物[8]。在食用油储存过程中,受水分、微生物、酶、光照、温度、空气等多种因素影响,致使油脂发生水解酸败,产生 FFA[9]。食用油中甘油三酯水解产生FFA的过程见图1。
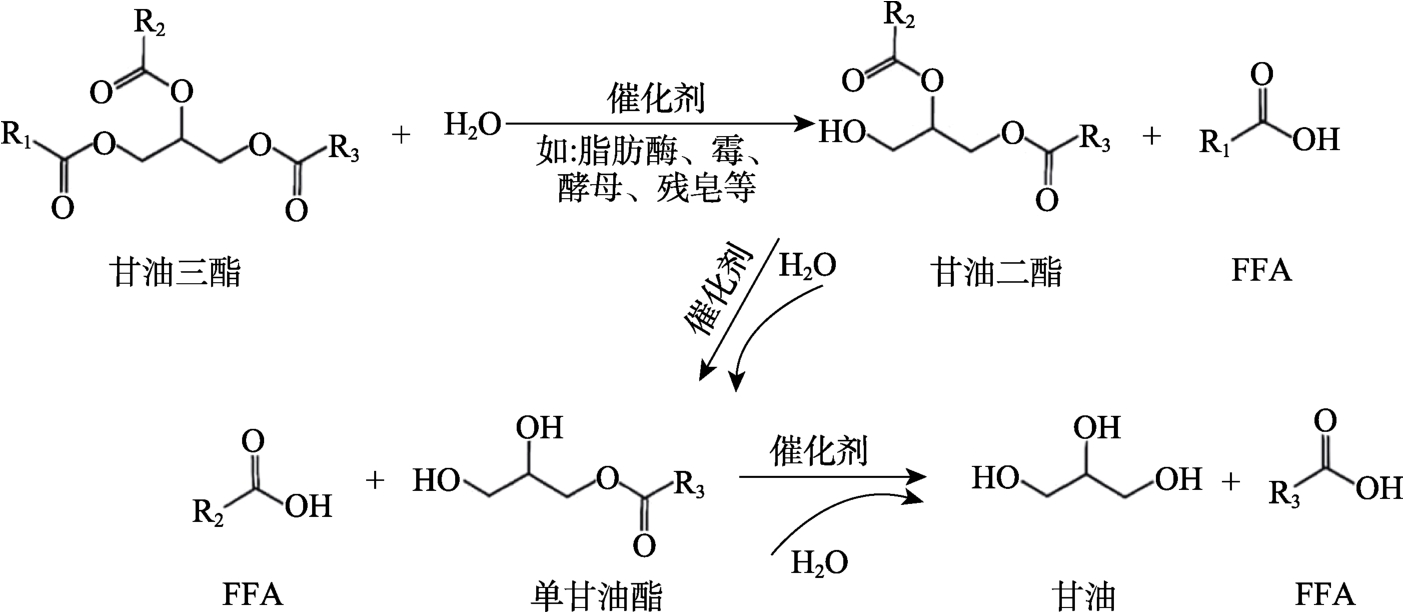
图1 食用油FFA的产生途径[10-11]
Fig.1 Production pathway of free fatty acid in edible oil[10-11]
注:R1、R2、R3表示不同的脂肪酸烷基。
Note: R1, R2 and R3 represent different fatty acid alkyl groups.
由图1可知,甘油三酯的水解分步进行,甘油三酯在微量水存在条件下,经脂肪酶、霉、酵母、残皂等催化剂催化,逐次产生甘油二酯、单甘油酯、甘油,伴随产生FFA[10-11]。甘油三酯水解过程中FFA含量变化见图2。
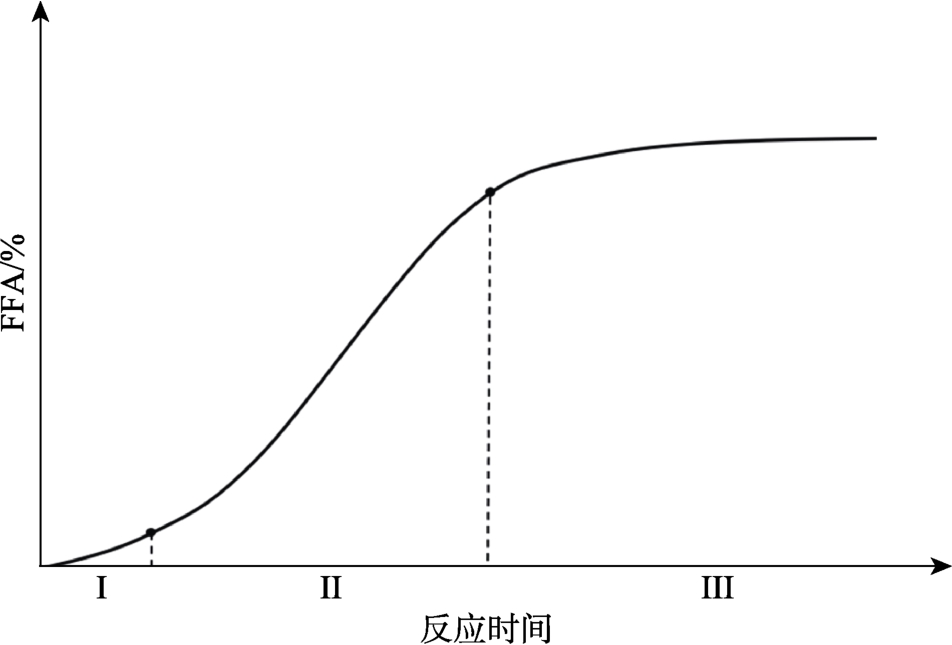
图2 甘油三酯水解反应过程[12]
Fig.2 Hydrolysis reaction process of triglyceride[12]
由图2可知,在水及催化剂存在条件下,甘油三酯发生自动催化反应,随反应的进行,FFA的产生速率不断变化。该过程可以分为三个阶段,首先是Ⅰ初期诱导期,水解产生FFA的速率慢,这是由于水在油中的溶解度较低,而水解速率与油脂和水的互溶性有关;Ⅱ中期水解速率加快,这是由于随着反应的进行,水解产生甘油二酯和单甘油酯,二者极性大于甘油三酯,且具有表面活性,增大了水在油中的溶解度,从而增大油水相的接触面积;Ⅲ后期由于水解产物(甘油和FFA)浓度的不断增加,导致酯化速率加快,水解速率降低,当酯化速率与水解速率相等时,水解反应趋于平衡,FFA含量达最大值[11-12]。
水解酸败是由脂肪酶和水共同造成的,在一定程度上,水分含量是影响食用油品质的重要因素,即使0.1%的水分就可以使油脂发生水解,且水解生成的FFA含量远远超出了阈值范围[11]。油脂中含有的水分,既是油脂发生水解变质的前提,也是各种酶显示活性以及微生物生长的前提,所以,应控制油脂中水分含量大小,减缓油脂水解的发生。此外,在高温条件下,甘油和FFA都会部分蒸发,从而促进了水解反应的进行[10],因此,应避免食用油暴露在光、热的环境中,提高油脂稳定性。
饱和FFA在一系列酶的催化下氧化生成有怪味的酮酸和甲基酮[13]。不饱和FFA发生自氧化反应,产生氢过氧化物,并被进一步分解为低分子酮、醛、醇类[11]。一般情况下,食用油中FFA的存在对人体不造成危害,但因其极易发生反应,进一步产生醛、酮、酸等,产生刺激性气味,使油脂的营养价值大大降低,食用后影响人体正常的消化吸收功能,并可能对人体的健康产生不利影响[8]。因此,监控油脂中FFA含量,评价食用油的新鲜度和油脂品质好坏,有着十分重要的意义。
2 国标法及其改进
食品安全国家标准中规定了食用油酸值测定的三种方法,分别是冷溶剂指示剂滴定法、冷溶剂自动电位滴定法、热乙醇指示剂滴定法[14],其比较见表1。
表1 食用油酸值检测三种滴定法的比较[14]
Table 1 Comparison of three titration methods for acid value detection of edible oil[14]

注:AVG:算数平均值。
Note: AVG: average.
项目 冷溶剂指示剂滴定法 冷溶剂自动电位滴定法 热乙醇指示剂滴定法溶剂 乙醚-异丙醇混合液1∶1 乙醚-异丙醇混合液1∶1 95%乙醇标准溶液 氢氧化钾或氢氧化钠标准溶液 氢氧化钾或氢氧化钠标准溶液 氢氧化钾或氢氧化钠标准溶液— 酚酞指示剂浅色油:1%酚酞乙醇溶液;深色油:1%百里酚酞乙醇溶液或碱性蓝6B乙醇溶液;米糠油:碱性蓝6B乙醇溶液精密度 酸值<1 mg/g,不超过AVG的15%;酸值≥1 mg/g,不超过AVG的12%
由表1可知,三种方法的溶剂、指示剂选择不同。在溶剂选择上,冷溶剂法溶剂毒性较大;在指示剂方面,冷溶剂指示剂法由于深色油脂滴定终点难以判断,因此针对颜色深浅的油样分别选择不同的指示剂,而对于深颜色油样,采用热乙醇法测定的结果平行性明显优于冷溶剂法[15],自动电位滴定法不受油脂颜色的干扰[7]。对于某些含有干扰成分的油脂如米糠油,米糠油中的谷维素是一种结构中带有酚羟基的物质,可以与标准溶液发生中和反应,从而影响结果的准确性,冷溶剂法和热乙醇法均无法有效避免该误差,而自动电位滴定法可排除 γ-谷维素对米糠油酸值检测的干扰[7]。自动电位滴定法采用自动滴定装置,抗干扰能力强;指示剂滴定法中热乙醇法需要加热,加热过程可能造成油脂酸值升高,对低酸值食用油影响较大,冷溶剂指示剂滴定法操作相对简单,但滴定过程中易出现油样与碱液未完全溶解在一起的情况,从而导致乳化浑浊现象,且两者测定结果均依赖于颜色变化和人工感官的判断,误差较大[16]。这三种滴定法可操作性强,成本较低,但是在测定酸值较低(<1 mg/g)的油脂时,精确度和灵敏度较低[14],且在测定数量较大的油脂样品时,化学试剂消耗量大,耗时长,无法满足现场快速检测的要求[1],特别是冷溶剂法溶剂的选择,乙醚具有一定毒性,对人体健康及环境均造成不良影响,因此,亟待寻找乙醚的替代溶剂,以达到环保经济的目的。
指示剂滴定法虽然存在一定局限性[17],但操作简单、易行,现仍是最普遍采用的食用油酸值测定方法。许多学者针对指示剂滴定法存在的问题对该法进行优化。马葱等[15]选用乙醇和石油醚混合溶剂作为提取溶剂,避免使用具有一定毒性且易使滴定终点褪色的乙醚;标准溶液使用氢氧化钾乙醇溶液代替氢氧化钾溶液,且碱液的用量不宜超过乙醇用量的1/4,从而避免滴定过程中出现浑浊现象。陈勤勤等[18]向油脂中加入饱和食盐水,可以破坏乳化现象使系统呈现明显的油水两相,通过食盐水层的颜色变化来间接判断滴定终点,使滴定终点更加清晰。王平东等[19]采用双液相滴定法,植物油脂中的黄色色素不溶于下层醇水相而保留于上层石油醚有机相中,从而避免了色素对滴定终点的干扰。曾史俊等[20]采用热乙醇法测定食用油酸值,结果表明:热乙醇法温度高,溶解能力强,扩散快,能及时判断滴定终点。
电位滴定法以 FFA发生中和反应所引起的“pH突跃”为依据判定滴定终点,排除了油脂试样颜色引起的终点判定误差[21],目前对电位滴定法的研究日渐成熟,李英军等[22]通过测定7种植物油酸值比较研究了人工滴定法与自动电位滴定法,结果表明:在测定颜色深且酸价高或者油脂颜色浅且酸价低的油脂时,自动电位滴定法的精密度更高一些。
3 光谱法
3.1 红外光谱法
3.1.1 近红外光谱法
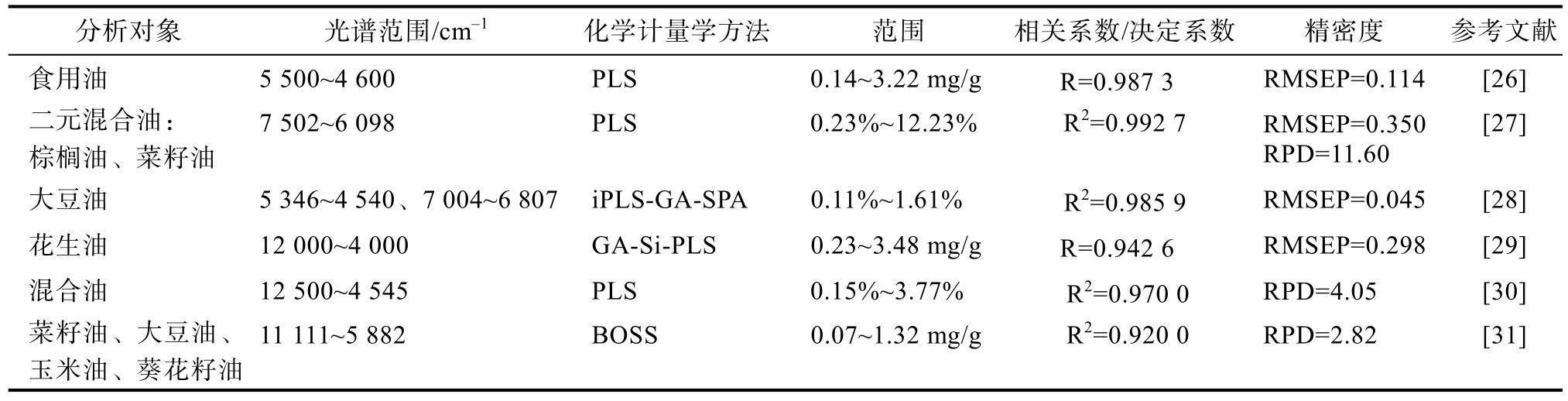
近红外(near infrared, NIR)光谱法是利用近红外谱区包含的物质信息,用于有机物质定性和定量分析的一种分析技术[23],该方法具有操作简便、定性定量准确、无需样品预处理、快速无损及多组分同时测定等优点[24]。食用油的NIR光谱是各种化学基团振动的倍频和组合频率的综合表现,可以通过观察C==O、O—H等基团伸缩振动的特征吸收来衡量其FFA含量。由于近红外光谱区的吸收强度弱、谱带复杂、重叠严重,因此必须借助化学计量学方法区分光谱间的不同[25],如偏最小二乘法(Partial least squares, PLS)、间隔偏最小二乘法(interval partial least squares, iPLS)、组合区间偏最小二乘法(synergy interval partial least square, Si-PLS)、遗传算法(genetic algorithm,GA)、 连续投影算法( successive projection algorithm, SPA)、蚁群优化算法(ant colony optimization, ACO)及引导软阈值算法(bootstrapping soft shrinkage, BOSS)等。NIR 光谱技术在食用油酸值测定中的应用见表2。
表2 NIR光谱技术在食用油酸值测定中的应用
Table 2 Application of NIR spectroscopy in determination of acid value of edible oil
注:R:相关系数;R2:决定系数;RMSEP:预测标准偏差;RPD:相对分析误差。
Note: R: correlation coefficient; R2: coefficient of determination; RMSEP: root mean square error of prediction; RPD: relative percent deviation.
分析对象 光谱范围/cm-1 化学计量学方法 范围 相关系数/决定系数 精密度 参考文献食用油 5 500~4 600 PLS 0.14~3.22 mg/g R=0.987 3 RMSEP=0.114 [26]二元混合油:棕榈油、菜籽油7 502~6 098 PLS 0.23%~12.23% R2=0.992 7 RMSEP=0.350 RPD=11.60[27]大豆油 5 346~4 540、7 004~6 807 iPLS-GA-SPA 0.11%~1.61% R2=0.985 9 RMSEP=0.045 [28]花生油 12 000~4 000 GA-Si-PLS 0.23~3.48 mg/g R=0.942 6 RMSEP=0.298 [29]混合油 12 500~4 545 PLS 0.15%~3.77% R2=0.970 0 RPD=4.05 [30]菜籽油、大豆油、玉米油、葵花籽油11 111~5 882 BOSS 0.07~1.32 mg/g R2=0.920 0 RPD=2.82 [31]
由表2可知,分析对象多为常见食用植物油,选择光谱范围大多在 4 600~7 500 cm-1范围内,这可能与C==O、O—H等基团的倍频和组合频在该光谱范围内有特征吸收有关。化学计量学方法大多采用 PLS,PLS可以降低模型复杂度,提高模型的预测精度。Yang等[29]分别采用PLS、Si-PLS、GA-PLS、GA-Si-PLS、ACO-PLS五种方法测定花生油酸值,结果表明:所有变量选择方法的性能都比PLS模型更好一些,特别是GA-Si-PLS。由此可见,PLS与其他数据处理方法相结合,有助于提高模型性能,使得在低于4 mg/g的酸值范围内,均能取得较为可靠的结果,国家标准GB2716—2018《食品安全国家标准 植物油》中规定食用植物油的酸值应不高于3 mg/g[32],说明可以通过NIR技术判断植物油酸值是否在安全范围内。此外,光谱法是基于某些基团的特征吸收对食用油酸值进行测定,不同的基团吸收峰强度不同,因此光谱法可以有效的避免米糠油中谷维素的干扰,实现准确测定。然而,由于不同类型的油品需要不同的NIR酸值测定模型,模型的通用性可能会限制其应用,充足的数据库和完善的校正模型是NIR技术测定食用油酸值的基础,因此,应合理选取并扩充样本、不断调整校正模型,以提高 NIR技术的准确度,进一步扩大其应用范围。
3.1.2 中红外光谱法
傅里叶变换红外(Fourier transform infrared,FTIR)光谱技术可以通过监测有机化合物官能团的特征吸收进行检测分析[33]。FTIR技术操作简单快捷,无需样品预处理,灵敏度高,可以实现在线监测,在实际工作中具有良好的应用前景[34]。由于食用油 FTIR光谱难以获得,因此需借助一定光谱采集方法来获取光谱信息,光谱采集方法包括液池法、衰减全反射(attenuated total reflection,ATR)、涂膜法及红外石英比色皿法(infrared quartz cuvette, IQC)。
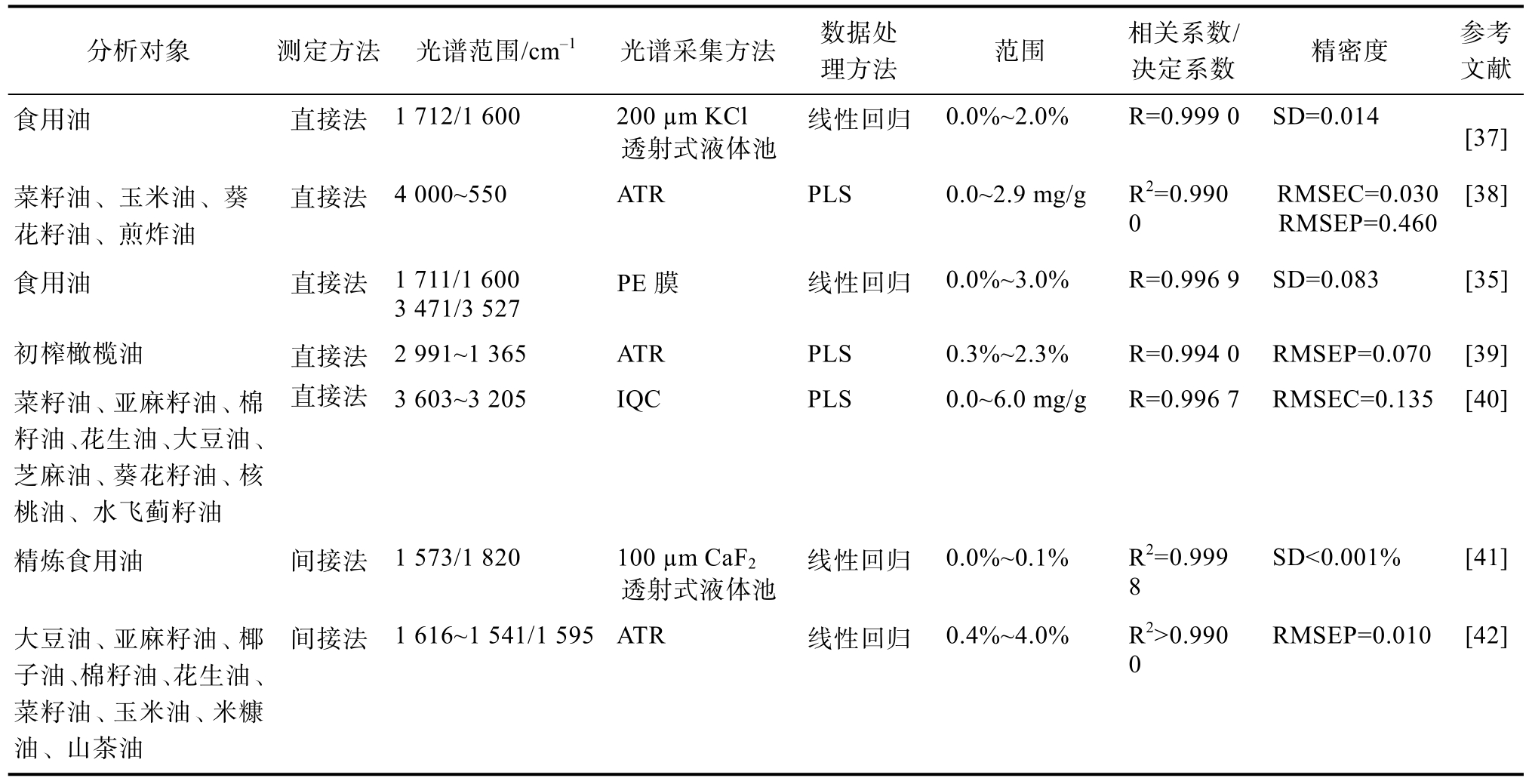
FTIR光谱技术定量测定油脂 FFA含量的方法,可分为直接法和间接法。直接法是基于C==O在1 711 cm-1处的特征吸收,通过建立模型进而实现对食用油FFA含量的测定,但测定结果易受甘油三酯(C==O在1 746 cm-1处有特征吸收峰)和基底效应的影响[33]。为了克服上述缺点,笔者所在团队设计了一种基于聚乙烯(polyethylene,PE)膜的FTIR光谱技术,通过研究甘油三酯(—C==O)的倍频特征吸收峰(3 471/3 527 cm-1),将酯振动的干扰强度降低到±0.083%[35]。间接法是用碱性物质把食用油中的FFA转化为羧酸盐,羧酸盐的羧基(COO—)基团在1 573 cm-1处有特征吸收,进而实现食用油中FFA含量的间接测定,避免了羰基吸收的干扰。Li等[36]使用新型光谱仪VFA-IR测定食用油中FFA含量,以乙醇为萃取剂,将FFA转化为羧酸盐,测定其在1 573 cm-1处的特征吸收峰,消除了基底效应。有关FTIR光谱技术在食用油酸值测定中的应用见表3。
表3 FTIR光谱技术在食用油酸值测定中的应用
Table 3 Application of FTIR spectroscopy in determination of acid value of edible oil
注:R:相关系数;R2:决定系数;SD:标准偏差;RMSEC:校正标准偏差;RMSEP:预测标准偏差。
Note: R: correlation coefficient; R2: coefficient of determination; SD: standard deviation; RMSEC: root mean square error of calibration; RMSEP: root mean square error of prediction.
分析对象 测定方法 光谱范围/cm-1 光谱采集方法 数据处理方法 范围 相关系数/决定系数 精密度 参考文献食用油 直接法 1 712/1 600 200 µm KCl透射式液体池线性回归 0.0%~2.0% R=0.999 0 SD=0.014 [37]菜籽油、玉米油、葵花籽油、煎炸油直接法 4 000~550 ATR PLS 0.0~2.9 mg/g R2=0.990 0 RMSEC=0.030 RMSEP=0.460[38]食用油 直接法 1 711/1 600 3 471/3 527 PE膜 线性回归 0.0%~3.0% R=0.996 9 SD=0.083 [35]初榨橄榄油 直接法 2 991~1 365 ATR PLS 0.3%~2.3% R=0.994 0 RMSEP=0.070 [39]菜籽油、亚麻籽油、棉籽油、花生油、大豆油、芝麻油、葵花籽油、核桃油、水飞蓟籽油直接法 3 603~3 205 IQC PLS 0.0~6.0 mg/g R=0.996 7 RMSEC=0.135 [40]精炼食用油 间接法 1 573/1 820 100 µm CaF2透射式液体池线性回归 0.0%~0.1% R2=0.999 8 SD<0.001% [41]大豆油、亚麻籽油、椰子油、棉籽油、花生油、菜籽油、玉米油、米糠油、山茶油间接法 1 616~1 541/1 595 ATR 线性回归 0.4%~4.0% R2>0.990 0 RMSEP=0.010 [42]
由表3可知,FTIR技术分析对象为常见食用油,间接法与直接法相比,虽然使分析变得复杂,但却提高了分析的灵敏度和准确性,尤其是对于低含量FFA的检测。光谱采集方法大多采用液池法、ATR,IQC和PE膜作为新型光谱采集方法,其操作简便、精密度高。IQC作为FTIR附件,可以提供合适而准确的光程,能更准确地测定低酸值食用油FFA含量;涂膜法所使用的PE膜是一次性的,其操作简便,采集速度快,在0%~3%FFA水平的分析范围内具有较好的检测准确度[35]。数据处理方法以线性回归为主。FTIR技术测定结果准确度高、分析速度快,易于实现食用油加工过程的动态监控。但其光谱难以获得,需要借助附件来采集光谱,且直接法分析过程易受基底效应的影响,间接法虽避免了基底效应,但操作相对繁琐,关于如何改进光谱采集方法及消除基底效应仍需进一步研究与探讨,如能得到改进,FTIR技术将会更加便捷,其应用前景也将更加广阔。
3.2 拉曼光谱法
拉曼光谱是一种散射光谱,基于分子极化率的改变,可以提供不同官能团分子结构信息[43]。该技术具有仪器操作简单、检测范围广、无污染及可实现远距离在线分析检测的特点[44]。食用油拉曼光谱特征峰与FFA分子结构具有相关性,可应用于FFA含量测定[45]。
食用油酸值一般通过拉曼光谱和PLS结合建模来测定,El-Abassy等[46]采用 PLS结合拉曼光谱技术测定特级初榨橄榄油中FFA的含量,发现基于1 600~945 cm-1区域处的拉曼光谱模型,可以较好的预测所获得的 FFA含量。Jiang等[47]通过变量组合总体分析方法优化拉曼光谱特性后再建立支持向量机模型,使得模型性能有了明显提高,验证了应用拉曼光谱结合多元分析技术实现食用油酸值(0.113~1.804 mg/g)在储藏过程中定量分析的可行性。相比于传统滴定法,拉曼光谱技术的准确性受油脂种类的影响较小,通过该法预测的FFA含量可以用于不同种类油脂的分类,然而仪器的高昂费用限制了该技术在常规分析中的使用,且相较其他光谱分析法,其准确度较低,灵敏度较差,使用时需要频繁校准,不能实现快速测定。
3.3 核磁共振波谱法
核磁共振(nuclear magnetic resonance , NMR)技术作为一种有效的脂肪酸表征技术,用于确定脂肪酸组成和不同酰基之间的比例,研究和监测食用油氧化变质[48],可用于测定食用油中FFA含量,具有无损、同时检测、高效准确、无污染等优点,在食用油脂分析检测方面显示出了良好的发展前景[49-50]。
目前已报道了许多食用植物油中FFA含量测定的方法,包括 13C-NMR、31P-NMR、1H-NMR法,其中最常用的是1H-NMR法。1H-NMR法是基于 FFA 的 α-羰基-CH2与酯化的 α-羰基-CH2信号积分计算FFA含量,其限制在于光谱宽度窄,可能出现光谱重叠;13C-NMR法可以较好的避免,该法根据游离羰基化学位移δ在176~178区域与酯化羰基化学位移δ在171~174区域产生信号强度的对比分析计算出FFA含量,然而该法采集合适信噪比的波谱所需时间较长;为缩短实验时间,可以采用 31P-NMR法,该法通过化学位移 δ在134.8处磷酸化FFA的信号计算酸值,然而其需要对FFA进行衍生化处理,可能会破坏分析物[48]。1H-NMR法的有效性和准确性在与滴定法的对比中得到了验证,利用两种技术对20多个不同品种油品进行分析,大多数样品的结果是相似的,少数南瓜籽油通过滴定法测定的酸值略高,这可能是由于南瓜籽油的颜色较深,从而导致滴定过程难以准确判断滴定终点[51]。王欣等[52]通过对低场核磁共振技术(low-field nuclear magnetic resonance,LF-NMR)弛豫特性、理化指标变化规律分析及主成分回归分析,建立了大豆油和玉米油在薯条煎炸过程中酸值与LF-NMR弛豫特性间的相关性模型(R2>0.9),模型验证良好。结果表明:根据LF-NMR弛豫特性的变化可以快速预测酸值的改变程度。NMR技术对深色油的适用性及对于非FFA的酸性物质的非检测性[48],使得该技术相比滴定法具有独特的优势,然而该方法虽然操作简单、准确快捷,但因其设备的高价格和技术要求,该法在酸值测定中并未得以广泛应用。
4 电化学法
电化学法是基于电化学池中所发生的电化学反应进行分析测定的,电化学池由电解液和浸入其中的电极组成,根据待测物质在溶液中的电流、电位、电量和电导率等参数的变化,将被测物质的浓度转化为一种电学参量加以测量[53]。
4.1 伏安法
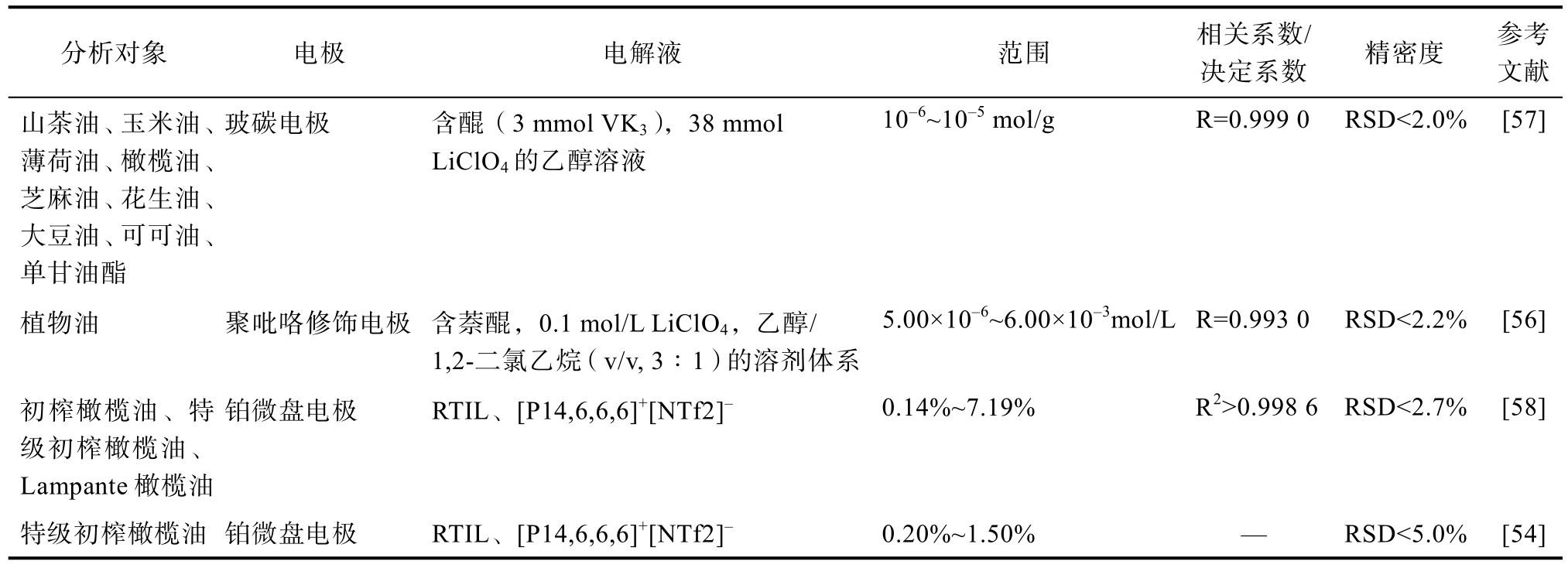
伏安法是一类重要的电化学分析方法,根据指示电极电位与通过电解池的电流之间的关系而获得分析结果,该法通常用于分析FFA等电活性较差、易于氧化或还原的化合物,是一种具有高度选择性和灵敏度的定量分析方法[54]。在存在少量酸的情况下,还原形式的醌(溶于乙醇)会产生非常强的伏安信号,产生的电流变化与酸浓度成正比[1]。Kusu等[55]改变了甲萘醌(VK3)的还原历程,在其原还原峰校正的电位处产生新的还原峰,新还原峰电流与FFA浓度成线性关系,基于此新还原峰电流的测定,提出了测定FFA浓度的新型伏安法。随后,LI等[56]提出了一种使用聚吡咯修饰电极和线性电位扫描伏安法测定酸值的方法,其线性检测范围为 5.0×10-6~6×10-3 mol/L,检测灵敏度为 2.41×10-2A L/mol,最低检测限为1.2×10-6 mol,每小时可分析 45个样品,该法与传统滴定法相比更加灵敏,且所需油样少,无需样品预处理。有关伏安法在食用油酸值测定中的应用见表4。
表4 伏安法在食用油酸值测定中的应用
Table 4 Application of voltammetry in determination of acid value of edible oil
注:RTIL:室温离子液体;[P14,6,6,6]+[NTf2]-:三己基(十四烷基)膦双(三氟甲基磺酰基)酰亚胺;R:相关系数;R2:决定系数;RSD:相对标准偏差。
Note: RTIL: Room temperature ionic liquid; [P14,6,6,6]+[NTf2]-: tri-hexyl(tetradecyl)phosphonium bis(trifluoromethylsulfonyl)imide;R: correlation coefficient; R2: coefficient of determination; RSD: relative standard deviation.
分析对象 电极 电解液 范围 相关系数/决定系数 精密度 参考文献山茶油、玉米油、薄荷油、橄榄油、芝麻油、花生油、大豆油、可可油、单甘油酯玻碳电极 含醌(3 mmol VK3),38 mmol LiClO4的乙醇溶液10-6~10-5 mol/g R=0.999 0 RSD<2.0% [57]植物油 聚吡咯修饰电极 含萘醌,0.1 mol/L LiClO4,乙醇/1,2-二氯乙烷(v/v, 3∶1)的溶剂体系5.00×10-6~6.00×10-3mol/L R=0.993 0 RSD<2.2% [56]初榨橄榄油、特级初榨橄榄油、Lampante橄榄油铂微盘电极 RTIL、[P14,6,6,6]+[NTf2]- 0.14%~7.19% R2>0.998 6 RSD<2.7% [58]特级初榨橄榄油 铂微盘电极 RTIL、[P14,6,6,6]+[NTf2]- 0.20%~1.50% — RSD<5.0% [54]
由表4可知,分析对象多为常见食用油,电极包括玻碳电极、聚吡咯修饰电极、铂微盘电极等,电解液大多为含有LiClO4的乙醇溶液。为克服FFA低电导率的问题,Baldo等[58]使用RTIL、[P14,6,6,6]+[NTf2]-作为支持电解质,使用铂微盘电极,通过在低扫描速率(即稳态下)循环伏安法和计时伏安法监测FFA的还原过程。之后,又建立了一种基于伏安法结合PLS测定特级初榨橄榄油FFA含量的方法,在低至0.2%的FFA水平下,也能实现准确定量[54]。伏安法是一种低成本、节但是其准确度和重现性主要取决于电极的条件[2],因此为进一步提高伏安法的准确度和稳定性,满省溶剂的酸值测定方法,适用于现场快速测定,足酸值检测不同精度要求,装置参数的优化可以作为接下来的研究重点。
4.2 电导率法
电导率法是基于一定温度条件下,水溶液中强电解质的浓度变化与其电导率的变化值成正比,向食用油中加入过量碱液,油中的FFA与过量的碱发生中和反应,同时,随着碱液的消耗,溶液电导率不断下降,可以建立溶液电导率与FFA含量的关系,通过测定溶液电导率的变化,从而实现食用油酸值的测定[59]。笔者所在团队利用KOH-FFA混合反应过程中KOH溶液电导率的变化测定食用油中 FFA含量,并优化了溶液中KOH浓度、油脂种类、料液比、温度及静置时间等工艺参数,通过与传统滴定法比较,电导率法具有更多优势[60]。电导率法具有重复性好、操作简便、价格低廉等优点[61],适合现场快速测定,具有很好的应用前景。
4.3 pH值测定法
pH值测定法是基于从食用油样品中快速、完整地提取FFA到混合试剂中,通过测定混合试剂的 pH值实现食用油酸值的测定。该混合试剂是指含有三乙醇胺(TEA)和 KNO3的异丙醇、水(1∶1,v/v)的混合物,由于该混合试剂含水量很高,食用油几乎不溶于该试剂,油样与试剂混合时形成乳状液,由于乳液相表面积较大,FFA提取速率大大加快[62]。早期学者通过理论和实验证明了:pH=A-logNa,A是给定试剂温度的常数(20 ℃时,A=7.325±0.003),Na是 FFA 的浓度[63]。Gerasimenko等[64]研究了自动流程pH法,油样和试剂以恒定速率流动,在混合器中混流形成乳液提取 FFA,然后将乳液送入盘管以完成提取和加热,再而进行 pH测定,与传统滴定法相比,大大减少了有机溶剂消耗量。pH值法作为一种简单且经济的方法,在食用油酸值检测应用中有很好的发展潜力。
5 比色法
5.1 铜皂法
铜皂法是基于FFA与显色剂(5%醋酸铜溶液用吡啶调至pH=6.1)中的铜离子反应生成的铜皂蓝色络合物在710 nm波长下有最大吸收值,再通过与脂肪酸吸光度工作曲线进行对照得出脂肪酸浓度[2]。Marta等[65]使用环己烷代替苯溶解油样,减少了苯对环境的污染,基于铜皂法测定的油脂酸值与传统滴定法对比,结果具有良好的准确度和相关性。Győrik等[66]提出了光热窗(使用632.8 nm氦氖激光作为辐照源)与铜皂法相结合测定食用油中FFA含量的方法,结果表明:当FFA浓度超过2 mmol/mL时,该方法的结果与传统滴定法有很高的相关性。
5.2 自动流动注射分析法
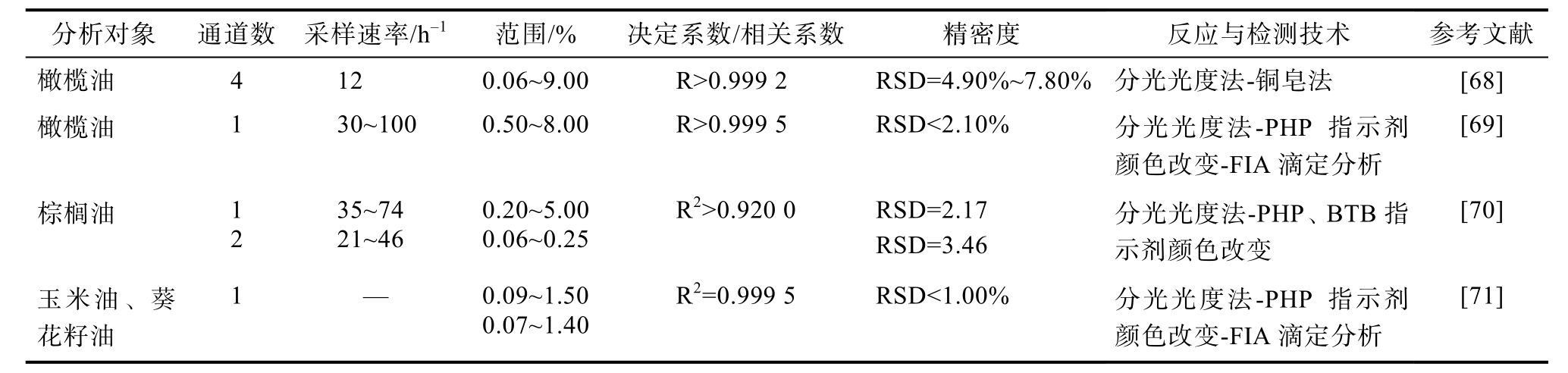
流动注射分析(flow injection analysis , FIA)技术是一种自动快速的化学分析技术,具有操作简便、快速、灵敏以及可实现在线监测等优点,现已广泛应用于食品领域[67]。首个基于铜皂法的自动化食用油酸值测定系统,就是通过FIA系统实现的。后又有学者基于酚酞(phenolphthalein,PHP)法结合FIA,通过监测KOH和FFA反应导致的PHP强度在562 nm处的降低,来实现FFA的定量。有关FIA技术在食用油酸值测定中的应用见表5。
表5 FIA技术在食用油酸值测定中的应用
Table 5 Application of FIA technology in determination of acid value of edible oil
注:BTB:溴百里酚蓝;R:相关系数;R2:决定系数;RSD:相对标准偏差。
Note: BTB: bromothymol blue; R: correlation coefficient; R2: coefficient of determination; RSD: relative standard deviation.
分析对象 通道数 采样速率/h-1 范围/% 决定系数/相关系数 精密度橄榄油 4 12 0.06~9.00 R>0.999 2 RSD=4.90%~7.80%橄榄油 1 30~100 0.50~8.00 R>0.999 5 RSD<2.10%棕榈油 1 2 35~74 21~46 0.20~5.00 0.06~0.25 R2>0.920 0 RSD=2.17 RSD=3.46玉米油、葵花籽油1 — 0.09~1.50 0.07~1.40 R2=0.999 5 RSD<1.00%反应与检测技术 参考文献 分光光度法-铜皂法 [68]分光光度法-PHP 指示剂颜色改变-FIA滴定分析[69]分光光度法-PHP、BTB指示剂颜色改变[70]分光光度法-PHP指示剂颜色改变-FIA滴定分析[71]
由表5可知,FIA系统的通道及采样速率得到不断优化,使装置尽可能简单,采样速率逐渐提高。Zhi等[68]基于铜皂比色法测定橄榄油 FFA含量,采用在线样品稀释,液液萃取通过反向流动实现,避免了使用相分离器,实现了样品自动稀释。Saad等[70]发现单线通道需要样品的离线预稀释,双线通道允许直接注入油样,并且分别推荐使用以 PHP为指示剂的单线流动注射分析和以 BTB为指示剂的双线流动注射分析来测定酸度大于 0.4和小于 0.4的样品。通过比色法结合FIA测定食用油酸值,可以实现分析自动化及在线监测,提高样品分析的效率,适合于脂肪酸含量较低的试样及大量样品的测定,具有很大的应用潜力。
5.3 其他法
Guo 等[72]研究了聚酰胺-胺(polyamidoamine,PAMAM)、金纳米粒子(gold nanoparticles,AuNP)竞争比色法测定食用油中总 FFA含量,PAMAM与AuNPs之间由于静电吸引会触发形成PAMAM/AuNP组装体,然而在酸碱化学和离子对的驱动下,FFA吸附在PAMAM表面,从而阻碍了PAMAM/AuNP的聚集,可以通过测定AuNPs的紫外吸收值,建立FFA浓度与吸光值间的关系曲线,从而实现FFA含量的测定。结果表明:PAMAM/AuNPs比色法结果与传统滴定法无显著差异,且避免了传统滴定法测定深色油脂终点的困难,可以灵敏的测定FFA含量。
纸基微流控芯片技术是以纸张为基底,将生物化学分析过程构建在一个几平方厘米甚至更小的芯片上,通过微流通道控制液体的输送,实现样品的制备、反应、检测等操作[73]。Muthukumar等[74]基于纸基微流体比色检测技术对食用油中的FFA含量进行测定,通过改变酚酞的含量,优化了从该装置获得的视觉信号,且目视比色信号的稳定性得到了检验。该法具有快速简便、经济环保的特点。
6 色谱法
该法可以提供食用油中各FFA的定性与定量信息,由于食用油基质复杂,FFA含量低、极性较强且挥发性低,因此需要先经过复杂的样品前处理将FFA转化为脂肪酸甲酯,再进行气相色谱(gas chromatography,GC)或气相色谱-质谱联用分析[75]。Wan等[76]比较了滴定法与GC法分析食用油中FFA含量的差异,结果表明:FFA含量在 0.04%~12%范围内,两种方法结果高度相关(R>0.996)。Xie等[77]研究了一种顶空气相色谱法测定食用油酸值的方法,该法基于FFA与碳酸氢盐间反应,之后通过顶空气相色谱法检测反应生成的CO2,结果表明:该法可以在30 min内完成中和反应,GC法简便、高效、准确,适合于油脂生产过程控制和和市场样品的质量检验。
与GC相比,高效液相色谱法可以直接将FFA转化为大量不同的衍生物。Wabaidur等[78]建立了一种将超高效液相色谱与质谱联用方法,用于同时分离鉴定和定量橄榄油中的 FFA,该法无需样品预处理(萃取或衍生化),有助于节省时间和成本。结果表明:方法回收率大于89%,线性关系良好(R2>0.992),检出限为 0.09~0.24 g/mL,相对标准偏差小于2.4%,是一种灵敏度高、重现性好、操作简便的食用油FFA的分析方法。该法试剂用量少,适合于大批量的样品测定,但整个过程繁琐、费时,更适合测定试样中单个脂肪酸的含量和脂肪酸组分[8]。
7 讨论
食用油酸值测定方法主要包括国标滴定法、光谱法、电化学法、比色法及色谱法,这些方法优缺点的比较见表6。
表6 食用植物油酸值测定方法的比较
Table 6 Comparison of determination methods for acid value of edible vegetable oil

国标法光谱法方法 优点 缺点冷溶剂指示剂滴定法 准确、快捷、简单、易操作,成本低 试剂消耗量大,溶剂毒性大,对某些油脂滴定终点判断误差大冷溶剂自动电位滴定法 操作简单,稳定性好,准确度高 滴定速度慢,油样易受空气影响,标准溶液消耗量大热乙醇指示剂滴定法 环保、毒性小 加热过程可能造成油脂酸值升高,对低酸值食用油影响较大近红外光谱法 操作简便,定性定量准确,无需样品预处理,快速无损,选择性好,多组分同时测定不同类型的油脂需要不同的酸值测定模型傅里叶变换红外光谱法 准确度高,分析速度快,选择性好,环保,灵敏度高,在线监测需要借助附件来采集光谱,直接法易受基底效应的影响,间接法操作繁琐拉曼光谱法 仪器操作简单,选择性好,高效环保 灵敏度较差,需要频繁校准电化学法核磁共振波谱法 选择性好,高效准确,无污染 技术要求高,价格昂贵伏安法 所需油样少,无需样品预处理,精确度高,成本低 准确度和重现性主要取决于电极的条件电导率法 重复性好,操作简便,价格低廉 准确度较低pH值测定法 操作简便,溶剂消耗量小,成本低 FFA提取不完全,结果准确度较低铜皂法 简单、快速,不需要复杂昂贵的仪器 金属离子的干扰,灵敏度低,需要频繁校准比色法自动流动注射分析法 操作简便,采样速率高,灵敏度高,在线监测 有机试剂消耗量大色谱法 试剂用量少,结果准确度高 需要标准品作对照,前处理复杂,耗时长
食用植物油酸值测定方法的选择主要取决于精确度要求、设备的可用性、技术人员的操作熟练度、样本数量及质量,如传统滴定法虽然操作简单、方便快捷,但在样本数量较多时会造成时间和资源浪费;光谱法适用于企业在生产过程中的品质监测和质量控制;电化学法适合相关部门的现场快速检测;比色法适合需要快速测定大量样品的场合;色谱法更适合于单个脂肪酸的含量和脂肪酸组分的测定。食用油样本质量不同,同一种测定方法的精确度也不同。对于颜色深浅的油脂,传统滴定法适合测定颜色较浅的食用油,测定颜色较深的油脂时,因滴定终点易判断不准确而造成结果误差较大;而各种仪器分析方法几乎不受油脂颜色的影响。对于不同酸值范围的油脂,传统滴定法在测定精炼程度高或者酸败程度小的油脂时,因这类油脂FFA含量少,仅凭借指示剂颜色变化和肉眼观察,难以准确把握滴定终点,此外,热乙醇指示剂滴定法操作过程中需要加热处理,对低酸值油样影响较大;而各类仪器分析方法对不同品质的油脂酸值的测定,均能取得较好的结果,其中比色法结合FIA及FTIR技术在测定低酸值油样时相较其它仪器分析方法精确度更高。对于含有干扰成分的油脂,如含有谷维素的米糠油,滴定法测定误差较大,光谱法的测定结果几乎不受谷维素等非FFA成分的影响,是测定该类油脂酸值十分有效的方法。
8 结束语
酸值是评价食用油质量的重要指标,国内外对食用油酸值的测定方法都有了深入的研究,光谱法、电化学法、比色法、色谱法等仪器分析方法作为传统滴定法的潜在替代方法,在分析速度、准确度、样品适用性方面均有较好的表现,然而目前大部分酸价测定方法存在只适应于实验室检测的问题,无法满足现代社会对食用油安全检测技术现场化准确测定的要求,传统滴定法因其经济实用性仍是最普遍使用的方法,笔者认为还需要从以下三个方面进一步探究和完善:(1)在不影响准确度的情况下,各种方法都应简化操作,缩短检测时间,提高检测效率,尤其是对试纸比色法进行深入研究,目前已有研究成果表明试纸法稳定性差、误差大,因此,对于试纸比色法的研究仍有较大提升空间,在分析测试的精确度和稳定性方面仍需改进和提高。(2)FTIR技术作为一项分析速度快、准确度高的分析方法,应进一步改进光谱采集方法,以便更容易地获得光谱,并且消除基底效应,避免繁琐操作,提高检测精度,拓宽 FTIR技术的应用范围。(3)伏安法是实现食用油酸值快速、精确、在线检测的重要方法,其应用潜力巨大,应进一步优化实验装置参数,改进溶剂和电极条件,提高准确度和稳定性,缩短检测时间。
[1]李书国, 陈辉, 李雪梅, 等. 食用油酸价分析检测技术研究进展[J]. 粮油食品科技, 2008(3): 31-33.LI S G, CHEN H, LI X M, et al. Progress of the research on analysis methods of acid value of edible oils[J]. Science and Technology of Cereals, Oils and Foods, 2008(3): 31-33.
[2]MAHESAR S A, SHERAZI S T H, KHASKHELI A R, et al.Analytical approaches for the assessment of free fatty acids in oils and fats[J]. Analytical Methods, 2014, 6(14): 4956-4963.
[3]薛莉. 食用植物油特质营养成分组成与分布研究[D]. 北京:中国农业科学院, 2018.XUE L. Research on the composition and distribution of characteristic nutritional components in edible vegetable oils[D].Beijing: Chinese Academy of Agricultural Sciences, 2018.
[4]刘芳, 王超, 杨菊, 等. 油脂酸价和过氧化值检测方法的研究进展[J]. 食品安全质量检测学报, 2019, 10(14): 4478-4482.LIU F, WANG C, YANG J, et al. Progress of determination methods for acid and peroxide values of oils and fats[J]. Journal of Food Safety and Quality, 2019, 10(14): 4478-4482.
[5]李杨. 油脂加工与精炼工艺学[M]. 北京: 科学出版社, 2018:13.LI Y. Oil processing and refining technology[M]. Beijing: Science Press, 2018: 13.
[6]王松霞. 大豆油脂浸出和精炼工艺研究[J]. 粮食科技与经济,2018, 43(7): 81-83.WANG S X. Study on soybean oil extraction and refining process[J]. Grain Science and Technology and Economy, 2018,43(7): 81-83.
[7]薛斌, 曹文明, 包杰, 等. 自动电位滴定法测定米糠油酸值的研究[J]. 中国油脂, 2014, 39(11): 83-87.XUE B, CAO W M, BAO J, et al. Detection of acid value of rice bran oil by automatic potentiometric titration[J]. China Oils and Fats, 2014, 39(11): 83-87.
[8]董晓斌. 食用油游离脂肪酸含量检测方法研究[D]. 杨凌: 西北农林科技大学, 2014.DONG X B. Research on detection methods for determination of free fatty acids in edible oils[D]. Yangling: Northwest A&F University, 2014.
[9]刘勤, 何丽君, 毛泽宇, 等. 浅谈植物油酸败原因及其使用[J]. 中小企业管理与科技, 2015(15): 242.LIU Q, HE L J, MAO Z Y, et al. Discussion on the causes of rancidity of vegetable oil and its application[J]. Management &Technology of SME, 2015(15): 242.
[10]王进英. 油茶籽油热稳定性研究[D]. 长沙: 中南林业科技大学, 2017.WANG J Y. Study on the heating stability of camellia seed oil[D]. Changsha: Central South University of Forestry and Technology, 2017.
[11]毕艳兰. 油脂化学[M]. 北京: 化学工业出版社, 2005: 74-79.BI Y L. Grease chemistry[M]. Beijing: Chemical Industry Press,2005: 74-79.
[12]胡健华, 金朝阳. 油脚、皂脚及毛油常压水解制脂肪酸催化剂的研制[J]. 中国油脂, 1998(5): 46-48.HU J H, JIN Z Y. Preparation of hydrolytic catalyst applied to production of fatty acids from oilstocks or soapstocks[J]. China Oils and Fats, 1998(5): 46-48.
[13]裴振东, 许喜林. 油脂的酸败与预防[J]. 粮油加工与食品机械, 2004(6): 47-49.PEI Z D, XU X L. Research on the rancidity of oil and its prevention[J]. Cereals and Oils Processing and Food Machinery,2004(6): 47-49.
[14]食品安全国家标准 食品中酸价的测定: GB 5009.229—2016[S]. 北京: 中国标准出版社, 2016.National food safety standard Determination of acid value in food:GB 5009.229—2016[S]. Beijing: China Standard Press, 2016.
[15]马葱, 刘钟栋. 酸碱滴定法在植物油质量检测中应用的改进[J]. 中国食品添加剂, 2018(2): 188-195.MA C, LIU Z D. Application and improvement of acid-base titration in vegetable oil quality and safety control[J]. China Food Additives, 2018(2): 188-195.
[16]蒋晓杰, 周旭. 食用油酸值、过氧化值安全测定方法探讨[J].粮食与饲料工业, 2017(6): 54-56.JIANG X J, ZHOU X. Discussion on safe determination method of edible oil acid value and peroxide value[J]. Cereal & Feed Industry, 2017(6): 54-56.
[17]吴金. 植物油脂酸价测定中的问题[J]. 食品安全导刊,2017(12): 70.WU J. Problems in determination of acid value of vegetable oil[J]. China Food Safety Magazine, 2017(12): 70.
[18]陈勤勤, 何意足, 张倩, 等. 深色油脂酸价测定方法的优化[J]. 现代食品, 2018(21): 163-165.CHEN Q Q, HE Y Z, ZHANG Q, et al. Optimization of the determination method of acid value of dark oil[J]. Modern Food,2018(21): 163-165.
[19]王平东, 徐宗季, 袁华山, 等. 两种方法测定有色油脂脂肪酸价的探讨[J]. 粮食储藏, 2020, 49(6): 47-50.WANG P D, XU Z J, YUAN H S, et al. Determination of fatty acid value of colored oil with two methods[J]. Grain Storage,2020, 49(6): 47-50.
[20]曾史俊, 钟宏星, 黎雁玲, 等. 食用油酸值两种检测方法的对比分析[J]. 广州化工, 2016, 44(9): 111-112.ZENG S J, ZHONG H X, LI Y L, et al. Comparative analysis of two methods of edible oil acid value determination[J]. Guangzhou Chemical Industry and Technology, 2016, 44(9): 111-112.
[21]钟宏星, 张晶, 陆剑华, 等. 3 种油脂酸价测定方法的比较[J].食品安全质量检测学报, 2019, 10(10): 3197-3201.ZHONG H X, ZHANG J, LU J H, et al. Comparison of three methods for the determination of acid valence of oil[J]. Journal of Food Safety and Quality, 2019, 10(10): 3197-3201.
[22]李英军, 吴丹, 吴欣欣, 等. 食用植物油中酸价的两种测定方法对比分析[J]. 食品安全导刊, 2020(18): 125-127.LI Y J, WU D, WU X X, et al. Comparative analysis of two determination methods of acid value in edible vegetable oil[J].China Food Safety Magazine, 2020, (18): 125-127.
[23]张严, 谢岩黎, 孙淑敏. 近红外光谱结合化学计量学方法在油脂检测中的应用[J]. 粮食与油脂, 2015, 28(1): 66-68.ZHANG Y, XIE Y L, SUN S M. Application of near-infrared spectroscopy combined with chemometrics in oil detection[J].Cereals & Oils, 2015, 28(1): 66-68.
[24]曾子琦, 蒋立文, 刘霞, 等. 近红外光谱无损检测在食用油脂分析中的应用研究进展[J]. 中国油脂, 2018, 43(8): 137-142.ZENG Z Q, JIANG L W, LIU X, et al. Advance in application of near infrared spectroscopy in nondestructive analysis of edible oil[J]. China Oils and Fats, 2018, 43(8): 137-142.
[25]ROHMAN A. The use of infrared spectroscopy in combination with chemometrics for quality control and authentication of edible fats and oils: A review[J]. Applied Spectroscopy Reviews,2017, 52(7): 589-604.
[26]于修烛, 张静亚, 李清华, 等. 基于近红外光谱的食用油酸价和过氧化值自动化检测[J]. 农业机械学报, 2012, 43(9): 150-154.YU X Z, ZHANG J Y, LI Q H, et al. Automatic determination of acid value and peroxide value of edible oils by near-infrared spectroscopy[J]. Transactions of the Chinese Society of Agricultural Machinery, 2012, 43(9): 150-154.
[27]MBA O, ADEWALE P, DUMONT M J, et al. Application of near-infrared spectroscopy to characterize binary blends of palm and canola oils[J]. Industrial Crops & Products, 2014, 61: 472-478.
[28]王立琦, 刘亚楠, 张青, 等. 食用油脂酸值近红外光谱特征波长优选[J]. 食品科学, 2016, 37(16): 205-210.WANG L Q, LIU Y N, ZHANG Q, et al. Optimization of characteristic wavelength variables of near infrared spectroscopy for detecting edible oil acid value[J]. Food Science, 2016,37(16): 205-210.
[29]YANG M X, CHEN Q S, KUTSANEDZIE F Y H, et al. Portable spectroscopy system determination of acid value in peanut oil based on variables selection algorithms[J]. Measurement, 2017,103: 179-185.
[30]MARTÍN J F G, BARRERA M D C L, GARCÍA M T, et al.Determination of the acidity of waste cooking oils by near infrared spectroscopy[J]. Processes, 2019, 7(5): 304.
[31]JIANG H, HE Y C, CHEN Q S. Determination of acid value during edible oil storage using a portable NIR spectroscopy system combined with variable selection algorithms based on an MPA-based strategy[J].Journal of the science of food and agriculture, 2020, 101(8): 3328-3335.
[32]食品安全国家标准 植物油: GB 2716—2018 [S]. 北京: 中国标准出版社, 2018.National food safety standard Vegetable oil: GB 2716—2018[S]. Beijing: China Standard Press, 2018.
[33]陈佳, 于修烛, 刘晓丽, 等. 基于傅里叶变换红外光谱的食用油质量安全检测技术研究进展[J]. 食品科学, 2018, 39(7):270-277.CHEN J, YU X Z, LIU X L, et al. A review of the application of fourier transform infrared spectroscopy for quality and safety analysis of edible oils[J]. Food Science, 2018, 39(7): 270-277.
[34]LI Q, CHEN J, HUYAN Z Y, et al. Application of Fourier transform infrared spectroscopy for the quality and safety analysis of fats and oils: A review[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(22): 3597-3611.
[35]DONG X B, LI Q H, SUN D J, et al. Direct FTIR analysis of free fatty acids in edible oils using disposable polyethylene films[J]. Food Analytical Methods, 2015, 8(4): 857-863.
[36]LI Y, GARCÍA-GONZÁLEZ D L, YU X Z, et al. Determination of free fatty acids in edible oils with the use of a variable filter array IR spectrometer[J]. Journal of the American Oil Chemists'Society, 2008, 85(7): 599-604.
[37]YU X Z, VAN DE VOORT F R, SEDMAN J, et al. A new direct Fourier transform infrared analysis of free fatty acids in edible oils using spectral reconstitution[J]. Analytical and Bioanalytical Chemistry, 2011, 401(1): 315-324.
[38]MAHBOUBIFAR M, YOUSEFINEJAD S, ALIZADEH M,et al. Prediction of the acid value, peroxide value and the percentage of some fatty acids in edible oils during long heating time by chemometrics analysis of FTIR-ATR spectra[J]. Journal of the Iranian Chemical Society, 2016, 13(12): 2291-2299.
[39]ZICKER M C, CRAIG A P, DE OLIVEIRA RAMIRO D, et al.Quantitative analysis of acidity level in virgin coconut oils by Fourier transform infrared spectroscopy and chemometrics[J].European Journal of Lipid Science and Technology, 2016, 118(9):1350-1357.
[40]HU K Q, HUYAN Z Y, GENG Q N, et al. Rapid determination of acid value of edible oils via FTIR spectroscopy using infrared quartz cuvette[J]. Journal of Oleo Science, 2019, 68(2): 121-129.
[41]AL-ALAWI A, VAN DE VOORT F R, SEDMAN J. A new FTIR method for the analysis of low levels of FFA in refined edible oils[J]. Spectroscopy Letters, 2005, 38(4-5): 389-403.
[42]DONG Y Y, SHI S X, LI Q, et al. An indirect analytical approach based on ATR-FTIR spectroscopy for determining the FFA content in vegetable oils[J]. RSC Advances, 2020, 10(40): 24073-24078.
[43]娄婷婷, 刘旸, 王禹, 等. 多种光谱技术在食用油分析鉴别中的研究进展[J]. 食品研究与开发, 2020, 41(1): 218-224.LOU T T, LIU Y, WANG Y, et al. Research progress of multispectroscopic techniques spectroscopy in analysis and identification of edible oil[J]. Food Research and Development, 2020, 41(1):218-224.
[44]董晶晶. 基于拉曼光谱的食用油品质检测方法研究[D]. 北京:北京工商大学, 2018.DONG J J. Research on the detection methods of edible oil quality based on Raman spectroscopy[D]. Beijing: Beijing Technology and Business University, 2018.
[45]JIMÉNEZ-SANCHIDRIÁN C, RUIZ J R. Use of Raman spectroscopy for analyzing edible vegetable oils[J]. Applied Spectroscopy Reviews, 2016, 51(5): 417-430.
[46]EI-ABASSY R M, DONFACK P, MATERNY A. Rapid determination of free fatty acid in extra virgin olive oil by Raman spectroscopy and multivariate analysis[J]. Journal of the American Oil Chemists Society, 2009, 86(6): 507-511.
[47]JiANG H, HE Y C, XU W D, et al. Quantitative detection of acid value during edible oil storage by Raman spectroscopy:Comparison of the optimization effects of BOSS and VCPA algorithms on the characteristic Raman spectra of edible oils[J].Food Analytical Methods, 2021. DOI: 10.1007/s12161-020-01939-5.
[48]PIETRO M E D, MANNU A, MELE A. NMR determination of free fatty acids in vegetable oils[J]. Processes, 2020, 8(4): 410.
[49]肖新生, 杨交如, 唐满生, 等. 核磁共振技术在食用油脂分析中的应用研究进展[J]. 中国油脂, 2018, 43(12): 134-139.XIAO X S, YANG J R, TANG M S, et al. Advance in application of NMR technology in edible oil analysis[J]. China Oils and Fats, 2018, 43(12): 134-139.
[50]CAI S, ZHANG Y, XIA F, et al. An expert system based on 1 H NMR spectroscopy for quality evaluation and adulteration identification of edible oils[J]. Journal of Food Composition and Analysis, 2019, 84: 103316.
[51]SKIERA C, STELIOPOULOS P, KUBALLA T, et al.Determination of free fatty acids in edible oils by 1H NMR spectroscopy[J]. Lipid Technology, 2012, 24(12): 279-281.
[52]王欣, 夏义苗, 史然, 等. 基于 LF-NMR 及主成分回归分析的油脂煎炸品质预测[J]. 中国食品学报, 2015,15(4): 155-163.WANG X, XIA Y M, SHI R, et al. Quality prediction of frying oil based on LF-NMR relaxation characteristics and principal component regression[J]. Journal of Chinese Institute Of Food Science and Technology, 2015, 15(4): 155-163.
[53]袁涛. 电化学法在食用油品质分析上的应用[D]. 石家庄:河北科技大学, 2013.YUAN T. The application of electrochemical method in edible oil quality analysis[D].Shijiazhuang: Hebei University of Science& Technology, 2013.
[54]BALDO M A, OLIVERI P, FABRIS S, et al. Fast determination of extra-virgin olive oil acidity by voltammetry and partial least squares regression[J]. Analytica Chimica Acta, 2019, 1056: 7-15.
[55]KUSU F, FUSE T, TAKAMURA K. Voltammetric determination of acid values of fats and oils[J]. Journal of AOAC International,1994, 77(6): 1686-1688.
[56]LI S G, ZHANG H, XUE W T. A novel method for the determination of acid value of vegetable oils[J]. European Journal of Lipid Science and Technology, 2007, 109(11): 1088-1094.
[57]TAKAMURA K, FUSE T, ARAI K, et al. A review of a new voltammetric method for determining acids[J]. Journal of Electroanalytical Chemistry, 1999, 468(1): 53-63.
[58]BALDO M A, OLIVERI P, SIMONETTI R, et al. A novel electroanalytical approach based on the use of a room temperature ionic liquid for the determination of olive oil acidity[J]. Talanta, 2016, 161: 881-887.
[59]于修烛, 杨晨, 杜双奎, 等. 基于反应过程碱液电导率变化的食用油酸值检测[J]. 农业机械学报, 2011, 42(9): 146-150.YU X Z, YANG C, DU S K, et al. Determination of acid value of edible oils based on electrical conductivity change value of alkaline solution during reaction[J]. Transactions of the Chinese Society of Agricultural Machinery, 2011, 42(9): 146-150.
[60]YU X Z, YANG C, DU S K, et al. A new method for determining free fatty acid content in edible oils by using electrical conductivity[J]. Food Analytical Methods, 2012, 5(6): 1453-1458.
[61]王思阳, 王梦竹, 刘婷婷, 等. 基于电导率的食用油氧化判别分析[J]. 中国油脂, 2019, 44(4): 54-57.WANG S Y, WANG M Z, LIU T T, et al. Discriminant analysis of edible oil oxidation based on electrical conductivity[J]. China Oils and Fats, 2019, 44(4): 54-57.
[62]TUR'YAN Y I, KARDASH E, GARIBYAN I. pH-metric determination of free fatty acids in oils and fats during frying in the absence of a chemical laboratory[J]. Journal of the American Oil Chemists’ Society, 2008, 85(1): 91-92.
[63]TUR'YAN Y I, BEREZIN O Y, KUSELMAN I, et al. pH-metric determination of acid values in vegetable oils without titration[J].Journal of the American Oil Chemists’ Society, 1996, 73(3): 295-301.
[64]GERASIMENKO E O, TUR′YAN Y I. Automated flow pH-method for the determination of total free fatty acids content in edible oils[J]. Food Chemistry, 2012, 132(3): 1562-1565.
[65]BERNÁRDEZ M, PASTORIZA L, SAMPEDRO G, et al.Modified method for the analysis of free fatty acids in fish[J].Journal of agricultural and food chemistry, 2005, 53(6): 1903-1906.
[66]GYŐRIK M, AJTONY Z, DÓKA O, et al. Determination of free fatty acids in cooking oil: Traditional spectrophotometry and optothermal window assay[J]. Instrumentation Science &Technology, 2006, 34(1-2): 119-128.
[67]龙泽荣, 刘莉, 赵建勇, 等. 流动注射光度法测定植物油中的脂肪醛[J]. 食品安全质量检测学报, 2017, 8(2): 544-549.LONG Z R, LIU L, ZHAO J Y, et al. Determination of aldehydes in vegetable oils by flow injection spectrophotometry[J]. Journal of Food Safety and Quality, 2017, 8(2): 544-549.
[68]ZHI Z L, RÍOS A, VALCÁRCEL M. An automated flowreversal injection/liquid—liquid extraction approach to the direct determination of total free fatty acids in olive oils[J]. Analytica Chimica Acta, 1996, 318(2): 187-194.
[69]NOUROS P G, GEORGIOU C A, POLISSIOU M G. Automated flow injection spectrophotometric non-aqueous titrimetric determination of the free fatty acid content of olive oil[J].Analytica Chimica Acta, 1997, 351(1): 291-297.
[70]SAAD B, LING C W, JAB M S, et al. Determination of free fatty acids in palm oil samples using non-aqueous flow injection titrimetric method[J]. Food Chemistry, 2006, 102(4): 1407-1414.
[71]AYYILDIZ H F, KARA H, SHERAZI S T H. A novel approach for determination of free fatty acids in vegetable oils by a flow injection system with manual injection[J]. Lipids, 2011, 46(12):1181-1190.
[72]GUO Y J, LIANG X, BI J M, et al. A polyamidoamine-mediated competitive colorimetric assay based on gold nanoparticles for determining acid values in edible sunflower seed, corn and extra virgin olive oils[J]. Food chemistry, 2019, 285: 450-457.
[73]吴静, 徐军飞, 石聪灿, 等. 纸基微流控芯片的研究进展及趋势[J]. 中国造纸学报, 2018, 33(2): 57-64.WU J, XU J F, SHI C C, et al. Research progress and trend of paper-based microfluidic devices[J]. Transactions of China Pulp and Paper, 2018, 33(2): 57-64.
[74]MUTHUKUMAR R, KAPOOR A, BALASUBRAMANIAN S,et al. Detection of adulteration in sunflower oil using paper-based microfluidic lab-on-a-chip devices[J]. Materials Today: Proceedings, 2020, 34(2): 496-501.
[75]刘明. 基于衍生化技术的游离脂肪酸质谱分析方法及其应用研究[D]. 北京: 中国农业科学院, 2017.LIU M. The study of a novel method based on derivatization technique for MS analysis of free fatty acids and its applications[D].Beijing: Chinese Academy of Agricultural Sciences, 2017.
[76]WAN P J, DOWD M K, THOMAS A E, et al. Trimethylsilyl derivatization/gas chromatography as a method to determine the free fatty acid content of vegetable oils[J]. Journal of the American Oil Chemists Society, 2007, 84(8): 701-708.
[77]XIE W Q, CHAI X S. An efficient method for determining the acid value in edible oils by solvent-assisted headspace gas chromatography[J]. Analytical Methods, 2016, 8: 5789-5793.
[78]WABAIDUR S M, ALAMMARI A, AQEL A, et al. Determination of free fatty acids in olive oils by UPHLC-MS[J]. Journal of chromatography B: biomedical sciences and applications, 2016,1031: 109-115.