玉米是一种重要的粮食作物,无论是作为直接的产品,还是由玉米制作而成的加工品或生产的副产品都有较高的附加值,带来了很高的经济效益,我国是全球第二大玉米生产国,其中西南、华北和东北地区的种植面积占全国的70%以上[1]。然而玉米无论在种植环节还是在储藏环节非常容易受到真菌毒素的污染,据全球粮农组织预测,全球大于25%的谷物都或多或少遭受真菌毒素侵害,从而带来了巨大的经济损失。
真菌毒素(mycotoxins)是特定霉菌在一定条件下产生的小分子次生代谢产物[2-3],在谷物中十分普遍,不仅给人畜健康带来巨大威胁,也会造成严重的经济损失[4]。真菌毒素种类繁多,目前监管和研究工作主要集中在黄曲霉毒素(AFT),赭曲霉毒素(OT),伏马毒素(FUM),玉米赤霉烯酮(ZEN)以及脱氧雪腐镰刀菌烯醇(DON)等。其中,黄曲霉毒素 B1(AFB1)分布最广且毒性最强,其致癌、致突变、致畸性均居首位,属于1类致癌物[5];FUM 种类繁多,其中伏马菌素B1(FB1)和B2(FB2)的污染最为广泛,属2B类致癌物[6-7];ZEN又称F-2毒素,是人体的内分泌干扰物[8];DON 则是B族单端孢霉烯族毒素的一种,其靶标器官是胃肠道系统,单端孢霉烯族B毒素还包括15-乙酰基呕吐毒素和3-乙酰基呕吐毒素等。这些真菌毒素除 FUM 外均具有脂溶性,不仅广泛污染谷物,还可通过污染谷物制成的饲料传递给牲畜,因此也存在于肉、蛋、奶等动物产品中。
目前无论是企业还是政府监管部门更多的是关注食品或饲料法律法规中存在限量标准的真菌毒素,随着检测技术的不断发展,一些新型真菌毒素和隐蔽型真菌毒素逐渐引起人们的关注,因缺乏合适的分析方法和系统充足的风险评估数据,鲜见相关法规与限量标准。谷物中主要的新型真菌毒素包括白僵菌素(BEA)、恩镰孢素(ENN)、Fusaproliferin(FUS)、串珠镰刀菌素(MON)、桔霉素(CIT)、杂色曲霉毒素(STG)及链格孢毒素等。其中MON的毒性很强,与T-2相当,主要靶标器官是心脏[9];CIT常与OTA共存增强其致癌性[10];STG是AFB1合成的前体化合物,被归为 2B类致癌物[11]。隐蔽型真菌毒素则是动植物体在受到外源毒素侵害时,将母体毒素与糖、氨基酸及硫酸盐等结合生成的衍生物[12];此外一些食品加工过程如发酵及热处理也可以提高隐蔽型毒素的含量[13]。目前,谷物中检测到的隐蔽型真菌毒素主要有 DON的葡萄糖苷衍生物(DON-3G,DON-15G),ZEN 的葡糖苷衍生物(ZEN-4G)以及硫酸盐衍生物(ZEN-14S)等[14]。隐蔽型毒素通常具有与其母体相似或较低的毒性作用,但当其生物利用率更高时则会表现出比母体更强的毒性作用[15]。
Romer labs是全球真菌毒素检测的领导者,于 1982年建立了全球第一家真菌毒素检测实验室,通过近四十年的积累发展成为世界上诊断技术及检测服务领域专业的实验室之一,奥地利总部一直致力于多毒素检测方法的开发,研究利用Romer Labs总部开发的40+真菌毒素液相色谱质谱联用方法检测了 2020年的 181份饲用玉米样品,重点对于呕吐毒素和玉米赤霉烯酮的隐蔽性毒素以及一些新型毒素进行了研究分析,为科研工作提供一定的参考。
1 材料与方法
1.1 试验材料
玉米样品,每份样品500~1 000 g,来源于田间采样和养殖户或饲料生产企业用作饲料原料:百奥明公司抽检的9个地区总共181个样本(见表1);真菌毒素标准物质:奥地利ROMER公司;甲醇、乙腈、乙酸、(色谱级)、纯水、乙酸铵(质谱级):德国默克公司。
表1 样品来源分布
Table 1 Distribution of samples
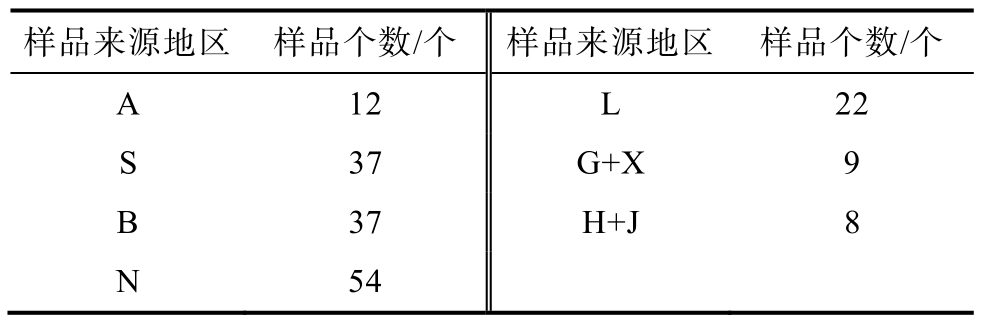
样品来源地区 样品个数/个 样品来源地区 样品个数/个A 12 L 22 S 37 G+X 9 B 37 H+J 8 N 54
1.2 仪器与设备
RAS Mill研磨机:奥地利 ROMER公司;Agilent 1290-Sciex QTRAP 5500高效液相色谱-串联质谱仪:美国安捷伦公司和美国SCIEX公司;Milli-Q超纯水仪:德国默克密理博公司;BSA2202S-CW 分析天平:德国赛多利斯公司;Pico-17离心机:美国赛默飞公司;RO500震荡器:德国格哈特公司。
1.3 试验方法
1.3.1 样品前处理方法
将玉米样品研磨过 20目筛混合均匀。称取10 g(精确至0.01 g)于250 mL三角烧瓶中,准确加入30 mL提取液,V(乙腈)∶V(水)∶V(甲酸)=79∶20∶1,以 180 r/min振摇 2 h,然后以4 000 r/min离心6 min后取100 μL上清液,加入600 μL稀释液混匀后用高效液相色谱–串联质谱仪进行检测分析。
1.3.2 色谱条件
飞诺美Gemini C18 column(150 x 4.6 mm i.d.5 µm),柱温 40 ℃,流速 0.5 mL/min;进样量20 μL;流动相A为含5 mmol乙酸铵的0.5%乙酸水溶液,流动相B为含5 mmol乙酸铵的0.5%乙酸的甲醇溶液。梯度洗脱条件如表2所示。
表2 梯度洗脱程序
Table 2 Gradient elution program %

时间/min 0 2 8 10 11 13 13.1 17流动相A 80 80 35 20 5 5 80 80流动相B 20 20 65 80 95 95 20 20
1.3.3 质谱条件
扫描模式:多反应监测(multiple reaction monitoring,MRM)模式;离子源:电喷雾电离ESI;正离子模式电喷雾电压:5 000 V,离子源温度:650 ℃;负离子模式电喷雾电压:–4 500 V,离子源温度:600 ℃;碰撞气:中等;Gas1:55 psi,Gas 2:65 psi;气帘气:30.0 psi;其他质谱条件见表3。
表3 质谱条件
Table 3 Mass spectrometry conditions

15-乙酰基呕吐毒素 正离子 339.0 137.1/321.1 71 15/13 10/14?15-乙酰基蛇形毒素 正离子 342.1 107.0/265.2 36 21/13 8/8 3-乙酰基呕吐毒素 负离子 397.1 307.2/337.1 –55 –22/–14 –9/–9田麦角碱 正离子 239.0 208.2/183.2 71 25/25 8/8 α-玉米赤霉烯醇 负离子 319.2 274.9/159.9 –110 –28/–40 –11/–7链格孢酚 负离子 257.0 215.0/213.0 –105 –36/–32 –7/–9白僵菌素 正离子 801.3 784.4/134.1 101 29/93 16/8 β-玉米赤霉烯醇 负离子 319.2 274.9/159.9 –110 –28/–40 –11/–7呕吐毒素-3-葡萄糖苷 负离子 517.1 427.1/457.1 –15 –28/–20 –11/–13蛇形毒素 正离子 384.2 307.1/104.9 36 17/55 10/8二氢麦角醇 正离子 257.1 208.1/167.0 86 33/53 6/12野麦角碱 正离子 255.1 224.1/180.1 76 21/53 8/12恩镰孢素 A 正离子 699.2 210.3/555.4 110 39/41 16/6恩镰孢素A1 正离子 685.0 668.2 /210.2 76 25 /45 20/8恩镰孢素B 正离子 657.2 640.2/196.2 96 25/37 16/10
续表3

分析物离子模式母离子子离子去簇电压/V 碰撞电压/V 碰撞池出口电压/V恩镰孢素B 1 正离子 6 7 1.2 6 5 4.3/1 9 6.1 7 1 2 5/3 9 1 4/1 0麦角酰胺 正离子 2 6 8.1 2 2 3.2/2 0 8.1 1 1 2 7/3 1 8/8麦角柯宁碱 正离子 5 6 2.1 2 2 3.2/2 6 8.1 3 6 4 3/3 3 6/8麦角异柯宁碱 正离子 5 6 2.1 2 2 3.2/2 6 8.1 3 6 4 3/3 3 6/8麦角克碱 正离子 6 1 0.2 2 2 3.1/2 6 8.1 9 6 4 3/3 7 8/1 0麦角异克碱 正离子 6 1 0.2 2 2 3.1/2 6 8.1 9 6 4 3/3 7 8/1 0麦角卡里碱 正离子 5 7 6.1 2 2 3.0/2 6 7.9 8 8 4 3/3 5 1 2/8麦角异卡里碱 正离子 5 7 6.1 2 2 3.0/2 6 7.9 8 8 4 3/3 5 1 2/8麦角新碱 正离子 3 2 5.8 2 2 3.1/2 0 8.0 5 1 3 1/3 7 1 0 /8麦角异新碱 正离子 3 2 5.8 2 0 8.0/2 2 3.1 5 1 3 7/3 1 8 /1 0麦角生碱 正离子 5 4 8.1 2 2 3.2/2 0 8.0 4 6 4 1/4 5 8/6麦角胺 正离子 5 8 2.1 2 2 3.0/2 6 8.2 9 1 3 9/3 5 8/1 0镰刀菌酸 正离子 1 7 9.9 1 3 4.1/9 1.9 2 6 2 1/3 3 1 0/1 4镰刀菌烯酮 负离子 4 1 3.3 5 9.1/2 6 2.9 –4 0 –4 4/–2 2 –1 3/–1 3胶霉毒素 正离子 3 2 7.0 2 6 3.1/2 4 5.1 4 1 1 3/2 3 1 0/1 0 H T-2毒素 正离子 4 4 2.1 2 6 3.2/2 1 5.2 2 6 1 7/1 7 1 0/6串珠镰刀菌素 负离子 9 6.9 4 1.0 –1 0 –1 8 –1 1霉酚酸 正离子 3 2 1.0 2 0 6.9/1 5 9.0 1 1 1 3 3/4 5 1 2/8新茄病镰刀菌烯醇 正离子 4 0 0.2 3 0 5.1/1 8 5.2 3 6 1 7/2 9 8/1 0雪腐镰刀菌烯醇 负离子 3 7 1.1 2 8 1.1/5 9.0 –3 5 –2 2/–4 6 –7/–5赭曲霉毒素B 正离子 3 7 0.1 2 0 5.0/1 0 3.2 5 6 3 3/7 7 1 2/6展青霉素 负离子 1 5 3.0 8 0.9/1 0 8.8 –4 5 –1 4/–1 0 –2 1/–9青霉酸 正离子 1 7 1.0 1 2 5.0/9 7.1 5 6 1 7/2 1 1 0/8异烟棒曲霉素 C 正离子 3 9 0.0 1 9 3.1/3 2 1.9 5 1 3 7/2 9 1 8/1 0杂色曲霉菌素 正离子 3 2 4.9 3 1 0.1/ 2 8 0.9 8 6 3 5/5 1 1 0/1 0 T-2毒素 正离子 4 8 4.2 2 1 5.0/3 0 5.1 5 1 2 9/1 9 1 4/6 T-2四醇 正离子 3 1 6.1 2 1 5.1/2 8 1.1 3 1 1 2/1 1 1 0/1 1 T-2 三醇 正离子 4 0 0.1 2 1 5.2/1 0 5.1 2 1 1 9/6 1 8/8玉米赤霉酮 负离子 3 1 9.1 2 7 5.2/1 6 1.0 –1 1 0 –3 0/–3 8 –7/–5 13 C-3-乙酰基呕吐毒素 负离子 4 1 4.1 3 3 2.2/3 5 4.1 –5 0 –2 2/–1 4 –9/–9 13 C-1 5-乙酰基呕吐毒素 正离子 3 5 6.1 1 4 5.2/3 3 8.2 7 1 1 5/1 3 6/1 0 13 C-呕吐毒素-3-葡萄糖苷 负离子 5 3 8.2 4 7 8.1/4 4 7.3 –2 0 –2 0/–3 0 –1 3/–7 13 C-蛇形毒素 正离子 4 0 3.2 3 2 4.2/2 4 4.1 4 1 1 7/2 3 1 0/6 13 C-H T-2毒素 正离子 4 6 4.3 2 7 8.0/1 1 3.0 4 6 1 9/6 5 6/8 13 C-霉酚酸 正离子 3 3 8.1 1 6 9.2/2 1 8.1 1 0 6 4 9/3 1 1 2/1 2 13 C-雪腐镰刀菌烯醇 负离子 3 8 6.1 5 8.9/2 9 5.1 –4 0 –5 2/–2 2 –5/–9 13 C-展青霉素 负离子 1 5 9.9 1 1 5.0/8 6.0 –5 0 –1 2/–1 6 –9/–7 13 C-异烟棒曲霉素 C 正离子 4 1 2.1 2 0 1.1/3 3 9.2 2 1 3 9/2 9 8 /1 0 13 C-杂色曲霉菌素 正离子 3 4 3.0 2 9 7.0/3 2 7.0 8 1 5 5/3 7 1 2/1 0 13 C-T-2毒素 正离子 5 0 8.2 2 2 9.1/1 9 8.1 4 1 2 9/3 1 1 2/1 2
1.4 数据分析
利用office2019软件中Excel进行统计分析。
2 结果与分析
2.1 质谱图情况
将 44种毒素混合标准溶液通过自动进样器进样,经色谱柱分离后注入ESI离子源,在上述条件下得到相应毒素的多反应监测色谱图,如图1-2。色谱峰形对称尖锐,表明该方法稳定可靠,有利于玉米中真菌毒素的检测。


图1 真菌毒素混合标准溶液在ESI+模式下的多反应监测色谱图
Fig.1 Multiple-reaction monitoring chromatograms of mixes solution of mycotoxin standards in ESI+

图2 真菌毒素混合标准溶液在ESI-模式下的多反应监测色谱图
Fig.2 Multiple-reaction monitoring chromatograms of mixes solution of mycotoxin standards in ESI-
2.2 呕吐毒素相关隐蔽性真菌毒素发生情况
随着对真菌毒素研究的深入,近年的研究发现某些真菌毒素可与一些极性较强的物质结合,这类结合态的真菌毒素是常规手段很难检测到的,但是在遇到消化酶或肠道微生物时会部分或全部释放,进入动物体内,当其生物利用率高时,会表现出比母体更强的毒性作用,严重危害畜禽健康。本次研究主要关注含量较高的呕吐毒素-3-葡萄糖苷(D3G)及呕吐毒素的两种乙酰基化合物:15-乙酰基呕吐毒素(15 AcDON)和3-乙酰基呕吐毒素(3 AcDON)。这些被检样品中,呕吐毒素-3-葡萄糖苷检出率最高,其中阳性最高值为412 μg/kg,而阳性均值最高为 152 μg/kg。3-乙酰基呕吐毒素检出率最高检出率较低,最高地区仅为17%;阳性最高值和阳性均值最高分别为21、18 μg/kg;有3个地区未检出3-乙酰基呕吐毒素。详细情况如图3、表4所示。

图3 隐蔽型毒素检出率
Fig.3 Occurrence data of masked-mycotoxin
表4 隐蔽性毒素数据
Table 4 Masked-mycotoxin in corn μg/kg
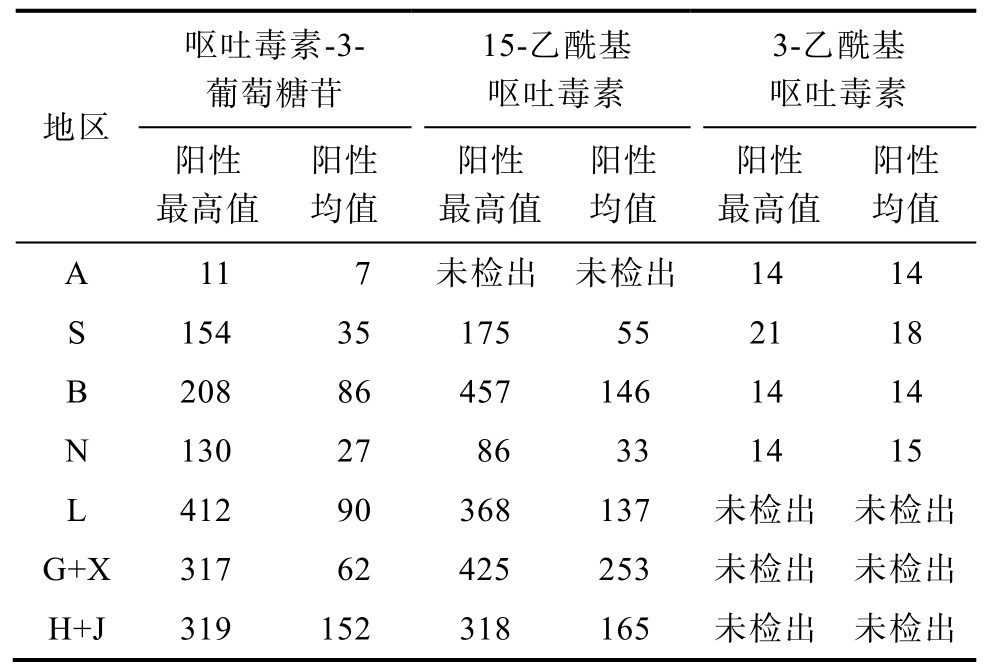
呕吐毒素-3-葡萄糖苷15-乙酰基呕吐毒素3-乙酰基呕吐毒素地区 阳性最高值阳性均值阳性最高值阳性均值阳性最高值阳性均值A 11 7 未检出 未检出 14 14 S 154 35 175 55 21 18 B 208 86 457 146 14 14 N 130 27 86 33 14 15 L 412 90 368 137 未检出 未检出G+X 317 62 425 253 未检出 未检出H+J 319 152 318 165 未检出 未检出
2.3 新型毒素和其他类毒素发生情况
随着检测技术的不断发展,一些新型的真菌毒素逐渐引起人们的关注。谷物中主要的新型真菌毒素包括白僵菌素(BEA)、恩镰孢素(ENN)、串珠镰刀菌素(MON)、杂色曲霉菌素(STC)、霉酚酸(MPA)越来越多的引起科研工作者的关注,除此以外像α-玉米赤霉烯醇(α-zearalenol,α-ZOL)、β-玉米赤霉烯醇(β-zearalenol,β-ZOL)、玉米赤霉酮(Zearalanone,ZAN)这些玉米赤霉烯酮代谢产物以及以链格孢酚(AOH)为代表的链格孢霉毒素也时有报道。虽然这些真菌毒素暂时没有进行常规的分析检测,更没有受到法规的管制,但是有证据表明,这些新型的真菌毒素不仅种类多,而且很可能产生协同作用,从而对食品和饲料安全产生更大影响。
在这些毒素中,白僵菌素检出率为 67%~100%。恩镰孢素A检出率最高为23%;恩镰孢素A1检出率最高为13%;恩镰孢素B检出率最高为23%,有2个地区均未检出;恩镰孢素B1检出率最高为14%,有2个地区未检出。串珠镰刀菌素检出率为78%~100%;霉酚酸检出率最高为33%,2个地区未检出;杂色曲霉菌素检出率最高为100%,2个地区均未检出;α-玉米赤霉烯醇检出率最高为 41%,2个地区未检出;玉米赤霉酮检出最高为 32%,2个地区未检出;格列孢酚均有检出,但检出率较低,为 8%~22%。详细情况如图4所示。

图4-1 白僵菌素和恩链孢霉检出率
Fig.4-1 Occurrence data of emerging-toxins such as BEA & ENN

图4-2 其他毒素以及部分毒素代谢物检出率
Fig.4-2 Occurrence data of other toxins and its metabolite in maize
2.3.1 白僵菌素发生情况
白僵菌素能够提高阳离子穿过细胞膜的能力,由此干扰正常生理水平下的阳离子浓度,影响细胞膜的电化学浓度,从而产生毒性反应。此外,白僵菌素还可以诱导染色体畸变,姐妹染色单体交换和微核形成,最终引起细胞凋亡,线粒体功能异常和红细胞膜变形等现象。本次研究白僵菌素的均值最大为 70.2 μg/kg,最低为 1.3 μg/kg。详细情况见表5。
表5 白僵菌素数据
Table 5 Beauverin data in maize μg/kg

地区 白僵菌素最高值 阳性均值A 8.0 1.3 S 699.0 70.2 B 351.0 26.9 N 223.0 23.9 L 87.2 8.6 G+X 0.7 3.7 H+J 27.3 6.6
2.3.2 恩镰孢素发生情况
恩镰孢素目前发现的有20多种,研究较多的主要有恩镰孢素 A、恩镰孢素 A1、恩镰孢素 B和恩镰孢素B1这四种,对人和动物有致癌、致畸、致突变等毒性。本次研究涉及的样品中,恩镰孢A最高值为 361.0 μg/kg,阳性均值为 128.0 μg/kg;恩镰孢 A1最高值为 13.9 μg/kg,阳性均值为8.4 μg/kg;恩镰孢B最高值为9.8 μg/kg,阳性均值为 1.8 μg/kg;恩镰孢 B1最高值为 7.8 μg/kg,阳性均值为2.1 μg/kg。有2个地区未检出恩镰孢素。详细情况见表6。
表6 恩镰孢素数据
Table 6 Enniatin data in maize μg/kg
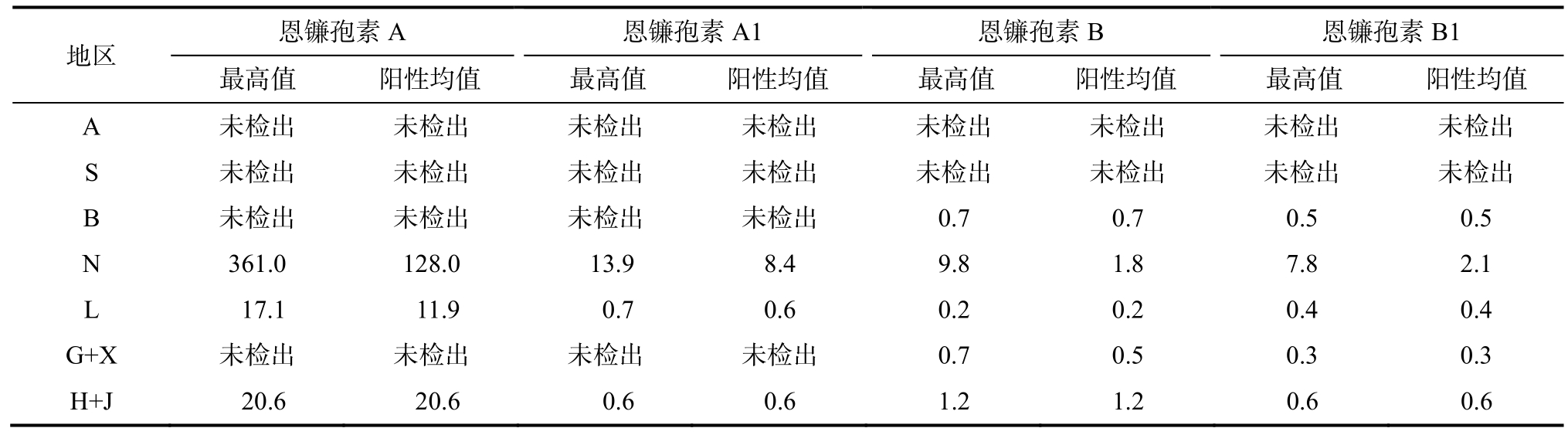
地区 恩镰孢素A 恩镰孢素A1 恩镰孢素B 恩镰孢素B1images/BZ_9_1787_2711_1800_2770.png最高值 阳性均值 最高值 阳性均值 最高值 阳性均值 最高值 阳性均值images/BZ_9_1787_2772_1800_2831.pngA 未检出 未检出 未检出 未检出 未检出 未检出 未检出 未检出S 未检出 未检出 未检出 未检出 未检出 未检出 未检出 未检出B 未检出 未检出 未检出 未检出 0.7 0.7 0.5 0.5 N 361.0 128.0 13.9 8.4 9.8 1.8 7.8 2.1 L 17.1 11.9 0.7 0.6 0.2 0.2 0.4 0.4 G+X 未检出 未检出 未检出 未检出 0.7 0.5 0.3 0.3 H+J 20.6 20.6 0.6 0.6 1.2 1.2 0.6 0.6
2.3.3 串珠镰刀菌素发生情况
串珠镰刀菌素的毒性很强,主要的靶标器官是心脏。本研究涉及的样品中,最高值和阳性均值最大分别为953、140 μg/kg。最高值和阳性均值最小值分别为113、31.3 μg/kg。详细情况见表7。
表7 串珠镰刀菌素数据
Table7 Moniliformin data in maize μg/kg

地区 串珠镰刀菌素最高值 阳性均值A 182 43 S 953 140 B 193 47 N 498 86 L 169 31 G+X 113 46 H+J 277 74
2.3.4 杂色曲霉菌素和霉酚酸发生情况
杂色曲霉菌素是AFB1合成的前体化合物,也是2B类致癌物。霉酚酸是免疫抑制剂,能阻断T和B淋巴细胞的增殖,抑制抗体形成和产生毒性T细胞[19]。本次研究涉及的样品中,杂色曲霉菌素最高值和阳性均值最高分别为8.4、2.9 μg/kg,有2个地区未检出。霉酚酸最高值和阳性均值最高分别为57.3、18.1 μg/kg,有2个地区未检出。详细情况见表8。
表8 杂色曲霉菌素和霉酚酸数据
Table 8 Sterigmatocystin & Mycophenolic acid data in maize μg/kg

地区 杂色曲霉菌素 霉酚酸images/BZ_10_805_1115_818_1180.png最高值 阳性均值 images/BZ_10_805_1182_837_1247.png最高值 阳性均值A 8.4 2.9 未检出 未检出S 1.8 0.9 57.3 18.1 B 0.7 0.5 3.9 3.9 N 4.0 1.2 5.9 4.9 L 未检出 未检出 12.1 8.0 G+X 未检出 未检出 11.0 4.9 H+J 未检出 未检出 未检出 未检出
2.3.5 α-玉米赤霉烯醇、β-玉米赤霉烯醇和玉米赤霉酮发生情况
α-玉米赤霉烯醇、β-玉米赤霉烯醇和玉米赤霉酮为玉米赤霉烯酮的代谢产物,与动物内源性雌激素β-雌二醇有类似的化学结构,故可以与动物细胞内β-雌二醇的受体结合而引起牲畜雌激素综合症状,导致牲畜体内雌激素过多,引起不孕不育、流产和死胎现象,并有很强的致癌性。α-玉米赤霉烯醇最高值和阳性均值最高分别为13.2、13.2 μg/kg,有1个地区未检出;β-玉米赤霉烯醇最高值和阳性均值最高分别为8.0、5.3 μg/kg,有3个地区未检出;玉米赤霉酮最高值和阳性均值最高分别为12.5、12.5 μg/kg,有2个地区未检出。详细情况见表9。
表9 α-玉米赤霉烯醇、β-玉米赤霉烯醇和玉米赤霉酮数据
Table 9 α-zearalenol、β-zearalen & Zearalanone occurrence data in maize μg/kg

α-玉米赤霉烯醇 β-玉米赤霉烯醇 玉米赤霉酮地区 最高值 阳性均值 最高值 阳性均值 最高值 阳性均值A 未检出 未检出 未检出 未检出 未检出 未检出S 5.2 3.0 8.0 5.3 5.3 2.6 B 13.2 13.2 3.1 3.1 12.5 12.5 N 1.4 1.1 4.7 3.3 1.3 1.0 L 2.8 1.5 3.0 2.4 2.6 1.7 G+X 未检出 未检出 未检出 未检出 未检出 未检出H+J 1.0 0.9 未检出 未检出 0.9 0.9
2.3.6 链格孢酚发生情况
链格孢酚是链格孢毒素的一种,对人和动物有致癌,致畸,致突变等毒性。链格孢酚是玉米中另一种常见的真菌毒素,绝对值不高,但本次研究涉及的样品,均有微量检出率。最高值和阳性均值最高分别为25.2、10.8 μg/kg。详细情况见表10。
表10 链格孢酚数据
Table 10 AOH Occurrence data in maize μg/kg

地区 链格孢酚最高值 阳性均值A 1.70 1.70 S 25.20 10.80 B 10.40 4.67 N 4.79 2.34 L 5.54 3.30 G+X 1.52 1.50 H+J 1.13 1.13
3 讨论与结论
玉米是我国重要的粮食作物,同时也是重要的饲料和工业原料,因此明确玉米中的真菌毒素分布情况和风险隐患,对于促进其精准监管和科学防治,推动粮食产业结构调整与绿色发展,保障我国农产品质量安全与农业产业高质量发展具有重要意义。本研究利用利用同位素内标-高效液相色谱-串联质谱法检测了 2020年用于饲料原料的181份盲样,数据表明隐蔽性毒素和新型毒素应该引起更为广泛的关注。
呕吐毒素的隐蔽性毒素由于其含有的糖苷基团或者乙酰基基团在进入人体和动物体内会在酶切作用下,还原为原型,因此其毒性也不能忽视,文献中多有报道关于国内外玉米的呕吐毒素隐蔽性毒素的暴露,例如Yan等2017年研究选取606个样品中3-ACDON和15-ACDON检出率分别为13.53%和 76.40%,阳性均值为 115、5 μg/kg[20]。欧盟食品安全评估委员会(EFSA)总结了欧洲各国关于隐蔽性毒素3-ACDON和15-ACDON以及DON-3G的数据,在谷物类原料中均有不同程度的检出[21]。
白僵菌素和恩镰孢霉作为重要的新型毒素主要由镰刀菌的某些菌种侵染小麦、大麦、黑麦和燕麦等谷物后,在潮湿和温度较低的条件下产生[22],是最具有代表性的六酯肽类化合物。这类毒素具有基因和细胞毒性,可以诱导染色体畸变、姐妹染色体单体交换和微核形成[23]。Han等2017年检测某省 71个玉米,其中白僵菌素检出率为85.9%,阳性均值为 46.96 μg/kg。恩镰孢霉 A、A1、B、B的检出率依次为 2.8%、4.2%、0%和4.2%,阳性均值分别为 0.13、0.14、0.21 μg/kg[24]。C, Luz等综述了白僵菌素在玉米、小麦、大麦等谷物中的检出率情况,发现全球各国的白僵菌素均有不同程度的检出[25],因此白僵菌素的污染也应引起重视。
随着检测技术的发展以及人们对于越来越多真菌毒素的关注,使得我们把研究重点更多的聚集在国内隐蔽性毒素和新型毒素的阳性检出率和检出均值,以期为相关研究部门和监管单位提供更多的数据参考。本研究中所检测样品来自若干不同地区,仅用于科研分析,样品未覆盖国内所有玉米产地,且部分地区样品数量相对较少,代表性弱,并不能全面反映这些地区2020年用于饲料原料的新玉米中真实的真菌毒素污染水平。本次分析的隐蔽性毒素和新型毒素的检测数据仅供研究同行参考。
[1]王娟, 王改琴, 李俊, 等. 2020年底各地新玉米真菌毒素风险分析[J]. 中国饲料, 2021(9): 93-97.WANG J, WANG G Q, LI J, et al. Mycotoxin risk analysis of new corn at the end of 2020[J]. China feed, 2021, (9): 93-97
[2]STOEV S D. Foodborne mycotoxicoses, risk assessment and underestimated hazard of masked mycotoxins and joint mycotoxin effects or interaction[J]. Environ Toxicol Pharmacol, 2015, 39(2):794-809.
[3]FAN K, XU J J, JIANG K Q, et al. Determination of multiple mycotoxins in paired plasma and urine samples to assess human exposure in Nanjing, China[J]. Environ Pollut, 2019, (248):865-873.
[4]HIDALGO-RUIZ J L, ROMERO-GONZ LEZ R, VIDALJ L M,et al. A rapid method for the determination of mycotoxins in edible vegetable oils by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Chem,2019, 288: 22-28.
[5]ESKOLA M, KOS G, ELLIOTT C T, et al. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%[J]. Crit Rev Food Sci Nutr,2019. DOI: 10. 1080/10408398. 2019. 1658570.
[6]XENIA P, JORDI O S, SONIA M, et al. Survey of mycotoxins in beer and exposure assessment through the consumption of commercially available beer in Lleida, Spain[J]. Food Sci Technol, 2018, (92): 87-91.
[7]IARC. Some traditional herbal medicines, some mycotoxins,naphthalene and styrene[M]. Lyon, France: World Health Organization, 2002.
[8]赵志辉, 农产品和饲料中常见真荫毒素的种类和危害[J]. 北京工商大学学报(自然科学版), 2012, 30 (4): 8-11.ZHAO Z H. Advances of research on mycotoxins in agricultural products and feed[J]. Journal of Beijing Technology and Business University( Natural Science Edition ), 2012, 30(4): 8-11.
[9]WANG X, WU Q, WAN D, et al. Fumonisins: oxidative stress-mediated toxicity and metabolism in rio and in vitro[J].Archives of Toxicology, 2016, 90(1): 81-101.
[10]KOWALSKA K, HABROWSKA-GORCZYNSKA D P L,ASTOWSKA-CIESIELSKA A W. Zearalenone as an endo. crine disruptor in humans[J]. Environmental Toxicology and Pharmacology, 2016(48): 141-149.
[11]GAO W, JIANG L, GE L, et al. Sterigmatocystin induced oxidative DNA damage in human liver-derived cell line through lysosomal damage[J]. Toxicology in Vitro 2015, 29(1): 1-7.
[12]崔莉, 刘阳, 刑福国. 小麦籽粒中结合态脱氧雪腐镰刀菌烯醇毒素产生规律研究[J]. 核农学报, 2013, 27(1): 56-60.CUI L, LIU Y, XING F G. Production of bound deoxvnivalenol by Fusarium graminearum in wheat grain[J]. Joumal of Nuelear Agricultural Sciences, 2013, 27(1): 56-60.
[13]KARLOVSKY P, SUMAN M, BERTHILLER F, et al. Impact of food processing and detoxification treatments on mycontamination[J]. Mycotoxin Res, 2016, 32(4).
[14]BERTHILLER F, CREWS C, DALL 'ASTA C, et al. Masked mycotoxins: a review[J]. Molecular Nutrition and Food Research,2013, 57(1): 165-186.
[15]WANG Y, XIAO C, GUO J, et al. Development and application of a method for the analysis of 9 mycotoxins in maize by HPLC-MS/ MS[J]. J Food Sci, 2013, 78(11): 1752-1756.
[16]MANAFY M, UMAKANTHA B, MOHAN K, et a1. Synergistic effects of two commonly contaminating mycotoxins (aflatoxin and T-2 Toxin) on biochemical parameters and immune status of broiler chickens[J]. World Applied Sciences Journal, 2012,17(3); 364-367.
[17]RUIZ M J, FRANZOVA P, JUAN-GARCIA A. Font G Toxicological interactions between the mycotoxins beauvericin,deoxynivalenol and T-2 toxin in CHO•K1 cells in vitro[J].Toxicon, 201l, 58: 3 15-326.
[18]BIOMIN World Mycotoxin Survey 2020, Annual Report No. 17.
[19]RANK C, NIELSEN K F, LARSEN T O, et al. Distribution of sterigmatocystin in filamentous fungi[J]. Fungal Biol, 2011,115(4/5): 406-420.
[20]YAN P P, LIU Z Z, GONG Z Y. Natural occurrence of deoxynivalenol and its acetylated derivatives in Chinese maize and wheat collected in 2017[J]. Toxins, 2020, 12: 200.
[21]HELLE K K, JAN A, Risks to human and animal health related to the presence of deoxynivalenol and its acetylated and modified forms in food and feed[J]Scientific opinioin,26,January 2017.
[22]JESTO1 M, Emerging mycotoxins fusaroliferin, beauvericin,enniatins, and moniliformin- a review[J]. Critical Reviews in Food Science and Nutrition, 2008, 48(1): 21-49.
[23]TAN D C, FLEMATTI G R, GHISALBERTI E L, et al,Toxigenicity of enniatins from Western Australian Fusarium species to brine shrimp(Artemia franciscana[J]. Toxincon, 2011,57(5): 817-825.
[24]HAN X M, XU W J, LI F Q, et al. Natural occurrence of beauvericin and enniatins in corn-and wheat-based samples harvested in 2017 collected from Shandong province, China[J].Toxins, 2019, 11: 9.
[25]C LUZ, F SALADINO, G MECA, Occurrence, toxicity,bioaccessibility and mitigation strategies of beauvericin, a minor Fusarium mycotoxin [J], Food and Chemical Toxicology.107(2017)430-439.
备注:本文的彩色图表可从本刊官网(http:// lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。